APLIKASI PCR BERBASIS MARKA
SUB1
(AEX1 DAN
RM219) PADA SELEKSI PADI BC1F1 CIHERANG-
SUB1
EUIS MARLINA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EUIS MARLINA. Aplikasi PCR berbasis marka
Sub1
(AEX1 dan RM219) pada
seleksi padi BC1F1 Ciherang-
Sub1
. Dibimbing oleh DJAROT SASONGKO HS
dan TRI JOKO SANTOSO.
Cekaman genangan merupakan pembatas ketiga utama dari 42 cekaman
biotik dan abiotik dalam produksi beras. Padi FR13A dapat beradaptasi terhadap
lingkungan yang terkena banjir berlebihan melalui sifat toleran genangan yang
dikontrol oleh suatu lokus tunggal utama (QTL) pada kromosom 9 yang diketahui
sebagai
Sub1.
Akan tetapi, varietas ini mudah terkena penyakit dan serangan
hama. Oleh karena itu, diperlukan suatu penelitian yang ditujukan memindahkan
gen
Sub1
dari kultivar asli ke dalam varietas yang lebih produktif. Pada penelitian
ini, padi Ciherang digunakan sebagai padi pemulih dan F1 Ciherang-
Sub1
sebagai
donor
Sub1
. Tujuan penelitian ini adalah menghasilkan varietas BC1F1
ABSTRACT
EUIS MARLINA. Application of PCR based
Sub1
marker (AEX1 and RM219) in
selection of BC1F1 Ciherang-
Sub1
rices. Under the direction of DJAROT
SASONGKO HS and TRI JOKO SANTOSO.
Submergence stress is the third most important limitation to rice production
from 42 biotic and abiotic stresses. FR13A has adapted to excessive flooding
environment by submergence tolerance is controlled by a single major
quantitative trait locus (QTL) on chromosome 9, named
Sub1
. However, these
varieties are susceptible to diseases and insect pests. It is therefore an attractive
research proposition to transfer
Sub1
gene from traditional cultivars into more
productive varieties. In this study, the Ciherang was used as host, and F1
Ciherang-
Sub1
was used as donors
Sub1
. The purpose of this study were to
generate BC1F1 Ciherang-
Sub1
varieties from backcross between F1
APLIKASI PCR BERBASIS MARKA
SUB1
(AEX1 DAN
RM219) PADA SELEKSI PADI BC1F1 CIHERANG-
SUB1
EUIS MARLINA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Aplikasi PCR Berbasis Marka
Sub1
(AEX1 dan RM219) pada Seleksi
Padi BC1F1 Ciherang-
Sub1
Nama
: Euis Marlina
NRP : G84062155
Disetujui
Komisi Pembimbing
Dr. Djarot Sasongko Hami Seno, M.S.
Dr. Tri Joko Santoso, M.Si.
Ketua Anggota
Diketahui
Dr. Ir. I Made Artika, M. App. Sc
Ketua Departemen Biokimia
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 2 Maret 1988 merupakan
anak tunggal dari pasangan Bapak Miki dan Ibu Nengsih (Alm.). Pendidikan
formal penulis dimulai di SDN Parung Seah 1 Sukabumi (1994-2000). Setelah
menyelesaikan pendidikan dasar penulis melanjutkan pendidikan di SLTPN 4
Sukabumi (2000-2003), serta menempuh pendidikan menengah atas di SMAN 2
Sukabumi (2003-2006). Pada tahun 2006 penulis diterima di Institut Pertanian
Bogor (IPB) melalui jalur USMI (Undangan Seleksi Masuk IPB). Setelah
melewati tahap Tingkatan Persiapan Bersama (TPB) selama 1 tahun, penulis
diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam (FMIPA).
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT yang telah berkehendak atas
segala sesuatu yang terjadi di alam semesta sehingga penulisan karya ilmiah ini
dapat terselesaikan. Karya ilmiah ini disusun berdasarkan kerja penelitian yang
dilaksanakan mulai bulan Mei sampai September 2010 yang bertempat di
Laboratorium Biologi Molekuler dan Rumah Kaca Balai Besar Penelitian dan
Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen),
Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Djarot Sasongko
Hami Seno, M.S. selaku pembimbing utama yang telah memberikan saran,
bimbingan, dan masukan-masukannya, selain itu penulis juga mengucapkan
terima kasih kepada Bapak Dr. Tri Joko Santoso, M.Si. selaku pembimbing
lapangan atas bimbingan, arahan, serta semangat yang diberikan selama penelitian
dan penyusunan karya ilmiah ini. Tak lupa penulis ucapkan terima kasih kepada
Dewi Praptiwi, Ganti Swara Pratama, Joel Rivandi Sinaga, Sugihartati, Taufiq,
dan Diyah Nur Maliki yang selalu membantu dan memberi semangat dalam
proses penelitian ini selama di Laboratorium BB Biogen. Terima kasih kepada
sahabatku Widya Dharma Lubayasari dan Dedi Setiawan atas dukungan, bantuan,
dan semangatnya. Penghargaan setinggi-tingginya penulis sampaikan kepada
kedua orang tua tercinta atas perhatian, motivasi, kasih sayang, dan doanya.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi Balai Besar Penelitian
dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB
Biogen), penulis pada khususnya, dan semua pihak pada umumnya.
Bogor, Januari 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Tanaman Padi ... 1
Cekaman Genangan pada Tanaman Padi ... 3
Gen Pengendali Toleransi Genangan ... 3
Pengembangan Varietas Padi Toleran Genangan ... 5
Identifikasi Toleransi Genangan Berbantuan PCR dengan Marka
Sub1
... 6
Elektroforesis ... 7
BAHAN DAN METODE
Alat dan Bahan ... 8
Metode Percobaan ... 8
HASIL DAN PEMBAHASAN
Pembentukan Populasi BC1F1 Ciherang-/Swarna-
Sub1
dan BC1F1
Ciherang/IR64-
Sub1
... 10
Seleksi Uji Toleransi Genangan ... 11
Isolasi dan Karakterisasi DNA ... 13
Hasil Seleksi BC1F1 Ciherang-
Sub1
dengan Analisis PCR ... 14
SIMPULAN DAN SARAN ... 16
DAFTAR PUSTAKA ... 16
DAFTAR TABEL
Halaman
1 Varietas padi tradisional tahan genangan ... 2
2 Pengukuran konsentrasi dan kemurnian DNA daun padi ... 14
DAFTAR GAMBAR
Halaman
1 Padi Ciherang ... 2
2 Keterkaitan
sub1A
dengan toleransi genangan ... 4
3 Contoh padi Swarna, padi Swarna-
Sub1
, padi IR64-
Sub1
... 6
4 Posisi fragmen DNA yang dihasilkan primer Sub1C173F dan
Sub1C173R
... 7
5 Diagram metode persilangan terarah ... 10
6 Pembentukan dan seleksi padi BC1F1 Ciherang-
Sub1
...11
7 Uji genangan padi BC1F1 Ciherang-
Sub1
... 12
8 Visualisasi hasil pemulihan (
recovery
) selama 10 hari ... 13
9 Hasil elektroforesis padi BC1F1 Ciherang/Swarna-
Sub1
dengan marka
AEX1 ... 15
10 Hasil elektroforesis padi BC1F1 Ciherang/IR64-
Sub1
dengan marka
AEX1 ... 15
11 Contoh hasil elektroforesis padi BC1F1 Ciherang/Swarna-
Sub1
dengan
marka RM219 ... 16
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian ... 20
2 Pembentukan benih BC1F1 Ciherang-
Sub1
... 21
3 Pengujian toleransi genangan ... 22
4 Isolasi DNA
……….………...…….. 23
5 Komposisi bufer ekstraksi DNA untuk 500 mL ... 24
6 Varietas-varietas padi hasil persilangan yang mengandung
Sub1
... 24
7 Pengukuran konsentrasi dan kemurnian DNA hasil isolasi ... 25
8 Hasil seleksi BC1F1 Ciherang-
Sub1
dengan marka RM219 ... 27
PENDAHULUAN
Perubahan iklim yang tidak menentu mendorong pengembangan padi yang toleran
terhadap cekaman abiotik, seperti
kekeringan, salinitas tinggi, maupun
genangan atau banjir. Curah hujan yang tinggi dapat menyebabkan banjir pada areal
pemukiman dan persawahan sehingga
merusak padi dan pada akhirnya terjadi
kegagalan panen. Banjir yang
mengakibatkan cekaman terhadap tanaman padi di wilayah Asia Selatan dan Tenggara diperkirakan mencapai 15 juta hektar setiap tahunnya (Septiningsih et al. 2008). Di Indonesia potensi areal persawahan yang terkena cekaman banjir cukup luas sekitar 13,3 juta ha terdiri atas 4,2 juta ha genangan dangkal, 6,1 juta ha genangan sedang, dan 3,0 juta ha genangan dalam (Nugroho et al. 1993). Terjadinya peningkatan curah hujan dan kenaikan permukaan air laut akibat pemanasan global akan mengakibatkan
semakin bertambahnya luas areal
persawahan yang mengalami cekaman
genangan (CGIAR 2006). Oleh karena itu, dalam rangka ketahanan pangan perlu dikembangkan padi yang toleran genangan (Fukao & Bailey 2008).
Penelitian ini merupakan bagian dari
pengembangan padi Ciherang toleran
genangan yang dilakukan secara persilangan
terarah (site-directed crossing) untuk
menghindari produk transgenik yang
pemasarannya terhambat oleh regulasi
GMO (Genetically Modified Organisms)
yang ketat (Xu et al. 2004, Mackill et al. 2007). Penggunaan padi varietas Ciherang
sebagai tetua pemulih (host) dapat
mengurangi resiko kegagalan panen karena tahan hama dan penyakit, produktivitas tinggi, dan waktu tanam lebih pendek. Aspek-aspek positif tersebut diharapkan dapat meningkatkan ekonomi petani dan sekaligus devisa negara jika diekspor, serta lebih menggairahkan minat pertanian, baik petani maupun industri, dan sekaligus mendukung program ketahanan pangan nasional.
Sebagai tetua donor digunakan padi F1
Ciherang-Sub1 yang membawa gen toleransi
genangan Submergence-1 (Sub1) dari padi FR13A (Rivandi 2010). Padi F1 Ciherang-Sub1 akan disilangbalikkan (back cross)
dengan Ciherang sehingga dihasilkan
tanaman BC1F1 yang mengandung gen
Sub1. Seleksi dilakukan melalui uji
genangan dan analisis molekuler PCR
berbasis marka AEX1 dan RM219 untuk
melacak keberadaan alel gen Sub1 pada
BC1F1.
Penelitian ini bertujuan memperoleh tanaman BC1F1 hasil persilangan balik F1
Ciherang/Swarna-Sub1 dan
Ciherang/IR64-Sub1 dengan Ciherang, serta menyeleksi tanaman BC1F1 melalui uji genangan dan analisis molekuler PCR dengan marka Sub1. Hipotesis penelitian ini adalah tanaman BC1F1 hasil persilangan balik padi Ciherang dengan padi donor F1 Ciherang-Sub1 akan toleran terhadap uji genangan dan hasil PCR akan menunjukkan DNA yang mengandung pita Sub1 seperti pada donor, sedangkan hal ini tidak akan terjadi pada padi Ciherang.
Hasil penelitian ini diharapkan
bermanfaat dalam program pembuatan
tanaman padi unggul dan komersial yang toleran genangan nontransgenik melalui metode persilangan terarah (site-directed crossing). Manfaat jangka panjang adalah meningkatkan produktifitas tanaman padi secara berkelanjutan untuk menjaga kondisi ketahanan pangan nasional.
TINJAUAN PUSTAKA
Tanaman Padi
Padi memegang peranan paling penting di antara berbagai sumber bahan pangan lainnya di Indonesia dalam penyediaan pangan yang mendukung ke arah ketahanan pangan nasional dan pemberdayaan ekonomi rumah tangga petani (Krishnan & Puepke
1983). Tanaman padi (Oryza sativa L.)
diklasifikasikan dalam Divisi
Spermatophyta, Sub Divisi Angiospermae,
Kelas Monocotyledone, Ordo
Poales/Glumiflorae, Famili Graminae,
Genus Oryza, dan Spesies Oryza sativa
(Siregar 1981). Padi yang termasuk ke
dalam genus Oryza, Oryza sativa L.
merupakan salah satu spesies yang
dibudidayakan di Asia sedangkan Oryza
glaberrima dibudidayakan di Afrika (Manurung & Ismunadji 1999). Berdasarkan pengamatan dan studi, diduga Oryza sativa dan Oryza glaberrima berasal dari leluhur
yang sama, yaitu Oryza perenis Moench
yang habitat asalnya Fondwanaland (Lu & Chang 1980). Proses evolusi kedua spesies tersebut berkembang menjadi tiga ras ekogeografik, yaitu Indika, Japonika, dan
Javanika. Masing-masing ras memiliki
beberapa varietas. Pada ras Indika termasuk
Membramo, dan IR64. Pada ras Japonika
termasuk varietas Nipponbare,
Tsukinohikari, Asonohikari, dan Koshikari. Pada ras Javanika termasuk varietas Rojo lele, Ciherang, dan Pandan Wangi.
Menurut Manurung dan Ismunadji (1999), akar tanaman padi digolongkan ke dalam tipe akar serabut. Akar primer
(radikula) yang tumbuh sewaktu
berkecambah selanjutnya akan digantikan oleh akar adventif. Menurut Harahap et al.
(1995), daun tanaman padi tumbuh
berselang-seling pada batang, satu daun pada tiap buku. Tiap daun terdiri atas helai daun, pelepah daun yang membungkus ruas, telinga daun (auricle), dan lidah daun (ligule). Daun teratas disebut daun bendera. Batang terdiri atas beberapa ruas yang dibatasi oleh buku. Daun dan tunas (anakan) tumbuh pada buku. Pada permulaan stadia tumbuh hanya terdiri atas pelepah-pelepah daun dan ruas yang tertumpuk padat.
Ciherang merupakan kelompok padi sawah varietas unggul hasil beberapa kali
persilangan, yaitu
IR18349-53-1-3-1-
3/IR19661-131-3-1//IR119661-131-3-1///IR64////IR64 (Gambar 1). Padi Ciherang memiliki karakteristik umur tanamannya cukup singkat yaitu 116 hingga 125 hari, bentuk tanaman tegak, tingginya mencapai 107 hingga 115 sentimeter, menghasilkan anakan produktif 14 hingga 17 batang, warna batang hijau, warna daun hijau, muka daun kasar pada sebelah bawah, posisi daun tegak, bentuk gabah panjang ramping, warna gabah kuning bersih, tekstur nasi pulen, kadar amilosa 23%, bobot 1000 butir 27 hingga 28 gram, rata-rata produksi 5 hingga 8.5 ton/ha, tahan terhadap bakteri hawar daun (HDB) strain III dan IV, serta tahan terhadap wereng coklat biotipe 2 dan 3. Padi Ciherang mulai diresmikan oleh menteri pertanian pada tahun 2000 dengan anjuran cocok ditanam pada musim hujan dan kemarau dengan ketinggian di bawah 500 meter di bawah permukaan laut (Hermanto 2006).
Gambar 1 Padi Ciherang.
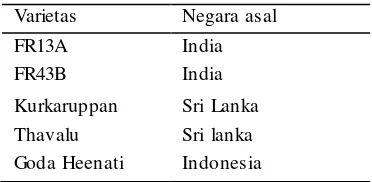
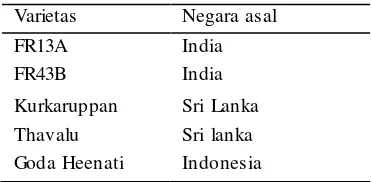
Beberapa varietas padi toleran
genangan telah teridentifikasi (Tabel 1), namun umumnya kemampuan kombinasi dan sifat agronominya (tanaman terlalu
tinggi, sensitif penyakit dan hama
serangga, serta produktivitas rendah) kurang memenuhi untuk kultivasi skala
besar (Mohanty et al. 2000).
Pengembangan padi tahan genangan telah dilakukan dengan rekayasa genetika yang menghasilkan tanaman transgenik, namun hasilnya belum sesuai dengan yang
diharapkan. Kemajuan lebih banyak
dicapai dari conventional breeding.
Kelebihan pemuliaan tanaman
menggunakan metode conventional
breeding adalah produk berupa nonGMO, stabilitasnya bisa sampai puluhan tahun, introduksi sifat spesifik dan selektif, sifat
rekombinan terarah, dan waktu
pengerjaannya relatif singkat yaitu 2 sampai 3 tahun bila mulai dari awal (Mackill et al. 2007).
Toleransi genangan (Sub1) diambil dari varietas FR13A yang paling dominan digunakan dalam pengembangan varietas padi tahan genangan. FR13A merupakan varietas lokal India yang berumur pendek dan berdaya hasil rendah. Padi FR13A merupakan varietas paling toleran yang pernah teridentifikasi terhadap cekaman genangan (Mackill et al. 1999). Pada varietas FR13A tidak terjadi pemanjangan batang yang berlebih akibat cekaman genangan air (Setter et al. 1997). Terdapat korelasi negatif antara persentase hidup tanaman dengan pemanjangan batang pada kondisi tanaman padi tercekam genangan air selama beberapa hari (Setter & Laureles 1995). Namun, di antara galur
turunan FR13A ada yang memiliki
kemampuan pemanjangan batang yang cukup baik, seperti galur IR70213-9-CPA-12-UBN-2-1-3-1, yang toleran terhadap cekaman genangan sesaat (Supartopo et al. 2008, Hairmansis et al. 2008).
Tabel 1 Varietas padi tradisional tahan genangan (Mohanty et al. 2000, Sarkar et al. 2006)
Varietas Negara asal
FR13A India
FR43B India
Kurkaruppan Sri Lanka
Thavalu Sri lanka
Cekaman Genangan pada Tanaman Padi Cekaman merupakan suatu kondisi lingkungan yang dapat memberi pengaruh buruk pada pertumbuhan, reproduksi, dan kelangsungan hidup tanaman (Gardener
1991). Menurut Fallah (2006), pada
umumnya cekaman lingkungan pada
tanaman dikelompokan menjadi dua, yaitu: (1) Cekaman biotik yang terdiri atas kompetisi intra spesies dan antar spesies, infeksi oleh hama dan penyakit, dan (2) Cekaman abiotik berupa suhu (tinggi dan rendah), air (kelebihan dan kekurangan), radiasi (ultraviolet, infra merah, dan radiasi
ionisasi), kimiawi (garam, gas, dan
pestisida), angin, suara, dan sebagainya. Cekaman genangan terhadap tanaman
padi dapat dikelompokan berdasarkan
durasi dan ketinggian genangan.
Berdasarkan durasi cekaman genangan dibedakan menjadi genangan sesaat (flash flood) dan genangan stagnan (stagnant flood) (Maurya et al. 1988). Genangan sesaat biasanya terjadi jika tanaman padi tergenangi air kurang dari dua minggu, kemudian air surut kembali. Jenis genangan ini merupakan tipologi daerah-daerah tadah hujan, pasang surut, dan tepian sungai. Pada cekaman genangan stagnan ketinggian air relatif stabil selama lebih dari tiga minggu dengan ketinggian yang bervariasi antara lokasinya. Jenis genangan ini merupakan tipologi daerah rawa lebak (Nugroho et al. 1993). Berdasarkan ketinggian air yang
menggenangi tanaman, genangan
dikelompokan menjadi genangan sebagian (partial submergence) jika 40-99% bagian atas tanaman tergenangi air dan genangan
yang mengakibatkan seluruh bagian
tanaman tergenangi air (complete
submergence). Terkadang banjir dapat mencapai ketinggian air lebih dari 2 meter
selama beberapa minggu yang
mengakibatkan tanaman padi tergenang seluruh bagian tanamannya oleh air (Setter & Laureles 1995).
Menurut Perata dan Voesenek (2007), salah satu kendala utama dalam produksi padi adalah tergenangnya padi dalam genangan air yang berlebihan atau banjir, terutama di Asia termasuk Indones ia. Hal ini dikarenakan sistem penanganan irigasi (curah hujan berlebih, luapan air sungai/laut) yang belum tertata rapih dan banyak lahan pertanian pada dataran rendah. Peningkatan frekuensi banjirnya areal persawahan juga dapat disebabkan perubahan iklim global yang akhir-akhir ini sulit diprediksi.
Pada umumnya tanaman padi sensitif terhadap genangan (Perata & Voesenek 2007). Meskipun padi merupakan tanaman yang dapat beradaptasi pada kondisi tanah yang airnya berlebih, namun secara umum tanaman padi akan mati jika seluruh bagian tanamannya tergenang selama seminggu (Ito & Kawano 1999). Tanaman padi yang masih muda biasanya lebih rentan terhadap cekaman genangan (Jackson & Ram 2003). Pada saat tergenang, padi terpapar dengan berbagai cekaman lingkungan dan biofisik, diantaranya menurunnya intensitas cahaya yang diterima dan hambatan laju difusi gas menuju (O2 dan CO2) atau menjauhi (etilen) tanaman (Mohanty et al. 2000, Sarkar et al. 2006). Laju difusi gas dalam air 10 000 lebih lambat dibandingkan di udara (Sarkar et al. 2006).
Pada saat tergenang terjadi keragaman konsentrasi O2 dan CO2, yaitu konsentrasi O2 0.0-0.6 mol m-3 (kesetimbangan di udara
0.24 mol m-3 pada suhu 30ºC) dan
konsentrasi CO2 0.004-0.020 mol m-3
(kesetimbangan di udara 0.01 mol m-3) (Sarkar et al. 2006). Tanaman menderita kekurangan O2 parsial (hipoksia) atau sama sekali tidak mendapatkan O2 (anoksia) (Mohanty et al. 2000). Penurunan difusi gas
ini mengakibatkan terhambatnya
pertumbuhan, metabolisme, dan daya tahan tanaman (Mohanty et al. 2000, Sarkar et al.
2006). Berkurangnya persediaan O2
menghambat proses respirasi sedangkan
kurangnya persediaan CO2 menghambat
proses fotosintesis, dan terhambatnya difusi etilen mendorong klorosis dan perpanjangan daun berlebih pada kultivar yang intoleran (Jackson et al. 1987; Jackson & Ram 2003).
Upaya tanaman dalam merespon
kondisi cekaman genangan dapat dilakukan melalui dua cara, yaitu pemanjangan buku-buku (internode) sehingga daun mampu
menggapai permukaan air dan
mempertahankan proses fisiologi tanaman sehingga mampu bertahan dan melanjutkan
kehidupannya (Mackill et al. 1999).
Tanaman padi toleran terhadap cekaman
rendaman jika mampu melanjutkan
kelangsungan hidupnya setelah terendam seluruh bagian tanamannya selama 10-15 hari.
layu dan mati. Hal yang sama akan terjadi pada padi, meskipun padi ditanam dalam air, namun tanaman muda seringkali terpengaruh oleh banjir tahunan di lahan pertanian dataran rendah. Namun, beberapa kultivar sangat toleran serta dapat bertahan hidup sampai dua minggu dalam penggenangan
sempurna berkaitan dengan tempat
percobaan kuantitatif utama yang ditunjuk
sebagai Submergence 1 (Sub1). Kenong Xu
dan rekannya dari International Rice
Research Institute (IRRI) di Filipina, dan University of California's Davis and Riverside campuses, menganalisis
komponen lokus Sub1 dan menemukan
bahwa Sub1A merupakan respon etilen mirip
gen yang mengendalikan toleransi terhadap genangan pada padi.
FR13A merupakan kultivar toleran genangan yang paling intensif digunakan dalam pengembangan padi toleran genangan (Mohanty et al. 2000). Hasil penelitian mendapatkan toleransi genangan pada FR13A terkait dengan quantitative trait loci
(QTL) mayor yang dikenal dengan
submergence 1 (Sub1) (Xu et al. 2004). Penggunaan metode QTL telah berhasil
mengidentifikasi gen yang mengatur
toleransi terhadap cekaman rendaman, Sub1 yang pengaruhnya paling kuat terpetakan pada kromosom 9 berukuran 200 kb, dan berperan dalam variasi toleransi genangan kultivar padi toleran Indica dan intoleran Japonica (Xu & Mackill 1996, Xu et al. 2004; Perata & Voesenek 2007).
Penelitian lebih lanjut menunjukkan
bahwa Sub1 pada FR13A mengkode tiga
faktor transkripsi (Sub1A, Sub1B, dan
Sub1C) yang termasuk kelompok B-2
subgrup Ethylene Response Factor
(ERFs)/ethylene-responsive element binding
proteins (EREBPs)/apetala2-lik eproteins (AP2) (Perata & Voesenek 2007). Sub1A yang pertama kali ditemukan merupakan suatu variabel namun dibutuhkan untuk toleransi terhadap genangan dan ketika terekspresi lebih dalam padi, gen Sub1A menyebabkan varietas padi toleran genangan di air. Gen Sub1A-1 hanya ditemukan dalam padi toleran genangan, sementara Sub1A-2
berbeda dari Sub1A-1 dengan suatu
perubahan nukleotida tunggal merupakan versi ketidaktoleransian dari gen tersebut. Ketika dimasukkan ke dalam varietas padi Swarna tidak toleran genangan, yang tidak ada gen Sub1A, ditemukan bahwa hasilnya tidak hanya toleran genangan air, namun juga produksi tinggi dan keuntungan
lainnya. Regulasi transkripsi SUB1A dan
SUB1C didapatkan meningkat akibat
genangan. Peningkatan SUB1C berkurang dengan adanya SUB1A, mengindikasikan adanya represi SUB1C oleh SUB1A. ERF ketiga, SUB1B hanya sedikit terpengaruh oleh genangan (Fukao & Bailey 2008, Perata & Voesenek 2007).
Hasil survei alel mendapatkan toleransi genangan terkait dengan alel Sub1A-1 dan intoleransi genangan terkait dengan alel Sub1A-2 (Fukao & Bailey 2008, Xu et al. 2004). Transformasi Sub1A-1 pada varietas Japonica intoleran genangan menghasilkan tanaman transgenik yang toleran genangan (Fukao & Bailey 2008, Perata & Voesenek 2007). Introgresi Sub1 (haplotipe Sub1A-1, Sub1B-1,Sub1C-1) pada intoleran kultivar Japonica M202 mendapatkan tanaman yang lebih: toleran terhadap genangan, lambat penurunan pati dan solubel karbohidratnya,
kecil mRNA -amilase dan sukrosa
sintasenya, tinggi aktivitas piruvat
dekarboksilase (Pdc) dan alkohol
dehidrogenasenya (Adh), kecil produksi
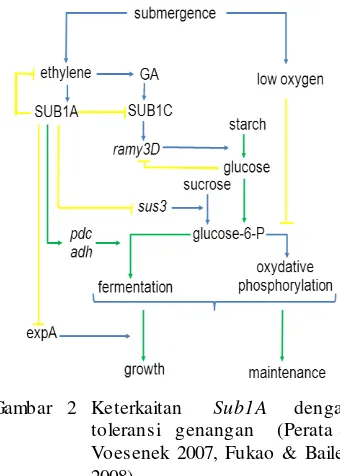
etilennya, dan berkurang transkripsi gen ekspansinya (Fukao & Bailey 2008). Data-data fisiologi ini mendukung teori bahwa strategi pertahanan terhadap genangan berlangsung melalui konservasi karbohidrat, represi elongasi sel, dan peningkatan kapasitas fermentasi (Perata & Voesenek 2007, Fukao & Bailey 2008). Keterkaitan Sub1 dengan toleransi genangan (Perata & Voesenek 2006, Fukao & Bailey 2008) telah dipostulasikan (Gambar 2).
Gambar 2 Keterkaitan Sub1A dengan
Genangan mengakibatkan akumulasi etilen dalam jaringan tanaman. Etilen
mengaktifkan transkripsi gen Sub1A
sehingga terjadi akumulasi protein SUB1A
hasil transkripsi. SUB1A menghambat
ekspansin A (ExpA) dan sukrosa sintase (Sus
3) sehingga menghambat pertumbuhan.
SUB1A meningkatkan transkripsi gen yang berkaitan dengan fermentasi sehingga terjadi akumulasi mRNA dan peningkatan aktivitas
Pdc dan Adh. Kondisi Fermentasi akan
membuat glikolisis dapat berlanjut sehingga menghasilkan ATP untuk bertahan. Namun, laju produksi etanol tidak jauh berbeda dengan genotip yang tidak mengandung gen Sub1A, mengindikasikan bahwa induksi Pdc dan Adh tidak terlalu krusial.
SUB1A menghambat gen yang
berkaitan dengan elongasi sel dan
katabolisme karbohidrat. Degradasi pati mengasilkan sumber glukosa untuk glikolisis dan pertumbuhan. Padi yang mengekspresi Sub1A, laju elongasi rendah, pati dan karbohidrat yang terkumpul dapat digunakan untuk mempertahankan perlambatan sintesis ATP melalui fermentasi. SUB1C yang
mengontrol gen -amilase (Ramy3D)
dihambat oleh SUB1A. Gibberellins (GA) terlibat dalam regulasi ekspresi Sub1C. Namun, efek tersebut terhadap ekspresi Ramy3D bersifat tidak langs ung, mengingat promotor gen ini yang tidak mengandung elemen GARE yang diperlukan untuk
regulasi GA. Peningkatan regulasi Ramy3D
oleh kandungan gula didapatkan pada Sub1A-defisien. SUB1A juga bertanggung
jawab pada restriksi feedback produksi
etanol.
Pengembangan Varietas Padi Toleran Genangan
Berbagai varietas baru tahan genangan
telah dihasilkan (Lampiran 6) melalui
pemuliaan konvensional (Xu et al. 2006,
Sarkar et al. 2006). Namun demikian
produktivitas varietas hasil persilangan relatif masih kurang tinggi (<6,5 ton/ha). Salah satu penyebabnya adalah introgresi
donor tidak terkontrol/terminimalisasi
sedangkan produktivitas varietas asli toleran genangan sangat kecil.
Pengembangan varietas unggul ini
terus dilakukan melalui pemanfaatan
rekayasa genetika maupun dengan
persilangan konvensional. Padi IR64
merupakan varietas unggul nasional yang dikembangkan sejak tahun 1986. Varietas padi ini merupakan hasil persilangan dari
tetua IR5657-33-2-1/IR2061-465-1-5-5.
Secara morfologi padi IR64 memiliki ciri-ciri sebagai berikut, yaitu tegak, kaki dan batang berwarna hijau, tinggi tanaman ±85 cm, dan kadar amilosa sebesar 24.1%. Selain itu, umur tanaman kurang lebih 115 hari serta tahan terhadap hama (IRRI 2004). Tahun 2006 padi varietas IR64 oleh IRRI
dikembangkan menjadi varietas padi
toleransi genangan dengan mentransfer gen Sub1 dari varietas FR13A tahan genangan
menjadi padi IR64-Sub1 (Gambar 3c).
Varietas padi IR64-Sub1 banyak digunakan di Asia terutama di Asia Tenggara termasuk Indonesia untuk berbagai penelitian dan
digunakan petani untuk meningkatkan
produktivitas hasil panen meskipun sering terjadi banjir (Septiningsih et al. 2008).
Padi Swarna-Sub1 merupakan varietas toleransi genangan yang berasal dari varietas FR13A (Gambar 3b). Gen toleran genangan Sub1 dari FR13A diintroduksi ke Swarna (Gambar 3a) dan menjadi varietas yang
popular di Asia Selatan dengan
menggunakan Mark er Assisted Breeding
(MAB). Di tahun 2006-2007 varietas ini telah diuji lebih lanjut oleh petani dan
peneliti di International Rice Research
Institute (IRRI) dan sekarang siap untuk
digunakan dan dipublikasikan.
Pengembangan varietas ini adalah contoh dari aplikasi ilmu pengetahuan modern molekular dengan memanfaatkan varietas lokal populer untuk sampai pada sebuah peningkatan produk yang toleransi terhadap genangan dan juga secara lokal dapat
diterima. Gen Sub1 telah berhasil
dimasukkan ke beberapa varietas berdaya hasil tinggi di Asia yang ditanam lebih dari satu juta hektar antara lain IR64, Swarna, Samba Mahsuri BR11, TDK dan CR1009 (IRRI 2007a; Mackill 2007; Septiningsih et al. 2008).
Padi Swarna-Sub1 memiliki beberapa karakteristik, yaitu umur berbunga 100-104 hari, umur panen 130-134 hari, tinggi tanaman 75-85 cm, gabah isi per malai sebanyak 131 bulir, tekstur nasi pera, toleran rendaman penuh 14 hari, peka terhadap hama wereng coklat biotipe 3, dan penyakit hawar daun bakteri. Karakteristik yang dimiliki oleh padi IR64-Sub1 diantaranya umur berbunga 83-86 hari, umur panen 112-116 hari, tinggi tanaman 90-95 cm, gabah isi per malai 83 bulir, tekstur nasi sedang, toleran rendaman penuh 14 hari, dan peka terhadap penyakit hawar daun bakteri (Hairmansis et al. 2008).
kertas/membran selulosa, gel pati, gel poliakrilamida, dan gel agarosa (Clark & Christopher 2000).
Gel yang digunakan adalah agarosa yang berasal dari ekstrak rumput laut yang telah dimurnikan. Marka atau penanda yang
digunakan pada proses running merupakan
campuran molekul dengan ukuran
berbeda-beda yang dapat digunakan untuk
menentukan ukuran molekul dalam pita
sampel. Setelah tahap running selesai,
dilakukan metode staining dan destaining. Staining methods yaitu pewarnaan gel agarosa dilakukan dengan menggunakan larutan etidium bromida (Etbr) selama 15 menit. Hal ini dilakukan dengan tujuan agar molekul sampel berpendar dalam sinar
ultraviolet. Destaining methods atau
penghilangan warna dilakukan dengan cara gel dimasukkan ke dalam air (akuades) selama 5 hingga 7 menit (Sambrook & Russel 1989, Clark & Christopher 2000).
BAHAN DAN METODE
Bahan dan Alat
Bahan tanaman padi diperoleh dari BB-BIOGEN dan LIPI. Tanaman padi
yang digunakan yaitu host (Ciherang),
donor padi F1 Ciherang-Sub1 (F1
Ciherang/Swarna-Sub1 dan F1
Ciherang/IR64-Sub1), tetua Sub1 (padi IR64-Sub1 dan padi Swarna-Sub1), dan padi IR42 sebagai kontrol. Reagen untuk isolasi DNA yaitu etanol 70%, etanol 95%, bufer ekstraksi (NaCl 5 M, Tris -HCl 1 M, EDTA 0,5 M, lauril sarkosin, dan urea),
fenol kloroform isoamilalkohol (PCI),
isopropanol, dan larutan TE (Tris-EDTA).
Bahan-bahan yang digunakan untuk
menguji hasil isolasi DNA dengan PCR adalah bufer PCR 10x, MgCl2 50 mM, dNTP mix 10 mM, primer AEX1, primer RM219, Taq polymerase, sampel DNA 50 ng/µL, dan MQ H2O. Bahan-bahan yang
digunakan untuk elektroforesis yaitu
loading dye, bufer TAE (Tris-Acetic Acid EDTA) 1x, agarosa, sampel DNA hasil PCR, marker DNA 1 kb, etidium bromida, dan akuabides.
Alat-alat yang digunakan untuk
pembentukan benih BC1F1 Ciherang-Sub1
adalah cawan petri, kertas saring, bak plastik volume 100 liter, penyedot vakum, kertas minyak, dan klip. Alat-alat yang digunakan untuk isolasi DNA adalah penangas air, cool box, pinset, tabung mikro, mortar, tip,
vorteks, mikrofuse (Backman rotor 12),
autopipet, inkubator, dan oven. Alat-alat yang digunakan untuk elektroforesis adalah neraca analitik, gelas ukur, labu erlenmeyer,
pengaduk magnet, microwave, tangki
elektroforesis, dan kertas aluminium foil. Alat-alat lain yang digunakan adalah
spektrofotometer (SmartSpec TM Plus
Spectrophotometer, Biorad), kuvet, mesin PCR PTC-100 (MJ Research, Inc), dan UV illuminator Chemidoc EQ Biorad.
Metode Penelitian
Penanaman dan Persilangan Tanaman Padi (Soedyanto et al. 1978)
Materi yang digunakan adalah
varietas unggul Ciherang sebagai host dan
padi donor F1 Ciherang-Sub1. Benih
BC1F1 Ciherang-Sub1 (BC1F1
Ciherang/IR64-Sub1 dan BC1F1
Ciherang/Swarna-Sub1) dihasilkan melalui penanaman benih padi dari masing-masing varietas dalam cawan petri sebanyak 60 benih. Setelah berkecambah, dipilih 50 kecambah dari masing-masing varietas
yang pertumbuhannya baik dan
dipindahkan ke bak pembenihan. Setelah berumur 3 minggu, tanaman dipindahkan ke ember dan dipelihara sampai berbunga. Tanaman tetua betina Ciherang dan tetua
jantan F1 Ciherang-Sub1 yang
pembungaannya bersamaan disilangkan
untuk mendapatkan tanaman BC1F1.
Sehari sebelum dilakukan persilangan, dilakukan kastrasi atau emaskulasi pada
bunga-bunga tanaman tetua betina
Ciherang. Kastrasi adalah proses
pembuangan bagian tanaman yang tidak diperlukan dalam proses persilangan.
Kastrasi dilakukan sehari sebelum
penyerbukan agar putik menjadi masak sempurna saat penyerbukan sehingga keberhasilan penyilangan lebih tinggi. Setiap bunga terdapat enam benang sari. Dua kepala putik yang menyerupai rambut tidak boleh rusak. Bunga pada malai yang akan dikastrasi dijarangkan hingga tinggal 15-50 bunga. Sepertiga bagian bunga dipotong miring menggunakan gunting kemudian benang sari diambil dengan alat penyedot vakum. Bunga yang telah bersih dari benang sari ditutup dengan kertas minyak agar tidak terserbuki oleh tepung sari yang tidak dikehendaki.
Proses penyerbukan dilakukan
3
hingga 32°C dan kelembapan udara hingga
80% sehingga dapat mempercepat
pemasakan tepung sari. Bunga jantan diambil kemudian disimpan dalam bak plastik. Setelah kepala sari membuka, segera dilakukan penyerbukan. Bunga betina yang sudah dikastrasi dibuka
tutupnya kemudian bunga jantan
diletakkan diatasnya. Benih-benih yang telah masak dipanen dan dikeringkan dalam oven selama 1 malam.
Pengujian Toleransi Genangan (Septiningsih et al. 2008)
Benih sebanyak 60 benih per fenotipe BC1F1 Ciherang-Sub1, padi tetua masing-masing sebanyak 60 benih, serta 60 benih padi IR42 disemai di cawan petri selama 5-7 hari. Padi varietas IR42 biasanya digunakan sebagai kontrol toleran genangan karena sensitif terhadap genangan sehingga dapat memudahkan mengetahui batas uji genangan yang dilakukan. Setelah bibit berumur 7 hari atau cukup tinggi untuk ditanam ke dalam
tanah, bibit dipindah tanam ke bak
percobaan berisi tanah. Bak percobaan ditanami ±50 bibit padi dengan jarak tanam 5 cm x 5 cm dan tanaman dibiarkan tumbuh sekitar 14 hari untuk siap dilakukan uji genangan.
Seleksi adanya gen Sub1 dari hasil persilangan untuk uji genangan disejajarkan dengan tetua masing-masing varietas. Padi IR42 sebagai kontrol negatif juga ditanam sejajar dalam satu pot kecil bersama dengan padi BC1F1 hasil persilangan dan tetua. Setelah padi berumur 14 hari dalam pot maka dilakukan uji genangan dengan memasukkan pot yang berisi tanaman padi yang telah disejajarkan tersebut ke dalam bak (tray) yang besar. Kemudian bak yang sudah berisi tanaman padi tersebut diisi dengan air (digenangi) sampai keseluruhan padi tersebut terendam. Ketika kontrol IR42
sudah menunjukkan kerusakan >50%
biasanya setelah 14 hari maka genangan air dalam bak tersebut dibuang. Setelah itu tanaman padi yang bertahan tersebut secara keseluruhan dibiarkan selama 10-21 hari
untuk melakukan recovery (pemulihan).
Kemudian tanaman padi yang pertumbuhan
paling bagus setelah proses recovery
ditumbuhkan dalam ember sampai daunnya siap untuk isolasi DNA.
Isolasi DNA Padi (Doyle & Doyle 1987) DNA genom total tanaman padi hasil persilangan BC1F1 Ciherang-Sub1 di isolasi
dari daun. Isolasi DNA dilakukan melalui empat tahapan yang meliputi pemanenan, preparasi ekstrak sel, pemurnian DNA, dan pemekatan DNA. Tanaman padi yang berumur 3 minggu dipanen dan dimasukkan dalam tabung mikro. Pemecahan sel dibantu dengan cara penggerusan dalam mortar. Sebanyak 1000 µL buffer ekstraksi CTAB hingga homogen. Suspensi diinkubasi di dalam penangas air selama 15 menit suhu 65ºC (setiap 5 menit dikocok dengan cara
tabung dibolak-balik secara perlahan).
Pemurnian DNA dari pengotor dihilangkan
dengan penambahan 100 µL fenol
kloroform isoamilalkohol (PCI) ke dalam tabung dan dikocok selama 20 detik hingga merata. Suspensi selanjutnya dis entrifugasi dengan kecepatan 9449 g selama 10 menit.
Pemekatan DNA dilakukan dengan menambahkan 500 µL isopropanol ke supernatan dan dicampur selama 5 menit. Sampel divorteks dan disentrifugasi kembali pada kecepatan 9449 g selama 5 menit. Pelet yang diperoleh dicuci dengan 500 µL etanol
70%. Campuran disentrifugasi kembali
selama 5 menit pada kecepatan 9449 g. Pelet selanjutnya dikeringkan di oven suhu 60ºC selama 10 menit. Pelet yang telah kering dilarutkan dengan larutan TE (Tris-EDTA) yang mengandung ribonuklease sebanyak 50-100 µL. Kemudian pelet yang telah dilarutkan dengan TE diinkubasi suhu 37°C selama 30 menit.
Pengukuran Konsentrasi dan Kemurnian DNA (Sambrook & Russel 1989)
Konsentrasi DNA ditentukan dengan spektrofotometer pada 260 nm. Sedangkan kemurnian DNA diukur pada 260/280 nm. Sampel DNA sebanyak 2 µL dilarutkan dalam buffer Tris-EDTA sebanyak 398 µL ke dalam kuvet sehingga volume akhirnya 400 µL. Kuvet ditutup, dimasukkan dalam tempat pengukuran dan ditekan tombol
“read sample”. Angka yang muncul pada layar merupakan konsentrasi dari DNA sampel yang diukur dan dicatat. Untuk mengukur kemurnian dari DNA, tombol
“OD 260/280” ditekan sehingga muncul
angka yang merupakan nilai kemurnian dari sampel DNA. DNA yang sudah diukur
konsentrasinya diencerkan sehingga
Seleksi PCR dengan Marka AEX1 (Septiningsih et al. 2008)
Hasil isolasi DNA yang akan
diperoleh disamakan terlebih dahulu
konsentrasinya, selanjutnya dilakukan
tahap PCR. Campuran reaksi untuk PCR terdiri atas 2 µL DNA 50 ng/µL, 2 µL buffer PCR 10x, 0.6 µL MgCl2 50 mM, 0.4 µL dNTP mix 50 mM, 1 µL masing-masing primer AEX1F ukuran 231 bp
sebagai forward dengan sekuen 5’
AGGCGGAGCTACGAGTACCA 3’ dan
primer AEX1R sebagai reverse dengan
sekuen 5’ GCAGAGCGGCTGCGA 3’
(Septiningsih et al. 2008), 0.16 µL Taq polymerase, dan 12.84 µL MQ H2O.
Kemudian dilakukan amplifikasi PCR
dengan kondisi denaturasi awal 94ºC selama 5 menit, denaturasi 94ºC selama 1 menit, penempelan primer 55ºC selama 1 menit, perpanjangan primer 72ºC selama 2 menit, dan perpanjangan primer akhir 72ºC selama 5 menit.
Seleksi PCR dengan Marka RM219 (Xu
et al. 2004)
Seleksi keberadaan gen Sub1 juga
dilakukan dengan menggunakan marka
mikrosatelit RM219 dengan campuran
reaksi untuk reaksi terdiri atas 1 µL DNA 50 ng/µL, 2µL bufer PCR 10x, 1.2 µL MgCl2 50 mM, 0.4 µL dNTP mix 50 mM,
1 µL masing-masing primer forward
RM219 dengan sekuen 5’
CGTCGGATGATGTAAAGCCT 3’ dan
primer reverse RM219 dengan sekuen 5’
CATATCGGCATTCGCCTG 3’, 0.16 µL
Taq polymerase, dan 12.84 µLMQ H2O. Selanjutnya dilakukan amplifikasi PCR seperti pada marka AEX1.
Elektroforesis Produk PCR (Septiningsih
et al. 2008)
Ukuran produk PCR selanjutnya dapat dianalisis dengan elekroforesis. Sebanyak 2% gel agarosa dan 1x buffer TAE (Tris Acetic Acid EDTA) dimasukkan ke dalam cetakan. Setelah gel agarosa memadat kemudian dimasukkan ke dalam tangki elektroforesis yang berisi 1x buffer TAE. Sebanyak 10 µl produk PCR dari
masing-masing sampel ditambahkan
dengan 2 µl loading dye dan dicampur sempurna, kemudian dimasukkan ke dalam sumur di dalam gel. Penentuan ukuran dari produk PCR disertakan juga DNA standar
(100 bp ladder) sebagai pembanding.
Sampel dielektroforesis dengan tegangan 80 volt selama kurang lebih 1.5 jam. Setelah itu, gel agarosa diwarnai dengan larutan etidium bromida (10 mg/L) selama 10 menit dan dicuci dengan air selama
10-20 menit. Gel agarosa kemudian
divisualisasi dengan Chemidoc gel system (Biorad).
HASIL DAN PEMBAHASAN
Pembentukan Populasi BC1F1 Ciherang/Swarna-Sub1 dan BC1F1
Ciherang/IR64-Sub1
Pembentukan populasi BC1F1
Ciherang-Sub1 dari penelitian ini merupakan penggabungan sifat yang dimiliki dari dua
jenis tetua yang berbeda. Proses
pembentukan populasi BC1F1 tersebut dilakukan melalui proses persilangan antara kepala putik dengan benang sari sehingga
dapat dihasilkan embrio yang akan
berkembang menjadi benih. Menurut Welsh (1981), penggabungan sifat yang berbeda dari kedua tetua pada BC1F1 terjadi secara
acak, sehingga kombinasi sifat yang
dihasilkan bersifat lebih menguntungkan dari kedua tetuanya. Keturunan yang dihasilkan akan memiliki sifat baru yang berbeda dengan kedua induknya. Keturunan BC1F1 yang dihasilkan bersifat heterozigot. Hasil persilangan antara Ciherang (host)
dengan F1 Ciherang-Sub1 (donor) akan
menghasilkan populasi BC1F1 dengan
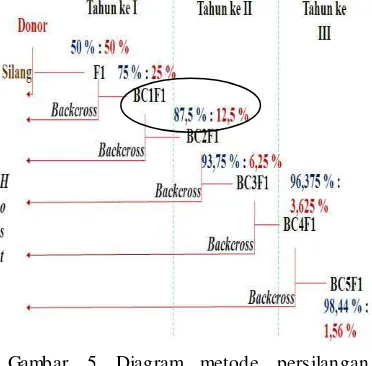
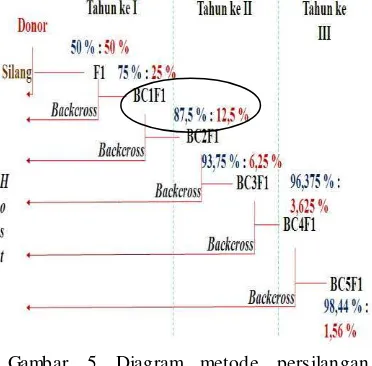
komposisi gen 75%:25%. Secara teori gen dari kedua tetua telah bersegregasi dalam tanaman BC1F1 dengan komposisi gen Ciherang paling banyak terkandung pada populasi BC1F1 Ciherang-Sub1 (Gambar 5).
Pembentukan benih BC1F1 Ciherang-Sub1 merupakan suatu proses penyilangan balik (back cross) antara tanaman tetua Ciherang (nontoleran genangan) dengan
tanaman F1 Ciherang-Sub1 (toleran
genangan atau donor Sub1) (Gambar 6).
Metode yang digunakan dalam proses penyilangan ini adalah metode persilangan terarah (site-directed crossing). Metode persilangan terarah ini lebih dikenal dengan nama mark er-assisted back crossing (Lu & Chang 1980, Mackill et al. 2007). Metode persilangan terarah merupakan alternatif yang dapat digunakan untuk mengintroduksi sifat tertentu secara spesifik tanpa harus melalui rekayasa genetika yang dapat menghasilkan tanaman transgenik (Xu et al. 2004, Mackill et al. 2007). Penyilangan balik tanaman F1 Ciherang-Sub1 terhadap Ciherang ditujukan agar tanaman BC1F1
Ciherang-Sub1 yang dihasilkan memiliki
sifat yang dimiliki oleh Ciherang, seperti produktivitas padi yang dihasilkan tinggi dan tahan terhadap penyakit.
Proses penyilangan yang dilakukan
untuk menghasilkan tanaman BC1F1
Ciherang-Sub1 perlu perhatian yang khusus,
salah satunya waktu penyilangan.
Persilangan dilakukan ketika pembungaan antara tetua jantan dan tetua betina memiliki waktu yang sama. Oleh karena itu, pengaturan dan penghitungan jarak waktu tanam perlu dilakukan agar kedua tetua
dapat berbunga secara bersamaan.
Persilangan antara Ciherang dengan F1
Ciherang/IR64-Sub1 terjadi lebih awal
dengan masa berbunga ±86 hari, sedangkan persilangan antara Ciherang dengan F1 Swarna-Sub1 memiliki masa berbunga ±104 hari.
Faktor lain yang mempengaruhi
tingkat keberhasilan proses penyilangan adalah proses kastrasi. Tetua betina (padi Ciherang) harus benar-benar bersih dari kandungan benang sari agar tidak terjadi penyerbukan sendiri. Apabila padi Ciherang ini melakukan penyerbukan sendiri maka padi yang dihasilkan adalah padi Ciherang bukan padi BC1F1 Ciherang-Sub1. Proses
penyilangan yang dilakukan dalam
penelitian ini dapat dikatakan berhasil. Sepuluh tanaman padi Ciherang yang disilangkan dengan sepuluh tanaman padi F1
Ciherang-Sub1 dapat menghasilkan cukup
banyak benih padi BC1F1 Ciherang-Sub1.
Jumlah benih BC1F1 Ciherang/Swarna-Sub1
yang dihasilkan dari proses penyilangan ini sebanyak 147 benih, sedangkan benih
BC1F1 Ciherang/IR64-Sub1 sebanyak 124
benih. Benih yang dihasilkan dari
persilangan memiliki bentuk ramping
panjang tanpa kulit luar. Benih-benih
tersebut kemudian ditumbuhkan untuk
menghasilkan tanaman utuh BC1F1
Ciherang-Sub1 (Gambar 6).
Gambar 6 Pembentukan dan seleksi padi
BC1F1 Ciherang-Sub1. (1)
Tetua host betina Ciherang
dengan donor F1 Ciherang-Sub1
yang telah dikastrasi; (2) Bunga padi yang telah diserbuki tepung sari dari bunga jantan dan ditutup dengan kertas minyak;
(3) Benih BC1F1 hasil
persilangan; (4) Benih ditanam pada petri dan bak kecil; (5)
Pengujian genangan; (6)
Populasi tanaman BC1F1
Ciherang-Sub1 dalam ember. Seleksi Uji Toleransi Genangan Tanaman padi pada umumnya dapat beradaptasi terhadap lingkungan yang terkena cekaman genangan, seperti lahan yang terkena banjir berlebihan. Respon tanaman padi terhadap lingkungan yang seperti itu akan melakukan dua proses pertahanan, yaitu pemanjangan sel tanaman dan toleran terhadap cekaman genangan
tersebut (Fukao & Bailey 2008).
Pemanjangan sel tanaman di bawah kondisi
Ciherang (host)
F1Ciherang-Sub1
1 2 3
4
5 6
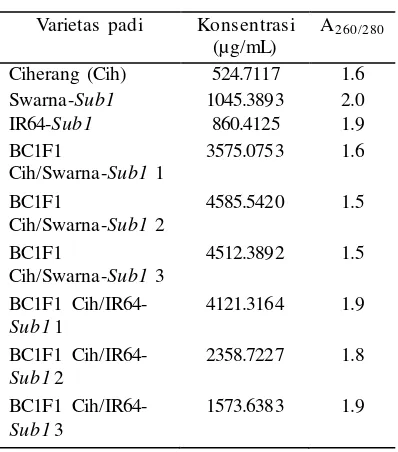
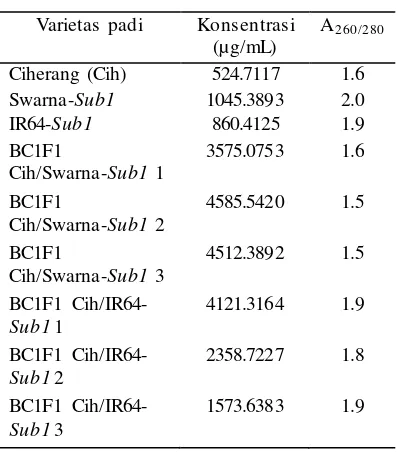
DNA padi Ciherang. Hal ini menunjukkan bahwa jumlah DNA yang diperoleh dari
hasil isolasi jumlahnya sedikit. Nilai
konsentrasi ini sangat berpengaruh terhadap proses selanjutnya yaitu analisis PCR. Konsentrasi masing-masing sampel harus disamakan dalam analisis PCR agar jumlah DNA yang teramplifikasikan relatif sama. Oleh karena itu, dilakukan pengenceran pada semua sampel hingga 50 µg/mL. Nilai kemurnian yang diperoleh juga memberikan hasil yang berbeda. Sampel DNA yang memiliki nilai kurang dari 1.8 (seperti pada
Ciherang) menunjukkan sampel DNA
mengalami kontaminasi protein sedangkan nilai kemurnian lebih dari 2.0 menunjukkan adanya kontaminasi oleh RNA (Sambrook & Russel 1989).
Tabel 2 Pengukuran konsentrasi dan
kemurnian DNA daun padi
Varietas padi Konsentrasi
(µg/mL)
A260/280
Ciherang (Cih) 524.7117 1.6
Swarna-Sub1 1045.3893 2.0
IR64-Sub1 860.4125 1.9
BC1F1
Cih/Swarna-Sub1 1
3575.0753 1.6
BC1F1
Cih/Swarna-Sub1 2
4585.5420 1.5
BC1F1
Cih/Swarna-Sub1 3
4512.3892 1.5
BC1F1 Cih/IR64-Sub1 1
4121.3164 1.9
BC1F1 Cih/IR64-Sub1 2
2358.7227 1.8
BC1F1 Cih/IR64-Sub1 3
1573.6383 1.9
Hasil Seleksi BC1F1 Ciherang-Sub1
dengan Analisis PCR
Marka Sub1A (AEX1)
Tanaman BC1F1 Ciherang-Sub1 yang
telah diseleksi dari uji toleran genangan perlu diuji lebih lanjut melalui analisis PCR.
Tanaman BC1F1 Ciherang-Sub1 yang
diduga telah terintrogresi gen Sub1 dari
tanaman tetua Ciherang/Swarna-Sub1 dan
Ciherang/IR64-Sub1 perlu ditentukan secara spesifik bahwa tanaman tersebut telah mengandung gen Sub1. Analisis PCR yang pertama kali dilakukan adalah seleksi
tanaman padi BC1F1 Ciherang-Sub1 dengan
marka Sub1A (AEX1). Marka ini digunakan
untuk menyeleksi tanaman BC1F1
Ciherang-Sub1 yang mengandung gen
Sub1A. Menurut Septingsih et al. (2008), SNP (Spesific Single Nucleotide Polymorphism) dalam daerah pengkodean Sub1A menyebabkan terjadinya substitusi
asam amino (nontoleran: CCG=prolin;
toleran: TCG=serin) yang ditargetkan untuk desain marka. Marka AEX1 merupakan pengembangan primer PCR dengan SNP
pada ujung 3’. Marka tersebut secara
spesifik dirancang untuk alel toleran
(IR40931). Primer marka AEX1F sebagai
forward dengan sekuen 5’
AGGCGGAGCTACGAGTACCA 3’.
Primer AEX1F berukuran 231 bp dengan nilai Tm sebesar 62.2ºC. Primer AEX1R
merupakan primer reverse yang spesifik
untuk toleran dengan nilai Tm sebesar 62.4ºC. Sekuen dari primer AEX1R adalah
5’ GCAGAGCGGCTGCGA 3’.
Hasil elektroforesis sampel DNA
tanaman padi BC1F1 Ciherang/Swarna-Sub1
(Gambar 9) dan BC1F1 Ciherang/IR64-Sub1 (Gambar 10) merupakan visualisasi sampel DNA tanaman padi dengan menggunakan gel agarosa 2%. Pengujian terhadap gen Sub1 dengan marka AEX1 ini merupakan tanaman BC1F1 Ciherang-Sub1 yang positif toleran genangan berdasarkan hasil uji genangan dan memiliki tingkat pertumbuhan yang baik. Data yang menunjukkan adanya pita DNA tersebut memberikan informasi bahwa tanaman-tanaman padi tersebut
mengandung gen Sub1A sehingga bisa
diidentifikasi sebagai padi toleran genangan. Namun, pada tanaman padi yang tidak memperlihatkan adanya pita DNA seperti padi Ciherang dan IR42 menunjukkan bahwa padi tersebut tidak memiliki gen Sub1A (nontoleran genangan).
Padi BC1F1 Ciherang-Sub1
memperlihatkan hasil yang positif bahwa keberadaan gen Sub1A telah terintrogresi ke dalam padi Ciherang melalui persilangan terarah dengan ukuran pita DNA yang diperlihatkan pada ukuran 231 bp mengikuti
tetua donornya masing-masing yaitu
Swarna-Sub1 dan IR64-Sub1. Hasil ini sesuai dengan penelitian sebelumnya yaitu hasil seleksi tanaman toleran genangan dengan menggunakan marka AEX1 pita DNA yang dihasilkan akan berukuran 231 bp (Septiningsih et al. 2008). Selanjutnya
tanaman padi BC1F1 Ciherang-Sub1 yang
telah positif mengandung gen Sub1 akan
disilangbalikkan (back cross) kembali
dengan padi Ciherang untuk menghasilkan
DAFTAR PUSTAKA
CGIAR [Consultative Group on
International Agriculture Research]. 2006. Intensified Research Effort Yields Climate-Resilient Agriculture
To Blunt Impact of Global
Warming, Prevent Widespread
Hunger.Heat-tolerant Wheat, Flood-proof Rice, Satellites for Carbon Trading Among New Technologies. Press release.pp4
Clark W, Christopher K. 2000. An
Introduction to DNA : Spechtrophotometry, Degradation, and the “Frangekel” Eksperimen. Alberta: University of Alberta. Doyle JJ, Doyle JL. 1987. Isolation of plant
DNA from fresh tissue. Focus 12: 13-15.
Fallah, Fajar A. 2006. Perspektif Pertanian dalam Lingkungan yang Terkontrol. AgroBiogen 5: 36-44.
Fukao T, Bailey SJ. 2008. Submergence
tolerance conferred by Sub1A is
mediated by SLR1 and SLRL1 restriction of gibberellin responses in rice. PNAS. 105: 16814-19.
Gardener FP, Pearce RB, Michell RL. 1991. Fisiologi Tanaman Budidaya. Jakarta: UI Pr.
Hairmansis A, Kustionto B, Supartopo I,
Khairullah, Suwarno. 2008.
INPARA3: Varietas unggul baru
padi rawa toleran Rendaman.
Seminar makalah penunjang Pekan Padi Nasional III. 22 Juli 2008. BB padi Sukamandi.
Harahap Z, Suwarno, Lubis E, Susanto TW.
1995. Padi Unggul Toleran
Kek eringan dan Naungan. Bogor: Pusat Penelitian dan Pengembangan Tanaman Pangan, Badan Litbang pertanian.
Hermanto. 2006. Padi Ciherang makin
populer. Warta Penelitian dan
Pengembangan Pertanian 28: 14-15. IRRI. 2004. Varietas unggul padi sawah
yang dilepas sejak 1943-2004.
http:\\www.knowledgebank.irri.org\r egionalSites\indonesia\docs\padiSaw ah. Pdf.
IRRI. 2007a. Responding to the needs of rice farmers in flash-flood-prone areas. Sub1news1: 2.
Ito OE, Kawano N. 1999. Physiological basis of submergence tolerance in rainfed lowland rice ecosystem. Field Crops Res 64: 75-90.
Jackson MB, Waters T, Setter, Greenway H. 1987. Injury to rice plants caused by
complete submergence: a
contribution by ethylene (ethene). J. Exp. Bot. 38: 1826-38.
Jackson MB, Ram PC. 2003. Physiological and molecular basis of susceptibility and tolerance of rice plants to
complete submergence. Ann. Bot.
91: 227-41.
Krishnan HB, Puepke SG. 1983. Nucleotide sequence of an abundant rice seed globulin. JBiophys 193: 460-466. Lu JJ, Chang TT. 1980. Rice in Temporal
and Spatial Prospective. In Rice Production and Utilization. Bor s. Luh (ed). West Port: AVI Pb. Mackill DJ, Nguyen, Jingxian Zhang. 1999.
Use of molecular markers in plant improvement programs for rainfed lowland rice. Field Crops Res 64: 177-185.
Mackill DJ. 2007. From genes to farmers’ fields: the practical application of
gene discovery to develop
submergence-tolerant rice will help farmers avoid the ravages of severe flooding. Rice Today 5: 28-30. Mackill DJ. 2007. Marker assisted selection
for submergence tolerance in rice. Mol. Plant Breeding 5: 207-208.
Manurung SO, Ismunadji M. 1999. Padi:
Buk u Padi 1. Bogor: Pusat Penelitian dan pengembangan Pertanian, Badan
Penelitian dan Pengembangan
Pertanian.
Maurya, Bottrall, Farrington J. 1988.
Improved livelihoods, genetic
diversity dan farmer participation: a strategy for rice breeding in rainfed areas of India. Exp Agri 24: 311-320.
Mikkelsen SR, Corton E. 2004.
Mohanty HK, Mallik S, Grover A. 2000. Prospect of improving flooding tolerance in lowland rice varieties by conventional breeding and genetic engineering. Curr. Sci. 78: 132-140. Mullis KB. 1990. The unusual origin of the
polymerase chain reaction.
Scientific American 17: 56-65. Neeraja C, Rodriguez RM, Pamplona A,
Heuer S, Xu K. 2007. A marker-assisted backcross approach for developing submergence tolerant rice cultivars. Theor Appl Genet 115: 767-776.
Nugroho K, Kusuma A, Paidi, Wahdini W, Suhardjo. 1993. Peta areal untuk
pengembangan pertanian lahan
pasang surut dan pantai. Proyek Penelitian Sumber Daya Lahan.
Pusat Penelitian Tanah dan
AgroKlimat. Badan Litbang
Pertanian.
Perata P, Voesenek LACJ. 2007.
Submergence tolerance in rice
requires Sub1A, an
ethylene-response-factor-like gene. Trends in Plant Sci. 12: 43-46.
Rivandi JS. 2010. Aplikasi berbagai marka
Sub1 (AEX1, SUB1C173, RM464,
RM219) pada pembentukan dan
seleksi F1 Ciherang toleran
genangan. Skripsi. Bogor: Fakultas Matematikan dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sambrook J, Russel DW. 1989. Molecular
Cloning: A Laboratory Manual. Edisi ke-3. New York: Cold-Spring Harbor Laboratory Pr.
Sarkar RK, Reddy JN, Sharma SG, Ismail AM. 2006. Physiology basis of
submergence in rice and
implications for crop protection. Curr. Sci. 91: 899-906.
Septiningsih EM et al.. 2008. Development
of submergence tolerant rice
cultivars: The Sub1 locus dan
beyond. Annals of Botany 103: 151-160.
Setter dan Laureles. 1995. Environmental characteristics of floodwater in eastern India: relevance to flooding tolerance of rice. Indian J. Plant Physiol. 38: 34-40.
Setter TL et al.. 1997. Physiology dan genetics of submergence tolerance in rice. Ann. Bot. 79: 67–77 .
Siangliw M, Toojinda T, Tragoonrung S, Vanavichit A. 2003. Molecular genetics of submergence tolerance in rice: QTL analysis of key traits. Annals of Botany 91: 243-253.
Siregar H. 1981. Budidaya Tanaman Padi di
Indonesia. Jakarta: Rineka.
Soedyanto R, Sianipar R. Sanusi A, Hardjanto . 1978. Bercocok Tanam Jilid II. Jakarta: Yasaguna.
Supartopo, R. Hermanasari, Maulana, dan A. Haermansis. 2008. Uji rendaman galur-galur harapan rawa lebak. Prosiding seminar apresiasi hasil penelitian padi menunjang P2BN. pp. 697-704.
Welsh, James R. 1981. Dasar-Dasar
genetik a dan Pemuliaan Tanaman. Jakarta: Erlangga.
Xu K, Mackill DJ. 1996. A major locus for submergence tolerance mapped on
rice chromosome 9. Mol Bree2:
219–224.
Xu K, Deb R, Mackill DJ. 2004. A
microsatellite Marker and a
Codominant PCR-Based Marker for
Marker-assistedselection of
Submergence Tolerance in Rice. Crop Sci. 44: 248–253.
Xu K et al.. 2006. Sub1A is an
ethylene-response-factor-like gene that
Lampiran 1 Alur penelitian
Tanaman padi
Host
Ciherang (F0)
Penyilangan Padi tetua (F0 dengan F1)
Benih hasil persilangan (BC1F1)
ditanam di pot kotak kecil ± 1-2
minggu
Uji genangan selama 14 hari dan
recovery
10 hari
Pemanenan BC1F1 untuk Isolasi
DNA
Cek kemurnian dan konsentrasi
DNA dengan spektrofotometer
Analisis PCR
Elektroforesis gel dan visualisasi
hasil amplifikasi DNA
Tanaman padi donor F1 Ciherang-
Sub1
(Ciherang/Swarna-
Sub1
dan Ciherang/IR64-
Sub1
)
Lampiran 5 Komposisi bufer ekstraksi DNA untuk 500 mL
Larutan Stok
Jumlah untuk 500
mL
Konsentrasi akhir
Tris-Cl 1 M (pH = 8,5)
NaCl 5 M
EDTA 0.25 M
CTAB
PVP
Merkaptoetanol
50 mL
140 mL
40 mL
10 g
10 g
1 mL
100 mM
1.4 M
20 mM
2% (b/v)
2% (b/v)
0.2% (v/v)
Lampiran 6 Varietas-varietas padi hasil persilangan yang mengandung
Sub1
(Xu
et al
. 2004, Sarkar
et al
. 2006)
Varietas
Lama
berbunga
(hari)
Lama
matang
(hari)
Tinggi
(cm)
Produktivitas
(ton/ha)
IR64-
Sub1
(IR07F102)
86
116
95
5,9
Swarna-
Sub1
(IR05F102)
104
134
85
5,3
Samba
Mahsuri-Sub1
(IR07F101)
98
126
85
6,5
TDK1-
Sub1
(IR07F289)
Sedang dikarakterisasi di IRRI
BR11-
Sub1
(IR07F290)
CR1009
Sub1
(IR07F291)
PSB RC68
98
121
121
6,5
Lampiran 7 Pengukuran konsentrasi dan kemurnian DNA hasil isolasi
Sampel
Konsentrasi
(µg/mL)
A
260/280Volume
DNA (µL)
Volume
ddH
2O (µL)
Ciherang (Cih)
524.7117
1.5580
9.53
90.47
Swarna-Sub1 (Swn-Sub1)
1045.3893
1.9976
23.91
476.09
IR64-Sub1
860.4125
1.8804
29.06
470.94
BC1F1 Cih/Swn-Sub1 1
3575.0753
1.6256
6.99
493.01
BC1F1 Cih/Swn-Sub1 2
4585.5420
1.4903
5.45
494.55
BC1F1 Cih/Swn-Sub1 3
4512.3892
1.4969
5.54
494.45
BC1F1 Cih/Swn-Sub1 4
4201.0684
1.5902
5.95
494.05
BC1F1 Cih/Swn-Sub1 5
4282.0620
1.9430
5.84
494.16
BC1F1 Cih/Swn-Sub1 6
6034.6826
1.5798
4.14
495.86
BC1F1 Cih/Swn-Sub1 7
3871.3997
1.4662
6.46
493.54
BC1F1 Cih/Swn-Sub1 8
3366.6521
2.0470
7.43
492.57
BC1F1 Cih/Swn-Sub1 9
7721.1196
1.6663
3.24
496.76
BC1F1 Cih/Swn-Sub1 10
6291.6182
1.6300
3.97
496.03
BC1F1 Cih/Swn-Sub1 11
3839.6182
1.5565
6.51
493.49
BC1F1 Cih/Swn-Sub1 12
1760.4060
1.8062
14.20
485.80
BC1F1 Cih/Swn-Sub1 13
1457.7708
1.8421
17.15
482.85
BC1F1 Cih/Swn-Sub1 14
777.2524
2.1455
32.16
467.84
BC1F1 Cih/Swn-Sub1 15
382.3071
1.4318
13.08
86.92
BC1F1 Cih/Swn-Sub1 16
1265.6226
1.7077
19.75
480.25
BC1F1 Cih/Swn-Sub1 17
1260.2039
1.8397
19.84
480.16
BC1F1 Cih/Swn-Sub1 18
1251.1879
1.9477
19.98
480.02
BC1F1 Cih/IR64-Sub1 1
4121.3164
1.9210
6.06
493.94
BC1F1 Cih/IR64-Sub1 2
2358.7227
1.7808
10.60
489.40
BC1F1 Cih/IR64-Sub1 3
1573.6383
1.8727
15.89
484.11
BC1F1 Cih/IR64-Sub1 4
2670.4971
1.8828
9.36
490.64
BC1F1 Cih/IR64-Sub1 5
1641.4984
1.9504
15.23
484.77
BC1F1 Cih/IR64-Sub1 6
1986.8638
1.8435
12.58
487.42
BC1F1 Cih/IR64-Sub1 7
1934.7235
1.7313
12.92
487.08
BC1F1 Cih/IR64-Sub1 8
1457.3708
1.5658
17.15
482.85
BC1F1 Cih/IR64-Sub1 9
4102.8608
1.8840
6.09
493.91
BC1F1 Cih/IR64-Sub1 10
2639.9067
1.9037
9.47
490.53
BC1F1 Cih/IR64-Sub1 11
1996.1305
1.9326
12.52
487.48
BC1F1 Cih/IR64-Sub1 12
5519.5020
1.4905
4.53
495.47
BC1F1 Cih/IR64-Sub1 13
3252.8425
1.7584
7.69
492.31
BC1F1 Cih/IR64-Sub1 14
3239.6465
1.5297
7.72
492.28
BC1F1 Cih/IR64-Sub1 15
3316.0740
1.3698
7.54
492.46
BC1F1 Cih/IR64-Sub1 16
2789.4897
1.9670
8.96
491.04
BC1F1 Cih/IR64-Sub1 17
3866.6401
1.4422
6.47
493.53
BC1F1 Cih/IR64-Sub1 18
2232.8313
1.6214
11.20
488.80
BC1F1 Cih/IR64-Sub1 19
3312.7227
1.8871
7.55
492.45
BC1F1 Cih/IR64-Sub1 20
1351.2483
1.9566
18.50
481.50
BC1F1 Cih/IR64-Sub1 21
2563.4788
1.6033
9.75
490.25
BC1F1 Cih/IR64-Sub1 22
1815.9373
1.9454
13.77
486.23
BC1F1 Cih/IR64-Sub1 23
3780.2964
1.3930
6.61
493.39
BC1F1 Cih/IR64-Sub1 24
2490.1047
1.8023
10.04
489.96
BC1F1 Cih/IR64-Sub1 25
2156.7651
1.9549
11.59
488.41
BC1F1 Cih/IR64-Sub1 26
3541.3970
1.4199
7.06
492.94
BC1F1 Cih/IR64-Sub1 27
901.7661
1.5967
27.72
472.28
BC1F1 Cih/IR64-Sub1 28
2982.8381
1.8559
8.38
491.62
Lampiran 7 (Lanjutan)
Sampel
Konsentrasi
(µg/mL)
A
260/280Volume
DNA (µL)
Volume
ddH
2O (µL)
BC1F1 Cih/IR64-Sub1 29
3579.4294
1.7498
6.98
493.02
BC1F1 Cih/IR64-Sub1 30
900.1044
1.4964
27.77
472.23
BC1F1 Cih/IR64-Sub1 31
743.4673
1.6514
33.63
466.37
BC1F1 Cih/IR64-Sub1 32
1325.6768
1.6980
18.86
481.14
BC1F1 Cih/IR64-Sub1 33
1407.0631
1.9155
17.77
482.23
BC1F1 Cih/IR64-Sub1 34
414.8721
1.8479
12.05
87.95
BC1F1 Cih/IR64-Sub1 35
769.1842
1.7738
6.50
93.50
Contoh perhitungan:
Dik: Ciherang (Cih)
M1 : konsentrasi DNA
V1 : volume DNA yang akan diambil
M2 : konsentrasi akhir (50 g/mL)
V2 : volume akhir (100 L)
Dit: V ddH
2O yang diambil
Penyelesain :
M1 x V1 = M2 x V2
524.7117 g/mL x V1 = 50 g/ml x 100 L
524.7117 g/mL x V1 = 5000 L g/mL
5000 L g/mL
V1 = 524.7117 g/mL
V1 = λ.53 L
V ddH
2O yang diambil = V2-V1
= 100 L
-
λ.53 L
= λ0.47 L
ABSTRAK
EUIS MARLINA. Aplikasi PCR berbasis marka
Sub1
(AEX1 dan RM219) pada
seleksi padi BC1F1 Ciherang-
Sub1
. Dibimbing oleh DJAROT SASONGKO HS
dan TRI JOKO SANTOSO.
Cekaman genangan merupakan pembatas ketiga utama dari 42 cekaman
biotik dan abiotik dalam produksi beras. Padi FR13A dapat beradaptasi terhadap
lingkungan yang terkena banjir berlebihan melalui sifat toleran genangan yang
dikontrol oleh suatu lokus tunggal utama (QTL) pada kromosom 9 yang diketahui
sebagai
Sub1.
Akan tetapi, varietas ini mudah terkena penyakit dan serangan
hama. Oleh karena itu,