PENGARUH PENGGUNAAN ANESTESI
PROPOFOL
DAN
ISOFLURANE
JANGKA PANJANG TERHADAP FUNGSI
KARDIOVASKULAR KELINCI DOMESTIK
SITARIA FRANSISKA SIALLAGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengaruh Penggunaan Anestesi Propofol dan Isoflurane Jangka Panjang terhadap Fungsi Kardiovaskular Kelinci Domestik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Sitaria Fransiska Siallagan
RINGKASAN
SITARIA FRANSISKA SIALLAGAN. Pengaruh Penggunaan Anestesi Propofol
dan Isoflurane Jangka Panjang terhadap Fungsi Kardiovaskular Kelinci Domestik. Dibimbing oleh DENI NOVIANA dan GUNANTI.
Penggunaan anestesi selama prosedur pembedahan akan menekan fungsi jantung. Beberapa pembedahan mayor membutuhkan anestesi jangka panjang dan akan meningkatkan penekanan pada fungsi jantung. Tujuan dari penelitian ini adalah untuk mengetahui efek jangka panjang dari anestesi propofol dan
isoflurane pada struktur dan fungsi kardiovaskular kelinci domestik yang meliputi frekuensi denyut jantung, volume aliran darah, kemampuan kontraksi, dan tekanan darah sistol melalui pemeriksaan ekhokardiografi M-mode dan tekanan darah.
Penelitian ini menggunakan 5 ekor kelinci jantan dengan usia 1-1,5 tahun. Anestesi yang digunakan selama penelitian adalah kombinasi propofol 12,5 mg/kg IV sebagai induksi dan inhalasi isoflurane sebagai maintenance selama 12 jam pengamatan. Isoflurane dialiri melalui masker dengan aliran oksigen murni 1 L/menit. Cairan NaCl fisiologi 0,9% digunakan selama penelitian berlangsung dengan aliran 6mL/kg/jam. Aliran infus dikontrol oleh infusion pump.
Tahapan penelitian dibagi menjadi tahap aklimasi, tahap persiapan, dan tahap pembiusan. Tahap aklimatisasi dilakukan setelah kelinci tiba di kandang. Aklimasi dilakukan selama 3 hari dengan menggunakan ivermectine sebagai antiektoparasit, mebendazole sebagai anti endoparasit, dan enrofloksasin sebagai antibiotik. Pengambilan darah dilakukan seminggu setelah aklimasi dilakukan. Tujuan dari pengambilan darah adalah untuk mengetahui kondisi kelinci sebelum digunakan pada penelitian.
Tahap persiapan dilakukan sebelum penelitian. Tahapan tersebut meliputi pencukuran rambut pada daerah right thorax, antebrachii medialis dan telinga. Pencukuran tersebut dilakukan untuk pemeriksaan ekhokardiografi, tekanan darah sistol, dan pemasangan oksimeter. Pada hari peneletian semua kelinci dilakukan pemeriksaan klinis yang meliputi pemeriksaan temperatur, pemeriksaan nafas, dan pemeriksaan frekuensi denyut jantung.
Tahap pembiusan dimulai saat propofol disuntikkan secara intravena dan berakhir pada saat aliran isoflurane dihentikan pada jam ke-12. Pada tahapan ini dilakukan pengambilan data ekhokardiografi pada saat induksi, serta pengambilan data tekanan darah sistol dan ekhokardiografi selama maintenance. Selama tahap pembiusan juga dilakukan pemeriksaan monitoring, yaitu pemeriksaan saturasi oksigen dan pemeriksaan klinis yang meliputi pemeriksaan temperatur dan pemeriksaan nafas. Saturasi oksigen diatur dengan nilai minimal saturasi oksigen adalah 95%.
berurutan adalah 0,23±0,02 hingga 0,27±0,04 cm dan 0,28±0,06 hingga 0,3±0,05 cm. Fungsi kardiovaskular yang diamati selama penelitian adalah frekuensi denyut, volume aliran, kemampuan kontraksi jantung serta tekanan darah sistol. Frekuensi denyut jantung berkisar antara 244±18 hingga 266±24 kali/menit. Volume aliran jantung yang meliputi stroke volume dan cardiac output secara berurutan berkisar antara 1,07±0,29 hingga 1,57±0,53 mL/denyut dan 0,27±0,07 hingga 0,39±0,14 L/menit. Kemampuan kontraksi jantung meliputi fraksi pemendekan dan fraksi ejeksi. Fraksi pemendekan dan fraksi ejeksi secara berurutan berkisar antara 26±3 hingga 31±5% dan 60±2 hingga 67±8%. Tekanan darah sistol berkisar antara 75,87±16,91 hingga 101,2±31,69 mmHg. Hasil pemeriksaan monitoring selama penelitian, diketahui kisaran rata-rata temperatur adalah 36,40±0,81 hingga 39,02±0,54oC dan frekuensi respirasi berkisar antara 42±6 hingga 61±23 kali/menit.
Berdasarkan hasil selama pengamatan dapat disimpulkan bahwa kombinasi anestesi propofol dan isoflurane jangka panjang menyebabkan penurunan temperatur, sedikit peningkatan frekuensi pernafasan pada jam tertentu serta penekanan struktur dan fungsi jantung yang minimal.
SUMMARY
SITARIA FRANSISKA SIALLAGAN. Effect of Long Time Anesthesia Propofol and Isoflurane on Cardiovascular Function of Domestic Rabbits. Supervised by DENI NOVIANA and GUNANTI.
Anesthesia during surgical procedures can lead to suppression of the heart function. Several major surgeries may require long time use of anesthetics and therefore increase the heart function suppression. The purpose of this study was to determine the effects of long time use of propofol and isoflurane anesthesia on cardiac function of domestic rabbits through the systole blood pressure and echocardiography examination.
This study used 5 male rabbits, 1-1,5 years old. Anaesthesia was used during the study was the combination of propofol 12,5 mg/kg IV as an induction and isoflurane inhalation as the maintenance anesthetic for a 12-hour observation. Isoflurane was inhaled with 1 L/minutes in facemasked. During this study, intravenous infusion was maintained with 6 mL/kg/hours NaCl physiology. Infuse flowing was controlled by infusion pump.
Study phases were acclimatization phase, preparation phase, and anaesthesia phase. Acclimatization phase was started by the time the rabbits were arrived to cages for 3 days. Acclimatization used ivermectine as parasiticids, mebendazole as anthelmentics, and enrofloxacin as antibiotics. Blood tests were examined after a week of acclimation to ensure the rabbit condition before the study.
Phases of preparation were done before the study. Phases include shaving hair on the right thoracic region, medial antebrachii, and ears. The shaving was done for echocardiography examination, systolic blood pressure, and oxygen saturation. On the day of the study, clinical examination was performed in all rabbits that including checking temperature, respiratory and heart rate examination.
Anaesthetic phase was begun when propofol was injected intravenously and done when isoflurane flowing was stopped at the twelfth hour. Echocardiography examination was done at the time of induction, as well as systolic blood pressure and echocardiography examinations were done during maintenance. During the examination phase of anesthesia, monitoring was also done including oxygen saturation and clinical examination including temperature and respiratory examination. Oxygen saturation was set to a minimum value of oxygen saturation was 95%.
observed in study were heart rate, heart blood volume, and the ability of the
heart’s contraction. Heart rate ranged from 244±18 to 266±24 beat/min. Heart
blood volumes which include stroke volume (SV) and cardiac output (CO) ranged from 1,07±0,29 to 1,57±0,53ml/beat and 0,27±0,07 to 0,39±0,14lt/min
respectively. the ability of the heart’s contraction includes fractional shortening,
and ejection fraction. Fractional shortening and ejection fraction ranged from 26±3 to 31±5% and 60±2 to 67±8% respectively. The results of monitoring examinations during the study, known temperature ranged from 36,40±0,81 to 39,02±0,54 °C and respiration rate ranged from 42±6 to 61±23 bpm.
Based on the result can be concluded that combination of long term propofol and isolfurane anesthesia causes temperature decreased, slight respiratory rate increased during limited hours, and minimal cardiac structure and function suppression.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENGARUH PENGGUNAAN ANESTESI
PROPOFOL
DAN
ISOFLURANE
JANGKA PANJANG TERHADAP FUNGSI
KARDIOVASKULAR KELINCI DOMESTIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
2
Judul Tesis : Pengaruh Penggunaan Anestesi Propofol dan Isoflurane Jangka Panjang terhadap Fungsi Kardiovaskular Kelinci Domestik Nama : Sitaria Fransiska Siallagan
NIM : B351110011
Disetujui oleh Komisi Pembimbing
Drh Deni Noviana, PhD Ketua
Dr Drh Gunanti, MS Anggota
Diketahui oleh
Ketua Program Studi Ilmu Biomedis Hewan
Drh Agus Setiyono, MS, PhD, APVet
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul tesis ini adalah pengaruh penggunaan anestesi propofol dan isoflurane jangka panjang terhadap fungsi kardiovaskular kelinci domestik. Tesis ini disusun sebagai salah satu syarat memperoleh gelar master (S2) pada mayor Ilmu Biomedis Hewan (IBH) program pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada drh Deni Noviana, Ph.D dan Dr drh Gunanti, MS selaku pembimbing, serta teman-teman sepenelitian yang banyak membantu dalam penelitian dan banyak memberi saran. Ungkapan terima kasih juga disampaikan kepada seluruh tenaga pendidik dan kependidikan bagian Bedah dan Radiologi yang telah mengijinkan dan membantu penulis melakukan penelitian di laboratorium radiologi. Terima kasih kepada PT Karindo Alkestron Indonesia yang telah membantu penelitian ini dalam bentuk penyediaan alat ultrasonografi (USG) ekhokardiografi tipe S-6X. Penulis juga mengucapkan terima kasih kepada Ayah, Ibu, serta seluruh keluarga, atas segala doa dan dukungan selama penulis mulai melanjutkan pendidikan, penelitian, hingga penyusunan tesis.
Penulis sangat menyadari bahwa penulisan dan isi tesis ini masih jauh dari sempurna, sehingga penulis sangat mengharapkan kritik dan saran sehingga dapat menjadi lebih baik. Semoga tulisan ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Anestesi Umum 3
Tahap-tahap Anestesi Umum 3
Propofol 4
Isoflurane 5
Tekanan Darah 6
Ekhokardiografi 6
Penilaian Ekhokardiografi 6
Perhitungan Kuantitas 7
Kelinci 7
3 METODE 9
Waktu dan Tempat Penelitian 9
Hewan Coba 9
Metode Penelitian 9
Analisis Data 11
4 HASIL DAN PEMBAHASAN 13
Pemeriksaan Darah 13
Pemeriksaan Klinis sebelum Penelitian 14
Pengamatan Klinis selama Penelitian 14
Tekanan Darah Sistol 19
Pengamatan Ketebalan Dinding 20
Pengamatan Frekuensi denyut jantung 22
Pengamatan Volume Aliran Jantung 23
Pengamatan Kemampuan Kontraksi Jantung 24
5 SIMPULAN 27
DAFTAR PUSTAKA 29
LAMPIRAN 37
DAFTAR TABEL
1 Diagram alir penelitian kombinasi propofol dan isoflurane 11 2 Hasil pemeriksaan darah lengkap kelinci domestik 13 3 Efek anestesi jangka panjang propofol-isoflurane terhadap
temperatur dan frekuensi respirasi kelinci domestik terhadap waktu pengamatan
tranduser short axis view pada right parasternal
10 3 Efek anestesi jangka panjang propofol-isoflurane terhadap temperatur
kelinci domestik selama pengamatan
15 4 Efek anestesi jangka panjang propofol-isoflurane terhadap frekuensi
respirasi kelinci domestik selama pengamatan
16 5 Efek anestesi jangka panjang propofol-isoflurane terhadap tekanan
darah sistol kelinci domestik selama pengamatan hingga jam ke-12
19 6 Pengamatan ekhokardiografi kelinci domestik terhadap struktur
jantung dibawah pengaruh anestesi propofol-isoflurane
20 7 Efek anestesi jangka panjang propofol-isoflurane terhadap ketebalan
dinding dan ruang ventrikel kiri jantung kelinci domestik selama pengamatan
21
8 Efek jangka panjang propofol-isoflurane terhadap frekuensi denyut jantung kelinci
22 9 Efek anestesi jangka panjang propofol-isoflurane terhadap stroke
volume dan cardiac output kelinci domestik
23 10 Efek anestesi jangka panjang propofol-isoflurane terhadap ejection
fraction dan fractional shortening kelinci domestik
24
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Jantung merupakan organ penting dalam tubuh yang berfungsi untuk mengedarkan darah ke seluruh bagian tubuh dan dipengaruhi oleh banyak hal. Faktor-faktor tersebut adalah kontraksi dan dilatasi atrium dan ventrikel, serta perubahan tekanan pada rongga thorak. Atrium dan ventrikel merupakan ruang jantung yang berfungsi menerima dan memompa darah, selain itu katup atrioventrikular, katup aorta dan katup pulmonalis juga berperan dalam aliran darah tersebut (Cunningham dan Klein 2007).
Peranan jantung yang penting dalam tubuh menyebabkan banyak peneliti yang tertarik untuk mengetahui lebih jauh tentang perubahan organ ini dari berbagai aspek. Beberapa penelitian klinis yang melibatkan jantung yaitu melihat efek agen anestesi tunggal maupun kombinasi terhadap sistem kardiovaskular (Baumgartner et al. 2010), efek dosis maksimum dan minimum dari suatu obat terhadap fungsi jantung (Vali et al. 2012), penyakit pada jantung (Roche et al.
2012). Anestesi merupakan prosedur yang penting selama pembedahan dan dapat menekan sistem kardiovaskular. Efek anestesi terhadap sistem kardiovaskular menyebabkan penggunaan anestesi perlu disertai dengan pengamatan terhadap fungsi jantung.
Beberapa metode telah digunakan untuk membantu peneliti maupun praktisi dalam menilai fungsi jantung, diantaranya adalah ekhokardiografi. Ekhokardiografi merupakan teknik diagnosa pada jantung dengan menggunakan gelombang suara ultra high-frequency yang dapat memberikan informasi morfologi dan struktur jantung yang meliputi ukuran, ketebalan, pergerakan otot dan katup jantung, serta aliran darah dalam pembuluh darah (Noviana et al. 2011). Ekhokardiografi juga dapat digunakan untuk mengevaluasi fungsi jantung yaitu dengan perhitungan ekhokardiografi seperti stroke volume (SV), cardiac output
(CO), fractional shortening (FS), dan ejection fraction (EF) (Fontes-Sousa et al. 2006).
Kelinci merupakan hewan laboratorium yang sering digunakan setelah mencit dan tikus putih. Beberapa penelitian yang melibatkan agen anestesi pada kelinci sering dilakukan dengan mengamati perubahan kimia klinis, efek pada sistem kardiorespirasi terhadap beberapa agen atau kombinasi agen anestesi, serta mengevaluasi efek klinis dan paraklinis agen anestesi terhadap beberapa metode pemberian (Baumgartner 2010, Khameneh et al. 2012).
Beberapa penelitian yang dilakukan terhadap kelinci seringkali menggunakan anestesi ataupun analgesik dengan durasi waktu lebih dari 6 jam (Jiang et al. 2012). Selain pada penelitian klinis, pembiusan jangka panjang pada beberapa hewan sering kali dibutuhkan untuk pembedahan. Menurut Tanaka et al
2
mengamati fungsi kardiovaskular dengan menggunakan metode ekhokardiografi pada penggunaan anestesi propofol-isoflurane jangka panjang.
Perumusan Masalah
Proses pembedahan pada umumnya membutuhkan anestesi. Setiap agen anestesi memiliki efek terhadap penekanan sistem kardiovaskular. Semakin panjang durasi pemberian anestesi maka penekanan terhadap sistem kardiovaskular juga akan semakin tinggi. Durasi waktu yang dibutuhkan selama proses pembedahan bisa dalam jangka waktu singkat ataupun panjang.
Kelinci merupakan salah satu hewan model untuk jantung, sehingga sering digunakan dalam berbagai penelitian. Penelitian yang dilakukan dapat berupa penelitian untuk proses pembedahan ataupun penelitian klinis, sehingga banyak macam agen anestesi yang digunakan pada kelinci. Propofol dan isoflurane
merupakan salah satu agen anestesi yang aman digunakan. Akan tetapi jika durasi anestesi semakin lama diperlukan, maka akan terjadi penekanan yang lebih pada sistem kardiovaskular. Efek jangka panjang terhadap sistem kardiovaskular dari kombinasi anestesi ini belum diketahui.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui efek jangka panjang dari anestesi propofol dan isoflurane pada struktur dan fungsi kardiovaskular kelinci domestik yang meliputi frekuensi denyut jantung, volume aliran darah, kemampuan kontraksi, dan tekanan darah sistol melalui pemeriksaan ekhokardiografi M-mode dan tekanan darah.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat:
1. Mengetahui efek jangka panjang penggunaan anestesi propofol dan
isoflurane terhadap fungsi kardiovaskular kelinci domestik.
2. Memperoleh data yang meliputi struktur dan ukuran jantung, tekanan darah, volume aliran, dan kemampuan kontraksi terhadap anestesi jangka panjang
2
TINJAUAN PUSTAKA
Anestesi umum
Anestesi berasal dari bahasa yunani yang berarti “tanpa perasaan” atau
“tidak sensitif” yang dapat diartikan menjadi “kehilangan sensasi” (Hitner dan Nagle 1999). Permasalahan utama yang berhubungan dengan pembedahan telah diselesaikan pada pertengahan abad ke Sembilan belas. Penyelesaian tersebut dengan memberikan kehilangan sensasi atau lebih spesifiknya kehilangan sensitifitas terhadap rasa sakit. Anestesi umum menyebabkan penekanan aktivitas sistem saraf pusat (SSP) (Xie et al. 2013). Saat ini anestesi telah digunakan dalam praktik kedokteran hewan sehari-hari sebagai sedasi, tranquilizer, immobilisasi, relaksasi otot, ketidaksadaran, mengontrol rasa sakit yang digunakan pada proses pembedahan, pemeriksaan dan penanganan gigi, grooming, diagnostic imaging, perawatan luka, penangkapan atau pemindahan satwa liar (Thomas dan Lerche, 2011). Anestesi umum diawali dengan induksi dari agen anestesi tertentu yang bersifat sementara yang menyebabkan ketidaksadaran, amnesia, analgesia, dan akinesia (hilangnya mobilisasi) (Brown et al. 2010).
Rute pemberian agen anestesi umum dapat melalui inhalasi ataupun parenteral. Tingkatan penekanan pada sistem saraf pusat sangat tergantung pada konsentrasi agen pada otak. Penekanan SSP berhubungan dengan kandungan fisik dari tiap agen (Hitner dan Nagle 1999), serta kondisi hewan seperti usia, aktifitas metabolisme, dan temperatur tubuh (Thomas dan Lerche 2011).
Tahap-tahap Anastesi Umum
Tahapan anestesi dibagi menjadi empat berdasarkan tanda-tanda yang diperlihatkan oleh pasien. Tanda-tanda tersebut disebabkan oleh tingkat penekanan otak yang diinduksi oleh anestesi. Muir (2007) menyatakan ada batas yang jelas antara tahap-tahap tersebut.
Tahap 1 dikenal juga sebagai tahap voluntary movement (dapat bergerak) dan dimulai dari awal pemberian hingga kehilangan kesadaran. Beberapa analgesik dapat mencapai fase yang lebih dalam dari tahap ini. Pada tahap ini korteks cerebral secara umum dihambat (Hitner dan Nagle 1999). Efek yang ditimbulkan pada tahap ini sangat bervariasi. Variasi yang ditimbulkan bisa disebabkan oleh jenis anestesi yang digunakan, sifat dan kondisi pasien, cara hewan direstrain, dan kecepatan induksi. Ketakutan hewan dapat timbul pada saat direstrain. Rasa takut pasien dapat menyebabkan pengurangan efek anestesi. Hewan yang ketakutan akan mengalami nafas yang dalam dan singkat. Pelepasan epineprin menyebabkan denyut jantung menguat dan mengencang, dan dilatasi pupil. Salivasi dapat muncul pada beberapa hewan, yang dapat juga disertai dengan urinasi dan defekasi. Ketika akan mencapai tahap kedua, hewan akan menjadi ataksia, kehilangan kemampuan untuk berdiri dan mengambil posisi
lateral recumbency.
4
normal (Hitner dan Nagle 1999). Sistem saraf pusat (SSP) tertekan, pasien kehilangan seluruh kemampuan bergerak. Efek penekanan SSP yaitu reflek meningkat dan berlebihan. Beberapa reaksi yang sering terlihat yaitu nafas dalam,
tachypnea, dan hiperventilasi. Pelepasan katekolamin yang berlanjut menyebabkan frekuensi denyut jantung semakin cepat dan kuat, aritmia jantung dapat terjadi, dan pupil sangat berdilatasi. Refleks palpebra dan bulu mata tampak jelas. Pada kucing ataupun anjing dapat terjadi muntah.
Tahap 3 disebut juga sebagai tahap anestesi pembedahan dan ditandai dengan hewan tidak sadar, disertai dengan penekanan refleks. Pada tahap ini otot berelaksasi, pernafasan melambat dan menjadi teratur. Reflek muntah dan menelan telah menghilang pada tahap ini. Tahap ini dibagi menjadi tiga taraf.
Taraf 1 dibagi menjadi 3 fase, yaitu: teranastesi ringan, sedang, dan dalam. Anestesi ringan bertahan hingga pergerakan bola mata berhenti. Anestesi sedang ditandai dengan paralisis interkostal, dan anastesi dalam ditandai oleh pernafasan diafragma. Taraf 2 berupa ketidaksadaran atau anestesi menengah yang ditandai dengan jumlah pulsus dan pernafasan yang stabil, menghilangnya refleks laring, reflex kornea yang kuat, dan relaksasi otot serta analgesik bagi kebanyakkan prosedur pembedahan. Taraf 3 berupa anestesi pembedahan yang mendalam yang digambarkan dengan penurunan fungsi otot interkostae dan volume tidal, jumlah respirasi meningkat, relaksasi otot yang mendalam, pernafasan diapragma, refleks kornea lemah, pupil dilatasi dan berada ditengah. Jika pendepresan SSP berlanjut, maka akan masuk ketahap selanjutnya.
Tahap 4. Pada tahap ini Sistem saraf pusat sangat tertekan dan pernafasan terhenti. Jantung hanya dapat berdenyut singkat. Tekanan darah berada dalam level shock, pengisian kapiler pada membran mukosa diperlambat, dan pupil sangat berdilatasi. Sphincter anal dan perkencingan mengalami relaksasi. Kematian akan terjadi beberapa saat kemudian. Jika anestesi diambil dan alat bantu pernafasan dipasang sebelum colaps myocardial, maka tahap ini dapat diatasi dan pasien akan kembali ke tahap 3.
Propofol
Propofol merupakan 2,6-diisopropylphenol yang sering digunakan sebagai agen anestesi. Sediaan propofol berbentuk emulsi dikarenakan propofol memiliki sedikit sifat kelarutan air (Thomas dan Lerche 2011). Sifat propofol sangat lipofilik dan terdistribusi ke seluruh tubuh termasuk pada otak dan sel darah merah (Riu et al. 2000). Propofol sering kali digunakan manusia (Koch et al. 2008) dan juga hewan seperti anjing (Mannarino et al. 2012), kuda (Umar et al. 2008), dan Kelinci (Jiang et al. 2012). Pada manusia propofol telah banyak digunakan sebagai sedasi pada kasus yang menggunakan endoskopi (Walker et al. 2003).
5
propofol menyebabkan hipoksia pada beberapa hewan eksperimen (Akada et al. 2007). Pada kelinci, propofol dengan dosis 16±5 mg/kg bb dapat menginduksi anestesi tanpa menyebabkan apnoea (Allweiler et al. 2010). Propofol
dimetabolisme pada hati dan dieliminasi melalui ginjal, sehingga pemberian
propofol dosis tinggi dapat menyebabkan disfungsi hati, dan peningkatan keratinin kinase (Jiang et al. 2012).
Mekanisme kerja propofol belum diketahui secara pasti hingga saat ini. Secara umum propofol bekerja pada reseptor Gammaamino butyric acid (GABA) dengan cara yang sama seperti barbiturat (Thomas dan Lerche 2011) dengan menghambat neurotransmitter GABA, serta meningkatkan inhibitory synaptic function dengan meningkatkan kinerja chloride channel pada reseptor GABA (Branson 2007, Fish 1997), dan/atau menunda penutupan calcium channel (Nakae
et al. 2000). Gamma amino butyric acidA (GABAA) merupakan asam amino yang
berfungsi untuk menghambat sistem saraf pusat (SSP) dan sistem saraf perifer. Asam amino GABA banyak terdapat pada otak, korda spinalis, dan sedikit pada jaringan saraf perifer, hati, spleen dan jantung (Crowel-Davis dan Murray 2006). Selain itu, propofol juga telah dilaporkan bekerja dengan menghambat reseptor N-methyl-D-aspartate (NMDA) (Irifune et al. 2003).
Isoflurane
Isoflurane merupakan anestesi inhalasi yang sering digunakan pada berbagai pembedahan. Isoflurane tidak berwarna dan berbentuk cairan. Sediaan
isoflurane bersifat stabil pada temperatur ruangan, sehingga tidak membutuhkan penanganan khusus (Thomas dan Lerche 2011). Keuntungan dari isoflurane
adalah memiliki kelarutan darah yang rendah, sehingga induksi serta recovery cepat terjadi, transformasi minimal di hati, dan viscerotoxicity yang rendah (Lipman et al. 1997, Thomas dan Lerche 2011). Mekanisme kerja isoflurane
adalah mempengaruhi aliran Ca2+ pada sejumlah sel dan meningkatkan aktivitas saraf simpatik (Takakura et al. 1998). Pada penggunaannya isoflurane
menyebabkan takikardi atau peningkatan frekuensi denyut jantung (Marano et al. 1996), peningkatan tekanan darah arteri (Takakura et al. 1998), dan kebutuhan oksigen meningkat (Aksenov et al. 2012).
Cairan isoflurane dievaporasi menjadi gas dengan menggunakan mesin anestesi dan dialirkan ke hewan dengan menggunakan masker/endotracheal tube. Gas isoflurane akan mengalir ke paru-paru, berdifusi ke sel-sel alveoli dan memasuki aliran darah. Area kaya kapiler pada alveoli paru-paru dapat menyerap dan menimbulkan efek yang cepat dari agen anestesi yang diberikan (Allen et al. 2011). Kecepatan difusi dipengaruhi oleh perbedaan konsentrasi isoflurane pada alveoli dan pembuluh darah. Sifat kelarutan lemak yang lebih rendah dibanding anestesi lainnya menyebabkan konsentrasi isoflurane yang tersimpan dalam lemak lebih kecil dibanding anestesi dengan kelarutan yang lebih tinggi (Thomas dan Lerche 2011). Isoflurane akan diekskresikan melalui paru-paru (Hitner dan Nagle 1999).
6
2012, Ogawa et al. 2011). Efek isoflurane pada GABA adalah menurunkan aksi potensial evoked inhibitory postsynaptic currents (eIPSCs), meningkatkan
miniature inhibitory postsynaptic currents (mIPSCs) dan failure rate (Rf) (Kotani dan Akaike 2013, Ogawa et al. 2011). Penghambatan pada pengambilan GABA oleh anestesi voletil akan meningkatkan GABA pada ekstraseluler, yang dapat memperpanjang aktivitas reseptor GABA ekstrasinaptik (Kotani dan Akaike 2013).
Isoflurane telah dilaporkan tidak hanya meningkatkan aktivitas reseptor GABA namun juga menghambat NMDA (Shelton dan Nicholson 2010). Penghambatan pada reseptor NMDA lebih rendah dibandingkan penghambatan pada reseptor GABA (Brosnan 2011). Peningkatan isoflurane pada reseptor GABA dan penghambatan reseptor NMDA menyebabkan penurunan rangsangan pada SSP (Crowell-Davis dan Murray 2006).
Tekanan darah
Metode pengukuran tekanan darah arteri terbagi menjadi dua kategori, yaitu: metode langsung (invasive) dan tidak langsung (non-invasive). Metode langsung merupakan metode yang menggunakan sistem implan yang secara langsung berhubungan dengan sistem arteri. Metode tidak langsung merupakan metode pengukuran tekanan darah arteri yang relative lebih mudah digunakan. Metode oksimetriinvasif merupakan salah satu metode dengan tingkat keakuratan tinggi. Selain metode oksimetri, menurut Harvey et al. (2012) menyatakan bahwa
Doppler arterial blood pressure juga merupakan metode yang dapat digunakan dalam pengukuran tekanan darah pada kelinci. Pengukuran tekanan darah dapat dilakukan pada beberapa arteri, yaitu: arteri auricularis centralis, arteri pada area kaki depan dan kaki belakang (Ypsilantis et al. 2005).
Ekhokardiografi
Ultrasound sering kali diaplikasikan pada dunia medis, baik pada bidang penelitian, pendidikan, maupun klinis. Ultrasound dapat menghasilkan gambaran kualitas kerja jantung dengan B-mode, ketebalan jaringan dengan M-mode, real time pada pemeriksaan frekuensi denyut jantung, dan gambaran aliran darah melalui fungsi Doppler (Fuentes 2008; Foster dan Theodoropoulos 2011).
Penilaian Ekhokardiografi
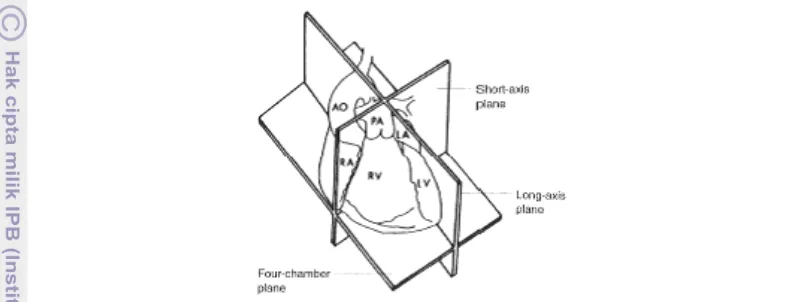
7 Pengukuran ketebalan jantung sering kali menggunakan posisi pengambilan gambar right parasternal view (RPS). Posisi RPS merupakan posisi yang sering digunakan untuk mengamati dimensi jantung bagian kiri. Pencitraan dimensi jantung didapat berdasarkan arah gelombang suara yang dikeluarkan oleh tranduser. Arah gelombang suara dapat dibedakan menjadi dua, yaitu memendek (short axis) dan memanjang (long axis) (Gambar 1) (Brown dan Gaillot 2008, Noviana et al. 2011).
Perhitungan Kuantitas
Menurut Brown dan Gaillot (2008), beberapa perhitungan matematika telah ditemukan untuk memperkirakan volume ventrikel. Perhitungan tersebut sangat penting dalam mendukung diagnosa dan prognosis kardiovaskular.
Ejection fraction (EF) adalah perhitungan indeks rasio volume ventrikel. Persamaannya adalah (EDV-ESV)/EDV, dimana EDV (end diastole volume) dan ESV (end systole volume) adalah volume akhir diastol dan volume akhir sistol, berturutan. Analogi dengan satu dimensi EF adalah fractional shortening (FS). Persamaan FS adalah (LVIDd-LVIDs)/LVIDd. LVIDd (left ventricular internal dimension diastole) adalah jarak antar dinding ventrikel kiri saat diastol, sementara LVIDs (left ventricular internal dimension systole) adalah jarak antar dinding ventrikel kiri saat sistol. Penetepan LVIDd dan LVIDs biasanya berdasarkan pengukuran M-mode pada posisi short axis. Volume setiap denyut ventrikel kiri (stroke volume/SV) dapat diukur dari perbedaan antara volume diastol dan sistol (EDV-ESV). Cardiac output (CO) atau volume yang dikeluarkan jantung permenit dapat dihitung melalui persamaan SV dikalikan dengan frekuensi denyut jantung (heart rate/HR).
Kelinci
Pada awalnya kelinci diklasifikasikan sebagai rodensia, namun dua pasang gigi seri pada rahang atas dan tidak adanya gigi taring menyebabkan kelinci diklasifikasikan pada famili Leoridae, ordo Lagomorpha, genus Oryctolagus, dan
Gambar 1. Potongan memanjang (long axis) dan memendek (short axis) pada jantung, AO:
aorta, PA: pulmonary artery, RA: right atria, RV: right ventricle, LA: left atria,
8
secara umum dikenal dengan lagomorphs. Nama ilmiah bagi kelinci domestik adalah Oryctolagus cuniculus (Hrapkiewizk dan Leticia 2007).
Kelinci sering kali digunakan pada penelitian. Hal tersebut dikarenakan ukuran, kemudahan dalam penanganan, dan relatif mudah dalam pengoleksian darah (Hrapkiewizk dan Leticia 2007). Hingga saat ini telah banyak penelitian yang dilakukan dengan menggunakan kelinci, beberapa diantaranya merupakan penelitian yang bertujuan mengetahui dosis, efek serta rute pemberian suatu agen anestesi (Gusak at al. 2012), efek vitamin terhadap parameter fisiologi setelah pemberian agen anestesi tertentu (Egwu et al. 2011), serta perbandingan antara penggunaan anestesi pada pemberian berulang (Felzemburgh et al. 2012). Sebaiknya kelinci tidak dipuasakan sebelum dianestesi, karena kelinci tidak dapat muntah. Puasa dibutuhkan saat akan dilakukan penelitian pada bagian pencernaan (Flecknell 2011).
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Januari-Maret 2013 di Bagian Bedah dan Radiologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan (FKH), Institut Pertanian Bogor (IPB).
Hewan Coba
Penelitian ini telah disetujui oleh komisi etik hewan IPB dengan nomor ACUC 02_2012 IPB. Hewan coba yang digunakan dalam penelitian adalah 5 ekor kelinci domestik jantan, berusia 1-1,5 tahun, dengan berat badan 2,02±0,15kg. Selama penelitian dilakukan, kelinci dipelihara pada kandang individu di kandang kelinci pada unit pemeliharaan hewan laboratorium Fakultas Kedokteran Hewan IPB.
Metode Penelitian
Tahap aklimatisasi
Penanganan awal kelinci yang akan digunakan selama penelitian yaitu aklimasi dengan menggunakan antibiotik enrofloksasin 5 mg/kg berat badan (BB) secara intra muscular (IM) 2x sehari selama 3 hari, ivermectine 0,3 mg/kg BB secara sub cutan (SC) sebagai antiektoparasit, dan mebendazole 50 mg/kg BB secara per oral (PO) sebagai antiendoparasit. Seminggu setelah aklimatisasi dilakukan, setiap kelinci dilakukan pemeriksaan klinis dan darah lengkap. Kelinci yang digunakan adalah kelinci yang dinyatakan sehat dari rangkaian pemeriksaan tersebut.
Tahap persiapan
Sebelum penelitian dilakukan hewan dicukur pada bagian right thorax, dan telinga, secara berurutan untuk pemeriksaan ekhokardiografi, pemasangan pulse oxymetri. Pada hari-H semua kelinci kembali dilakukan pemeriksaan klinis yang meliputi pemeriksaan temperatur dengan mengukur temperatur rektal menggunakan termometer digital, menghitung frekuensi denyut jantung dengan auskultasi jantung, menghitung respirasi dengan mengamati gerakan pernafasan pada bagian dada dan perut.
Tahap pembiusan
10
isoflurane dengan konsentrasi 1-3% dialirkan bersama dengan oksigen murni melalui sistem semi tertutup dengan menggunakan masker. Selama proses anestesi berlangsung, ikatan oksigen saturasi dipertahankan tidak kurang dari 95%.
Pemeriksaan klinis
Selama penelitian dilakukan pemeriksaan terhadap kelinci. Pengamatan meliputi pengamatan temperatur, frekuensi denyut jantung secara auskultasi, dan pemeriksaan frekuensi respirasi setiap menit. Pemeriksaan temperatur dilakukan secara per rektal dengan menggunakan termometer digital tipe harmed®, pemeriksaan frekuensi denyut jantung dilakukan menggunakan stetoskop ABN® dengan tipe majestic, sementara pemeriksaan frekuensi respirasi dilakukan dengan menghitung pergerakan thoraks-abdomen. Pemeriksaan dilakukan sebelum hewan diinduksi hingga pembiusan berakhir. Pemeriksaan dilakukan setiap 15 menit.
Pengambilan data tekanan darah
Tekanan darah diukur dengan menggunakan metode non-invasive yang sering digunakan oleh beberapa dokter hewan. Pengukuran menggunakan metode
Doppler dengan cuff vet fickemeyer yang ditempatkan pada permukaan kulit mengitari arteri brachialis. Doppler flow detection (model 811-B, Barks Medical Electronics, Inc., Aloha, or USA) menggunakan gelombang ultrasonik digunakan untuk mengamati aliran arteri tersebut. Probe diletakkan pada permukaan kulit yang telah dicukur dan telah diolesi gel USG. Pengambilan data dilakukan pada waktu induksi dan dilanjutkan setiap dua jam setelah pemasangan infus. Proses ini dilakukan sebanyak tiga kali setiap kali pengambilan data.
Pemeriksaan ekhokardiografi
Pemeriksaan ekhokardiografi dilanjutkan setelah hasil pemeriksaan klinis berada dalam kisaran normal yang kemudian akan disesuaikan dengan hasil pemeriksaan darah lengkap. Pada pemeriksaan ekhokardiografi hewan ditidurkan pada tempat berbaring khusus dengan posisi rebah kanan/right parasternal (RPS), dengan posisi tranduser short axis views. Mesin ultrasonografi yang digunakan selama penelitian adalah Sonodop S-6 X (PT Karindo Alkestron, Indonesia)
11 dengan tranduser yang digunakan pada penelitian adalah tranduser linear S/N: 1101027 dengan frekuensi 3,5-10 MHz.
Tranduser diposisikan setelah detak jantung terpalpasi antara intercostae 4-6. Posisi tranduser SA dilakukan untuk mendapatkan pencitraan B-mode, M-mode
untuk pengukuran frekuensi denyut jantung, left ventricular internal dimension diastole (LVIDd), left ventricular internal dimension systole (LVIDs), left ventricular free wall diastole (LVWd), left ventricular free wall systole (LVWs),
interventricular septum diastole (IVSd), interventricular septum systole (IVSs),
fractional shortening (FS), cardiac output (CO) dan stroke volume (SV).
Frekuensi denyut jantung dihitung dengan cara mengukur antara dua gelombang R pada tampilan elektrokardiografi pada layar monitor.
Interventricular septum diastole (IVDSd) dihitung dengan mengukur jarak
interventricular septum pada saat akhir diastol sedangkan interventricular septum systole (IVDSs) dihitung dengan cara mengukur jarak interventricular septum saat akhir sistol. Penghitungan LVIDd dilakukan pada saat akhir diastol sementara LVIDs diukur pada saat sistol. Left ventricular free wall (LVW) dihitung dengan mengukur dinding ventrikel kiri pada saat akhir diastol dan sistol. Data HR, CO, SV, EF dan FS diketahui melalui hasil penghitungan data pada mesin USG.
Pengamatan parameter di atas dilakukan tiga kali pengulangan dan data tersimpan pada komputer mesin USG. Pemeriksaan ekhokardiografi dilakukan pada waktu induksi dan dilanjutkan setelah isoflurane dialirkan setiap 2 jam hingga jam ke-12.
Analisis Data
Data yang diperoleh akan disajikan sebagai rataan±standar deviasi dalam deskriptif naratif secara kualitatif , sedangkan data kuantitatif diuji secara statistik dengan menggunakan penghitungan anova one way. Data dianalisis menggunakan piranti lunak SPSS for windows®dan Microsoft Excel®.
Tabel 1 Diagram alir penelitian kombinasi propofol dan isoflurane
No Kegiatan P I Jam ke-
0 1 2 3 4 5 6 7 8 9 10 11 12 1 Penimbangan √
2 Pemeriksaan klinis √ √ √ √ √ √ √ √ √ √ √ √ √ √ √
3 Induksi awal √
4 Saturasi oksigen √ √ √ √ √ √ √ √ √ √ √ √ √
5 Pemasangan infus √
6 Tekanan darah √ √ √ √ √ √ √
7 Ekhokardiografi √ √ √ √ √ √ √
4
HASIL DAN PEMBAHASAN
Pemeriksaan Darah
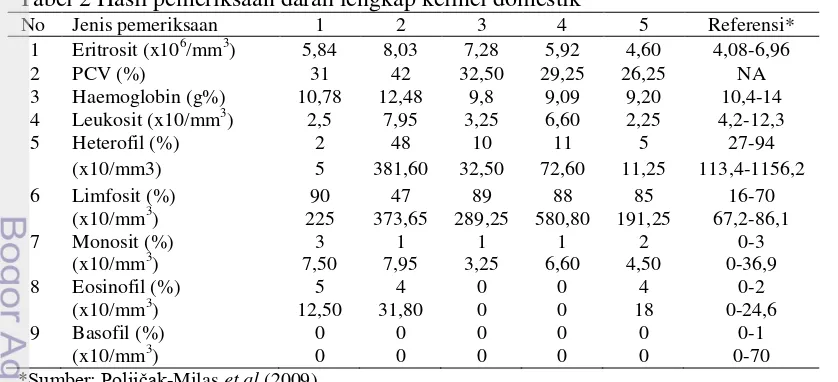
Pengambilan darah dilakukan pada v. auricularis marginalis. Pada sampel darah kelinci tersebut dilakukan pemeriksaan darah lengkap (Tabel 2). Pemeriksaan darah lengkap dilakukan seminggu setelah aklimatisasi dilakukan. Dari hasil pemeriksaan darah dapat diketahui bahwa beberapa kelinci mengalami polisitemia dan anemia ringan. Polisitemia atau peningkatan jumlah eritrosit dapat disebabkan oleh dehidrasi ringan (Cotter 2001). Dehidrasi menyebabkan penurunan plasma darah, sehingga terjadi hemokonsentrasi (Stockham dan Scott 2002). Dehidrasi dapat disebabkan oleh penurunan intensitas minum dari tiap kelinci yang disebabkan oleh stres lingkungan. Selain itu polisitemia juga dapat terjadi akibat stres pada saat pengambilan darah. Pada saat stres, kelinci akan melepaskan epinephrine (Cunninghum dan Klein 2007). Epinephrine akan meningkatkan kontraksi otot polos limpa, sehingga limpa akan melepaskan sejumlah sel darah ke pembuluh darah perifer (Stockham dan Scott 2002).
Hasil pemeriksaan darah juga menunjukkan jumlah leukosit berada dibawah kisaran referensi. Penurunan leukosit disebabkan oleh penurunan heterofil. Pada pemeriksaan darah juga diketahui adanya limfositosis dan eosinofilia pada beberapa hewan. Limfositosis dan eosinofilia dapat disebabkan oleh stres akut pada saat pengambilan darah yang disebabkan oleh peningkatan adrenalin (Suckow et al. 2012).
Tabel 2 Hasil pemeriksaan darah lengkap kelinci domestik
No Jenis pemeriksaan 1 2 3 4 5 Referensi*
1 Eritrosit (x106/mm3) 5,84 8,03 7,28 5,92 4,60 4,08-6,96
2 PCV (%) 31 42 32,50 29,25 26,25 NA
3 Haemoglobin (g%) 10,78 12,48 9,8 9,09 9,20 10,4-14 4 Leukosit (x10/mm3) 2,5 7,95 3,25 6,60 2,25 4,2-12,3
5 Heterofil (%) 2 48 10 11 5 27-94
(x10/mm3) 5 381,60 32,50 72,60 11,25 113,4-1156,2
6 Limfosit (%) 90 47 89 88 85 16-70
(x10/mm3) 225 373,65 289,25 580,80 191,25 67,2-86,1
7 Monosit (%) 3 1 1 1 2 0-3
(x10/mm3) 7,50 7,95 3,25 6,60 4,50 0-36,9
8 Eosinofil (%) 5 4 0 0 4 0-2
(x10/mm3) 12,50 31,80 0 0 18 0-24,6
9 Basofil (%) 0 0 0 0 0 0-1
(x10/mm3) 0 0 0 0 0 0-70
14
Pemeriksaan Klinis sebelum Penelitian
Tujuan dari pemeriksaan ini adalah mengetahui kondisi awal kelinci yang akan digunakan. Kelinci yang digunakan pada penelitian ini memiliki berat badan 2,02±0,15kg. Hasil pemeriksaan temperatur, frekuensi denyut jantung, dan respirasi secara berurutan adalah 39,26±0,47oC, 206±20 kali/menit, dan 188±20 kali/menit. Robertshaw (2004) dan Detweiler dan Ericson (2004) menunjukkan hasil pemeriksaan temperatur dan frekuensi denyut jantung pada kelinci coba masih dalam kisaran normal yaitu 38,6-40,1oC dan 180-350 kali/menit, sementara hasil pemeriksaan frekuensi respirasi menunjukkan peningkatan yaitu diatas 30-60 kali/menit (Taylor et al. 2010).
Berdasarkan referensi diketahui bahwa temperatur dan frekuensi denyut jantung berada dalam kisaran normal, namun frekuensi respirasi mengalami peningkatan. Peningkatan pada frekuensi respirasi dikenal juga dengan tachypnea. Tachypnea dapat disebabkan oleh faktor fisiologi seperti stres ataupun exercise
yang berlebihan pada saat pengambilan hewan coba (Boudarene et al. 2002).
Tachypnea mengindikasikan peningkatan kebutuhan oksigen tubuh sehingga mengaktifkan saraf vagus (Yu et al. 2001). Walaupun pada penelitian ini frekuensi denyut jantung masih berada dalam kisaran normal namun peningkatan frekuensi respirasi akan diimbangi dengan peningkatan frekuensi denyut jantung dan CO (Hjortdal et al. 2003). Peningkatan frekuensi denyut jantung dan CO dapat disebabkan oleh peningkatan kinerja saraf vagus (Kobayashi et al. 2006) serta usaha tubuh untuk memenuhi kebutuhan oksigen tubuh (Cunningham dan Klein 2007).
Pada saat hewan stres, medulla adrenalis akan melepaskan epinephrine (E) dan norepinephrine (NE). Pada kondisi stres, ikatan epinephrine dan
norepinephrine pada β-adrenergik yang menyebabkan vasodilasi akan mengalahkan efek ikatan epinephrine dan norepinephrine pada α-adrenergik. Pelepasan epinephrine dan norepinephrine akan menyebabkan dilatasi arteriol pada sistem koronari dan otot skeletal serta dilatasi bronkus, sehingga aliran darah ke jantung dan otot akan meningkat (Cunninghum dan Klein 2007, Grimm dan Wagner 2007). Peningkatan aliran darah akan meningkatkan aliran oksigen (Terakawa et al. 2009). Hewan akan berusaha bernafas sesering mungkin agar dapat memenuhi kebutuhan oksigen (Cunningham dan Klein 2007).
Pengamatan Klinis selama Penelitian
Pemeriksaan temperatur dilakukan setiap 15 menit selama penelitian berlangsung. Nilai temperatur berada pada kisaran normal pada 30 menit pertama, yaitu pada menit ke 0, ke-15, dan ke-30 yang secara berurutan adalah 39,02; 38,76, dan 38,34oC. Setelah menit ke-30 temperatur mengalami penurunan dengan cepat hingga menit ke 135 dan relatif stabil hingga jam ke-12. Salah satu efek propofol
merupakan merelaksasi otot (Thomas dan Lerche 2011), sehingga mengurangi panas tubuh. Kombinasi propofol dan isoflurane juga menghambat respon pengaturan temperatur tubuh (Carerro dan Fàbregas 2012) dengan mengaktifkan
reseptor α-adrenergik perifer (Bandschapp dan Laizzo 2011, Branson 2007).
15 menghambat aliran darah (Cunningham dan Klein 2007). Kinerja isoflurane
terhadap pengaturan temperatur sesuai dengan dosis yang diberikan. Semakin meningkat dosis yang diberikan maka pengaturan temperatur juga akan semakin terhambat (Imamura et al. 2003).
Temperatur terendah pada saat penelitian terdapat pada menit ke-330 yaitu 36,40oC sehingga dapat dikategorikan sebagai hipotermi tingkat ringan. Penurunan temperatur menunjukkan perbedaan nyata (P < 0,05). Pada saat terjadi hipotermi, vasokontriksi pada pembuluh darah perifer akan menghambat aliran darah yang dapat meningkatkan temperatur permukaan tubuh (Branson 2007). Selama penelitian berlangsung, kelinci menggigil pada jam-jam tertentu. Imamura
et al (2003) menyatakan bahwa isoflurane menyebabkan kelinci menggigil pada hipotermi ringan. Respon menggigil merupakan salah usaha tubuh untuk meningkatkan temperatur tubuh (Branson 2007, Cunningham dan Klein 2007) yang dipengaruhi oleh saraf otonom (Buggy dan Crossley 2000).
Temperatur tubuh tidak sama pada tiap bagiannya, permukaan kulit merupakan bagian tubuh yang sering kali mengalami perubahan temperatur (Sessler 2008). Hal ini disebabkan pada kulit terdapat thermoreseptor yang sangat sensitif terhadap perubahan temperatur lingkungan atau obyek yang menempel pada kulit (Akers dan Denbbow 2008). Proses menghilangnya temperatur tubuh dapat melalui proses radiasi, konveksi, evaporasi, dan konduksi (Carero dan Fàbregas 2012). Penurunan temperatur pada kulit akan meningkatkan termosensitiviti hipotalamus. Hipotalamus akan merangsang peningkatan temperatur lokal (Stitt 1976), dengan mendilatasi prekapiler sehingga meningkatkan aliran darah perifer. Namun demikian kebanyakan pembuluh darah berkontraksi pada daerah yang mengalami hipotermi (Carero dan Fàbregas 2012).
Efek yang dapat ditimbulkan dari hipotermi tingkat ringan adalah sedikit peningkatan kontraksi miokardial, peningkatan tekanan darah, penurunan CO, serta peningkatan frekuensi denyut jantung yang disebabkan oleh peningkatan preload (Moore et al. 2011).
Pemeriksaan klinis lainnya adalah penghitungan rata-rata frekuensi respirasi permenit, yang juga dilakukan setiap 15 menit selama penelitian berlangsung. Rata-rata frekuensi respirasi yang diperoleh diawali dengan berada pada kisaran normal (45 kali/menit) yang semakin lama semakin meningkat hingga mencapai batas atas nilai normal yaitu 61 kali/menit dan mengalami sedikit penurunan hingga 56 kali/menit menit terakhir. Nilai maksimal dan minimal frekuensi respirasi secara statistik tidak berbeda nyata (P > 0,05) dan
16
masih berada dalam kisaran normal frekuensi respirasi kelinci (Taylor et al. 2010). Peningkatan frekuensi respirasi yang perlahan mengindikasikan bahwa semakin lama tubuh kekurangan oksigen yang kemudian diimbangi dengan penarikan oksigen yang lebih sering (Cunningham dan Klein 2007).
Penggunaan propofol pada kelinci yang dikombinasikan dengan anestesi volatil menyebabkan penekanan terhadap sistem respirasi (Chang et al. 2009). Selama penelitian kadar oksigen saturasi diatur dengan nilai minimal 95%, namun pada beberapa hewan menunjukkan gejala dyspnoe yang ditandai dengan respirasi yang dalam dan berat pada jam-jam tertentu. Menurut Takemura et al (2005)
isoflurane dapat menyebabkan penyempitan arteri pulmonalis, sehingga dapat menghambat aliran darah paru-paru. Selain itu, aktivitas saraf phrenic merupakan indikator yang baik untuk mengontrol sistem pernafasan (Marinov et al. 2011). Saraf phrenic mengontrol pernafasan dengan mengontrol kontraksi otot diafragma (Frazier dan Revelette 1991). Isoflurane telah diketahui meningkatkan amplitudo saraf phrenic, sehingga meningkatkan frekuensi respirasi (Lazarenko et al. 2010). Respirasi yang dalam dan berat menyebabkan posisi jantung turut bergetar, sehingga pengambilan gambar ekho menjadi lebih sulit.
18
Data ditampilkan secara kuantitatif dalam Mean ± SD terhadap menit pengamatan; abcde Huruf berbeda menunjukkan adanya perbedaan (P < 0,05).
19 Tekanan Darah Sistol
Tekanan darah sistol merupakan tekanan darah maksimum yang terjadi saat ventrikel kiri berkontraksi (Cunningham dan Klein 2007). Pada pengamatan tekanan darah selama periode maintenance hingga jam ke-12 diketahui nilai terendah pada jam ke-0 yaitu 75,87±16,91 mmHg, sementara nilai tertinggi didapat pada jam ke-12 yaitu 101,2±31,69 mmHg. Kisaran tekanan darah sistol pada kelinci adalah 90-130 mmHg (Gillett 1994), sehingga hasil penelitian sedikit mengalami penurunan tekanan darah. Penurunan tekanan darah selama penelitian mengalami perbedaan nyata (P < 0,05).
Propofol dan isoflurane menyebabkan penurunan tekanan darah sistol (Marano et al. 1996, Plumb 2005, Cruz et al. 2010) yang dipengaruhi oleh dosis dan lama pemberian (Ma et al. 1999). Propofol menyebabkan penurunan tekanan darah sistol yang disebabkan oleh peningkatan saraf simpatis perifer yaitu pada 2-adrenoreseptor (Chang et al. β010). Pengaktifan -adrenoseptor perifer akan menyebabkan vasodilatasi arteri dan vena, selain itu penurunan temperatur dan penurunan CO (Branson 2007) akan menyebabkan penurunan tekanan darah sistol.
Isoflurane menurunkan resistensi sistemik pembuluh darah dengan menghambat kontraksi miokardium (Izumi et al. 2001). Pada jam-jam terakhir terjadi sedikit peningkatan tekanan darah dan meningkatkan secara signifikan pada jam ke-12. Peningkatan terjadi akibat efek negatif dari penurunan temperatur tubuh serta anestesi propofol dan isoflurane yang meningkatkan konsentrasi norephinephrine
(Izumi et al. 2001, Mustafa dan Thulesius 2002). Peningkatan NE mengaktifkan
α2-adrenoreseptor sehingga akan menyebabkan vasokontriksi perifer, peningkatan tekanan darah, dan peningkatan frekuensi denyut jantung (Rang et al. 1995, Mustafa dan Thulesius 2002).
20
Pengamatan Ketebalan Dinding
Pengukuran dimensi otot jantung dilakukan dengan menggunakan ekhokardiografi dengan posisi right parasternal (RPS). Posisi RPS yang biasa digunakan untuk mengamati dan mengukur ketebalan dinding jantung bagian kiri
(Pennick dan d’Anjou β00Ř). Ekhogram yang didapat tergantung pada arah gelombang ekho dan waktu pengambilan data (Noviana et al. 2012). Ekhogram yang didapat pada penelitian adalah ekhogram dengan menggunakan B-mode
untuk mengamati bentuk dan pergerakan jantung secara langsung, dan M-mode
untuk mengetahui ketebalan jaringan dengan menggunakan satu gelombang ekho (Gambar 6) (Fuentes 2008).
Pada ekhogram B-mode (Gambar 6A), bagian jantung digambarkan dengan berbagai tingkatan ekhogenitas. Bentuk serta tingkatan ekhogenitas jantung kelinci sesuai dengan penelitian sebelumnya yang dilakukan yaitu pada anjing dan kuncing (Noviana et al. 2011, Noviana dan Kurniawan 2013). Dinding ventrikel kiri dan septa interventrikular digambarkan dengan warna abu-abu karena tersusun dari jaringan otot, dimensi ruang ventrikel kiri berwarna hitam karena tersusun dari cairan. Perbedaan tampilan pada tiap bagian disebabkan oleh perbedaan ekhogenitas yang dipengaruhi oleh derajat atau intensitas ekho yang kembali menuju tranduser berdasarkan struktur jaringan. Semakin tinggi tingkat ekhogenitas maka semakin tinggi pula gelombang yang dipantulkan (Noviana et al. 2012). Acoustic enhancement juga nampak pada gambaran B-mode. Artefak ini biasa muncul pada bagian distal dari jaringan yang meneruskan gelombang tanpa adanya pemantulan seperti pada jaringan yang terdiri dari cairan (Sites et al. 2007).
Pengukuran struktur jantung dilakukan melalui M-mode (Gambar 6.B). Hal ini disebabkan B-mode hanya dapat digunakan untuk melihat bentuk, pergerakan otot serta katup jantung namun tidak akurat dalam pengukuran struktur
jantung saat sistol dan diastol (Pennick dan d’Anjou β00Ř). Pengukuran M-mode
dilakukan pada fase induksi dan dilanjutkan setiap dua jam hingga fase
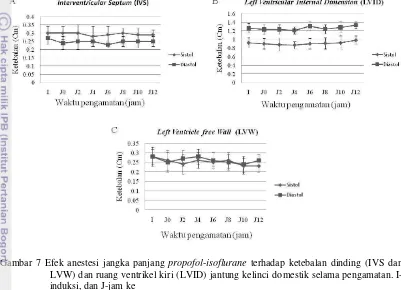
maintenance berakhir yaitu jam ke dua belas. Pada gambar 7 dapat dilihat bahwa ukuran IVS, LVID dan LVW saat sistol dan diastol relatif konstan namun berbeda nyata (P < 0,05), terkecuali IVS saat sistol.
*
Gambar 6. Pengamatan ekhokardiografi kelinci domestik terhadap struktur jantung dibawah pengaruh anestesi propofol-isoflurane. A. B-mode, B. M-mode, IVS: Interventricular
septum, LVID: Left ventricular internal dimension, LVW: Left ventricular free wall, *
21 Hasil pengamatan IVSd menunjukkan penurunan nyata sementara IVSs tidak menunjukkan penurunan nyata (P < 0,05) (Gambar 7A). Kisaran IVSd dan IVSs secara berturutan adalah 0,23±0,02 hingga 0,27±0,04 cm dan 0,28±0,06 hingga 0,3±0,05 cm. Hasil LVIDs dan LVIDd menunjukkan sedikit peningkatan yang signifikan selama penelitian (Gambar 7B). Kisaran LVIDd adalah 1,21±0,08 hingga 1,33±0,1 cm dan LVIDs adalah 0,87±0,08 hingga 0,98±0,08 cm.
Ketebalan otot dinding ventrikel kiri menunjukkan sedikit fluktuasi. Peningkatan ataupun penurunan ketebalan otot menunjukkan perbedaan nyata (P < 0,05). Kisaran LVWd adalah 0,24±0,04 hingga 0,28±0,04 cm dan LVWs adalah 0,23±0,03 hingga 0,28±0,05 cm (Gambar 7C). Ukuran jantung menunjukkan perbedaan ukuran saat sistol dan diastol, terutama pada dinding inter ventrikular dan lumen ventrikel kiri. Hal ini disebabkan pada saat sistol jantung berkontraksi sehingga otot menjadi lebih tebal dan ruang LV menjadi lebih sempit. Pada saat diastol, otot akan menipis dan lumen jantung akan semakin melebar (Kealy et al
2011). Hasil penelitian ini sesuai dengan hasil penelitian yang dilakukan oleh Stypmann et al (2007), yaitu pada IVS lebih tipis dibanding LVW pada saat sistol maupun diastol. Gambar 7 juga menunjukan ketebalan dinding ventrikel kiri memiliki ukuran yang hampir sama pada saat sistol dan diastol.
Penggunaan M-mode ekhokardiografi telah banyak digunakan untuk mengukur ketebalan dinding, ruang, serta katup pada berbagai hewan (Noviana et al. 2011, Noviana dan Kurniawan 2013, Noviana et al. 2013). Ukuran yang didapat pada penelitian ini lebih kecil dibanding dengan beberapa penelitian lain (Stypmann et al. 2007). Perbedaan ukuran tersebut dikarenakan ukuran jantung dapat dipengaruhi oleh ras dan berat badan (Muzzi et al. 2006), sehingga semakin
Gambar 7 Efek anestesi jangka panjang propofol-isoflurane terhadap ketebalan dinding (IVS dan LVW) dan ruang ventrikel kiri (LVID) jantung kelinci domestik selama pengamatan. I-induksi, dan J-jam ke
22
ringan berat kelinci coba maka akan semakin kecil ukuran jantung yang dimiliki. Namun demikian Propofol dan isoflurane mempengaruhi ukuran dimensi jantung dengan merelaksasi otot jantung (Chang et al. 2010, Izumi et al. 2001). Penurunan kontraksi jantung akan menyebabkan penurunan pada LVW dan IVS, serta peningkatan pada ukuran LVID.
Pengamatan Frekuensi Denyut Jantung
Penggunaan anestesi pada hewan coba memiliki efek yang berbeda pada morfologi dan fungsi jantung. Berdasarkan Detweiler dan Ericson (2004), frekuensi denyut jantung yang dihasilkan pada penelitian ini berada pada kisaran normal yaitu 244±18 hingga 266±24 kali/menit. Gambaran frekuensi denyut jantung yang terjadi tidak menunjukkan perbedaan nyata (P > 0.05) pada awal induksi hingga jam 4, namun mengalami peningkatan kembali hingga jam ke-12 (Gambar 8). Penurunan dan peningkatan frekuensi denyut jantung selama penilaian masih berada dalam kisaran normal.
Secara umum, hasil penelitian ini lebih tinggi dibandingkan dengan kelinci yang sadar (Stypmann et al. 2007). Perbedaan pada frekuensi denyut jantung dapat disebabkan oleh beberapa faktor. Salah satu faktor tersebut adalah anestesi yang digunakan. Propofol dan isoflurane meningkatkan frekuensi denyut jantung kelinci (Baumgarnert et al. 2008; Marano et al. 1996). Menurut McIntosh et al
(2012) peningkatkan tersebut dikarenakan aktivitas saraf simpatis ginjal meningkat akibat penggunaan propofol. Peningkatan saraf simpatis ginjal disebabkan oleh penghambatan angiotensin II (Dendofer et al. 2002) dan peningkatkan aktivitas saraf vagus (Kobayashi et al. 2006). Walaupun demikian Giuseppe et al (1996) menegaskan bahwa peningkatan frekuensi denyut jantung terjadi tanpa disertai perubahan aktivitas norephinephrine dan ephinephrine. Penurunan dan peningkatan frekuensi denyut jantung dapat dipengaruhi oleh konsentrasi isoflurane yang dialirkan.
23 Pengamatan Volume Aliran Jantung
Hasil pengukuran dimensi dengan menggunakan M-mode dapat digunakan untuk mengukur dan menghitung stroke volume (SV), dan cardiac output ventrikel kiri (CO). Stroke volume merupakan volume darah yang dipompa darah setiap denyutnya. Penghitungan stroke volume bertujuan untuk mendapatkan CO. Cardiac output didapat melalui perhitungan SV yang dikalikan dengan frekuensi denyut jantung, sehingga pola SV dan CO hampir serupa (Gambar 8) (Stypmann et al. 2007). Pada penelitian ini SV dan CO tertinggi terjadi pada jam ke-6 yaitu 1,57 ± 0,53 mL/denyut dan 0,39±0,14 L/menit untuk SV dan CO secara berturutan. Peningkatan dan penurunan SV dan CO mengalami perbedaan nyata (P < 0,05).
Semakin meningkatnya SV dan CO pada jam tersebut, mengindikasikan semakin banyak darah yang dipompa ke organ lainnya. Peningkatan SV dan CO dapat dikarenakan pada jam ke-6 lumen ventrikel kiri memiliki ukuran terlebar. Beberapa faktor yang mempengaruhi SV dan CO adalah preload, kontraksi, dan
afterload (Muzzi et al. 2006). Semakin banyak darah yang masuk (preload) dan semakin sedikit sedikit darah yang tertinggal (afterload), maka semakin tinggi pula nilai SV dan CO. Propofol dan isoflurane mempengaruhi hemodinamik dengan menurunkan preload, afterload dan kontraksi miokardium (Chang et al. 2010, Izumi et al. 2001). Penurunan preload dan afterload dapat disebabkan penghambatan α2-adrenoreseptor dan pengaktifan 2-adrenoreseptor (Chang et al. 2010, Kingery et al. 2002).
Faktor lain yang mempengaruhi CO adalah frekuensi denyut jantung. Frekuensi denyut jantung yang meningkat ataupun menurun akan mempengaruhi CO. Walaupun CO dipengaruhi oleh frekuensi denyut jantung, namun CO tidak dipengaruhi oleh dosis anestesi (Stypmann et al. 2007).
Secara umum hasil SV dan CO pada penelitian ini lebih rendah dibanding dengan kelinci sadar (Stypmann et al. 2007). Hasil SV dan CO yang lebih rendah juga dapat disebabkan oleh perbedaan berat badan dan perbedaan ras (Muzzi et al. 2006). Suckow et al (2012) menyatakan isoflurane dapat menyebabkan penurunan volume CO. Faktor lain yang mempengaruhi CO dan SV adalah temperatur tubuh. Penurunan temperatur tubuh disertai dengan penurunan fungsi jantung. Semakin rendah temperatur tubuh maka semakin rendah nilai CO, walaupun demikian kisaran temperatur tubuh pada penelitian ini masih berada dalam kisaran hipotermi ringan (Hong et al. 2002). Penurunan aliran darah jantung
Gambar 9. Efek anestesi jangka panjang propofol-isoflurane terhadap stroke volume dan cardiac
24
mengindikasikan penurunan aliran darah dan O2 keseluruh tubuh, sehingga akan
merangsang saraf vagus untuk meningkatkan aliran darah sebagai usaha tubuh dalam memenuhi kebutuhan 02 tubuh (Gambar 9) (Kobayashi et al. 2006).
Pengamatan Kemampuan Kontraksi Jantung
Persentase EF dan FS juga tidak menunjukkan perubahan yang signifikan selama penelitian berlangsung. Nilai tertinggi pada EF dan FS terjadi pada jam yang sama yaitu jam ke-6, dengan nilai 67±8 dan 31±5%, secara berurutan. Nilai terendah terjadi pada jam ke-12 yaitu 60±2 dan 26±3%, secara berurutan. Persentase EF dan FS selama penelitian mengalami perbedaan nyata (P < 0,05). Persentase FS yang didapat lebih rendah dibanding dengan kelinci yang sadar, sementara nilai EF sedikit lebih tinggi (Stypmann et al. 2007). Perbedaan pada FS sesuai dengan Baumgartner et al. (2008) yang menyatakan efek propofol
secara IV adalah penurunan FS. Isoflurane dengan konsentrasi 1,5-3% menjaga fungsi ventrikel kiri yang ditunjukkan oleh nilai FS yang tidak mengalami
perubahan signifikan selama penelitian ( íha et al. 2012).
Perubahan pada miokardium ventrikel kiri selama sistol akan mempengaruhi jumlah darah yang dipompa, dimana jumlah darah yang dipompa dikenal juga sebagai EF (Kusunose et al. 2012). Persentase FS dan EF yang didapat berbanding lurus dengan LVID, sehingga pola kedua parameter ini hampir sama (Gambar 10). Seperti halnya LVID, nilai tertinggi EF dan FS terjadi pada jam ke-6.
Fraksi pemendekan merupakan persentase jantung berkontraksi. Fraksi pemendekan dipengaruhi oleh selisih LVIDd dan LVIDs. Semakin menurunnya FS menandakan kemampuan kontraksi jantung semakin menurun. Propofol dan
isoflurane menyebabkan penurunan kontraksi (Chang et al. 2010) yang menyebabkan penurunan FS.
Gambar 10. Efek anestesi jangka panjang propofol-isoflurane terhadap ejection fraction dan
25
Tabel 4 Efek anestesi jangka panjang propofol dan isoflurane terhadap tekanan darah sistol, struktur dan dimensi, volume aliran, serta kemampuan kontraksi jantung kelinci domestik
5
SIMPULAN
DAFTAR PUSTAKA
Akada S, Fagerlund MJ, Lindahl SGE, Sakamoo A, Prabhakar NR, dan Eriksson LI. 2007. Pronounced Depression by Propofol on Carotid Body Response to CO2 and K+-Induced Carotid Body Activation.
http://dx.doi.org/10.1016/j.resp.2007.10.011.
Akers RM dan Denbow DM, 2008. Anatomy and Physiology of Domestic Animals. Blackwell Publishing. Australia. Hlm 254-255.
Aksenov D, Eassa JE, Lakhoo J, Wyrwicz A, dan Linsenmeier RA. 2012. Effect of Isoflurane on Brain Tissue Oxygen Tension and Cerebral Autoregulation in Rabbits. Neurosci Lett. 524(2): 116-118.
Allen LV, Popovich NG, dan Ansel HC. β011. Ansel’s Pharmaceutical Dosage
Forms and Drug Delovery Systems. Edisi ke-9. Williams & Wilkins. China. Hlm 170.
Allweiler S, Leach MC, dan Flecknell PA. 2010. The Use of Sevoflurane for Surgical Anaesthesia in New Zealand White Rabbits. Lab Anim. 44(2): 113-117. Doi: 10.1258/Ia.2009.009036.
Ballesteros KA, Sikorski A, Orfila JE, dan Martinez JL Jr. 2012. Effect of inhaled anesthetic isoflurane on long-term potentiation of CA3 pyramidal cell afferents in vivo. Int J Gen Med. 5: 935-942.
Bandchapp O dan Laizzo PA. 2011. Induction of therapeutic hypothermia requires modulation of thermoregulatory defenses. Theurapeutic Hypothermia and Temperature Management. 1(2): 77-87. DOI: 10.1089/ther.2010. 0010.
Baumgartner C, Bollerhey M, Henke J, Wagner S, Ungerer M, Erhardt W. 2008. Effects of propofol on ultrasonic indicators of haemodynamic function in rabbits. Vet Anaesth Analg. 35(8):100-112.
Baumgartner C, Bollerhey M, Ebner J, Singer LL, Schuster T, Henke J, Erhardt W. 2010. Effects of Ketamine-Xylazine Intravenous Bolus Injection on Cardiovascular Function in Rabbit. Can Vet J. 74: 200-208.
Boudarene M, Legros JJ, Timsit-Berthier M. 2002. Study of the stress response: role of anxiety, cortisol and DHEAs. Encephale. 28(2): 139-146.
Branson KR. 2007. Injectable and Alternative Anesthetic Technique. Didalam:
Lumb & Jones’ Veterinary Anesthesia and Analgesia. Tranquilli WJ, Thurmon JC, dan Grimm KA, Editor. Edisi ke-4. Blackwell Publishing. Oxford. Hlm 291-296.
Brosnan RJ. 2011. GABAA receptor antagonism increases NMDA receptor
inhibition by isoflurane at a minimum alveolar concentration. Vet Anaesth Analg. 38(3): 231-239.
Brown D dan Gaillot H. 2008. Heart. didalam Atlas of Small Animal Ultrasonography. Blackwell Publishing. Iowa. Hlm 151-191.
Brown EN, Lydic R, dan Schiff ND. 2010. General Anesthesia, Sleep, and Coma. N Engl JMed. 363: 2638-2650.
30
Carrero EJ dan Fàbregas N. 2012. Thermoregulation and neuroanesthesia.SaudiJ Anaesth. 6(1): 5-7.
Chang CH, Roh GU, dan Park WK. 2010. Effects of propofol on -adrenoreceptor-mediated signal transduction in cardiac muscle; role of cAMP. Korean J Anesthesiol. 58(4): 374-377.
Chang C, Uchiyama A, Ma L, Mashimo T, Fujino Y. 2009. A Comparison of the Effects on Respiratory Carbon Dioxide Response, Arterial Blood Pressure, and Heart Rate of Dexmedetomidine, Propofol, and Midazolam in Sevoflurane-Anesthetized Rabbits. Anesth Analg 109: 84-89.
Cotter SM. 2001. Quick LookSeries in Veterinary Medicine. Hematology. Cann CC, editor. Teton New Media. Jackson. WY. Hlm 57.
Crowell-Davis S dan Murray T. 2006. Veterinary Psychopharmacology. Blackwell Publishing. Iowa. Hlm 25
Cruz FS, Carregaro AB, Raiser AG, Zimmerman M, Lukarsewski R, Steffen RP. 2010. Total intravenous anesthesia with propofol and S(+)-ketamine in rabbits. Vet Anaesth Analg. 37(2): 116-122.
Cunningham JG dan Klein BG. 2007. Veterinary Physiology. Edisi ke-4. Angiotensin II induces catecholamine release by direct ganglionic excitation. Hypertension 40: 348–354.
Egwu GO, Mshelia GD, Sanni S, Anyenyiki PA, dan Adeyanju. 2011. The Effect of Vitamin C at Varying Times on Physiological Parameters in Rabbits after Xylazine Anasthesia. Veterinaria Italiana. 47(1): 97-104. http://izs.it/vet_italiana.
Felzemburgh VA, Catolin QC, Machado KM, Campos JHO. 2012. Comparison berween the Anesthetic Induction Times in the First and Second Surgery in Rabbits. Acta Cirúrgica Brasileira. 27(7): 482-487.
Fish RE. 1997. Pharmacology of Injectable Anesthetics. Didalam: Anesthesia and Analgesia in Laboratory Animals. Kohn DF, Wixson SK, White WJ, dan Benson GJ, editor. Academic Pr. London. Hlm 8-9.
Flecknell P. 2011. Rodent and Rabbit Anesthesia. chapter 11. didalam Anesthesia and Analgesia for Veterinary Technicians. edisi ke-4. Mosby, Inc., Missouri. Hlm 298-317.
Fontes-Sousa APN, Brás-Silva C, Moura C, Areías JS, Leíte-Moreíra. 2006. M-mode and Doppler echocardiographic reference values for male New Zealand white rabbits. AJVR. 67(10): 1725-1729.
Foster S dan Theodoropoulos C. 2011. Ultrasound. didalam Small Animal Imaging Basic and Practical Guide. Spinger. New York. Hlm 207-215. Frazier DT dan Revelette WR. 1991. Role of phrenic nerve afferents in the control