IDENTIFIKASI DAN DETEKSI
MULTIPLEX REVERSE
TRANSCRIPTION POLYMERASE CHAIN REACTION
VIRUS
–
VIRUS PENYEBAB GEJALA MOSAIK
PADA NILAM (
Pogostemon cablin
BENTH.)
MIFTAKHUROHMAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi dan Deteksi
Multiplex Reverse Transcription Polymerase Chain Reaction Virus – Virus Penyebab Gejala Mosaik pada Nilam (Pogostemon cablin Benth.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Miftakhurohmah
NIM A352100031
RINGKASAN
MIFTAKHUROHMAH. Identifikasi dan Deteksi MultiplexReverse Transcription Polymerase Chain Reaction Virus – Virus Penyebab Gejala Mosaik pada Nilam (Pogostemon cablin Benth.). Dibimbing oleh GEDE SUASTIKA dan TRI ASMIRA DAMAYANTI.
Nilam merupakan salah satu sumber devisa Indonesia dan Indonesia menjadi penyuplai terbesar kebutuhan minyak nilam dunia. Salah satu kendala dalam budidaya nilam adalah infeksi virus. Informasi tentang virus – virus yang menginfeksi tanaman nilam masih terbatas. Oleh karena itu penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi virus – virus yang berasosiasi dengan gejala mosaik pada tanaman nilam secara serologi dan molekuler.
Pengambilan sampel dan pengamatan gejala infeksi virus dilakukan di tiga lokasi pertanaman nilam, yaitu Manoko (Bandung Barat), Cicurug (Sukabumi) dan Cijeruk (Bogor). Setiap lokasi dilakukan pengambilan sampel sebanyak 30 tanaman baik yang bergejala maupun tidak. Deteksi secara serologi dilakukan menggunakan empat antiserum : Cymbidium mosaic virus (CymMV), Broad bead wilt virus 2 (BBWV2), Cucumber mosaic virus (CMV) dan Potyvirus.
Identifikasi secara molekuler dilakukan meliputi amplifikasi DNA virus tanaman dengan reverse transcription polymerase chain reaction (RT-PCR), perunutan DNA, dan analisis hasil runutan DNA. Untuk pengembangan deteksi cepat secara molekuler dilakukan multiplex reverse transcription polymerase chain reaction
(RT-PCR) dengan menggunakan delapan variasi kombinasi konsentrasi primer (I, II, III, IV, V, VI, VII dan VIII).
Kejadian infeksi Potyvirus di Manoko sebesar 100%, di Cicurug 83.3% dan 50.0% di Cijeruk. Kejadian infeksi BBWV2 sebesar 100% di Manoko, 73.3% di Cicurug dan 90.0% di Cijeruk. Kejadian infeksi CymMV sebesar 3.3% di Manoko dan Cicurug, sedangkan kejadian CMV di Cicurug sebesar 80.0% dan 13.3% di Cijeruk. Semua pasangan primer yang digunakan berhasil mengamplifikasi semua virus, dan mengkonfirmasi deteksi secara serologi. Analisis homologi runutan nukleotida dan asam amino menunjukkan bahwa isolat BBWV2 Manoko memiliki homologi tertinggi dengan BBWV2 asal Singapura (tanaman inang Megakepasma erythroclamys / ME). Isolat BBWV2 Manoko mengelompok dengan isolat BBWV2 asal Singapura (ME), Cina (lada) dan Korea Selatan (cabai merah) berdasarkan runutan nukleotida dan asam amino. Isolat CymMV asal Manoko memiliki homologi nukleotida dan asam amino tertinggi dengan isolat CymMV asal Korea Selatan (Cymbidium). Hasil analisis filogenetik berdasarkan runutan nukleotida, isolat CymMV Manoko mengelompok dengan CymMV asal Indonesia (Dendobrium), Cina (Cymbidium
Multiplex RT-PCR berhasil mengamplifikasi Potyvirus, BBWV2 dan CymMV menggunakan kombinasi primer V, VI, VII dan VIII. Dengan teknik ini, deteksi infeksi virus ganda pada tanaman nilam bisa dilakukan secara simultan dan hemat dalam penggunaan bahan – bahan yang diperlukan.
SUMMARY
MIFTAKHUROHMAH. Identification and Multiplex Reverse Transcription Polymerase Chain Reaction Detection of Viruses Associated with Mosaic Symptom on Patchouli (Pogostemon cablin Benth.). Supervised by GEDE SUASTIKA and TRI ASMIRA DAMAYANTI.
Patchouli essential oil is one of sources of Indonesia foreign exchange, since Indonesia is the biggest supplier of patchouli oil in the world. One of obstacle on the patchouli production is viral infection. Virus(es) infecting patchouli plant has not been well known. Thus, the aim of presented work is to detect and identify virus(es) associated with mosaic symptom on patchouli either serologically or molecularly.
Samples were collected from patchouli cultivation in Cicurug and Cijeruk (Sukabumi) and in Manoko (Lembang, Bandung) by taking 30 symptomatic and asymptomatic samples from each location. Serological test using four antisera to
Cucumber mosaic virus (CMV), Cymbidium mosaic virus (CymMV), Potyvirus
and Broad bean wilt virus 2 (BBWV2) were carried out to determine the incidence of virus infection. Further molecular detection of virus(es) was carried out by reverse transcription polymerase chain reaction (RT-PCR) and DNA sequencing. Multiplex RT-PCR was developed to provide rapid detection of those viruses used eight combination of primer concentrations (I, II, III, IV, V, VI, VII and VIII).
Multiplex RT-PCR was succesfully amplified Potyvirus, BBWV2 and CymMV by using primer combination V, VI, VII and VIII. The multiplex RT-PCR can be applied to detect multiple viruses infection on patchouli simultaneously.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
IIDENTIFIKASI DAN DETEKSI MULTIPLEX REVERSE TRANSCIPTION POLYMERASE CHAIN REACTION VIRUS – VIRUS PENYEBAB
GEJALA MOSAIK PADA NILAM (Pogostemon cablin BENTH.)
MIFTAKHUROHMAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi dan Deteksi Multiplex Reverse Transcription
Polymerase Chain Reaction Virus - Virus Penyebab Gejala Mosaik pada Nilam (Pogostemon cablin Benth.)
Nama : Miftakhurohmah NIM : A352100031
Disetujui oleh Komisi Pembimbing
Dr Ir Gede Suastika, MSc Dr Ir Tri Asmira Damayanti, MAgr
Ketua Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Dr Ir Sri Hendrastuti H., MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan hidayahNya yang diberikan sehingga penulis dapat menyelesaikan tesis yang
berjudul “Identifikasi dan Deteksi Multiplex Reverse Transcription Polymerase Chain Reaction Virus - Virus Penyebab Gejala Mosaikpada Nilam (Pogostemon cablin Benth.)”. Shalawat dan salam tercurah kepada Nabi Besar Muhammad SAW beserta keluarga, sahabat dan para pengikutnya. Tesis ini dibuat untuk memenuhi syarat memperoleh gelar Magister Sains pada Program Studi Fitopatologi.
Terima kasih penulis ucapkan kepada Dr Ir Gede Suastika, MSc dan Dr Ir Tri Asmira Damayanti, MAgr atas bimbingan, saran, kritik, dan dukungan moril yang sangat besar peranannya dalam penelitian dan penyelesaian tesis ini. Ucapan terima kasih juga disampaikan kepada Ir Kikin Hamzah Mutaqin, MSi, PhD yang bersedia menjadi Penguji Luar Komisi pada Ujian Tesis; Badan Litbang pertanian atas kesempatan dan beasiswa yang diberikan kepada penulis untuk mengikuti program Pascasarjana di IPB; Dr Ir Sri Hendrastuti Hidayat, MSc atas bimbingan dan izin penggunaan bahan laboratorium untuk penelitian. Terima kasih sebesar – besarnya penulis ucapkan kepada suami, anak – anak, orang tua dan saudara yang telah memberikan dukungan selama penulis menjalani studi. Ucapan terima kasih juga penulis sampaikan kepada seluruh pegawai Kelompok Peneliti Proteksi Tanaman Balai Penelitian Tanaman Rempah dan Obat atas seluruh bantuan dan dukungannya selama penulis menjalani studi. Penulis menyampaikan terima kasih kepada teman – teman di laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB atas seluruh bantuan, dukungan semangat, dan keceriannya selama penulis menjalani penelitian.
Bogor, Oktober 2013
DAFTAR ISI
Pengamatan Partikel Virus Menggunakan Mikroskop Elektron 8
Deteksi dan Identifikasi Virus Berdasarkan Biomolekuler 9 Kejadian Infeksi Virus pada Pertanaman Nilam 17 Partikel Virus 20 Deteksi Potyvirus, BBWV2 dan CymMV secara Molekuler 21
Broad bean wilt virus 2 22 Homologi runutan nukleotida dan asam amino gen
SCP BBWV2 23
Pohon filogenetika runutan nukleotida dan asam
amino gen SCP BBWV2 25
Cymbidium mosaic virus 26 Homologi runutan nukleotida dan asam amino gen
CP CymMV 28
Pohon filogenetika runutan nukleotida dan asam
amino gen CP CymMV 30
Multiplex RT-PCR 32
SIMPULAN DAN SARAN 33
Simpulan 34
Saran 34
DAFTAR PUSTAKA 34
LAMPIRAN 40
DAFTAR TABEL
1 Primer - primer yang digunakan untuk deteksi virus mosaik nilam 14 2 Program amplifikasi untuk setiap primer yang digunakan dalam kegiatan
PCR 15
3 Kombinasi total konsentrasi primer Potyvirus, BBWV2 dan CymM 15 4 Kejadian penyakit Potyvirus, BBWV2, CymMV, CMV dan TMV pada
pertanaman nilam di Manoko, Cicurug dan Cijeruk 18
5 Hasil BLAST runutan nukleotida isolat BBWV2 asal Cicurug
menggunakan software Blast (www. ncbi.nml.niv.gov) 22 6 Isolat BBWV2, PatMMV dan BBWV1 dari database GenBank yang
digunakan untuk membandingkan homologi gen SCP BBWV2 Manoko 24 7 Homologi runutan nukleotida dan asam amino gen SCP BBWV2 Manoko
dengan beberapa anggota genus Fabavirus 24
8 Hasil BLAST runutan nukleotida isolat CymMV asal Manoko
menggunakan software Blast (www.ncbi.nml.niv.gov) 27 9 Isolat CymMV dari database GenBank yang digunakan untuk
membandingkan homologi gen CP CymMV Manoko 29
10 Homologi nukleotida dan asam amino gen CP CymMV Manoko dengan
beberapa CymMV asal beberapa negara lain 29
DAFTAR GAMBAR
1 Peta genom secara umum anggota genus Potyvirus. P1-Pro, berukuran 35K, yaitu protein dengan aktifitas proteolitik; HC-Pro berukuran 52K yaitu protein dengan aktifitas helper component; P3 berukuran 50K; protein yang belum diketahui fungsinya berukuran 6K; CI berukuran 71 K, membentuk badan inklusi silindris; protein yang belum diketahui fungsinya, berukuran 6K; NIa dan NIb berukuran 21, 27 dan 58K merupakan protein pembentuk badan inklusi (small dan large) dan CP sebagai pembentuk selubung protein, berukuran 30K (van Regenmortel et
al. 2000) 5
2 Organisasi genom CMV. 1a dan 2a : protein replikasi berukuran 109K dan 14K; protein 2b overlap dengan ORF 2a sebanyak 69 kodon; 3a :
Movement protein berukuran 32K, dan 3b. : selubung protein (CP)
berukuran 24K (Hull 2002) 5
3 Struktur genom RNA 1 (A) dan RNA 2 (B) PatMMV. Pro-C= protease cofactor, NTB= nucleotide tri-phosphate binding protein, VPg= viral protein genome-linked, C-Pro : cysteine protease, RdRp : RNA dependent
RNA polymerase, MP : movement protein, LCP : Large Coat Protein, SCP : Short Coat Protein (Ikegami et al. 1998; 2001) 6
4 Genom CymMV, salah satu anggota genus Potexvirus, RdRP : RNA
dependent RNA polymerase, TGB : triple gene block, MP : movement protein, CP : coat protein (Ajjikuttira dan Wong 2009) 7 5 Gejala infeksi virus tanaman nilam di lapangan. a. tidak bergejala, b dan c.
6 Mikrograf elektron dari cairan daun nilam yang telah diwarnai dengan
uranyl acetate : a. Partikel Potyvirus, b. Partikel BBWV2, c. Partikel
CymMV 21
7 Hasil visualisasi RT-PCR dengan primer P29502 dan CPUP pada gel agarosa 1.5%. 1-2. Isolat Cijeruk, 3-7. Isolat Cicurug, 8-10. Isolat Manoko, K+. Kontrol positif Potyvirus dari nilam asal Bogor, K-. Kontrol
negatif, M. Penanda DNA 100 pb 21
8 Hasil visualisasi RT-PCR dengan primer BBWVVSSP dan BBWVKMRM pada gel agarose 1.5%. M. Penanda DNA 100 pb, K-. kontrol negatif, 1-2. isolat dari Manoko positif, 3. isolat Manoko negatif, 4-6. isolat dari Cicurug positif, 7-9. isolat dari Cijeruk positif 22 9 Hasil visualisasi RT-PCR BBWV2 pada gel agarosa 1%. 1. Isolat Manoko
negatif, 2. Isolat Manoko positif, 3. Isolat Cicurug positif, K- . kontrol
negatif, M. Penanda DNA 1 kb plus 23
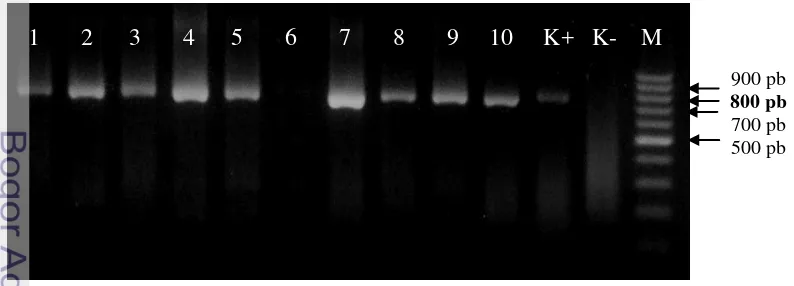
10 Pohon filogenetika gen SCP BBWV2 isolat Manoko berdasarkan : (a) runutan nukleotida, (b) asam amino. Pohon filogenetika dibuat dengan menggunakan software MEGA 4.0, metode neighbour-joining, dengan
bootstrap sebanyak 1000 kali. BBWV1 (AY781172) digunakan sebagai
pembanding di luar grup 26
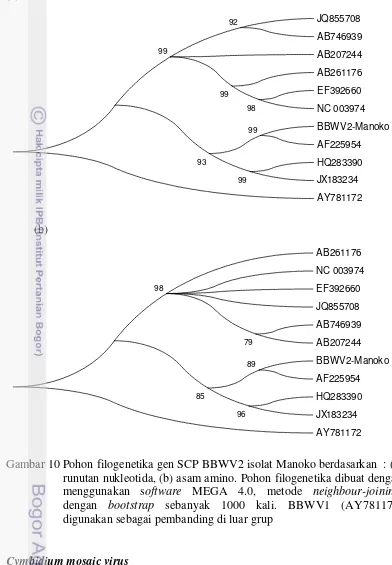
11 Hasil visualisasi RT-PCR dengan primer general Potexvirus pada gel agarosa 1.5 %. M. Penanda DNA 100 pb, K-. kontrol negatif, K+. kontrol
positif, CymMV asal Anggrek, 1. isolat Manoko 27
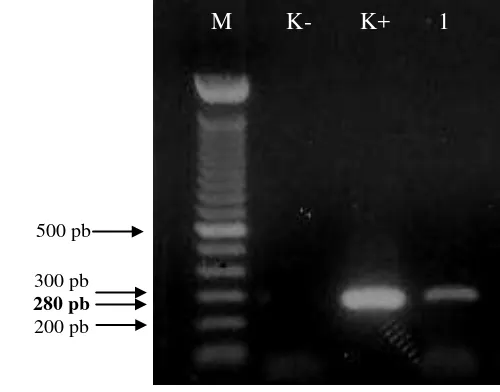
12 Hasil visualisasi RT-PCR CymMV pada gel agarosa 1.5 %. M. Penanda DNA 100 pb, K-. kontrol negatif, K+. kontrol positif, 1. sampel Cicurug,
2-4. sampel Manoko 28
13 Pohon filogenetika gen CP CymMV isolat Manoko berdasarkan : (a) runutan nukleotida. (b) asam amino. Pohon filogenetika dibuat menggunakan software MEGA 4.0, metode neigbour-joining, dengan
bootstrap sebanyak 1000 kali. PVX (AF485891) digunakan sebagai
pembanding di luar grup 31
14 Hasil visualisasi uniplex RT-PCR pada gel agarosa 1.5%. M. Penanda DNA 100 pb, 1. Sampel sehat, 2. Potyvirus, 3. CymMV, 4. BBWV2 32 15 Hasil visualisasi multiplex RT-PCR pada gel agarosa 1.5 %. M. Penanda
DNA 100 pb, 1 – 8. Produk PCR yang teramplifikasi oleh set primer I – VIII, dimana kombinasinya dapat dilihat pada tabel di atas gambar 33
DAFTAR LAMPIRAN
1 Hasil ELISA sampel komposit dan sampel tunggal dari Manoko, Cicurug
4 Hasil alignment nukleotida antara genom CymMV isolat Manoko dengan nukleotida genom – genom CymMV yang didapatkan dari database GenBank Hasil alignment nukleotida antara genom CymMV isolat Manoko dengan nukleotida genom – genom CymMV yang
didapatkan dari database GenBank 48
5 Hasil alignment asam amino antara genom CymMV isolat Manoko dengan nukleotida genom – genom CymMV yang didapatkan dari
PENDAHULUAN
Latar Belakang
Nilam (Pogostemon cablin Beth) merupakan salah satu tanaman penghasil minyak atsiri yang menjadi salah satu sumber devisa Indonesia. Minyak nilam dalam dunia perdagangan internasional dikenal sebagai patchouli oil banyak digunakan sebagai bahan fiksatif dalam pembuatan parfum, sabun dan kosmetik. Indonesia memenuhi kurang lebih 70% kebutuhan minyak nilam dunia dengan volume ekspor rata–rata di atas 1 000 ton per tahun (Barani 2008). Ekspor minyak nilam Indonesia pada tahun 2004 mencapai 2 074 ton dengan nilai US$ 27 137 juta (Direktorat Jenderal Perkebunan 2006). Hal ini mengakibatkan tingginya minat petani untuk mengembangkan tanaman nilam. Pada tahun 2009 luas areal penanaman nilam seluas 24 535 ha, yang meningkat sebesar 9.79% dari tahun 2008, dengan produktifitas sebesar 0.11 ton/ha. Namun demikian, pada tahun 2010, terjadi penurunan sebesar 4.53% luas penanaman nilam, menjadi 23 472 ha, dan penurunan produktifitas sebesar 0.09 ton/ha (Direktorat Jenderal Perkebunan 2012).
Salah satu kendala budidaya tanaman nilam adalah adanya serangan hama dan penyakit. Penyakit utama pada tanaman nilam adalah penyakit layu yang disebabkan oleh Ralstonia solanacearum dan serangan nematoda (Asman et al.
1998; Mustika et al. 1991). Penelitian tentang penyakit layu sudah banyak dilakukan, baik mengenai deteksi dan identifikasi, serta usaha –usaha pengendaliannya. Selain penyakit layu dan serangan nematoda, infeksi virus juga ditemukan pada tanaman nilam. Beberapa virus yang dilaporkan menyerang tanaman nilam adalah Tobacco necrosis virus (Gama et al. 1982), Patchouli mild mosaic virus (PatMMV) (Natsuaki et al. 1994), Patchouli mottle virus (PatMoV) (Natsuaki et al. 1994, Sugimura et al. 1995), Patchouli virus X (PatVX) (Filho et al. 2002), dan Peanut stripe virus (PStV) (Singh et al. 2009).
Uji serologi sampel tanaman nilam berhasil mendeteksi PatMoV (Sumardiyono et al. 1996), dan infeksi campuran antara CMV dan Potyvirus pada pertanaman nilam di Cianjur dan Bogor (Sukamto et al. 2007). Pada pertanaman nilam di Jawa Barat, Sumatera Utara dan Sumatera Barat, ditemukan gejala mosaik yang berasosiasi dengan Potyvirus berdasarkan uji serologi dan PCR. Sedangkan gejala mosaik di Brebes (Jawa Tengah) terdeteksi positif Broad bean wilt virus 2 (BBWV2) (Noveriza et al. 2012a).
Infeksi virus pada tanaman nilam diketahui telah menjadi kendala utama pada pertanaman nilam di Jawa dan Sumatera Barat. Kejadian penyakit akibat infeksi Potyvirus diperkirakan berkisar antara 30 sampai 50%, sedangkan di Jawa Tengah akibat infeksi BBWV2 berkisar 40% (Noveriza et al., 2012a). Infeksi virus menyebabkan penurunan bobot terna basah sebesar 7.87 sampai 34.65%, bobot terna kering sebesar 0.62 sampai 40.42% dan penurunan kadar patchouli alcohol sebesar 0.72 sampai 5.06% (Noveriza et al., 2012b).
2
serologi dan molekuler. Salah satu teknik serologi adalah Enzyme-Linked Immunosorbent Assay (ELISA), sedangkan teknik molekuler yang umum digunakan adalah Polymerase Chain Reaction (PCR) (Naidu dan Hughes, 2003). Dari hasil PCR, selanjutnya dapat dilakukan perunutan susunan nukleotida, yang dapat digunakan untuk mengklasifikasikan virus berdasarkan genomnya. Penelitian terdahulu menunjukkan bahwa analisis sekuen coat protein (CP) sangat berguna dalam kegiatan identifikasi BBWV1 dan BBWV2 (Kobayashi et al.
1999, Kondo et al. 2005). Beberapa software telah tersedia untuk mengklasifikasikan virus berdasarkan susunan nukleotida genomnya, diantaranya BioEdit, MEGA, dan GeneDoc (Tamura et al. 2007; Hall 1999).
Infeksi ganda virus pada tanaman nilam telah dilaporkan sebelumnya oleh Natsuaki et al. (1994) dan Sugimura et al. (1995), yang menyebabkan gejala lebih parah dibandingkan infeksi tunggal. Untuk mendeteksi secara cepat infeksi beberapa virus pada tanaman, diperlukan metode deteksi secara cepat, efisien dan akurat. Metode multiplex reverse transcription polymerase chain reaction (RT-PCR) telah banyak digunakan untuk mendeteksi infeksi ganda beberapa virus pada tanaman.
Kebun Percobaan Balittro di Manoko dan Cicurug, serta kebun petani di Cijeruk memiliki lahan pertanaman nilam yang cukup luas, dan berdasarkan pengamatan awal, banyak ditemukan gejala penyakit yang diduga berasosiasi dengan virus. Nilam diperbanyak secara vegetatif dan pada ketiga lahan pertanaman tersebut diproduksi bibit tanaman nilam, serta belum diketahui status kesehatan nilam yang berasal dari lokasi tersebut. Oleh karena itu, perlu dilakukan penelitian tentang deteksi dan identifikasi virus – virus yang berasosiasi dengan penyakit mosaik pada pertanaman nilam di ketiga lokasi tersebut serta metode deteksi beberapa virus secara simultan.
Tujuan Penelitian
1. Mendeteksi dan mengidentifikasi virus – virus yang berasosiasi dengan penyakit mosaik pada tanaman nilam.
2. Mengoptimasi metode multiplex reverse transcription polymerase chain reaction (RT-PCR)untuk mendeteksi secara simultan Potyvirus, BBWV2 dan CymMV.
Manfaat Penelitian
Penelitian diharapkan mendapatkan informasi jenis – jenis virus yang menginfeksi nilam sebagai dasar pengambilan tindakan pengendalian yang tepat serta metode deteksi secara simultan Potyvirus, BBWV2 dan CymMV.
Hipotesis
1. Gejala mosaikpada nilam dapat disebabkan oleh lebih dari satu jenis virus. 2. Multiplex RT-PCR dapat diterapkan untuk mendeteksi virus – virus pada
3
TINJAUAN PUSTAKA
Budidaya Tanaman Nilam
Tanaman nilam merupakan salah satu tanaman penghasil minyak atsiri. Minyak nilam, yang dalam dunia perdagangan internasional dikenal sebagai
patchouli oil, merupakan bahan pengikat aroma wangi yang tidak dapat digantikan dengan zat sintetis lain. Selain minyak nilam yang bermanfaat, limbah hasil penyulinganpun dapat dipergunakan sebagai bahan baku pupuk organik, karena memiliki kadar hara yang tinggi. Dengan teknologi pengomposan yang cepat dan efisien, akan menghasilkan pupuk organik yang bermutu tinggi (Suhirman 2011).
Di Indonesia, terdapat tiga jenis nilam, yaitu Pogostemon cablin Benth (nilam Aceh), P. heyneanus (nilam jawa) dan P. hortensis (nilam sabun), dimana hanya nilam jawa yang berbunga. Selain bunga, ketiga jenis tanaman nilam tersebut dapat dibedakan berdasarkan karakter morfologi, kandungan dan kualitas minyak, serta ketahanannya terhadap cekaman biotik dan abiotik. Nilam Aceh merupakan jenis nilam yang paling banyak dibudidayakan karena kadar minyaknya lebih tinggi dan kualitas minyaknya lebih bagus dibandingkan nilam jawa dan nilam sabun (Nuryani 2006).
Nilam Aceh diperkirakan masuk ke Indonesia lebih dari seabad yang lalu, diduga berasal dari Filipina atau Semenanjung Malaysia. Berdasarkan pengamatan tanaman nilam Aceh, ditemukan perbedaan baik karakter morfologi, kandungan minyak, sifat fisika kimia minyak serta ketahanannya terhadap penyakit dan kekeringan. Hal ini diduga karena telah lama dibudidayakan di beberapa daerah, menyebabkan terjadinya perubahan dari sifat – sifat asalnya. Nilam Jawa berasal dari India, disebut juga nilam kembang karena dapat berbunga, yang dapat dibedakan dengan nilam Aceh berdasarkan visual daunnya. Daun nilam Jawa permukaannya kasar dengan tepi bergerigi runcing, sedangkan daun nilam Aceh permukaannya halus dengan tepi bergerigi tumpul. Nilam Jawa lebih tahan terhadap serangan nematoda dan penyakit layu bakteri dibandingkan nilam Aceh, namun kualitas minyaknya kurang bagus (Nuryani 2006). Nilam sabun, seperti halnya nilam Jawa, memiliki kualitas minyak yang kurang bagus dibandingkan nilam Aceh. Pada zaman dulu, daun nilam sabun digunakan untuk mencuci pakaian. Daun nilam sabun tidak berbulu, permukaannya mengkilap, dan lebih tipis dari daun nilam Aceh (Mangun 2002).
Tanaman nilam termasuk tanaman herba yang mudah dibudidayakan. Nilam dapat tumbuh dengan baik pada ketinggian 500 sampai 400 m dpl, namun masih mampu tumbuh di dataran rendah dan dataran tinggi sampai ketinggian 1 200 m dpl. Pertumbuhan tanaman nilam membutuhkan curah hujan berkisar antara 2 000 sampai 2 500 mm/th, suhu optimum 24 sampai 28 oC, intensitas penyinaran 75 sampai 100%, serta kelembaban lebih dari 75% (Nuryani et al.
2005).
4
(1) varietas, harus berasal dari varietas unggul. Varietas yang direkomendasikan yaitu Sidikalang, Lhokseumawe dan Tapak Tuan; (2) Tanaman induk, benih harus berasal dari tanaman induk yang sehat (bebas hama dan penyakit) dan tanpa gejala kekurangan unsur hara; (3) Lokasi asal benih, untuk benih dari lokasi dengan kondisi agroklimat yang berbeda, perlu dilakukan penyesuaian (Ditjenbun 2011).
Salah satu kendala budidaya pada tanaman nilam adalah adanya serangan Organisme Pengganggu Tumbuhan (OPT). Hama utama pada tanaman nilam adalah Aphis gossypii, ulat pemakan daun, ulat penggulung daun (Sylepta sp.), walang sangit, tungau merah, belalang dan rayap (Mardiningsih et al. 2011). Selain berperan sebagai hama, A. gossypii juga berperan sebagai vektor beberapa virus, diantaranya yaitu Broad bean wilt virus 1 (BBWV1) (Belliure et al. 2009), dan Potyvirus. BBWV1 dan Potyvirus ditemukan menginfeksi tanaman nilam, yang menyebabkan gejala mosaik pada tanaman nilam (Noveriza et al. 2012a).
Penyakit penting pada tanaman nilam adalah penyakit layu bakteri yang diakibatkan oleh Ralstonia solanacearum, penyakit merah dan kuning yang disebabkan oleh nematoda, penyakit budok yang diakibatkan oleh cendawan
Synchytrium sp., dan penyakit mosaik yang disebabkan oleh virus (Wahyuno et al.
2011). Infeksi virus menyebabkan terjadinya penurunan produksi dan kadar
patchouli alcohol pada beberapa varietas tanaman nilam (Noveriza et al. 2012b).
Virus – Virus yang Menginfeksi Tanaman Nilam
Potyvirus
Potyvirus tergolong ke dalam famili Potyviridae yang memiliki anggota spesies paling banyak dibandingkan genus lain (Fauquet et al. 2005). Beberapa anggota genus ini menyebabkan kehilangan secara nyata pada tanaman holtikultura, tanaman hias, tanaman pangan dan padang rumput (Chen et al. yaitu 9 161 nukleotida yang mengkode 3 000 asam amino (340 kDa), terdiri dari P1-Pro, HC-Pro, P3, CI (cylindrical inclusion), NIa dan NIb (nuclear inclusion a dan b), serta CP (coat protein), (4) 3’ untranslated region, berukuran 190 basa, sebelum poly A (van Regenmortel et al. 2000; Hull 2002) (Gambar 1). Partikel
Potyvirus berbentuk benang lentur, tanpa amplop, berdiameter 11 sampai 15 nm, dengan panjang 650 sampai 900 nm (Fauquet et al. 2005).
5
Potyvirus yang menginfeksi tanaman nilam diidentifikasi sebagai Peanut stripe virus (PStV) di India yang menyebabkan gejala mosaik pada daun nilam (Singh et al. 2009), Patchouli mottle virus (PatMoV) di Jepang, dengan gejala berkisar antara tanpa gejala sampai belang lemah (Natsuaki et al. 1994) dan
Telosma mosaic virus (TeMV) di Sumatra Utara, Sumatra Barat dan Jawa Barat yang menyebabkan gejala mosaik dengan beberapa variasi (Noveriza et al.
2012a).
Gambar 1 Peta genom secara umum anggota genus Potyvirus. P1-Pro, berukuran 35K, yaitu protein dengan aktifitas proteolitik; HC-Pro berukuran 52K yaitu protein dengan aktifitas helper component; P3 berukuran 50K; protein yang belum diketahui fungsinya berukuran 6K; CI berukuran 71 K, membentuk badan inklusi silindris; protein yang belum diketahui fungsinya berukuran 6K; NIa dan NIb berukuran 21, 27 dan 58K merupakan protein pembentuk badan inklusi (small dan large) dan CP sebagai pembentuk selubung protein berukuran 30K (van Regenmortel et al. 2000)
Cucumber mosaic virus (CMV)
CMV tergolong ke dalam genus Cucumovirus, famili Bromoviridae. CMV merupakan tipe spesies dari Cucumovirus, dengan bentuk partikel spherical
berdiameter 26 sampai 35 nm dan panjang 30 sampai 85 nm. Virus ini memiliki kisaran inang yang luas, menginfeksi 85 famili tanaman, dan lebih dari 1 000 spesies. CMV ditularkan oleh kutudaun secara non persisten, dan dapat ditularkan juga secara mekanis (Fauquet et al. 2005).
Genom CMV memiliki 3 utas tunggal RNA positif sense, yaitu RNA 1 (3 357 nukleotida), RNA 2 (3 050 nukleotida), dan RNA 3 (2 116 nukleotida), serta 2 subgenomik RNA, yaitu RNA 4 dan RNA4A (1 027 nukleotida). RNA 1 dan
RNA 2 mengkode gen replikasi. Selain itu, pada 3’ sequence RNA 2, mengkode
6
CMV terdeteksi secara serologi menginfeksi pertanaman nilam di Cianjur dan Bogor, Jawa Barat. Infeksi CMV bersama – sama dengan Potyvirus
menyebabkan gejala mosaik. Berdasarkan hasil ELISA, antiserum Potyvirus
bereaksi lebih kuat dengan sampel dibandingkan dengan antiserum CMV (Sukamto et al. 2007).
Fabavirus
Fabavirus tergolong ke dalam famili Comoviridae, dilaporkan menginfeksi tanaman yang memiliki arti penting secara ekonomi diantaranya bush basil (Ocimum basilicum) (Sanz et al. 2001), gentian (Gentiana scabra) (Kobayashi et al. 2005), Mikania micrantha (Compositae) (Wang et al. 2008), dan cabai (Capsicum annum) (Lee et al. 2000). Di lapangan, Fabavirus ditularkan oleh kutudaun secara non persisten. Broad bean wilt virus 1 ditularkan secara efektif oleh Myzus persicae dan Aphis gossypii (Belliure et al. 2009), serta BBWV pada basil juga ditularkan oleh M. persicae dan A. gossypii (Sanz et al. 2001).
Partikel Fabavirus berbentuk icosahedral berdimeter sekitar 30 nm, memiliki genom 2 RNA utas tunggal berukuran antara 6.0 sampai 6.3 kb (RNA1) dan 3.9 sampai 4.5 kb (RNA2), di mana masing – masing RNA terenkapsidasi secara terpisah (Kobayashi et al. 2005). Prediksi runutan poliprotein yang dikode oleh RNA 1 PatMMV dihasilkan untuk protease cofactor (39K), NTP-binding protein (66K), VPg (3K), cysteine protease (23K) dan RNA-dependent RNA
polymerase (79K). Protease diperlukan untuk memecah poliprotein pada virus yang menggunakan polyprotein processing sebagai strategi translasi. ORF panjang dari RNA2 PatMMV, menunjukkan Movement Protein (MP) berukuran 52K, Large Coat Protein (LCP) berukuran 44K dan Small Coat Protein (SCP) berukuran 22K (Gambar 3A dan 3B) (Ikegami et al. 1998; 2001).
(A) RNA1
(B) RNA2
Gambar 3 Struktur genom RNA 1 (A) dan RNA 2 (B) PatMMV. Pro-C=
protease cofactor, NTB= nucleotide tri-phosphate binding protein,
VPg= viral protein genome-linked, C-Pro : cystein protease, RdRp :
RNA dependent RNA polymerase, MP : movement protein, LCP :
Large Coat Protein, SCP : Short Coat Protein (Ikegami et al. 1998; 2001)
Genus Fabavirus memiliki empat spesies definitif yaitu : BBWV 1 dan 2,
Lamium mild mosaic virus (LMMV) dan PatMMV (van Regenmortel et al. 2000). Saat ini ditemukan virus baru yang tergolong Fabavirus juga, yaitu Gentian mosaic virus (Kobayashi et al. 2005).
Fabavirus yang menyebabkan gejala mosaik pada tanaman nilam di Jepang dilaporkan disebabkan oleh PatMMV. Virus ini memiliki kemiripan
7 morfologi partikel, berat molekul CP dan hubungan serologi dengan BBWV dan LMMV. Namun demikian, PatMMV menunjukkan perbedaan kisaran inang dan gejala pada tanaman Vicia faba dan Nicotiana tabacum. Perbedaan ini yang menyebabkan PatMMV dikategorikan sebagai spesies baru anggota Fabavirus
(Natsuaki et al. 1994).
Potexvirus
Genus Potexvirus dinamakan setelah Potato virus X (PVX), memiliki banyak anggota yang menginfeksi beberapa tanaman di seluruh dunia. Salah satu anggota genus ini yang terkenal adalah Cymbidium mosaic virus (CymMV) yang menyebabkan kehilangan besar secara ekonomi pada tanaman anggrek. Gejala yang disebabkan Potexvirus umumnya mosaik dan tanaman kerdil. Potexvirus
memproduksi sejumlah besar partikel virus pada sitoplasma sel yang terinfeksi (Agrios 2005).
Partikel Potexvirus berbentuk flexuous rod, dengan panjang antara 470 sampai 580 nm, dan berdiameter antara 11 sampai 13 nm. Genom Potexvirus
adalah RNA positif utas tunggal, berukuran 5.8 sampai 7.0 kb dan memiliki lima
Open Reading Frame (ORF). ORF1 mengkode protein yang berhubungan dengan replikasi virus, ORF2 sampai 4 berfungsi sebagai Triple Gene Block (TGB) dan mengkode gen yang berhubungan dengan perpindahan virus dari sel ke sel. ORF5 mengkode coat protein virus (Gambar 4) (Agrios 2005; van der vlugt dan Barendsen 2002).
55’ (A)n
Gambar 4 Genom CymMV, salah satu anggota genus Potexvirus. RdRp :
RNA-dependent RNA polymerase, TGB : triple gene block, MP :
8
Deteksi dan Identifikasi Virus
Deteksi dan identifikasi secara tepat virus penyebab penyakit merupakan langkah penting pertama untuk menentukan strategi pengendalian penyakit. Pengendalian setelah terjadi infeksi virus sering tidak memberikan hasil yang memuaskan. Pengendalian virus lebih efektif jika dilakukan sebelum terjadi infeksi. Penggunaan bahan tanaman bebas virus merupakan pendekatan pengendalian yang paling efektif. Salah satu bagian penting untuk memproduksi bahan tanaman bebas virus adalah tersedianya metode diagnosis yang sensitif (Makkouk dan Kumari 2006).
Teknik deteksi dan identifikasi virus terbagi dalam dua kategori yaitu : berdasarkan sifat-sifat biologi yang berhubungan dengan interaksi virus dengan inang dan atau vektor dan berdasarkan bagian dari partikel virus, yaitu asam nukleat dan CP (Naidu dan Hughes 2003). Deteksi dan identifikasi berdasarkan sifat biologi virus adalah berdasarkan tipe gejala yang muncul, kisaran inang, penularan melalui vektor, sifat-sifat fisik virus (titik panas inaktivasi, titik batas pengenceran dan ketahanan in vitro), dan pengamatan partikel virus dengan mikroskop elektron. Sedangkan berdasarkan CP dan asam nukleat bisa dilakukan dengan uji serologi dan teknik molekuler.
Pengamatan Partikel Virus Menggunakan Mikroskop Elektron
Mikroskop elektron merupakan alat yang dapat digunakan untuk mengamati bentuk partikel virus, sebagai dasar identifikasi virus tertentu yang belum diketahui identitasnya. Dengan mikroskop elektron identitas virus dapat diketahui dengan mengamati bentuk partikel virus, panjang partikel virus, dan morfologinya. Partikel virus yang akan diamati akan lebih jelas apabila dipurifikasi terlebih dahulu. Pengamatan partikel virus dari sap tanaman yang belum dipurifikasi biasanya merupakan ekstrak sap yang kasar sehingga pada hasil pengamatan akan terlihat kotoran sap disekitar partikel virus (Doi et al. 1969; Djikstra dan De Jagger 1998).
Penggunaan transmission electron microscope (TEM) selama tahun 1970 sampai 1980 telah berkontribusi pada penemuan beberapa virus penting pada manusia, seperti Adenovirus, Entrovirus, Paramyxovirus dan Reovirus yang diisolasi dari sel. Pada masa itu, TEM digunakan sebagai teknik rutin dalam deteksi virus. Setelah teknik ELISA dan PCR ditemukan, penggunaan TEM pada deteksi virus telah bergeser dari teknik rutin menjadi teknik penunjang dalam deteksi agen infeksius yang belum diketahui, karena teknik ELISA dan PCR lebih sensitif. Selain itu, TEM tidak bisa digunakan untuk deteksi cepat virus pada sampel yang banyak, relatif mahal baik alatnya maupun perawatannya, sehingga banyak insitusi penelitian pertanian yang tidak mampu memilikinya. Namun demikian, TEM masih digunakan untuk mempelajari siklus hidup virus pada sel inangnya, dan deteksi cepat patogen baru atau yang belum diketahui misalnya pada kasus bioterorisme. Dengan menggunakan TEM, maka akan terlihat semua morfologi patogen pada sampel yang diamati (Roingeard 2008; Naidu dan Hughes 2003).
9 / sel tersebut, akan dapat dilihat interaksi virus-sel, termasuk tahapan replikasi virus. Teknik pewarnaan negatif ini dapat dikombinasikan dengan metode serologi untuk melokalisasi antigen virus (Marshal 2012). Penggabungan TEM dengan metode serologi menggunakan antiserum monoklonal ataupun poliklonal merupakan teknik deteksi virus yang cepat dan akurat. Antiserum VP 664 mampu mengaglutinasi lebih banyak partikel White spot syndrome virus pada kerang laut dengan reaksi antigen – antiserum, sehingga lebih banyak partikel virus yang teramati di bawah TEM (Hipolito et al. 2012). Teknik pewarnaan negatif yang telah dioptimasi, dapat digunakan sebagai protokol umum untuk mempelajari struktur protein di bawah mikroskop elektron, terutama protein highly dynamic
dengan struktur equilibrium-fluctuating (Zhang et al. 2013).
Deteksi dan Identifikasi Virus Berdasarkan Sifat Biomolekuler
Serologi. Beberapa teknik serologi yang bisa digunakan adalah dot immunoblotting assay (DIBA), immunosorbent electron microscopy (ISEM) (Naidu dan Hughes 2003), enzyme-linked immunosorbent assay (ELISA) dan
tissue blot immunoassay (TBIA) (Webster et al. 2004). ELISA merupakan uji serologi yang populer untuk deteksi virus pada materi tanaman, serangga vektor, benih dan bahan tanaman vegetatif (Naidu dan Hughes 2003). Keuntungan dari teknik ELISA adalah memiliki sensitifitas yang tinggi, dapat mendeteksi sampel dalam jumlah besar lebih cepat, hanya membutuhkan antiserum dalam jumlah sediki dan hasilnya kuantitatif (Agrios 2005). Namun demikian, teknik ELISA, seperti teknik serologi lainnya, memiliki kelemahan, yaitu tidak bisa membedakan virus yang sekerabat, terutama bila yang digunakan antiserum universal genus. Selain itu, beberapa antigenic site dimiliki oleh virus yang tidak sekerabat, sehingga memungkinkan terjadinya reaksi silang (Putnam 1995).
Terdapat dua teknik ELISA, yaitu Double Antibody Sandwich ELISA (DAS-ELISA atau ELISA secara langsung) dan Indirect ELISA (ELISA tidak langsung). Perbedaan pada kedua teknik ini telah dijelaskan oleh Clark dan Adams (1977) serta Koenig (1981), yaitu pada coating microtiter plates-nya dengan antiserum atau antigen. Pada teknik DAS-ELISA, plate langsung dicoating dengan antiserum spesifik yang kemudian berikatan dengan antigennya (virus), sedangkan pada teknik Indirect ELISA, plate dicoating dengan antigen dulu, baru dicoating dengan antiserumnya.
Penggunaan teknik Indirect ELISA untuk mengamati reaktivitas antiserum
Chrysanthemum B Carlavirus (CVB) menunjukkan bahwa semakin tinggi pengenceran antiserum dan sampel menghasilkan reaksi yang semakin lemah. Sensitifitas teknik ELISA dalam mendeteksi CVB cukup tinggi, yaitu virus masih terdeteksi pada pengenceran sampel 1/256 dan antiserum 100 000 kali (Temaja et al. 2010). Dengan teknik Indirect ELISA, CymMV dan Odontoglossum ringspot virus (ORSV) terdeteksi pada Dendrobium yang diperbanyak secara vegetatif, dan tidak terdeteksi pada Dendrobium hasil kultur jaringan (Khentry et al. 2006).
10
Polymerase chain reaction (PCR). PCR merupakan teknik yang memungkinkan amplifikasi spesifik dan deteksi runutan target DNA dari campuran komplek asam nukleat. Kombinasi primer spesifik dan DNA polymerase, yang digunakan untuk mengamplifikasi runutan target melalui siklus
denaturasi, annealing, dan sintesis DNA yang berulang memungkinkan terjadinya peningkatan jumlah DNA (Seal dan Coates 1998). Teknik ini memiliki beberapa kelebihan, yaitu lebih sensitif dan spesifik, dapat digunakan untuk mendeteksi virus yang telah diketahui maupun yang belum diketahui, yang tidak memiliki antiserum, belum tersedia banyak informasi, dan juga bisa untuk mendeteksi virus dari tanaman berkayu (Agrios 2005; Naidu dan Hughes 2003). Namun demikian, teknik PCR sulit dilakukan di beberapa laboratorium yang memiliki keterbatasan dana, karena teknik ini memerlukan peralatan dan bahan – bahan yang relatif mahal. Selain itu, sensitifitas teknik ini menyebabkan peralatan dan proses pengerjaan PCR harus selalu steril untuk mencegah hasil positif yang palsu (false positive), karena kontaminan bisa menjadi DNA templat (Johnson 2000).
Proses PCR terdiri dari 20 atau 30 siklus, yang masing-masing siklus terdiri dari tiga tahap : (1) DNA utas ganda dipanaskan pada suhu 94 sampai 96
o
C untuk memisahkannya menjadi utas yang terpisah, (2) tahap annealing atau penempelan primer pada utas DNA yang dilakukan pada suhu 45 sampai 60 oC, (3) ekstensi setiap primer, selalu terjadi pada suhu 72 oC menggunakan DNA
thermostable (Akinjogunla et al. 2008). Dalam beberapa jam, runutan target diamplifikasi dalam jumlah besar dan hasilnya dapat dianalisis dengan gel agarosa yang dielektroforesis, kemudian diwarnai dengan ethidium bromide untuk melihat keberadaan DNA hasil amplifikasi (Naidu dan Hughes 2003).
Untuk diagnosis virus tanaman yang memiliki asam nukleat RNA, RNA target dikonversikan menjadi complementary DNA (cDNA) yang dikopi dengan transkripsi balik sebelum PCR dimulai. Pada siklus awal PCR, DNA akan disintesis berdasarkan cDNA templat menghasilkan DNA utas ganda. Proses amplifikasi dinamakan RT-PCR (Naidu dan Hughes 2003). Teknik RT-PCR telah banyak digunakan untuk mendeteksi virus – virus tanaman yang memiliki genom RNA. Teknik RT-PCR berhasil mendeteksi sampel positif ACLSV, ASGV, dan ASPV pada apel lebih banyak 8.6% dibandingkan dengan teknik ELISA (Caglayan et al. 2006).
Beberapa pengembangan lain dari teknik PCR, diantaranya adalah
Immunocapture-PCR (IC-PCR) (Webster et al. 2004) dan Bio-PCR (Schaad dan Frederick 2002). Teknik PCR yang dikembangkan untuk mendeteksi beberapa target sekaligus, dinamakan Multiplex PCR. Teknik ini menggunakan beberapa pasang primer yang berbeda dalam satu reaksi PCR. Multiplex PCR merupakan teknik yang cepat, mudah dilakukan dan lebih ekonomis untuk deteksi rutin beberapa virus dalam satu sampel, dan telah berhasil digunakan untuk deteksi virus dari beberapa tanaman (Lee dan Chang 2006).
Teknik multiplex RT-PCR dengan menggunakan pasangan primer spesifik, telah berhasil mendeteksi infeksi CymMV dan Odontoglossum ringspot virus
(ORSV) pada anggrek (Lee dan Chang 2006) dan Dasheen mosaic virus (DsMV),
Turnip mosaic virus (TuMV), Konjac mosaic virus (KoMV), serta Zantedeschia mild mosaic virus (ZaMMV) pada tanaman Calla lily di Taiwan (Hu et al. 2010).
11 Oleh karena itu, optimasi harus dilakukan untuk meminimalkan produk yang tidak diinginkan. Beberapa optimasi yang perlu dilakukan adalah : (1) optimasi kondisi siklus multiplex RT-PCR, yang meliputi suhu dan waktu ekstensi, serta suhu dan waktu annealing; (2) optimasi komponen reaksi multiplex, yang meliputi konsentrasi primer, konsentrasi dNTP dan MgCl2, konsentrasi bufer PCR,
konsentrasi templat DNA dan DNA polimerase serta penggunaan adjuvants
seperti DMSO, glyserol dan BSA. Optimasi tersebut dilakukan dengan pendekatan empiris atau trial and error, karena tidak diketahui cara untuk memprediksi kinerja pasangan primer yang dipilih. Oleh karena itu, perlu didesain primer – primer yang digunakan dengan memperhatikan GC content, panjang primer, dan sekuennya (Henegariu et al. 1997; Elnifro et al. 2000).
Penggunaan beberapa pasangan primer dalam satu reaksi multiplex RT-PCR sering menyebabkan kendala dalam pelaksanaannya, yaitu menyebabkan teknik ini kurang bersifat universal dan memerlukan optimasi yang ekstensif. Untuk mengatasi kendala tersebut, metode universal multiplex PCR diciptakan dengan menggunakan universal adapter-F dan universal adapter-R yang dihubungkan ke primer forward dan reverse. Dengan teknik ini, maka pasangan - pasangan primer yang berbeda suhu annealingnya bisa digunakan untuk mendeteksi secara cepat keragaman genetik jagung. Teknik ini juga bisa digunakan untuk analisis polimorfisme, pengujian kuantifikasi dan identifikasi spesies (Wen dan Zhang 2012).
METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dari bulan Januari 2012 sampai Maret 2013.
Pengambilan Sampel
Pengambilan sampel daun tanaman nilam, baik yang bergejala maupun tidak, dilakukan di dua Kebun Percobaan Balittro yaitu di Cicurug (Sukabumi) dan Manoko (Bandung Barat), serta di lahan petani di Cijeruk (Bogor). Setiap lokasi dilakukan pengambilan sampel sebanyak 30 tanaman yang terdiri dari 5 sampel diambil dari tanaman yang tidak bergejala, dan sisanya tanaman yang bergejala. Pengambilan sampel dilakukan secara acak, baik pada tanaman yang bergejala maupun tidak. Dokumentasi gejala di lapangan juga dilakukan untuk keperluan deskripsi gejala.
Pengamatan Partikel Virus
12
of International Agricultural Development, Tokyo University of Agriculture
(Jepang), serta di lembaga Eijkman, Jakarta. Pengamatan dilakukan dengan metode pewarnaan negatif dengan menggunakan grid berukuran 400 mesh, di bawah mikroskop elektron.
Deteksi Serologi
Sampel yang didapatkan dari lapangan, dideteksi secara serologi dengan menggunakan antiserum universal Potyvirus, antiserum spesifik BBWV2 dan CymMV (DSMZ, Jerman), serta antiserum spesifik CMV (Agdia, USA). Uji serologi dilakukan untuk mengetahui kejadian infeksi Potyvirus, BBWV2, CMV dan CymMV dari setiap lokasi pengambilan sampel. Sampel yang didapatkan dari setiap lokasi, yaitu sebanyak 30, dibuat menjadi 6 sampel komposit, dimana setiap komposit terdiri dari 5 sampel. Selanjutnya, bila sampel komposit menunjukkan hasil positif, uji serologi dilanjutkan terhadap setiap individu sampel dari sampel komposit positif tersebut.
Teknik DAS-ELISA untuk antiserum BBWV2 dan CymMV mengacu pada pedoman DSMZ. Antiserum (IgG), dilarutkan pada bufer coating (sodium carbonate 1.59 g; sodium bicarbonate 2.93g; sodium azide 0.2 g; aquades 1 L, pH 9.6), dengan perbandingan sesuai yang dianjurkan, kemudian dimasukkan ke dalam sumuran plat mikrotiter sebanyak 100 µl, diinkubasi pada suhu 37 oC, selama 2 sampai 4 jam. Plat mikrotiter dicuci dengan PBST (Phosphate Buffered Saline Tween : sodium chloride 8.0 g; monobasic potassium phosphate 0.2 g;
dibasic sodium phosphate 1.15 g; potassium chloride 0.2 g; aquades 1 L; pH 7.4;
tween 20 0.5 ml) tiga kali. Sampel digerus pada bufer ekstraksi (PBST + 2% PVP (Polyvinyl pyrrolidone)) dengan perbandingan 1:5 (b/v), dimasukkan ke sumuran plat mikrotiter sebanyak 100 µl, diinkubasi pada suhu 4 oC semalaman. Plat mikrotiter dicuci dengan PBST tiga kali. Enzim konjugat (IgG-AP) disiapkan, dilarutkan pada bufer konjugat (bufer ekstraksi + 0.2% egg albumin (Sigma A-5253)), dengan perbandingan sesuai yang dianjurkan, dimasukkan ke sumuran plat mikrotiter, diinkubasi pada suhu 37 oC, selama 4 jam. Plat mikrotiter dicuci dengan PBST tiga kali. Substrat, yaitu p-nitrophenyl phosphate (PNP) dilarutkan ke bufer substrat (diethanolamine 97 ml; sodium azide 0.2 g; aquades 1 L; pH 9.8), kemudian dimasukkan ke setiap sumuran plat mikrotiter, diinkubasi pada suhu ruang pada kondisi gelap, selama 30 sampai 60 menit, atau sampai diperoleh reaksi yang jelas.
13 mikrotiter dicuci tiga kali dengan PBST. PNP dilarutkan pada bufer substrat, dimasukkan ke setiap sumuran sebanyak 100 µl, diinkubasi pada suhu ruang pada kondisi gelap, selama 30 sampai 60 menit, atau sampai reaksi yang jelas diperoleh.
Prosedur Indirect-ELISA untuk antiserum CMV sesuai dengan anjuran dari Agdia : sampel digerus pada bufer ekstraksi. Sampel sebanyak 100 µl dimasukkan ke plat mikrotiter, diinkubasi semalam pada suhu 4 oC. Plat mikrotiter dicuci dengan larutan PBST 1x, 3 sampai 5 kali, sampai bersih. Antiserum primer (IgG) dilarutkan dalam bufer konjugat dengan perbandingan sesuai yang direkomendasikan, kemudian dimasukkan sebanyak 100 µl ke setiap sumuran plat mikrotiter, diinkubasi selama 1 sampai 2 jam pada suhu ruang. Plat mikrotiter dicuci dengan PBST 1x sebanyak tiga kali. Enzim konjugat GAR-AP (Goat anti-rabbit yang telah dilabel dengan enzim Alkaline phosphatase) dilarutkan dalam bufer konjugat, dimasukkan ke sumuran plat sebanyak 100 µl, diinkubasi selama 1 jam pada suhu ruang. Plat dicuci dengan PBST 1x, sebanyak 3 kali. Tablet PNP dilarutkan dalam bufer PNP, dimasukkan ke sumuran plat sebanyak 100 µl, diinkubasi selama 15 menit sampai 4 jam pada ruang gelap, sampai terjadi perubahan warna.
Titer virus secara kuantitatif dibaca menggunakan ELISA READER model 550 (Bio-Rad, USA) pada panjang gelombang 405 nm. Hasil pembacaan Philekorea Technology). Bufer XPRB disiapkan dengan menambahkan 1%
mercaptoethanol (ME). Sampel daun nilam sebanyak 0.1 g digerus menggunakan nitrogen cair pada mortar, sampai menjadi serbuk. Serbuk sampel ditambah bufer XPRB yang telah ditambah ME, dimasukkan ke dalam kolom filter dan disentrifugasi selama 2 menit pada kecepatan 13 000 rpm. Supernatan dipindahkan ke tabung eppendorf baru dan etanol absolut ditambahkan sebanyak 0.5 kali volume supernatan, dan dicampur dengan cara dipipet atau dibolak-balik. Kemudian supernatan dalam alkohol dimasukkan ke dalam kolom XPPLR mini, dan disentrifugasi selama 1 menit pada kecepatan 13 000 rpm. Setelah supernatan dibuang, kolom diberi wash buffer 1 (WB1) sebanyak 500 µl, disentrifugasi selama 1 menit, dan supernatan dibuang. Wash buffer 2 (WB2) sebanyak 750 µl ditambahkan ke dalam kolom, disentrifugasi selama 1 menit, dan supernatan dibuang. Selanjutnya, untuk mengeringkan kolom, dilakukan sentrifugasi kolom selama 3 menit pada kecepatan 13 000 rpm. RNA total dikoleksi dengan cara memberikan air bebas nuklease sebanyak 50 µl ke pusat membran kolom XPPLR yang diletakkan pada tabung eppendorf baru, dibiarkan selama 1 menit, lalu disentrifugasi selama 2 menit. RNA yang telah diperoleh disimpan di freezer -80
o
14
Konstruksi cDNA (complementary DNA)
Reaksi reverse transcription (RT) dilakukan untuk membuat cDNA dengan menggunakan enzim reverse transcriptase. Adapun reaksi RT dilakukan dalam 10 µl reaksi campuran yang terdiri dari air bebas nuklease (3.7 µl), bufer RT 5x (2 µl), DTT 50 mM (0.35 µl), dNTP 10 mM (0.5 µl), M-MuLV Rev (Fermentas) (0.35 µl), RNase Inhibitor (0.35 µl), Oligo d(T) 10 µM (0.75 µl) dan RNA templat (2 µl) selama 1 jam pada suhu 42 oC.
Amplifikasi DNA dan Multiplex Reverse Transcription Polymerase Chain Reaction (RT-PCR)
Amplifikasi DNA. Sepasang primer degenerate untuk BBWV1 dan BBWV2 (BBWVSSP dan BBWVKMRM), digunakan dalam deteksi awal BBWV2 pada nilam. Dengan primer ini, ukuran produk yang didapatkan sebesar 323 pb, yang merupakan bagian dari C-terminal Large Coat Protein (LCP) sampai N-terminal Short Coat Protein (SCP) Selanjutnya, untuk mendapatkan keseluruhan bagian gen CP, yang berukuran 2 000 pb, digunakan primer
degenerate BBWV (BBWV25 dan BBWV3487M) (Kondo et al. 2005) (Tabel 1). Untuk mendeteksi Potexvirus pada nilam, digunakan sepasang primer universal Potexvirus, yang mengamplifikasi bagian RNA dependent RNA polymerase
(RdRp/replikase) (Miglino et al. 2011). Selanjutnya, untuk mengamplifikasi keseluruhan gen CP CymMV, digunakan sepasang primer spesifik CyCP-F1 dan CyCP-R1 (Lee dan Chang 2008) (Tabel 1). Deteksi Potyvirus secara molekuler menggunakan primer degenerate P9502 dan CPUP, yang mengamplifikasi wilayah CP Potyvirus (Van der vlugt et al 1999).
Tabel 1 Primer - primer yang digunakan untuk deteksi virus mosaik nilam
No. Pasangan
2 BBWV25 5’-AATGARRTKGTNCTCAAYTA-3’ 2 000
pb
Kondo et al. (2005)
BBW3487M 5’-AMAMAGGTCATGGAACCCA-3’.
3 Potex4 5’-AGCATGGCGCCATCTTGTGACTG-3’ 280 pb Miglino et
al. (2011)
Potex5 5’-CTGAAGTCACAATGGGTGAAGAA-3’
4 CyCP-F1 5-ATGGGAGAGYCCACTCCARCYCCAGC-3′ 679 pb
800 pb
15 masing – masing 1 µl dan DNA templat 1 µl. Program PCR diatur berbeda, tergantung pasangan primer yang digunakan (Tabel 2).
Tabel 2 Program Amplifikasi untuk setiap primer yang digunakan dalam kegiatan PCR
Denaturasi awal pada suhu 95 oC selama 5 menit; 35 siklus terdiri dari 95 oC selama 1 menit, 51 oC selama 1 menit selama 30 detik, ekstensi akhir 72 oC selama 7 menit.
Denaturasi awal pada suhu 94 oC selama 5 menit, 45 siklus : 94 oC selama 1 menit; 54 oC selama 2 menit; 72 oC selama 1 menit, ekstensi akhir 72 oC selama 10 menit.
Lee dan Chang menginfeksi nilam secara simultan, dilakukan optimasi multiplex RT-PCR
Potyvirus, BBWV2 dan CymMV. Primer yang digunakan adalah primer
degenerate Potyvirus, P9502 dan CPUP (800 pb), primer degenerate BBWV, BBWVVSSP dan BBWVKMRM (323 pb), serta primer spesifik CymMV, CyCP-F1 dan CyCP-R1 (679 pb). Untuk optimasi reaksi multiplex RT-PCR, digunakan beberapa kombinasi konsentrasi primer sebagai berikut (Tabel 3):
Tabel 3 Kombinasi total konsentrasi primer Potyvirus, BBWV2, dan CymMV
16
cDNA yang dihasilkan dari hasil RT, diamplifikasi pada reaksi campuran PCR mix (Go Green Taq-Promega) 12.5 µl, primer forward dan reverse 10 µM, masing – masing sesuai konsentrasi primer pada Tabel 3, DNA template 1 µl, dan air bebas nuklease ditambahkan sampai volume 25 µl. Program PCR terdiri dari 1 siklus 95 oC selama 5 menit, 10 siklus pada suhu 95 oC selama 1 menit; 51 oC selama 1 menit; 72 oC selama 1 menit, 30 siklus pada suhu 94 oC selama 1 menit; 54 oC selama 1 menit; 72 oC selama 2 menit, ekstensi akhir 72 oC selama 10 menit.
Visualisasi DNA
DNA hasil amplifikasi PCR divisualisasi pada gel agarosa 1 atau 1.5 % yang telah ditambah ethidium bromide (0.5 µl/10 ml 0.5x TBE). Sampel dimasukkan ke dalam sumuran gel agarosa, kemudian dielektroforesis pada 50 Volt selama 50 menit. Hasil visualisasi dilihat di bawah transilluminator ultraviolet dan didokumentasi dengan kamera digital.
Analisis Runutan Nukleotida dan Asam amino
Perunutan Susunan Nukleotida
Perunutan susunan nukleotida menggunakan mesin sequencer ABI-Prism 3100-Avant Genetic Analyzer di laboratorium Research and Development Centre
PT. Genetika Science Indonesia. Hasil runutan dianalisis menggunakan software Blast (www. NCBI. Nml. Niv.gov) dan software Wu-Blast (www.ebi.ac.uk). Contiq hasil perunutan DNA dilakukan dengan bantuan program Sequencher4.8 dan software Complementor (www.justbio.com). Selanjutnya, hasil runutan yang sudah diolah, diterjemahkan menjadi urutan protein (asam amino), dengan bantuan software Translate ( www.expasy.org.tools).
Analisis Identitas Matriks dan Filogenetika
Hasil runutan yang telah diolah, dibandingkan tingkat homologi runutan gen CP dan asam aminonya dengan beberapa genom virus dari berbagai negara yang diambil dari database GenBank.
Matriks identitas nukleotida dan asam amino diperoleh dengan menggunakan software BioEdit versi 7.0. Selanjutnya, gambar pensejajaran susunan nukleotida didapatkan dengan menggunakan program GeneDoc versi 2.7.000.
17
HASIL DAN PEMBAHASAN
Gejala Infeksi Virus pada Nilam
Infeksi virus pada tanaman nilam menyebabkan gejala mosaik dengan beberapa variasi, yaitu mosaik lemah, bintik kuning, mosaik hijau muda hijau tua, dengan penebalan pada warna hijau tua, mosaik dengan perubahan bentuk pada daun (malformasi) serta mosaik hijau tua dan kuning (Gambar 5). Gejala mosaik, baik mosaik, mosaik hijau muda hijau tua, serta mosaik hijau tua dan kuning, ditemukan di semua lokasi pengambilan sampel. Sedangkan gejala bintik kuning hanya ditemukan pada sampel asal Cicurug.
Penelitian sebelumnya menemukan bahwa sampel dari Bogor, Cianjur, Sukabumi dan Garut (Jawa Barat), Pakpak Barat (Sumatera Utara) serta Pasaman Barat (Sumatera Barat) menunjukkan gejala mosaik yang bervariasi juga. Gejala mosaik lemah sampai parah menunjukkan terinfeksi oleh Potyvirus secara tunggal. Sedangkan gejala mosaik parah yang ditemukan di Brebes (Jawa Tengah) disebabkan oleh infeksi tunggal BBWV2 (Noveriza et al. 2012a). Gejala mosaik dilaporkan sebelumnya pada pertanaman nilam di India yang terinfeksi PStV (Potyvirus) (Singh et al. 2009), dan di Jepang yang terinfeksi oleh PatMMV (Fabavirus) (Natsuaki et al. 1994).
Gambar 5 Gejala infeksi virus pada tanaman nilam di lapangan. a. tidak bergejala, b dan c. mosaik lemah, d – g. variasi gejala mosaik, h. bintik kuning
Kejadian Infeksi Virus pada Pertanaman Nilam
Hasil uji serologi menunjukkan bahwa BBWV2 dan Potyvirus
menginfeksi tanaman nilam di ketiga lokasi pengambilan sampel, CymMV ditemukan di Cicurug dan Manoko, sedangkan CMV ditemukan di Manoko dan
a
h g
f e
d c
18
Cijeruk. Infeksi Potyvirus dan BBWV2 di Manoko menunjukkan kejadian paling tinggi (100%), dan yang terendah CymMV (3.3%). Demikian juga di Cicurug, kejadian infeksi Potyvirus tertinggi (83.3%), diikuti dengan CMV (80.0%), BBWV2 (73.3%) dan yang terendah CymMV (3.3%). Infeksi virus tertinggi di Cijeruk adalah BBWV2 (90.0%), diikuti dengan Potyvirus (50.0%) dan CMV (13.3%) (Tabel 4). Hasil ini menunjukkan bahwa pada pertanaman nilam di ketiga lokasi tersebut telah terinfeksi oleh beberapa virus dengan kejadian penyakit yang tinggi.
Infeksi BBWV2 sebelumnya dilaporkan ditemukan di pertanaman nilam di Brebes (Noveriza et al. 2012a). Ditemukannya BBWV2 di Cicurug, Manoko dan Cijeruk, serta CymMV di Manoko dan Cicurug menunjukkan bahwa infeksi kedua virus tersebut telah menyebar ke daerah lain, padahal sebelumnya
Potexvirus tidak ditemukan di Cicurug dan Bogor (Sukamto et al. 2007)
Berbeda dengan penelitian sebelumnya oleh Noveriza et al. (2012a), gejala yang ditemukan pada ketiga lokasi, berdasarkan uji serologi bereaksi positif dengan 2 sampai 4 antiserum yang digunakan. Hal ini menunjukkan bahwa infeksi virus pada pertanaman nilam sudah lebih parah dari tahun – tahun sebelumnya karena terjadi infeksi ganda virus.
Tabel 4 Kejadian infeksi Potyvirus, BBWV2, CymMV, CMV dan TMV pada pertanaman nilam di Manoko, Cicurug dan Cijeruk
Lokasi Kejadian Infeksi (%)*
Pada tanaman yang tidak bergejala, juga terdeteksi terinfeksi oleh
Potyvirus, CMV, BBWV2 dan CymMV, baik secara tunggal maupun ganda (Lampiran 1). Hasil yang sama juga diperoleh pada penelitian – penelitian terdahulu. Infeksi PatVX (Potexvirus) pada pertanaman nilam di Brazil, tidak menunjukkan gejala (Filho et al. 2002). PatMMV dan PatMoV terdeteksi juga pada tanaman nilam yang tidak bergejala (Natsuaki et al. 1994). Oleh karena itu identifikasi jenis virus tidak bisa dilakukan berdasarkan deskripsi gejala saja karena terjadinya infeksi virus baik tunggal maupun ganda menyebabkan gejala yang sangat bervariasi, bahkan tidak bergejala.
Untuk mendapatkan gejala yang khas dari setiap infeksi virus, maka perlu dilakukan pemurnian virus dari sampel yang didapatkan pada tanaman indikator virus target. Pemisahan Tobacco mosaic virus (TMV), Tomato mosaic virus
19 Berdasarkan hasil deteksi virus dan pengamatan gejala pada tanaman, ditemukan bahwa tanaman dengan gejala yang parah pada umumnya berasosiasi dengan infeksi ganda virus, atau infeksi ganda virus mungkin menyebabkan gejala yang lebih parah pada tanaman. Hal ini, diduga disebabkan oleh beberapa faktor, diantaranya ketahanan tanaman, kondisi lingkungan yang mendukung (suhu, kelembaban, vektor) dan virulensi virus. Berdasarkan ELISA, tanaman nilam varietas Lhokseumawe dan Tapak Tuan dari UPBS Balittro terdeteksi Potyvirus, sedangkan varietas Sidikalang tidak terdeteksi terinfeksi virus (Noveriza et al.
2012b). Hasil yang berbeda didapatkan pada penelitian ini, yaitu varietas Sidikalang di ketiga lokasi pengambilan sampel terdeteksi terinfeksi virus. Hal ini menunjukkan bahwa varietas – varietas tanaman nilam yang dimiliki oleh Balittro rentan terhadap infeksi virus. Keberadaan vektor di lapangan paling berperan dalam penyebaran virus, karena selain membawa virus ke pertanaman, juga menularkan virus dari tanaman sakit ke tanaman sehat (Agrios 2005). A. gossypii
sebagai salah satu hama pada tanaman nilam, berperan sebagai vektor Potyvirus,
CMV dan BBWV. Keberadaan vektor yang membawa tiga virus ini diduga merupakan penyebab meluasnya infeksi beberapa virus pada tanaman nilam.
Infeksi BBWV2 di Manoko dan Cicurug ditemukan selalu bersamaan dengan infeksi Potyvirus, bahkan pada beberapa sampel dari Cicurug, terinfeksi tiga virus dengan CMV. Sebaliknya, infeksi Potyvirus ditemukan tunggal pada beberapa sampel, dengan titer yang lebih tinggi dibandingkan BBWV2 dan CMV. Hasil yang berbeda di lokasi Cijeruk, dimana infeksi Potyvirus ditemukan selalu bersamaan dengan infeksi BBWV2, sedangkan infeksi tunggal BBWV2 ditemukan pada beberapa sampel. Namun demikian, titer Potyvirus tetap terlihat lebih tinggi dibandingkan BBWV2 dan CMV (Lampiran 1). Diduga Potyvirus
merupakan virus yang dominan pada tanaman nilam dibandingkan BBWV2, CMV dan CymMV. Infeksi ganda Potyvirus dengan CMV pada tanaman melon juga memperlihatkan konsentrasi Potyvirus yang lebih tinggi (Grafton-Cradwell et al. 1996).
Selain pemurnian virus, untuk mendapatkan gejala yang khas dari setiap virus, juga perlu dilakukan kajian tentang jenis interaksi antara virus – virus yang menginfeksi tanaman nilam. Interaksi antara beberapa virus pada infeksi campuran, bisa bersifat antagonis atau sinergis. Interaksi antagonis terjadi bila infeksi virus pertama akan mencegah infeksi virus kedua. Sedangkan interaksi sinergis terjadi bila infeksi campuran akan menyebabkan peningkatan multiplikasi dari satu atau semua virus, dan menyebabkan gejala lebih parah dibandingkan pada infeksi tunggal (Syller 2012).
Gejala parah yang ditemukan di ketiga lokasi pengambilan sampel diduga juga disebabkan oleh interaksi sinergis antara virus – virus yang menginfeksi tanaman nilam. Keparahan gejala akibat interaksi sinergis juga terjadi pada infeksi ganda Blackberry yellow vein associated virus (Crinivirus) (BYVaV) dengan
Blackberry Virus Y (BVY) (Potyvirus), dimana infeksi ganda keduanya menyebabkan gejala penguningan pada pembuluh daun tanaman Blackberry,
20
ganda antara Zucchini yellow mosaic virus (ZYMV) (Potyvirus) dan CMV, dimana interaksi keduanya bersifat sinergis (Malik et al. 2010).
Titer Potyvirus tidak berbeda, baik pada infeksi tunggal maupun infeksi ganda. Sebaliknya, titer BBWV2 pada infeksi campuran dengan Potyvirus dua kali lipat lebih tinggi dibandingkan pada infeksi tunggal (Lampiran 1). Hasil ini menunjukkan bahwa infeksi ganda BBWV2 dengan Potyvirus merupakan interaksi sinergis, yang menyebabkan peningkatan titer BBWV2 pada tanaman. Interaksi sinergis yang menyebabkan peningkatan titer virus juga terjadi pada infeksi ganda PVX dengan TMV atau Tomato mosaic virus (ToMV) pada daun tomat, yaitu titer PVX pada infeksi ganda terlihat lebih tinggi dibandingkan infeksi tunggal, berdasarkan uji serologi dengan DAS-ELISA. Peningkatan titer virus pada infeksi ganda, juga berkorelasi dengan peningkatan keparahan penyakit dibandingkan pada infeksi tunggal (Balogun et al. 2002; Balogun 2008).
Namun demikian, perlu dilakukan penelitian lanjutan untuk melihat interaksi antara virus – virus yang menginfeksi tanaman nilam, dengan membandingkan gejala yang diakibatkan oleh infeksi tunggal dan infeksi ganda. Pada penelitian ini, tidak dilakukan pengamatan perbedaan gejala yang diakibatkan oleh infeksi tunggal dan campuran.
Perbanyakan nilam secara konvensional dilakukan secara vegetatif, yaitu dengan stek batang. Hal ini menjadi salah satu penyebab terjadinya peningkatan infeksi virus pada pertanaman nilam jika dalam perbanyakan stek tidak memperhatikan kesehatan tanaman nilam. Untuk itu, perlu dilakukan upaya untuk mendapatkan bibit nilam yang sehat, misalnya dengan kultur jaringan stek nilam bebas virus. Tanaman nilam hasil kultur meristem terdeteksi bebas PStV sebesar 66.67% dengan RT-PCR (Singh et al. 2009). Selanjutnya, untuk menurunkan penyebaran virus pada tanaman nilam di lapangan dapat dilakukan dengan teknik rekayasa genetika. Teknik rekayasa genetika dengan memasukkan precursor gen CP, berhasil mendapatkan 21 tanaman transgenik dari 24 tanaman yang digunakan. Dua minggu setelah inokulasi PatMMV, tanaman transgenik yang dihasilkan terlihat sehat, sedangkan tanaman non transgenik daunnya keras, menguning dan tanaman menjadi kerdil. Hasil ini menunjukkan bahwa tanaman transgenik yang dihasilkan resisten terhadap PatMMV (Kadotani dan Ikegami 2002).
Pengamatan Partikel Virus
Pengamatan partikel virus pada sampel tanaman yang terinfeksi virus dengan menggunakan mikroskop elektron merupakah teknik cepat untuk mengetahui morfologi dan ukuran partikel virus dari daun bergejala. Partikel berbentuk benang lentur, dengan panjang partikel sekitar 1 000 nm, ditemukan pada sampel daun segar tanaman nilam yang terdeteksi secara molekuler sebagai
21
Gambar 6 Mikrograf elektron dari cairan daun nilam yang telah diwarnai dengan
uranyl acetate : a. Partikel Potyvirus, b. Partikel BBWV2, c. Partikel CymMV
berdiameter lebih kurang 30 nm dan 27 nm (Kobayashi et al. 2005; Natsuaki et al.
1994). Dengan ditemukannya dua partikel virus pada 1 sampel, merupakan konfirmasi adanya infeksi campuran beberapa virus berdasarkan deteksi serologi.
Pada sampel yang berbeda, yang terdeteksi secara molekuler terinfeksi oleh CymMV, ditemukan partikel virus berbentuk benang lentur, memiliki panjang partikel lebih kurang 500 nm, yang merupakan ciri partikel Potexvirus
(Gambar 6c). Partikel Mint Virus X asal tanaman mentha juga memiliki bentuk dan panjang partikel yang sama dengan CymMV yang ditemukan pada nilam dalam penelitian ini (Tzanetakis et al. 2006).
Deteksi Potyvirus, BBWV2 dan CymMV secara Molekuler
Potyvirus
Deteksi molekuler beberapa sampel daun nilam bergejala dan tidak bergejala dari ketiga lokasi menggunakan primer degenerate gen CP Potyvirus,
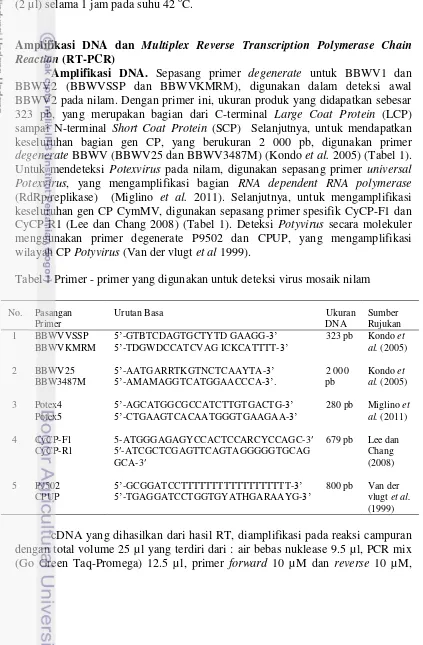
berhasil teramplifikasi pita DNA berukuran 800 pb pada sampel Manoko, Cicurug dan Cijeruk, yang berukuran sama dengan kontrol positif (Gambar 7). Potyvirus
pada tanaman nilam di Indonesia, telah teridentifikasi sebagai TeMV (Noveriza et al. 2012a).
Gambar 7 Hasil visualisasi RT-PCR dengan primer P29502 dan CPUP pada gel agarosa 1.5%. 1-2. Isolat Cijeruk, 3-7. Isolat Cicurug, 8-10. Isolat Manoko, K+. Kontrol positif Potyvirus dari nilam asal Bogor, K-. Kontrol negatif, M. Penanda DNA 100 pb
100 nm
200 nm a b 100 nm c
1 2 3 4 5 6 7 8 9 10 K+ K- M