KERAGAAN
IN VITRO
DAN
IN VIVO
HIBRIDA SOMATIK ANTARA
Solanum melongena
cv. DOURGA DENGAN
Solanum torvum
Sw.
AGUS JOKO SANTOSO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Keragaan In Vitro dan
In Vivo Hibrida Somatik antara Solanum melongena cv. Dourga dengan Solanum torvum Sw. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
Agus Joko Santoso
ABSTRAK
AGUS JOKO SANTOSO. Keragaan In Vitro dan In Vivo Hibrida Somatik antara
Solanum melongena cv. Dourga dengan Solanum torvum Sw. Dibimbing oleh AGUS PURWITO dan ALI HUSNI.
Terung adalah tanaman yang mudah terserang oleh beberapa penyakit. Salah satu usaha perbaikan yang dilakukan adalah merakit kultivar terung dengan kerabat liarnya yang memiliki sifat ketahanan melalui fusi protopas. Penelitian ini dilakukan untuk mempelajari keragaan in vitro dan in vivo hibrida somatik antara
Solanum melongena cv. Dourga dengan Solanum torvum Sw. Penelitian ini merupakan penelitian faktor tunggal dengan tujuh taraf klon, yaitu Solanum melongena cv. Dourga, Solanum torvum Sw., dan 5 klon hibrida somatik (SMST1, SMST2, SMST3, SMST4, and SMST5) yang disusun menggunakan Rancangan Acak Lengkap. Peubah yang diamati antara lain tinggi tanaman, jumlah daun, panjang daun, panjang tangkai daun, jumlah akar, panjang akar, jumlah buku, warna batang, warna tangkai daun, jumlah duri pada permukaan daun, dan bentuk lobus daun. Pada kondisi in vitro, pertumbuhan Solanum torvum Sw. berbeda sangat nyata dengan kelima klon hibrida somatik. Klon SMST1, SMST2, dan SMST4 menunjukkan pertumbuhan yang lebih baik dari klon SMST3 dan SMST5. Pada kondisi in vivo, klon-klon yang diuji memiliki kekerabatan yang lebih dekat dengan Solanum torvum Sw.
Kata kunci: Keragaan fenotipik, Terung pipit, Takokak, Terung putih.
ABSTRACT
AGUS JOKO SANTOSO. In Vitro and In Vivo Variability of Somatic Hybrid between Solanum melongena cv. Dourga with Solanum torvum Sw. Supervised by AGUS PURWITO and ALI HUSNI.
Eggplant is the plant which susceptible to several diseases. One attempt to improve these caracters is combining the eggplant cultivar with its wild relatives through protoplast fusion. The research was conducted to study the variability in vitro and in vivo of somatic hybrids between Solanum melongena cv. Dourga with
Solanum torvum Sw. This study used seven clones, Solanum melongena cv. Dourga, Solanum torvum Sw., and 5 clones of somatic hybrids (SMST1, SMST2, SMST3, SMST4, and SMST5) was arranged with completely randomized design single factor. The variables measured were plant height, number of leaves, leaf length, petiole length, number of roots, root length, number of stem segment, stem color, petiole color, the number of spines on the leaf surface, and leaf blade lobing. In in vitro conditions, the growth of Solanum torvum Sw. significantly different with the five somatic hybrid clones, with higher vigor. Clones SMST1, SMST2, and SMST4 showed better growth than clone SMST3 and SMST5. In in vivo condition, the clones tested had a similarity with Solanum torvum Sw.
6
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
KERAGAAN
IN VITRO
DAN
IN VIVO
HIBRIDA SOMATIK ANTARA
Solanum melongena
cv. DOURGA DENGAN
Solanum torvum
Sw.
AGUS JOKO SANTOSO
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
8
Judul Skripsi : Keragaan In Vitro dan In Vivo Hibrida Somatik antara Solanum melongena cv. Dourga dengan Solanum torvum Sw.
Nama : Agus Joko Santoso NIM : A24080025
Disetujui oleh
Dr. Ir. Agus Purwito, MSc.Agr. Pembimbing I
Dr. Drs. Ali Husni, M.Si. Pembimbing II
Diketahui oleh
Dr. Ir. Agus Purwito, MSc.Agr. Ketua Departemen
PRAKATA
Segala puji penulis panjatkan ke hadirat Allah SWT yang telah memberikan kekuatan dan kemudahan sehingga penulis dapat menyelesaikan penelitian ini dengan baik. Shalawat dan salam senantiasa tercurah kepada Muhammad Saw.
Penelitian yang berjudul Keragaan In Vitro dan In Vivo Hibrida Somatik antara Solanum melongena cv. Dourga dengan Solanum torvum Sw.inididorong oleh keinginan untuk mendapatkan informasi keragaman genetik tanaman terung hasil fusi protoplas dengan melihat keragaman pertumbuhan dan morfologi dari hibrida somatik pada tahap in vitro dan in vivo.
Terima kasih penulis sampaikan kepada Dr. Ir. Agus purwito, MSc.Agr. dan Dr. Drs. Ali Husni, M.Si. selaku pembimbing yang telah memberikan saran, arahan, dan masukan mulai perencanaan, pelaksanaan, dan penyusunan skripsi ini. Di samping itu penghargaan penulis sampaikan kepada Teh Juju dan seluruh staf Laboratorium Bioteknologi Tanaman Departemen Agronomi dan Hortikultura IPB, Pak Milin dan seluruh pegawai lapang kebun percobaan Cikabayan, Pak Joko dan seluruh Staf BB Biogen yang telah membantu persiapan dan pelaksanaan penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada ayah, ibu, serta seluruh keluarga atas segala dukungan moril dan materiil. Terima kasih juga tak lupa penulis sampaikan kepada Sime Darby yang telah memberikan dana penelitian melalui program beasiswa Minamas.
Semoga penelitian ini bermanfaat.
Bogor, April 2013
10
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 2
Keragaan Fenotipik Tanaman In Vitro 11
Tinggi Tanaman 12
Keragaan Fenotipik Tanaman In Vivo 16
Tinggi Tanaman 16
Jumlah Daun 17
Panjang Daun 18
Panjang Tangkai Daun 18
Jumlah Duri pada Permukaan Atas Daun 18
DAFTAR TABEL
11. Rekapitulasi uji F dari peubah vegetatif yang diamati pada
keragaan in vitro klon yang diuji umur 1-5 MST 12 22. Rata-rata tinggi tanaman pada keragaan in vitro klon yang diuji
umur 2-5 MST
59. Rata-rata jumlah daun klon yang diuji pada kondisi in vivo umur
1-5 MST 18
610. Rata-rata panjang daun, panjang tangkai daun, dan jumlah duri
permukaan daun klon yang diuji pada kondisi in vivo 5 MST 19 711. Matrik perbedaan morfologi tanaman terung pada percobaan in
vivo 20
812. Pengelompokan tanaman dengan kekerabatan lebih dari 80% 24
DAFTAR GAMBAR
1. Buah Solanum melongena cv. Dourga 2. Terung pipit (Solanum torvum Sw.)
3. Kondisi umum klon yang diuji pada percobaan in vitro umur 5 MST 3 4 10 4. Kondisi klon yang diuji pada minggu kedua aklimatisasi 10 5. Klon yang diuji pada percobaan in vivo umur 5 MST 11 6. Klon yang diuji pada percobaan in vitro umur 5 MST 16 7. Warna batang klon yang diuji pada kondisi in vivo umur 5 MST 19
8. Duri pada permukaan atas daun 21
9. Bentuk daun klon yang diuji pada kondisi in vivo umur 5 MST 22 10. Bentuk bunga klon yang diuji pada kondisi in vivo 23 11. Dendogram klon berdasarkan karakter kualitatif dan kuantitatif 24
DAFTAR LAMPIRAN
1. Kriteria skoring analisis gerombol 29
PENDAHULUAN
Latar Belakang
Terung (Solanum melongena L.) adalah salah satu tanaman komersial penting yang dimanfaatkan buahnya untuk dikonsumsi sebagai sayuran. Terung termasuk tanaman herba tegak dan berkayu dengan tinggi antara 0.3 sampai 1.5 meter. Tanaman ini berasal dari India dan saat ini telah tersebar di daerah tropis lainnya (Wijayakusuma, 2004).
Terung merupakan sayuran buah penting dengan produksi dunia mencapai lebih dari 31 juta ton. Produsen terbesar terung adalah Cina (17 juta ton), India (8 juta ton), Mesir (1 juta ton), Turki (0.9 juta ton), serta Jepang dan Italia (masing-masing 0.4 juta ton) (Daunay dan Janick, 2007). Produksi terung di Indonesia pun terus meningkat setiap tahun. Pada tahun 2005 produksi terung di Indonesia mencapai jumlah 333 328 ton dan pada tahun 2011 produksi terung nasional meningkat sebesar 55.85% menjadi 519 481 ton (BPS, 2012). Meningkatnya produksi ini menandakan bahwa terung merupakan sayuran yang cukup digemari oleh masyarakat sehingga pengembangan komoditas terung perlu terus dilakukan. Terung sangat mudah terserang penyakit. Salah satu penyakit yang menjadi permasalahan serius pada tanaman terung di daerah tropis adalah penyakit layu bakteri yang disebabkan oleh Rastolnia solanacearum (Kallo, 1986). Penyakit ini dapat menular melalui tanah yang terkontaminasi, peralatan, air, serangga, atau melalui benih terinfeksi dan persemaian. Beberapa cara yang dapat dilakukan untuk mengatasi penyakit ini antara lain dengan menggunakan kultivar tahan, benih bersertifikat, fumigasi, mikroba antagonis sebagai agen biokontrol, perbaikan sistem budidaya tanaman, perbaikan tanah, pengendalian yang terintegrasi, serta mutan virulen R. Solanacearum (Tahat dan Sijam, 2010).
Adapun cara yang paling efektif dan efisien untuk menanggulangi penyakit tersebut adalah dengan menggunakan varietas tahan (Husni et al., 2004). Akan tetapi, sumber ketahanan umumnya terdapat pada spesies liar seperti Solanum torvum Sw. (Kallo, 1986; Budi, 2002; Husni et al., 2004), Solanum Xantocarpum,
Solanum taxanum (Kallo, 1986), dan Solanum aethiopicum (Saputra, 2002), sehingga pemindahan sifat sulit dilakukan dengan persilangan konvensional karena inkompatibilitas yang tinggi (Collonier et al., 2001). Persilangan seksual antara terung budidaya dengan Solanum torvum menghasilkan hibrida bersifat steril dengan viabilitas polen sangat rendah karena terjadi abnormalitas di setiap tahap meiosis (McCommon dan Honma, 1983). Oleh karena itu, salah satu teknik yang dapat dilakukan untuk memindahkan sumber ketahanan ini adalah dengan teknik fusi protoplas (Husni et al., 2004).
2
Solanacearum. Mariska dan Husni (2006) telah melakukan fusi protoplas terung dengan takokak namun menghasilkan hibrida hasil fusi yang tidak dapat menghasilkan buah. Meskipun telah ditemukan hibrida somatik hasil fusi protoplas S. melongena L. dengan S. torvum Sw. yang tahan terhadap penyakit layu bakteri, penelitian lanjutan untuk mengetahui keragaan yang dibawa oleh hibrida somatik perlu dilakukan.
Perumusan Masalah
Pada penelitian ini, masalah yang dapat dirumuskan antara lain:
1. Apakah pertumbuhan klon hibrida somatik memiliki perbedaan dengan pertumbuhan kedua tetuanya?
2. Apakah terdapat gabungan sifat-sifat fenotipik yang diturunkan oleh tetua
Solanum melongena cv. Dourga dan Solanum torvum Sw. pada klon-klon hibrida somatik?
Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui karakter fenotipik individu hibrida somatik antara Solanum melongena cv. Dourga dengan Solanum torvum Sw.
Manfaat Penelitian
Penelitian ini memberikan tambahan informasi baru mengenai keragaan in vitro dan in vivo hibrida somatik antara Solanum melongena cv. Dourga dengan
Solanum torvum Sw. yang akan berguna bagi penelitian dan pengembangan terung hibrida di masa yang akan datang.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini terbatas pada keragaan in vitro dan in vivo
hibrida somatik tanpa melibatkan faktor produksi. Karakter yang diamati terbatas pada karakter kuantitatif dan karakter kualitatif tanaman pada fase vegetatif.
TINJAUAN PUSTAKA
Terung
Terung termasuk tanaman tahunan yang berumur singkat pada daerah tropis, dan diproduksi sebagai tanaman semusim di daerah subtropis. Terung dapat tumbuh membentuk semak hingga tumbuh tinggi antara 0.5 sampai 2.5 meter. Pertumbuhan terung bersifat indeterminate. Tanaman ini dapat menghasilkan buah dengan jumlah sedikit ataupun banyak, tergantung pada setiap kultivar. Terung membentuk semak dengan memproduksi tunas-tunas baru dari ketiak daunnya. Akar tunggang terung sangat kuat dan akar-akarnya menyebar dengan kedalaman sedang. Batangnya tegak dan bercabang, serta dapat menjadi kayu dengan cepat. Beberapa jenis terung ada yang berduri. Daun terung berukuran besar, tumbuh berselang-seling, dan permukaannya ditumbuhi oleh rambut-rambut halus berwarna abu-abu yang cukup tebal, khususnya pada tipe-tipe liar. Daunnya berbentuk bulat telur dengan tepi yang bergelombang. Pangkal daun berbentuk setengah lingkaran, sedangkan ujungnya meruncing (Rubatzky dan Yamaguchi, 1999).
Terung dimanfaatkan buahnya untuk dikonsumsi. Tanaman ini diperkirakan berasal dari India dan telah tercatat tumbuh di Cina lima abad yang lalu. Terung tumbuh pada akhir musim semi, musim panas, dan musim gugur di sebagian besar daerah utara. Tanaman ini merupakan tanaman yang membutuhkan cuaca hangat dan membutuhkan waktu 100 sampai 140 hari dari persemaian hingga berbuah (Splittstoesser,1990).
Terung memiliki banyak kultivar. Salah satu kultivar terung introduksi adalah Solanum melongena cv. Dourga (Gambar 1). Solanum melongena cv. Dourga memiliki tinggi sekitar 31.60 cm dengan pertumbuhan yang pendek atau kerdil, gemuk, dan tegak. Ukuran batang besar, berwarna hijau, bentuk atau penampang batang membujur bulat dengan pertumbuhan cabang simpodial dan letaknya berselang. Daun berwarna hijau, bentuk elips dengan pinggiran atau tepi daun rata dan dasar daun berbentuk hati. Permukaan daun berbulu, kasar dan rata, tulang daun menyirip, berukuran kecil, berbulu, dan berwarna hijau. Jumlah daun
Solanum melongena cv. Dourga sekitar 37.6 helai. Petiol berwarna hijau dan berbentuk bulat, umur berbunga sekitar 51.80 hari, dan jumlah bunga 31 bunga per tanaman (Rochmah, 2001).
4
Umur panen Solanum melongena cv. Dourga berbanding terbalik dengan umur berbunga, dan umur berbunga tidak mempengaruhi persentase terbentuknya buah karena bunga tanaman terung cenderung rontok atau gugur setelah mekar. Tipe buah tunggal, buah berwarna putih, berbentuk bulat panjang dengan diameter bagian ujung buah lebih besar dari pangkal buah, permukaan buah licin, dan daging buah berwarna putih dengan letak biji tersebar di tengah (Rochmah, 2001)
Terung Pipit
Terung pipit (Gambar 2) diklasifikasikan ke dalam genus Solanum, famili Solanaceae, ordo Solanales, subkelas Asteridae, kelas Magnoliopsida, divisi Magnoliophyta, superdivisi Spermatophyta, subkingdom Tracheobionta (USDA, 2012).
Gambar 2 Terung pipit (Solanum torvum Sw.)
Terung pipit juga dikenal dengan nama turkeyberry, susumber, gully-bean,
Thai eggplant, atau devil’s fig. Terung pipit merupakan salah satu genus Solanum yang berduri. Tinggi terung pipit dapat mencapai hampir lima meter, buahnya banyak dengan ukuran sebesar anggur ketika dewasa, diameter mencapai 2.5 cm, berjumlah banyak dalam satu tandan yang bercabang. Panjang daun terung pipit mencapai 25 cm, berbentuk oval dengan ujung yang runcing (Markle et al., 2008). Francis (2013) menyatakan bahwa terung pipit kebanyakan hanya mampu hidup sekitar 2 tahun dan setiap tahun tingginya dapat bertambah 0.75 – 1.5 m.
Terung pipit merupakan tanaman yang memiliki khasiat sebagai obat. Ekstrak tanaman ini telah digunakan secara luas untuk mengobati berbagai penyakit pada manusia. Bahan kimia yang ada pada tanaman ini telah digunakan sebagai antihipertensi, antioksidan, obat penenang, pelancar pencernaan, dan lain-lain (Agrawal et al., 2010). Terung pipit juga memiliki gen sumber ketahanan terhadap serangan penyakit layu bakteri yang disebabkan oleh Rastolnia solanacearum (Kallo, 1986; Budi, 2002; Husni et al., 2004).
Fusi Protoplas
bergabung. Dua protoplas yang bergabung ini akan membentuk sel baru yang berisi nukleus dari kedua sel tetua dengan cepat (Shepard et al., 1983). Fusi protoplas dapat digunakan untuk mengatasi masalah dalam persilangan tanaman secara seksual, terutama inkompatibilitas dan sterilitas pada turunan F1. Masalah ini muncul pada persilangan antargenotipe berkerabat jauh (Mariska dan Husni, 2006).
Telah banyak bahan kimia dan kondisi fisik yang diuji coba untuk membantu terjadinya fusi protoplas, tapi kemajuan besar terjadi ketika ditemukannya polyethylene glycol (PEG) sebagai pemercepat fusi protoplas.
Polyethylene glycol [HOCH2-(CH2-O-CH2)n-CH2OH] sangat larut dalam air dan memiliki bobot molekul kurang dari 1 000 sampai 20 000 (shepard et al., 1983).
PEG bekerja dengan bertindak sebagai jembatan perantara yang mampu menginduksi bergabungnya dua protoplas. Keberhasilan fusi dan regenerasi sangat ditentukan oleh konsentrasi PEG dan lama inkubasi dalam larutan PEG (husni et al., 2004)
Mariska dan Husni (2006) telah melakukan fusi protoplas pada tanaman lada, nilam, dan terung dengan menggunakan PEG 6 000 konsentrasi 30% selama 20-25 menit untuk menyatukan protoplas tanaman budidaya dengan kerabat liarnya dalam upaya membentuk hibrida somatik. Husni et al. (2004) telah berhasil melakukan fusi protoplas antara Solanum melongena cv. Dourga dengan
Solanum torvum Sw. menggunakan PEG 30% dan dapat diregenerasi menjadi tanaman. Pada tahun 2010, Husni juga telah berhasil melakukan fusi protoplas tanaman jeruk siam simadu dengan mandarin satsuma menggunakan PEG 4% dan 30%. Sel hasil fusi yang berhasil diregenerasikan menjadi tanaman berasal dari perlakuan PEG 4% saja, sedangkan perlakuan menggunakan PEG 30% belum berhasil diregenerasikan.
Kultur Jaringan
Kultur jaringan tanaman terdiri atas satu set teknik in vitro, metode, dan strategi dari kelompok teknologi yang disebut bioteknologi tanaman. Kultur jaringan telah digunakan untuk meningkatkan keragaman genetik, memperbaiki kesehatan bahan tanam, dan untuk meningkatkan jumlah plasma nutfah yang diinginkan oleh pemulia tanaman (Brown dan Thorpe, 1995).
Kultur in vitro merupakan teknik memisahkan bagian dari tanaman seperti tunas terminal, tunas aksilar, daun, batang, atau embrio serta menumbuhkannya di dalam media buatan dalam kondisi aseptik sehingga membentuk tanaman lengkap. Hal ini didasari oleh adanya daya totipotensi sel. Terbentuknya tanaman lengkap dari eksplan potongan bagian tanaman dipengaruhi oleh banyak faktor antara lain: kondisi fisiologi eksplan, genotipe eksplan, media dasar, zat pengatur tumbuh, serta lingkungan kultur seperti pencahayaan maupun kelembaban dan suhu ruangan (Lestari, 2012).
6
(2002) menyatakan keunggulan lain dari kultur in vitro adalah dapat digunakan sebagai metode untuk mengetahui keragaan tanaman hibrida somatik hasil fusi protoplas pada tingkat paling awal, sehingga lebih efisien dalam jumlah material yang dipakai, serta penghematan waktu dan tempat.
Satu kelemahan besar dalam penggunaan teknik in vitro adalah materi tanaman yang digunakan sangat mungkin mengalami kondisi dan situasi yang tidak normal. Hal ini terutama berlaku untuk sel yang dikultur dalam suspensi, yang memiliki sedikit kemiripan dengan sel pada jaringan tertutup dan adanya ancaman dari bakteri di lingkungan yang sangat berbeda dengan yang ada di dalam jaringan tanaman (Sigee, 1993).
Kesuksesan dalam kultur jaringan tanaman dapat disandarkan pada dua faktor kritis: pemilihan eksplan dan media kultur. Pemilihan eksplan, berkaitan dengan jaringan asal, tahap perkembangan, dan kondisi fisiologis, harus ditentukan oleh tujuan dari kultur jaringan dan plastisitas jaringan yang bersangkutan. Seleksi dan modifikasi media kultur yang tepat telah disederhanakan dengan sangat baik melalui upaya Philip R. White, K. V. Thimann, Folke Skoog, Carlos O. Miller, Toshio Murashige, serta murid dan rekan-rekan mereka. Formulasi garam anorganik dari Murashige dan Skoog yang diterbitkan pada 1962 merupakan salah satu karya besar dalam sejarah sel dan kultur jaringan, yang mampu memfasilitasi secara luas dalam bidang hortikultura, pertanian, dan biologi (Smith dan Gould, 2013).
Jaringan terung memiliki potensi morfogenetik tinggi yang sangat berguna dalam perkembangan bioteknologi untuk meningkatkan keberagaman genetik tanaman, seperti penyelamatan embrio, seleksi in vitro, hibridisasi somatik, dan transformasi genetik (Magioli dan Mansur, 2004). Media KM8P merupakan media yang terbaik untuk regenerasi protoplas tanaman terung mulai dari pembentukan dinding sel, pembelahan, dan pembentukan mikrokalus (Husni, 2002). Charaya et al. (2011) telah melakukan pengujian terhadap tiga jenis eksplan tanaman terung (hipokotil, kotiledon, dan daun) dengan menggunakan media tumbuh MS + 2.5 mg BAP. Pada media MS + 2.5 mgl-1 BAP, regenerasi kalus paling tinggi terdapat pada eksplan kotiledon, sedangkan pemanjangan tunas maksimum terjadi pada media ½ MS + 0.3 mgl-1 BAP.
METODE
Waktu dan Tempat
Bahan Percobaan
Bahan tanaman terung yang digunakan adalah lima klon hibrida somatik dan dua kultivar tetua. Klon hibrida somatik di atas merupakan koleksi in vitro di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya genetik Pertanian (BB Biogen).
Media yang digunakan dalam kultur in vitro adalah MS (Murashige dan Skoog 1962) dengan penambahan vitamin MW (Morel dan Wetmore 1951), 30 g sukrosa, dan 7 g agar. Bahan tanaman yang digunakan dalam percobaan in vivo
adalah planlet yang dihasilkan dari percobaan in vitro. Media tanam yang digunakan ketika aklimatisasi adalah campuran tanah dan pupuk organik dengan komposisi 1 : 1 yang telah disterilisasi pada suhu 1210 C selama empat jam. Pada percobaan in vivo, media tanam yang digunakan terdiri dari campuran tanah dan pupuk organik dengan komposisi 2 : 1. Bakterisida Agrept dan fungisida antracol
digunakan untuk pengendalian bakteri dan jamur. Pupuk buatan yang digunakan adalah Urea, SP 36, dan KCl.
Peralatan yang digunakan dalam percobaan in vitro adalah laminar air flow
dan peralatan tanam in vitro pada umumnya. Peralatan yang digunakan dalam percobaan in vivo adalah greenhouse, cangkul, polibag ukuran 20 cm x 25 cm, dan sungkup plastik transparan.
Metode Percobaan
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) faktor tunggal. Percobaan dilakukan dengan tujuh taraf perlakuan yang terdiri dari Solanum melongena cv. Dourga dan Solanum torvum Sw. sebagai tetua, serta lima nomor hibrida somatik Solanum melongena cv. Dourga dengan Solanum torvum Sw. (SMST1, SMST2, SMST3, SMST4, SMST5). Pada percobaan in vitro, setiap perlakuan diulang sebanyak sepuluh kali dengan satu tabung reaksi untuk setiap satuan percobaan, sehingga dibutuhkan masing-masing sepuluh eksplan untuk setiap perlakuan. Seluruh eksplan ditanam pada media MS + Vit. MW + 30 g sukrosa + 7 g agar. Pada percobaan in vivo, setiap perlakuan diulang sepuluh kali dengan satu polibag 5 kg untuk setiap satuan percobaan, sehingga dibutuhkan masing-masing sepuluh polibag Solanum melongena cv. Dourga, Soanum torvum Sw., dan lima nomor hibrida somatik.
Model rancangan yang digunakan adalah sebagai berikut: ij
i ij
(i = 1,2,3,...,7; j = 1,2,3,...,10) Keterangan:Yij = respon pengamatan perlakuan ke-i, ulangan ke-j = nilai tengah umum
i = pengaruh perlakuan ke-i
ij = pengaruh galat percobaan (experimental error) perlakuan ke-i, ulangan ke-j)
8
lanjut dengan Duncan Multiple Range Test (DMRT). Data kualitatif yang diperoleh dianalisis menggunakan analisis gerombol.
Pelaksanaan Percobaan
1. Persiapan bahan tanam in vitro.
Pada percobaan in vitro, bahan tanam didapatkan dari koleksi klon hibrida somatik Solanum melongena cv. Dourga dengan Solanum torvum Sw. Sebelum percobaan dilakukan, planlet diperbanyak pada media MS + Vit. MW + 30 g sukrosa + 7 g agar untuk mendapatkan jumlah eksplan yang sesuai kebutuhan. Selama proses perbanyakan, pemeliharaan yang dilakukan antara lain membuang tanaman yang terkontaminasi, memotong ujung planlet yang hampir menyentuh tutup botol, dan mensubkultur planlet yang sudah lama. Selama proses perbanyakan ini, juga dilakukan pembuatan media yang digunakan untuk percobaan. Setelah eksplan yang dimiliki sesuai dengan kebutuhan, penanaman segera dilakukan. Eksplan yang dipergunakan dalam percobaan ini adalah eksplan buku tunas aksilar.
2. Persiapan bahan tanam in vivo.
Bahan tanam yang digunakan untuk percobaan in vivo adalah planlet hasil perbanyakan in vitro yang telah memiliki akar dan daun yang cukup. Planlet selanjutnya diaklimatisasi selama dua minggu. Pada masa aklimatisasi, planlet ditanam pada gelas plastik 300 ml dengan campuran media tanah yang telah disterilkan dan pupuk organik dengan komposisi 1 : 1. Tanaman diletakkan dalam sebuah rak yang diselubungi oleh plastik trasparan dan diberi atap untuk menghindari penguapan yang berlebihan akibat angin dan panas matahari. Tanaman disungkup dengan plastik transparan selama satu minggu pertama dan sungkup plastik dilepaskan pada minggu kedua.
3. Persiapan media tanam.
Media tanam yang digunakan pada kondisi in vivo adalah campuran tanah dan pupuk organik dengan komposisi 2 : 1. Media diletakkan dalam sebuah polibag berukuran 20 cm x 25 cm. Media diberi bakterisida dan fungisida sebelum proses penanaman. Penanaman dilakukan pada sore hari di dalam greenhouse.
4. Pemeliharaan tanaman.
Pengamatan pada percobaan in vivo dimulai pada 1 MST sampai 5 MST. pada pengamatan kuantitatif, peubah yang diamati antara lain: tinggi tanaman, diukur dari permukaan tanah hingga ujung tunas apikal; jumlah daun, dihitung pada seluruh bagian tanaman yang telah tumbuh sempurna; panjang daun, diukur dari pangkal hingga ujung daun; panjang tangkai daun, diukur dari ketiak daun hingga pangkal daun; dan jumlah duri pada permukaan atas daun. Pada pengamatan kualitatif, peubah yang diamati antara lain: warna batang dan tangkai daun; bentuk lobus daun; dan duri pada batang.
HASIL DAN PEMBAHASAN
Keadaan Umum Tanaman
Penelitian ini dilaksanakan dalam dua percobaan, yaitu percobaan in vitro
dan percobaan in vivo. Pada percobaan in vitro, sumber eksplan diperoleh dari perbanyakan dengan menggunakan buku tunas aksilar. Tunas aksilar adalah tunas yang terdapat pada sudut antara masing-masing daun dan batang (Campbell et al., 2003).
Eksplan yang ditanam diambil dari ruas tunas aksilar dengan panjang bervariasi antara 0.5 sampai 1.0 cm. Variasi panjang eksplan ini disebabkan panjang ruas tunas masing-masing klon berbeda-beda. Eksplan ditanam di dalam tabung reaksi berdiameter sekitar 3 cm dan tinggi sekitar 15 cm. Penanaman eksplan merupakan salah satu tahap kritis dalam penelitian ini. Ukuran eksplan yang kecil sangat rentan terhadap panas dari alat-alat tanam, sementara di sisi lain peralatan tanam harus selalu dipanaskan untuk menghindari kontaminasi bakteri ataupun jamur.
Dalam beberapa hari pengamatan pertumbuhan tanaman, beberapa tanaman terlihat tidak tumbuh dengan baik. Hal ini disebabkan oleh adanya akar yang mengkalus, batang yang mengkalus, dan kontaminasi bakteri. Keadaan tanaman dalam kondisi in vitro terbagi menjadi beberapa kelompok, antara lain tanaman yang berakar baik dan tumbuh dengan baik, tanaman dengan akar yang mengkalus sehingga bidang penyerapan sangat luas dan pertumbuhan sangat cepat, tanaman yang tidak berakar dan juga tidak mengkalus sehingga pertumbuhannya sangat lambat, serta tanaman yang batangnya mengkalus dan terlihat seperti kelebihan air (Gambar 3). Keadaan ini terdapat pada semua klon yang diuji.
10
SMST2 S. torvum Sw. SMST1 SMST3 Gambar 3 Kondisi umum klon yang diuji pada percobaan in vitro umur 5 MST*.
a) pangkal batang mengkalus dan akar tidak muncul, b) planlet tumbuh dengan normal, c) batang mengkalus dan tumbuh tidak normal, d) pangkal batang mengkalus dan diselubungi semacam kristas dan menyebabkan pertumbuhan sangat cepat, (*) minggu setelah tanam.
Selama masa aklimatisasi, tanaman yang mengalami kelayuan dan mati mencapai 25%. Tanaman dengan jumlah daun dan akar yang banyak lebih tahan dibandingkan dengan tanaman yang jumlah daun dan akarnya sedikit. Keberadaan akar lebih menentukan keberhasilan tanaman dalam proses aklimatisasi dibanding keberadaan daun karena selama aklimatisasi, tanaman membutuhkan akar untuk menyerap unsur hara dari media. Klon SMST5 yang memiliki pertumbuhan yang lemah hampir seluruhnya mengalami kematian dan hanya menyisakan satu tanaman, sehingga tidak dapat dimasukkan ke dalam percobaan in vivo. Kondisi tanaman pada tahap aklimatisasi dapat dillihat pada gambar 4.
Pada percobaan in vivo, tanaman yang telah berhasil tumbuh stabil selama dua minggu aklimatisasi dipindahkan ke dalam polibag berukuran 20 x 25 cm2 dengan media berasal dari campuran tanah dan pupuk organik dengan perbandingan 2 : 1. Tanaman diletakkan di dalam rumah kaca untuk menghindari serangan hama dan penyakit. Sebelum tanaman dipindahkan ke media tanam in vivo, media diberi bakterisida dan fungisida untuk menghindari serangan bakteri ataupun cendawan yang berasal dari tanah. Pengamatan dilakukan hingga tanaman berumur 5 MST (Gambar 5).
Gambar 5 Klon yang diuji pada percobaan in vivo umur 5 MST. a) Solanum torvum Sw., b) Solanum melongena cv. Dourga,
c) SMST1, d) SMST2, e) SMST3, f) SMST4.
Selama tanaman berada dalam kondisi in vivo, penyiraman dilakukan setiap hari (pagi atau sore). Pemupukan dilakukan sebanyak empat kali dengan dosis total terdiri dari urea 10 g/tanaman, SP36 9 g/tanaman, dan KCl 7 g/tanaman. Selama pengamatan dilakukan dalam percobaan in vivo, beberapa tanaman mengalami kelayuan dan mati akibat kondisi rumah kaca yang cukup panas selama minggu pertama dengan suhu udara luar berkisar 22.8o sampai 32.7oC (BMKG, 2012).
Keragaan Fenotipik Tanaman in Vitro
Pada percobaan in vitro, pengamatan dilakukan secara kuantitatif (tinggi tanaman, jumlah daun, jumlah akar, panjang akar, dan jumlah buku batang) dan secara kualitatif (warna daun). Pengamatan pada percobaan in vitro dilakukan hingga tanaman berumur 5 MST.
12
Tabel 1 Rekapitulasi uji F dari peubah vegetatif yang diamati pada keragaan in vitro klon yang diuji umur 1-5 MST
Peubah vegetatif Klon
**: berpengaruh sangat nyata pada uji F taraf 1%, -: pengamatan tidak dilakukan.
Tinggi Tanaman
Tinggi tanaman pada percobaan in vitro diukur dari permukaan media sampai ujung tunas apikal. Tinggi tanaman dapat menunjukkan kemampuan tumbuh dan penyerapan nutrisi tanaman terung pada kondisi in vitro.
Pada 2 minggu setelah tanam, Solanum torvum Sw. (2.56 cm) memiliki tingkat pertumbuhan di atas semua klon. Klon SMST3 (0.15 cm) merupakan klon dengan pertumbuhan paling lambat (Tabel 2).
Pada 5 MST, klon SMST3 (0.45 cm) berbeda nyata dengan kedua tetua dan memiliki pertumbuhan paling lambat. Klon SMST1 (1.53 cm), SMST2 (0.89 cm), SMST4 (1.24 cm), dan SMST5 (0.73 cm) tidak berbeda nyata dengan Solanum melongena cv. Dourga (1.16 cm). Solanum torvum Sw. (10.0 cm) sangat berbeda nyata dengan Solanum melongena cv. Dourga dan kelima klon lainnya dan memiliki pertumbuhan paling cepat (Tabel 2).
Solanum torvum Sw. lebih responsif pada media MS tanpa hormon tumbuh (Moreira et al., 2010) sedangkan Solanum melongena tidak dapat tumbuh baik Angka yang diikuti huruf sama pada kolom yang sama tidak berbeda nyata pada taraf 5 % berdasarkan uji DMRT.
Tidak hanya pertumbuhan planlet yang membutuhkan hormon tambahan,
dalam kultur in vitro, Solanum melongena membutuhkan penambahan hormon auksin dan sitokinin, sedangkan Solanum torvum tidak membutuhkan hormon auksin dan sitokinin. Oleh karena itu, performa Solanum torvum Sw. lebih baik dibandingkan Solanum melongena dan hasil fusi protoplas.
Jumlah Daun
Banyaknya jumlah daun merupakan salah satu indikator penting untuk melihat tingkat pertumbuhan tanaman. Fungsi daun pada tanaman sangat penting karena daun merupakan organ fotosintesis utama pada sebagian besar tumbuhan (Campbell et al., 2003). Pada in vitro, jumlah daun dapat dijadikan indikator bahwa tanaman tumbuh dengan baik dan akan menjadi bakal bibit yang baik.
Pada 1 MST, jumlah daun Solanum torvum Sw. (1.3 helai) telah menunjukkan perbedaan yang nyata dengan semua klon, namun pertumbuhan daun Solanum melongena cv. Dourga (0.2 helai) dan 5 klon lainnya tidak berbeda nyata satu sama lain. Perbedaan pertumbuhan daun antar klon mulai terlihat sejak 2 MST hingga 5 MST (Tabel 3).
Pada 1-5 MST, pertambahan jumlah daun Solanum torvum Sw. paling tinggi dan sangat berbeda nyata dengan klon lainnya. Klon SMST1, SMST2, SMST4, dan SMST5 tidak berbeda nyata dengan Solanum melongena cv. Dourga dan menempati urutan kedua jumlah daun terbanyak. Pertambahan jumlah daun paling lambat dimiliki oleh klon SMST3 yang berbeda nyata dengan kedua tetuanya
Akar merupakan salah satu indikator apakah pertumbuhan tanaman berjalan baik atau tidak. Akar berfungsi menambatkan tumbuhan ke tanah, menyerap mineral dan air, menghantarkan air dan nutrien, serta menyimpan makanan (Campbell et al., 2003). Pada in vitro, akar berfungsi untuk menyerap nutrisi yang disediakan pada media in vitro.
Pertambahan jumlah akar Solanum torvum Sw. sangat cepat terjadi pada minggu ke-2 pengamatan, sedangkan pada 3 – 5 MST, pertambahan jumlah akar
14
Hal ini sesuai dengan penelitian Moreira et al. (2010) yang menyatakan
Solanum torvum menghasilkan pengakaran yang lebih tinggi pada media tanpa penambahan hormon auksin dan sitokinin dibandingkan dengan media yang ditambahkan hormon.
Pertumbuhan akar pada klon hibrida somatik mulai terlihat pada 2 MST, namun pertumbuhan akar belum terjadi pada klon SMST5. Semua klon telah memiliki akar pada 3 MST. Pada 5 MST, Solanum melongena cv. Dourga (0.3 buah) memiliki jumlah akar paling sedikit dan tidak berbeda nyata dengan klon SMST5 (0.6 buah). Hal ini kemungkinan disebabkan oleh media yang tidak diberi penambahan hormon. Ray et al. (2011) menyatakan Solanum melongena yang dikulturkan pada media tanpa hormon tidak memiliki kemampuan regenerasi. Klon SMST1 (1.6 buah), SMST2 (1.6 buah), SMST3 (1.0 buah), dan SMST4 (1.4 buah) tidak berbeda nyata satu dengan yang lain dan memiliki jumlah akar di antara Solanum torvum Sw. (6.6 buah) dan Solanum melongena cv. Dourga (0.3 buah) pada 5 MST (Tabel 4).
Hasil penelitian Ray et al. tersebut menunjukkan sifat genetik yang berbeda antara Solanum melongena cv. Dourga dengan Solanum torvum Sw. Hal inilah yang mungkin menyebabkan adanya perbedaan pertumbuhan hibrida somatik antara Solanum melongena cv. Dourga dan Solanum torvum Sw. Lestari (2012) menyatakan bahwa faktor genetik merupakan salah satu faktor yang menentukan kemampuan regenerasi tunas.
Angka yang diikuti huruf sama pada kolom yang sama tidak berbeda nyata pada taraf 5 % berdasarkan uji DMRT.
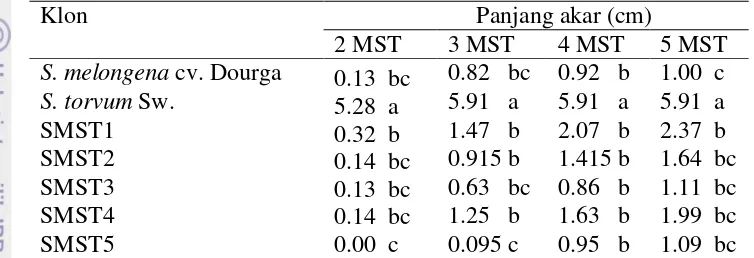
Panjang Akar
Panjang akar menunjukkan kemampuan tanaman dalam menjangkau nutrisi yang akan diserap. Panjang akar juga menjadi indikator pertumbuhan yang baik di samping jumlah akar. Tanaman dengan akar yang banyak dan panjang akan memiliki pertumbuhan yang sangat baik karena dapat menyerap hara dengan maksimal.
Panjang akar Solanum torvum Sw. (5.91 cm) sangat berbeda nyata dengan semua klon hibrida somatik dan memiliki akar terpanjang pada 5 MST. Solanum melongena cv. Dourga (1.00 cm) memiliki akar terpendek dan tidak berbeda nyata dengan klon SMST2 (1.64 cm), SMST3 (1.11 cm), SMST4 (1.99 cm), SMST5 (1.09 cm), namun berbeda nyata dengan klon SMST1 (2.37 cm) (Tabel 5).
Tabel 5 Rata-rata panjang akar pada keragaan in vitro klon yang diuji dengan klon lainnya. Hal ini juga sesuai dengan penelitian Moreira et al. (2010) yang menyatakan bahwa Solanum torvum pada media MS tanpa penambahan hormon menghasilkan perpanjangan tunas lebih tinggi dibandingkan MS dengan penambahan hormon, sedangkan Ray et al. (2011) menyatakan Solanum melongena pada media MS tanpa hormon tidak memiliki kemampuan regenerasi. Perbedaan ini menyebabkan perbedaan pertumbuhan masing-masing klon hibrida somatik. Klon SMST2 (3.0 buah) merupakan klon hibrida dengan jumlah buku terbanyak dan berbeda nyata dengan klon SMST5 (1.5 buah) yang memiliki jumlah buku paling sedikit (Tabel 6).
Tabel 6 Rata-rata jumlah buku klon yang diuji pada kondisi in vitro umur 5 MST
16
Pada percobaan in vitro, Beberapa klon hibrida somatik yang memiliki karakter pertumbuhan yang baik dari semua peubah yang diamati (tinggi tanaman, jumlah daun, jumlah akar, panjang akar, dan jumlah buku) adalah klon SMST1, SMST2, dan SMST4, sedangkan klon SMST3 dan SMST5 memiliki kemampuan tumbuh yang rendah.
Morfologi Batang dan Daun
Pada kondisi in vitro, keragaan morfologi tanaman secara kualitatif memperlihatkan adanya perbedaan yang jelas antara klon SMST5 dengan kultivar pembanding maupun klon lainnya.
Klon SMST5 memiliki batang yang rapuh dengan warna hijau keputih-putihan, sedangkan klon SMST1, SMST2, SMST3, SMST4, Solanum melongena
cv. Dourga, dan Solanum torvum Sw. berwarna hijau muda. Klon SMST5 juga memiliki warna daun yang berbeda dengan klon lainnya. Daun klon SMST5 berwarna hijau muda di bagian tengah dan berwarna putih di sepanjang tepi daunnya (variegata), sedangkan klon lainnya dan kultivar pembanding memiliki daun berwarna hijau di seluruh permukaannya (Gambar 6).
Gambar 6 Klon yang diuji pada percobaan in vitro umur 5 MST. a) Solanum torvum Sw., b) Solanum melongena cv. Dourga, c) SMST1, d) SMST2, e) SMST3, f) SMST4, g) SMST5.
Keragaan Fenotipik Tanaman in Vivo
Pada percobaan in vivo, pengamatan dilakukan secara kuantitatif (tinggi tanaman, jumlah daun, panjang daun, panjang petiola, jumlah duri permukaan atas daun) dan secara kualitatif (warna batang, duri pada batang, bentuk daun, warna tangkai daun, duri pada daun). Keragaan fenotipik yang diamati pada percobaan in vivo menunjukkan perbedaan sangat nyata hanya pada karakter tinggi tanaman dan jumlah duri pada permukaan atas daun (Tabel 7).
Tinggi Tanaman
menyerap hara dengan baik. Peubah tinggi tanaman pada klon-klon yang diuji menunjukkan perbedaan yang nyata pada umur 1 MST, 4 MST, dan 5 MST. Pada umur 2 MST dan 3 MST, peubah tinggi tanaman tidak menunjukkan perbedaan yang nyata berdasarkan uji statistik (Tabel 8). Adanya perbedaan nyata peubah tinggi tanaman pada 1 MST disebabkan oleh pertumbuhan planlet in vitro yang bervariasi sehingga tinggi awal tanaman berbeda-beda. Pada 2 MST dan 3 MST, tanaman sudah beradaptasi dengan lingkungan sekitar, sehingga pertumbuhan berjalan normal dan klon yang diuji tidak menunjukkan perbedaan yang nyata. Tabel 7 Rekapitulasi uji F dari peubah vegetatif yang diamati pada keragaan in
vivo klon yang diuji. tidak berpengaruh nyata pada uji F taraf 5%, - : pengamatan tidak dilakukan.
. tidak berbeda nyata dengan SMST2 (23.06 cm). SMST1 (18.90 cm) dan SMST3 (20.56 cm) tidak menunjukkan perbedaan yang nyata, dan memiliki tinggi di bawah SMST2. Pertumbuhan terendah dimiliki oleh Solanum torvum Sw. (14.67 cm) yang tidak memiliki perbedaan nyata dengan Solanum melongena cv. Dourga (13.00 cm) (Tabel 8).
Perbedaan tinggi yang signifikan pada 4-5 MST mengindikasikan adanya kemampuan tumbuh yang berbeda antar klon. Klon SMST2 dan SMST4 lebih tinggi dan berbeda nyata dari kedua tetua pembanding.
Jumlah Daun
18
pada umur 1 – 2 MST, namun tidak menunjukkan perbedaan yang signifikan pada umur 3 – 5 MST (Tabel 9).
Solanum melongena cv. Dourga memiliki jumlah daun terbanyak dan berbeda nyata dengan klon lainnya pada umur 1-2 MST. Jumlah daun paling sedikit pada umur 1 MST dimiliki oleh klon SMST4 (3.44 helai). Pada umur 3-5 MST, semua klon tidak memiliki perbedaan yang nyata.
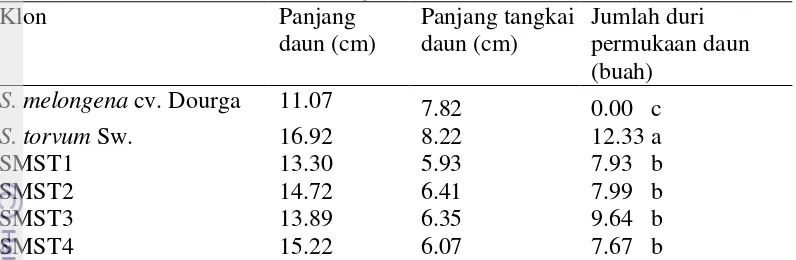
sebagian besar tumbuhan merupakan tempat melakukan fotosintesis dan penyediaan nutrisi untuk tumbuh dan berkembang (Campbell et al., 2003). Luas daun menentukan tingkat kemampuan daun dalam menyerap cahaya sebagai salah satu materi fotosintesis. Pada lebar yang sama, daun yang lebih panjang akan lebih banyak menyerap cahaya matahari. Peubah panjang daun yang diamati pada 5 MST tidak menunjukkan perbedaan nyata berdasarkan uji statistik (Tabel 10). Panjang Tangkai Daun
Panjang tangkai daun menunjukkan kemampuan tanaman dalam memaksimalkan penyerapan cahaya matahari oleh daun. Peubah panjang tangkai daun tidak menunjukkan perbedaan yang nyata antar klon yang diuji. Solanum torvum Sw. (8.22 cm) memiliki tangkai daun terpanjang meskipun tidak berbeda nyata dengan klon lainnya. Tangkai daun terpendek dimiliki oleh klon SMST1 (5.93 cm) (Tabel 10).
Jumlah Duri pada Permukaan Atas Daun
Duri merupakan salah satu bentuk pertahanan tanaman terhadap serangan organisme pengganggu tanaman (OPT). Duri pada umumnya banyak dimiliki oleh kultivar terung liar, sedangkan terung budidaya pada umumnya tidak memiliki duri.
Tabel 10 Rata-rata panjang daun, panjang tangkai daun, dan jumlah duri permukaan daun klon yang diuji pada kondisi in vivo 5 MST
Klon Panjang
daun (cm)
Panjang tangkai daun (cm)
Jumlah duri permukaan daun (buah)
S. melongena cv. Dourga 11.07 7.82 0.00 c
S. torvum Sw. 16.92 8.22 12.33 a
SMST1 13.30 5.93 7.93 b
SMST2 14.72 6.41 7.99 b
SMST3 13.89 6.35 9.64 b
SMST4 15.22 6.07 7.67 b
Angka yang diikuti huruf sama pada kolom yang sama tidak berbeda nyata pada taraf 5 % berdasarkan uji DMRT.
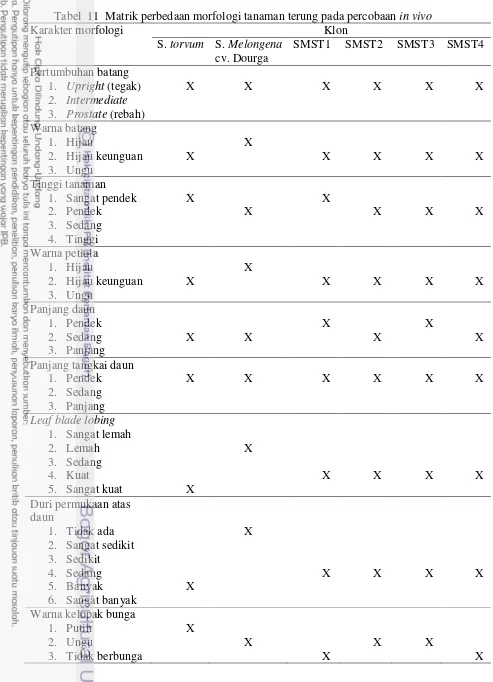
Morfologi Batang
Pertumbuhan batang Solanum melongena cv. Dourga dan Solanum torvum
Sw. menunjukkan pertumbuhan batang yang tegak (upright). Klon-klon hibrida somatik ini juga memiliki pertumbuhan batang yang tegak (Tabel 11). Pada umur 5 MST, Solanum melongena cv. Dourga memiliki warna batang hijau terang di seluruh permukaan batangnya dan ditumbuhi rambut-rambut yang sangat halus. Pada umur yang sama, Solanum torvum Sw. memiliki batang yang berwarna hijau keunguan dan ditumbuhi rambut-rambut halus yang lebih jelas terlihat dibandingkan Solanum melongena cv. Dourga (Gambar 7). Fusi protoplas kedua tetua ini menghasilkan klon SMST1, SMST2, SMST3, dan SMST4 yang memiliki warna batang menyerupai Solanum torvum Sw. (Tabel 11).
Gambar 7 Warna batang klon yang diuji pada kondisi in vivo umur 5 MST. a)
Solanum torvum Sw., b) Solanum melongena cv. Dourga, c) SMST1, d) SMST2, e) SMST3, f) SMST4.
20
Tabel 11 Matrik perbedaan morfologi tanaman terung pada percobaan in vivo
Morfologi Daun
Morfologi daun yang diamati meliputi warna tangkai daun, bentuk lobus daun, dan duri pada permukaan daun. Menurut IBPGR (1990), warna tangkai daun terbagi menjadi lima macam, yaitu hijau, hijau keunguan, ungu, ungu gelap, dan coklat gelap.
Tangkai daun Solanum melongena cv. Dourga pada umur 5 MST berwarna hijau, sedangkan tangkai daun Solanum torvum Sw. berwarna hijau keunguan. Fusi protoplas kedua tetua ini menghasilkan Klon SMST1, SMST2, SMST3, dan SMST4 yang memiliki tangkai daun menyerupai Solanum torvum Sw., yakni hijau keunguan (Tabel 11).
Permukaan daun pada Solanum melongena cv. Dourga bergelombang dan tidak ditumbuhi duri di permukaan daunnya, sedangkan pada Solanum torvum Sw. permukaan daunnya rata dan ditumbuhi duri-duri tajam yang tersebar di permukaannya (Gambar 8). Keempat klon yang diuji menunjukkan bentuk permukaan daun yang mirip Solanum melongena cv. Dourga, yakni rata namun ditumbuhi duri-duri tajam.
Gambar 8 Duri pada permukaan atas daun. a) Solanum torvum
Sw., b) Solanum melongena cv. Dourga, c) duri.
Tanaman terung memiliki daun berbentuk bulat telur dengan ujung meruncing dan pangkal berbentuk setengah lingkaran, sedangkan tepi daun bergelombang dengan ujung yang bermacam-macam, mulai dari yang tumpul hingga meruncing. Terdapat lima kelompok pembagian bentuk lobus daun, yaitu sangat lemah (tepi daun rata tidak bergelombang), lemah (sedikit bergelombang),
intermediete (terlihat jelas bergelombang namun ujung belum runcing), kuat (terlihat menjari dan ujung runcing), dan sangat kuat (tepi daun menjari dan terlihat seperti membentuk anak daun) (IBPGR, 1990).
Pada umur 5 MST, lobus daun Solanum melongena cv. Dourga masuk dalam kategori lemah (tepi daun terlihat sedikit bergelombang), sedangkan
Solanum torvum Sw. masuk dalam kategori sangat kuat, yakni tepi daun terlihat seperti membentuk anak daun (Gambar 9). Fusi protoplas kedua tetua ini menghasilkan klon SMST1, SMST2, SMST3, dan SMST4 yang memiliki bentuk lobus daun menjari dan ujung meruncing (kategori kuat) (Tabel 11).
22
Gambar 9 Bentuk daun klon yang diuji pada kondisi in vivo umur 5 MST. a) Solanum torvum Sw., b) Solanum melongena
cv. Dourga, c) SMST1, d) SMST2, e) SMST3, f) SMST4.
Pada pengamatan in vitro dan in vivo terdapat perbedaan hasil yang menarik. Semua klon hibrida somatik dan Solanum melongena cv. Dourga memiliki pertumbuhan yang jauh lebih rendah bila dibandingkan dengan Solanum torvum
Sw pada percobaan in vitro, akan tetapi pertumbuhan klon terlihat lebih cepat bila dibandingkan dengan kedua tetua pada percobaan in vivo. Hal ini mengindikasikan bahwa pada kondisi in vitro, klon-klon hibrida somatik memiliki kemiripan dengan Solanum melongena cv. Dourga yang tidak memiliki kemampuan tumbuh yang baik pada media MS tanpa hormon tumbuh. Pada percobaan in vivo, klon hibrida somatik telah memiliki perakaran dan daun yang cukup, sehingga pertumbuan terjadi dengan baik.
Pada percobaan in vitro, tanaman juga tidak menunjukkan perbedaan dari bentuk daun dan warna batang, sedangkan pada percobaan in vivo, perbedaan pada bentuk daun terlihat dengan jelas. Hal ini disebabkan oleh adanya faktor epigenetik. Pada kondisi in vitro, diferensiasi sel tanaman belum terjadi sepenuhnya, sehingga perbedaan morfologi sulit untuk diamati. Oleh karena itu, pengamatan secara in vitro tidak menguntungkan jika faktor yang diamati adalah keragaan morfologi tanaman.
Morfologi Bunga
Gambar 10 Bentuk bunga klon yang diuji pada kondisi in vivo. a) Solanum melongena cv. Dourga, b) SMST3, c) Solanum torvum Sw. Hasil pengamatan yang dilakukan terhadap pembungaan klon-klon hibrida somatik memperlihatkan bahwa klon SMST2 dan SMST3 berhasil berbunga dengan bentuk dan warna kelopak yang menyerupai Solanum melongena cv. Dourga, akan tetapi tumbuh bergerombol menyerupai Solanum torvum Sw. (Gambar 10). Adapun klon SMST1 dan SMST4 pada waktu yang sama belum menunjukkan tanda-tanda pembungaan. Potensi genetik yang dapat dilihat dari bunga yang tumbuh menggerombol pada hibrida somatik ini adalah kemungkinan untuk mendapatkan tanaman terung dengan jumlah buah yang banyak pada satu tanaman.
Sihachakr et al. (1994) juga telah melakukan fusi protoplas Solanum melongena L. dengan Solanum torvum Sw. dan mendapatkan hibrida somatik yang memiliki karakter morfologi batang dan daun menyerupai Solanum torvum
Sw., sedangkan bunganya menyerupai bunga Solanum melongena L.
Analisis Gerombol
Analisis gerombol dilakukan berdasarkan keragaan fenotipik tanaman di lapangan yang terdiri dari delapan karakter, yaitu tinggi tanaman, warna batang, jumlah daun, panjang daun, panjang tangkai daun, jumlah duri pada permukaan daun, warna tangkai daun, dan bentuk tepi daun. Kekerabatan tanaman dalam pengelompokan ini didasarkan pada karakter yang dimiliki oleh masing-masing tanaman dan dibuat skor untuk analisis gerombol.
Dendogram (Gambar 11) menunjukkan kekerabatan hubungan antar individu tanaman. Semakin dekat jarak yang satu dengan yang lain, maka semakin dekat pula kekerabatannya. Berdasarkan hasil analisis gerombol, klon-klon tersebut dapat dikelompokkan menjadi dua kelompok menurut jarak kedekatan (similarity) dengan persentase kemiripan > 80% (Tabel 12).
24
Tabel 12 Pengelompokan tanaman dengan kekerabatan lebih dari 80% Kelompok Jenis klon
I Solanum torvum Sw, SMST1, SMST2, SMST3, SMST4 II Solanum melongena cv. Dourga
Gambar 11 Dendogram klon berdasarkan karakter kualitatif dan kuantitatif.
SIMPULAN DAN SARAN
Simpulan
Pada percobaan in vitro, keragaan fenotipik semua peubah pada klon-klon yang diuji menunjukkan kemiripan dengan Solanum melongena cv. Dourga dan berbeda nyata dengan Solanum torvum Sw. Pada percobaan in vitro, klon SMST1, SMST2, dan SMST4 memiliki kemampuan tumbuh lebih baik dari klon SMST3 dan SMST5.
Pada percobaan in vivo, klon-klon yang diuji menunjukkan perbedaan yang nyata pada peubah tinggi tanaman dan jumlah duri pada permukaan daun, sedangkan pada peubah jumlah daun, panjang daun, dan panjang tangkai daun, klon-klon yang diuji tidak menunjukkan perbedaan yang signifikan dengan kultivar pembanding. Hasil analisis gerombol memperlihatkan bahwa klon-klon yang diuji memiliki kekerabatan yang lebih dekat kepada Solanum torvum Sw. dibandingkan dengan Solanum melongena cv. Dourga.
Saran
Diperlukan penelitian lanjutan pada periode generatif, sehingga dapat diketahui apakah klon-klon yang diuji memiliki sifat-sifat yang diinginkan oleh pemulia tanaman, yakni terung hibrida yang fertil dan tahan terhadap penyakit layu bakteri.
DAFTAR PUSTAKA
Agrawal AD, Bajpei PS, Patil AA, Bavaskar SR. 2010. Solanum torvum Sw. – A Phytopharmacological review. Der Pharmacia Lettre 2(4):403-407.
[BPS] Badan Pusat Statistik. 2012. Produksi sayuran di Indonesia. [Diakses 2011 Sep 24]. Tersedia pada: http://www.bps.go.id/tab_sub/view.php?tabel=1& daftar=1&id_subyek=55¬ab=20.
[BMKG] Badan Meteorologi Klimatologi dan Geofisika. 2012. Buletin analisis hujan dan indeks kekeringan bulan April 2012 dan prakiraan hujan bulan Juni, Juli, dan Agustus 2012. [diunduh 2013 Mar 2] tersedia pada: http://bekasikota.go.id/files/fck/Prak%20Jabar%20Juni%202012-B%20ok. pdf.
Brown DCW, Thorpe TA. 1995. Crop improvement through tissue culture. World journal of Microbio and biotech(11):409-415.
Budi EL. 2002. Evaluasi ketahanan nomor-nomor tanaman hasil fusi protoplas antara terung (Solanum melongena cv. Dourga) dengan terung pipit (Solanum torvum CN2) terhadap penyakit layu bakteri Rastolnia solanacearum [Skripsi]. Bogor (ID): Institut Pertanian Bogor. 27 hlm. Campbell NA, Reece JB, Mitchell LG. 2003. Biologi. Ed ke-5. Jilid ke-2. Jakarta.
Erlangga. 472 hlm.
Charaya P, Sanghera GS, Gossal SS. 2011. Effect of genotype and explants on direct in vitro regeneration in brinjal (Solanum melongena L.).Jour Pl Sci Res 27(1):37-43.
Collonier C, Mulya K, Fock I, Mariska I, Servaes A, Vedel F, Yakovlev SS, Souvannavong V, Ducreux G, Sihachakr D. 2001. Source of resistance against Rastolnia solanacearum in fertile somatic hybrids of eggplant (Solanum melongena L.) with Solanum aethiopicum L. Plant Science 160:301-313.
26
Ferdausi A, Nath UK, Das BL, Alam MS. 2009. In vitro regeneration system in brinjal (Solanu melongena L.) for stress tolerant somaclone selection. Bangladesh Agril. Univ. 7(2): 253 – 258.
Francis J. 2013. K. Solanum torvum Sw. (Solanaceae): turkey berry. [Diunduh pada 2013 Jan 10]. Tersedia pada: http://www.fs.fed.us/global/iitf/pdf/ shrubs/Solanum%20torvum.pdf.
Husni A. 2002. Studi regenerasi protoplas tanaman terung (Solanum melongena
L.) dan ketahanan regeneran terhadap penyakit bakteri layu (Rastolnia solanacearum) [Tesis]. Bogor (ID): Institut Pertanian Bogor. 59 hal.
Husni A, Mariska I, Hobir. 2004. Fusi protoplas dan regenerasi hasil fusi antara
Solanum melongena dan Solanum torvum Sw. Bioteknologi Pertanian 9(1): 1-7.
Husni A. 2010. Fusi Interspesies antara Jeruk Siam Simadu (Citrus nobilis Lour.) dengan Mandarin Satsuma (Citrus unshiu Marc.) [Disertasi]. Bogor (ID): Institut Pertanian Bogor. 149 hal.
[IBPGR] International Board for Plant Genetic Resources. 1990. Descriptors for Eggplant. Rome: IBPR pr. 23 hlm.
Kallo. 1986. Vegetable Breeding volume II. Florida: CRC Inc. 2122 hlm.
Lestari EG. Regenerasi tanaman secara in vitro dan faktor-faktor yang mempengaruhi. [diakses 2013 Jan 9]. Tersedia pada: http://biogen. litbang.deptan.go.id/index.php/2012/11/regenerasi-tanaman-secara-in-vitro-dan-faktor-faktor-yang-mempengaruhi/.
Magioli C, Mansur E. 2004. Eggplant (Solanum melongena L.): tissue culture, genetic transformation, and use as alternative model plant. Acta bot. Bras. 19(1):139-148.
Markle LT, Overholt WA, Langeland KA. 2008. Natural areas weeds: invasive Solanum spp. In Florida. SS AGR 312: 1-7.
Mariska I, Husni A. 2006. Perbaikan sifat genotipe melalui fusi protoplas pada tanaman lada, nilam, dan terung. Litbang Pertanian 25(2):55-60.
McCommon KR, Honma S. 1983. Morphological and cytogenetic
analyses of an
interspesific hybrid eggplant, Solanum melongena xSolanum torvum. Hort. Science 18(6): 894-895.
Moreira CB, Lima SS, Esquibel MA, Sato A. 2010. Solasodine acumulation in regenerated plants of Solanum torvum Sw. Revista brasileira de plantas medicinais12(1). [diunduh 2012 Sep 11]. Tersedia pada: http:// www.scielo.br/scielo.php?script=sci_arttext&pid=S1516057220100001000 11&lng=en&nrm=iso&tlng=en
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Pantarum 15: 473-497 Putri. 2002. Keragaan fenotipik hibrida somatik hasil fusi protoplas antara BF15
dengan Solanum stenotomum secara in vitro [Skripsi]. Bogor (ID): Institut Pertanian Bogor. 39 hlm.
Ray PB, Hasan L, Sarker SK. 2011. In vitro cultivation and regeneration of Solanum melongena (L.) using stem, root and leaf
explants. Nepal J. Biotech 1(1): 49-54. Rochmah S. 2001. Karakterisasi morfologi dan produksi tanaman hibrida somatik
dan kultur anther hasil fusi protoplas antara terung (Solanum melongena L.) dengan kerabat liarnya [Skripsi]. Bogor (ID): Institut Pertanian Bogor. 102 hal.
Rubatzky VE, Yamaguchi M. 1999. World Vegetable: Principle, Production, and Nutrition Value. Edisi K-2. Maryland: Aspen Publisher, Inc.
Saputra D. 2002. Evaluasi ketahanan hibrid somatik Solanum melongena dengan
Solanum aethiopicum dan turunannya terhadap penyakit layu bakteri [Skripsi]. Bogor (ID): Institut Pertanian Bogor. 38 hlm.
Shepard J F, Bidney D, Barsby T, Kemble R. 1983. Genetic transfer in plants through interspesific protoplast fusion. Science 219:683-688.
Sigee DC. 1993. Bacterial Plant Pathology: Cell and Molekular Aspects. Inggris: Cambridge Univ Pr. 318 hlm.
Sihachakr D, Daunay MC, Serraf I, Chaput MH, Mussio I, Haicour R, Rossignol L, Ducreux G. 1994. Somatic hybridization of eggplant (Solanum melongena L.) with its close and wild relatives. P. 255-278. In Bajaj YPS (Eds.). Somatic Hybridization in Crop Improvement I. Biotechnology in Agriculture and Forestry Vol.27. Springer-Veriag Berlin Heidelberg.
Smith RH, Gould JH. 2013. Introduction/T. Murashige and F. Skoog: Part 1 / Propagation and Tissue Culture. [diunduh 2013 Mar 4]. Tersedia pada: http://essm.tamu.edu/media/46257/murashigeandskoogintropapersjanick.pdf. Splittstoesser WE. 1990. Vegetable Growing Handbook: Organic and Traditional
28
Tahat MM, Sijam K. 2010. Rastolnia solanacearum: the bacterial wilt causal agent. Plant Science 9(7):385-393.
[USDA] United State Departemen of Agriculture. 2012a. Plant profile: Solanum melongenaL. [diakses 2012 Apr 5]. Tersedia pada: http://plants.usda.gov /java/nameSearch?keywordquery=solanum+melongena&mode=sciname&s ubmit.x=0&submit.y=0.
[USDA] United State Departemen of Agriculture. 2012b. Plant profile: Solanum torvumSw. [diakses 2012 Apr 5]. Tersedia pada: http://plants.usda.gov /java/nameSearch?keywordquery=solanu-m+torvum&mode=sciname&sub mit.x=0&submit.y=0.
Lampiran 1 Kriteria skoring analisis gerombol (IBPGR, 1990)
Karakter Kriteria skoring
Tinggi tanaman umur 5 MST 1. sangat pendek (<20 cm) 3. pendek (~30 cm) 5. sedang (~60 cm) 7. tinggi (~100 cm) 9. sangat tinggi (>150 cm)
Jumlah daun 5 MST 1.sangat lemah (~2) 3. lemah (~5) 5. sedang (~10) 7. Kuat (~20) 9. sangat kuat (>30)
Warna batang 5 MST 1.hijau 3. hijau keunguan 5. ungu 6. ungu gelap 9. coklat gelap
Panjang daun 5 MST 3. pendek (~10 cm) 5. Sedang (~20 cm) 7. panjang (~30 cm)
Panjang tangkai daun 5 MST 1.sangat pendek (<5 cm) 3. Pendek (~10 cm) 5. sedang (~30 cm) 7. Panjang (~50 cm) 9. sangat panjang (>100 cm)
Warna tangkai daun 5 MST 1.hijau 3. Hijau keunguan 5. ungu 6. Ungu gelap 9. coklat gelap
Jumlah duri pada permukaan atas daun 5 MST
0. tidak ada 1. Sangat sedikit (1-2) 3. sedikit (3-5) 5. Sedang (6-10) 7. banyak (11-20) 9. Sangat banyak (>20) Bentuk tepi daun 1.sangat lemah 3. Lemah
30
Lampiran 2 Skoring analisis gerombol
Klon Tinggi
tanaman
Warna batang
Jumlah daun
Warna tangkai daun
Panjang daun
Panjang tangkai daun
Bentuk tepi daun
Jumlah duri pada
permukaan atas daun
S. melongena cv. Dourga 3.00 1.00 4.33 1.00 5.67 3.00 3.00 0.00
S. torvum Sw. 1.00 3.00 4.50 3.00 5.00 3.00 9.00 6.50
SMST1 1.44 3.00 3.00 3.00 3.67 2.56 7.00 5.00
SMST2 2.25 3.00 3.00 3.00 4.25 3.00 7.00 5.00
SMST3 2.00 3.00 3.00 3.00 4.00 2.50 7.00 5.75