ISOLASI FRAKSI AKTIF ANTIBAKTERI DARI
EKSTRAK ETIL ASETAT BUAH PARIJOTO
(Medinilla speciosa
Blume)
SKRIPSI
SYAIMA
1111102000056
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ISOLASI FRAKSI AKTIF ANTIBAKTERI DARI
EKSTRAK ETIL ASETAT BUAH PARIJOTO
(Medinilla speciosa
Blume)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
SYAIMA
1111102000056
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Nama : Syaima
Program Studi : Farmasi
Judul Skripsi : Isolasi Fraksi Aktif Antibakteri dari Ekstrak Etil Asetat Buah Parijoto (Medinilla speciosaBlume)
Parijoto (Medinilla speciosaBlume) merupakan tanaman obat yang telah banyak digunakan masyarakat untuk mengobati penyakit sariawan, diare, kolesterol serta sebagai nutrisi bagi ibu hamil. Penelitian terdahulu menyebutkan bahwa ekstrak etil asetat buah parijoto memiliki aktivitas antibakteri terbesar dibandingkan ekstrak metanol dan n-heksan terhadap Staphylococcus aureus dan Escherichia coli. Penelitian ini bertujuan untuk mengisolasi ekstrak etil asetat buah parijoto dan mengetahui aktivitas antibakteri dari fraksi-fraksi hasil isolasi. Ekstrak etil asetat diperoleh dengan metode maserasi dan partisi. Isolasi fraksi dilakukan dengan teknik kromatografi kolom. Fraksi hasil isolasi diuji aktivitas antibakteri dengan menggunakan metode bioautografi langsung pada konsentrasi 50 mg/mL terhadap Staphylococcus aureus dan Escherichia coli. Hasil kromatografi kolom didapatkan 25 fraksi dan dari uji aktivitas 25 fraksi diketahui bahwa 21 fraksi aktif terhadap Staphylococcus aureus dan Escherichia coli, 2 fraksi aktif hanya terhadap Staphylococcus aureus, dan 2 fraksi aktif hanya terhadap Escherichia coli. Fraksi 13 mempunyai aktivitas antibakteri tertinggi terhadap Staphylococcus aureus yaitu sebesar 18,5 mm. Sedangkan fraksi 24 mempunyai aktivitas antibakteri tertinggi terhadapEscherichia coli yaitu sebesar 14,7 mm.
Name : Syaima
Program Study : Pharmacy
Title : Isolation of Active Antibacterial Fraction from Ethyl Acetate ExtractMedinilla speciosaBlume
Parijoto (Medinilla speciosa Blume) is an medicinal plant that has widely been used of society to treat the disease like mouth sores, diarrhea, antihyperlipidemia, and nutrients for pregnant women. The previous research showed that ethyl acetate extract of Medinilla speciosahad the most extensive antibacterial activity compared to methanol extract and n-hexane extract againstStaphylococcus aureus and Escherichia coli. This research aimed to isolate ethyl acetate extract of Medinilla speciosa and to investigate the antimicrobial activity of isolated fractions. Ethyl acetate extract was obtained with maseration and partition method. Isolation of fractions conducted through the column chromatography technique. Fractions were carried out by bioautography thin layer chromatography at concentration 50 mg/mL against Staphylococcus aureus and Escherichia coli. The results of column chromatography were 25 isolated fractions, and antibacterial test of isolated fractions showed that 21 fractions were active against Staphylococcus aureus and Escherichia coli, 2 fractions were active against Staphylococcus aureus only, and 2 fractions were active against Escherichia coli only. Fraction 13 has the highest antibacterial activity to Staphylococcus aureus that is 18.5 mm. While fraction 24 has the highest antibacterial activity to Escherichia colithat is 14.7 mm.
Alhamdulillah, pujji syukur saya panjatkan kepada Allah azza wa jalla
yang telah melimpahkan rahmat dan karuniaNya kepada saya. Sholawat serta
salam semoga selalu tercurah kepada junjungan kita Nabi Muhammad SAW.
Berkat rahmat dan pertolongan Allah, saya dapat menyelesaikan penelitian dan
penulisan skripsi yang berjudul “Isolasi Fraksi Aktif Antibakteri dari Ekstrak Etil
Asetat Buah Parijoto (Medinilla speciosa Blume)”. Skripsi ini disusun sebagai
salah satu syarat untuk memperoleh gelar Sarjana Farmasi dari Program Studi
Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
Penulis menyadari bahwa tanpa bantuan dan bimbingan dari berbagai
pihak mulai dari masa perkuliahan hingga penyusunan skripsi, sangatlah sulit
untuk menyelesaikan skripsi ini. Dalam kesempatan ini, penulis menyampaikan
terimakasih kepada :
1. Ibu Puteri Amelia, M.Farm., Apt dan Ibu Ismiarni Komala, Ph.D., Apt
selaku dosen pembimbing yang dengan penuh kesabaran telah banyak
memberikan bimbingan, arahan, ilmu, waktu, tenaga, dan semangat selama
proses penyelesaiian penelitian ini.
2. Prof. Dr. Arief Sumantri S.KM, M.KM selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Bapak Yardi, Ph.D., Apt selaku ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta yang telah memberikan motivasi dan dukungan.
4. Bapak dan Ibu dosen pengajar Program Studi Farmasi Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta
yang telah banyak memberikan ilmu dan teladan selama masa perkuliahan.
5. Kedua orang tua terkasih, Abi Farid Ahmad Okbah dan Mama Jamilah
Ganis atas kasih sayang, dukungan, semangat, doa yang tiada henti, serta
hiburan, dan doa yang saya butuhkan.
7. Sahabat-sahabat yang mendampingi hari-hari saya selama 3 tahun,
Umniyaty Mufidah dan Athirotin Halawiyah, yang telah banyak
memberikan semangat, motivasi, dukungan, nasihat-nasihat yang
membangun, serta kepada M.Saiful Amin yang telah banyak membantu
dalam proses pengerjaan penelitian ini.
8. Keluarga Akademi Thibbun Nabawi angkatan 5 yang selalu mendukung,
mendoakan, memberikan hiburan. Semoga kebersamaan dan kekeluargaan
ini terus terjalin.
9. Teman-teman seperjuangan Farmasi angkatan 2011 atas persaudaraan dan
pertemanan yang berkesan selama 4 tahun ini.
10. Pihak-pihak yang tidak dapat disebutkan satu persatu yang telah membantu
kelancaran pengerjaan skripsi ini.
Semoga Allah azza wa jalla membalas kebaikan semua pihak yang telah
membantu. Akhirnya dengan segala kerendahan hati, penulis berharap kritik
dan saran atas kekurangan dan keterbatasan penelitian ini. Semoga hasil
penelitian ini bermanfaat untuk banyak pihak dan perkembangan ilmu
pengetahuan.
Ciputat, Juli 2015
HALAMAN JUDUL... ii
2.1 TanamanMedinilla speciosa Blume... 4
2.2 Simplisia... 6
3.1 Tempat dan Waktu Penelitian... 28
3.2 Alat dan Bahan... 28
3.3 Cara Kerja... 29
3.3.1 Penyiapan Simplisia... 29
3.3.2 Pembuatan dan Partisi Ekstrak... 29
3.3.3 Skrining Fitokimia... 30
3.4.5.3 Rekristalisasi... 33
3.3.6 Pewarnaan Gram... 34
3.3.7 Uji Aktivitas Antibakteri... 34
3.3.8 Uji Kemurnian Senyawa... 36
BAB 4 HASIL DAN PEMBAHASAN ... 37
4.1 Pemeriksaan Simplisia ... 37
4.2 Penyiapan Simplisia ... 37
4.3 Ekstraksi dan Partisi ... 37
4.4 Pengukuran Kadar Air Ekstrak Etil Asetat ... 39
4.5 Uji Penapisan Fitokimia Ekstrak Etil Asetat ... 39
4.6 Isolasi Senyawa Menggunakan Kromatrografi Kolom ... 40
4.7 Uji Bioautografi Non-Elusi Fraksi ... 43
4.8 Pemurnian dan Uji Kemurnian Fraksi 9... 51
4.9 Uji Bioautografi Elusi Fraksi 9 ... 52
BAB 5 KESIMPULAN DAN SARAN ... 56
5.1 Kesimpulan... 56
5.2 Saran... 56
Gambar 2.1 Pohon dan BuahMedinilla speciosa... 5 Gambar 2.2 Rumus bangun Kloramfenikol... 17 Gambar 4.1 Profil KLT eluat hasil fraksinasi dari ekstrak etil asetat
dengan kromatrografi kolom ... 41 Gambar 4.2 Profil KLT fraksi gabungan... 42 Gambar 4.3 Hasil pewarnaan Gram bakteri S.aureus dan E.coli di
bawah mikroskop perbesaran 100 x 10 ... 44 Gambar 4.4 Hasil uji bioautografi dari ekstrak etil asetat terhadap
bakteriS.aureusdanE.coli... 48 Gambar 4.5 Profil KLT fraksi 9 sebelum rekristalisasi... 51 Gambar 4.6 Profil KLT 2 dimensi fraksi 9 setelah rekristalisasi ... 52 Gambar 4.7 Hasil uji bioautografi elusi fraksi 9 terhadap S.aureus
Tabel 2.1 Perbedaan ciri-ciri bakteri Gram positif dan Gram negatif 10 Tabel 4.1 Hasil rendemen ekstrak n-heksan, etil asetat, dan metanol . 38 Tabel 4.2 Hasil uji penapisan fitokimia ekstrak etil asetat ... 39 Tabel 4.3 Hasil uji bioautografi fraksi dari ekstrak etil asetat
Lampiran 1. Hasil determinasi tanamanMedinilla speciosaBlume ... 63 Lampiran 2. Bagan alur penelitian... 64 Lampiran 3. Bagan alur kerja ekstraksi dan partisi buah Medinilla
speciosa ... 65 Lampiran 4. Bagan kerja fraksinasi dengan kromatografi kolom ... 66 Lampiran 5. Bobot masing-masing fraksi hasil kromatografi kolom.. 67 Lampiran 6. Data profil KLT eluat hasil fraksinasi dari ekstrak etil
asetat dengan kromatrografi kolom... 68 Lampiran 7. Bagan alur kerja uji antibakteri dengan metode
1.1.Latar Belakang
Penyakit infeksi merupakan salah satu masalah kesehatan dengan
prevalensi yang cukup tinggi di Indonesia. Infeksi adalah proses invasif oleh
mikroorganisme dan berproliferasi di dalam tubuh yang menyebabkan sakit
(Potter & Perry, 2005). Infeksi dapat disebabkan oleh virus, jamur, parasit, dan
bakteri. Bakteri patogen yang sering menyebabkan infeksi pada manusia
diantaranya adalah Staphylococcus aureus dan Escherichia coli. Infeksi oleh
S.aureus ditandai dengan kerusakan jaringan yang disertai abses bernanah.
Beberapa penyakit infeksi yang disebabkan oleh S. aureus adalah bisul, jerawat,
impetigo, dan infeksi luka. Infeksi yang lebih berat diantaranya pneumonia,
mastitis, plebitis, meningitis, infeksi saluran kemih, osteomielitis, dan
endokarditis. S. aureus juga merupakan penyebab utama infeksi nosokomial,
keracunan makanan, dan sindroma syok toksik (Ryan,et al., 1994; Warsa, 1994).
Infeksi yang disebabkan oleh E.coli adalah infeksi saluran kemih, diare, sepsis,
dan meningitis (Jawetzet al., 1996).
E. coli adalah bakteri yang merupakan anggota flora normal usus. E. coli
berperan penting dalam sintesis vitamin K, konversi pigmen-pigmen empedu,
asam-asam empedu dan penyerapan zat-zat makanan.E. colimenjadi patogen jika
jumlah bakteri ini dalam saluran pencernaan meningkat atau berada di luar usus
(Jawetz et al., 1996). Pengobatan infeksi dilakukan dengan pemberian antibiotik,
tetapi banyak bakteri yang telah resisten terhadap antibiotik sehingga perlu
dilakukan pencarian antibakteri baru.
Penelitian-penelitian pencarian bahan antibakteri telah banyak dilakukan
terutama dari berbagai jenis tumbuhan. Para ilmuwan terus berusaha untuk
mencari sumber antibakteri baru. Tumbuhan yang digunakan untuk obat
tradisional dapat dijadikan alternatif pencarian zat antibakteri, karena pada
umumnya memiliki senyawa aktif yang berperan dalam bidang kesehatan (Zuhud,
Tumbuhan dikenal mengandung berbagai golongan senyawa kimia
tertentu sebagai bahan obat yang mempunyai efek fisiologis terhadap organisme
lain, atau sering disebut sebagai senyawa bioaktif. Kurang lebih 80% obat-obatan
yang digunakan oleh masyarakat Indonesia berasal dari tumbuhan obat. Telah
banyak senyawa aktif asal tumbuhan yang memasuki aplikasi komersial untuk
berbagai kegunaan. Senyawa alam hasil isolasi dari tumbuhan, juga digunakan
sebagai bahan asal untuk sintesis bahan-bahan biologis aktif dan sebagai senyawa
model untuk merancang senyawa baru yang lebih aktif dengan sifat toksik yang
lebih rendah (Sasongko, 2002).
Indonesia merupakan negara dengan kekayaan alam yang melimpah.
Hampir segala jenis tumbuhan dapat tumbuh di wilayah negara ini. Wilayah hutan
tropika Indonesia memiliki keanekaragaman hayati tertinggi ke-2 di dunia setelah
Brazil. Sebanyak 40.000 jenis flora yang ada di dunia, terdapat 30.000 jenis dapat
dijumpai di Indonesia dan 940 jenis diantaranya diketahui berkhasiat sebagai obat
dan telah dipergunakan dalam pengobatan tradisional secara turun-temurun oleh
berbagai etnis di Indonesia. Jumlah tumbuhan obat tersebut sekitar 90% dari
jumlah tumbuhan obat yang terdapat dikawasan Asia (Masyhud, 2010).
Popularitas dan perkembangan obat tradisional semakin meningkat seiring
dengan slogan “kembali ke alam” yang kian menggema sehingga banyak yang
tertarik untuk mengeksporasi manfaat tumbuhan negeri ini. Diantara tumbuhan
yang digunakan dan diteliti adalah buah parijoto (Medinilla speciosa Blume) yang
merupakan anggota famili Melastomataceae. Buah parijoto merupakan tanaman
khas dari Desa Colo Kecamatan Dawe Kabupaten Kudus Jawa Tengah.
M.speciosa tumbuh liar di lereng-lereng gunung atau di hutan-hutan dan kadang
dibudidayakan sebagai tanaman hias (Wibowo,dkk., 2012).
Buah parijoto telah digunakan secara empiris untuk mengobati penyakit
sariawan, diare, kolesterol serta sebagai nutrisi bagi ibu hamil (Anonim, 2013).
Berdasarkan penelitian yang dilakukan oleh Wachidah (2013), ekstrak buah
parijoto memiliki berbagai kandungan kimia, seperti: saponin, glikosida,
flavonoid, dan tannin. Flavonoid, saponin, dan tanin dapat menghambat
Pada penelitian sebelumnya (Mukarromah, 2015) telah dilaporkan bahwa
ekstrak etil asetat buah parijoto memiliki aktivitas antibakteri paling besar
terhadap bakteri Staphylococcus aureus dan Escherichia coli dibandingkan
dengan ekstak metanol atau ekstak n-heksan buah parijoto. Oleh karena itu, sangat
perlu untuk melakukan isolasi dari ekstak etil asetat buah parijoto.
1.2.Rumusan Masalah
Rumusan masalah yang mendasari penelitian ini adalah manakah diantara
fraksi-fraksi hasil isolasi dari ekstrak etil asetat buah parijoto yang menunjukkan
aktivitas antibakteri terhadap bakteriStaphylococcus aureusdanEscherichia coli.
1.3.Tujuan Penelitian
Tujuan yang diharapkan dari penelitian ini adalah memberikan informasi
mengenai aktvitas antibakteri dari fraksi-fraksi hasil isolasi ekstrak etil asetat buah
parijoto terhadap bakteriStaphylococcus aureusdanEscherichia coli.
1.4. Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi salah satu sumber informasi
ilmiah mengenai aktivitas antibakteri dari buah Medinilla speciosa Blume yang
berguna bagi perkembangan ilmu pengetahuan dan menjadi dasar informasi untuk
2.1. TanamanMedinilla speciosaBlume
2.1.1. Klasifikasi Tanaman
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua /dikotil)
Sub Kelas : Rosidae
Ordo : Myrtales
Famili : Melastomataceae
Genus : Medinilla
Spesies :Medinilla speciosaBlume
(www.plantamor.com)
2.1.2. Morfologi Tanaman
Parijoto merupakan tanaman perdu dengan tinggi 1-2 m, batang bulat,
kulit dengan lapisan gabus jika tua, bergerigi, kasar, putih kecoklatan; daun
tunggal, bersilang berhadapan, tangkai pendek, bulat, lunak, warna ungu
kemerahan, helaian daun berbentuk lonjong, pangkal dan ujung runcing, tepi rata,
panjang 10-20 cm, lebar 5-15 cm, pertulangan melengkung, permukaan atas licin,
berwarna hijau, permukaan bawah kasar, warna hijau kelabu; bunga majemuk, di
ketiak daun, sempurna, berkelamin ganda, kelopak 5 helai, ujung runcing, pangkal
berlekatan, panjang 3-8 mm, warna ungu tua, benang sari 2 kali lipat jumlah
mahkota, kepala sari berupa kuncup membengkok, warna merah keunguan, kepala
putik duduk di atas bakal buah, kepala putik bulat, ungu, mahkota lepas, 5 helai,
bentuk kuku, panjang 5-8 mm, warna merah muda; buah buni, bulat, bagian ujung
berbenjol bekas pelekatan kelopak, diameter 5-8 mm, warna merah keunguan; biji
(a) (b)
Gambar 2.1Pohon (a) dan Buah (b)Medinilla speciosa
(Sumber : Koleksi pribadi)
2.1.3. Tempat Tumbuh
Medinilla speciosamerupakan tumbuhan liar di lereng-lereng gunung atau
di hutan-hutan dan kadang dibudidayakan sebagai tanaman hias. Tumbuhan ini
tumbuh baik pada tanah yang berhumus tinggi dan lembab, pada ketinggian 800
m sampai 2.300 m di atas permukaan laut. Berbunga pada bulan November –
Januari dan waktu panen yang tepat bulan Maret–Mei (Anonim, 2013).
2.1.4. Khasiat
Secara tradisional buah parijoto digunakan sebagai obat sariawan,
antiradang dan antibakteri (Anonim, 2013). Parijoto dipercaya oleh masyarakat di
daerah Gunung Merapi dapat meningkatkan kesuburan janin dan kesehatan ibu
(Anggana, 2011).
2.1.5. Kandungan Kimia
Buah parijoto memiliki berbagai kandungan kimia yaitu: saponin,
glikosida, flavonoid, dan tannin (Wachidah, 2013). Flavonoid yang merupakan
senyawa fenol dapat menyebabkan penghambatan terhadap sintesis dinding sel
(Mojab et al., 2008). Flavonoid yang merupakan senyawa fenol dapat bersifat
koagulator protein (Dwijoseputro, 1994). Protein yang menggumpal tidak akan
Pada konsentrasi yang biasa digunakan (larutan dalam air 1-2%), fenol dan
derivatnya menimbulkan denaturasi protein (Jawetz et al., 1996). Saponin
merupakan zat hemolitik yang kuat serta memiliki sifat seperti sabun. Saponin
juga bersifat spermisida, antimikrobia, antiperadangan dan memiliki aktivitas
sitotoksik (Tjay dan Rahardja, 2002).
Kandungan senyawa kimia lain, yaitu tanin, mempunyai sifat sebagai
pengelat berefek spasmolitik, yang dapat mengerutkan membran sel sehingga
mengganggu permeabilitas sel. Akibat terganggunya permeabilitas, sel tidak dapat
melakukan aktivitas hidup sehingga pertumbuhannya terhambat atau bahkan mati.
Efek antibakteri tanin antara lain melalui reaksi dengan membran sel, inaktivasi
enzim dan destruksi atau inaktivasi fungsi materi genetik (Ajizah, 2004).
2.2. Simplisia (Depkes, 2000)
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, berupa
bahan yang dikeringkan. Simplisia dibedakan menjadi simplisia nabati, simplisia
hewani dan simplisia mineral. Simplisia nabati adalah simplisia yang berupa
tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan.
Eksudat tumbuhan adalah isi sel yang secara spontan keluar dari tumbuhan
atau isi sel yang dengan cara tertentu dikeluarkan dari selnya, atau senyawa nabati
lainnya yang dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa
senyawa kimia murni.
2.3. Ekstraksi
2.3.1. Pengertian Ekstraksi dan Ekstrak
Ekstraksi merupakan pemisahan zat berkhasiat yang terkandung dalam
jaringan tumbuhan atau hewan dari komponen inaktif atau inert menggunakan
pelarut selektif (Handa, 2008). Hasil dari ekstraksi disebut ekstrak. Menurut FI
IV, ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
Ekstrak dikelompokan atas dasar sifatnya, yaitu (Voight, 1995) :
a. Ekstrak encer adalah sediaan yang memiliki konsistensi semacam madu
dan dapat dituang.
b. Ekstrak kental adalah sediaan yang dilihat dalam keadaan dingin dan tidak
dapat dituang. Kandungan airnya berjumlah sampai 30%.
c. Ekstrak kering adalah sediaan yang memiliki konsistensi kering dan
mudah dituang, sebaiknya memiliki kandungan lembab tidak lebih dari
5%.
d. Ekstrak cair adalah ekstrak yang dibuat sedemikiannya sehingga 1 bagian
simplisia sesuai dengan 2 bagian ekstrak cair.
2.3.2. Metode Ekstraksi
Metode ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu :
A. Ekstraksi dengan Cara Dingin
1. Maserasi
Maserasi adalah proses ekstraksi dengan cara merendam simplisia dengan
pelarut tertentu dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruangan. Jumlah pelarut yang dipakai tergantung pada banyaknya
sampel. Cara ini dapat menarik zat-zat berkhasiat yang tidak tahan pemanasan
(Depkes, 2000).
Maserasi merupakan cara ekstraksi yang paling sederhana. Dasar dari
maserasi adalah melarutnya bahan kandungan simplisia dari sel yang rusak, yang
terbentuk pada saat penghalusan, ekstraksi (difusi) bahan kandungan dari sel yang
masih utuh. Setelah selesai waktu maserasi, artinya keseimbangan antara bahan
yang diekstraksi pada bagian dalam sel dengan masuk ke dalam cairan, telah
tercapai maka proses difusi segera berakhir. Selama maserasi, tujuan
dilakukannya pengocokan berulang adalah untuk menjamin keseimbangan
konsentrasi bahan ekstraksi yang lebih cepat di dalam cairan. Keadaan diam
selama maserasi menyebabkan turunnya perpindahan bahan aktif. Semakin besar
perbandingan simplisia terhadap cairan pengekstraksi, akan semakin banyak hasil
2. Perkolasi
Perkolasi adalah proses ekstraksi menggunakan alat perkolator yang
dilakukan dengan cara mengalirkan cairan pelarut organik pada sampel yang
sebelumnya telah dibasahi. Prinsip dari metode perkolasi adalah pelarut yang
telah jenuh yang berada di dalam perkolator akan digantikan oleh pelarut yang
lebih baru dan segar. Ekstraksi ini membutuhkan pelarut yang lebih banyak
(Depkes, 2000).
B. Ekstraksi dengan Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna
(Depkes, 2000).
2. Sokhlet
Soklet adalah ekstraksi menggunakan pelarut yang selalu baru, umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi terus menerus dengan
jumlah pelarut relatif konstan dengan adanya pendingin balik. Dalam metode ini,
simplisia diletakkan di dalam kantong yang terbuat dari kertas saring dan
ditempatkan dalam alat Sokhlet. Pelarut dipanaskan sampai menguap dan uap
yang dihasilkan akan mengalami kondensasi dan mengekstraksi simplisia
(Depkes, 2000 dan Handa, 2008).
3. Digesti
Digesti merupakan metode maserasi kinetik (dengan pengadukan terus
menerus) yang menggunakan temperatur hangat yaitu 30-40 0C selama proses
ekstraksinya. Metode ini digunakan untuk sampel yang pada suhu kamar tidak
tersari dengan baik (Depkes, 2000 dan Handa, 2008).
4. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
selama waktu tertentu (15-20 menit). Infus dapat dikatakan sebagai metode
modifikasi dari maserasi (Singh, 2008).
5. Dekok
Dekok adalah infus pada waktu yang lebih dan pada temperatur sampai
titik didih air (Depkes, 2000). Metode ini digunakan untuk mengekstraksi zat
yang larut air dan stabil terhadap pemanasan.
2.4. Tinjauan Bakteri
2.4.1. Karakteristik Bakteri
Bakteri adalah sekelompok mikroorganisme yang bersel satu, tidak
berklorofil, berkembang biak dengan pembelahan diri, dan sangat kecil hingga
hanya terlihat dengan bantuan mikroskop (Dwidjoseputro, 1994).
Ada beberapa bentuk dasar bakteri yaitu (Pratiwi, 2008) :
1. Bulat (cocus atau cocci)
2. Batang atau silinder (bacillus atau bacilli)
3. Spiral
Umumnya bakteri adalah monomorfik (memiliki hanya satu bentuk)
namun ada bakteri tertentu yang memiliki banyak bentuk (pleomorfik) misal
bentuk iregular pada termoplasma. Sebagian besar bakteri memiliki diameter
dengan ukuran 0,2-2,0 mm dan panjang berkisar 2-8 mm. Biasanya sel-sel bakteri
muda berukuran jauh lebih besar daripada sel-sel yang tua. Bentuk dan ukuran
suatu bakteri dapat dipengaruhi oleh faktor lingkungan seperti temperatur
inkubasi, umur kultur, dan komposisi media pertumbuhan (Pratiwi, 2008).
2.4.2. Bakteri Gram Positif dan Negatif
Berdasarkan pewarnaan Gram, bakteri dapat dibedakan menjadi dua
golongan, yaitu bakteri Gram positif dan bakteri Gram negatif. Contoh bakteri
Gram positif diantaranya adalah Staphyloccocus aureus dan Bacillus subtilis.
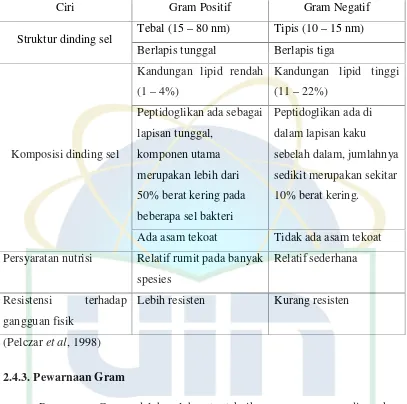
Tabel 2.1.Perbedaan ciri-ciri bakteri Gram positif dan Gram negatif
Ciri Gram Positif Gram Negatif
Struktur dinding sel Tebal (15–80 nm) Tipis (10–15 nm)
Berlapis tunggal Berlapis tiga
Ada asam tekoat Tidak ada asam tekoat
Persyaratan nutrisi Relatif rumit pada banyak
spesies
Pewarnaan Gram adalah salah satu teknik pewarnaan yang digunakan
untuk mengidentifikasi bakteri. Pewarnaan Gram menggunakan lebih dari satu
pewarna dan memiliki reaksi yang berbeda untuk setiap jenis bakteri, sehingga
dapat membedakan dua kelompok besar bakteri yaitu Gram positif dan Gram
negatif (Pratiwi, 2008).
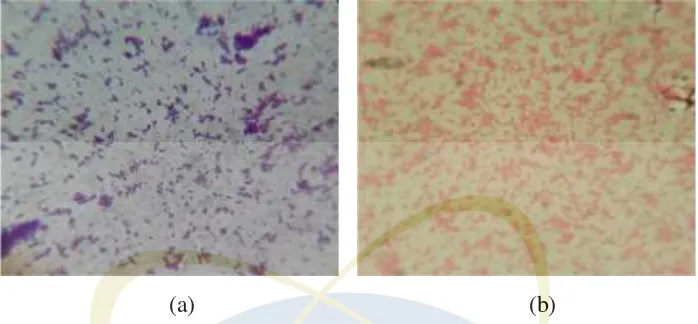
Pada pewarnaan Gram, bakteri yang telah difiksasi dengan panas sehingga
membentuk noda pada kaca objek diwarnai dengan pewarna basa yaitu kristal
violet. Karena warna ungu mewarnai seluruh sel, maka pewarna ini disebut
pewarna primer. Selanjutnya pewarna dicuci dan pada noda spesimen ditetesi
iodin yang merupakan mordant (penajam). Setelah iodin dicuci, baik bakteri
Gram positif maupun bakteri Gram negatif tampak berwarna ungu. Selanjutnya
pada spesies bakteri tertentu dapat menghilangkan warna ungu dari sel. Setelah
alkohol dicuci, noda spesimen diwarnai kembali dengan safranin yang merupakan
pewarna basa berwarna merah. Bakteri yang tetap berwarna ungu digolongkan ke
dalam Gram positif, sedangkan bakteri yang berwarna merah digolongkan ke
dalam Gram negatif (Pratiwi, 2008).
Perbedaan warna yang terjadi disebabkan oleh adanya perbedaan struktur
pada dinding selnya. Dinding bakteri Gram positif banyak mengandung
peptidoglikan sedangkan dinding bakteri Gram negatif banyak mengandung
lipopolisakarida. Kompleks kristal violet-iodin yang masuk ke dalam sel bakeri
Gram positif tidak dapat tercuci oleh alkohol karena adanya lapisan peptidoglikan
yang kokoh pada dinding sel, sedangkan pada bakteri Gram negatif alkohol akan
merusak lapisan lipopolisakarida sehingga kompleks kristal violet-iodin dapat
tercuci dan menyebabkan sel bakteri tampak transparan yang akan berwarna
merah setelah diberi safranin (Pratiwi, 2008).
2.4.4. Pertumbuhan Bakteri
Pertumbuhan bakteri adalah peningkatan semua komponen sel, sehingga
menghasilkan peningkatan ukuran sel dan jumlah sel yang akan menyebabkan
peningkatan jumlah individu di dalam populasi. Inokulum hampir selalu
mengandung ribuan organisme, pertumbuhan menyatakan pertambahan jumlah
atau massa melebihi yang ada di dalam inokulum asalnya (Pelczaret al, 1998).
Faktor-faktor yang mempengaruhi pertumbuhan bakteri, yaitu (Nurwanto, 1997) :
1. Suhu
Bakteri tumbuh pada suhu biasa/umum seperti halnya organisme lainnya.
Kebanyakan bakteri tumbuh pada kisaran suhu tertentu, sekitar 30 0C. Spesies
bakteri dapat tumbuh pada suhu minimum, optimum, dan maksimum tertentu.
Suhu minimum : suhu terendah untuk bakteri tetap dapat hidup.
Suhu optimum : suhu dimana bakteri tumbuh dengan baik.
Berdasarkan faktor suhu, bakteri dibagi dalam 3 kelompok :
• Psikrofil, hidup pada suhu dingin, di bawah 200C, optimum 150C.
• Mesofil, hidup pada suhu antara 10-450C.
• Termofil, hidup pada suhu tinggi 40-600C.
2. pH
Kebanyakan bakteri tumbuh pada kisaran sempit, pH mendekati netral
(6,5-7,5). Sedikit bakteri yang tumbuh pada pH asam dibawah 4, tetapi ada bakteri
bahkan dapat hidup pada pH 1. Keperluan akan pH tertentu ini digunakan untuk
mengisolasi bakteri. Untuk mengatur pH dapat ditambahkan HCl, KOH atau
NaOH.
3. Tekanan osmosis
Air merupakan bahan yang sangat penting bagi pertumbuhan bakteri
karena 80%-90% bakteri tersusun dari air. Tekanan osmosis sangat diperlukan
untuk mempertahankan bakteri agar tetap hidup. Apabila bakteri berada dalam
larutan yang konsentrasinya lebih tinggi daripada konsentrasi yang ada dalam sel
bakteri, maka cairan dari sel akan keluar melalui membran sitoplasma yang
disebut plasmolisis.
4. Oksigen
Berdasarkan kebutuhan oksigen sebagai akseptor elektron, bakteri dapat
dibedakan menjadi dua golongan, yaitu bakteri aerob dan anaerob. Bakteri aerob
adalah bakteri yang dapat menggunakan oksigen sebagai sumber akseptor
elektron terakhir dalam proses bioenerginya. Sebaliknya, bakteri anaerob adalah
bakteri yang tidak dapat menggunakan oksigen sebagai sumber akseptor elektron
dalam proses bioenerginya.
Berdasarkan kebutuhan oksigen, maka bakteri dapat diklasifikasikan dalam empat
kelompok :
a. Aerob, yaitu bakteri hanya dapat tumbuh apabila ada oksigen bebas.
b. Anaerob, yaitu bakteri hanya dapat tumbuh jika tidak ada oksigen bebas.
c. Anaerob fakultatif, yaitu bakteri yang dapat hidup dalam lingkungan dengan
d. Mikroaerofil, yaitu bakteri yang dapat tumbuh apabila ada oksigen dalam
jumlah kecil.
2.4.5. Bakteri yang Digunakan dalam Penelitian
2.4.5.1. Escherichia coli
Escherichia coli merupakan bakteri Gram negatif non spora berbentuk
batang pendek yang memiliki panjang sekitar 2 µm, diameter 0,7 µm, lebar sekitar
0,4-0,7µm dan bersifat anaerob fakultatif. E. colimembentuk koloni yang bundar,
cembung, dan halus dengan tepi yang nyata (Smith-Keary, 1988 ; Jawetz et al.,
1996). Suhu optimum pertumbuhan adalah 370C.
E. coli adalah anggota flora normal usus. E. coli berperan penting dalam
sintesis vitamin K, konversi pigmen-pigmen empedu, asam-asam empedu dan
penyerapan zat-zat makanan. E. coli termasuk ke dalam bakteri heterotrof yang
memperoleh makanan berupa zat oganik dari lingkungannya karena tidak dapat
menyusun sendiri zat organik yang dibutuhkannya. Zat organik diperoleh dari sisa
organisme lain. Bakteri ini menguraikan zat organik dalam makanan menjadi zat
anorganik, yaitu CO2, H2O, energi, dan mineral. Di dalam lingkungan, bakteri
pembusuk ini berfungsi sebagai pengurai dan penyedia nutrisi bagi tumbuhan
(Ganiswarna, 1995).
E. coli menjadi patogen jika jumlah bakteri ini dalam saluran pencernaan
meningkat atau berada di luar usus. E. coli menghasilkan enterotoksin yang
menyebabkan beberapa kasus diare. E. coli berasosiasi dengan enteropatogenik
2.4.5.2.Staphylococcus aureus
S. aureus adalah bakteri berbentuk bulat, bersifat Gram positif, biasanya
tersusun dalam rangkaian tidak beraturan seperti buah anggur. Beberapa
diantaranya tergolong flora normal pada kulit dan selaput mukosa manusia,
menyebabkan penanahan, abses, berbagai infeksi piogen dan bahkan septikimia
yang fatal.S. aureusmengandung polisakarida dan protein yang berfungsi sebagai
antigen dan merupakan substansi penting di dalam struktur dinding sel, tidak
membentuk spora, dan tidak membentuk flagel (Jawetzet al., 1996).
S. aureustumbuh dengan baik pada berbagai media bakteriologik dibawah
suasana aerobik atau mikro-aerobik. Tumbuh dengan cepat pada temperatur 370C
dan pH 7,4 namun pembentukan pigmen yang terbaik adalah pada temperatur
kamar (20-35oC) (Jawetzet al., 1996).
2.5. Media
Media adalah bahan atau campuran bahan yang digunakan untuk
menumbuhkan dan mengembangbiakkan bakteri. Media yang digunakan harus
dalam keadaan steril, artinya sebelum ditumbuhi bakteri yang dimaksud, tidak
ditumbuhi bakteri lain yang tidak diharapkan (Dwijosaputro, 1994).
Media yang paling baik bagi pemeliharaan bakteri adalah media yang
mengandung zat-zat organik seperti rebusan daging, sayur-sayuran, sisa-sisa
makanan, atau ramuan-ramuan yang dibuat oleh manusia. Media buatan manusia
a. Media cair
Media cair yang biasa dipakai adalah kaldu yang dibuat dengan kombinasi
air murni, kaldu daging lembu dan pepton. Pepton mengandung banyak N2,
sedangkan kaldu berisi garam-garam mineral. pH medium diatur menjadi sedikit
asam atau netral yaitu pada pH 6,8-7 yang disesuaikan untuk kebanyakan bakteri.
Kaldu kemudian disaring dengan kertas saring kemudian dimasukkan ke dalam
tabung dan disumbat dengan kapas. Kemudian barulah dimasukan ke autoklaf.
b. Media padat
Media padat dibuat dari kaldu yang dicampur dengan sedikit agar-agar,
kemudian disterilkan, dan dibiarkan mendingin hingga menjadi media padat.
Agar-agar ialah sekedar zat pengental dan bukan zat makanan bagi bakteri.
Gelatin dapat juga digunakan sebagai zat pengental, tetapi gelatin mencair pada
suhu 23oC sehingga tidak dapat diletakkan pada suhu ruangan.
c. Media diperkaya
Beberapa bakteri memerlukan zat makanan tambahan berupa serum atau
darah yang tidak mengandung fibrinogen. Fibrinogen adalah zat yang
menyebabkan darah menjadi kental apabila keluar di luka. Serum atau darah
dicampurkan ke dalam media yang sudah disterilkan. Jika pencampuran dilakukan
sebelum sterilisasi, maka serum atau darah akan mengental akibat pemanasan.
d. Media kering
Media ini berupa serbuk kering yang dilarutkan dalam air lalu disterilkan.
Pada media ini tidak perlu dilakukan pemeriksaan pH karena sudah dilakukan
pada waktu pembuatan serbuk.
e. Media sintetik
Media sintetik berupa ramuan-ramuan zat organik yang mengandung zat
karbon dan nitrogen. Bakteri autotrof dapat hidup dalam media ini. Bakteri
saprofit juga dapat hidup dalam media ini, tetapi perlu penambahan natrium sitrat
dan natrium amonium fosfat yang merupakan sumber karbon dan sumber
2.6. Antibakteri
Antibakteri adalah zat yang membunuh bakteri atau menekan
pertumbuhan dan reproduksi bakteri (Volk, dkk,. 1993). Berdasarkan jenis daya
tahan kerjanya terhadap bakteri, zat antibakteri dibagi dalam dua kelompok yaitu
bakteriostatik dan bakterisidal. Zat bakterisidal adalah zat-zat yang dapat
membunuh bakteri, sedangkan zat bakteriostatik hanya menghambat pertumbuhan
bakteri (Irianto, 2006).
Macam-macam mekanisme aksi antibakteri adalah (Pratiwi, 2008) :
1. Menghambat sintesis dinding sel
Penghambatan dilakukan dengan cara merusak lapisan peptidoglikan yang
menyusun dinding sel bakteri Gram positif maupun Gram negatif.
2. Merusak membran plasma
Antibakteri bekerja dengan mengubah permeabilitas membran plasma sel
bakteri. Membran plasma bersifat semipermeabel dan mengendalikan transpor
berbagai metabolit ke dalam dan ke luar sel. Adanya gangguan atau kerusakan
pada membran plasma akan menghalangi proses osmosis dan proses biosintesis
dalam membran.
3. Menghambat sintesis protein
Membunuh bakteri dengan cara menghambat sintesis protein sehingga
bakteri tidak mampu mensintesis protein yang penting untuk pertumbuhannya.
4. Menghambat sintesis asam nukleat
Antibakteri bekerja dengan cara menghambat proses transkripsi dan
replikasi bakteri.
5. Menghambat sintesis metabolit esensial
Sintesis metabolit esensial bisa dihambat dengan antimetabolit yang
2.6.1. Antibakteri yang Digunakan Sebagai Kontrol Positif
Kloramfenikol yang digunakan sebagai kontrol positif, memiliki
karakteristik sebagai berikut (Ditjen POM, 1979):
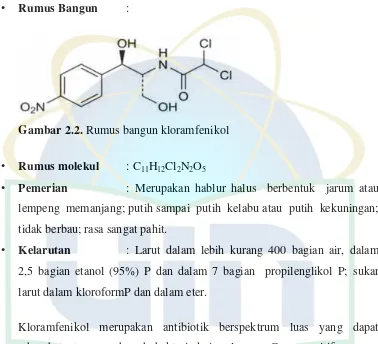
• Rumus Bangun :
Gambar 2.2.Rumus bangun kloramfenikol
• Rumus molekul : C11H12Cl2N2O5
• Pemerian : Merupakan hablur halus berbentuk jarum atau lempeng memanjang; putih sampai putih kelabu atau putih kekuningan;
tidak berbau; rasa sangat pahit.
• Kelarutan : Larut dalam lebih kurang 400 bagian air, dalam 2,5 bagian etanol (95%) P dan dalam 7 bagian propilenglikol P; sukar
larut dalam kloroformP dan dalam eter.
Kloramfenikol merupakan antibiotik berspektrum luas yang dapat
menghambat atau membunuh bakteri dari golongan Gram positif maupun
Gram negatif. Kloramfenikol bekerja dengan cara bereaksi pada sub unit 50S
ribosom dan menghalangi aktivitas enzim peptidil transferase. Enzim ini
berfungsi untuk membentuk ikatan peptida antara asam amino baru yang
masih melekat pada tRNA dengan asam amino terakhir yang sedang
berkembang. Sebagai akibatnya, sintesis protein bakteri akan terhenti seketika
2.7. Uji Aktivitas Antibakteri
Ada beberapa metode yang dapat digunakan untuk pengujian aktivitas antibakteri,
diantara yaitu :
a. Uji Difusi
Metode yang paling sering digunakan adalah metode difusi agar. Cakram
kertas saring berisi sejumlah tertentu obat ditempatkan pada permukaan media
padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya. Setelah
inkubasi, diameter zona hambatan sekitar cakram dipergunakan mengukur
kekuatan hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh
beberapa faktor fisik dan kimia, selain faktor antara obat dan organisme (misalnya
sifat medium dan kemampuan difusi, ukuran molekular dan stabilitas obat).
Meskipun demikian, standarisasi faktor-faktor tersebut memungkinkan melakukan
uji kepekaan dengan baik (Jawetz et al, 1996).
Terdapat tiga jenis interpretasi zona hambat dalam metode difusi agar, yaitu:
• Zona hambat radikal jika zona hambat yang terbentuk jernih tanpa ada pertumbuhan bakteri.
• Zona hambat iradikal bila masih ada bakteri yang tumbuh di dalam zona hambat.
• Zona hambat nol bila tidak terbentuk zona hambat (Lorian, 1980).
b. Uji Dilusi
Metode ini digunakan untuk mengukur Kadar Hambat Minimum (KHM)
dan Kadar Bunuh Minimum (KBM). Metode dilusi ada dua jenis yaitu dilusi cair
dan dilusi padat. Pada dilusi cair, dibuat seri pengenceran antibakteri dalam media
cair berisi bakteri uji. Media dengan konsentrasi agen antibakteri terkecil yang
jernih tanpa pertumbuhan bakteri uji ditetapkan sebagai KHM. Media yang jernih
tanpa pertumbuhan bakteri uji dikultur ulang dalam media padat tanpa bakteri uji
dan agen antimikroba. Media selanjutnya diinkubasi selama 18-24 jam. Jumlah
koloni yang tumbuh dalam media padat dihitung. Media dengan jumlah koloni
bakteri uji yang mengalami penurunan seribu kali lipat dibandingkan dengan
Metode dilusi padat pada dasarnya sama seperti metode dilusi cair, tetapi
media yang dipakai dalam metode ini adalah media padat. Keuntungan metode ini
adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk
menguji beberapa mikroba uji (Pratiwi, 2008).
c. Uji Bioautografi
Bioautografi merupakan metode spesifik untuk mendeteksi bercak pada
kromatogram hasil KLT yang memiliki aktivitas antibakteri, antifungi, dan
antivirus. Dengan metode ini, maka dapat diketahui bercak yang memiliki
aktivitas dan dapat dilakukan isolasi senyawa aktif. Metode ini sangat praktis dan
mudah, namun memiliki kerugian yaitu tidak dapat digunakan untuk menentukan
KHM atau KBM-nya (Pratiwi, 2008).
Ada dua macam uji bioautografi :
1. Bioautografi langsung
Metode ini dapat dilakukan dengan dua cara :
a. Plat hasil KLT disemprot dengan suspensi bakteri uji.
b. Plat KLT disentuhkan di atas media agar yang telah ditanami bakteri uji
(sering disebut bioautografi kontak).
Setelah diinkubasi, area jernih di mana tidak terdapat pertumbuhan bakteri
merupakan spot senyawa aktif (Pratiwi, 2008).
2. Bioautografioverlay
Metode ini dilakukan dengan cara menuangkan media agar ke dalam petri
dan ditunggu hingga memadat. Selanjutnya plat hasil KLT diletakkan di atas
media agar tersebut. Media agar berisi bakteri uji dituang di atas plat hasil KLT
dan ditunggu hingga memadat. Area hambatan setelah inkubasi pada suhu 37°C
selama 18-24 jam dilihat dengan cara menyemprotkan tetrazolium klorida. Spot
senyawa aktif akan muncul sebagai area jernih dengan latar belakang ungu
2.8. Kromatografi
Kromatografi adalah prosedur pemisahan zat terlarut oleh suatu proses
migrasi diferensiasi diferensial dinamis dalam sistem yang terdiri dari dua fase
atau lebih, salah satu diantaranya bergerak secara berkesinambungan dalam arah
tertentu dan didalamnya zat-zat tersebut menunjukkan perbedaan mobilitas
disebabkan adanya perbedaan dalam adsorpsi, partisi, kelarutan, tekanan uap,
ukuran molekul, atau kerapatan muatan ion. Perbedaan tersebut menjadi acuan
dalam identifikasi atau penetapan masing-masing zat dengan metode analitik
(Depkes RI, 1995). Pemilihan teknik kromatografi sebagian besar bergantung
pada sifat kelarutan dan keatsirian senyawa yang akan dipisah (Harbone, B.J.,
1987).
Pemisahan dan pemurnian kandungan tumbuhan terutama dilakukan
dengan menggunakan salah satu dari empat teknik kromatografi, yaitu
kromatografi kertas, kromatografi lapis tipis, kromatografi gas cair, dan
kromatografi cair kinerja tinggi (Harbone, B.J., 1987).
2.8.1. Kromatografi Lapis Tipis.
Kromatografi lapis tipis (KLT) merupakan metode pemisahan fisikokimia
yang didasarkan atas penjerapan, partisi (pembagian) atau gabungannya (Harmita,
2006). Menurut Kowalska, dkk (2008) KLT adalah teknik kromatografi yang
digunakan untuk analisis kualitatif senyawa organik, isolasi senyawa tunggal dari
senyawa campuran, analisis kuantitatif, dan isolasi skala preparatif.
Prinsip KLT yaitu perpindahan analit pada fase diam karena pengaruh fase
gerak. Proses ini biasa disebut elusi. Semakin kecil ukuran rata-rata partikel fase
diam dan semakin sempit kisaran ukuran fase diam, maka semakin baik kinerja
KLT dalam hal efisiensi dan resolusinya. Fase gerak yang dikenal sebagai pelarut
pengembang akan bergerak sepanjang fase diam kerena pengaruh kapiler pada
pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada
Keuntungan dari penggunaan metode KLT adalah :
a. Membutuhkan biaya yang relatif lebih rendah dibandingkan dengan metode
pemisahan lainnya (Poole, 2003).
b. Dapat mengidentifikasi banyak sampel dalam waktu bersamaan (Poole, 2003).
c. Waktu yang diperlukan untuk analisis cukup singkat, yaitu sekitar 15-60 menit
(Harmita, 2006).
d. Jumlah zat yang dianalisis cukup kecil, sekitar 0,01 g senyawa murni atau 0,1 g
simplisia (Harmita, 2006).
e. Teknik pengerjaan sederhana dan tidak diperlukan ruang besar (Harmita,
2006).
Kerugian menggunakan metode ini hanya pada prosedur pembuatan
lempeng yang membutuhkan tambahan waktu, kecuali jika telah tersedia lempeng
yang diproduksi secara komersial (Harmita, 2006). Hal-hal yang harus
diperhatikan dalam kromatografi lapis tipis adalah :
A. Fase diam
Fase diam KLT merupakan sebuah lapisan dibuat dari salah satu penjerap
yang khusus digunakan untuk KLT. Lapisan penjerap yang umum digunakan
adalah silika gel, alumunium oksida, kieselguhr, selulosa dan turunannya,
poliamida, dan lain-lain. Silika gel merupakan penjerap yang paling banyak
digunakan dalam KLT (Stahl, 1987).
Prinsip pemisahan pada lempeng yang menggunakan silika gel adalah
interaksi ikatan hidrogen atau dipol dengan permukaan silanol dimana fase gerak
yang digunakan adalah zat yang bersifat lipofilik. Zat akan memisah dari silanol
berdasarkan tingkat kepolarannya (Sherma dan Fried, 2003).
B. Fase gerak
Dalam KLT, fase gerak sering disebut sistem pelarut. Pelarut dapat dipilih
dari pustaka, namun pelarut umumnya dipilih berdasarkan coba-coba dari para
analisis. Prinsip umum pemilihan pelarut dalam KLT adalah pelarut yang dipilih
sesuai dengan sampel dan lapisan adsorben yang digunakan karena pelarut akan
daya yang lebih besar akan meningkatkan nilai Rf. Untuk KLT yang
menggunakan silika gel sebagai adsorbennya, pelarut yang digunakan bersifat
sedikit polar (Sherma dan Fried, 2003).
Hal-hal yang perlu diperhatikan pada saat penggunaan pelarut pada KLT
(eluen) antara lain : eluen harus murni, campuran eluen yang digunakan dapat
terdiri dari dua sampai tiga jenis eluen, komposisi eluen dapat berubah karena
penyerapan atau penguapan, komponen campuran eluen kemungkinan dapat
bereaksi satu sama lain (Harmita, 2006).
C. Deteksi senyawa
Senyawa yang sudah berwarna langsung dideteksi dengan mata,
sedangkan senyawa yang tidak berwarna dideteksi dengan sinar UV pada panjang
gelombang 254 nm. Untuk senyawa yang menghasilkan fluoresensi, senyawa
tersebut diperiksa dengan sinar UV pada panjang gelombang 366 nm (Sherma dan
Fried, 2003). Jika dengan kedua cara itu senyawa tidak dapat dideteksi, maka
harus dicoba dengan menggunakan pereaksi kimia tanpa atau dengan pemanasan
(Stahl, 1985).
2.8.2. Kromatografi Kolom
Salah satu metode pemisahan senyawa dalam jumlah besar adalah
menggunakan kromatografi kolom. Kromatografi kolom merupakan kromatografi
cair dimana fase diam ditempatkan dalam tabung kaca berbentuk silinder pada
bagian bawahnya tertutup dengan katup atau kran dan fase gerak dibiarkan
mengalir ke bawah karena adanya gaya gravitasi (Gritter, Bobbit & Schwarting,
1991). Hal-hal yang harus diperhatikan dalam kromatografi kolom adalah :
a. Fase diam
Fase diam untuk kolom biasanya berukuran 63 – 250 µm. Sifat fase diam
bergantung pada pH dan tingkat keaktifannya. Fase diam yang biasa digunakan
adalah silika gel, selulosa, alumina, arang, polistiren atau poliamida (Gritter,
b. Fase gerak
Fase gerak yang digunakan dapat dimulai dengan pelarut non polar
kemudian ditingkatkan kepolarannya secara bertahap, baik dengan pelarut tunggal
ataupun kombinasi dua pelarut yang berbeda kepolarannya dengan perbandingan
tertentu sesuai tingkat kepolaran yang dibutuhkan (Stahl, 1969).
c. Pemilihan pelarut
Pemilihan pelarut perlu dilakukan untuk mengetahui pelarut atau
campuran pelarut mana yang dapat menghasilkan pemisahan yang diinginkan. Hal
itu dapat dilakukan dengan tiga pendekatan yaitu, penelusuran pustaka, penerapan
data KLT pada pemisahan dengan kolom, dan pemakaian elusi landaian umum
mulai dari pelarut yang tidak menggerakkan linarut sampai pelarut yang lebih
polar yang menggerakkan linarut (Gritter, Bobbit & Schwarting, 1991).
d. Deteksi senyawa hasil kromatografi kolom
Fraksi yang diperoleh dari kolom kromatografi ditampung dalam
penampung dengan ukuran yang dikehendaki dan dilihat profilnya dengan
menggunakan metode KLT. Jika menghasilkan profil KLT yang mirip, maka
fraksi tersebut digabung. Fraksi yang telah digabung, selanjutnya diuapkan
pelarutnya sehingga didapatkan isolat. Noda pada plat KLT dideteksi dengan
lampu UV dengan panjang gelombang 254 nm dan 366 nm untuk
senyawa-senyawa yang mempunya gugus kromofor, dengan penampakan noda seperti
larutan Iod, FeCl3dan H2SO4dalam metanol 10% (Stahl, 1969).
2.9. Pemurnian Senyawa
Pemurniaan dilakukan untuk memisahkan senyawa yang menjadi target
dari pengotornya. Pemurnian senyawa dapat dilakukan dengan berbagai cara,
diantaranya :
2.9.1. Rekristalisasi
Rekristalisasi adalah teknik pemurnian suatu zat padat dari campuran atau
pengotornya yang dilakukan dengan cara mengkristalkan kembali zat tersebut
daya larut yang cukup besar antara zat yang dimurnikan dengan zat pengotor,
tidak meninggalkan zat pengotor pada kristal, dan mudah dipisahkan dari
kristalnya (Rositawati, dkk., 2013).
Prinsip dasar rekristalisasi adalah perbedaan kelarutan antara zat yang
akan dimurnikan dengan kelarutan zat pencampur atau pencemarnya. Larutan
yang terbentuk dipisahkan satu sama lain, kemudian larutan zat yang diinginkan
dikristalkan dengan cara menjenuhkannya (Rositawati, dkk., 2013).
2.10. Uji Kemurnian
Kemurnian merupakan hal yang penting dimiliki suatu senyawa hasil
isolasi. Oleh karena itu, perlu dilakukan uji kemurniaan terhadap senyawa hasil
isolasi. Metode yang dapat digunakan untuk uji kemurniaan antara lain dengan
penentuan titik leleh dan penggunaan KLT dua dimensi.
2.10.1. Penentuan Titik Leleh
Titik leleh suatu padatan kristalin didefinisikan sebagai suhu dimana
padatan berubah menjadi cairan di bawah tekanan total satu atmosfer. Senyawa
murni memiliki rentang titik leleh yang tajam dimana jarak temperatur senyawa
tersebut sangat kecil ketika berubah sempurna dari padat ke cair. Rentang
temperatur maksimum untuk senyawa murni adalah 1-2 0C (Margono dan
Zandrato, 2006).
Penentuan titik leleh adalah salah satu metode yang cepat dan mudah
untuk memastikan kemurnian dari suatu padatan dengan mengukur titik lelehnya.
Teknik penentuan titik leleh dari senyawa organik menggunakan metode mikro
dengan menggunakan pipa kapiler banyak digunakan karena mudah,
menggunakan sampel yang sedikit dan datanya memuaskan (Gilbert dan Martin,
2011).
Ada beberapa pertimbangan dalam menentukan titik leleh. Diantaranya
adalah rentang titik leleh yang diamati bergantung pada beberapa faktor yaitu :
jumlah sampel, laju pemanasan selama penentuan, dan kemurnian serta sifat kimia
dari sampel. Akurasi dari pengukuran suhu bergantung sepenuhnya pada kualitas
2.10.2. KLT Dua Dimensi
Langkah dari metode ini yaitu sampel ditotolkan pada bagian pojok dari
fase diam dan dilakukan proses elusi. Selanjutnya lempeng diangkat, dikeringkan,
diputar 900, dan dilakukan elusi dengan eluen yang berbeda dari eluen pertama.
Keuntungan dari KLT dua dimensi antara lain :
a. Merupakan salah satu metode sederhana tanpa menggunakan peralatan
yang rumit.
b. Lempeng yang digunakan sekali pakai sehingga tidak perlu prosedur yang
sulit untuk membersihkan sampel yang diuji.
c. Tidak ada batasan dalam penggunaan fase gerak karena sebelum dilakukan
elusi kedua, dilakukan penguapan terlebih dahulu terhadap eluen pertama.
d. Mampu menganalisis senyawa campuran.
e. Hasil pemisahan mudah dilihat. (Cielsa dan Waksmundzka, 2009)
2.11. Identifikasi Struktur Senyawa
Identifikasi struktur dapat dilakukan dengan berbagai cara, diantaranya yaitu :
2.11.1. Spektroskopi NMR (Nuclear Magnetic Resonance)
Spektroskopi Resonansi Magnetik Inti (NMR) merupakan salah satu
metode yang bermanfaat dalam penentuan struktur senyawa organik. Dasar dari
metode spektroskopi ini adalah kajian terhadap momen magnet dari inti atom. Inti
atom dalam molekul yang timbul akibat perputaran inti tersebut. Momen magnet
dari suatu inti atom dipengaruhi oleh atom-atom yang ada di dekatnya, sehingga
atom yang sama dapat mempunyai momen magnet yang berbeda bergantung pada
lingkungannya. Bila inti atom diletakkan diantara kutub-kutub magnet yang
sangat kuat, inti akan mensejajarkan medan magnetiknya sejajar (paralel) atau
melawan (antipararel) dengan medan magnet (Achmadi, 2003). Sifat inilah yang
digunakan untuk menentukan struktur suatu molekul. Inti yang paling penting
dalam penetapan struktur senyawa organik yaitu1H dan13C.
1. 13C NMR (Carbon Nuclear Magnetic Resonance)
Spektroskopi 13C NMR memberikan informasi tentang jumlah atom
lebih lebar dibandingkan daerah pergeseran kimia inti 1H. Keduanya diukur
terhadap senyawa standar yang sama, yaitu tetrametilsilen (TMS), yang semua
karbon metilnya ekuivalen dan memberikan sinyal yang tajam. Pergeseran kimia
untuk13C dinyatakan dalam satuan δ (Achmadi, 2003).
2. 1H NMR (Hydrogen Nuclear Magnetic Resonance)
Spektroskop 1H NMR memberikan informasi mengenai banyaknya sinyal
dan pergeseran kimianya dapat digunakan untuk mengidentifikasi jenis inti 1H
yang secara kimia berbeda di dalam molekul, luas puncak menginformasikan
banyaknya inti 1H dari setiap jenis yang ada, pola pembelahan spin-spin
menginformasikan tentang jumlah 1H tetangga terdekat yang dimliki oleh inti1H
tertentu (Achmadi, 2003).
Spektrum NMR 1H biasanya diperoleh dengan cara melarutkan sampel
senyawa yang sedang dikaji (biasanya hanya beberapa miligram) dalam sejenis
pelarut yang tidak memiliki inti 1H. Contoh pelarut seperti ini adalah CCl4 atau
pelarut dengan hidrogen yang digantikan oleh deuterium, seperti CDCl3
(deuteriokloroform) dan CD3COCD3 (heksadeutioaseton). Salah satu cara untuk
menetapkan puncak dari spektra1H NMR adalah dengan mengintregasikan luas di
bawah setiap puncak. Luas puncak (peak area) berbanding lurus dengan jumlah
inti 1H yang menyebabkan terjadinya puncak tersebut. Cara yang lebih umum
untuk menetapkan puncak adalah dengan membandingkan pergeseran kimia
dengan proton yang serupa dengan senyawa rujukan yang diketahui (Achmadi,
2003).
2.11.2. FTIR (Fourier Transform Infra Red)
Spektrofotometri inframerah (IR) merupakan salah satu alat yang dapat
digunakan untuk menganalisa senyawa kimia. Spektra inframerah suatu senyawa
dapat memberikan gambaran dan struktur molekul senyawa tersebut. Spektra IR
dapat dihasilkan dengan mengukur absorbsi radiasi, refleksi atau emisi di daerah
IR (Harjono, 1992).
Syarat suatu gugus fungsi dalam suatu senyawa dapat terukur pada spektra
IR adalah adanya perbedaan momen dipol pada gugus tersebut. Vibrasi ikatan
Untuk pengukuran menggunakan IR biasanya berada pada daerah bilangan
gelombang 400-4500 cm-1. Daerah pada bilangan gelombang ini disebut daerah
IR sedang, dan merupakan daerah optimum untuk penyerapan sinar IR bagi
ikatan-ikatan dalam senyawa organik (Harjono, 1992).
Absorpsi molekul pada infra merah terjadi ketika molekul tereksitasi ke
tingkat energi yang lebih tinggi. Suatu molekul hanya menyerap energi tertentu
dari radiasi infra merah. Kegunaan spektroskopi IR adalah sebagai sidik jari suatu
molekul dan untuk menentukan informasi struktural dari suatu molekul (Pavia, et
al. 2001).
Bila suatu senyawa menyerap radiasi pada suatu panjang gelombang
tertentu, intensitas radiasi yang diteruskan oleh sampel akan berkurang. Hal
tersebut mengakibatkan penurunan nilai %T dan terlihat pada spektrum sebagai
suatu sumur yang disebut puncak absorbsi atau pita absorbsi (Kosela, 2010).
Pita-pita absorbsi dalam spektrum inframerah dapat dikelompokkan menurut
intensitasnya, yaitu: kuat (s), medium (m), dan lemah (w). Suatu pita lemah yang
bertumpang tindih dalam suatu pita kuat disebut bahu (sh). Istilah-istilah tersebut
hanya bersifat kualitatif (Supratman, 2010).
Untuk menentukan spektrum IR dari suatu senyawa, senyawa harus
ditempatkan di sampel holder atau sel. Sel harus terbuat dari bahan ionik seperti
natrium klorida atau kalium bromida. Plat KBr lebih mahal dan memiliki
kelebihan dalam penggunaan direntang 4000 sampai 400 cm-1. Natrium klorida
digunakan secara luas karena murah dan penggunaannya pada rentang 4000
3.1. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Farmakognosi Fitokimia Program
Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri
Syarif Hidayatullah Jakarta. Waktu penelitian dimulai pada bulan Januari hingga
Juni 2015.
3.2. Alat dan Bahan
3.2.1. Alat
Alat-alat yang digunakan pada penelitian ini antara lain : blender (Philip),
gelas ukur (Pyrex), erlenmeyer (Iwaki),beacker glass(Iwaki), timbangan analitik,
corong, tabung reaksi (Pyrex), rak tabung reaksi, botol gelap, kolom kromatografi,
batang pengaduk, pipet tetes, spatula, seperangkat alat vaccum rotary evaporator
(Eyela), kaca arloji, cawan porselen, pipa kapiler, vial, plat KLT, cawan petri,
jarum ose, hot plate,magnetic stirrer, oven, autoklaf, lampu spiritus, mikroskop,
Laminar Air Flow, mikropipet, lemari pendingin,incubator(Memmert),vortex.
3.2.2. Bahan Uji
Bahan uji yang digunakan adalah ekstrak etil asetat dari buah parijoto
(Medinilla speciosa Blume) dengan spesifikasi warna ungu tua dan rasa asam
sepat yang berasal dari Kecamatan Dawe, Kudus Jawa Tengah yang diambil pada
bulan Februari 2015. Sampel ini sebelumnya telah dideterminasi di Herbarium
Bogoriense, Pusat Penelitian Biologi LIPI, Bogor, Jawa Barat.
3.2.3. Bahan Kimia dan Bahan Biologi
Bahan kimia yang digunakan antara lain : pelarut n-heksana, etil asetat,
metanol, etanol 96%, pereaksi Dragendorf, HCl 2N, aquadest, kloroform, asam
asetat anhidrida, asam sulfat pekat, logam magnesium, FeCl3, plat silika F254,
saring, kapas, aluminium foil. Bahan biologi yang digunakan adalah : kultur
bakteri Staphylococcus aureus ATCC 6538 dan Escherichia coli ATCC 35218,
medium NA (Nutrient Agar), medium BHI (Brain Heart Infussion).
3.3. Cara Kerja
3.3.1. Penyiapan Simplisia
Buah Medinilla speciosa Blume yang telah diperoleh dari Kecamatan
Dawe, Kudus dicuci bersih, kemudian dilakukan sortasi basah untuk memisahkan
kotoran-kotoran atau bahan-bahan asing lainnya. Buah yang telah bersih
dikeringkan dengan cara diangin-anginkan. Buah segar tersebut kemudian
dihaluskan dengan blender. Setelah diblender, ditimbang sampel yang didapat
kemudian dilakukan ekstraksi.
3.3.2. Pembuatan dan Partisi Ekstrak
Buah segar yang telah diblender dan ditimbang kemudian diekstraksi
dengan cara maserasi menggunakan pelarut metanol. Sampel direndam dengan
pelarut metanol di dalam botol gelap hingga sampel terendam 3 cm dibawah
pelarut. Pergantian pelarut dilakukan setiap 1 hari sambil sesekali botol dikocok.
Setelah 1 hari, hasil maserasi disaring menggunakan kapas untuk memisahkan
ampasnya, kemudian larutan maserat disaring kembali menggunakan kertas
saring. Ampas yang diperoleh dimaserasi kembali oleh metanol selama dua hari
dan disaring kembali. Proses ini diulang hingga diperoleh larutan maserat yang
bening. Larutan maserat dipekatkan dengan vaccum rotary evaporator pada suhu
40oC hingga diperoleh ekstrak kental. Ekstrak kental yang diperoleh, dihitung
untuk diketahui hasil rendemennya (Depkes, 2000).
= 100%
Ekstrak metanol yang telah diperoleh dipartisi menggunakan pelarut
n-heksan dan etil asetat. Ekstrak metanol dilarutkan dengan sedikit metanol
hingga ekstrak dapat dituang ke dalam corong pisah. Dimasukkan n-heksan ke
membuka kran pada corong untuk mengeluarkan gas yang terbentuk. Dibiarkan
beberapa menit sampai terlihat bidang batas antara lapisan metanol dan lapisan
n-heksan. Lapisan yang berada di atas adalah lapisan n-heksan dan yang berada di
bawah adalah lapisan metanol. Lapisan dipisahkan dengan cara membuka kran
corong pisah untuk mengambil lapisan metanol, lapisan atas yang tertinggal
dikumpulkan. Lapisan metanol dimasukkan kembali ke dalam corong pisah dan
ditambahkan pelarut n-heksan yang baru. Partisi dilakukan dengan cara yang
sama hingga pelarut n-heksan bening.
Partisi dilakukan kembali menggunakan pelarut etil asetat. Ekstrak
metanol dimasukkan ke dalam corong pisah, kemudian dimasukkan pelarut etil
asetat. Corong pisah dikocok dan dibiarkan beberapa menit hingga terbentuk dua
lapisan. Lapisan atas merupakan lapisan etil asetat dan lapisan bawah merupakan
lapisan metanol. Partisi diulang hingga pelarut etil asetat bening. Lapisan
n-heksan, lapisan etil asetat, dan lapisan metanol dipekatkan menggunakan vaccum
rotary evaporator pada suhu 40oC hingga diperoleh ekstrak kental.
Masing-masing ekstrak kemudian ditimbang (Dai, 2012).
3.3.3. Skrining Fitokimia Ekstrak
Analisis fitokimia merupakan analisis kualitatif yang dilakukan untuk
mengetahui komponen bioaktif yang terkandung dalam ekstrak buah Medinilla
speciosaBlume. Analisis fitokimia yang dilakukan meliputi uji alkaloid, saponin,
terpenoid dan steroid, flavonoid, tannin dan polifenol.
a. Pengujian Golongan Alkaloid
Sebanyak 0,5 gram ekstrak dilarutkan dalam asam klorida 1% dan
disaring. Filtrat dibagi menjadi dua bagian, salah satu bagian ditetesi dengan
pereaksi Mayer dan bagian yang lain ditetesi dengan pereaksi Dragendorf. Hasil
positif ditunjukkan dengan terbentuknya endapan putih dengan perekasi Mayer
dan endapan merah dengan pereaksi Dragendorf (Ahmadet al, 2013).
b. Pengujian Golongan Saponin
Sebanyak 0,5 gram ekstrak dimasukkan ke dalam tabung reaksi,
10 detik. Pembentukan busa setinggi 1–10 cm yang stabil selama tidak kurang
dari 10 menit menunjukkan adanya saponin. Pada penambahan 1 tetes HCl 2N,
busa tidak hilang (Depkes RI, 1989).
c. Pengujian Golongan Terpenoid dan Steroid
Pemeriksaan steroid dan triterpenoid dilakukan dengan reaksi
Liebermann-Burchard. Sebanyak 0,5 gram ekstrak ditambahkan 5 mL kloroform,
kemudian ditambahkan asam asetat anhidrida dan beberapa tetes asam sulfat
pekat. Hasil uji positif untuk terpenoid bila terbentuk warna hijau gelap. Hasil uji
positif untuk steroid bila terbentuk warna merah muda atau merah (Ahmad et al,
2013)..
d. Pengujian Golongan Flavonoid
Sebanyak 1 gram sampel diekstraksi dengan 5 mL etanol kemudian
ditambahkan beberapa tetes HCl pekat dan 1,5 gram logam magnesium. Adanya
flavonoid diindikasikan dari terbentuknya warna pink atau merah magenta dalam
waktu 3 menit (Ahmadet al, 2013)..
e. Pengujian Golongan Tannin dan Polifenol
Sebanyak 0,5 gram ekstrak dilarutkan dalam 5 mL air aquadest kemudian
diteteskan larutan besi (III) klorida 10%, jika terjadi warna biru tua atau hitam
kehijauan menunjukkan adanya tanin dan polifenol (Ahmadet al, 2013).
3.3.4. Penetapan Kadar Air Ekstrak (Depkes RI, 2000)
Penetapan kadar air menggunakan metode gravimetri. Krusibel porselin
kosong dikonstankan terlebih dahulu dengan pemanasan pada suhu 100 – 105 oC
selama 2 jam, didinginkan dalam desikator dan ditimbang. Sebanyak 1 g sampel
ditimbang dalam krusibel yang telah diketahui beratnya, dikeringkan dalam oven
pada suhu 105 – 110 oC selama 5 jam, didinginkan dalam desikator dan
selanjutnya ditimbang kembali. Perlakuan diulang sampai beratnya konstan.
3.3.5. Isolasi dan Pemurnian Ekstrak (Harborne, 1987)
3.3.5.1.Kromatografi Kolom
Sistem kromatografi kolom yang digunakan adalah kromatografi kolom
fase normal, dimana fase diamnya adalah silika gel 60 yang bersifat polar dan fase
geraknya adalah kombinasi sistem eluen yaitu n-heksan: etil asetat: metanol
dengan perbandingan tingkat kepolaran secara bergradien.
Penyiapan kolom kromatografi. Pertama-tama pada ujung kolom
kromatografi diberikan kapas untuk menahan agar silika gel tidak keluar.
Ditimbang silika gel seberat 30 kali berat ekstrak kental, kemudian di masukkan
ke dalam beacker glass dan ditambahkan pelarut n-heksana sehingga
menghasilkan silika dengan konsistensi seperti bubur, kemudian diaduk hingga
terbentuk suspensi. Suspensi silika gel yang telah terbentuk, dimasukkan ke dalam
kolom kromatografi yang telah berisi n-heksan sedikit demi sedikit sambil
diketuk-ketuk. Pelarut yang mengalir ke ujung kolom ditampung, kemudian
dimasukkan kembali ke dalam kolom. Hal ini dilakukan secara berulang-ulang
hingga silika gel menjadi padat. Kemudian ekstrak etil asetat yang telat
diadsorpsikan dengan silika dimasukkan ke dalam kolom melalui bagian atas
kolom dengan cara menaburkannya sedikit demi sedikit.
Pembuatan sistem pelarut. Pelarut dibuat dengan perbandingan antara
pelarut nonpolar, semipolar dan polar sehingga terjadi peningkatan polaritas atau
yang disebut sistem gradien. Pelarut yang digunakan adalah n-heksana, etil asetat,
dan metanol, dimana setiap gradien kepolarannya ditingkatkan 10%. Setiap
pelarut dibuat dengan volume 700 mL.
Proses fraksinasi. Fraksinasi pertama dimulai dengan menggunakan
pelarut n-heksana 100% sebanyak 300 mL. Pelarut n-heksana 100% dimasukkan
ke dalam kolom kromatografi sedikit demi sedikit, kemudian kran kolom dibuka
sehingga pelarut tersebut akan turun melalui kolom. Hasil kolom yang keluar
ditampung pada vial-vial dan diberi nomor berurutan. Penggantian gradien fasa
gerak dilakukan ketika gradien sebelumnya telah habis digunakan untuk mengaliri