ABSTRAK
ABDUL KODIR. Aktivitas Antioksidan dan Inhibisi Enzim α Glukosidase serta Toksisitas Ekstrak Air-Etanol dan Heksan Anggrek Merpati (Dendrobium cruminatum SW). Dibimbing oleh Dr Djarot Sasongko Hamiseno, MS dan Drs Edy Djauhari PK, Msi.
Anggrek merpati (Dendrobium cruminatum) merupakan tanaman anggrek yang banyak tumbuh hampir diseluruh wilayah indonesia. Daun anggrek merpati mengandung senyawa flavonoid yang bermanfaat sebagai antioksidan dan antidiabetes. Penelitian ini bertujuan untuk mengetahui potensi ekstrak daun anggrek merpati sebagai antioksidan, inhibitor enzim α-glukosidase serta potensinya sebagai senyawa yang bersifat toksik pada larva udang Artemia salina
Leach. Aktivitas antioksidan diukur dengan menggunakan metode
diphenylpicrylhydrazyl (DPPH) dan inhibitor enzim α glukosidase diukur berdasarkan terbentuknya p-nitrifenol-α-D-glukopiranosida (p-NPG) yang diukur dengan spektrofotometer pada panjang gelombang 410 nm. Hasil penelitian menunjukkan aktivitas antioksidan dan toksisitas tertinggi teramati oleh pelarut air dengan IC50 sebesar 153.5 μg/mL dan tingkat toksisitas sebesar 889.64 μg/mL sedangkan aktivitas inhibisi enzim α-glukosidase yang paling tinggi dimiliki oleh pelarut etanol dengan presentase 4% pada konsentrasi 1000 μg/mL atau nilai IC50 sebesar 435 μg/mL
kata kunci : Anggrek merpati, antioksidan, antidiabetes dan toksisitas. ABSTRACT
ABDUL KODIR. Analysis aktivity of α-glucosidase enzyme inhibition, and cytotoxicity Extract Antioxidant Water, Etanol and hexane Anggrek merpati (Dendrobium cruminatum SW). Supervised by Dr. Djarot Sasongko Hamiseno, MS and Drs Edy Djauhari PK, Msi.
Dendrobium cruminatum are anggrek that grow in almost all regions of Indonesia. Dendrobium cruminatum leaves contain flavonoid compounds that are useful as an antioxidant and antidiabetic. This study aims to determine the ability of the anggrek merpati extract as an antioxidant and it’s potential to inhibition activity of α-glucosidase enzyme and also as a compound that toxic to the larvae of shrimp Artemia salina Leach with different solvents. The antioxidant activity was measured by using DPPH method and antidiabetic measured by the formation of p-nitrifenol-α-D-glukopiranosida (p-NPG) were measured with a spectrophotometer at a wavelength of 410 nm. The results of antioxidant activity and cytotoxicity testing showed that the best solvent used for the extraction of anggrek merpati leaf is water solvent with IC50 value of 153.565 μg / mL and the level of cytotoxicity was 889.641 mg / mL. whereas the activity of the inhibition of α-glucosidase enzyme is owned by the highest percentage of etanol by 64% at a concentration of 1000 μg / mL or IC50 value of 435 μg / mL.
AKTIVITAS ANTIOKSIDAN DAN INHIBISI ENZIM
α
-GLUKOSIDASE SERTA TOKSISITAS EKSTRAK
AIR-ETANOL DAN HEKSAN ANGGREK
MERPATI
(Dendrobium cruminatum
SW
)
ABDUL KODIR
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
14
DAFTAR PUSTAKA
[BPOM] Badan Pengawas Obat dan Makanan. 2005. Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.00.05.41.1384 Tahun 2005 tentang Kriteria dan Tata Laksana Pendaftaran Obat Tradisional, Obat Herbal Terstandar, dan Fitofarmaka. Jakarta (ID): BPOM.
[Depkes] Departemen Kesehatan. 2002. Jumlah Penderita Diabetes Indonesia Ranking ke-4 Di Dunia. Jakarta (ID): Depkes.
Attaur-Rahman. 1991. Studies In Natural Product Chemistry. Volume 9B. London: Elsevier.
Ayoola et al..2008. Phytochemical screening and antioxidant activities of some selected medicinal plants used for malaria therapy in Southwestern Nigeria.Tropical Journal of Pharmaceutical Research 7(3):1019-1024.
Bayu A. 2009. Hutan mangrove sebagai salah satu sumber produk alam lautOseana.Vol XXXIV No.2 (15-23).
Bintang M. 2010. Biokimia Teknik Penelitian .Jakarta : Erlangga
Collegate, Steven M, Russel JM. 1993. Bioactive Natural Products, Detection, Isolation, and Structural Determination. Boca Raton: CRC Press.
Egwaikhide PA, Gimba CE. 2007. Analysis of the phytochemical content and anti-microbial activity of plectranthus glandulosis whole plant. Middle-EastJournal of Scientific Research 2(3 4):135-138.
Eleanore Y. 2013. Analisis Fitokimia dan Aktivitas Antioksidan Ekstrak Daun Sengon (Paraserianthes faicataria (L) Nielsen) Menggunakan Metode DPPH.Bogor : IPB
Fawzy C, Abdallah HM, Mohamed SAM, Fathy MS, dan Amany AS. 2008.Antidiabetic and Antioxidant Activities 13 of Major Flavonoids of Cynanchum acutum L. (Asclepiadaceae) Growing in Egypt. Z. Natureforsch
63: 658-662.
Gao H. Huang YN, Xu PY, Kawabata J. 200 . Inhibitory effect on α-glucosidase by the fruits of Terminalia chebula Retz.Food Chemistry 105: 628-634.
Harborne JB. 1987. Metode Fitokimia : Penentuan Cara Modern Menganalisa Tumbuhan. Padnawinata K dan Soediro W, Penerjemah; Bandung : ITB. Hartika R. 200 . Aktivitas inhibisi α-glukosidase ekstrak senyawa golongan
flavonoid buah mahkota dewa.[Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Irwan F. 2011. Aktivitas antidiabetes dan analisis fitokimia ekstrak air dan etanol daun wungu (Graptophyllum pictum (L.)Griff).[Skripsi].Bogor : Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Javanmardi J, Stushnoff C, Lockeb E, Vivancob JM. 2003. Antioxidant activity and total phenolic content of iranian ocimum accessions. Food Chemistry83:547–550.
15 Kumar B, Sandhar HK, Tiwari P, Salhan M, Sharma P. 2011a. A review of and pharmacology of flavonoids.InternationalPharmaceutica Sciencia (IPS)
1(1):26-29.
Kusuma WR. 2012. Aktivitas antioksidan dan antiinflamasi in vitro serta kandungan kurkuminoid dari temulawak dan daun anggrek merpati asal Wonogiri [skripsi]. Bogor: fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lukacinova, J. Mojzis, R. Benacka, J. Keller, T. Maguth, P. Kurila, L. Vasko, O. Racz, dan F. Nistiar. 2008. Preventive effects of flavonoids on alloxan-induced diabetes mellitus in rats. ACTA VETBRNO (77): 175-182.
Lumbessy M, Abidjuju J, Paendong JJE. 2013. Total flavonoid pada beberapa tanaman obat tradisional di desa WaItina kecamatan Mangoli Timur kabupaten Kepulauan Sula provinsi Maluku Utara 2(1):50-55. Jurnal MIPA UNSRAT online.
Marinova D, Ribarova , Atanassova M. 2005. Total phenolics and total flavonoids in bulgarian fruits and vegetables. Journal of the University ofChemical Technology and Metallurgy 40(3):255-260.
Meyer BN et al.. 1982. Brine Shrimp : A convenient general biaoassay for active plant constituents. Planta Med 45:31-34.
Molyneux P. 2004.The use of stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioksidan activity.Songklanakarin Journal ScienceTechnology
26(2):211-219.
Nurcholis W. 2008.Profil senyawa penciri bioaktivitas tanaman daun anggrek merpati pada agrobiofisik berbeda [Tesis]. Bogor (ID): Institut Pertanian Bogor. Pembayun R, Gardjito M, Sudarmadji S, Rahayu K. 2007. Kandungan fenol dan
sifat antibakteri dari berbagai jenis ekstrak produk gambir (UncariaGambirRoxb).Majalah Farmasi Indonesia 18(3):141 – 146.
Pradana D. 2001.Inventarisasi hasil-hasil penelitian sengon (Paraserianthesfalcatarian (L) Neielsen) di Indonesia [skripsi]. Bogor (ID): Institut PertanianBogor.
Rohdiana D. 2001. Radical scavengers activity of tea polyphenol. Majalah Farmasi Indonesia 12(1):53-58.
Steinberg D. 2009.The LDL modification hypothesis of atherogenesis.Journal of Lipid Research 50:376-381.
Subeki.1 8. Pengaruh cara pemasakan terhadap kandungan β-karoten beberapa macam sayuran serta daya serap dan retensinya pada tikus percobaan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Subroto MA.2006. Ramuan Herbal untuk Diabetes Mellitus. Jakarta : Penebar Swadaya. 100 hlm
Sugiwati S. 2005. Aktivitas Antihiperglikemik dari Ekstrak Buah Mahkota Dewa (Phaleria macrocarpa (Scheff oerl. Sebagai Inhibitor α-Glukosidase In Vitro dan In Vivo pada Tikus Putih [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sutedja L. 2003. Bioprospekting Tumbuhan Obat Indonesia sebagai Sediaan Fitofarmak Antidiabetes. Laporan Kemajuan Tahap II Riset Unggulan Terpadu, Pusat Penelitian Kimia-LIPI.
16
Wing. 1998. Orchid of Singapore Botanic Gardens. National Park Board Singapore Botanic Gardens. Singapore
Zebri H, Kodjo C, Benie A, Bekro JM, Bekro YA. 2008. Phytochemical screening and determination of flavonoids in Secamone afzelii (Asclepiadaceae) extracts.African Journal of Pure and Applied Chemistry 2(8):080-082.
6
konsentrasi yang digunakan. Nilai x yang diperoleh merupakan konsentrasi larutan yang menyebabkan kematian terhadap 50% larva udang. Ekstrak dinyatakan aktif apabila nilai LC50 lebih kecil dai 1000 μg/mL.
HASIL
Kadar Air Daun Anggrek Merpati
Hasil pengukuran kadar air simplisia daun Anggrek merpati asal Bogor dari tiga kali ulangan yaitu ulangan 1, 2 dan 3 mendapatkan hasil berturut-turut sebesar 3.42%, 3.32% dan 3.22% dan mendapatkan rata-rata sebesar 3.32% (data dan perhitungan pada Lampiran 2).
Rendemen Ekstrak daun Anggrek Merpati
Hasil pengukuran rendemen ekstrak daun anggrek merpati dengan pelarut etanol, heksan dan air (Gambar 2) mendapatkan rendemen berkisar antara 1.98% hingga 15.77%. Rendemen tertinggi terdapat pada ekstrak daun anggrek merpati dengan pelarut etanol (15.77%), sedangkan rendemen terendah terdapat pada ekstrak daun anggrek merpati dengan pelarut heksan (1.98%) (data dan perhitungan pada Lampiran 3).
Gambar 2. Rendemen ekstrak daun anggrek merpati Hasil uji Fitokimia Ekstrak Daun Anggrek Merpati
Hasil uji fitokimia ekstrak daun anggrek merpati dengan pelarut etanol, heksan dan air pada (Gambar 3) menunjukkan bahwa pelarut yang paling banyak melarutkan senyawa senyawa fitokimia adalah pelarut etanol yaitu senyawa flavonoid, saponin, tanin, dan steroid, sedangkan pelarut yang paling sedikit melarutkan senyawa fitokimia adalah pelarut heksan yaitu hanya senyawa steroid. Gambar hasil fitokimia dapat dilihat pada Lampiran 7.
7 Tabel2 Hasil uji fitokimia ekstrak daun anggrek merpati.
Uji fitokimia Hasil
keterangan : tanda (+) menunjukkan tingkat intensitas warna tanda (-) tidak terdapat senyawa
Nilai IC50 Ekstrak Anggrek Merpati terhadap Aktivitas Antioksidan
Hasil pengukuran IC50 antioksidan oleh ekstrak daun anggrek merpati dengan pelarut etanol, heksan dan air pada (Gambar 4) mendapatkan nilai IC50 berkisar antara 153.56±5.53 hingga 3551.34±533.95 μg/mL (data dan perhitungan pada lampiran 5). Hasil uji statistika menunjukkan tidak terdapat perbedaan yang signifikan antara pelarut etanol dan air pada taraf 95%, sedangkan pada pelarut etanol dan heksan serta air dan heksan menunjukkan perbedaan yang signifikan. Nilai IC50 tertinggi dimiliki pelarut heksan sebesar 3551.34±533.95 μg/mL, sedangkan nilai IC50 terendah dimiliki pelarut air sebesar 153.56± 5.53 μg/mL.
Gambar 4 Nilai IC50 aktivitas Ekstrak daun Anggrek Merpati
Nilai IC50Ekstrak Anggrek Merpati terhadap Inhibisi Enzim α-Glukosidase
Hasil pengukuran presentase inhibisi enzim α-glukosidase oleh ekstrak daun anggrek merpati dapat dilihat pada Gambar 5. Hasil penelitian menunjukkan dari ketiga pelarut yang digunakan pada ekstrak daun anggrek merpati, pelarut yang memiliki aktivitas inhibisi enzim α glukosidase yang paling tinggi yaitu pada pelarut etanol. Sedangkan, yang memiliki aktivitas terendah yaitu ekstrak daun anggrek merpati dengan pelarut air. Pada kosentrasi 1000 μg/mL ekstrak daun anggrek merpati dengan pelarut etanol mampu menghambat aktivitas enzim
8
sebesar 64% sedangkan pada ekstrak daun enggrek merpati dengan pelarut air hanya menghambat sebesar 13%. Namun, jika dibandingkan dengan akarbosa sebagai kontrol positif hasil sampel ekstrak daun anggrek merpati berbeda jauh yaitu sebesar 99% pada konsentrasi 1000 μg/mL (data dan perhitungan pada Lampiran 6).
Gambar 5 Nilai Presentase Inhibisi enzim α-glukosidase Keterangan :
Hasil Toksisitas Ekstrak Daun Anggrek Merpati
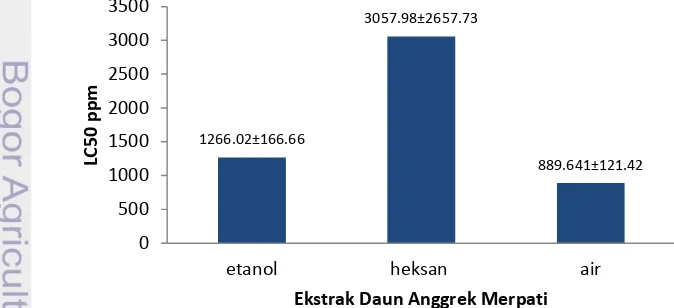
Hasil pengukuran nilai LC50 dari pelarut etanol, heksan dan air pada (Gambar 6) mendapatkan nilai LC50 dari pengujian toksisitas berkisar antara 889.64±121.42 hingga 3057.98±2657.73 μg/mL. Nilai LC50 tertinggi dimiliki pelarut heksan sebesar 3057.98±2657.73 μg/mL, sedangkan nilai LC50 terendah dimiliki pelarut air sebesar 889.64±121.42μg/mL (data dan perhitungan pada lampiran 4)
Gambar 6 Toksisitas Ekstrak Daun Anggrek Merpati
9
PEMBAHASAN
Kadar Air
Penentuan kadar air merupakan tahapan penting dalam melakukan analisis tumbuhan sebagai tanaman obat. Penentuan kadar air bertujuan untuk mengetahui proporsi atau presentase air dalam sampel yang diuji. Air merupakan salah satu senyawa yang sangat potensial bagi kelangsungan hidup semua makhluk hidup dari tingkat yang paling rendah (prokariot) hingga tingkat tinggi (eukariot) oleh sebab itu pengetahuan tentang kadar air menjadi salah satu indikator penting mengenai kualitas tanaman obat, karena kadar air yang cukup tinggi pada bahan obat akan menjadi tempat yang baik bagi pertumbuhan mikroorganisme. Informasi kadar air ini nantinya akan digunakan untuk mengetahui lama penyimpanan, cara penyimpanan, cara pengolahan dan cara pengemasan tanaman obat (Pradana 2001). Hasil pengukuran kadar air rerata yang dilakukan pada daun anggrek merpati sebesar 3.32 % menunjukkan bahwa simplisia daun anggrek merpati ini dapat disimpan dalam jangka waktu yang lama karena kadar air yang kurang dari 5% bersifat tahan terhadap pencemaran mikroorganisme (Pradana 2001). Jika dibandingkan dengan hasil kadar air yang dilaukan pada daun sengon oleh Yafet E (2013) tidak berbeda jauh yaitu sebesar 4.85%.
Ekstrak Daun Anggrek Merpati
Ekstraksi merupakan langkah awal yang dilakukan sebagai bagian dari persiapan sampel untuk digunakan dalam barbagai uji berikutnya. Ekstraksi daun anggrek merpati dilakukan dengan menggunakan metode maserasi, yaitu proses pengekstrakan simplisia dengan menggunakan pelarut melalui beberapa pengocokan pada suhu ruang (Lumbessy et al. 2013). Prinsip ekstraksi didasarkan pada perpindahan komponen zat yang terlarut ke dalam pelarut, sehingga terjadi perpindahan pada lapisan antar muka dan berdifusi terbawa pelarut. Maserasi digunakan untuk simplisia yang mengandung senyawa aktif yang mudah larut, tidak mengandung zat yang mudah menguap dalam pelarut, serta tidak mengandung benzoin, sitrat, dan lain-lain (Voigt 1994).
10
alkil (-R) yang bersifat non polar. Adanya kedua gugus tersebut diharapkan agar senyawa kimia dengan tingkat kepolaran berbeda dalam simplisia akan terekstrak kedalam etanol (Khopkar 2003). Sedangkan heksan dipilih untuk menjadi pembanding dari pelarut air dan etanol, hal ini karena heksan memiliki sifat non polar. Selain itu diharapkan senyawa nonpolar yang tidak terekstrak oleh air dan etanol dapat terekstrak oleh heksan.
Rendemen Ekstrak Daun Anggrek Merpati
Rendemen merupakan senyawa aktif yang terdapat pada sampel daun anggrek merpati yang terekstrak pada pelarut yang digunakan. Kuantitas rendemen dapat digunakan untuk mengetahui kemampuan pelarut dalam memisahkan senyawa aktif yang terdapat pada simplisia sampel daun anggrek merpati. Pemisahan ini terjadi berdasarkan interaksi analat (komponen senyawa aktif) dengan senyawa yang berasal dari pelarut. Interaksi ini akan terjadi berdasarkan polaritas masing-masing kepolaran analat dan pelarut yang hampir sama yang menimbulkan interaksi tersebut dapat terjadi (Ayoola et al. 2008). Hasil menunjukkan nilai rendemen yang paling besar diperoleh pada etanol yaitu sebesar 15.77%. Hal ini berdasarkan sifat etanol yang memiliki dua gugus fungsi yang berbeda tingkat kepolarannya, yaitu gugus hidroksil (OH) yang bersifat polar dan gugus alkil (-R) yang bersifat non polar. Adanya kedua gugus tersebut diharapkan agar senyawa kimia dengan tingkat kepolaran berbeda dalam simplisia akan terekstrak kedalam etanol (Khopkar 2003). Sehingga komponen yang terekstrak pada etanol menjadi lebih banyak.
Hasil Fitokimia Ekstrak Daun Anggrek Merpati
Fitokimia merupakan analisis awal yang dilakukan untuk mengidentifikasi senyawa aktif yang terdapat pada tumbuhan (Pembayun et al.. 2007). Uji fitokimia dilakukan untuk mengkaji kandungan senyawa aktif yang terdapat pada ekstrak daun anggrek merpati. Uji ini meliputi enam uji yaitu uji alkaloid, flavonoid, saponin, tanin, steroid dan triterpenoid. Menurut Egwaikhide dan Gimba (2007) perbedaan jenis pelarut akan mempengaruhi perbedaan hasil dalam kekuatan sinyal yang diidentifikasi, yaitu tingkat kepekatan.
11 Hasil Uji Antioksidan Ekstrak Daun Anggrek Merpati
Aktivitas antioksidan yang dilakukan terhadap ekstrak daun anggrek merpati dilakukan dengan metode DPPH dengan penentuan nilai IC50. Penentuan IC50 dilakukan untuk menentukan efektivitas ekstrak daun anggrek merpati terhadap radikal sebesar 50% (Molyneux 2004). Hasil penelitian menunjukkan bahwa ekstrak daun anggrek merpati dengan IC50 yang baik adalah dengan pelarut air. Hasil ini menunjukkan bahwa ekstrak daun anggrek merpati yang menggunakan pelarut air dengan IC50 sebesar 153.56±5.53μg/mL mampu menangkal radikal bebas sebannyak 50%. Nilai IC50 yang semakin rendah (dibawah 200 μg/mL) menunjukkan bioaktivitas yang semakin kuat dan lebih efektif (Kusuma 2012).
Berdasarkan perolehan data secara keseluruhan dapat dilihat aktivitas antioksidan yang paling tinggi terdapat pada sampel ekstrak daun anggrek merpati dengan pelarut air (IC50 terendah). Menurut Zebri et al. (2008) aktivitas antioksidan bahan alam dapat dipengaruhi oleh kadar fenol dan flavonoid yang dikandungnya, hal ini sesuai dengan data fitokimia yang menunjukkan bahwa total senyawa flavonoid tertinggi terdapat pada ekstrak daun anggrek merpati dengan pelarut air dengan melihat kepekatan warna hasil sampel uji flavonoid. Senyawa flavonoid merupakan senyawa yang memiliki gugus fenol yang lebih kompleks dengan derajat hidroksilasi yang lebih tinggi. Keberadaan gugus hidroksil pada senyawa fenol dan flavonoid tersebut yang menimbulkan antioksidan (Egwaikhide dan Gimba 2007). Hal ini dapat disebabkan karena atom oksigen pada gugus hidroksil mempunyai pasangan elektron yang bebas yang cukup untuk menghambat reaktivitas atom reatif penyusun senyawa radikal bebas (Gambar 7) (Egwaikhide dan Gimba 2007). Hasil ini membuktikan bahwa daun anggrek merpati cukup efektif digunakan sebagai antioksidan.
Gambar.7 Struktur dasar senyawa flavonoid (A),
12
Hasil Uji Inhibisi Enzim α-glukosidase
Enzim α-glukosidase merupakan enzim yang terdapat pada usus halus manusia. Enzim ini merupakan enzim kunci yang berperan dalam proses akhir pemecahan karbohidrat. Enzim α-glukosidase bekerja dengan cara menghidrolisis ikatan α-glikosidik pada oligosakarida dan menghasilkan glukosa. Pengujian aktivitas enzim α-glukosidase dapat diukur secara invitro dan in vivo. Pada pengujian secara in vitro dapat disimulasikan dengan menggunakan substrat p-NPG. Enzim α-glukosidase akan membantu menghidrolisis substrat p-NPG menjadi p-nitrofenil dan glukosa. Intensitas warna yang dihasilkan akan semakin kuat apabila jumlah p-nitrofenil yang dihasilkan semakin banyak (Gao et al.
2007). Analisis aktivitas inhibisi Enzim α-glukosidase di lakukan dengan prinsip, sampel yang digunakan memiliki kesamaan struktural dengan substrat sehingga mampu berkompetisi untuk mendapatkan sisi aktif enzim. Akibatnya produk yang terbentuk akan berkurang sehingga intensitas warna yang dihasilkan menjadi lemah (Irawan 2011).
Aktivitas inhibisi enzim α-glukosidase suatu bahan alam dipengaruhi oleh kadar flavonoid (Hartika 2009 ; Lukacinova et al. 2008 dan Fawzy et al. 2008). Flavonoid ditemui dalam bentuk mono-, di-, atau triglikosida. Oleh karena itu, unit-unit gugus hidroksil dalam flavonoid tersebut terikat oleh glukosa, senyawa flavonoid dari ekstrak daun anggrek merpati ini direaksikan dengan p-NPG dan enzim α-glukosidase. Senyawa flavonoid diharapkan dapat berkompetisi dengan substrat sehingga sampel dapat menempel pada sisi aktif enzim dan tidak terbentuk produk. Produk yang akan dihitung absorbansinya adalah p-nitrofenol yang berwarna kuning (Sutedja 2003). Selain itu Bayu (2009) menyatakan bahwa senyawa steroid selain bermanfaat sebagai antiradang, antiinflamasi, antikarsinogenik juga memiliki aktivitas inhibisi enzim α-glukosidase sebagai antidiabetes.
13 Toksisitas Ekstrak Daun Anggrek Merpati
Pengujian toksisitas merupakan uji yang dilakukan untuk menduga suatu bahan aktif memiliki kemampuan sebagai anti kanker dan hama penyakit, selain itu uji toksisitas ini dapat membantu menentukan efek farmakologi dari bahan tersebut (Mc Laughin et al. Dalam Attaur-Rahman 1991). Uji toksisitas ekstrak daun anggrek merpati dilakukan menggunakan metode BSLT dengan menggunakan larva udang Artemia salina Leach. Metode BSLT ini memiliki kelebihan selain mudah dan murah hasilnya memiliki tingkat kepercayaan 95% (Colegete et al. 1993). Senyawa aktif yang memiliki daya sitoksisitas tinggi diketahui berdasarkan nilai Lethal Concentration 50% (LC50), yaitu konsentrasi zat toksik yang dapat mengakibatkan kematian organisme sampai 50%. Menurut Meyer et al. (1982), senyawa kimia dikatakan berpotensi bioaktif bila mempunyai nilai LC50<1000 μg/mL dan bersifat non toksik bila nilai LC50>1000 μg/mL.
Hasil penelitian menunjukkan nilai LC50 dari seluruh ekskstrak daun anggrek merpati, ekstrak oleh air memiliki toksisitas yang paling tinggi sebesar 889.64±121.42 μg/mL, menurut Nurcholis (2008), nilai LC50 rendah (dibawah 1000 μg/mL) menunjukkan toksisitas yang tinggi. Sedangkan ekstrak oleh etanol dan heksan berturut-turut 1266.02±166.66 dan 3057.98±2657.73 μg/mL menunjukkan bahwa tingkat toksisitasnya rendah. Hal ini dapat disebabkan karena kandungan senyawa flavonoid pada ekstrak air, karena senyawa flavonoid memiliki aktivitas toksisitas (Nurcholis 2008).
SIMPULAN
Hasil penelitian menunjukkan aktivitas antioksidan dan toksisitas tertinggi teramati pada ekstrak daun anggrek merpati oleh pelarut air dengan IC50 sebesar 153.56±5.53 μg/mL dan tingkat toksisitas sebesar 889.64±121.42 μg/mL sedangkan aktivitas inhibisi enzim α-glukosidase yang paling tinggi dimiliki ekstrak daun anggrek merpati oleh pelarut etanol dengan presentase 64% pada konsentrasi 1000 μg/mL atau nilai IC50 sebesar 435 μg/mL
SARAN
17
18
Lampiran 1 Bagan alir penelitian
Persiapan sampel daun anggrek merpati
Uji BSLT Uji inhibisi α
-glukosidase Uji aktivitas
antioksidan
Pengukuran kadar air simplisia
19
Keterangan : C : bobot cawan + sampel basah B : bobot sampel basah A : bobot cawan + sampel kering
Lampiran 3 Rendemen daun anggrek merpati
Pelarut Bobot sampel (g) Bobot ekstrak (g) Rendemen (%)
Etanol 25 3.80 15.77
Lampiran 4 Data Nilai LC50 (toksisitas) ekstrak daun anggrak merpati
Pelarut Ulangan LC50 (μg/mL) LC50 rata-rata
21
22
Contoh perhitungan:
% Inhibisi = (S1-S0)
S1 100
= (0. 03-0.134)
0. 03 100
= 85.160% Keterangan : S1= absorbansi blanko
S0= absorbansi sampel Menentukan IC50
Y = ax + b x = (y-b)
a
contoh perhitungan :
y = 24.9 ln (x) – 74.42 50 = 24.9 ln (x) – 74.42 ln (x) = (5024. - 4.42)
ln (x) = 4.997 x = 147.93 IC50 rerata = 3
= 3
23
24
Contoh perhitungan:
% Inhibisi = C-(S1-S0)
c 100
= 0.5 4-(0.0. 1-0.05 )
0.5 4 100
= 99.291%
20
Lampiran 7 gambar hasil uji fitokimia steroid dan terpenoid
Uji alkaloid Uji tanin
Uji steroid dan terpenoid Uji flavonoid
2
dalam menurunkan kadar glukosa dalam darah, selain itu daun anggrek merpati juga memiliki kandungan flavonoid yang tinggi, kandungan flavonoid yang tinggi ini selain bermanfaat sebagai antidiabetes juga berpotensi sebagai antioksidan, antiinflamasi dan antikanker (Kumar et al. 2011) .
Tujuan penelitian ini adalah mengetahui pengaruh ekstrak daun (Dendrobium crumenatum Sw.) terhadap aktivitas antioksidan, aktivitas inhibisi enzim α glukosidase dan toksisitasnya secara in vitro dengan menggunakan tiga jenis pelarut yaitu air, etanol dan heksan. Penelitian ini diharapkan mampu memberi informasi ekstrak daun anggrek merpati terhadap aktivitas inhibisi enzim α-glukosidase, aktivitas antioksidan serta potensinya sebagai senyawa yang bersifat toksisitas pada larva udang Artemia salina Leach dengan pelarut yang terbaik, sehingga dapat dieksplorasi lebih lanjut sebagai suatu sumber tanaman obat.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan selama 3 bulan dari bulan Februari sampai dengan April 2014. Tempat pelaksanaan program ini di Laboratorium Biokimia, Departemen Biokimia dan Laboratorium Pusat Studi Biofarmaka IPB.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, gelas piala, rotavapor, shaker, labu Erlemeyer, pipet tetes, pipet Mohr, pipet volumetrik, oven, cawan porselin, penjepit kayu, penjepit besi, neraca analitik, batang pengaduk, Elisa, Spektrofotometer Serapan Atom, eksikator, lampu UV, corong pisah, jarum suntik, gelas ukur, cawan penguap, dan mesin penghalus.
Bahan-bahan yang digunakan, yaitu tanaman anggrek merpati, etanol 70%, akuades, HCl, ammonia, kloroform, pereaksi Dragendroff, pereaksi Mayer, NaOH, NaCH3COO, enzim α-glukosidase, p-nitrofenil α-D-glukopiranosida, KH2PO4, metanol 30 %, H2SO4, FeCl3, telur udang Artemia salina, air, kertas saring, alkohol teknis,
Prosedur Analisis Data
Ekstraksi Daun Anggrek Merpati (Depkes 2002)
3 didalam gelas Erlemeyer 250 mL, sambil di goyang. Hasil maserasi diukur filtratnya lalu dilakukan evaporasi pada suhu 60°C selama 15 menit untuk menguapkan pelarutnya hingga diperoleh ekstrak kental (pasta). Sedangkan dengan pelarut akuades serbuk anggrek merpati ditimbang sebanyak 25 g kemudian ditambahkan air sebanyak 250 mL lalu direbus selama 6 jam pada suhu 50°C. Setelah itu, larutan tersebut disaring untuk mendapatkan ekstrak air anggrek merpati.
Penentuan kadar air (Depkes 2002)
Cawan porselen dikeringkan selama 3 jam dalam oven pada suhu 105°C, lalu didinginkan dalam eksikator selama 1 jam kemudian bobot cawan ditimbang (a). Sebanyak 5 g sampel ditimbang (b), lalu dimasukkan ke dalam cawan porselen dan dikeringkan dalam oven selama 4-6 jam pada suhu 105°C. Setelah itu, didinginkan dalam eksikator dan ditimbang kembali (c). Pengukuran kadar air diulang sampai 3 kali, hingga dicapai bobot konstan, dan dihitung kadar airnya. Adapun rumus penentuan kadar air sebagai berikut:
% Bobot kering (BK) = x100% % Kadar air = 100 - %BK Penapisan Fitokimia (Harborne 1987)
Penapisan fitokimia terhadap daun anggrek merpati dilakukan untuk mengetahui kandungan senyawa bioaktif daun tersebut. Pengujian yang dilakukan diantaranya adalah uji flavonoid, uji alkaloid, uji tanin, uji triterpenoid dan steroid, serta uji saponin. Pengujian senyawa bioaktif yang terkandung dalam daun anggrek merpati ini mengacu pada metode Harborne 1987.
Uji flavonoid. Tabung reaksi disiapkan dan diisi dengan 0.1 g ekstrak dan ditambahkan 2 mL etanol 90%. Campuran tersebut dikocok hingga homogen dan dipanaskan pada suhu 100ºC selama 5 menit. Larutan didinginkan dan ditabahkan larutan H2SO4 pekat. Perubahan warna diamati. Hasil positif ditunjukkan dengan adanya perubahan menjadi warna merah. Metode tersebut diulangi dengan menggunakan 1 mL ekstrak daun anggrek merpati yang telah diencerkan.
Uji alkaloid. Ekstrak daun anggrek merpati sebanyak 0.5 g dimasukkan ke dalam tabung reaksi dan ditambahkan 5 mL HCl 1%. Larutan dikocok hingga homogen. Larutan disaring dengan kertas saring. Filtrat yang diperoleh ditambahkan dengan 1 mL H2SO4. Larutan dibagi menjadi tiga bagian. Bagian pertama ditambahkan 1 mL pereaksi Dragendrof. Bagian kedua ditambahkan 1 mL pereaksi Meyer. Bagian ketiga ditambahkan 1 mL peraksi Wagner.
4
Uji terpenoid dan steroid. Sebanyak 0.1 g ekstrak daun anggrek merpati dimasukkan ke dalam tabung reaksi dan ditambahkan 5 mL etanol 30%. Larutan dikocok dan dipanaskan pada 100ºC selama 5 menit. Larutan didinginkan dan disaring. Filtrat yang diperoleh diuapkan. Filtrat diencerkan dengan 1 mL eter. Larutan dibagi menjadi dua. Larutan ditambahkan dengan 2 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat. Hasil positif ditunjukkan dengan warna merah untuk terpenoid dan biru atau hijau untuk steroid.
Uji antioksidan (Bintang M2009)
Persiapan standar. Standar yang dipakai pada penelitian ini ialah asam askorbat. Serbuk asam askorbat ditimbang sebanyak 0.005 gram. Serbuk ini dimasukkan ke dalam labu ukur 100 mL. Akuades dimasukkan pula ke dalam labu ukur tersebut hingga tanda tera 100 mL. Labu tersebut ditutup dengan alumunium foil dan dikocok vertikal hingga homogen. Larutan standar asam askorbat sediaan dengan konsentrasi 50 mL siap diencerkan. Larutan asam askorbat yang digunakan sebagai standar konsentrasinya yaitu 10 μg/mL, 7.5 μg/mL, 5 μg/mL, 2.5 μg/mL, 1 μg/mL, dan 0.5 μg/mL.
Persiapan reagen DPPH. Serbuk reagen DPPH sebanyak 0.005 gram ditimbang dan dimasukkan ke dalam labu ukur 50 mL. Akuades dimasukkan pula ke dalam labu ukur 50 mL. Labu tersebut ditutup dengan alumunium foil dan diultrasonikasi selama 30 menit hingga homogen. Larutan reagen DPPH 100 μg/mL siap digunakan.
Uji antioksidan metode DPPH. Sebanyak 100 μL ekstrak sampel/standar diletakkan ke dalam plat mikro. Kemudian reagen DPPH 100 μg/mL sebanyak 100 μL ditambahkan kedalam plat mikro tersebut. Campuran dikocok hingga homogen inkubasi larutan uji di ruang yang gelap selama 90 menit. Absorbansi dibaca dengan microplat reader pada panjang gelomabang 517 nm (Bintang M 2009)
Aktivitas Inhibisi α-Glukosidase (Saraswaty 2010)
Pengujian inhibisi α-glukosidase dilakukan dengan modifikasi metode Saraswaty (2010). Pengujian terhadap inhibisi aktivitas enzim α-glukosidase menggunakan substrat p-nitrofenil-α-D-glukopiranosida (p-NPG) dan enzim α -glukosidase. Larutan enzim dibuat dengan melarutkan 1.0 mg enzim α -glukosidase dalam larutan bufer fosfat (pH 7) yang mengandung 200 mg serum bovin albumin. Sebelum digunakan enzim diencerkan 25 kali dengan bufer fosfat pH 7.
Sampel ekstrak daun anggrek merpati masing-masing dilarutkan dalam DMSO dengan konsentrasi 1000, 500, 250, 125, 62.5, 31.25 μg/mL. Pengujian aktivitas inhibisi enzim α glukosidase dengan mereaksikan sampel ekstrak daun anggrek merpati, enzim α-glukosidase dan substrat p-NPG. Penghentian reaksi enzim substrat dilakukan dengan penambahan Na2CO3 200 mM. Sistem reaksi seperti pada Tabel 1 disiapkan pada microplate. Larutan kemudian diukur absorbansinya menggunakan microplate reader pada panjang gelombang 400 nm. Percobaan dilakukan sebanyak tiga kali ulangan.
5 dalam campuran reaksi seperti dalam sampel ekstrak. Daya inhibisi enzim α -glukosidase dapat dinyatakan dalam % daya inhibisi, dengan rumus sebagai berikut :
S1 : campuran enzim-substrat dengan ekstrak Tabel 1 Sistem reaksi inhibisi α-glukosidase
Blanko C S0 S1
Blanko : Sistem reaksi tanpa adanya ekstrak dan enzim C : campuran tanpa ekstrak 20
S0 : campuran dengan enzim, namun tanpa ekstrak S1 : campuran dengan enzim dan ekstrak
Uji Toksisitas dengan Metode BSLT(Meyer et al.1982)
6
konsentrasi yang digunakan. Nilai x yang diperoleh merupakan konsentrasi larutan yang menyebabkan kematian terhadap 50% larva udang. Ekstrak dinyatakan aktif apabila nilai LC50 lebih kecil dai 1000 μg/mL.
HASIL
Kadar Air Daun Anggrek Merpati
Hasil pengukuran kadar air simplisia daun Anggrek merpati asal Bogor dari tiga kali ulangan yaitu ulangan 1, 2 dan 3 mendapatkan hasil berturut-turut sebesar 3.42%, 3.32% dan 3.22% dan mendapatkan rata-rata sebesar 3.32% (data dan perhitungan pada Lampiran 2).
Rendemen Ekstrak daun Anggrek Merpati
Hasil pengukuran rendemen ekstrak daun anggrek merpati dengan pelarut etanol, heksan dan air (Gambar 2) mendapatkan rendemen berkisar antara 1.98% hingga 15.77%. Rendemen tertinggi terdapat pada ekstrak daun anggrek merpati dengan pelarut etanol (15.77%), sedangkan rendemen terendah terdapat pada ekstrak daun anggrek merpati dengan pelarut heksan (1.98%) (data dan perhitungan pada Lampiran 3).
Gambar 2. Rendemen ekstrak daun anggrek merpati Hasil uji Fitokimia Ekstrak Daun Anggrek Merpati
Hasil uji fitokimia ekstrak daun anggrek merpati dengan pelarut etanol, heksan dan air pada (Gambar 3) menunjukkan bahwa pelarut yang paling banyak melarutkan senyawa senyawa fitokimia adalah pelarut etanol yaitu senyawa flavonoid, saponin, tanin, dan steroid, sedangkan pelarut yang paling sedikit melarutkan senyawa fitokimia adalah pelarut heksan yaitu hanya senyawa steroid. Gambar hasil fitokimia dapat dilihat pada Lampiran 7.
PENDAHULUAN
Perkembangan pola hidup dan makanan, mengarah pada kebiasaan mengkonsumsi makanan dan cara hidup yang praktis dan mudah didapat, seperti mengkonsumsi makanan cepat saji dan kebiasaan merokok tanpa dibarengi dengan kegiatan olah raga. Dampak yang dihasilkan dari pola hidup yang tidak baik ini berakibat pada adanya akumulasi radikal bebas di dalam tubuh. Radikal bebas merupakan salah satu faktor yang mengakibatkan timbulnya penyakit degeneratif. Penyakit tersebut digolongkan sebagai penyakit-penyakit akibat terganggunya metabolisme tubuh seseorang, penyakit yang muncul antara lain penyakit jantung koroner, penyakit diabetes melitus, darah tinggi, stroke dan kanker (Steinberg 2009).
Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas yang dapat menyebabkan kerusakan asam lemak tak jenuh, membran dinding sel, pembuluh darah, basa DNA, dan jaringan lipid sehingga menimbulkan penyakit (Subeki 1998). Tubuh tidak mempunyai sistem pertahanan antioksidatif yang berlebihan, sehingga jika terjadi paparan radikal berlebih tubuh membutuhkan antioksidan eksogen (Rohdiana 2001). Banyak upaya yang dilakukan untuk mendapatkan antioksidan dari luar tubuh (eksogen) guna mendukung antioksidan yang ada di dalam tubuh (endogen). Salah satu antioksidan yang sering dijumpai adalah golongan fenolik yang banyak ditemukan hampir di setiap tumbuhan. Berdasarkan Marinova et al. (2005) lebih dari 4000 jenis flavonoid ditemukan di berbagai tumbuhan tingkat tinggi dan tingkat rendah.
Salah satu penyakit degeneratif akibat akumulasi radikal bebas yaitu Diabetes melitus. Diabetes melitus (DM) merupakan suatu kelainan metabolik kronis serius yang memiliki dampak signifikan terhadap kesehatan seseorang atau suatu kondisi konsentrasi glukosa dalam darah secara kronis lebih tinggi dari pada nilai normal (hiperglikemia) akibat tubuh kekurangan insulin atau fungsi insulin yang tidak efektif (Subroto 2006).
Menurut data yang dikeluarkan World Healt Organisation (WHO) tahun 2010 menyebutkan bahwa 60% penyebab kematian semua umur di dunia adalah karena penyakit tidak menular. Diabetes melitus menduduki peringkat ke-6 sebagai penyebab kematian. Sekitar 1,3 juta orang meninggal akibat diabetes dan empat persen meninggal sebelum umur 70 tahun. Pada tahun 2030 diperkirakan Indonesia akan memiliki penyandang DM sebanyak 21,3 juta jiwa (Depkes 2013).
Indonesia merupakan negara agraris dengan megabiodiversitas, memiliki keanekaragaman hayati flora dan fauna yang sangat melimpah. Hal ini tentu membuat Indonesia memiliki berbagai tanam-tanaman yang memiliki berbagai potensi, salah satunya sebagai obat. Anggrek merpati (Dendrobium chrysotoxum)
merupakan salah satu tumbuhan obat yang banyak tumbuh di India, Indochina, Myanmar, cina, Thailand, Semenanjung Malaysia, Indonesia termasuk pulau kalimantan, Filipina, dan Kepulauan di Samudra Pasifik, sehingga mudah ditemui bahkan pada cabang- cabang pohon di pinggir jalan sekalipun (Wing 1998), tetapi selama ini anggrek merpati dikenal sebagai jenis anggrek yang kurang diperhatikan masyarakat. Menurut Zhao Y (2007) Tanaman Anggrek
2
dalam menurunkan kadar glukosa dalam darah, selain itu daun anggrek merpati juga memiliki kandungan flavonoid yang tinggi, kandungan flavonoid yang tinggi ini selain bermanfaat sebagai antidiabetes juga berpotensi sebagai antioksidan, antiinflamasi dan antikanker (Kumar et al. 2011) .
Tujuan penelitian ini adalah mengetahui pengaruh ekstrak daun (Dendrobium crumenatum Sw.) terhadap aktivitas antioksidan, aktivitas inhibisi enzim α glukosidase dan toksisitasnya secara in vitro dengan menggunakan tiga jenis pelarut yaitu air, etanol dan heksan. Penelitian ini diharapkan mampu memberi informasi ekstrak daun anggrek merpati terhadap aktivitas inhibisi enzim α-glukosidase, aktivitas antioksidan serta potensinya sebagai senyawa yang bersifat toksisitas pada larva udang Artemia salina Leach dengan pelarut yang terbaik, sehingga dapat dieksplorasi lebih lanjut sebagai suatu sumber tanaman obat.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan selama 3 bulan dari bulan Februari sampai dengan April 2014. Tempat pelaksanaan program ini di Laboratorium Biokimia, Departemen Biokimia dan Laboratorium Pusat Studi Biofarmaka IPB.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, gelas piala, rotavapor, shaker, labu Erlemeyer, pipet tetes, pipet Mohr, pipet volumetrik, oven, cawan porselin, penjepit kayu, penjepit besi, neraca analitik, batang pengaduk, Elisa, Spektrofotometer Serapan Atom, eksikator, lampu UV, corong pisah, jarum suntik, gelas ukur, cawan penguap, dan mesin penghalus.
Bahan-bahan yang digunakan, yaitu tanaman anggrek merpati, etanol 70%, akuades, HCl, ammonia, kloroform, pereaksi Dragendroff, pereaksi Mayer, NaOH, NaCH3COO, enzim α-glukosidase, p-nitrofenil α-D-glukopiranosida, KH2PO4, metanol 30 %, H2SO4, FeCl3, telur udang Artemia salina, air, kertas saring, alkohol teknis,
Prosedur Analisis Data
Ekstraksi Daun Anggrek Merpati (Depkes 2002)
13 Toksisitas Ekstrak Daun Anggrek Merpati
Pengujian toksisitas merupakan uji yang dilakukan untuk menduga suatu bahan aktif memiliki kemampuan sebagai anti kanker dan hama penyakit, selain itu uji toksisitas ini dapat membantu menentukan efek farmakologi dari bahan tersebut (Mc Laughin et al. Dalam Attaur-Rahman 1991). Uji toksisitas ekstrak daun anggrek merpati dilakukan menggunakan metode BSLT dengan menggunakan larva udang Artemia salina Leach. Metode BSLT ini memiliki kelebihan selain mudah dan murah hasilnya memiliki tingkat kepercayaan 95% (Colegete et al. 1993). Senyawa aktif yang memiliki daya sitoksisitas tinggi diketahui berdasarkan nilai Lethal Concentration 50% (LC50), yaitu konsentrasi zat toksik yang dapat mengakibatkan kematian organisme sampai 50%. Menurut Meyer et al. (1982), senyawa kimia dikatakan berpotensi bioaktif bila mempunyai nilai LC50<1000 μg/mL dan bersifat non toksik bila nilai LC50>1000 μg/mL.
Hasil penelitian menunjukkan nilai LC50 dari seluruh ekskstrak daun anggrek merpati, ekstrak oleh air memiliki toksisitas yang paling tinggi sebesar 889.64±121.42 μg/mL, menurut Nurcholis (2008), nilai LC50 rendah (dibawah 1000 μg/mL) menunjukkan toksisitas yang tinggi. Sedangkan ekstrak oleh etanol dan heksan berturut-turut 1266.02±166.66 dan 3057.98±2657.73 μg/mL menunjukkan bahwa tingkat toksisitasnya rendah. Hal ini dapat disebabkan karena kandungan senyawa flavonoid pada ekstrak air, karena senyawa flavonoid memiliki aktivitas toksisitas (Nurcholis 2008).
SIMPULAN
Hasil penelitian menunjukkan aktivitas antioksidan dan toksisitas tertinggi teramati pada ekstrak daun anggrek merpati oleh pelarut air dengan IC50 sebesar 153.56±5.53 μg/mL dan tingkat toksisitas sebesar 889.64±121.42 μg/mL sedangkan aktivitas inhibisi enzim α-glukosidase yang paling tinggi dimiliki ekstrak daun anggrek merpati oleh pelarut etanol dengan presentase 64% pada konsentrasi 1000 μg/mL atau nilai IC50 sebesar 435 μg/mL