PENAPISAN DAN IDENTIFIKASI BAKTERI ENDOFIT
CABAI MERAH PENGHAMBAT
Colletotrichum capsici
LU’LU’ ATUL FITRIYAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan dan Identifikasi Bakteri Endofit Cabai Merah Penghambat Colletotrichum capsici adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Lu’lu’ Atul Fitriyah
ABSTRAK
LU’LU’ ATUL FITRIYAH. Penapisan dan Identifikasi Bakteri Endofit Cabai Merah Penghambat Colletotrichum capsici. Dibimbing oleh SYAEFUDIN, IFA MANZILA, dan DWI NINGSIH SUSILOWATI.
Cabai merah menjadi salah satu komoditas pertanian penting yang dibudidayakan di Indonesia. Adanya kenaikan maupun penurunan produksi cabai merah yang fluktuatif disebabkan oleh patogen Colletotrichum sp. Salah satu agen biokontrol untuk mengatasi masalah tersebut adalah penggunaan bakteri endofit. Bakteri endofit yang mampu memproduksi Asam Indol Asetat (AIA) dapat meningkatkan pertahanan tanaman terhadap patogen. Penelitian ini bertujuan mengisolasi, mengarakterisasi, dan mengidentifikasi isolat bakteri endofit tanaman cabai merah yang memiliki aktivitas sebagai penghasil AIA yang mampu menghambat patogen Colletotrichum capsici. Sebanyak 109 isolat bakteri endofit asal BB Biogen dan Hama Proteksi Tanaman IPB telah dianalisis. Isolat dengan kode B6.2 merupakan isolat yang dapat menghambat C. capsici tertinggi yaitu 75% dan isolat dengan kode A27 mampu menghasilkan AIA tertinggi yaitu 70.41 ppm. Pengujian ke-8 isolat bakteri endofit menunjukkan 3 isolat bakteri endofit potensial, yaitu A4.2, B6.2, dan D11.1. Berdasarkan hasil sekuensing gen 16S rRNA diketahui isolat A4.2 termasuk dalam genus Pseudomonas serta isolat B6.2 dan D11.1 termasuk dalam genus Bacillus.
Kata kunci: bakteri endofit, produksi AIA, patogen Colletotrichumcapsici
ABSTRACT
LU’LU’ ATUL FITRIYAH. Screening and Identification Endophytic Bacteria Red Chili that has Inhibit Colletotrichum capsici. Supervised by SYAEFUDIN, IFA MANZILA, and DWI NINGSIH SUSILOWATI
Red chili is one of the important cultivated comodities in Indonesia. The fluctuating increase and decrease of red chili production is caused by Colletotrichum sp. pathogen. One of the biocontrol agents to solve the problem is endophytic bacteria. Endophytic bacteria that can produce Indole Acetic Acid (IAA) can increase plant’s defense from the pathogen. This research’s purposes areto isolate, characterize, and identify endophytic bacteria isolate from red chili that has AIA-producing activity and can inhibit Colletotrichum capsici. There are 109 endophytic bacteria isolates from BB Biogen and Bogor Agricultural University Departement of Plant and Protection that have been analyzed. B6.2 isolate is the highest isolate that has inhibit C. capsici which is 75% and A27 isolate produces the most amount of AIA which is 70.41 ppm. After the 8th test endophytic bacteria isolates, it shows that there are 3 potential endophytic bacteria isolates which are A4.2, B6.2, and D11.1. Based on the result of sequencing 16S rRna gene known that isolate A4.2 classified into Pseudomonas genus, B6.2 and D11.1 isolates are classified into Bacillus genus.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PENAPISAN DAN IDENTIFIKASI BAKTERI ENDOFIT
CABAI MERAH PENGHAMBAT
Colletotrichum capsici
DEPARTEMEN BIOIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 ini ialah Penapisan dan Identifikasi Bakteri Endofit Cabai Merah Penghambat Colletotrichum capsici.
Terima kasih penulis ucapkan kepada Bapak Syaefudin, SSi, MSi, Ibu Dr Ifa Manzila, MSi, dan Ibu Dwi Ningsih Susilowati, STP, MSi selaku pembimbing yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Jajang, Bapak Ughi, Ibu Aminah, dan Kak Sherly beserta seluruh staf Laboratorium Mikrobiologi Konservasi Mikroorganisme BB Biogen yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, sahabat dekat, serta teman-teman Biokimia angkatan 48, keluarga HKRB untuk segala doa, kasih sayang dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Metode Penelitian 3
HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 13
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 22
RIWAYAT HIDUP 31
DAFTAR TABEL
1 Pengujian antagonis bakteri endofit terhadap C. capsici 10 2 Analisis kuantitatif AIA isolat bakteri endofit 10 3 Analisis kualitatif HCN isolat bakteri endofit 11 4 Konsentrasi dan kualitas DNA 8 isolat bakteri endofit pada λ260 nm
dan λ280 nm 11
5 Identifikasi isolat A4.2, B6.2, dan D11.1 12
DAFTAR GAMBAR
1 Skema pengujian antagonis antara bakteri endofit (garis lurus) dengan patogen C. capsici (bulat abu-abu) dalam cawan petri 6 2 Jumlah isolat bakteri endofit cabai merah yang diisolasi dari akar,
batang, dan daun 9
3 Pengujian antagonis bakteri endofit (a) mampu menghambat, (b) sangat menghambat, dan (c) tidak mampu menghambat C. Capsici 10 4 Elektroforegram hasil isolasi DNA (M) marker 1 kb (1) isolat A27 (2)
isolat A28 (3) isolat A2.1 (4) isolat A2.2 (5) isolat A4.2 (6) isolat B1.2
(7) isolat B6.2 (8) isolat D11.1 12
5 Elektroforegram hasil isolasi DNA (M) marker 1 kb (1) isolat A27 (2) isolat A28 (3) isolat A2.1 (4) isolat A2.2 (5) isolat A4.2 (6) isolat B1.2
(7) isolat B6.2 (8) isolat D11.1 12
6 Struktur kimia hormon AIA 15
7 Lintasan sintesis AIA pada sel bakteri 16
8 Standar AIA 28
DAFTAR LAMPIRAN
1 Bagan alir penelitian 22
2 Delapan isolat bakteri endofit cabai merah penghasil AIA 23 3 Hasil seleksi dan karakterisasi 109 isolat bakteri endofit cabai merah 24
4 Deret standar AIA dari larutan standar 27
5 Pengukuran absorbansi standar AIA λ 530 nm 27
PENDAHULUAN
Tanaman cabai, seperti cabai rawit, cabai merah, paprika, dan cabai hias merupakan salah satu komoditas pertanian yang banyak dibudidayakan oleh petani. Cabai merah (Capsicum annum L.) biasa digunakan sebagai bumbu dapur atau rempah-rempah. Tanaman cabai merah mengandung kalori, protein, lemak, kabohidarat, kalsium, vitamin A, B1, C, dan kapsidiol. Cabai merah juga mengandung antioksidan yang berfungsi untuk menjaga tubuh dari radikal bebas dan Lasparaginase serta Capsaicin yang berperan sebagai zat antikanker (Prajnanta 2001).
Kebutuhan cabai merah pada tahun 2010 sebanyak 317 400 000 kg per tahun (Kementerian Pertanian 2013). Produksi cabai merah pada tahun 2009 sebesar 7.04 ton/ha, sedangkan tahun 2010 hanya mencapai 3.83 ton/ha (BPS 2011). Produksi cabai merah nasional tahun 2011 sebesar 888 852 ton dan tahun 2012 terjadi kenaikan 7.28% menjadi sebesar 935 557 ton (Kementerian Pertanian 2013). Adanya kenaikan maupun penurunan produksi cabai merah yang fluktuatif disebabkan oleh gangguan penyakit yang menyerang cabai merah. Salah satu gangguan penyakit yang menyerang tanaman cabai sejak tanaman disemaikan sampai dipanen adalah antraknosa (Hidayat et al. 2004).
Penyakit antraknosa disebabkan oleh patogen Colletotrichum sp. Penyakit ini menyebabkan buah akan gugur sebelum dipanen dan busuk ketika sudah dipanen sehingga dapat menurunkan produksi cabai merah sebesar 45-60% (Hidayat et al. 2004). Penggunaan pestisida untuk tujuan pengendalian hama dan penyakit tanaman masih merupakan cara yang paling disukai oleh petani. Penggunaan pestisida yang terlalu sering dapat menyebabkan terjadinya residu pada bahan makanan, pencemaran lingkungan, dan munculnya hama dan patogen yang resisten terhadap suatu pestisida. Pengendalian ramah lingkungan perlu dikembangkan untuk mengatasi dampak negatif tersebut. Salah satu alternatifnya dengan pemanfaatan agen biokontrol berupa bakteri antagonis atau bakteri endofit (Suryadi et al. 2013).
Bakteri endofit merupakan bakteri yang hidup dan berasosiasi dengan jaringan tanaman tanpa memberikan kerugian pada tanaman tersebut. Beberapa kelebihan bakteri endofit diantaranya mikroorganisme ini banyak terdapat di tanah atau jaringan tanaman sehat, produksi massal lebih mudah dan lebih cepat daripada mikroorganisme lain, seperti jamur (Yadi et al. 2013). Bakteri endofit menguntungkan tanaman inangnya dengan cara menstimulasi pertumbuhan tanaman, memfiksasi nitrogen, dan meningkatkan sistem pertahanan tanaman terhadap gangguan penyakit tanaman. Hal ini dikarenakan bakteri endofit mampu memproduksi senyawa antibakteri, enzim, asam salisilat, etilena, dan senyawa sekunder yang berperan dalam menginduksi ketahanan tanaman (Marwan et al. 2011).
2
bakteri endofit yang berperan dalam merangsang hormon pemacu pertumbuhan tanaman adalah hormon AIA. Bakteri penghasil hormon AIA berpotensi untuk bergabung dengan beberapa proses fisiologi tanaman dengan cara memasukkan AIA yang dihasilkannya ke tanaman sehingga akan mempengaruhi pertumbuhan tanaman. Beberapa bakteri endofit pernah diisolasi dari jaringan tanaman pangan, seperti tanaman padi, jagung, dan tebu (Khairani 2009). Isolasi dan identifikasi bakteri endofit dari tanaman cabai merah penghasil AIA dalam menghambat patogen C. capsici belum pernah dilaporkan, sehingga perlu dilakukan penelitian untuk menguji keefektifan fitohormon yang dihasilkan cabai merah tersebut.
Penelitian yang dilakukan meliputi isolasi, karakterisasi, dan identifikasi bakteri endofit tanaman cabai merah yang memiliki aktivitas sebagai penghasil AIA yang mampu menghambat patogen C. capsici. Penelitian ini bertujuan mendapatkan isolat bakteri endofit potensial untuk pengendalian patogen C. capsici sehingga dapat digunakan sebagai agen biokontrol. Penelitian ini diharapkan mendapatkan bakteri endofit potensial yang mampu menghambat patogen C. capsici pada tanaman cabai merah melalui peningkatan pembentukan AIA sehingga memberikan respon ketahanan tanaman.
METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini yaitu isolat bakteri endofit cabai merah koleksi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen) dan cabai merah koleksi Hama dan Proteksi Tanaman Institut Pertanian Bogor (HPT IPB) dari akar, batang, dan daun, larutan sodium hipoklorit 5% dan 20%, etanol 70%, Gentian violet, L-triptofan, reagen Salkowski, lugol iodin, larutan Fuchin, kentang, akuades, dextrose, isolat Colletotrichum capsici,buffer STE (100 mM NaCl, 10 mM Tris-HCl, 1 mM EDTA
pH 8), kit lisis sel, primer 63F (forward) dan primer 1387R (reverse), DNA polymerase (Go Taq Green Master Mix-Promega), loading dye 6x, dan marker ladder 1 kb.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah sentrifus Legend Micro 21R (Amerika Serikat), spektrofotometer UV-visible Hitachi U-2800 (Jepang), kabinet laminar air flow, shaker incubator IKA KS 260 Basic (Jerman), oven, autoklaf Wiseclave (Jerman), kuvet, cawan petri, tabung reaksi, pipet tetes, pipit Mohr, gelas ukur, gelas piala, kaca objek, bunsen, inkubator, kertas saring, mikroskop cahaya Olympus BX-51 (Jepang), mortar, labu ukur, mesin PCR Esco (Singapura), freezer, microwave, pengaduk magnetik, vortex, waterbath,
3 Metode Penelitian
Secara garis besar penelitian ini terbagi menjadi beberapa tahap, yaitu isolasi bakteri endofit cabai merah, uji hipersensitivitas, uji hemolisis, uji antagonis terhadap patogen C. capsici, pewarnaan Gram, analisis kuantitatif produksi AIA, uji HCN, isolasi DNA, amplifikasi gen 16S rRNA, dan identifikasi isolat bakteri endofit potensial.
Pembuatan Media
Media Agar-agar King’s B (Schegel 1993). Sebanyak 20 g protease pepton, 15 mL gliserol, 1.5 g KH2PO4, 1.5 g MgSO4.7H2O dilarutkan dalam 1000 mL akuades dalam Erlenmeyer. Setelah tercampur secara merata, ditambahkan 20 g bacto agar. Setelah semuanya larut, larutan di autoklaf pada suhu 121oC selama 1 jam. Selanjutnya media yang sudah diautoklaf, dituang secukupnya ke dalam cawan petri. Cawan petri yang sudah berisi media padat disimpan pada suhu 4oC.
Media Nutrient Broth (NB) cair (Schegel 1993). Sebanyak6.5 g Nutrient Broth (NB) dilarutkan dalam 500 mL akuades dalam Erlenmeyer dan dihomogenkan sampai merata. Media NB cair tersebut ditambahkan 10 g bacto agar untuk media NA dan dapat juga dioven sampai larut dan dimasukkan ke dalam tabung reaksi untuk media agar miring. Setelah itu, media di autoklaf pada suhu 121oC selama 1 jam.
Media Potato Dextrose Agar (PDA) (Schegel 1993). Komposisi media PDA terdiri atas campuran air rebusan kentang kentang 200 g, bacto agar 20 g, dextrose agar 20 g, dan akuades 1000 mL. Sebanyak 200 g kentang direbus dengan 500 mL akuades. Setelah mendidih, air rebusannya disaring dan ditambahkan dengan akuades sampai volume akhirnya 1000 mL. Lalu, ditambahkan 20 g dextrose agar, dan 20 g bacto agar, diaduk sampai merata. Setelah semuanya larut, larutan di autoklaf pada suhu 121oC selama 1 jam. Selanjutnya media yang sudah diautoklaf, dituang secukupnya ke dalam cawan petri. Cawan petri yang sudah berisi media padat disimpan pada suhu 4oC.
Media Agar Darah (Blood Agar) (Gerhardt et al. 1994). Sebanyak 40 g/ L Blood Agar Base (BBL) dicampurkan dengan 1 L akuades dalam Erlenmeyer. Setelah tercampur merata, larutan di autoklaf suhu 121oC selama 1 jam. Lalu, ditambahkan dengan darah domba steril yang telah didefibrinasi sebanyak 70 mL/ L. Selanjutnya media dihomogenkan, lalu dituang secukupnya ke dalam cawan petri. Cawan petri yang sudah berisi media padat disimpan pada suhu 4oC.
Media Glisin (Godinho et al. 2010). Sebanyak 3.25 g NB dilarutkan dalam 250 mL akuades dalam Erlenmeyer dan ditambahkan 1.1 g glisin. Setelah semuanya tercampur, ditambahkan 5 g bacto agar. Kemudian dioven sampai larut dan dimasukkan ke dalam tabung reaksi. Tabung reaksi ditutup dengan kapas dan kertas alumunium foil. Tabung reaksi yang sudah berisi media padat di autoklaf pada suhu 121oC selama 1 jam. Setelah itu, tabung reaksi di miringkan supaya terbentuk media glisin.
Pembuatan Larutan
4
volume akhirnya 500 mL. Larutan kemudian dipindahkan ke dalam botol gelap yang dilapisi alumunium foil dan disimpan di tempat yang gelap.
Larutan Standar AIA (Patten & Glick 2002). Sebanyak 0.1 g standar dilarutkan ke dalam 50 mL akuades ke dalam labu Erlenmeyer dan dihomogenkan hingga merata. Setelah itu, Erlenmeyer ditutup dengan alumunium foil.
Larutan L-Triptofan (Gupta et al. 2012). Sebanyak 2 g L-triptofan dilarutkan dengan akuades steril hingga mencapai volume akhir 100 mL kemudian disterilkan dengan autoklaf suhu 121oC. Larutan L-Triptofan disaring dengan milipore 0.45 μm hingga larutan L-Triptofan berwarna jernih.
Larutan Asam Pikrat (Godinho et al. 2010). Sebanyak 0.5 g asam pikrat ditimbang dan dicampurkan dengan 2 g Na2SO4. Kemudian dilarutkan dalam 100 mL akuades. Setelah itu, media dihomogenkan dan diautoklaf pada suhu 121oC. Sterilisasi Sampel (Manurung et al. 2014)
Sampel yang digunakan adalah tanaman cabai merah koleksi Dr Ifa Manzila, BB Biogen dan koleksi HPT IPB. Jaringan akar, batang, dan daun dari masing-masing tanaman cabai merah dipotong ± 1 cm. Potongan tersebut dicuci dengan akuades steril sebanyak 5 kali. Selanjutnya, potongan akar, batang, dan daun disterilisasi dengan perlakuan yang berbeda. Jaringan daun dan akar disterilisasi dengan larutan sodium hipoklorit 20% selama 20 menit, lalu disterilkan dengan alkohol 70%, dan kembali dicuci dengan akuades steril sebanyak 5 kali. Jaringan batang disterilisasi dengan larutan sodium hipoklorit 20% selama 5 menit, lalu disterilkan dengan alkohol 70%, dan kembali dicuci dengan akuades steril sebanyak 5 kali.
Isolasi Bakteri Endofit Tanaman Cabai Merah (Munif et al. 2012)
Sebanyak 2.64 g akar, 5.00 g batang, dan 3.10 g daun cabai merah dihancurkan sampai halus dalam mortar steril dengan penambahan akuades steril di kabinet laminar air flow. Sebanyak 1 mL masing-masing suspensi akar, batang, dan daun cabai merah dicampur dengan 9 mL air steril dalam tabung reaksi dan dihomogenkan dengan vortex. Suspensi akar, batang, dan daun selanjutnya diencerkan secara seri dengan konsentrasi 101, 102, 103, 104,dan 105. Selanjutnya, sebanyak 0.1 mL dari masing-masing pengenceran disebar pada medium agar-agar King’s B dan diinkubasi selama ± 2 hari pada suhu ruang. Setelah itu, jumlah koloni bakteri yang terbentuk dihitung dari pengenceran yang paling encer yaitu 105, 104, dan 103.
Peremajaan Isolat Bakteri Endofit (Desriani et al. 2013)
5 suhu ruang. Pengerjaan dilakukan secara aseptik dalam ruang kabinet laminar air flow.
Peremajaan Isolat Patogen Colletotrichum capsici (Siregar 2009)
Isolat C. capsici yang digunakan dalam penelitian didapatkan dari koleksi IPBCC. Isolat C. capsici ditumbuhkan pada media PDA sebanyak 4 cawan petri dan diinkubasi pada suhu ruang selama 5 hari. Isolat C. capsici yang telah diremajakan siap digunakan untuk pengujian selanjutnya.
Pengujian Hipersensitivitas (Wulandari et al. 2012)
Pengujian hipersensitivitas dilakukan terhadap semua bakteri yang telah diisolasi dari jaringan akar, batang, dan daun tanaman cabai merah. Uji hipersensitivitas dilakukan dengan menyuntikkan suspensi bakteri endofit sebanyak 1 mL dengan microsyringe ke daun tembakau hingga membasahi ruang antar sel. Pengamatan dilakukan setelah 48 jam dengan melihat gejala nekrotik pada daun tembakau. Hasil positif ditunjukkan dengan berubahnya warna hijau daun menjadi kuning kering.
Pengujian Hemolisis (Akhdiya 2014)
Uji ini dilakukan dengan cara menginokulasikan isolat bakteri endofit ke permukaan media agar darah. Setelah diinkubasi selama 1-5 hari pada suhu ruang, dilakukan pengamatan ada atau tidaknya aktivitas hemolisis di sekitar koloni bakteri. Isolat-isolat yang tidak menunjukkan aktivitas hemolisis dipilih sebagai bahan percobaan berikutnya.
Pengujian Antagonisme Bakteri Endofit terhadap Patogen C. capsici (Harni et al. 2014)
Uji antagonis dilakukan dengan pengujian dual culture antara patogen dengan bakteri endofit dalam cawan petri yang berisi medium PDA, kemudian dibuat garis tengah. Isolat patogen C. capsici diletakkan di tengah cawan petri dan isolat bakteri endofit diletakkan 1 cm dari tepi cawan petri yang berdiameter 9 cm (Gambar 1). Biakan tersebut diinkubasikan pada suhu 25oC. Pertumbuhan jamur diamati setiap hari selama 7 hari. Kemampuan antagonis bakteri endofit ditentukan dengan menghitung pertumbuhan miselium patogen C. capsici dengan rumus:
Keterangan:
I: persentasi zona penghambat pertumbuhan (%)
6
Gambar 1 Skema pengujian antagonis antara bakteri endofit (garis lurus) dengan patogen C. capsici (bulat abu-abu) dalam cawan petri Karakterisasi Bakteri Endofit Potensial terhadap Patogen C. capsici
Pendugaan Jenis Gram Bakteri (Chandra & Mani 2011). Larutan KOH diteteskan secukupnya pada kaca preparat. Satu ose koloni bakteri dicampurkan ke dalam larutan KOH tersebut dan dilihat pembentukan lendir dengan cara ditarik berlawanan arah. Adanya lendir menunjukkan jenis Gram bakteri tersebut adalah negatif, tetapi jika tidak terbentuk lendir maka diduga jenis Gram bakteri tersebut positif.
Analisis Kuantitatif Kadar AIA (Patten & Glick 2002)
Pembiakan Bakteri pada Media NB Cair. Sebanyak 2 g triptofan dituangkan ke dalam Erlenmeyer yang berisi 100 mL akuades yang telah disterilisasi. Larutan tersebut dipindahkan ke dalam labu Erlenmeyer kosong yang steril dengan menggunakan micropore dan syringe. Sebanyak 1 mL larutan triptofan dipindahkan ke dalam tabung ulir menggunakan pipet mikro dan disimpan di dalam inkubator bergoyang selama ± 24 jam.
Pengukuran Standar AIA. Masing-masing larutan standar dibuat dengan konsentrasi 1, 5, 10, 20, 40, 80, 100 mg/ mL. Kemudian ditambahkan 4 mL pereaksi Salkowski ke dalam larutan standar tersebut dan dihomogenkan dengan vortex. Larutan diinkubasi selama 1 jam dan diukur serapannya menggunakan spektrofotometer pada λ= 530 nm.
Pengukuran Sampel. Biakan pada media NB cair yang telah disimpan di dalam inkubator bergoyang, masing-masing dimasukkan ke dalam tiga tabung mikro steril, lalu disentrifugasi dengan kecepatan 10000 rpm pada suhu 4°C selama 10 menit. Supernatan diambil sebanyak 2 mL dan dimasukkan ke dalam tabung reaksi menggunakan pipet mikro dan ditambahkan 4 mL pereaksi Salkowski. Campuran dihomogenkan dengan vortex dan diinkubasi selama 1 jam. Larutan diukur absorbansinya menggunakan spektrofotometer dengan λ= 530 nm. Konsentasi IAA dari isolat dapat dihitung dari persamaan regresi kurva standar. Analisis Kualitatif Produksi HCN (Godinho et al. 2010)
7 Identifikasi Isolat Bakteri Endofit Potensial berdasarkan Marka 16S rRNA
Isolasi DNA (Kochar et al. 2009). Isolasi DNA dilakukan dengan kit (Wizard DNA Genome Purification Kit-Promega). Isolat bakteri endofit potensial diambil dengan ose steril, lalu disuspensikan dalam 10 mL media NB dan disimpan di dalam inkubator bergoyang selama ± 24 jam. Setelah itu, kultur dipindahkan ke tabung Eppendorf sebanyak 1.5 mL. Kultur bakteri kemudian disentrifugasi pada kecepatan 10000 rpm selama 10 menit dengan suhu 4°C. Supernatan yang terbentuk dibuang dan peletnya disimpan untuk proses berikutnya. Pelet yang merupakan bakteri Gram positif ditambahkan EDTA 50 mM sebanyak 480 μL dan lisozim 10 mg/ mL sebanyak 100 μL kemudian diinkubasi pada suhu 37oC selama 60 menit. Setelah diinkubasi, campuran tersebut disentrifugasi dengan kecepatan 10000 g selama 6 menit, kemudian dibuang supernatannya. Pelet dari hasil sentrifugasi disimpan untuk tahap lisis sel. Bakteri dengan Gram negatif langsung masuk ke tahap lisis sel. Bakteri Gram positif maupun bakteri Gram negatif ditambahkan nucleid lysis solution sebanyak 600 μL kemudian dikocok perlahan menggunakan pipet mikro. Campuran tersebut lalu diinkubasi di atas waterbath suhu 80oC selama 5 menit dan didiamkan pada suhu kamar. Setelah dingin ditambahkan RNAse solution mix sebanyak 2 μL dan diinkubasi pada suhu 37oC selama 45 menit untuk dilanjutkan ke tahap presipitasi protein.
Sebanyak 200 μL protein precipitation solution ditambahkan pada campuran tersebut, diinkubasi di penangas es selama 5 menit kemudian disentrifugasi dengan kecepatan 10000 g selama 6 menit. Supernatan yang terbentuk dipindahkan dalam tabung Eppendorf baru yang berisi 600 μL isopropanol absolut lalu disentrifugasi kembali dengan kecepatan 10000 g selama 6 menit dan diambil supernatannya. Supernatan tersebut ditambahkan etanol 70% sebanyak 600 μL dan disentrifugasi pada kecepatan 10000 g selama 6 menit. Setelah disentrifugasi, supernatan dibuang dan peletnya dikeringkan selama 30 menit kemudian disuspensi kembali dengan 20 μL rehydration solution dan disimpan dalam freezer.
Analisis Kuantitatif DNA dengan Nanodrop (Thermo Fisher Scientific 2009). Sebanyak 2 μL larutan TE dipipet ke dalam lubang ukur kemudian nanodrop ditutup dan ditekan tombol read blank pada komputer. Buffer TE yang tersisa dibersihkan dengan kertas tisu. Sampel DNA dipipet sebanyak 2 μL ke dalam lubang ukur, kemudian menu read sample diklik. Hasil pengukuran berupa nilai konsentrasi DNA akan muncul dalam satuan ng/μL. Kemurnian DNA dapat dilihat berdasarkan nilai nisbah nilai absorbansi DNA pada λ= 260 nm dengan nilai absorbansi DNA pada λ= 280 nm.
8
akuades selama 5 menit. Setelah direndam, gel agarosa diangkat dan disimpan di dalam UV-translluminator untuk dilihat hasilnya.
Amplifikasi Gen 16S rRNA (Jha et al. 2012). Gen penyandi 16S rRNA diamplifikasi dengan metode PCR menggunakan primer 63F (forward) dan primer 1387R (reverse). Primer 63F terdiri atas susunan basa 5’- CAGGCCTAACACATGCAAGTC, sedangkan primer 1387R tersusun atas basa 5’- GGGCGGCGTGTACAAGGC. Komposisi reaksi PCR yang digunakan antara lain Go Taq DNA polimerase 12.5 µL, primer reverse 1 µL, primer forward 1µL, ddH2O 8.5 µL dan DNA hasil isolasi 2 µL.Campuran pereaksi dan sampel DNA dimasukkan ke dalam mesin PCR yang telah diprogram dengan 16s rRNA. Mesin PCR dijalankan selama 1 jam 58 menit terdiri atas tahap denaturasi I pada suhu 94oC selama 5 menit, denaturasi II pada suhu 94oC selama 1 menit 30 detik, annealing pada suhu 55oC selama 45 detik, dan extention pada suhu 72oC selama 1 menit. Keempat tahap ini dilakukan sebanyak 29 siklus yang dilanjutkan dengan tahap extention akhir yang dilakukan pada suhu 72oC selama 1 menit. Tahapan terakhir dilakukan pada suhu 15oC.
Elektroforesis Hasil Amplifikasi PCR (Sambrook & Russel 2001). Pembuatan gel dilakukan dengan cara melarutkan 1.2 % agarosa dalam larutan 1 x buffer TAE lalu dipanaskan hingga mendidih agar agarosa terlarut. Setelah dipanaskan, agarosa didinginkan beberapa saat lalu ditambahkan EtBr, selanjutnya dimasukkan dalam cetakan gel dan dibiarkan hingga memadat. Gel yang sudah terbentuk lalu direndam dengan larutan 1 x TAE buffer dalam alat elektroforesis. Sebanyak 2 μL loading dye ukuran 1 kb dimasukkan ke dalam sumur
gel urutan pertama sebagai marker. Sampel DNA diambil sebanyak 3 μL dan
dimasukkan ke dalam sumur gel. Sampel dielektroforesis bersamaan dengan 2 μL marker 1 kb yang telah dicampur dengan loading dye. Elektroforesis dijalankan dengan tegangan 110 V selama ± 30 menit. Gel agarosa yang telah dijalankan kemudian diangkat dan direndam di dalam EtBr selama 10 menit. Gel agarosa dipindahkan dan direndam kembali di dalam larutan akuades selama 5 menit. Visualisasi DNA dilakukan dengan menggunakan UV Illuminator ChemiDoc Biorad dan kemudian diambil gambarnya.
Sekuensing Gen 16S rRNA (Modifikasi Jha et al. 2012). Sekuensing dilakukan melalui jasa perusahaan sekuensing 1st Base Malaysia untuk mengetahui jenis spesies bakteri yang didapatkan dari hasil isolasi.
HASIL DAN PEMBAHASAN
Hasil
Isolasi Bakteri Endofit
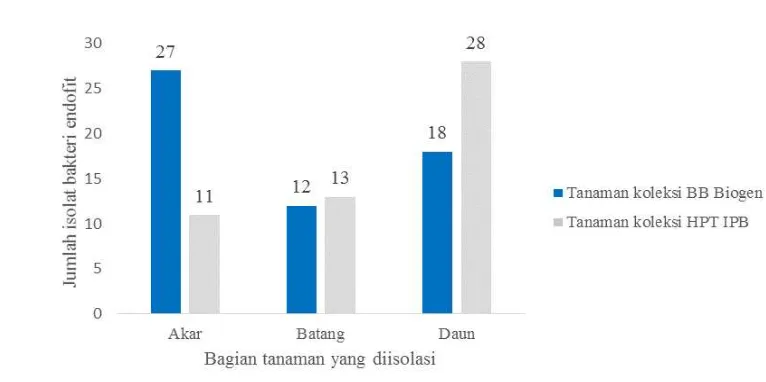
9 Total kedua isolat berjumlah 109 isolat (Gambar 2). Sebanyak 57 isolat berasal dari koleksi BB Biogen terdiri atas 27 isolat dari akar, 12 isolat dari batang, dan 18 isolat dari daun. Sebanyak 52 isolat berasal dari koleksi HPT IPB terdiri atas 11 isolat dari akar, 13 isolat dari batang, dan 28 isolat dari daun. Sebanyak 109 isolat ini memperlihatkan keragaman dari segi morfologi koloni. Bentuk koloni isolat didominasi oleh bentuk bulat dan berwarna putih, selebihnya berwarna kuning dan tidak beraturan (Lampiran 2). Tepi koloni bervariasi dengan tipe cembung dan datar. Selain itu, densitas bakteri endofit tertinggi ditunjukkan oleh isolat asal BB Biogen berasal dari sampel akar, sedangkan dari HPT IPB berasal dari sampel daun.
Gambar 2 Jumlah isolat bakteri endofit cabai merah yang diisolasi dari akar, batang, dan daun
Jenis Gram Isolat Bakteri Endofit
Hasil pendugaan jenis Gram bakteri endofit disajikan dalam Lampiran 3. Berdasarkan Lampiran 3 dapat dilihat bahwa hasil pendugaan jenis Gram bakteri menunjukkan hampir keseluruhan bakteri berjenis Gram positif. Terdapat 11 isolat dari 57 isolat koleksi BB Biogen memiliki jenis Gram negatif, sedangkan dari koleksi HPT IPB terdapat 5 isolat dari 52 isolat berjenis Gram negatif.
Seleksi I Isolat Bakteri Endofit
Seleksi awal bakteri endofit dilakukan dengan uji HR dan uji hemolisis. Hasil pengamatan uji HR menunjukkan sebanyak 61 isolat terdiri atas 59 isolat sampel cabai merah dan 2 kontrol positif menunjukkan gejala nekrosis (Lampiran 3). Terdapat 7 isolat yaitu isolat A6, A17, A19, A26, A2.1, A2.2, dan A6.1 sangat patogen yang ditandai seluruh jaringan daun tembakau yang telah diinokulasi berubah menjadi coklat kering. Setelah uji HR, isolat bakteri endofit diuji dengan metode uji hemolisis. Uji hemolisis isolat bakteri endofit disajikan dalam Lampiran 3. Sebanyak 109 isolat dari sampel cabai merah menunjukkan 44 isolat bersifat β-hemolisis, 48 isolat bersifat α-hemolisis, dan 17 γ-hemolisis.
Seleksi II Isolat Bakteri Endofit
10
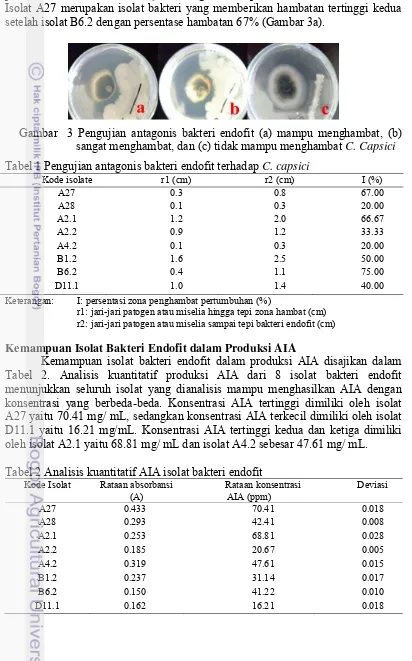
C. capsici dengan baik (Tabel 1), sedangkan 13 isolat, salah satunya D13 (Gambar 3c) tidak mampu menghambat pertumbuhan patogen C. capsici. Bakteri endofit yang memiliki nilai antagonis tertinggi yaitu isolat B6.2 mampu menghambat pertumbuhan miselium C. capsici dengan nilai persentase 75% (Gambar 3b). Isolat A27 merupakan isolat bakteri yang memberikan hambatan tertinggi kedua setelah isolat B6.2 dengan persentase hambatan 67% (Gambar 3a).
Gambar 3 Pengujian antagonis bakteri endofit (a) mampu menghambat, (b) sangat menghambat, dan (c) tidak mampu menghambat C. Capsici Tabel 1 Pengujian antagonis bakteri endofit terhadap C. capsici
Kode isolate r1 (cm) r2 (cm) I (%)
A27 0.3 0.8 67.00
A28 0.1 0.3 20.00
A2.1 1.2 2.0 66.67
A2.2 0.9 1.2 33.33
A4.2 0.1 0.3 20.00
B1.2 1.6 2.5 50.00
B6.2 0.4 1.1 75.00
D11.1 1.0 1.4 40.00
Keterangan: I: persentasi zona penghambat pertumbuhan (%)
r1: jari-jari patogen atau miselia hingga tepi zona hambat (cm) r2: jari-jari patogen atau miselia sampai tepi bakteri endofit (cm)
Kemampuan Isolat Bakteri Endofit dalam Produksi AIA
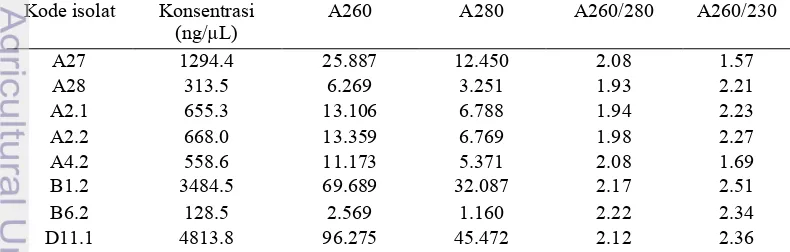
Kemampuan isolat bakteri endofit dalam produksi AIA disajikan dalam Tabel 2. Analisis kuantitatif produksi AIA dari 8 isolat bakteri endofit menunjukkan seluruh isolat yang dianalisis mampu menghasilkan AIA dengan konsentrasi yang berbeda-beda. Konsentrasi AIA tertinggi dimiliki oleh isolat A27 yaitu 70.41 mg/ mL, sedangkan konsentrasi AIA terkecil dimiliki oleh isolat D11.1 yaitu 16.21 mg/mL. Konsentrasi AIA tertinggi kedua dan ketiga dimiliki oleh isolat A2.1 yaitu 68.81 mg/ mL dan isolat A4.2 sebesar 47.61 mg/ mL. Tabel 2 Analisis kuantitatif AIA isolat bakteri endofit
Kode Isolat Rataan absorbansi
(A) Rataan konsentrasi AIA (ppm) Deviasi
A27 0.433 70.41 0.018
A28 0.293 42.41 0.008
A2.1 0.253 68.81 0.028
A2.2 0.185 20.67 0.005
A4.2 0.319 47.61 0.015
B1.2 0.237 31.14 0.017
B6.2 0.150 41.22 0.010
11 Kemampuan Isolat Bakteri Endofit dalam Produksi HCN
Isolat bakteri endofit dianalisis secara kualitatif dengan pengujian produksi HCN. Berdasarkan Tabel 3 dapat dilihat bahwa semua isolat tidak memproduksi HCN. Hasil negatif ini ditandai dengan tidak terbentuknya perubahan warna kuning menjadi merah.
Tabel 3 Analisis kualitatif HCN isolat bakteri endofit
Kode Isolat Perubahan warna Produksi HCN
A27 Kuning -
Identifikasi Isolat Bakteri Endofit Potensial berdasarkan Marka 16S rRNA Sebanyak 8 isolat bakteri endofit dielektroforesis DNAnya (Gambar 4). Semua isolat dalam Gambar 4 menunjukka adanya pita-pita DNA yang mengindikasikan keberhasilan isolasi DNA. Pita yang terbentuk dari masing-masing isolat hampir mempunyai ketebalan yang sama, kecuali isolat A2.2. Isolat A2.2 memiliki pita yang tipis karena DNA yang terisolasi dari isolat tersebut hanya sedikit. Tabel 4 menunjukkan 8 isolat bakteri endofit memiliki tingkat kemurnian yang tinggi yaitu antara 1.93-2.22. Hal ini menunjukkan DNA yang diisolasi berhasil karena kualitas DNA utuh, murni, dan hanya mengandung kontaminasi protein maupun RNA yang sedikit.
Delapan isolat bakteri endofit yang telah diketahui hasil pita-pita DNAnya, diamplifikasi dengan PCR menggunakan primer 16S rRNA. Elektroforegram hasil PCR disajikan dalam Gambar 5. Berdasarkan Gambar 5, terlihat bahwa isolat A27, A28, A2.1, A2.2, A4.2, B1.2, B6.1, dan D11.1 menghasilkan pita tunggal DNA yang berukuran ~1400 bp. Ukuran ini terdapat pada rentang ukuran marker yang digunakan yaitu 1 kb. Hal ini menunjukkan bahwa secara kualitatif, isolat bakteri endofit cabai merah dapat diidentifikasi menggunakan analisis molekuler gen 16S rRNA.
12
Gambar 4 Elektroforegram hasil isolasi DNA (M) marker 1 kb (1) isolat A27 (2) isolat A28 (3) isolat A2.1 (4) isolat A2.2 (5) isolat A4.2 (6) isolat B1.2 (7) isolat B6.2 (8) isolat D11.1
Gambar 5 Elektroforegram hasil isolasi DNA (M) marker 1 kb (1) isolat A27 (2) isolat A28 (3) isolat A2.1 (4) isolat A2.2 (5) isolat A4.2 (6) isolat B1.2 (7) isolat B6.2 (8) isolat D11.1
Identifikasi isolat bakteri endofit pada Tabel 5 dipilih berdasarkan seleksi I, seleksi II, uji antagonis tertinggi dan AIA tertinggi. Terlihat bahwa isolat A4.2 memiliki persentase keidentikan 99.5% dengan spesies Pseudomonas stutzeri (T); ATCC 17588; AF094748, sedangkan isolat B6.2 dan D11.1 memiliki persentase keidentikan 100% berturut-turut dengan spesies Bacillus vallismortis (T); DSM11031; AB021198 dan spesies Bacillus cereus (T); ATCC 14579; AE016877. Berdasarkan nilai presentase keidentikan ini, maka diketahui bahwa isolat A4.2 termasuk dalam bakteri genus Pseudomonas, sedangkan isolat B6.2 dan D11.1 termasuk dalam bakteri genus Bacillus.
Tabel 5 Identifikasi isolat A4.2, B6.2, dan D11.1
Kode isolat Hasil sekuensing % Homologi
A4.2 Pseudomonas stutzeri (T); ATCC 17588;
AF094748 99.5
B6.2 Bacillus vallismortis (T); DSM11031; AB021198 100
13 Pembahasan
Isolasi Bakteri Endofit
Tahap awal sebelum melakukan isolasi bakteri endofit adalah sterilisasi permukaan. Penggunaan prosedur sterilisasi permukaan yang tepat dan efektif berfungsi untuk menjamin isolat yang dihasilkan adalah murni bakteri endofit dan hasil penelitian tidak tercampur oleh bakteri rhizosfer dan filoplan. Pembersihan akar, batang, dan daun cabai merah dilakukan untuk menghilangkan kotoran dan bakteri kontaminan dari permukaan jaringan tanaman sehingga pada tahap isolasi bakteri endofit akan diperoleh isolat murni bakteri endofit. Sodium hipoklorit berfungsi untuk menghilangkan kotoran, bakteri, dan cendawan yang ada pada jaringan tanaman sehingga ketika dikulturkan dalam medium tidak tumbuh bakteri dan cendawan kontaminan di sekitarnya (Hart 2005).
Isolasi merupakan tahap awal dari suatu eksplorasi bakteri untuk uji kualitatif untuk memperoleh isolat biakan bakteri murni serta uji kuantitatif, seperti pengukuran kadar IAA dan isolasi DNA. Hasil isolasi bakteri endofit menunjukkan tingginya bakteri endofit berasal dari sampel akar. Tingginya densitas bakteri endofit akar ini disebabkan karena daerah akar di dalam tanah menyebabkan bakteri di dalamnya relatif lebih terlindung dari fluktuasi suhu udara dan lebih terjamin ketersediaan airnya (Munif et al. 2012). Menurut Hallman & Berg (2006), densitas bakteri endofit pada akar kapas, jagung manis, serta bit dilaporkan mencapai 106 CFU/g, sedangkan pada batang dan daun densitas bakteri endofit berturut-turut mencapai 104 dan 103 CFU/g. Perbedaan hasil isolat dari kedua sampel dikarenakan sampel tanaman cabai merah koleksi BB Biogen sudah layu, sedangkan tanaman cabai merah koleksi HPT IPB masih muda, sehat, dan segar. Tanaman yang masih muda dan sehat, jaringan vaskularnya terbentuk sempurna sehingga banyak bakteri endofit. Jaringan tanaman yang sehat dapat menghasilkan nutrien yang cukup untuk tumbuhnya bakteri endofit. Sebaliknya, tanaman yang kurang sehat, jaringan tanaman di dalam batang dan daun sudah ada yang rusak dan tidak dapat menghasilkan nutrien secara maksimal untuk tumbuhnya bakteri endofit. Nutrien digunakan sebagai biosintesis dan sumber energi untuk mendukung pertumbuhan bakteri. Jaringan tanaman yang dikultur memerlukan unsur hara dari dalam media tumbuh yang berguna untuk merangsang pertumbuhan serta perkembangan sel jaringan (Pudaritadesantamaria 2004).
Jenis Gram Isolat Bakteri Endofit
14
terjadi osmosis. Pecahnya sel melepaskan materi genetik (DNA) yang melimpah di dalam sel bakteri. Molekul DNA yang sangat panjang bersifat sticky strings (menyerupai lendir, getah atau lengket) yang memberikan hasil seperti lendir saat diangkat dengan jarum inokulum (Simatupang 2008). Menurut Sunatmo (2009), jenis bakteri Gram positif memiliki dinding sel yang tersusun atas 90% peptidoglikan dan molekul lain dalam jumlah yang kecil seperti asam tekoat, sedangkan jenis bakteri Gram negatif hanya 10% dinding selnya tersusun atas peptidoglikan dan sebagaian besar berupa membran luar yang membentuk lipopolisakarida (LPS).
Seleksi I Isolat Bakteri Endofit
Penapisan isolat bakteri endofit dalam penelitian ini diawali dengan uji hipersensitivitas (HR). Wulandari et al. (2012) menyebutkan bahwa respon hipersensitif diartikan sebagai reaksi pertahanan yang cepat dari tanaman menghadapi patogen disertai kematian sel yang cepat pada jaringan yang telah disuntikkan suspensi bakteri, tetapi keberadaannya tidak mempengaruhi pertumbuhan tanaman inang. Uji HR merupakan metode yang paling baik dan paling cepat karena bakteri patogen dapat menginduksi reaksi hipersensitif pada daun tembakau yang disuntikkan bakteri sehingga dapat menimbulkan gejala nekrosis pada jaringan yang diserang. Gejalanya muncul pada 24 sampai 48 jam setelah inokulasi. Daun hijau berubah menjadi coklat nekrosis diikuti dengan mengeringnya jaringan tersebut. Uji HR dapat dijadikan sebagai bagian praseleksi, tetapi tidak berarti isolat yang lolos seleksi HR adalah nonfitipatogenik terhadap semua jenis tanaman sehingga perlu dilakukan uji hemolisis dan uji antagonis untuk menentukan isolat murni bakteri endofit.
Salah satu analisis sifat virulensi dari suatu bakteri dapat diketahui dari fenotipenya berupa kemampuan bakteri melisiskan eritrosit. Bakteri yang mampu melisiskan eritrosit bersifat lebih virulen dibandingkan bakteri yang tidak mampu melisiskan eritrosit. Kemampuan bakteri untuk melisiskan eritrosit ditentukan oleh substansi berupa protein ekstraseluler yang disebut hemolisin. Bakteri yang memproduksi hemolisin memperlihatkan perubahan warna zona pertumbuhan bakteri pada media agar darah. Bakteri yang memiliki kemampuan untuk merusak eritrosit secara sempurna memperlihatkan zona bening di sekitar pertumbuhan koloni pada media agar darah dan dikelompokkan sebagai bakteri yang bersifat β -hemolisis. Namun, jika di sekitar koloni bakteri hanya memperlihatkan perubahan warna sehingga media agar berwarna kehijauan sampai kecoklatan dan zona yang terlihat tidak jernih dikelompokkan sebagai bakteri yang bersifat α-hemolisis serta bakteri yang tidak memiliki kemampuan untuk merusak eritosit dikelompokkan sebagai nonhemolisis atau γ-hemolisis (Suardana et al. 2014). Uji hemolisis disajikan dalam Lampiran 3. Berdasarkan Lampiran 3 diketahui bahwa sebagian besar isolat bakteri endofit cabai merah berpotensi patogen terhadap mamalia sehingga harus dihindari penyebarannya di lapangan. Hanya isolat bakteri yang bersifat nonhemolisis yang dapat digunakan pada tahap selanjutnya.
Seleksi II Isolat Bakteri Endofit
15 bahwa hanya 8 isolat bakteri endofit yang mampu menghasilkan daya hambat terhadap patogen C. capsici karena pertumbuhan bakteri endofit lebih aktif daripada patogen. Selain terbentuknya zona hambat, kompetisi merupakan faktor yang sangat penting dalam pengendalian jamur patogen oleh bakteri endofit, kompetisi zona hambat terjadi ketika kedua organisme berada pada tempat yang sama dan menggunakan nutrisi yang sama (Wulandari et al. 2012).
Kemampuan menginduksi ketahanan tanaman merupakan salah satu keuntungan adanya bakteri endofit untuk melawan pertumbuhan organisme lain. Harni & Ibrahim (2011) menyebutkan mekanisme bakteri endofit dalam menginduksi ketahanan tanaman dilakukan dengan mengkolonisasi jaringan dalam tanaman sehingga menstimulasi tanaman untuk meningkatkan produksi senyawa metabolit yang berperan dalam ketahanan tanaman, seperti enzim peroksidase, peningkatan aktifitas kitinase, dan fitoaleksin. Enzim peroksidase dibutuhkan oleh tanaman untuk menghasilkan senyawa-senyawa pertahanan tanaman, seperti lignin, kitin, dan beberapa senyawa penyusun dinding sel. Fitoaleksin mampu menghambat pertumbuhan dan perkembangan patogen, seperti Phytopthora citrophthora pada jeruk.
Kemampuan Isolat Bakteri Endofit dalam Produksi AIA
Analisis AIA dilakukan dengan metode yang dilakukan oleh Patten & Glick (2002) mempunyai beberapa keunggulan, yaitu cepat, mudah, dan dapat dikerjakan untuk menganalisis sampel dalam jumlah banyak. Isolat bakteri yang diuji menunjukkan adanya perbedaan konsentrasi AIA yang dihasilkan. Adanya perbedaan konsentrasi AIA ini dikarenakan bakteri yang diuji berbeda jenis dan jumlah koloninya. Bakteri yang berbeda memiliki kemampuan kecepatan yang berbeda pula dalam mensintesis triptofan menjadi AIA. AIA merupakan hormon auksin endogen yang dihasilkan oleh bakteri endofit yang memiliki struktur molekul C10H9O2N (Gambar 6) yang berperan dalam merangsang pertumbuhan tanaman. AIA banyak ditemukan di jaringan meristem atau jaringan yang aktif membelah yaitu ujung akar, pucuk daun, bagian-bagian bunga yang aktif berkembang, dan benjolan pada tanaman pada fase pertumbuhan aktif. Selain itu, AIA juga berperan dalam pemanjangan pucuk batang, ujung akar, pematangan biji, dan peningkatan bobot basah (Khairani 2009).
Gambar 6 Struktur kimia hormon AIA (Rao 1994)
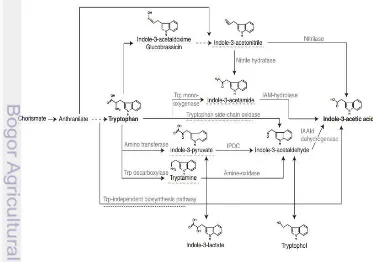
16
Tahap pertama pada jalur IAM adalah perubahan senyawa perkursor (triptofan) menjadi indole-3-acetamide oleh TMO (tryptophan monooxygenase) yang disandikan oleh gen IaaM dan tahap selanjutnya yaitu perubahan indole-3-acetamide menjadi asam indol-3-asetat (AIA) oleh indole-3-acetamide hydrolase yang disandikan oleh gen IaaH. Adapun enzim kunci pada biosintesis AIA melalui jalur IAM adalah enzim TMO (Spaepen et al. 2007). Gen IaaM maupun IaaH telah banyak dikarakterisasi dari bakteri yang simbion pengikat nitrogen, seperti spesies Rhizobium dan Brandyrhizobium maupun bakteri patogen tanaman, seperti Agrobacterium tumefaciens, P. savastanoi, dan P. agglomerans (Spaepen & Vanderleyden 2011). Selain itu, ketika kondisi tertentu, triptofan diubah oleh bakteri endofit menjadi indol menggunakan enzim triptofanase. Enzim triptofanase mendegradasi molekul asam amino triptofan menjadi asam piruvat, ammonia, dan indol. Gugus indol pada AIA dideteksi dengan pereaksi Salkowski sehingga menghasilkan warna. Reagen ini dapat bereaksi dengan asam indol piruvat yang terakumulasi dalam filtrat yang diuji hingga menyebabkan terbentuknya warna merah muda (Yurekli et al 2003).
Pengukuran AIA dilakukan dengan spektrofotometer UV-Vis pada panjang gelombang 530 nm. Panjang gelombang tersebut memberi serapan maksimum pada warna yang dibentuk oleh pereaksi Salkowski. Warna yang terbentuk dari reaksi antara pereaksi Salkowski dengan sampel memiliki intensitas yang berbeda. Warna yang pekat seperti merah muda gelap menunjukkan konsentrasi bakteri endofit yang cukup tinggi dibandingkan dengan larutan yang memiliki warna merah muda terang. Hasil pengukuran AIA ini dibandingkan dengan standar AIA. Absorbansi AIA yang melebihi absorbansi standar perlu dilakukan pengenceran 1: 2. Analisis kuantitatif produksi AIA yang disajikan dalam Tabel 2 menunjukkan bahwa isolat bakteri endofit A2.1 berwarna merah muda gelap dengan nilai absorbansi yang melebihi nilai absorbansi standar AIA sehingga dilakukan pengenceran 1: 2.
17 Kemampuan Isolat Bakteri Endofit dalam Produksi HCN
Menurut Agustiansyah et al. (2013), senyawa HCN merupakan salah satu metabolit sekunder yang dihasilkan oleh bakteri Pseudomonas spp. dan bersifat antimikrob. Perubahan warna kertas saring terjadi akibat adanya reaksi antara asam piktat (Na2CO3) dan sianida yang dihasilkan oleh bakteri menjadi bentuk natrium sianida (NaCN). NaCN terbentuk melalui penyerapan gas sianida oleh NaOH atau Na2CO3 melalui reaksi antara natrium dan amonia yang awalnya terbentuk NaNH2 yang akan bereaksi dengan karbon dan akan menghasilkan natrium sianamida (Na2NCN) dan akhirnya terbentuk NaCN, salah satu jenis dari sianida. Keuntungan metode ini adalah mampu mendeteksi produksi sianida sampai tingkat yang paling rendah. Produksi sianida juga dipengaruhi oleh glisin. Penambahan glisin pada medium mampu meningkatkan produksi sianida. Selain itu, oksigen juga berpengaruh terhadap pembentukan sianida. Bakteri Pseudomonas aeruginosa menghasilkan sianida pada keadaan kadar oksigen rendah, sedangkan isolat Bacillus cenocipacea tidak mampu menghasilkan sianida dengan kadar oksigen yang rendah (Ryall et al. 2008). Analisis kualitatif produksi HCN yang disajikan dalam Tabel 3 menunjukkan bahwa 8 isolat bakteri endofit tidak dapat memproduksi HCN.
Identifikasi Isolat Bakteri Endofit Potensial berdasarkan Marka 16S rRNA Isolasi DNA adalah proses pengeluaran DNA atau ekstraksi yang dilakukan dengan homogenasi dan penambahan buffer ekstraksi atau buffer lisis untuk mencegah kerusakan DNA (Yuwono 2006). Hasil isolasi DNA ditampilkan dalam bentuk pita-pita DNA pada gel agarosa. Gel yang digunakan pada percobaan adalah gel agarosa konsentrasi 1.2 %. Setiap sumur dalam gel agarosa ini diisi dengan sampel isolasi DNA sebanyak 2 μL dan loading dye sebanyak 1 μL. Loading dye berfungsi sebagai pemberat DNA sehingga sampel berada di dasar gel (Sudjadi 2008). Hasil isolasi dielektroforesis untuk mengetahui tingkat kemurnian DNAnya. Isolasi DNA 8 isolat bakteri endofit yang disajikan dalam Tabel 4 berhasil karena pita DNAnya utuh, murni dengan kemurnian antara 1.93-2.22, dan hanya sedikit mengandung kontaminasi protein maupun RNA. Menurut Syafaruddin & Santoso (2011), DNA dikatakan murni jika perbandingan A260 dan A280 berkisar antara 1.8-2.0.
18
Sekuensing DNA digunakan untuk mengetahui urutan nukleotida DNA maupun RNA. Reaksi sekuensing membutuhkan primer yang akan menempel pada rantai tunggal template DNA. Berdasarkan hasil seleksi isolat bakteri endofit, diperoleh isolat dengan kode A4.2, B6.2, dan D11.1 sebagai isolat potensial. Hasil sekuensing menunjukkan bahwa isolat bakteri endofit dengan kode A4.2 termasuk dalam genus Pseudomonas dengan jenis spesies bakteri Pseudomonas stutzeri, sedangkan bakteri endofit dengan kode B6.2 dan D11.1 termasuk dalam genus Bacillus. Bakteri endofit kode B6.2 dan D11.1 berturut-turut merupakan jenis spesies bakteri Bacillus vallismortis dan bakteri Bacillus cereus.
Bakteri Pseudomonas stutzeri merupakan anggota genus Pseudomonas. Bakteri genus Pseudomonas adalah bakteri Gram negatif yang dikenal sebagai plant-associated bacteria, bersifat aerob, memiliki sel berbentuk lurus atau sedikit berlekuk, dan bersifat motil oleh satu atau beberapa flagella. Bakteri endofit dengan genus Pseudomonas berperan sebagai agen biokontrol pada tanaman, agen fitoremediasi, dan pemacu pertumbuhan tanaman (Ryan et al. 2008). Bakteri P. stutzeri disebut juga sebagai dinitrifiers karena bakteri ini mampu merubah nitrat menjadi gas nitrogen, banyak ditemukan di tanah, dan dapat menghasilkan eksotoksin sehingga menyebabkan nekrosis jaringan (Jawetz et al. 2004).
Bakteri genus Bacillus merupakan bakteri berbentuk batang, tergolong dalam bakteri Gram positif, bersifat aerobik, dan dapat membentuk endospora secara intraseluler sebagai respon terhadap kondisi lingkungan yang kurang menguntungkan. Bacillus cereus merupakan salah satu anggota genus Bacillus yang berpotensi antibiotik, memiliki lebar sel 0.9-1.2 µm dan panjang 3-5 µm, bersifat motilitas, spora elipsoidal, sentral atau parasentral, dan tidak membentuk kapsul. B. cereus memproduksi Biocercin yang efektif menghambat Staphylococcus aureus dan Staphylococcus albus dengan menggunakan protease pepton agar sebagai medium uji. Selain itu, B. cereus juga memproduksi Mycocercin yang merupakan antibiotik peptida yang efektif terhadap beberapa jenis yeast maupun mold dengan rentang Minimal Inhibitory Concentration (MIC) antara 19.5-78 µg/ mL (Hoffmaster et al. 2008).
SIMPULAN DAN SARAN
Simpulan
19 Saran
Perlu dilakukan penyejajaran isolat bakteri endofit hasil sekuensing dengan bakteri lain dalam data base dari GeneBank menggunakan blast n dari situs National Center for Biotechnology Information (NCBI). Selain itu, inokulasi isolat bakteri endofit terhadap tanaman secara in vivo juga perlu dilakukan untuk melihat pengaruh AIA terhadap tanaman secara langsung.
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2011. Produksi Cabai Indonesia. Jakarta (ID): BPS. Agustiansyah, Ilyas S, Sudarsono, Machmud M. 2013. Karakteristik rizobakteri
yang berpotensi mengendalikan bakteri Xanthomonas oryzae Pv. Oryzae dan meningkatkan pertumbuhan tanaman padi. JHPT. 13(1): 42-51.
Akhdiya A. 2014. Karakterisasi bakteri endofit penghasil Volatile Organic Compounds (VOC) untuk meningkatkan ketahanan tanaman kentang terhadap penyakit layu bakteri [disertasi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Chandra TJ & Mani PS. 2011. A study of 2 rapid tests to differentiate Gram positive and Gram negative aerobic bacteria. JMAS. 1(2): 84-85.
Desriani, Kusumawati DE, Rivai A, Hasanah N, Amrinola W, Triratna L, Sukma A. 2013. Potential endophytic bacteria for increasing paddy var rojolele productivity. Int J on Adv Sci, Eng and Information Tech. 3(1): 76-78. Gerhardt P, Murray RGE, Wood WA, Noel NR. 1994. Methods for General and
Molecular Bacteriology. Washington DC (US): American Society for Microbiology.
Godinho A, Ramesh R, Bhosle S. 2010. Studi mengenai Bakteri Sand Dune sebagai pemacu pertumbuhan pada tanaman terong. JAS. 6(5): 555-564. Harni R, Supramana, Sinaga MS, Giyanto, Supriadi. 2012. Mekanisme bakteri
endofit mengendalikan nematoda Pratylenchus branchyurus pada tanaman nilam. Bul Littro. 23(1): 102-114.
Gupta M, Shashi K, Arvind G, Bikram S, Rupinder T. 2012. Isolation and identification of phosphate solubilizing bacteria eble to enhance the growth and aloin-A biosynthesis of Aloe barbadensis Miller. Microbiology Research. 167(1): 358-363.
Hallmann.J, Berg G. 2006. Spectrum and Population Dynamics of Bacterial Root Endophytes. Microbial Roots Endophytes. Germany (DE): Springer-Verlag Berlin Heidelberg.
Harni R, Ibrahim MSD. 2011. Potensi bakteri endofit menginduksi ketahanan tanaman lada terhadap infeksi Meloidogyne incognita. Littri. 17(1): 118-123.
Hart H. 2005. Kimia Organik Suatu Kuliah Singkat. Jakarta (ID): Erlangga. Hidayat IM, Sulastrini I, Kusandriani Y, Permadi AH. 2004. Lesio sebagai
20
Colletotrichum capsici dan Colletotrichum gloeosporioides. J Hort. 14(3): 161-162.
Hoffmaster AR, Novak RT, Marston CK, Gee JE, Pruckler JM, Wilkins PP. 2008. Genetic diversity of clinical isolates of Bacillus cereus using multilocus sequence typing. BMC Microbiology. 8(1):191.
Jawetz, Melnick, Delberg A. 2004. Mikrobiologi Kedokteran. Ed ke-23. Jakarta (ID): Buku Kedokteran EGC.
Jha B, Gontia I, Anton H. 2012. The roots of halophyte Salicornia branchiata are a source of new halotolerant diazotropic bacteria with plant growth-promoting potential. Plant Soil. 326(1): 265-277.
Kementerian Pertanian. 2013. Produksi Nasional Komoditas Cabai. Jakarta (ID): Kementerian Pertanian Indonesia
Khairani G. 2009. Isolasi dan uji kemampuan bakteri penghasil hormon IAA (Indole Acetic Acid) dari akar tanaman jagung (Zea mays) [skripsi]. Medan (ID): Universitas Sumatera Utara.
Kochar M, Ashutosh U, Sheela S. 2011. Indole-3-acetic acid biosynthesis in the biocontrol strain Pseudomonas flourescens Psd and plant growth regulation by hormone overexpression. Microbiology Research. 162(1): 426-435. Manurung IR, Pinem MI, Lubis L. 2014. Uji antagonisme jamur endofit terhadap
Cercospora oryzae Miyake dan Culvularia lunata (Wakk) Boed. dari tanaman padi di laboratorium. J Agrotek. 2(4): 1563-1571.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evalution of usefull bacterium-spesific PCR primerthat amplify gens coding for bacterial 16S rRNA. J Appl Envp Microbiol. 64(1): 795-799.
Marwan H, Meity SS, Giyanto, Abdjad AN. 2011. Isolasi dan seleksi bakteri endofit untuk pengendalian penyakit darah pada tanaman pisang. J HPT Trop. 11(2): 113-121.
Munif A, Wiyono S, Suwarno. 2012. Isolasi bakteri endofit asal padi gogo dan potensinya sebagai agens biokontrol dan pemacu pertumbuhan. J Fitopatol Indones. 8(3): 57-64.
Patten CL, Glick BR. 2002. Role of Pseudomonas pulida indole acetic acid in development of the host plant root system. Appl Environ Microbiol. 68(1): 3795-3801.
Prajnanta F. 2001. Agribisnis Semangka Nonbiji. Jakarta (ID): Penebar Swadaya. Pudaritadesantamaria W. 2004. Potensi bakteri rizosfer dan endofit pada akar
pisang dalam pengendalian penyakit layu fusarium. Hayati. 11(2): 67-71. Purwanto UMS. 2014. Isolasi dan identifikasi senyawa antibakteri dari bakteri
endofit tanaman sirih hijau (Piper betle L.) [skripsi]. Bogor (ID): Departemen Biokimia, Institut Pertanian Bogor.
Rao NS. 1994. Mikroorganisme dan Pertumbuhan Tanaman. Ed ke-2. Jakarta (ID): UI Press.
Ryall B, Lee X, Zlosnik JEA, S Hoshino, HD Williams. 2008. Bacteria of Burkholderia cepacia complex are cyanogenic uder biofilm and colonial growth condition. Biomed Central Microbiology. 8(1):108.
21 Sambrook J, DW Russell. 2001. Molecular Cloning: A Laboratory Manual. Ed
ke-3. New York (US): Coldspring Harbor Laboratory Press.
Schegel HG. 1993. General Microbiology. Australia (AU): Cambridge University Press.
Simatupang DS. 2008. Berbagai mikroorganisme rhizosfer pada tanaman pepaya (Carica papaya L.) di Pusat Kajian Buah-buahan Tropika (PKBT) IPB Desa Ciomas, Kecamatan Pasirkuda, Kabupaten Bogor, Jawa Barat [skripsi]. Bogor (ID): Departemen Proteksi Tanaman IPB.
Siregar SF. 2009. Uji aktivitas antibakteri ekstrak etanol dan air rebusan kulit batang Ingul (Toona sinensis M. Roem) terhadap beberapa bakteri [skripsi]. Medan (ID): Fakultas Farmasi USU.
Spaepan S, Vanderleyden J, Roseline R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiol Rev. 1-24.
Spaepan S, Vanderleyden J. 2013. Auxin and plant-microbe intractions. Cold Spring Harb Perspect Biol. 10(1):1101.
Strobel G, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiology andMolecular Biology Reviews. Microbiol. 67(1): 491-502.
Suardana IW, Utama IH, Wibowo WH. 2014. Identifikasi Escherichia coli O157:H7 dari feses ayam dan uji profil hemolisisnya pada media agar darah. J Med Vet Indones. 8(1): 1-5
Sudjadi. 2008. Bioteknologi Kesehatan. Yogyakarta (ID): Kanisius. Sunatmo TI. 2009. Mikrobiologi Esensial. Jakarta (ID): Ardi Agency.
Suryadi Y, Priyatno TP, Samudra IA, Susilowati DN, Patricia, Irawati W. 2013. Karakterisasi dan identifikasi isolat bakteri endofitik penghambat jamur patogen padi. Bul Plasma Nutfah. 19(1): 25-32.
Suwanda. 2008. Pedoman Diagnosis Golongan Bakteri OPTK. Jakarta (ID): Departemen Pertanian Badan Karantina Pertanian.
Syafaruddin, Santoso TJ. 2011. Optimasi teknik isolasi dan purifikasi DNA yang efisien dan efektif pada kemiri sunan (Reutalis trisperma (Balnco) Airy Shaw). Littri. 17(1): 11-17.
Thermo Fisher Scientific. 2009. Nanodrop 2000/200c Spectrpphotometer V1.0 User Manual. Wilmington (US): Thermo Fischer Scientific.
Wulandari H, Zakiatulyaqin, Supriyanto. 2012. Isolasi dan pengujian bakteri endofit dari tanaman lada (Piper ningrum L.) sebagai antagonis terhadap patogen hawar beludru.J Perkebunan Lahan Trop. 2(2):23-31.
Yurekli F, Geckil H, Topcuoglu F. 2003. The synthesis of indole-3-acetic acid by the industrially important white-rot fungus Lentinus sajor-caju under different culture conditions. Mycological Research. 107(1): 305-309.
22
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Sampel cabai merah (akar, batang, dan daun)
Disterilisasi dengan alkohol 70% dan sodium hipoklorit 20%, diencerkan dengan air hingga 105
Isolat sampel 105, 104, dan 103
100 µL ditumbuhkan ke dalam media agar-agar King’s B, diinkubasi 25oC selama ±24 jam
Isolat bakteri
Warna daun tembakau hijau
menjadi coklat
Persentasi zona hambat bakteri terhadap patogen Diuji kualitatif
dengan uji HR
Diuji kualitatif dengan uji hemolisis
Adanya zona bening maupun coklat kehijauan
Diuji kuantitatif dengan uji antagonis
Identifikasi
molekuler (isolasi, amplifikasi, dan sekuensing DNA)
23 Lampiran 2 Delapan isolat bakteri endofit cabai merah penghasil AIA
Kode isolat Gambar koloni tunggal
isolate Hasil pengamatan
A27, A28 A27: koloni berwarna
kuning, berbentuk bulat, dan datar A28: koloni berwarna kuning, berbentuk bulat, dan datar
A2.1, A2.2 A2.1: koloni berwarna
putih susu, berbentuk bulat, dan cembung
A2.2: koloni berwarna putih susu, berbentuk bulat, dan
cembung
A4.2 A4.2: koloni berwarna
putih susu, berbentuk bulat, dan cembung
B1.2 B1.2: koloni berwarna
putih, berbentuk bulat, dan cembung
B6.2 B6.2: koloni berwarna
putih, berbentuk bulat, dan cembung
D11.1 D11.1: koloni berwarna
putih, berbentuk bulat, dan cembung
Keterangan: A: akar tanaman cabai merah B: batang tanaman cabai merah
24
Lampiran 3 Hasil seleksi dan karakterisasi 109 isolat bakteri endofit cabai merah
No. Asal
25 Lanjutan lampiran 3
35 B8 - + β
36 B9 + - α
37 B10 + - α
38 B11 + - β
39 B12 + + β
40 D1 Daun + - α
41 D2 + - α
42 D3 + - α
43 D4 + - α
44 D5 + - β
45 D6 + - β
46 D7 - - α
47 D8 + - β
48 D9 + - β
49 D10 + - β
50 D11 + - β
51 D12 + - β
52 D13 + - α
53 D14 + + α
54 D15 + - β
55 D16 + - β
56 D17 + + α
57 D18 + - α
58 HPT
IPB A1.1 + - α
59 A1.2 + - β
60 A2.1 + ++ γ
61 A2.2 + ++ γ
62 A3.1 + - γ
63 A4.1 + - γ
64 A4.2 - - γ
65 A5.1 + - γ
66 A5.2 + + γ
67 A6.1 + ++ γ
68 A6.2 + - α
69 B1.1 + - γ
26
Lanjutan lampiran 3
71 B2.1 + - β
72 B2.2 + - β
73 B3.1 + - α
74 B3.2 + - α
75 B4.1 + - α
76 B4.2 + - α
77 B5.1 + - α
78 B5.2 + - α
79 B6.2 + - γ
80 B7.1 + - β
81 B7.2 + + β
82 D1.1 + + α
83 D1.2 + - α
84 D2.1 + - β
85 D2.2 + - β
86 D3.1 + - α
87 D3.2 + - α
88 D4.1 + - α
89 D4.2 + - β
90 D5.1 + - α
91 D5.2 + - α
92 D6.1 - - α
93 D6.2 - - α
94 D7.1 + - β
95 D7.2 + - β
96 D8.1 + - β
97 D8.2 + - α
98 D9.1 + - α
99 D9.2 + - α
100 D10.1 + - α
101 D10.2 + - β
102 D11.1 + - γ
103 D12.2 + - β
104 D12.2 + - β
105 D13.1 + - α
106 D14.1 + - α
27 Lanjutan lampiran 3
108 D15.1 + + β
109 D15.2 + - β
110 Xanthomonas
20D +
111 Xanthomonas
1/100 ++
112 E. coli -
Keterangan: * Pendugaan jenis Gram bakteri dilakukan dengan metode string test
** - : tidak patogen + : patogen ++ : sangat patogen
*** β : hemolisis total (warna kuning transparan pada bakteri) α : hemolisis sebagian (warna coklat/ hijau pada bakteri) γ : non-hemolisis (warna tetap merah pada bakteri)
Lampiran 4 Deret standar AIA dari larutan standar
Konsentrasi (ppm) Standar AIA (µL) Akuades (mL)
1 5 4.995
5 25 4.975
10 50 4.950
20 100 4.900
40 200 4.800
80 400 4.600
100 500 4.500
Lampiran 5 Pengukuran absorbansi standar AIA λ 530 nm
Jenis Larutan Konesntrasi Larutan
(ppm) Nilai Absorbansi (A)
Standar IAA 1 0.058
5 0.088
10 0.127
20 0.211
40 0.336
80 0.460
28
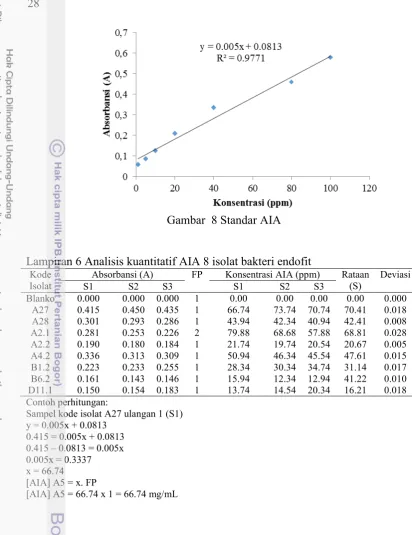
Gambar 8 Standar AIA
Lampiran 6 Analisis kuantitatif AIA 8 isolat bakteri endofit Kode
Isolat S1 Absorbansi (A) S2 S3 FP Konsentrasi AIA (ppm) S1 S2 S3 Rataan (S) Deviasi
Blanko 0.000 0.000 0.000 1 0.00 0.00 0.00 0.00 0.000
A27 0.415 0.450 0.435 1 66.74 73.74 70.74 70.41 0.018
A28 0.301 0.293 0.286 1 43.94 42.34 40.94 42.41 0.008
A2.1 0.281 0.253 0.226 2 79.88 68.68 57.88 68.81 0.028
A2.2 0.190 0.180 0.184 1 21.74 19.74 20.54 20.67 0.005
A4.2 0.336 0.313 0.309 1 50.94 46.34 45.54 47.61 0.015
B1.2 0.223 0.233 0.255 1 28.34 30.34 34.74 31.14 0.017
B6.2 0.161 0.143 0.146 1 15.94 12.34 12.94 41.22 0.010
D11.1 0.150 0.154 0.183 1 13.74 14.54 20.34 16.21 0.018
Contoh perhitungan:
Sampel kode isolat A27 ulangan 1 (S1) y = 0.005x + 0.0813
0.415 = 0.005x + 0.0813 0.415 – 0.0813 = 0.005x 0.005x = 0.3337 x = 66.74 [AIA] A5 = x. FP
29 Lampiran 7 Sekuens gen 16S rRNA isolat A4.2, B6.2, dan D11.1
A. Isolat A4.2 (Pseudomonas stutzeri (T); ATCC 17588; AF094748)
GCGATTCCGACTTCACGCAGTCGAGTTGCAGACTGCGATCCGGA
B. Isolat B6.2 (Bacillus vallismortis (T); DSM11031; AB021198
GCTTCACGCAGTCGAGTTGCAGACTGCGATCCGAACTGAGAAC
C. Isolat D11.1 (Bacillus cereus (T); ATCC 14579; AE016877
30
31
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 19 Juli 1993 dari ayah bernama Suparno dan ibu bernama Suparmi. Penulis merupakan anak pertama dari 2 bersaudara. Penulis berasal dari SMAN 2 Rembang (2008-2011) dan tahun 2011 diterima di Institut Pertanian Bogor (IPB) melalui SNMPTN Undangan dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.