POLA DISTRIBUSI DAN PRODUKSI ENERGI
MITOKONDRIA SEL-SEL TROFOBLAS BLASTOSIS
MENCIT(Mus musculus albinus)
ROZA HELMITA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudulpola distribusi dan produksi energi mitokondria sel-sel trofoblas blastosis mencit (Mus musculus albinus) adalah benar hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah dipublikasikan kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2007
Roza Helmita
ABSTRAK
ROZA HELMITA. Pola distribusi dan produksi energi mitokondria sel-sel trofoblas blastosis mencit (Mus musculus albinus). Dibimbing oleh ITA DJUWITA, BAMBANG PURWANTARA dan ADI WINARTO.
Penelitian ini dilakukan untuk mempelajari (1) tingkat kegagalan nidasi dan perlekatan sel-sel trofoblas pada substrat dalam kultur in vitro, (2) kemampuan pertumbuhan dan diferensiasi sel-sel trofoblas pada blastosis nidasi dan gagal nidasi, (3) aktivitas NADH-CoQ reductase sel-sel trofoblas dari blastosis nidasi dan gagal nidasi serta (4) pola distribusi mitokondria dari sel-sel trofoblas yang mengalami nidasi dan gagal nidasi dalam medium kultur in vitro. Blastosis dikoleksi dari kornua uterus mencit pada hari keempat setelah fertilisasi dan dibagi menjadi tiga kelompok blastosis yaitu: (1) nidasi dalam waktu 24 jam, (2) nidasi dalam waktu 48 jam dan (3) gagal nidasi. Masing-masing kelompok dikultur dalam medium DMEM yang diberi tambahan 50µg/ml gentamicin, NBCS 20%, 1µl/ml ITS (kandungan insulin 5µg/ml, tranferin 10µg/ml, selenium 5µg/ml; Sigma St Louis USA) dan ß-mercaptoethanol 14,3 mM (Sigma St Louis USA) pada inkubator CO2 5% suhu 37 °C selama 10 hari. Terhadap monolayer trofoblas dilakukan pengukuran pertumbuhan (outgrowth) dengan menggunakan
eyespiece micrometer, pewarnaan Giemsa untuk melihat morfologi sel yang berdiferensiasi dan pewarnaan histokimia untuk menganalisis NADH-CoQ reduktase, serta imunositokimia untuk mengetahui distribusi mitokondria. Hasil yang diperoleh menunjukkan terdapat perbedaan kemampuan nidasi blastosis dan perlekatan sel-sel trofoblas. Pertumbuhan (outgrowth) sel-sel trofoblas dari blastosis 24 jam nidasi berbeda secara signifikan dengan sel-sel trofoblas dari blastosis 48 jam nidasi dan blastosis gagal nidasi. Hasil pewarnaan Giemsa menunjukkan bahwa sel-sel trofoblas dari blastosis 24 jam dan 48 jam nidasi mampu berdiferensiasi menjadi sitotrofoblas, sinsitiotrofoblas dan spongiotrofoblas lebih banyak dibanding sel-sel trofoblas dari blastosis gagal nidasi. Aktivitas NADH-CoQ reduktase sel-sel trofoblas dari blastosis 24 jam dan 48 jam nidasi berbeda secara signifikan dengan sel-sel trofoblas dari blastosis gagal nidasi dan pola distribusi mitokondria sel-sel trofoblas pada blastosis nidasi dalam waktu 24 dan 48 jam menunjukkan keadaan normal dengan pola yang homogen yaitu tersebar merata di dalam sitoplasma, sedangkan blastosis gagal nidasi mempunyai pola distribusi mitokondria yang heterogen (abnormal) dan mengelompok dalam sitoplasma sel-sel trofoblas. Berdasarkan hasil penelitian yang diperoleh disimpulkan bahwa pola distribusi mitokondria yang abnormal dan gangguan produksi energi mitokondria dapat menyebabkan kegagalan nidasi dan implantasi.
ABSTRACT
ROZA HELMITA. The Pattern of Distribution and Energy Production of Mitochondrial in Trophoblast Cells of Mouse Blastocyst. Under the direction of ITA DJUWITA, BAMBANG PURWANTARA and ADI WINARTO
The objectives of this study were to investigate: (1) the failure of ability of blastocyst to hatch and attachment of trophoblast cells, (2) the outgrowth and differentiation of trophoblast cells in in vitro cultured undergo hatch and no hatch blastocyst, (3) the activity of mitochondria NADH-CoQ reductase and (4) the pattern of mitochondrial distribution. Blastocysts were collected from uterine horn of mice at day-4 of pregnancy. The animal were divided into 3 groups: blastocysts hatched within 24 hours, 48 hours and non hatching. Embryos were cultured in DMEM medium supplemented with 50µg/ml gentamicin, NBCS 20%, 1µl/ml ITS (kandungan insulin 5µg/ml, tranferin 10µg/ml, selenium 5µg/ml; Sigma St Louis USA) dan ß-mercaptoethanol 14,3 mM (Sigma St Louis USA) in 5% CO2 incubator at 37°C for 10 days. The outgrowth of trophoblast cells were measured using eyespiece micrometer. The trophoblasts monolayer were processed for Giemsa staining, histochemistry analysis of NADH-tetrazolium reductase activity and imunocytochemistry to examine the pattern of mitochondrial distribution. Results of this experiment showed that the ability of blastocyst hatching in in vitro was different. The outgrowth trophoblast diameter of 24 h hatched blastocyst was significantly higher than the 48 h hatched and non hatched blastocyst. Morphological examination using light microscope showed that the trophoblast monolayers of 24 h hatched blastocyst differentiated into cytotrophoblast, syncytioptrophoblast and spongiotrophoblast after 10 days of cultured. The activity of NADH-CoQ reductase of 24 h and 48 h hatched blastocysts showed higher staining intensity than the non hatched blastocysts. The distribution of mitochondrial within trophoblast cell cytoplasma of 24 h and 48 h hatched blastocyst were homogen around nucleus whereas those of non hatched blastocyst were clustered and heterogen. In conclusion, the failure of blastocysts hatching and implantation was due to the impairment of mitochondria to produce energy and the abnormal pattern of mitochondrial distribution.
RINGKASAN
ROZA HELMITA. Pola distribusi dan produksi energi mitokondria sel-sel trofoblas blastosis mencit (Mus musculus albinus). Dibimbing oleh ITA DJUWITA, BAMBANG PURWANTARA dan ADI WINARTO
Perkembangan embrio praimplantasi ada kalanya mengalami gangguan sehingga tidak semua embrio praimplantasi dapat mengalami nidasi dan implantasi. Diantara banyak faktor yang dapat mempengaruhi terjadinya kegagalan nidasi dan implantasi blastosis diantaranya adalah: (1) gangguan pada organel sel, misalnya pada mitokondria yang dapat mengakibatkan proses pembentukan energi tidak berfungsi dengan baik, (2) ketebalan zona pelusida, yakni semakin tebal zona pelusida maka energi dan tekanan yang dibutuhkan akan semakin besar untuk dapat menembus zona pelusida, (3) aktivitas enzim proteolitik yang berperan penting dalam mencerna zona pelusida sehingga zona pelusida menjadi tipis dan blastosis dapat dengan mudah keluar dari zona pelusida, dan (4) faktor penuaan (aging) yang dapat berkontribusi dalam perkembangan kualitas embrio praimplantasi. Kegagalan ini menyebabkan embrio dalam tahap blastosis tidak dapat nidasi atau berkontak dengan endometrium sehingga implantasi dan kebuntingan tidak dapat terjadi. Oleh karena itu tujuan dari penelitian ini untuk mempelajari dan memperoleh informasi mengenai: (1) tingkat kegagalan nidasi dan perlekatan sel-sel trofoblas pada substrat dalam kultur in vitro, (2) kemampuan pertumbuhan dan diferensiasi sel-sel trofoblas pada blastosis nidasi dan gagal nidasi dan (3) aktivitas NADH-CoQ reduktase sel-sel trofoblas dari blastosis nidasi dan gagal nidasi serta (4) pola distribusi mitokondria dari sel-sel trofoblas yang mengalami nidasi dan gagal nidasi dalam medium kultur in vitro.
Penelitian ini menggunakan blastosis mencit yang dibagi kedalam tiga perlakuan, yaitu: (1) blastosis yang nidasi cepat (24 jam), (2) blastosis yang nidasi lambat (48 jam) dan (3) blastosis yang gagal nidasi. Masing-masing kelompok dikultur sampai membentuk monolayer selama 10 hari, selanjutnya diukur penjuluran sel-sel trofoblas pertumbuhan (outgrowth), diidentifikasi morfologi sel-sel trofoblas yang mengalami diferensiasi dan aktivitas NADH-CoQ reductase secara histokimia serta distribusi mitokondria secara imunositokimia. Masing-masing perlakuan menggunakan minimal 10 embrio. Data tingkat nidasi blastosis dan perlekatan, pertumbuhan (outgrowth) serta aktivitas NADH-CoQ reductase sel-sel trofoblas diuji dengan analisis keragaman dan dilanjutkan dengan uji Beda Nyata Terkecil (BNT) menggunakan software Statistic Analyses System (SAS 2000). Data morfologi sel-sel trofoblas yang mengalami diferensiasi dan pola distribusi mitokondria sel-sel trofoblas dianalisis secara deskriptif.
blastosis yang nidasi tidak semuanya dapat melakukan perlekatan (attachment). Hasil pengamatan terhadap 28 blastosis nidasi dalam waktu 24 jam yang mampu melekat sebanyak 15 (54%) embrio, sedangkan 17 blastosis yang nidasi dalam waktu 48 jam sebanyak 7 (41%) embrio (Tabel 1). Hal ini menunjukkan bahwa walaupun secara morfologi blastosis yang dikultur memiliki kualitas yang sama, namun setelah kultur in vitro menunjukkan viabilitas yang berbeda.
Kemampuan pertumbuhan sel-sel trofoblas dari blastosis nidasi dan gagal nidasi sangat berbeda yang ditunjukkan oleh rataan pertumbuhan sel-sel trofoblas. Hasil pengukuran pada hari ke-10 kultur menunjukkan bahwa rataan pertumbuhan sel-sel trofoblas yang dihasilkan oleh blastosis nidasi dalam 24 jam mencapai 652,6 ± 306µm, berbeda nyata (P < 0,05) dengan blastosis yang nidasi dalam 48 jam dan gagal nidasi, masing-masing 322,9 ± 87µm dan 180,2 ± 60µm (Tabel 2). Hal ini menunjukkan bahwa kegagalan nidasi yang terjadi pada individu blastosis juga berkaitan erat dengan kemampuan pertumbuhan sel khususnya sel-sel trofoblas. Pertumbuhan sel-sel trofoblas dapat dijadikan indikasi dalam menentukan keberhasilan proses implantasi. Semakin luas pertumbuhan sel-sel trofoblas menunjukkan kemampuan invasi sel trofoblas yang tinggi. Invasi sel-sel trofoblas penting untuk membentuk anchoring vili yang menjadi perantara hubungan antara maternal dan fetus.
Hasil penelitian menunjukkan bahwa terdapat perbedaan kemampuan diferensiasi antara blastosis yang nidasi (24 dan 48 jam) dengan blastosis yang gagal nidasi. Pada blastosis nidasi (24 dan 48 jam ) ditemukan sekitar 50% sitotrofoblas, 30% sinsitiotrofoblasdan 15% spongiotrofoblas dari jumlah total sel yang berdiferensiasi. Sedangkan blastosis yang gagal nidasi mempunyai kemampuan berdiferensiasi yang rendah, ditunjukan dari hasil pengamatan terhadap monolayer sel trofoblas yang mengalami diferensiasi menjadi sinsitiotrofoblas sekitar 10-30%, selebihnya berdiferensiasi menjadi sitotrofoblas serta tidak ditemukan spongiotrofoblas dan glikogen trofoblas.
terdapat dalam matriks mitokondria, misalnya enzim NADH-CoQ reduktase. Adanya gangguan pada komponen kunci rantai transpor elektron yaitu pada kompleks I (NADH-CoQ reduktase) dapat mengakibatkan terganggu atau tidak terbentuknya elektron sehingga energi (ATP) tidak dapat dihasilkan dengan efisien dan dapat mengganggu fisiologis sel. Selanjutnya mengakibatkan sel mengalami lisis atau apoptosis sehingga sel tidak dapat tumbuh dan berdiferensiasi ke proses selanjutnya. Hasil imunositokimia terhadap mitokondria pada sel-sel trofoblas dari blastosis nidasi dan gagal nidasi terdapat perbedaan pola distribusi mitokondria di sitoplasma sel-sel trofoblas. Pada sel-sel trofoblas yang nidasi mempunyai pola distribusi mitokondria yang homogen yaitu mitokondria tersebar secara merata disekitar nukleus, sedangkan pola distribusi mitokondria dari sel-sel trofoblas yang gagal nidasi yaitu heterogen, tidak tersebar merata tetapi mitokondria tersebar secara acak dan mengelompok pada satu tempat. Pola distribusi mitokondria yang heterogen pada sel-sel trofoblas dari blastosis gagal nidasi mengindikasikan adanya gangguan distribusi energi (ATP) ke dalam nukleus sehingga nukleus kekurangan energi (ATP) yang diperlukan untuk menjalankan fungsinya, seperti proliferasi dan diferensiasi. Selain itu, pola distribusi mitokondria yang heterogen atau mengelompok dapat dijadikan sebagai indikasi sel akan atau mengalami apoptosis. Hal ini disebabkan dalam proses apoptosis melibatkan mitokondria. Sel yang mengalami apoptosis mempunyai energi (ATP) yang rendah atau menurun. Dengan demikian ATP yang tersedia menjadi sedikit dan berdampak pada pertumbuhan dan aktivitas sel-sel trofoblas.
Berdasarkan hasil penelitian dapat disimpulkan bahwa rendahnya aktivitas NADH-CoQ reduktase dan pola distribusi mitokondria abnormal (heterogen) mengakibatkan kemampuan pertumbuhan dan diferensiasi sel-sel trofoblas rendah yang selanjutnya dapat berdampak pada kegagalan nidasi dan implantasi.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
POLA DISTRIBUSI DAN PRODUKSI ENERGI
MITOKONDRIA SEL-SEL TROFOBLAS BLASTOSIS
MENCIT(Mus muculus albinus)
ROZA HELMITA
Tesis
Sebagai salah satu syarat memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pola Distribusi dan Produksi Energi Mitokondria Sel-Sel Trofoblas Blastosis Mencit (Mus muculus albinus).
Nama : Roza Helmita
NRP : B051050051
Ketua Program Studi Biologi Reproduksi
Dr. drh. Tuty L. Yusuf, MS
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, MS
Tanggal Ujian : 15 Agustus 2007 Tanggal Lulus : Disetujui
Komisi Pembimbing
Dr. drh. Bambang Purwantara, M.Sc. Anggota
drh. Adi Winarto, Ph.D Anggota
Diketahui
PRAKATA
Alhamdulillah, puji syukur senantiasa penulis panjatkan kehadirat Allah
SWT atas segala limpahan karunia dan rahmat-Nya sehingga penelitian dan
penulisan tesis ini dapat diselesaikan. Penelitian yang telah dilaksanakan berjudul
‘Pola distribusi dan produksi energi mitokondria sel-sel trofoblas blastosis mencit
(Mus muculus albinus)’.
Terima kasih dan penghargaan yang tinggi penulis ucapkan kepada Ibu Dr.
drh Ita Djuwita, M.Phil, Bapak Dr. drh. Bambang Purwantara, M.Sc dan Bapak
drh. Adi Winarto, PhD selaku ketua dan anggota komisi pembimbing yang telah
meluangkan waktu untuk memberikan bimbingan dan nasehat serta dorongan
semangat yang begitu besar sehingga penulis dapat menyelesaikan penelitian dan
tesis ini. Disamping itu, terimakasih penulis ucapkan kepada Bapak Dr. drh. M.
Agus Setiadi sebagai penguji luar komisi yang telah memberikan masukan dan
saran kepada penulis. Terima kasih kepada Ibu Dr. drh. Tuty L. Yusuf, MS, selaku
Ketua Program Studi Biologi Reproduksi beserta seluruh staf pengajar Program
Studi Biologi Reproduksi, Departemen Klinik, Reproduksi dan Patologi FKH
IPB. Terima kasih kepada Laboratorium Embriologi dan Laboratorium Histologi
Departemen Anatomi, Fisiologi dan Farmakologi FKH IPB serta Unit Pelaksana
Teknis (UPT) Hewan Laboratorium FKH IPB atas bantuan fasilitas pendukung
sehingga penelitian dapat berjalan dengan baik.
Penulis juga menyampaikan rasa terima kasih kepada Bapak Ir. Thomas
Mata Hine, M.Si, Bapak Ir. Bayu Rosadi, M.Si, Bapak Dr. drh. I Wayan Batan,
M.Si, Bapak Wibi Riawan (Lab. Biomedis FK UNIBRAW), Bapak drh. Arief
Bodieono PhD, Bapak drh Kusdiantoro Mohammad. M.Si, Bapak drh. Fachrudin
PhD, drh. Wahono Esthi Prasetyaningtyas M.Si, Nurbariah M.Si, Ni Luh Gde
Sumardani M.Si, Ir Yanhendri M.Si, drh. Erma Najmiati, rekan-rekan mahasiswa
Program Studi Biologi Reproduksi (Bapak Ramadan, Mas Sigit, Pak Heri, Nuril,
Ibu Enny, Pak Taufik, Beni), keluarga besar Laboratorium Embriologi (Bu Yani,
Mas Wahyu), rekan-rekan mahasiswa Program Studi SVT 2006 ( Harry, Dini,
Dwi, Riris). Teman-teman di Vaillya ( Iis, Bu Agnet, Ka’ Diana, Ella), Uni Wike,
Mba Nada, Ka Jannah, Maya Indah wahyuni, Uul, Arie dan berbagai pihak yang
Terima kasih tak terhingga selamanya kepada Keluarga tercinta, ayahanda
dan ibunda, adik-adikku tersayang (Nia, Romi dan Razaq) serta seluruh keluarga
besar (Etek Ema dan keluarga, etek In dan keluarga, Pak Umar dan keluarga, Pak
Mai dan keluarga serta Pak Cut dan keluarga, Tek Wit dan keluarga, Tek Cun dan
keluarga) atas segala doa, kasih sayang, pengorbanan, pengertian dan semangat
serta dukungan materil yang tiada henti diberikan kepada penulis selama ini.
Akhir kata penulis mengharapkan semoga tesis ini dan apa yang telah
dihasilkan dapat bermanfaat bagi pengembangan ilmu pengetahuan, bagi pembaca
pada umumnya dan penulis pada khususnya.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh pada tanggal 14 April 1981 dari
pasangan Roslan dan Zuhelmi. Penulis merupakan putri pertama dari empat
bersaudara.
Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Padang, Padang dan
gelar sarjana diraih pada tahun 2005. Pada tahun yang sama, penulis diterima
sebagai mahasiswa program master (Strata 2) pada Program Studi Biologi
DAFTAR ISI
Diferensiasi Sel Trofoblas... 8
Implantasi dan Perkembangan Sel Trofoblas dalam Sistem Kultur In Vitro... 10
Mitokondria... 12
Produksi ATP dalam Mitokondria ... 13
Mitokondria dan Apoptosis... 16
BAHAN DAN METODE
Pengukuran Pertumbuhan (‘Outgrowth’) Sel-Sel Trofoblas... 20
Morfologi Sel trofoblas yang Berdiferensiasi ... 21
Aktivitas NADH-CoQ Reductase dengan Pewarnaan Histokimia .. 21
Distribusi Mitokondria Sel-Sel Trofoblas secara Imunositokimia ... 22
Analisis Data ... 23
HASIL DAN PEMBAHASAN Tingkat Kegagalan Nidasi dan Perlekatan Sel-Sel Trofoblas In Vitro.. 24
Pertumbuhan dan DiferensiasiSel-Sel Trofoblas dalam Kultur In Vitro 25 Aktivitas NADH-CoQ Reductase Sel-Sel trofoblas ... 29
Pola Distribusi Mitokondria pada Sel-Sel Trofoblas ... 31
SIMPULAN DAN SARAN ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Halaman 1 Persentase perkembangan blastosis ke tahap nidasi
dan perlekatan pada dasar cawan petri dalam kultur in vitro... 25
2 Rataan pertumbuhan sel-sel trofoblas ... 27
3 Hasil pewarnaan histokimia terhadap aktivitas
DAFTAR GAMBAR
Halaman
1 Blastosis ekspan ... 4
2 Proses nidasi blastosis dari zona pelusida... 5
3 Proses implantasi embrio ... 7
4 Pertumbuhan sel-sel trofoblas secara in vitro... 11
5 Struktur mitokondria ... 12
6 Rantai respirasi elektron dalam mitokondria ... 15
7 Dua jalur apoptosis... 18
8 Pertumbuhan sel-sel trofoblas didalam medium kultur in vitro... 26
9 Morfologi sel-sel trofoblas yang telah mengalami diferensiasi ... 28
10 Aktivitas NADH-CoQ reduktase pada monolayer sel-sel trofoblas ... 30
DAFTAR LAMPIRAN
Halaman 1 Komposisi medium koleksi blastosis (phosphate buffered
saline)... 40
2 Komposisi medium Tissue Culture Medium (TCM) ... 41
3 Komposisi medium (Dubellco’s Modified Eagles’ Medium) DMEM... 42
PENDAHULUAN
Latar Belakang
Implantasi merupakan suatu peristiwa dalam reproduksi mamalia yang
menentukan apakah kebuntingan akan dapat dipertahankan sampai lahir. Untuk
mencapai tahap implantasi, embrio tahap blastosis harus mengalami nidasi
(hatching) yaitu proses keluarnya embrio dari zona pelusida (Dey et al. 2004;
Horse et al. 2004). Nidasi blastosis terdiri dari inner cell mass (ICM) yang akan
menjadi fetus dan lapisan epitel paling luar yaitu trofoblas yang akan berperanan
di dalam proses implantasi serta rongga yang berisi cairan, disebut blastosul.
Perkembangan embrio praimplantasi ada kalanya mengalami gangguan
sehingga tidak semua embrio praimplantasi dapat mengalami nidasi dan
implantasi. Hal ini ditunjukkan dari hasil transfer blastosis manusia yaitu sekitar
47%-60% yang berhasil mengalami implantasi dan hamil (Fong et al. 2001).
Bahkan Norwitz et al. (2001) mengemukakan bahwa blastosis yang dikultur in
vitro kemudian ditransfer, menunjukkan tingkat implantasi yang lebih rendah
yaitu sekitar 25%. Sedangkan Hredzak et al. (2005) menyatakan bahwa pada
mencit tingkat implantasi embrio segar adalah 31,3%.
Diantara banyak faktor yang dapat mempengaruhi terjadinya kegagalan
nidasi dan implantasi blastosis diantaranya adalah: (1) gangguan pada organel sel,
misalnya pada mitokondria yang dapat mengakibatkan proses pembentukan energi
tidak berfungsi dengan baik (Tsuzuki et al. 2001; John 2002; Tamassia et al.
2004; Turrens 2003), (2) ketebalan zona pelusida, yakni semakin tebal zona
pelusida maka energi dan tekanan yang dibutuhkan akan semakin besar untuk
dapat menembus zona pelusida, (3) aktivitas enzim proteolitik yang berperan
penting dalam mencerna zona pelusida sehingga zona pelusida menjadi tipis dan
blastosis dapat dengan mudah keluar dari zona pelusida, dan (4) faktor penuaan
(aging) yang dapat berkontribusi dalam perkembangan kualitas embrio
praimplantasi (Acton et al. 2004; Blerkom 2004; Osagie et al. 2003; Fong et
al.2001). Kegagalan ini menyebabkan embrio dalam tahap blastosis tidak dapat
nidasi atau berkontak dengan endometrium sehingga implantasi dan kebuntingan
Selama perkembangan embrio praimplantasi dari zigot sampai mencapai
blastosis terjadi peningkatan aktivitas metabolisme serta kebutuhan energi
(Trimarchi et al. 2000; Ludwig et al. 2001; Blerkom 2004). Proses pembentukan
energi sangat tergantung pada aktivitas mitokondria sebagai organel pembangkit
energi dalam sel (power house cell) sehingga gangguan atau rusaknya
mitokondria dapat mempengaruhi proses pembentukan energi yang sangat
dibutuhkan dalam proses nidasi dan implantasi blastosis.
Pembentukan energi berupa adenosin triphosphat (ATP) di dalam
mitokondria terjadi melalui dua interaksi siklus metabolisme, yaitu siklus asam
sitrat (siklus Kreb) dan fosforilasi oksidasi (Klobuear dan Gorup 2004; Brookes
2004). Salah satu produk dari siklus asam sitrat adalah nikotinamida adenin
dinukleotidadehidrogenase (NADH) yang berfungsi sebagai substrat pada reaksi
transduksi energi dalam sistem rantai transpor elektron (RTE) atau fosforilasi
oksidasi. Pelepasan energi NADH terjadi secara bertahap dengan melibatkan
enzim-enzim antara lain NADH-CoQ reduktase pada kompleks I. Gangguan atau
kerusakan pada komponen kunci rantai transpor elektron terutama pada kompleks
I dapat mengakibatkan tidak terbentuknya elektron sehingga ATP tidak dapat
dihasilkan dengan efisien dan dapat meningkatkan produksi radikal bebas. Radikal
bebas adalah molekul reaktif yang dapat merusak DNA dan membran sel melalui
jalur oksidasi sehingga menyebabkan apoptosis sel dan mempercepat penuaan
(aging) (Dimauro dan Schon 2003; Trimarchi et al. 2000; Blerkom 2004).
Walaupun kajian dan informasi terhadap proses implantasi secara in vitro
cukup banyak dilaporkan, namun sejauh mana kegagalan nidasi blastosis yang
diakibatkan oleh kelainan pola distribusi dan gangguan fungsi mitokondria belum
diketahui. Disamping itu rendahnya tingkat kebuntingan yang disebabkan oleh
kegagalan nidasi sulit diketahui secara in vivo. Oleh sebab itu perlu kajian in vitro
mengenai kegagalan nidasi dan implantasi yang dikaitkan dengan pola distribusi
dan aktivitas mitokondria dalam memproduksi energi. Hal tersebut dapat dilihat
dari aktivitas NADH-CoQ reduktase serta kemampuan pertumbuhan dan
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari dan memperoleh informasi
mengenai: (1) tingkat kegagalan nidasi dan perlekatan sel-sel trofoblas pada
substrat dalam kultur in vitro, (2) kemampuan pertumbuhan dan diferensiasi
sel-sel trofoblas pada blastosis yang mengalami nidasi dan gagal nidasi dan (3)
aktivitas NADH-CoQ reduktase sel-sel trofoblas pada blastosis yang mengalami
nidasi dan yang gagal nidasi serta (4) pola distribusi mitokondria dari sel-sel
trofoblas yang mengalami nidasi dan gagal nidasi dalam medium kultur in vitro.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan tambahan terhadap
informasi dasar mengenai faktor penyebab kegagalan nidasi blastosis dan
TINJAUAN PUSTAKA
Embrio Praimplantasi
Perkembangan embrio praimplantasi dimulai setelah fertilisasi yakni dari
mulai tahap zigot yang selanjutnya mengalami pembelahan mitosis sampai
membentuk blastosis. Pada mencit blastosis terbentuk empat hari setelah
fertilisasi. Struktur blastosis terdiri dari dua tipe sel yaitu inner cell mass (ICM)
dan sel trofoblas. Inner cell mass (ICM) akan membentuk embrionic stem cell
(ESC) pluripotent yang dapat berdiferensiasi menjadi berbagai tipe sel dari tubuh
fetus. Sementara itu sel-sel trofoblas akan berperan dalam proses implantasi dan
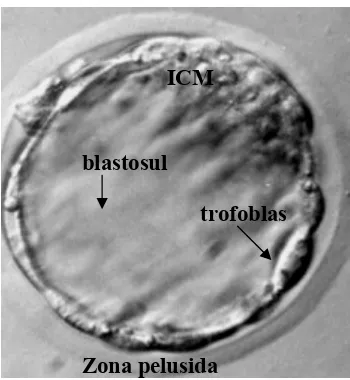
menjadi selaput ekstraembrionik (Gambar 1) (Kimber & Spanswick 2000; Hardy
& Spanos 2000; Goetz 2002). Di bagian dalam dari lapisan sel-sel trofoblas
terdapat suatu rongga berisi cairan yang disebut blastosul. Di bagian paling luar,
blastosis dibungkus oleh suatu selaput glikoprotein yang disebut dengan zona
pelusida. Seiring dengan pertumbuhan embrio praimplantasi, blastosul akan
mengalami pembesaran akibat terjadinya akumulasi cairan sehingga ukuran
blastosis bertambah besar dan tahap tersebut disebut dengan blastosis yang meluas
(blastosis ekspan). Selanjutnya blastosis eskpan akan mengalami nidasi
(hatching).
Gambar 1 Blastosis ekspan mencit. Zona pelusida
blastosul ICM
Nidasi Blastosis
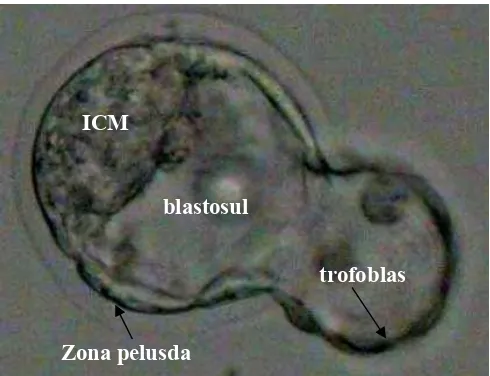
Nidasi merupakan proses keluarnya blastosis dari zona pelucida. Nidasi
dimulai dengan adanya akumulasi cairan secara bertahap dalam blastosul sehingga
terjadi peningkatan ukuran atau volume blastosis dari ukuran awalnya. Akumulasi
cairan dalam blastosul mengandung Na+/K+ dan ATPase yang menyebabkan
terjadinya peningkatan tekanan hidrostatik internal pada trofoblas dan zona
pelusida. Akibatnya zona pelusida menjadi tipis dan elastis (Gambar 2) (Balaban
et al.2002; Gonzales et al. 1996; Jones et al. 2000).
Gambar 2 Proses nidasi blastosis dari zona pelusida
Blastosis keluar dari zona pelusida pada kutub yang berlawanan dengan
inner cell mass (ICM) dan proses nidasi akan selesai apabila seluruh blastosis
telah keluar dari zona pelusida. Selanjutnya fimbria halus dan kecil muncul pada
sel trofoblas dan bergerak secara amuboid ke dinding endometrium untuk
melakukan proses implantasi yang diawali dengan terjadinya perlekatan dengan
epitel endometrium (Horse et al. 2004; Osagie & Biggers 2003).
Pada blastosis faktor-faktor yang dapat mempengaruhi proses nidasi
diantaranya, adalah: (1) ketersediaan energi (ATP) dalam blastosis yang
diperlukan untuk menekan zona pelusida, (2) ketebalan zona pelusida, yakni
semakin tebal zona pelusida maka energi dan tekanan yang dibutuhkan akan
semakin besar untuk dapat menembus zona pelusida, serta (3) aktivitas enzim
proteolitik yang berperan penting dalam mencerna zona pelusida sehingga zona ICM
blastosul
Zona pelusda
pelusida menjadi tipis dan blastosis dapat dengan mudah keluar dari zona pelusida
(Osagie et al. 2003; Fong et al.2001).
Implantasi Embrio
Proses implantasi dimulai setelah blastosis keluar dari zona pelusida yang
diikuti dengan kontak secara fisik dan fisiologis antara trofoblas dengan dinding
endometrium uterus (Horse et al. 2004). Proses ini melibatkan serangkaian
interaksi intraseluler serta interaksi antara sel dan matriks (Dey et al. 2004).
Ada tiga tahapan dalam proses implantasi, yaitu (1) aposisi, (2) perlekatan
(adhesi) dan (3) invasi. Aposisi merupakan adhesi yang tidak stabil dan terjadi
setelah blastosis berkontak dengan dinding uterus; sedangkan perlekatan (adhesi)
merupakan perlekatan yang stabil antara trofoblas dengan sel epitel uterus.
Selanjutnya sel trofoblas melakukan infiltrasi ke dalam endometrium yang diikuti
dengan invasi di dalam endometrium membentuk anchoring vili agar fetus
memperoleh makanan dari induk (Gambar 3) (Dey et al. 2004; Dominguez et al.
2005).
Pada manusia dan mencit endometrium mengalami desidualisasi, yaitu sel-
sel stroma mengalami perubahan morfologi, perubahan komposisi matriks
interseluler serta peningkatan pertumbuhan kapiler-kapiler pembuluh darah.
Adanya desidualisasi menyebabkan dikeluarkannya bahan-bahan metabolit,
seperti karbohidrat, protein, lemak dan asam nukleat. Bahan-bahan tersebut
INVASION
Gambar 3 Proses implantasi embrio ( Dominguez et al. 2005).
Berdasarkan perbedaan cara interaksi antara blastosis dan sel-sel uterus,
implantasi dapat dikelompokkan menjadi tiga jenis, yaitu: (1) sentral (superficial),
(2) eksentrik dan (3) interstisial (profundal). Pada implantasi superficial,
implantasi hanya berupa perlekatan pada permukaan uterus dan tidak terjadi
infiltrasi pada epitel endometrium. Tipe ini terdapat pada mamalia seperti kuda,
sapi, domba dan kambing. Implantasi eksentrik terjadi pada hewan anjing, kucing,
tikus dan mencit; pada tipe ini implantasi terjadi pada epitel uterus yang
mengalami invaginasi dan terjadi sedikit kerusakan pada stroma uterus. Pada tipe
interstitial terjadi pada babi, simpanse dan manusia. Pada tipe ini, implantasi
Diferensiasi Sel Trofoblas
Setelah blastosis keluar dari zona pelusida, sel-sel trofoblas akan melekat
pada dinding endometrium uterus. Sel trofoblas merupakan sel-sel yang berperan
penting dalam proses implantasi dan membentuk hubungan antara induk dan fetus
(Horse et al.2004; Nadra et al. 2006). Pada masa proses implantasi sel-sel
trofoblas mengalami proliferasi dan diferensiasi. Secara morfologi, diferensiasi
sel-sel trofoblas dibagi kedalam empat tipe, yaitu: 1) giant trophoblast cell, 2) sel
spongiotrofoblas (spongiotrophoblast), 3) sel glikogen, dan 4) sel
sinsitiotrofoblas (syncytiotrophoblast) (Kliman 2000; Kimber & Spanswick
2000). Keempat tipe sel tersebut merupakan hasil penggabungan (fusi) atau
diferensiasi sitotrofoblas (cytotrophoblast). Sebagian sitotrofoblas bergabung
bersama membentuk sinsitiotrofoblas. Selain itu sitotrofoblasjuga berdiferensiasi
menjadi giant trophoblast cell, spongiotrofoblas dan sel glikogen trofoblas
(Lunghi et al. 2007; Kliman 2000).
Giant trophoblast cells terdapat pada koriovitelin dan korioalantois
plasenta. Sel ini berukuran besar dengan satu nukleus. Giant trophoblast cells
menghasilkan beberapa growth factor (baik secara autokrin maupun parakrin) dan
hormon-hormon yang mendukung pertumbuhan dan perkembangan fetus serta
interaksi fisiologis antara fetus dan induk (Dey et al. 2004). Sel ini melakukan
proses endoreduplikasi, seperti melanjutkan sintesis DNA tanpa pembelahan sel.
Diferensiasi giant trophoblast cells didukung oleh dua gen faktor transkripsi basic
helix-loop helix (bHLH) yaitu Hand 1 dan Stra13.
Sel spongiotrofoblas secara morfologi berbeda dengan giant trophoblast
cells dan turut berperan dalam aktivitas endokrin. Sel glikogen sesuai dengan
namanya, sel ini banyak mengandung glikogen yang berpotensi dalam
penyimpanan energi dan muncul pada akhir kebuntingan (Kliman 2000).
Sel sinsitiotrofoblas merupakan sel dengan dua atau lebih nukleus
(multinukleus) berasal dari hasil penggabungan sitotrofoblas. Sel ini bertanggung
jawab dalam pengangkutan nutrien dan pembuangan sisa metabolisme,
mensekresikan hormon human chorionic gonadotrophin (hCG) yang penting
untuk mempertahankan korpus luteum untuk menghasilkan progesteron yang
plasenta yang berperan sebagai regulator metabolisme lipid dan karbohidrat pada
induk. Selain itu sinsitiotrofoblas juga menghasilkan ß1-glycoprotein spesifik,
plasminogen activator inhibitor type 2, growth hormone, collagenase,
thrombomodulin dan reseptor-reseptor growth factor ( Haig 1996; Frendo et al
2003).
Secara in vitro, diferensiasi sel sitotrofoblas diketahui dipengaruhi oleh
beberapa faktor seperti growth factor (epidermal growth factor, kelompok
granulosit-makrofag) dan hormon-hormon (hCG, estradiol) (Lunghi et al. 2007;
Kliman 2000). Menurut Frendo et al (2003) terdapat keterlibatan cyclic AMP
(cAMP), protein kinase serta stres oksidatif dengan diferensiasi dan fusi sel
trofoblas. Selain itu, kandungan oksigen berhubungan dengan respirasi dan
pembentukan ATP serta cAMP. Rendahnya kandungan oksigen atau sampai
dalam kondisi hipoxia dapat menghambat proliferasi sitotrofoblasdan diferensiasi
sinsitiotrofoblas (Aplin & Kimber 2004; Cartwright et al.2002; Lunghi et al.
Implantasi dan Perkembangan Sel Trofoblas dalam Sistem Kultur In Vitro Upaya untuk mempelajari proses implantasi secara in vivo mengalami
kendala. Untuk dapat mengamati proses implantasi khususnya pertumbuhan dan
perkembangan sel-sel trofoblas diperlukan sistem in vitro yang memadai.
Berbagai model implantasi blastosis telah dilakukan, diantaranya menggunakan
feeder layer seperti sel epitel endometrium, sel stroma, sel desidua serta matriks
ekstraseluler seperti laminin dan fibronectin yang berperan sebagai tempat
perlekatan dan invasi menyerupai sel-sel uterus maternal (Tayade et al. 2005;
Harun 2006).
Dalam sistem kultur in vitro, telah dilaporkan bahwa sel-sel trofoblas
mampu tumbuh sampai mengalami perlekatan (attachment) dan pertumbuhan
(outgrowth) yang mirip dengan proses adesi dan invasi secara in vivo. Sel-sel
trofoblas yang dikultur secara in vitro dapat tumbuh dengan baik apabila
dikondisikan sesuai dengan suasana in vivo. Penggunaan sistem kultur yang baik
mampu mendukung pertumbuhan dan perkembangan sel-sel trofoblas, terutama
penggunaan medium kultur yang tepat, penambahan serum, substrat energi
(piruvat dan glukosa), metabolit esensial (karbohidrat, asam amino, vitamin,
protein dan peptida), ion-ion anorganik, matriks ekstraseluler seperti laminin,
serta sistem inkubasi yang meliputi suhu, pH, fase gas serta osmolalitas medium
(Gardner et al.2002; Summers 2003).
Pada lingkungan in vitro, medium merupakan hal yang penting dalam
perkembangan sel-sel trofoblas. Medium yang digunakan harus mengandung
glukosa konsentrasi tinggi sebagai sumber energi. Sedangkan piruvat dan laktat
dalam konsentrasi rendah. Hal ini disebabkan pada perkembangan embrio pasca
implantasi terjadi peningkatan aktivitas metabolisme sehingga memerlukan energi
yang banyak. Selain itu, penambahan asam amino dan growth factor penting
dalam meningkatkan viabilitas dan perkembangan embrio secara in vitro (Gardner
et al. 2002).
Sel-sel trofoblas di dalam medium kultur akan melakukan perlekatan pada
dasar cawan petri atau pada feeder layer setelah blastosis mengalami nidasi.
Selanjutnya sel-sel trofoblas akan berproliferasi dan tumbuh ke arah luar dari
trofoblas akan semakin luas sampai mencapai batas maksimum (Gambar 4)
(Tayade et al. 2005).
Hari Tingkat Gambaran embrio Potongan melintang
0 Blastosis
1 Nidasi
2 Perlekatan
3-5 Awal pertumbuhan
6-7 maksimum pertumbuhan
8-9 akhir pertumbuhan
Mitokondria
Mitokondria berasal dari bahasa Yunani yaitu mito yang berarti benang dan
chondrion yang berarti granul atau butiran-butiran, sehingga dapat diartikan
organel yang mempunyai rangkaian granul-granul atau butiran-butiran yang
tersusun seperti benang. Mitokondria merupakan organel yang unik karena
memiliki materi genetik (DNA) sendiri berbentuk lingkaran yang turut berperan
dalam pewarisan sifat keturunan. Materi genetik ini berasal dari maternal,
sehingga setiap oosit mengandung banyak mitokondria pada sitoplasmanya
(Tamassia et al. 2004).
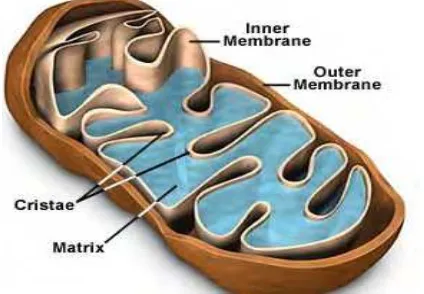
Struktur mitokondria berbentuk oval dengan panjang 1-2 mm dan lebar
0,5-1 mm, berada dalam sitoplasma yang strukturnya dikelilingi oleh dua membran,
yaitu membran luar dan membran dalam. Keduanya merupakan fosfolipid lapis
ganda (bilayer) yang terdiri atas kumpulan protein yang unik. Pada membran luar
terlihat halus tetapi mengandung protein transpor yang disebut porin, sehingga
membran luar berfungsi sebagai tempat keluar masuknya ion atau molekul kecil,
termasuk protein berukuran kecil kedalam ruang antar membran, namun tidak
semuanya melewati membran dalam yang bersifat impermeabel seperti di ruang
matriks. Pada membran dalam terdapat bagian yang berlipat-lipat, disebut krista.
Membran dalam membagi mitokondria menjadi dua ruang. Ruang pertama berupa
ruang antar membran, daerah sempit antara membran dalam dan membran luar.
Ruang kedua, yaitu matriks mitokondria yang dilingkupi oleh membran dalam
(Gambar 4) (Brokes et al. 2004; Cummins 2001; Dimauro & Schon 2003).
Membran dalam dan matriks merupakan tempat utama aktivitas
mitokondria. seperti siklus asam sitrat, oksidasi asam lemak, sintesis urea serta
pembentukkan energi. Hal ini disebabkan di dalam matriks banyak terkandung
enzim yang mencapai sekitar 67%. Sedangkan krista membuat membran dalam
mitokondria mempunyai pemukaan yang luas sehingga produktivitas respirasi
seluler meningkat (Dimauro & Schon 2003; Davidson 2006).
Produksi ATP dalam Mitokondria
Mitokondria pada awal perkembangan mempunyai struktur yang lebih kecil
dibanding individu dewasa dengan diameter < 0,5 µm. Selain itu mitokondria
pada stadium ini terdiri dari krista pendek dengan jumlah sedikit, sehingga
aktivitas respirasi rendah. Respirasi ini akan meningkat seiring dengan
perkembangan embrio. Struktur mitokondria juga akan mengalami perubahan
sesuai aktivitasnya, karena harus menghasilkan ATP (Adenosin Triphosphat)
dalam jumlah banyak. Dengan demikian konsumsi oksigen pada embrio semakin
lama akan meningkat sesuai perkembangannya (Trimarchi et al. 2000; Cummins
2001; Harvey et al. 2002; Osagie et al. 2003).
Pada awal perkembangannya embrio sangat membutuhkan energi untuk
aktivitasnya dan hampir 85% energi embrio dihasilkan dalam mitokondria melalui
metabolisme fosporilasi oksidasi dan siklus Kreb dalam bentuk ATP (Blerkom
2004; Harvey et al. 2002; Gardner et al. 2002). Energi atau ATP sangat
dibutuhkan untuk aktivitas biosintesis seluler, produksi membran plasma dan
proses perkembangan morfodinamika yang kritikal seperti pembentukan blastosul
pada proses blastulasi dan ekspansi blastosis. Selain itu ATP juga diperlukan pada
waktu nidasi agar embrio dapat implantasi (Gardner et al. 2002; Ludwig et al.
2001; Fleming 2004).
Aktivitas mitokondria dalam membentuk energi membutuhkan oksigen
dan nutrien atau substrat seperti glukosa, piruvat dan laktat yang akan diubah
menjadi ATP, proses ini disebut respirasi aerobik. Oleh sebab itu, mitokondria
juga dikenal sebagai power house cell. Produksi energi dalam mitokondria
transpor elektron. Siklus asam sitrat merubah karbohidrat dan asam lemak
menjadi ATP dan hidrogen dalam bentuk nicotinamide adenine dinucleotida
dehydrogenase (NADH) dan flavin adenin dinucleotida dehidrogenase (FADH2)
yang merupakan molekul tinggi energi karena masing-masing molekul tersebut
mengandung sepasang elektron yang mempunyai potensial transfer tinggi.
Rantai tranpor elektron merupakan kumpulan molekul yang tertanam pada
membran dalam mitokondria. Pelipatan membran dalam untuk membentuk krista
meningkatkan luas permukaannya untuk dapat melakukan transpor elektron.
Elektron yang masuk ke rantai transpor elektron berasal dari hasil reaksi glikolisis
dan siklus krebs yang disimpan dalam bentuk NADH. Bila masuk kedalam sistem
rantai transpor elektron dan terjadi penggabungan hidrogen dan oksigen maka
dapat membentuk ATP, sehingga disebut juga fosforilasi oksidatif. Proses ini
menghasilkan ATP lebih banyak dibanding siklus asam sitrat dan glikolisis, yaitu
30 ATP yang terbentuk, 26 ATP berasal dari proses fosforilasi oksidatif. Sebagian
besar komponen rantai transpor elektron merupakan protein.
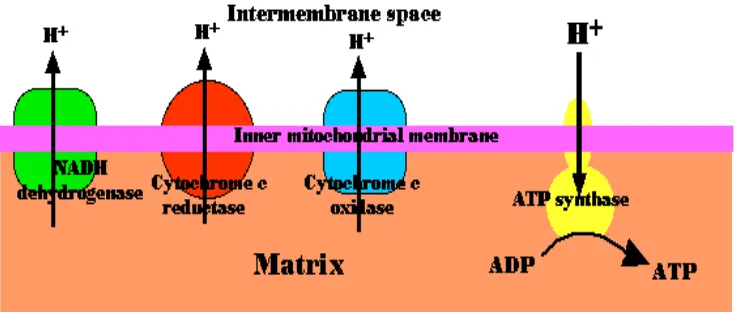
Reaksi fosforilasi oksidatif dalam mitokondria terdiri atas lima kompleks
protein, yaitu (1) kompleks I mengkatalis NADH dari siklus asam sitrat dengan
NADH-coenzym Q reductase sebagai reseptor menjadi bentuk tereduksi. NADH
merupakan kunci utama dari reaksi fosforilasi oksidatif yang berperan sebagai
perantara antara siklus krebs dengan rantai transpor elektron pada komplek I.
Langkah awal adalah pengikatan NADH dan transfer dua elektronnya ke flavin
mononukleotida (FMN), gugus prostetik komplek ini, menjadi bentuk tereduksi,
FMNH2. Elektron kemudian ditransfer dari FMNH2 keserangkaian rumpun
belerang besi (4Fe-4S), jenis kedua gugus prostetik dalam NADH-Q reduktase.
Elektron dalam rumpun belerang-besi kemudian diangkut ke ko-enzym Q, dikenal
juga sebagai ubiquinon. Ubiquinon mengalami reduksi menjadi radikal bebas
anion semiquinon dan reduksi kedua terjadi dengan pengambilan elektron kedua
membentuk ubiquinol (QH2) yang terikat enzim. Pasangan elektron pada QH2
dipindahkan ke rumpun belerang besi (2Fe-2S) kedua yang ada pada NADH-Q
reduktase, dan akhirnya ke Q yang bersifat aktif dalam inti hidrofobik membran
dalam mitokondria. Aliran dua elektron ini menyebabkan terpompanya empat H+
transpor elektron terutama pada enzim kompleks I dapat mengurangi produksi
ATP, meningkatkan kebocoran elektron dan meningkatkan produksi superoksida
(Grivennikova 2001). (2) Kompleks II menerima elektron dari FADH2 dan juga
melewati kompleks III melalui coenzyme Q, (3) kompleks respirasi III dengan
cytochrome c tereduksi dan cytochrome c oxidoreductase sebagai akseptor dan
(4) kompleks respirasi IV (cytochrome c oxidase) mengkatalis oksidasi
cytochrome c. (5) Kompleks V merubah adenosin diphosphate (ADP) menjadi
ATP dengan bantuan enzim ATP synthase. Adapun enzim yang terlibat dalam
reaksi ini yaitu NADH-coQ reductase, coQH2-cytochrome c reductase,
cytochrome c reductase dan ATP synthase (Dimauro dan Schon 2003;Klobuear
dan Gorup 2004).
Gambar 6 Rantai respirasi elektron dalam mitokondria.
Secara garis besar reaksi pembentukan ATP yang berlangsung di
mitokondria dapat dibagi menjadi tiga tahap: (1) Reaksi oksidasi piruvat (atau
asam lemak) menjadi CO2. Reaksi ini terkait dengan reduksi NAD+ dan FAD
menjadi NADH dan FADH2. Reaksi-reaksi ini berlangsung dalam ruang matriks
mitokondria, (2) transfer elektron dari NADH dan FADH2 ke O2. Rangkaian
reaksi ini berlangsung pada membran dalam mitokondria dan (3) pemanfaatan
energi yang tersimpan dalam bentuk gradien elektrokimia untuk memproduksi
ATP. Reaksi ini dikatalisis oleh enzim ATP sintetase yang berlokasi pada
Gangguan pada sistem rantai transpor elektron dapat meningkatnya
produksi radikal bebas. Radikal bebas adalah molekul reaktif yang dapat merusak
DNA dan membran sel melalui jalur oksidasi. Normalnya, rantai respirasi
mitokondria membuat radikal bebas dalam jumlah yang rendah selama proses
pembuatan ATP. Dengan meningkatnya radikal bebas dapat menyebabkan
kerusakan lebih lanjut DNA mitokondria (mtDNA) yang akan mengakibatkan
vicious cycle timbulnya kerusakan dan produksi radikal bebas, salah satunya
apoptosis dan mempercepat penuaan (aging) (Turrens 2003; Tamassia et al.2002;
Cummin 2001 ).
Mitokondria dan Apoptosis
Mitokondria selain berfungsi sebagai tempat penghasil energi (ATP) juga
berperan penting sebagai pengontrol reaksi reduksi oksidasi, homeostasis dan
apoptosis serta aging. Gangguan fungsi mitokondria dalam memproduksi energi
dapat mengakibatkan gangguan pada fungsi lain dari mitokondria, seperti
terjadinya peningkatan apoptosis dari aktivitas normalnya (Vogel 2005; Watson
et al. 1998).
Pada proses implantasi, dinding endometrium mengalami apoptosis pada
waktu sel trofoblas melakukan invasi dan infiltrasi ke dalam endometrium. Selain
itu, sel-sel trofoblas juga mengalami apoptosis pada waktu invasi. Namun jumlah
apoptosis yang meningkat dari normalnya dapat mengakibatkan terjadi kelainan
implantasi atau kebuntingan, seperti preeclamsia (Zhang & Paria 2006; Jauniaux
et al. 2003; Joswig et al. 2003; Thouas et al. 2005).
Apoptosis merupakan suatu proses kematian sel terencana (programmed
cell death) yang dicirikan dengan terjadinya pengerutan sel dan nukleus. Kromatin
nukleus pada proses apoptosis mengalami kondensasi, yang kemudian pecah.
Pecahan ini kemudian dibungkus dalam suatu vesikel, disebut sebagai apoptotic
bodies, yang mengandung pula sisa-sisa organel sel dan fragmen DNA lain, untuk
selanjutnya difagositosis baik oleh sel-sel tetangganya maupun mengalami
Apoptosis terjadi melalui 2 jalur utama yakni (1) jalur ekstrinsik atau
death receptor (DR) pathway, dan (2) jalur intrinsik atau jalur mitokondria. Pada
jalur ekstrinsik, apoptosis dimulai setelah DR pada membran plasma berikatan
dengan protein Fas, suatu glycocylated cell-surface protein dengan berat molekul
42-52 kDa. Reaksi ini akan diikuti oleh apoptotic pathway yang terdiri dari
seperangkat enzim (FAAD, TRADD, caspase 8 dan 10), berfungsi sebagai
penggerak efektor apoptosis (Haupt et al. 2003; Wang 2001).
Pada jalur intrinsik yang terjadi di intraseluler akan muncul inisiasi
apoptosis oleh produksi biokimia yang berasal dari intraseluler stres, seperti
oksidatif stres, perubahan redoks, ikatan kovalen, peroksidasi lipid. Jalur
apoptosis distimulus dari luar yang mengaktifkan caspase untuk menginduksi
lepasnya sitokrom c. Lepasnya sitokrom c akan berikatan dengan Apaf-1, yaitu
protein yang terdapat dalam sitosol yang normalnya merupakan monomer inaktif.
Selanjutnya akan membentuk apoptosom yang melepaskan procaspase 9 dan
menginduksi dilepasnya caspase 3, sehingga sel mengalami apoptosis (Gambar 5)
Gambar 7. Dua jalur apoptosis (jalur ekstrinsik dan intrinsik) (Haupt et al. 2003).
Proses apoptosis tidak menyebabkan terjadinya reaksi inflamasi, namun
prosesnya diinduksi oleh reaksi inflamasi sebelumnya. Apoptosis membutuhkan
energi, tetapi proses ini dapat menghabiskan energi akibat banyaknya pori dari
membran mitokondria yang terbuka, akibatnya sel yang mengalami apoptosis
mempunyai energi (ATP) yang rendah atau menurun (Straszewski-Chavez et al.
2005; Zess 2005).
Tinggi atau rendahnya aktivitas mitokondria berhubungan erat dengan
banyak atau sedikitnya jumlah dan distribusi mitokondria dalam sitoplasma.
Semakin banyak jumlah mitokondria dan pola distribusinya merata didalam
jumlah mitokondria yang sedikit dan pola distribusi yang tidak merata atau
mengelompok menunjukkan aktivitas mitokondria yang terganggu atau terhambat
akibatnya energi atau ATP yang dihasilkan dalam jumlah sedikit. Akibatnya sel
dapat berhenti bekerja dan mengalami apoptosis (Cummins 2001; Tarin et al.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai dari September 2006 sampai dengan Mei
2007, di Laboratorium Embriologi dan Laboratorium Histologi, Departemen
Anatomi, Fisiologi, dan Farmakologi serta Unit Pelaksana Teknis (UPT) Hewan
Laboratorium, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB),
Dramaga Bogor.
Materi Penelitian
Materi penelitian yang digunakan adalah mencit betina (Mus musculus
albinus) dara (6-8 minggu) strain DDY. Mencit dipelihara dalam kandang plastik
yang diberi sekam dan dilengkapi dengan penutup kawat. Pakan dan air minum
diberikan ad libitum.
Rancangan Percobaan
Blastosis mencit dibagi kedalam tiga perlakuan, yaitu: (1) blastosis yang
nidasi cepat (24 jam), (2) blastosis yang nidasi lambat (48 jam) dan (3) blastosis
yang gagal nidasi. Masing-masing kelompok dikultur sampai membentuk
monolayer selama 10 hari, selanjutnya diukur penjuluran sel-sel trofoblas
pertumbuhan (outgrowth), diidentifikasi morfologi sel-sel trofoblas yang
mengalami diferensiasi dan aktivitas NADH-CoQ reductase secara histokimia
serta distribusi mitokondria secara imunositokimia. Masing-masing perlakuan
menggunakan minimal 10 embrio.
Metode Penelitian Koleksi Blastosis
Mencit putih (Mus muculus albino) dara strain DDY disuperovulasi dengan
penyuntikan hormon Pregnant mare’s serum gonadotrophin (PMSG, Folligon®,
Intervet, Netherland) dengan dosis 5 IU/ekor dan 46 jam kemudian disuntik
dengan hormon human chorionic gonadotrophin (hCG, Chorulon®, Intervet,
penyuntikan hCG, mencit betina dikawinkan dengan pejantan dengan
perbandingan jantan : betina 1:1. Mencit betina yang telah dikawini pejantan
dicirikan oleh adanya sumbat vagina (masa perkejuan berwarna putih kekuningan
di dalam lumen vagina) pada 18 jam pasca hCG dan dianggap sebagai hari
pertama kebuntingan. Mencit betina dimatikan 96-98 jam pasca hCG dengan cara
dislocatio cervicalis. Blastosis diperoleh dengan cara membilas (flushing) kedua
kornua uterus dengan menggunakan spuit 1 cc yang berisi medium Modified
Phosphat Buffered Saline (mPBS). Selanjutnya embrio dicuci sebanyak tiga kali
di dalam larutan mPBS (Hogan et al. 1994).
Kultur Blastosis Secara In Vitro
Blastosis yang terkoleksi dimasukkan ke dalam 20 µl medium tetes pada
cawan petri steril yang ditutupi dengan mineral oil. Medium yang dipakai adalah
Tissue Culture Medium (TCM 199 Gibco-BRL) yang diberi gentamicin 50 µg/ml
medium, New Born Calf Serum (NBCS) 20%. Proses kultur dilakukan di dalam
inkubator CO2 5% pada suhu 37°C selama 24-48 jam sampai blastosis mengalami
nidasi. Blastosis yang gagal nidasi dan masih hidup dibantu proses nidasinya
dengan menggunakan enzim pronase 0,05% (Sigma, USA). Kultur selanjutnya
dilakukan dengan menggunakan Dubellco’s Modified Eagles’ Medium (DMEM
Gibco-BRL) yang ditambahkan 50µg/ml gentamicin, NBCS 20%, 1µl/ml ITS
(kandungan insulin 5µg/ml, tranferin 10µg/ml, selenium 5µg/ml; Sigma St Louis
USA) dan ß-mercaptoethanol 14,3 mM (Sigma St Louis USA). Kultur dilakukan
tidak menggunakan feeder layer dari maternal sehingga embrio dapat dianalisa
secara spesifik. Blastosis dikultur selama 10 hari sampai sel-sel trofoblas
membentuk monolayer.
Pengukuran Pertumbuhan (Outgrowth)Sel-Sel Trofoblas
Sel-sel trofoblas dalam medium kultur in vitro akan tumbuh dan melakukan
penjuluran ke arah eksternal (outgrowth). Pengukuran areal pertumbuhan sel-sel
trofoblas menggunakan eyespiece micrometer dengan mengukur panjang
pertumbuhan sel-sel trofoblas mulai dari batas luar ICM sampai batas luar sel
Morfologi Sel Trofoblas yang Berdiferensiasi
Pengamatan morfologi sel-sel trofoblas yang mengalami diferensiasi
dilakukan dengan pewarnaan Giemsa sebagai berikut: Preparat monolayer sel-sel
trofoblas direndam dalam metanol selama 30 menit. Selanjutnya diwarnai dengan
Giemsa selama 10- 15 menit dan dibilas dengan akuades sebanyak tiga kali
selama lima menit, dan diperiksa dibawah mikroskop cahaya (Kiernan 1990).
Aktivitas NADH- CoQ Reductasedengan Pewarnaan Histokimia
Aktivitas NADH-CoQ reductase dideteksi dengan pewarnaan histokimia
yang dilihat dari aktivitas NADH-tetrazolium reductase berdasarkan metode
Malik et al (2000) dengan modifikasi.
Pemeriksaan aktivitas NADH- TR secara histokimia:
a. Monolayer sel-sel blastosis diinkubasi pada suhu 37°C, dalam campuran
pereaksi yang terdiri dari: 0,2 mol/L buffer fosfat (pH 7,4) yang mengandung
0,1 mol/L sodium laktat, 0,1% laktat dehydrogenase (LDH; Boehringer
Mannheim), 0,5 mg/ml NAD (Boehringer Mannheim) dan 0,5 mg/ml
nitroblue tetrazolium (NBT; Boehringer Mannheim), selama 60 menit dalam
suasana gelap.
b. Reaksi enzim NADH-tetrazolium reductase dihentikan dengan mencuci kultur
monolayer sel dengan buffer fosfat 0,05 mol/L. NADH-TR akan mengubah
NBT yang tidak berwarna menjadi produk reduksi yang berwarna biru.
Pengamatan dilakukan terhadap intensitas perbedaan warna biru diantara tiga
kelompok perlakuan.
Penilaian aktivitas NADH-TR dilakukan berdasarkan pengamatan
intensitas warna biru dari nitroblue tetrazolium pada sel-sel trofoblas yakni:
(1) biru tua (2) biru
Warna biru tua yang ditimbulkan menggambarkan bahwa fungsi mitokondria pada
sistem transpor elektron dalam kondisi sangat baik. Bila tidak atau sangat sedikit
menghasilkan warna biru menggambarkan adanya gangguan atau disfungsi pada
mitokondria terutama pada sistem transpor elektron khususnya kompleks I
(NADH-CoQ reduktase) dalam membentuk energi.
Distribusi Mitokondria Sel-Sel Trofoblas Secara Imunositokimia
Aktivitas mitokondria dalam melakukan apoptosis pada sel-sel trofoblas
dideteksi dengan imunositokimia terhadap mitokondria dengan melihat pola
distribusi mitokondria pada sel-sel trofoblas. Imunositokimia terhadap
mitokondria pada sel-sel trofoblas dilakukan dengan prosedur sebagai berikut:
Preparat monolayer sel-sel trofoblas dicuci menggunakan PBS pH 7,4 satu kali
selama lima menit. Dilanjutkan dengan bloking endogenous peroksida
menggunakan 3% H2O2 selama 20 menit. Setelah itu preparat dicuci dengan PBS
pH 7,4 tiga kali masing-masing selama lima menit. Kemudian preparat monolayer
sel-sel trofoblas dilakukan bloking unspesifik protein menggunakan 5% FBS yang
mengandung 0,25% Triton X-100, dicuci dengan PBS pH 7,4 tiga kali
masing-masing selama lima menit. Preparat monolayer sel-sel trofoblas diinkubasi
menggunakan mouse monoklonal anti mitokondria semalam pada suhu 4 °C.
Selanjutnya preparat monolayer sel-sel trofoblas dicuci menggunakan PBS pH 7,4
tiga kali masing-masing selama lima menit. Setelah itu diinkubasi menggunakan
anti mouse conjugated selama satu jam pada suhu ruang. Preparat monolayer
sel-sel trofoblas dicuci dengan PBS pH 7,4 tiga kali masing-masing sel-selama lima
menit, kemudian diinkubasi menggunakan SA-HRP (Strep-Avidin Horse Radis
Peroxidase) selama 40 menit dan dicuci dengan PBS pH 7,4 tiga kali,
masing-masing selama lima menit. Preparat monolayer sel-sel trofoblas ditetesi dengan
DAB (Diamino Benzidine) dan inkubasi selama 10 menit, kemudian dicuci
dengan PBS pH 7,4 tiga kali, masing-masing selama lima menit. Setelah itu
dilakukan pewarnaan menggunakan Mayer Hematoxilin yang diinkubasi selama
10 menit dan dicuci dengan akuades, kemudian diperiksa dibawah mikroskop
Analisis Data
Data tingkat nidasi blastosis dan perlekatan, pertumbuhan (outgrowth) serta
aktivitas NADH-CoQ reductase sel-sel trofoblas diuji dengan analisis keragaman
dan dilanjutkan dengan uji Beda Nyata Terkecil (BNT) menggunakan software
Statistic Analyses System (SAS 2000). Data morfologi sel-sel trofoblas yang
mengalami diferensiasi dan pola distribusi mitokondria sel-sel trofoblas dianalisis
HASIL DAN PEMBAHASAN
Tingkat Kegagalan Nidasi dan Perlekatan Sel-Sel Trofoblas dalam Kultur In Vitro
Nidasi merupakan suatu proses keluarnya blastosis dari zona pelusida
yang membungkusnya. Proses nidasi diawali dengan adanya penambahan ukuran
blastosul, pertambahan jumlah sel-sel trofoblas dan inner cell mass (ICM), yang
selanjutnya berdampak pada semakin besarnya tekanan hidrostatik dari dalam
embrio ke arah zona pelusida dan menyebabkan zona pelusida tersebut semakin
menipis (Dey et al. 2004).
Secara alamiah blastosis mencit akan nidasi pada hari kelima setelah
fertilisasi, tetapi tidak semua blastosis dapat nidasidalam waktu yang sama. Pada
mencit dan tikus terdapat embrio yang terlambat implantasi (delay implantation).
Hal ini disebabkan endometrium belum siap menerima embrio sehingga pada
peristiwa tersebut embrio mengalami dorman namun metabolisme embrio tetap
berjalan sampai embrio mempunyai energi yang cukup untuk proses nidasi,
proliferasi dan pertumbuhan sel-sel trofoblas (Dey et al. 2004; Lee & Demayo
2004).
Hasil pengamatan terhadap 99 blastosis yang dikultur dalam TCM 199
menunjukkan kecepatan nidasi yang berbeda, yaitu terdapat blastosis yang nidasi
dalam waktu 24 dan 48 jam masing-masing sebesar 28% dan 17%, tidak
menunjukkan perbedaan yang nyata. Namun jumlah kedua kelompok perlakuan
tersebut (24 dan 48 jam) menunjukkan perbedaan yang nyata jika dibandingkan
dengan blastosis yang mengalami gagal nidasi sebanyak 55%. Blastosis yang
gagal nidasi dibantu keluar dari zona pelusida menggunakan pronase 0,05%
sehingga sel-sel trofoblas dapat melekat pada dasar cawan petri. Akan tetapi,
blastosis yang nidasi tidak semuanya dapat melakukan perlekatan (attachment).
Hasil pengamatan terhadap 28 blastosis nidasi dalam waktu 24 jam yang mampu
melekat sebanyak 15 (54%) embrio, sedangkan 17 blastosis yang nidasi dalam
waktu 48 jam sebanyak 7 (41%) embrio (Tabel 1). Hal ini menunjukkan bahwa
walaupun secara morfologi blastosis yang dikultur memiliki kualitas sama, namun
Tabel 1 Persentase perkembangan blastosis ke tahap nidasi dan perlekatan pada dasar cawan petri dalam kultur in vitro
Jumlah blastosis (persentase) Waktu nidasi Jumlah blastosis
Nidasi Perlekatan Gagal melekat
24 jam 28(28)a 15(54)a 13(46)a
48 jam 17(17)a 10(59)a 7(41)a
Gagal nidasi
99
54(55)b 12(22)b* 42(78)b
* Setelah perlakuan dengan pronase 0.05%. Superscript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P<0,05).
Hal tersebut disebabkan adanya perbedaan dari kualitas organel-organel
yang terkandung dalam sel-sel embrio yang tidak tampak secara morfologi
dibawah mikroskop cahaya. Salah satu organel yang terkait dengan kemampuan
proses nidasi adalah mitokondria sebagai sumber energi ATP. Energi (ATP)
sangat diperlukan dalam proses nidasi blastosis dan implantasi dalam jumlah yang
tinggi (Balaban et al.2002; Blerkom et al.2006). Semakin banyak energi yang
tersedia maka blastosis dapat memberikan tekanan yang besar terhadap zona
pelusida sehingga menyebabkan zona pelusida menjadi tipis dan elastis dan
embrio dapat dengan mudah keluar.
Kegagalan perlekatan (attachment) sel-sel trofoblas kemungkinan dapat
disebabkan oleh kegagalan sel dalam memproduksi bahan-bahan yang
memperantarai interaksi embrio dengan endometrium, misalnya integrin dan
chaderin (Glass et al. 1983). Namun demikian hal ini perlu dibuktikan lebih
lanjut.
Pertumbuhan dan Diferensiasi Sel-Sel Trofoblas dalam Kultur In Vitro Proses implantasi dalam uterus akan terjadi apabila blastosis mengalami
nidasi, kemudian sel-sel trofoblas melakukan perlekatan (adhesi) pada dinding
endometrium. Sel-sel trofoblas akan berproliferasi dan berdiferensiasi agar dapat
masuk (infiltrasi) dan invasi di dalam endometrium. Dalam lingkungan in vitro
proses implantasi juga diawali dengan blastosis nidasi, diikuti dengan sel-sel
trofoblas melekat (attachment) pada dasar cawan petri (substrat), kemudian sel-sel
atau outgrowth dan membentuk monolayer. Semakin banyak sel-sel trofoblas
yang berproliferasi maka luasan pertumbuhan sel-sel trofoblas akan semakin luas.
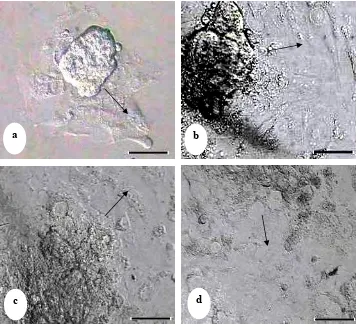
Proses ini mirip dengan invasi pada sistem in vivo. Pertumbuhan sel-sel trofoblas
pada kultur in vitro meluas dengan bentuk radial dan tidak simetris serta condong
meluas pada bagian sisi tertentu. Peristiwa tersebut mirip dengan proses sel-sel
trofoblas masuk ke dalam endometrium (Gambar 7).
Gambar 8 Pertumbuhan sel-sel trofoblas didalam medium kultur in vitro. (a) Hari ke-2, (b) Hari ke-5, (c) Hari ke-7 dan (d) Hari ke-10. Tanda panah menunjukkan arah pertumbuhan sel-sel trofoblas dalam bentuk monolayer yang tidak beraturan. Bar: 100µm.
Kemampuan pertumbuhan sel-sel trofoblas dari blastosis nidasi dan gagal
nidasi sangat berbeda yang ditunjukkan oleh rataan pertumbuhan sel-sel trofoblas.
Hasil pengukuran pada hari ke-10 kultur menunjukkan bahwa rataan pertumbuhan
sel-sel trofoblas yang dihasilkan oleh blastosis nidasi dalam 24 jam mencapai
652,6 ± 306µm, berbeda nyata (P < 0,05) dengan blastosis yang nidasi dalam 48
a b
jam dan gagal nidasi, masing-masing 322,9 ± 87µm dan 180,2 ± 60µm (Tabel 2).
Hal ini menunjukkan bahwa kegagalan nidasi yang terjadi pada individu blastosis
juga berkaitan erat dengan kemampuan pertumbuhan sel khususnya sel-sel
trofoblas.
Tabel 2 Rataan pertumbuhan sel-sel trofoblas
Waktu nidasi
(jam) Jumlah blastosis Rataan ± SB (µm)
24 15 652.6± 306a
48 10 322.9 ± 87b
Gagal nidasi 12 180.2 ± 60 c
Superscript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P<0,05)
Pertumbuhan sel-sel trofoblas dapat dijadikan indikasi dalam menentukan
keberhasilan proses implantasi. Semakin luas pertumbuhan sel-sel trofoblas
menunjukkan kemampuan invasi sel-sel trofoblas yang tinggi. Invasi sel-sel
trofoblas penting untuk membentuk anchoring vili yang menjadi perantara
hubungan antara maternal dan fetus (Jauniaux et al. 2003; Horse et al.2004; James
et al. 2005).
Sel-sel trofoblas merupakan bagian penyusun plasenta yang terdiri dari
berbagai tipe sel hasil diferensiasi sel trofoblas. Sel trofoblas pertama kali
berdiferensiasi menjadi sitotrofoblas. Selanjutnya sitotrofoblas berproliferasi dan
melakukan fusi dengan sesamanya menjadi sinsitiotrofoblas. Selain itu,
sitotrofoblas juga berdiferensiasi menjadi giant trophoblast cell dan
spongiotrofoblas.Pada manusia dan mencit, diakhir kebuntingan sel-sel trofoblas
berdiferensiasi menjadi sel glikogen yang berperan sebagai penyimpanan energi
(Horse et al. 2004: Hashash et al. 2004).
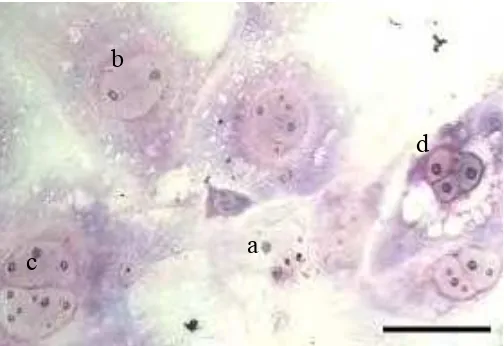
Secara morfologi sel-sel trofoblas mempunyai variasi bentuk, yaitu sel
dengan satu nukleus yang disebut sitotrofoblas. Sel ini bersifat invasif dan
proliferatif. Sedangkan sinsitiotrofoblas mempunyai morfologi dengan banyak
nukleus (dua atau lebih) dan didalamnya terdapat nukleolus yang banyak.
Sinsitiotrofoblas bersifat invasif tetapi tidak proliferatif. Selain itu, terdapat sel
yang memiliki satu nukleus dengan ukuran besar disebut giant trophoblast cell.
Spongiotrofoblas mempunyai morfologi mirip sitotrofoblas dan mempunyai
vakuola yang banyak. Sedangkan sel glikogen trofoblas mempunyai banyak
granul dalam sitoplasmanya (Parast et al. 2001) (Gambar 8).
Gambar 9 Morfologi sel-sel trofoblas yang telah mengalami diferensiasi. (a) Sitotrofoblas, (b) Trophoblast Giant Cell (TGC), (c) Sinsitiotrofoblas, (d) Spongiotrofoblas. Pewarnaan Giemsa. Bar: 100µm.
Hasil penelitian menunjukkan bahwa terdapat perbedaan kemampuan
diferensiasi antara blastosis yang nidasi (24 dan 48 jam) dengan blastosis yang
gagal nidasi. Pada blastosis nidasi (24 dan 48 jam ) ditemukan sekitar 50%
sitotrofoblas, 30% sinsitiotrofoblasdan 15% spongiotrofoblas dari jumlah total sel
yang berdiferensiasi. Sedangkan blastosis yang gagal nidasi mempunyai
kemampuan berdiferensiasi yang rendah, ditunjukan dari hasil pengamatan
terhadap monolayer sel trofoblas yang mengalami diferensiasi menjadi
sinsitiotrofoblas sekitar 10-30%, selebihnya berdiferensiasi menjadi sitotrofoblas
serta tidak ditemukan spongiotrofoblas dan glikogen trofoblas (Babawale et al.
2002; James et al. 2005).
Diferensiasi sel-sel trofoblas penting dalam mempertahankan kebuntingan.
Sinsitiotrofoblas berfungsi sebagai tempat pertukaran nutrisi dari maternal ke
fetus, metabolisme dan sintesis hormon steroid dan peptida yang dibutuhkan
untuk pertumbuhan dan perkembangan fetus, seperti human Chorionic
Gonadotrophin (hCG). Selain itu sinsitiotrofoblas juga menghasilkan ß1
-glycoprotein spesifik, plasminogen activator inhibitor tipe 2, growth hormone,
a
b
c
collagenase, thrombomodulin dan reseptor-reseptor growth factor (Hashash et al.
2004; Nadra et al. 2006;Lunghi et al. 2007).
Giant trophoblast cell penting dalam menghasilkan metalloproteinase dan
mensintesis beberapa kelompok plasental prolactin termasuk placental lactogen
(PL)-I, PL-II dan proliferin yang penting dalam mempertahankan korpus luteum
selama kebuntingan dan menstimulasi produksi progesteron yang penting untuk
perkembangan kelenjar susu dan laktasi. Sel TGC melakukan proses
endoreduplikasi, seperti melanjutkan sintesis DNA tanpa pembelahan sel
(Hashash et al. 2004 ; Nadra et al. 2006; Lunghi et al.2007).
Aktivitas NADH-CoQ Reduktase Sel-Sel Trofoblas
Pada perkembangan embrio dari blastosis sampai pasca implantasi, terjadi
peningkatan kebutuhan energi (ATP). Energi yang diambil berasal dari hasil
fosforilasi oksidasi. Energi (ATP) yang dihasilkan dari reaksi fosforilasi oksidasi
lebih banyak dibandingkan dengan glikolisis atau siklus krebs (Gardner et al.
2002). Dalam proses pembentukkan energi pada fosforilasi oksidasi diperlukan
substrat yang berasal dari salah satu produk siklus asam sitrat (siklus Kreb), yaitu
nicotinamide adenin dinucleotide dehydrogenase (NADH) yang berfungsi sebagai
substrat pada reaksi transduksi energi dalam sistem rantai transpor elektron (RTE)
atau fosforilasi oksidasi. Pelepasan energi NADH terjadi secara bertahap dengan
melibatkan enzim-enzim seperti NADH-CoQ reduktase pada kompleks I.
Hasil identifikasi secara histokimia terhadap aktivitas enzim NADH-CoQ
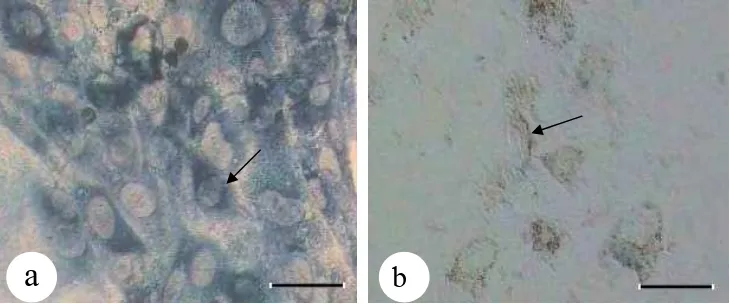
reduktase pada sel-sel trofoblas menunjukkan perbedaan intensitas warna yang
nyata (P < 0,05) antara blastosis yang nidasi 24 dan 48 jam dengan blastosis gagal
nidasi (Tabel 3). Hasil pengamatan terhadap 15 blastosis yang nidasi pada 24 jam
kultur dan 10 blastosis yang nidasi pada 48 jam kultur menunjukkan intensitas
warna biru tua (skor 3) (100%). Disisi lain, 11 dari 12 blastosis yang gagal nidasi
(91,67 %) tidak menunjukkan intensitas warna biru (skor 0) dan hanya satu