IDENTIFIKASI, PROFIL PROTEIN DAN ANALISIS WARNA
FILET DORI
NURFAJRIN NISA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Identifikasi, Profil Protein dan Analisis Warna Filet Dori” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NURFAJRIN NISA. Identifikasi, Profil Protein dan Analisis Warna Filet Dori. Dibimbing oleh TATI NURHAYATI, MALA NURILMALA DAN NURLISA A BUTET.
Filet dori banyak beredar pada swalayan besar, namun kepastian ikan yang digunakan dalam produk filet dori masih belum jelas. Spesies yang digunakan untuk nama dagang dori menurut FDA merupakan Zeus faber, sedangkan pasar Eropa juga memiliki persoalan nama dagang untuk pacific dory, vietnames sole dan fresh water dory yang merupakan Pangasius. Informasi yang disediakan pada label makanan laut sering tidak jelas atau tidak dapat dipertanggungjawabkan. Konsumen sering disajikan ikan yang salah yaitu spesies yang berbeda dari yang mereka bayar. Identifikasi spesies pada filet ikan sangat penting dalam menghadapi kasus economic fraud. Metode analisis molekuler merupakan metode yang akurat untuk identifikasi sehingga perlu diterapkan untuk memperoleh kepastian spesies yang digunakan. DNA mitokondria (mtDNA) telah banyak digunakan untuk identifikasi. Marka gen 16S rRNA dan COI merupakan marka gen mitokondria yang banyak digunakan untuk identifikasi. Filet dori juga memiliki penampakan warna yang berbeda. Warna tersebut mempengaruhi tingkat penerimaan konsumen. Warna merupakan parameter penting yang digunakan untuk mengetahui kualitas produk perikanan. Tujuan penelitian ini adalah (1) mengidentifikasi filet dori secara molekuler menggunakan marka gen 16S rRNA dan COI meliputi penentuan nukleotida spesifik yang menjadi penciri (barcode) tiap filet dori, jarak genetik, dan pohon filogenetik, serta menyimpan runutan nukleotida yang didapat berdasarkan marka gen 16S rRNA dan COI pada genbank, (2) Mempelajari profil protein menggunakan SDS PAGE dan analisis warna yang meliputi pengukuran warna menggunakan chromameter dan konsentrasi mioglobin pada filet dori dan ikan patin.
Hasil identifikasi menunjukkan bahwa spesies yang digunakan adalah Pangasianodon hypophthalmus (KC846907.1) dengan tingkat kesamaan sebesar 98-99%. Jarak genetik pada gen 16SrRNA dan COI antar sampel memiliki kekerabatan yang erat. Marka gen 16S rRNA dan COI menunjukkan terdapat variasi basa nukleotida antar sampel filet dori dan ikan patin. Marka gen 16S rRNA mendapatkan 5 nomor akses dan marka gen COI mendapatkan 7 nomor akses. Hasil penentuan profil protein didapatkan bahwa sampel DI, DM dan DG terdapat pita tambahan pada berat molekul 44,6 kDa. Hasil analisis warna menunjukkan bahwa filet DI dan DG masih baik dan belum mengalami autooksidasi mioglobin.
SUMMARY
NURFAJRIN NISA. Identification, Protein Profile and Color Measurement of Dory Fillets. Supervised by TATI NURHAYATI, MALA NURILMALA and NURLISA A BUTET.
Dory fillets commonly found in supermarkets, but the certainty of fishes are used in product dory fillets still unclear. The species is used to the trade name of dory fillets according to the FDA is Zeus faber, while the experience from European market also occure issues of naming. Some names for pangasius species, such as Pacific dory, Vietnamese sole and fresh water dory, have been misleading. The information that is provided on seafood labels is frequently misleading or fraudulent. Consumers are frequently served the wrong species a completely different with the one they paid for. Species authentication on fish fillet is very important to againts cases of economic fraud. Molecular analysis method is an accurate method for identify, so it is used to the certainty of the species in the fish fillet product. Mitochondrial DNA (mtDNA) has been applied on species identification, genetic markers belong to mtDNA, i,e., 16S rRNA and COI are of the one. Dory fillets has the appearance of a different color that affects the level of consumer acceptance. Color is an important parameter used to know the quality of fishery products. This study was aimed: (1) to identify dory fillet using molecular markers 16S rRNA and COI gene includes determining specific nucleotide that became identifier (barcode) each dory fish fillet, genetic distance, phylogenetic tree and submit the sequence of nucleotides 16S rRNA and COI gene in GenBank, (2) to study protein profile using SDS PAGE and color analysis includes color determination using chromameter and myoglobin extractability of dory fillets and catfish.
The results of identification showed that the samples used in dory fish fillet products is Pangasianodon hypophthalmus (KC846907.1) and the degree of similarity are 98-99%. The genetic distance using 16S rRNA and COI gene between samples had a close relationship. Marka gene of 16S rRNA and COI showed that there are nucleotide variations between samples fillet dori and catfish. Marka gene of 16S rRNA obtain 5 accession numbers and marka gene of COI obtain 7 accession numbers. Results showed at the protein profile determination of sample DI, DM and DG there is an additional band at a molecular weight of 44.6 kDa. Results of the color measurement showed that the fillet of DI and DG still good and has not experienced myoglobin autooxidation.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
IDENTIFIKASI, PROFIL PROTEIN DAN ANALISIS WARNA
FILET DORI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah atas segala Rahmat dan Karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Judul tesis ini
adalah ”Identifikasi, Profil Protein dan Analisis Warna Filet Dori”. Penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Dr Tati Nurhayati SPi MSi, Dr Mala Nurilmala SPi MSi dan Dr Ir Nurlisa A Butet MSc selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dukungan, semangat kepada penulis sehingga penulis dapat menyelesaikan tesis ini.
2. Dr Asadatun Abdullah SPi MSM MSi selaku dosen penguji luar komisi yang telah memberikan bimbingan dan arahan sehingga penulis mampu menyelesaikan tesis ini.
3. Dr Ir Wini Trilaksani MSc selaku perwakilan tim gugus kendali mutu atas saran serta masukannya kepada penulis.
4. Keluarga: Kedua orang tua (Eva Fauziah dan Faruq Cahyono) beserta kakak (Azwar Effendi) dan adik (Illiyin M Yazaka, M Alhakam Yazaka, Nur Fath Aliyah) yang telah memberikan dukungan baik materil maupun spiritual kepada penulis.
5. Teman-teman satu tim penelitian yang saya banggakan (Mbak Lita, Mbak Yustin, Mbak Nuring, Mas Deden, Asya, Lela, Agus, Yuyun, Kak Findra, Kak Panji, Kak Wahyu, Kak Samsul, Lusita, Feby, Dewi). Terimakasih atas bantuan yang tulus. Laboran yang telah membantu penelitian saya (Paqih, Mas Ipul, Mba Dila, Mba Dini dan Bu Ema).
6. Keluarga besar mahasiswa sekolah pascasarjana Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
7. Teman-teman Jamilah yang banyak memberikan motivasi (Rosmely, Atika, Nurma, Mbak Yani, Kak Rina, Teh Yeni, Teh Herly, Mila, Fifit, Anit, Risa, Mbak Anty, Mbak Nurmi, Pei, Elis, Uni Iil, Teh Pera).
8. DIKTI yang telah membiayai pendidikan dan penelitian melalui beasiswa BPPDN.
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Oleh karena itu, jika terdapat kesalahan penulis memohon maaf yang sebesar-besarnya. Penulis sangat mengharapkan kritik dan saran yang membangun sehingga bermanfaat untuk penyelesaian tesis ini.
Akhirnya, semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan 3
Manfaat Penelitian 3
2 METODE PENELITIAN
Waktu dan Tempat 4
Bahan 4
Alat 4
Prosedur Penelitian 5
Prosedur Analisis 6
Identifikasi Secara Molekuler 6
Penentuan Profil Protein dengan SDS PAGE 9
Analisis Warna 10
3 HASIL DAN PEMBAHASAN
Identifikasi Secara Molekuler 12
Penentuan Profil Protein dengan SDS PAGE 17
Analisis Warna 19
4 SIMPULAN DAN SARAN
Simpulan 22
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 29
DAFTAR TABEL
1 Komposisi PCR untuk amplifikasi gen 16S rRNA dan COI 8 2 Kuantitas isolasi DNA filet dori dan ikan patin 12 3 Hasil identifikasi spesies dari filet dori dan ikan patin menggunakan
BLASTn 14
4 Situs nukleotida gen 16S rRNA dan COI pada filet dori dan ikan patin 14 5 Pairwise distance pada gen 16S rRNA dan COI pada filet dori dan
ikan patin 15
6 Nomor akses pada marka gen 16S rRNA dan COI pada filet dori dan
ikan patin 17
7 Hasil pegukuran warna filet dori dan ikan patin 20
8 Indeks kemerahan filet dori dan ikan patin 20
9 Konsentrasi mioglobin (mg/100 g) daging merah dan daging putih
pada filet dori dan ikan patin 21
DAFTAR GAMBAR
1 Tahap identifikasi secara molekuler 5
2 Tahap penentuan profil protein dan analisis warna 6 3 Visualisasi DNA filet dori dan ikan patin menggunakan agarosa 1,2% 13 4 Amplifikasi DNA filet dori dan ikan patin marka menggunakan gen
16S rRNA dan COI 13
5 Konstruksi pohon filogenetik berdasarkan gen 16S rRNA 16 6 Konstruksi pohon filogenetik berdasarkan gen COI 16
7 Profil protein filet dori dan ikan patin 18
DAFTAR LAMPIRAN
1 Dokumentasi sampel filet dori 31
2 Pensejajaran nukleotida gen 16S rRNA antar sampel filet dori dan ikan patin berdasarkan sekuen 602 pb yang dibandingkan dengan P.
hypophthalmus dan Z. faber dari NCBI 32
3 Situs nukleotida spesifik gen 16S rRNA antar sampel filet dori dan ikan patin berdasarkan sekuen 602 pb yang dibandingkan dengan P.
hypophthalmus dan Z. faber dari NCBI 33
4 Situs nukleotida spesifik gen 16S rRNA antar sampel filet dori dan ikan patin berdasarkan sekuen 602 pb yang dibandingkan dengan P.
hypophthalmus dari NCBI 35
5 Situs nukleotida spesifik gen 16S rRNA antar sampel filet dori dan
6 Pensejajaran nukleotida gen COI antar sampel filet dori dan ikan patin berdasarkan sekuen 598 pb yang dibandingkan dengan P.
hypophthalmus dan Z. faber dari NCBI 36
7 Situs nukleotida spesifik gen COI antar sampel filet dori dan ikan patin berdasarkan sekuen 598 pb yang dibandingkan dengan P.
hypophthalmus dan Z. faber dari NCBI 37
8 Situs nukleotida spesifik gen COI antar sampel filet dori dan ikan patin berdasarkan sekuen 598 pb yang dibandingkan dengan P.
hypophthalmus dari NCBI 39
9 Situs nukleotida spesifik gen COI antar sampel filet dori dan ikan
patin berdasarkan sekuen 598 pb 40
1
PENDAHULUAN
Latar Belakang
Filet dori banyak beredar pada swalayan besar, namun kepastian ikan yang digunakan dalam produk filet dori masih belum jelas. Spesies yang digunakan untuk nama dagang dori menurut FDA merupakan Zeus faber (Yanci et al. 2008), sedangkan di Eropa nama dagang untuk pacific dory, vietnames sole dan fresh water dory yang merupakan pangasius masih menjadi persoalan karena nama dagang tersebut menyesatkan (Lee 2006). Ikan dori merupakan ikan air laut yang memiliki nilai ekonomi tinggi, sedangkan ikan patin merupakan ikan air tawar yang memiliki ekonomi rendah (Kuan et al. 2015). Ikan patin sering diubah nama dagangnya menjadi ikan cajun delight catfish, ikan delta fresh catfish, ikan white roughy, ikan pacific dory, dan ikan grouper (Jacquet dan Pauly 2008).
Produk perikanan merupakan salah satu makanan yang paling diminati namun konsumen sering diberikan sedikit atau tidak ada informasimengenai label spesies. Informasi yang disediakan pada label produk perikanan juga sering tidak dapat dipertanggungjawabkan. Konsumen sering diberikan ikan yang salah, yaitu spesies yang berbeda dari yang mereka bayar (Stiles et al. 2011).
Ikan patin Vietnam yang biasa dikenal sebagai basa atau tra, dijual sebagai ikan grouper di Kansas, Baltimore dan Tampa. Di Amerika ikan patin tersebut juga dijual sebagai ikan grouper untuk menghindari tarif lebih pada tahun 2010 (NOAA 2007). Ikan dengan nama dagang atlantic cod telah diganti dengan escolar. Ikan tersebut dapat menyebabkan gejala diare berat, mual, muntah, dan kram perut (Lam 2007). Mislabeling juga terjadi pada ikan monkfish yang ternyata merupakan ikan buntal beracun dan hanya dapat dimakan dengan pengolahan khusus. Ikan beku tersebut diimpor dari California, diproses di Cina, berlabel di Korea dengan lokasi penangkapan yang tidak diketahui (Cohen et al. 2009).
Identifikasi spesies pada filet ikan sangat penting dalam menghadapi kasus commercial fraud, yaitu mengganti spesies yang memiliki nilai komersial tinggi dengan spesies bernilai komersial rendah yang sering dilakukan oleh para produsen. Menurut Jacquet dan Pauly (2008) dorongan finansial merupakan motivasi kuat untuk mengubah nama ikan dengan nama yang lebih menarik. Banyak ikan yang diberi nama baru dan sering mirip dengan ikan yang telah populer. Hal ini tentu saja sangat merugikan konsumen. Pelabelan spesies yang salah tersebut menyebabkan masalah serius dalam hal kesehatan, ekologi, dan ekonomi (Gomes et al. 2014).
2
cytochrome b (Cyt b) (Pepe et al. 2005), 16S rRNA (Mane et al. 2013), dan control region (Johnson dan O’Brien 1997).
Laju mutasi yang cepat pada gen COI dapat mengidentifikasi spesies yang berbeda (Solihin 1994). Gen tersebut banyak digunakan untuk identifikasi spesies, beberapa peneliti melaporkan bahwa COI mengandung cukup variasi sehingga mampu mengidentifikasi secara akurat berbagai macam hewan, termasuk organisme air tawar (Hubert et al. 2008) dan organisme air laut (Ward et al. 2005; Spies et al. 2006). Gen ini juga telah berhasil digunakan dalam identifikasi olahan ikan dan kasus commercial fraud (Cawthorn et al. 2012).
Gen 16S rRNA sering dipakai untuk identifikasi spesies bahkan populasi, baik untuk organisme eukariot dan prokariot (Devereux dan Wilkinson 2004). Pemalsuan olahan ikan pada restoran di Jerman berhasil dideteksi menggunakan 16S rRNA(Kappel dan Schrőder 2016), juga berhasil mendeteksi beberapa produk fish maw (Wen et al. 2015). Gen 16S rRNA dapat digunakan untuk mengidentifikasi hewan laut, tumbuhan, dan bakteri (Baharum dan Nurdalila 2012).
Filet dori yang terdapat di Indonesia berasal dari produksi lokal dan impor yang memiliki karakteristik penampakan daging yang berbeda. Filet dori impor lebih disukai konsumen karena memiliki warna yang lebih putih dibandingkan dori lokal, sedangkan filet dori lokal memiliki warna yang lebih merah. Warna merah tersebut disebabkan oleh adanya protein pigmen mioglobin. Mioglobin diketahui memberikan warna merah pada otot, tergantung turunan dan konsentrasinya (Faustman et al. 1992; postnikova et al. 1999). Stabilitas mioglobin juga mempengaruhi warna daging (Chantai et al. 1998; Chen 2003; Suzuki dan Kisamori 1984). Proses penanganan, penyimpanan ikan, kandungan biokimia, dan mikrobiologi dapat menyebabkan perubahan warna daging (Faustman et al. 1992; O’Grady et al. 2001; Pacheco-Aguilar et al. 2000), penambahan asam dan basa pada perlakuan awal juga mempengaruhi perubahan warna daging (Ochiai et al. 2009). Perubahan warna tersebut dapat dipengaruhi oleh banyak faktor seperti pH, suhu, kekuatan ion dan reaksi oksigen (Renerre dan Labas 1987). Karakteristik penampakan warna filet yang berbeda tersebut perlu dipelajari menggunakan profil protein, pengukuran warna dan konsentrasi mioglobin (Chaijan et al. 2007; Thiansilakul et al. 2011; Nurilmala dan Ochiai 2013).
Perumusan Masalah
3 permasalahan identifikasi dan kepastian pada tingkat spesies bahkan sampai tingkat populasi pada spesies yang sama.
Penipuan dengan mislabeling pada produk olahan berbahan dasar ikan menjadi masalah penting pada industri produk perikanan ditingkat Internasional dan Regional. Mislabeling terjadi ketika salah satu spesies digantikan oleh spesies yang lain (Rasmussen dan Morrissey 2008). Efek merugikan dari mislabeling pada produk berbahan baku ikan yaitu ekonomi dan bahaya kesehatan (Galimberti et al. 2013). Umumnya penyebab terjadinya mislabeling adalah ingin meningkatkan nilai jual dari produk (Von der Heyden et al. 2010). Motif penipuan ekonomi didalam industri makanan laut, telah diungkap berdasarkan pada penggantian spesies dari ikan mahal diganti dengan menggunakan spesies yang lebih murah (Rasmussen dan Morrissey 2008).
Warna daging dari filet dori sangat mempengaruhi tingkat penerimaan konsumen dan harga dari filet tersebut, hal ini merupakan tantangan utama dalam industri pengolahan filet ikan. Warna daging filet yang tidak putih (merah muda atau kuning) menyebabkan harga filet menjadi lebih rendah di pasar (Sørensen 2005), sehingga warna yang tidak diinginkan tersebut umumnya dihilangkan dengan metode fisik misalnya dengan pencucian (Chaijan et al. 2006), pendarahan (bleeding) (Richards dan Hultin 2002; Sakai et al. 2006) dan metode kimia yang bertujuan untuk memutihkan filet yaitu dengan menambahkan hidroperoksida (Huges et al. 1979) dan titanium dioksida (Benjakul et al. 2004). Proses perlakuan pemfiletan yang beragam tersebut menyebabkan karakteristik penampakan yang berbeda, sehingga perlu dipelajari menggunakan profil protein, pengukuran warna dan konsentrasi mioglobin (Chaijan et al. 2007; Thiansilakul et al. 2011; Nurilmala dan Ochiai 2013).
Tujuan Penelitian ini bertujuan untuk :
1. Mengidentifikasi filet dori secara molekuler menggunakan marka gen 16S rRNA dan COI meliputi penentuan urutan nukleotida spesifik yang menjadi penciri (barcode) tiap filet dori, jarak genetik dan filogenetik, serta menyimpan runutan nukleotida yang didapat berdasarkan marka gen 16S rRNA dan COI pada genbank.
2. Mempelajari profil protein menggunakan SDS PAGE dan analisis warna yang meliputi pengukuran warna menggunakan chromameter dan konsentrasi mioglobin pada filet dori dan ikan patin.
Manfaat Penelitian
4
2
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan September 2014 sampai Januari 2016 di Laboratorium Biologi Molekuler Departemen Pengelolaan Sumberdaya Perairan, Laboratorium Karakteristik Bahan Baku, Laboratorium Bioteknologi Hasil Perairan II, Departemen Teknologi Hasil Perairan, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah empat sampel filet dori lokal dan dua filet dori impor yang diambil dari beberapa supermarket yang ada diwilayah Bogor menggunakan teknik random sampling, serta satu ikan patin dari Desa Petir, Bogor, Jawa Barat sebagai kontrol positif karena ikan tersebut diduga merupakan spesies yang digunakan dalam filet dori. Tiga filet dori dari setiap sampel (DI, PU, DN, DL, DG, DS dan DM) digunakan untuk uji pengukuran warna dan konsentrasi mioglobin. Sampel yang telah dikumpulkan disimpan pada suhu -20 ºC sebelum dianalisis molekuler.
Bahan-bahan kimia yang digunakan adalah kit isolasi komersial Dneasy Blood & Tissue Kit (Qiagen), gel agarose 1,2% (Vivantis Inc., US), buffer Tris Acetic EDTA (TAE) 1x (Vivantis Inc., US), primer universal 16S rRNA dan COI, PCR mix Kapa Taq Extra Hot Start Ready Mix PCR Kit (Kapa Biosystems), loading buffer dan marker DNA (Vivantis Inc., US), Separating gel (12,5%), stacking gel (3%), tetrametiletilendiamin (TEMED) dan O-ftatalaldehid (OPA), akuabides, NaNO3, KCN, bufer potasium fosfat 1 N, SDS (Merck, Darmstadt, Germany), glisin (Merck, Darmstadt, Germany), gliserol (Merck, Darmstadt, Germany), ammonium persulfat (APS) (Sigma-Aldrich, Missouri, USA), β -merkaptoetanol (Merck, Darmstadt, Germany), coomassie brilliant blue (Merck, Darmstadt, Germany), metanol (Merck, Darmstadt, Germany), asam asetat glasial (Merck, Darmstadt, Germany), dan bromphenol blue (Merck, Darmstadt, Germany), buffer laemmli 2x (Bio-Rad Laboratories, Inc. US), marker protein 8,8-192 kDa (Nacalai tesque, Inc. Kyoto-Japan). Bahan software yang dipakai adalah CustalW program MEGA 5.05 (Molecular Evolutionary Genetic Analysis), BLASTn (Basic Local Alignment Search Tool nucleotide).
Alat
5
kromameter (minolta CR-310, Konika Minolta, Tokyo, Jepang), sentrifuse (Himac CR 21G, Hitachi, Tokyo, Jepang).
Prosedur Penelitian
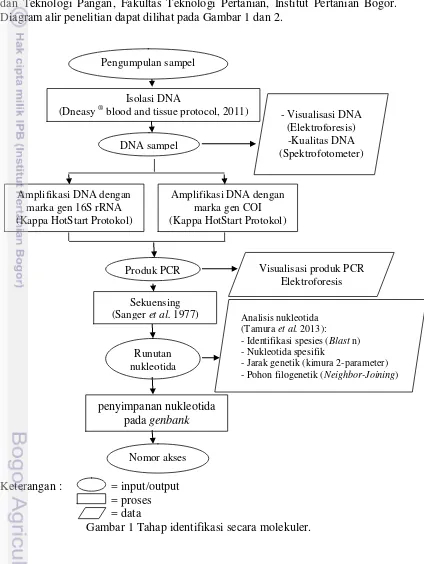
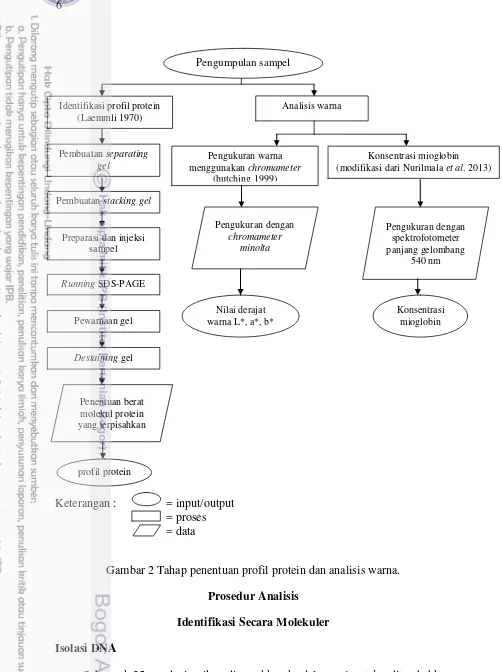
Tahapan penelitian ini meliputi identifikasi secara molekuler, profil protein dan analisis warna pada filet dori. Identifikasi secara molekuler meliputi penentuan nukleotida spesifik yang menjadi penciri (barcode) tiap filet dori, jarak genetik, dan filogenetik berdasarkan marka gen 16S rRNA dan COI. Pengukuran warna menggunakan chromameter dilakukan di Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Diagram alir penelitian dapat dilihat pada Gambar 1 dan 2.
Keterangan : = input/output = proses = data
Gambar 1 Tahap identifikasi secara molekuler.
Isolasi DNA
(Dneasy ® blood and tissue protocol, 2011)
DNA sampel
Amplifikasi DNA dengan marka gen 16S rRNA (Kappa HotStart Protokol)
Produk PCR
Sekuensing (Sanger et al. 1977)
Runutan nukleotida
- Visualisasi DNA (Elektroforesis) -Kualitas DNA (Spektrofotometer)
Visualisasi produk PCR Elektroforesis
Analisis nukleotida (Tamura et al. 2013): - Identifikasi spesies (Blast n) - Nukleotida spesifik
- Jarak genetik (kimura 2-parameter) - Pohon filogenetik (Neighbor-Joining)
Amplifikasi DNA dengan marka gen COI (Kappa HotStart Protokol) Pengumpulan sampel
penyimpanan nukleotida pada genbank
6
Keterangan : = input/output = proses = data
Gambar 2 Tahap penentuan profil protein dan analisis warna. Prosedur Analisis
Identifikasi Secara Molekuler Isolasi DNA
Sebanyak 25 mg daging ikan dimasukkan ke dalam microtube, ditambahkan
180 μL buffer ATL dan 20 μL proteinase K, kemudian divortex selama 10 detik.
Penentuan berat molekul protein yang terpisahkan
Pengukuran dengan
chromameter minolta
Pengukuran dengan spektrofotometer panjang gelombang
540 nm Identifikasi profil protein
(Laemmli 1970)
Pengukuran warna
menggunakan chromameter
(hutching 1999)
Konsentrasi mioglobin (modifikasi dari Nurilmala et al. 2013)
profil protein
Nilai derajat warna L*, a*, b*
Konsentrasi mioglobin
Pembuatan separating
gel
Pembuatan stacking gel
Preparasi dan injeksi sampel
Running SDS-PAGE
Pewarnaan gel
Destaining gel
Pengumpulan sampel
7 Sampel diinkubasi selama 1 jam pada suhu 56ºC (dishake setiap 15 menit).
Sampel ditambahkan 200 μL buffer AL dan diinkubasi selama 10 menit pada suhu 56ºC kemudian ditambahkan 200 μL etanol 96% dan divortex. Sebanyak 600 μL sampel dipindahkan ke dalam Dneasy Mini spin column yang telah ditempatkan pada collection tube kemudian disentrifugasi dengan kecepatan 8.000 rpm selama 1 menit, kemudian larutan dalam collection tube dibuang. Buffer AW1 sebanyak
500 μL ditambakan pada DNeasy Mini spin column, dilanjutkan sentrifugasi dengan kecepatan 8.000 rpm selama 1 menit, kemudian larutan dalam collection tube dibuang. Buffer AW2 sebanyak 500 μL ditambahkan pada DNeasy Mini spin column kemudian disentrifugasi selama 3 menit pada kecepatan 14.000 rpm, setelah proses sentrifugasi, collection tube beserta larutan yang berada didalamnya dibuang. DNeasy Mini spin column ditempatkan pada microtube baru dengan ukuran 1,5 mL dan ditambahkan 100-200 μL buffer AE ke dalam bagian DNeasy membranes. Langkah ini dilanjutkan dengan inkubasi selama 1 menit pada suhu ruang (15-25ºC), kemudian dilakukan sentrifugasi selama 1 menit pada kecepatan 8.000 rpm dan diambil cairannya. Hasil dari ektraksi DNA dilakukan visualisasi. Pengukuran Konsentrasi dan Kemurnian DNA
Konsentrasi DNA dianalisis dengan spektrofotometer, didasarkan pada prinsip iradiasi ultra violet yang diserap oleh nukleotida dan protein dalam larutan. Penyerapan maksimal oleh DNA dicapai pada panjang gelombang 260 nm, sedangkan penyerapan maksimal oleh protein diperoleh pada panjang gelombang 280 nm (Muladno 2010). Pengukuran konsentrasi DNA adalah sebagai berikut:
Konsentrasi DNA (µg/mL) A260 50 faktor pengenceran
Kemurnian DNA ditentukan dengan cara menghitung rasio antara nilai OD (optical density) 260 dan 280 pada sampel DNA yang diukur melalui spektrofotometer. Kemurnian DNA didapatkan berdasarkan perbandingan nilai absorbansi panjang gelombang 260 nm dan 280 nm. Absorbansi maksimal dari nukleotida terjadi pada panjang gelombang 260 nm, sedangkan absorbansi maksimal dari kontaminan protein berada pada panjang gelombang 280 nm (Boyer dan Rodney 2005).
Visualisasi Isolat DNA
Visualisasi DNA dianalisis menggunakan elektroforesis, meliputi: a. Pembuatan gel agarosa 1,2%
Pembuatannya adalah dengan cara melarutkan 1,2 gram bubuk agarosa pada 100 mL buffer TAE 1x, larutan dipanaskan di atas hot plate selama beberapa menit sampai mendidih dan warna larutan menjadi jernih. Larutan didiamkan
selama beberapa menit kemudian ditambahkan 0,5 μL ethidium bromide
kemudian larutan dituangkan dalam cetakan yang telah dipasang electrophoresis comb.
b. Elektroforesis
8
larutan buffer. Sebanyak 2,5 μL hasil ekstraksi DNA ditambahkan 0,20 μL larutan loading dye yang digunakan sebagai pemberat. Larutan tersebut dicampurkan pada plastik steril dan dimasukkan ke dalam sumur gel agarosa. Sebanyak 2,5 μL DNA marker dimasukkan ke dalam salah satu sumur. Alat casting tray kemudian dihubungkan dengan seperangkat alat katoda-anoda. Bagian yang terdapat DNA berada di sisi negatif, DNA bermuatan negatif sehingga ketika alat dijalankan DNA akan bergerak dari kutub negatif ke positif. Alat dijalankan selama 30 menit dan 100 V. Langkah terakhir adalah visualisasi DNA dengan menggunakan sinar UV (elektroforsis DNA genom).
Amplifikasi fragmen gen 16S rRNA dan COI dengan PCR
Amplifikasi fragmen DNA untuk fragmen gen 16S rRNA dan COI menggunakan primer universal untuk beberapa biota akuatik. Komposisi PCR untuk amplifikasi menggunakan PCR mix Kapa Taq Extra Hot Start Ready Mix PCR Kit (Kapa Biosystems) sebanyak 25 µL, komposisi yang digunakan terdapat pada Tabel 1.
Amplifikasi ini menggunakan mesin PCR Termocycler dengan kondisi amplifikasi untuk fragmen gen 16S rRNA dilakukan pada suhu predenaturasi 94ºC selama 3 menit, suhu denaturasi 94ºC selama 45 detik, suhu annealing 46ºC selama 1 menit, suhu elongasi 72ºC selama 1 menit, suhu post PCR 72ºC selama 7 menit, dan suhu penyimpanan 15ºC selama 10 menit. Prosedur ini dilakukan sebanyak 35 siklus.
Tabel 1 Komposisi PCR untuk amplifikasi gen 16S rRNA dan COI
No Bahan Jumlah (µL)
1 ddH2O 9
2 PCR mix 25
3 Primer Forward 3 4 Primer Reverse 3
5 DNA template 10
Kondisi amplifikasi untuk fragmen gen COI dilakukan pada suhu predenaturasi 94ºC selama 3 menit, suhu denaturasi 94ºC selama 45 detik, suhu annealing 54ºC selama 1 menit, suhu elongasi 72ºC selama 1 menit, suhu post PCR 72ºC selama 7 menit dan suhu penyimpanan 15ºC selama 10 menit. Prosedur ini dilakukan sebanyak 35 siklus.
Hasil PCR divisualisasi menggunakan elektroforesis. Sampel PCR sebanyak 2,5 µL dimasukkan ke dalam electrophoresis chamber untuk dimigrasikan selama 60 menit, kemudian divisualisasi di bawah monitor UV. Sampel PCR yang menghasilkan pita yang tebal dan terang dikirimkan ke perusahaan jasa sekuensing untuk dilakukan perunutan nukleotida.
Pensejajaran nukleotida
9 nukleotida menggunakan program MEGA 5.2. Hasil pensejajaran dikomparasi menggunakan Basic Local Alignment Search Tool nucleotide (BLASTn).
Jarak genetik dan kekerabatan
Jarak genetik antar sampel dianalisis menggunakan pairwise distance dengan metode kimura 2-parameter menggunakan program MEGA 5.2, jarak genetik antar sampel dan outgrup sampel yang diambil dari GenBank juga dianalisis. Konstruksi pohon filogenetik dibuat berdasarkan jarak genetik yang sudah dihitung dengan menggunakan metode Neighbor-Joining (NJ) pada program MEGA 5.2.
Penyimpanan nukleotida pada genbank
Bank data nukleotida berupa pangkalan data primer yang digunakan untuk menyimpan sekuen primer dari asam nukleat dan protein. Pangkalan data Genbank dioperasikan oleh National Center for Biotechnology Information (NCBI) yang mengakomodasi semua publikasi sekuen DNA dengan annotations (penjelasan atau catatan) yang akan selalu berkembang dan diperbaharui. Sekuen DNA filet dori berdasarkan marka gen 16S rRNA dan COI disimpan pada situs web Bankit-National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/WebSub/?tool=genbank) dengan mengisikan penjelasan meliputi informasi pribadi, sequence authors, sequencing technology, nucleotide, submission category, source modifiers, features, review & correct.
Penentuan profil protein dengan SDS PAGE (Laemmli 1970)
SDS-Polyacrylamide Gel Electrophoresis (SDS-PAGE) dilakukan untuk menentukan berat molekul protein. Analisis SDS-PAGE dilakukan menggunakan gel akrilamid dengan konsentrasi separating gel 12,5% dan stacking gel 3%. Sampel yang dielektroforesis adalah ekstrak protein larut air. Beberapa tahapan utama yang harus dilakukan dalam melakukan elektroforesis SDS-PAGE adalah a) pembuatan separating gel, b) pembuatan stacking gel, c) persiapan sampel, d) running gel, e) pewarnaan gel, f) destaining gel, dan g) penentuan berat molekul protein-protein yang terpisahkan.
a) Pembuatan separating gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai cetakan gel dirangkai sesuai dengan petunjuk pemakaian. Bahan yang digunakan untuk membuat separating gel adalah 4,8 mL ddH2O, 6,2 ml 30% acrilamid, 3,75 mL 1,5M Tris-HCl (pH 8,8), 150 µ L 10% SDS, 150 µ L 10% APS, 15 µ L TEMED. Bahan tersebut dicampurkan dengan penambahan APS dan TEMED secara urut kemudian dimasukkan sebanyak ±5 mL campuran ke dalam lempengan kaca (mini slab) tanpa menimbulkan gelembung udara dengan menggunakan mikro pipet sampai sekitar 1 cm dari atas lempengan. Bagian yang tidak diisi gel diberi akuades sebanyak ±1 mL untuk meratakan gel yang terbentuk. Gel kemudian dibiarkan mengalami polimerisasi selama 30-60 menit.
b) Pembuatan stacking gel
10
3,7 mL ddH2O; 0,5 mL 30% acrilamid; 0,65 mL 1,5 M Tris-HCl (pH 6,8); 50 µL 10% SDS, 50 µL 10% APS, 5 µL TEMED. Campuran dimasukkan ke dalam mini slab, kemudian sisir dimasukkan dengan cepat tanpa menimbulkan gelembung udara. Stacking gel dibiarkan mengalami polimerisasi selama 30-60 menit. Sisir diangkat dari atas gel dengan perlahan dan slab ditempatkan ke dalam wadah elektroforesis. Bufer elektroforesis dimasukkan ke dalam wadah elektroforesis di bagian dalam dan luar agar gel terendam.
c) Preparasi dan injeksi sampel
Sampel diekstrak proteinnya dengan cara 1 g sampel ditambahkan 3 mL akuades dikocok-kocok kemudian disentrifuse dengan kecepatan 5.000 rpm, suhu 4°C selama 30 menit dan diambil supernatannya. Volume yang sama dari sampel dicampur dengan buffer sampel laemmli. Campuran sampel dan buffer diinkubasi pada 95ºC selama 3 menit. Sampel siap diinjeksikan ke dalam sumur
menggunakan mikropipet sebanyak 5 μL. Salah satu sumur diinjeksikan protein marker sebanyak 5 μL protein marker.
d) Running SDS-PAGE
Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik dinyalakan dan dijaga konstan pada 13 mA dan voltase 150 V selama ±3 jam. Setelah selesai, aliran listrik dimatikan dan katup elektroda dilepaskan, lalu plat gel dipindahkan dari elektroda.
e) Pewarnaan gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah tertutup yang telah berisi pewarna coomasie briliant blue (kurang lebih 20 mL) dan didiamkan selama 2 jam.
f) Destaining gel
Gel diangkat dan dicuci menggunakan akuades beberapa kali. Larutan penghilang warna (destaining solution) ditambahkan dan digoyangkan hingga latar belakang pita protein menjadi terang. Larutan penghilang warna dibuang dan gel siap dianalisis. Gel hasil elektroforesis SDS-PAGE tersebut di dokumentasikan dalam bentuk gambar.
g) Penentuan berat molekul protein yang terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi antara mobilitas relatif protein marker (penanda protein) dengan logaritma dari berat molekul marker yang diketahui. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein diukur dari garis awal separating gel sampai ujung pita protein yang dibandingkan dengan jarak migrasi tracking dye. Mobilitas relatif tersebut dirumuskan sebagai persamaan berikut :
Rf = jarak migrasi protein jarak migrasi tracking dye
Analisis warna
Pengukuran warna menggunakan chromameter (Hutching 1999)
11 pengukuran warna sampel. Sistem warna yang digunakan adalah sistem L, a, dan b.
Sampel diletakkan pada tempat yang tersedia, kemudian tombol start ditekan dan akan diperoleh nilai L, a dan b. Hasil pengukuran dikonversi ke dalam sistem Hunter dengan L menyatakan parameter kecerahan (light) yang mempunyai nilai 0 (hitam) sampai 100 (putih). Nilai L menyatakan cahaya pantul yang menghasilkan warna kromatik putih, abu-abu, dan hitam. Semakin tinggi nilai L maka semakin tinggi kecerahan warna. Notasi a menyatakan warna kromatik campuran merah-hijau dengan nilai +a (positif) dari 0 sampai 80 untuk warna merah dan –a (negatif) dari 0 sampai –80 untuk warna hijau. Notasi b menyatakan warna kromatik campuran kuning-biru dengan nilai +b (positif) dari 0 sampai 70 untuk warna kuning dan nilai –b (negatif) dari 0 sampai –70 untuk warna biru.
Konsentrasi mioglobin (modifikasi dari Nurilmala et al. 2013)
Sebanyak 3 gram sampel ditambahkan dengan 21 mL akuabides dingin (0 – 4ºC) kemudian dihomogenkan selama 1 menit. Setelah itu disentrifuse selama 15 menit dengan kecepatan 3.000 g pada suhu 4ºC. Sebanyak 1 mL ekstrak filet dori dicampur dengan 0,5 mL buffer potasium phosphat (25 mM, pH 7), tambahkan 25 µL NaNO3 5% dan 25 µL KCN 1%. Absorbansi diukur menggunakan spektrofotometer (540 nm). Konsentrasi Mb dihitung menggunakan rumus :
Konsentrasi ( mgg) absorban 2
Keterangan :
11.300 = koefisien molekuler extinction 16.000 = berat molekul mioglobin
Analisis statistik (Steel dan Torrie 1993)
Analisis statistik dilakukan terhadap data yang diperoleh pada analisis warna yang meliputi hasil pengukuran warna menggunakan chromameter dan konsentrasi mioglobin dengan menggunakan perhitungan berdasarkan tingkat kepercayaan 95%. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL), rancangan tersebut digunakan untuk membandingkan pengukuran warna dan konsentrasi mioglobin filet dori yang terdiri dari satu faktor dan tujuh taraf dengan tiga kali ulangan. Data yang diperoleh dianalisis menggunakan analisis ragam, apabila pengaruhnya berbeda nyata maka dilanjutkan dengan uji lanjut least significant difference (LSD). Hipotesis yang digunakan adalah sebagai berikut :
H0: Perbedaan produk filet dori tidak berpengaruh terhadap pengukuran warna dan konsentrasi mioglobin filet dori.
12
Rancangan yang digunakan adalah sebagai berikut :
ij i ij
Y
Keterangan :
Yij = Hasil pengukuran warna dan konsentrasi mioglobin ke-j dengan produk filet dori ke-i
µ = Pengaruh rata-rata dari produk filet dori
τi = Pengaruh produk filet dori ke-i
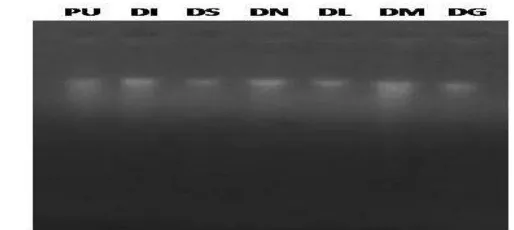
Kuantitas isolasi DNA filet dori dan ikan patin dapat dilihat pada Tabel 2. Kemurnian DNA didapatkan berdasarkan perbandingan nilai absorbansi panjang gelombang 260 nm dan 280 nm.
Tabel 2. Kuantitas isolasi DNA filet dori dan ikan patin
Nama sampel Kode sampel Konsentrasi (ng/µL) 260/280 Patin utuh
Filet dori produksi Jakarta 1 Filet dori produksi Jakarta 2 Filet dori impor 1 1,81-2,60. Sampel PU, DI dan DS memiliki nilai kemurnian lebih dari 2, hal ini dapat terjadi karena adanya kontaminasi RNA. Menurut Santella (2006) rasio absorbansi pada panjang gelombang 260 dan 280 yang berada diatas kisaran nilai DNA murni menunjukkan terdapat kontaminasi RNA, sedangkan rasio dibawah 1,8 menunjukkan adanya kontaminasi protein. Hal ini diduga kurangnya penambahan enzim RNAse, sehingga RNA belum terdegradasi secara sempurna.
13
PU= Patin utuh; DI= Filet dori impor 1; DS= Filet dori produksi Sidoarjo; DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor 2.
Gambar 3 Visualisasi DNA filet dori dan ikan patin menggunakan agarosa 1,2%. Amplifikasi fragmen gen 16S rRNA dan COI dengan PCR
Hasil elektroforegram fragmen gen 16S rRNA dan COI (Gambar 4) memperlihatkan bahwa semua sampel DNA filet dori dan ikan patin berhasil teramplifikasi pada 640 bp untuk 16S rRNA dan 700 bp untuk COI, hal ini sesuai dengan DNA target. Produk PCR tersebut dilanjutkan pada tahap pemurnian dan sekuensing.
(a) (b)
PU= Patin utuh; DI= Filet dori impor 1; DS= Filet dori produksi Sidoarjo; DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor 2.
Gambar 4 Amplifikasi DNA filet dori dan ikan patin (a) marka gen 16S rRNA (b) marka gen COI.
Pensejajaran Nukleotida Gen 16S rRNA dan COI
14
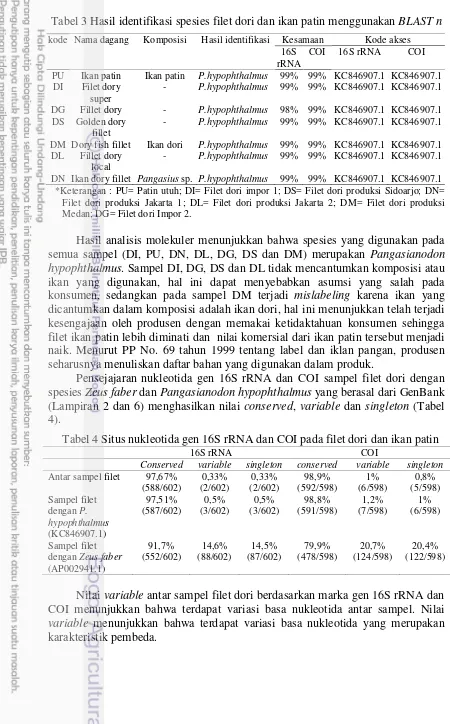
Tabel 3 Hasil identifikasi spesies filet dori dan ikan patin menggunakan BLAST n
kode Nama dagang Komposisi Hasil identifikasi Kesamaan Kode akses
16S *Keterangan : PU= Patin utuh; DI= Filet dori impor 1; DS= Filet dori produksi Sidoarjo; DN=
Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor 2.
Hasil analisis molekuler menunjukkan bahwa spesies yang digunakan pada semua sampel (DI, PU, DN, DL, DG, DS dan DM) merupakan Pangasianodon hypophthalmus. Sampel DI, DG, DS dan DL tidak mencantumkan komposisi atau ikan yang digunakan, hal ini dapat menyebabkan asumsi yang salah pada konsumen, sedangkan pada sampel DM terjadi mislabeling karena ikan yang dicantumkan dalam komposisi adalah ikan dori, hal ini menunjukkan telah terjadi kesengajaan oleh produsen dengan memakai ketidaktahuan konsumen sehingga filet ikan patin lebih diminati dan nilai komersial dari ikan patin tersebut menjadi naik. Menurut PP No. 69 tahun 1999 tentang label dan iklan pangan, produsen seharusnya menuliskan daftar bahan yang digunakan dalam produk.
Pensejajaran nukleotida gen 16S rRNA dan COI sampel filet dori dengan spesies Zeus faber dan Pangasianodon hypophthalmus yang berasal dari GenBank (Lampiran 2 dan 6) menghasilkan nilai conserved, variable dan singleton (Tabel 4).
Tabel 4 Situs nukleotida gen 16S rRNA dan COI pada filet dori dan ikan patin
16S rRNA COI
Conserved variable singleton conserved variable singleton
Antar sampel filet
15 Menurut Hardjamulia et al. (1987) ikan patin jenis P. hypophthalmus yang dalam beberapa tahun terakhir berkembang di Indonesia merupakan ikan yang diintroduksi dari Thailand pada tahun 1972. Ikan patin ini banyak disebut dengan nama patin siam (Sadili 1998). Setelah 40 tahun lebih diintroduksi, ikan patin lokal tidak mengembangkan mutasi nukleotida yang signifikan dibanding ikan patin impor, hal ini menunjukkan bahwa ikan patin mampu mengembangkan daya adaptasi lokal yang tinggi.
Jarak genetik dan kekerabatan
Jarak genetik disajikan pada Tabel 5. Penentuan jarak genetik menggambarkan kedekatan genetik antar spesies maupun intraspesies, persentase jarak genetik dapat digunakan untuk mengetahui status spesies yaitu spesies yang sama atau berbeda spesies (Sahara et al. 2015). Jarak genetik berdasarkan gen 16S rRNA antar kelompok sampel filet dori dengan ikan patin (Pangasianodon hypophthalmus) dari GenBank menunjukkan kesamaan spesies yang tinggi (0-0,3%), sedangkan antar kelompok sampel filet dori dengan ikan dori (Zeus faber) dari GenBank memiliki jarak genetik antara 0-16,2%.
Tabel 5 Pairwise distance gen 16S rRNA dan COI pada filet dori dan ikan patin
Keterangan : PU= Patin utuh; DI= Filet dori impor; DS= Filet dori produksi Sidoarjo; DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor.
Jarak genetik berdasarkan marka gen COI antar kelompok sampel filet dori dengan ikan patin (Pangasianodon hypophthalmus) dari GenBank menunjukkan kesamaan spesies yang tinggi sebesar 0,2-0,5%, sedangkan jarak genetik antar kelompok sampel filet dori dengan ikan dori (Zeus faber) dari GenBank memiliki jarak genetik antara 0,2-24,2%. Menurut Herbert et al. (2003), perbedaan jarak genetik kurang atau sama dengan 3% menunjukkan spesies identik secara molekuler. Menurut Zein dan Fitriana (2012), jarak genetik dalam satu spesies yang rendah dan jarak genetik antar spesies yang tinggi pada COI menunjukkan bahwa gen ini efektif untuk identifikasi pada tingkat spesies dan tepat digunakan sebagai DNA barcode.
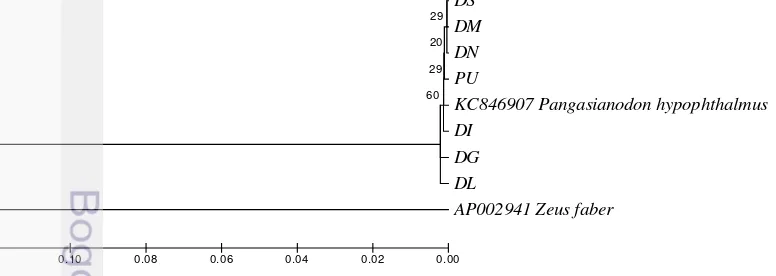
Pohon filogenetik dikonstruksi menggunakan metode neighbor joining tree yaitu model Kimura 2-parameter dengan bootstrap 1.000 kali (Gambar 5 dan 6). Pohon filogenetik dari 16S rRNA memperlihatkan keidentikan yang tinggi antar
16
sampel filet dan sampel dari GenBank kecuali sampel filet dori DI. Pohon filogenetik dari 16S rRNA pada sampel lokal (PU, DL dan DN) dan sampel yang diambil dari GenBank membentuk satu cluster dengan nilai bootstrap sebesar 68%, sedangkan filet impor DI membentuk cluster yang terpisah dari ketiga sampel lokal.
PU=Patin utuh; DI=Filet dori impor 1; DS=Filet dori produksi Sidoarjo; DN=Filet dori produksi Jakarta 1; DL=Filet dori produksi Jakarta 2; DM=Filet dori produksi Medan; DG=Filet dori Impor 2.
Gambar 5 Konstruksi pohon filogenetik berdasarkan gen 16S rRNA.
Menurut Sahara et al. (2015), pengelompokan taksa dalam satu cluster menggambarkan kedekatan kekerabatannya. Semakin tinggi kemiripan urutan nukleotida maka semakin tinggi similiritasnya menyebabkan posisinya ada dalam percabangan pohon filogenetik menjadi berdekatan.
Pohon filogenetik dari COI memperlihatkan cluster pertama dengan nilai bootstrap sebesar 60% terdiri dari sampel DS, DM, DN, PU, sampel yang diambil dari GenBank dan sampel DI, sedangkan sampel DG dan DL terpisah dari semua sampel. Hasil konstruksi pohon filogenetik berdasarkan marka gen 16S rRNA dan COI menunjukkan bahwa marka gen COI lebih mampu menunjukkan perbedaan basa nukleotida dari tiap sampel. Bucklin et al. (2003) menyatakan bahwa COl memiliki laju perubahan sekuens yang tinggi dan memperlihatkan adanya divergensi sekuen intraspesies. Menurut Hebert et al. (2003), COI memiliki rentang sinyal filogenetik yang lebih besar daripada gen mitokondria lainnya, serta memiliki laju mutasi yang lebih tinggi dibandingkan dengan laju mutasi dua gen mitokondria lain seperti 12S rRNA dan 16S rRNA.
PU=Patin utuh; DI=Filet dori impor 1; DS=Filet dori produksi Sidoarjo; DN=Filet dori produksi Jakarta 1; DL=Filet dori produksi Jakarta 2; DM=Filet dori produksi Medan; DG=Filet dori Impor 2.
Gambar 6 Konstruksi pohon filogenetik berdasarkan gen COI.
17 Nilai bootstrap pada pohon filogenetik baik menggunakan marka gen 16S rRNA maupun COI termasuk dalam katergori belum stabil karena suatu cabang dikatakan stabil jika nilai bootstrap diatas 95% dan dikatakan tidak stabil jika nilai bootstrap berada dibawah 70% (Osawa et al. 2004). Menurut Sahara et al. (2015), nilai bootstrap 71% menunjukkan pengelompokan belum stabil sehingga masih bisa berubah posisinya dalam pohon filogenetik.
Penyimpanan nukleotida pada genbank
Hasil penyimpanan nukleotida pada genbank didapatkan nomor akses. Nomor akses pada marka gen 16S rRNA dan COI dapat dilihat pada Tabel 6.
Tabel 6 Nomor akses marka gen 16S rRNA dan COI pada filet dori dan ikan patin Kode
sampel
16S rRNA COI
Nomor akses Nomor akses PU
Keterangan : PU= Patin utuh; DI= Filet dori impor; DS= Filet dori produksi Sidoarjo; DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor.
Penentuan profil protein dengan SDS PAGE
Hasil SDS-PAGE fraksi protein yang diekstrak menggunakan akuades dapat dilihat pada Gambar 7. Gambar tersebut memperlihatkan meskipun spesies yang digunakan dalam produk filet dori sama tetapi memiliki profil pita yang berbeda, hal ini diduga karena adanya penambahan aditif yang berbeda saat proses pencucian filet dori. Klorin umumnya digunakan saat pencucian pada industri filet ikan dori dan pH optimum dari air yang digunakan untuk klorin adalah 6,5-7,5. Menurut Tong thi et al. (2015), tahap pencucian menggunakan klorin umumnya digunakan oleh industri filet patin di Vietnam. Fukuzaki (2006) menambahkan pH optimum yang digunakan untuk klorin adalah 6,5-7,5. pH pencucian yang berbeda dari filet dori diduga menghasilkan profil protein yang berbeda. Menurut Tadpitchayangkoon et al. (2010), perbedaan perlakuan pH pada ikan striped catfish menghasilkan pola profil protein yang berbeda.
18
DG memiliki pita tambahan dengan berat molekul 201,3 yang diduga sebagai myosin heavy chain. Menurut Ladrat et al.(2003), MHC memiliki berat molekul ~200 kDa. MHC diduga ikut terekstrak saat ekstraksi menggunakan akuades karena adanya penambahan asam dan zat aditif garam saat proses pemfiletan dori. Menurut Ngapo et al. (1996) protein miofibril dapat larut pada pH dibawah 4. Wu et al. (2016) juga menambahkan pada pH 5,5; 6,5; dan 7,5 kelarutan protein miofibril meningkat dengan meningkatnya konsentrasi NaCl. Menurut Baylan et al. (2015) protein miosin pada ikan teri terdenaturasi dengan penambahan 8-10% garam (b/v). Orban et al. (2008) menambahkan, zat aditif yang digunakan saat proses pemfiletan umumnya dituliskan pada kemasan, tulisan E 451 (sodium atau potassium triphosphates) pada kemasan menunjukkan adanya penambahan fosfat, senyawa tersebut digunakan untuk menahan air selama proses penyimpanan dingin dan non-fosfat untuk filet yang menggunakan garam. Garam aditif, fosfat, glukosa dan askorbat sering digunakan dalam proses filet ikan (Thorarinsdottir et al. 2004; Esaiassen et al. 2005, Woyewoda dan Bligh 2006).
PU=Patin utuh; DI=Filet dori impor 1; DS=Filet dori produksi Sidoarjo; DN=Filet dori produksi Jakarta 1; DL=Filet dori produksi Jakarta 2; DM=Filet dori produksi Medan; DG=Filet dori Impor 2.
Gambar 7 Profil protein filet dori dan ikan patin.
19 Identifikasi protein sarkoplasma dari berat molekul 27,8, 36, 44,6, 50,8, 55,3 dan 57,8 kDa adalah carbonic anhydrase III, glyceraldehyde-phosphate dehydrogenase (GAPDH), kreatin kinase, enolase, phosphoglucose isomerase dan pyruvate kinase.
Menurut Toyohara et al. (1999) berat molekul 43, 35 dan 50 kDa pada ikan mackerel (Scomber japonicus) merupakan glyceraldehydes-phosphate dehydrogenase (GAPDH), kreatin kinase dan enolase. Nakagawa et al. (1988) menambahkan protein sarkoplasma dengan berat molekul 43 kDa pada ikan red sea bream, pacific mackerel dan carp merupakan kreatin kinase. Menurut Gratacos-Cubarsi dan Lametsch (2008), protein sarkoplasma dengan berat molekul 28 dan 58 kDa diidentifikasi sebagai carbonic anhydrase III dan pyruvate kinase, sedangkan berat molekul 55 kDa pada White croaker (Argyrosomus argentatus) diidentifikasi sebagai phosphoglucose isomerase (Cao et al. 2000).
Identifikasi protein miofibril dari berat molekul 39,2, 110,2 dan 201,3 kDa adalah tropomiosin, paramiosin dan MHC. MHC memiliki berat molekul ~200 kDa dan berat molekul tropomiosin adalah 38,63 (Ladrat et al.2003), sedangkan berat molekul 110 kDa merupakan paramiosin pada kerang jenis Aulacomya ater ater (Molina) (Paredi et al.1998).
Analisis warna
Pengukuran warna menggunakan chromameter
Nilai L* (kecerahan), a* (kemerahan), b* (kekuningan) pada PU, DI, DS, DN, DL, DM dan DG ditunjukkan pada Tabel 7. Sampel DS, DN, DM dan filet patin karawang dan impor (Nurilmala et al. 2015) memiliki nilai a* yang rendah dan nilai b* yang tinggi. Nilai a* yang rendah menunjukkan bahwa filet tersebut telah mengalami autooksidasi mioglobin. Menurut Chen dan Chow (2001) autooksidasi mioglobin dapat menyebabkan meningkatnya nilai L* dan menurunnya nilai a*. Shon et al. (2005) juga menemukan penurunan nilai a* bertepatan dengan meningkatnya tingkat metmioglobin pada ikan ekor kuning. Menurut Thiansilakul et al. (2011) meningkatnya nilai L* bertepatan dengan menurunnya nilai a* pada larutan metmioglobin (autooksidasi mioglobin).
20
Tabel 7 Hasil pengukuran warna filet dori dan ikan patin
Kode sampel L* DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor 2. L= kecerahan, a= kemerahan, b= kekuningan. Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%. 1
Nurilmala et al. (2015), 2 Ochiai et al. (2009).
Nilai indeks kemerahan (redness index (a*/b*)) ditunjukkan pada Tabel 8. Didapatkan nilai indeks kemerahan yang tinggi pada sampel PU, DI, DL dan DG dibandingkan sampel lainnya, nilai indeks kemerahan yang tinggi tersebut menunjukkan bahwa daging sampel tersebut memiliki warna yang tidak gelap.
Tabel 8 Indeks kemerahan filet dori dan ikan patin
Keterangan : PU= Patin utuh; DI= Filet dori impor 1; DS= Filet dori produksi Sidoarjo; DN= Filet dori produksi Jakarta 1; DL= Filet dori produksi Jakarta 2; DM= Filet dori produksi Medan; DG= Filet dori Impor 2. a*/b*= indeks kemerahan. Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%. 1
Nurilmala et al. (2015).
Menurut Ochiai et al. (1988) indeks kemerahan (a*/b*) digunakan untuk mengevaluasi perubahan warna pada daging tuna. Ditambahkan oleh Chaijan dan Panpipat (2009), meningkatnya metmioglobin bertepatan dengan menurunnya
21 indeks kemerahan pada daging selama penyimpanan dingin. Chaijan et al. (2005) melaporkan bahwa indeks kemerahan dari ikan sarden dan makarel menurun ketika waktu penyimpanan meningkat, hal ini menunjukkan penggelapan daging kemungkinan besar disebabkan oleh perubahan pigmen, terutama mioglobin. Konsentrasi mioglobin
Mioglobin memberikan kontribusi utama dalam memberikan warna pada daging, tergantung pada turunan dan konsentrasinya (Faustman et al. 1992; Postnikova et al. 1999). Konsentrasi mioglobin dari filet dori yang diekstrak menggunakan akuades dapat dilihat pada Tabel 9. Pengukuran konsentrasi mioglobin dilakukan pada daging terang (fast muscle) dan daging gelap (dark muscle) pada setiap sampel filet dori.
Nilai konsentrasi mioglobin terendah ada pada DI (filet impor), konsentrasi mioglobin yang rendah umumnya dikaitkan dengan kualitas yang rendah, akan tetapi rendahnya konsentrasi mioglobin pada DI juga diduga karena heme yang merupakan penyebab warna merah sengaja dihilangkan saat proses pemfiletan melalui pencucian dengan penambahan asam. Menurut Tadpitchayangkoon et al. (2010), protein heme dapat dihapus dengan pemisahan daging merah dan daging putih sebelum proses deboning dan pencucian saat pengolahan ikan sehingga warnanya menjadi lebih putih. Kristinsson dan Hultin (2004) menambahkan bahwa mioglobin mudah didenaturasi pada pH rendah, akan tetapi pH rendah tersebut dapat meneybabkan warna daging menjadi coklat kekuningan akibat oksidasi saat denaturasi, hal tersebut menyebabkan ikan terlihat seperti memiliki kualitas rendah. Menurut Nurilmala dan Ochiai (2013) daging yang memiliki kualitas rendah, mioglobin menjadi kurang larut air sehingga sulit diekstrak. Chaijan et al. (2007) dan Renerre et al. (1992) menyatakan, pH yang rendah dapat mengurangi stabilitas dari ikatan antara heme dan globin dan meningkatkan laju autooksidasi.
Tabel 9 Konsentrasi mioglobin (mg/100 g) daging merah dan daging putih pada filet dori dan ikan patin
Kode sampel Daging merah Daging putih PU
22
4
SIMPULAN DAN SARAN
Simpulan
Hasil identifikasi menunjukkan bahwa spesies yang digunakan adalah Pangasianodon hypophthalmus (KC846907.1) dengan tingkat kesamaan sebesar 98-99%. Jarak genetik pada gen 16SrRNA dan COI antar sampel memiliki kekerabatan yang erat. Marka gen 16S rRNA dan COI menunjukkan terdapat variasi basa nukleotida antar sampel filet dori dan ikan patin. Marka gen 16S rRNA mendapatkan 5 nomor akses dan marka gen COI mendapatkan 7 nomor akses. Hasil penentuan profil protein didapatkan bahwa sampel DI, DM dan DG terdapat pita tambahan pada berat molekul 44,6 kDa. Hasil analisis warna menunjukkan bahwa filet DI dan DG masih baik dan belum mengalami autooksidasi mioglobin.
Saran
Identifikasi filet dori selanjutnya sebaiknya menggunakan marka gen COI karena memiliki basa nukleotida yang lebih conserve dalam satu spesies, sedangkan antar spesies memiliki sedikit basa nukleotida yang conserve. Diperlukan penelitian lebih mendalam mengenai batasan maksimum dan minimum konsentrasi mioglobin pada perbedaan penambahaan zat aditif sebagai acuan kualitas filet dori yang mampu diterima, serta korelasi penerimaan konsumen (organoleptik) terhadap warna daging.
DAFTAR PUSTAKA
Arif IA, Khan HA, Bahkali AH, Al Homaidan AA, Al Farhan AH, Al Sadoon M, Shoobrak M. 2011. Review: DNA marker technology for wildlife conservation. Saudi Journal of Biological Sciences. 18:219-225.
Baharum SN, Nurdalila AA. 2012. Application of 16S rDNA and cytochrome b ribosomal markers in studies of lineage and fish populations structure of aquatic species. Molecular Biology Report. 39:5225-5232.
Baylan M, Mazi G, Ozcan N, Ozcan BD, Akar M, Coskun A. 2015. Changes of Electrophoretic Protein Profiles of Smoked and Marinated Rainbow Trout (Oncorhynchus mykiss) During Refrigerated Storage. Journal Of Agricultural Sciences. 21:262-269.
Benjakul S, Visessanguan W, Kwalumtharn Y, The effect of whitening agents on the gel-forming ability and whiteness of surimi. International Journal of Food Science and Technology. 39(7): 773-781.
Boyer, Rodney. 2005. Modern Experimental Biochemistry. Third Edition. India (IN): Pearson Education, Inc.
Brown JR, Beckenbach K, Beckenbach AT, Smith MJ. 1996. Lenght variation heteroplasmy and sequence divergence in the mitochondrial DNA of four species of sturgeon (Acipmer). Genetics. 142:525-535.
23 Cao MJ, Osatomi K, Matsuda R, Ohkubo M, Hara K, Ishihara T. 2000. Purification of a novel serine proteinase inhibitor from the skeletal muscle of white croaker (Argyrosomus argentatus). Biochemical and Biophysical Research Communications. 272:485–489.
Cawthorn DM, Steinman HA, Witthuhn RC. 2012. DNA barcoding reveals a high incidence of fish species misrepresentation and substitution on the South African market. Food Research International. 46:30–40.
Chaijan M, Benjakul S, Visessanguan W, Faustman C. 2006. Physicochemical properties, gel-forming ability and myoglobin content of sardine (Sardinella gibbosa) and mackerel (Rastrelliger kanagurta) surimi produced by conventional method and alkaline solubilisation process. European Food Research and Technology. V222(1):58-63.
Chaijan M, Benjakul S, Visessanguan W, Faustman C. 2007. Characterization of myoglobin from sardine (Sardinella gibbosa) dark muscle. Food Chemistry. 100:156-164.
Chaijan M, Benjakul S, Visessanguan, Faustman C. 2005. Changes of pigments and color in sardine (Sardinella gibbosa) and mackerel (Restrelliger kanagurta) muscle during iced storage. Food Chemistry. 93:607-617.
Chaijan P, Panpipat W. 2009. Post harvest discoloration of dark-fleshed fish muscle: a review. Walailak Journal Science. 6(2):149-166.
Chantai S, Neida H, Ogawa M, Tamiya T, Tsuchiya T. 1998. Effect of heating on autoxidation rate of fish holo and reconstututed myoglobins. Fisheries Science. 64:574-577.
Chen HH. 2003. Effect of cold storage on the stability of chub and horse mackerel myoglobins. Journal of Food Science. 68:1416-1419.
Chen WL, Chow CJ. 2001. Studies on the physico chemical properties of milkfish myoglobin. Journal Food Biochemical. 25:157-174.
Chiu TH, Shu YC, Pai JY, Chang HC. 2012. Molecular markers for detection and diagnosis of the giant grouper (Epinephelus lanceolatus). Food Control. 24:29-37.
Cohen NJ, Deeds JR, Wong ES, Hanner RH, Yancy HF, White KD, Thompson TM, Wahl M, Pham TD, Guichard FM, Huh I, Austin C, Dizikes G, Gerber SI. 2009. Public health response to puffer fish (Tetrodotoxin) poisoning from mislabeled product. Journal of Food Protection. 72(4):810-7.
Devereux R, Wilkinson SS. 2004. Amplification of Ribosomal RNA Sequences. Molecular Microbial Ecology Manual 2nd ed. Netherlands (NL): Kluwer Academic Publishers.
Esaiassen M, Østli J, Joensen SR. 2005. Brining of cod fillets: effects of phosphate, salt, glucose, ascorbate and starch on yield, sensory quality and consumers liking. Lwt-Food Science and Technology. 38:641–649.
Faustman C, Yin MC, Nadeau DB. 1992. Color stability, lipid stability, and nutrient composition of red and white veal. Journal of Food Science. 57:302-306.
Fukuzaki S. 2006. Mechanisms of actions of sodium hypochlorite in cleaning and disinfection processes. Biocontrol Science. 11(4):147–157.
24
Gomes G, Schneider H, Sampaio I, Silva R, Oliveira J, Felipe B, Veneza I. 2014. A barcode for the authentication of the snappers (Lutjanidae) of the western atlantic : rDNA 5s or mitochondrial COI?. Journal Food Control. 38:116-123.
Gratacos-Cubarsi M, Lametsch R. 2008. Determination of changes in protein conformation caused by pH and temperature. Meat Science. 80:545-549. Haard NF. 1992. Biochemistry and Chemistry of Color and Color Change in colour in frozen stored fillets of Norwegian spring-spawning herring (Clupea harengus L.) effects of treatment with ascorbic acid. Food Chemistry. 82:447–453.
Hardjamulia A, Prihadi TH, Subagyo. 1987. Pengaruh salinitas terhadap pertumbuhan dan kelangsungan hidup ikan jambal siam (Pangasius sutchi). Bulletin Penelitian Perikanan Darat. 5:111-117.
Hashimoto K, Watabe S, Kono M, Shiro K. 1979. Muscle protein composition of sardine and mackerel. Bulletin of the Japanese Society of Scientific Fisheries. 45(11):1435-1441.
Hebert PDN, Cywinska A, Ball SL, deWaard JR.. 2003. Biological identifications through DNA barcodes. Proceedings of the Royal Society of London Series B – Biological Sciences. 270:313–321. doi: 10.1098/rspb.2002.2218.
Hubert N, Hanner R, Holm E, Mandrak NE, Taylor E, Burridge M, Watkinson D, Dumont P, Curry P, Bentzen P, Zhang JB, April J, Bernatchez L. 2008. Identifying Canadian freshwater fishes through DNA barcodes. Plos One. 3:2490.
Hughes AR, McCrudden JE, Mayes BJR, penemu; 23 Jan 1979. Process for bleaching dark fish meat, Patent America US 4136204.
Hultin HO, Kelleher SD, Feng Y, Kristinsson HG, Richards M P, Undeland IA. 2004 April 8. High efficiency alkaline protein extraction. Patent America US 20040067551.
Hutching JB. 1999. Food Color and Appearance. Gaithersburg (US): Aspen Publisher. Inc, Maryland.
Jacquet JL, Pauly D. 2008. Trade secrets: renaming and mislabeling of seafood. Journal of Marine Policy. 32:309-318.
Johnson WE, O’Brien SJ. 1997. Phylogenetic reconstruction of the Felidae using 16s rRNA and NADH-5 mitochondrial genes. Journal Molecular Evolution. 44:S98-S116.
Kappel K, Schrőder U. 2016. Substitution of high-priced fish with low-priced species: adulteration of common sole in German restaurants. Food Control. 59:478-486.
25 Kuan J, Tsuei HW, Lin CY, Lin HY, Chung-Wang YJ, Chou HK, Cheng HF. 2015. Development of real-time PCR approach for rapid detection of dory fish (Zeus faber) and catfish (Pangasianodon hypophthalmus) in Foods. Di dalam: Blulmenthal M, Pauli G, editor. Adulteration and Fraud in Food Ingredients and Dietary Supplements; 2015 December 2-4, Rockville, USA. Maryland (US): Botanical Adulterants Monitor. 46.
Ladrat C, Verrez-Bagnis V, Noel J, Fleurence J. 2003. In vitro proteolysis of myofibrillar and sarcoplasmic proteins of white muscle of sea bass (Dicentrarchus labrax L.): effects of cathepsin B, D and L. Food Chemistry. 81:517-525.
Laemmli UK. 1970. Cleavage of structural protein during the assembly of the heat ofbacteriophag T4. Nature. 227(10):680-685.
Lam V. 2007. Oilfish – the case of the imitation Atlantic cod. The Sea Around Us Project Newsletter. 40:1- 2. www.seaaroundus.org/ newsletter/Issue40.pdf Ledword DA 1979. Protein-polysaccharides interactions. Blansshard MV,
Mitchell JR, editor. Sydney (AU): Butterwolih and Co. Ltd. 56-78
Lee D. 2006. Identity crisis: basa, tra products suffer from inconsistent naming. Global Aquaculture Advocate. 20-21. Retrieved from http://www. gaalliance.org/pdf/GAA-Lee-Jun06.pdf.
Mane BG, Mendiratta SK, Tiwari AK, Narayan R. 2013. Sequence analysis of mitochondrial 16S rRNA gene to identify meat species. Journal of Applied Animal Research. 41(1):77-81.
Muladno. 2010. Teknologi Rekayasa Genetika. Edisi kedua. IPB Press. Bogor. 130 hlm.
Nakagawa T, Watabe S, Hashimoto K. 1988. Identification of three major components in fish sarcoplasmic proteins. Nippon Suisan Gakkaishi. 54:999-1004.
[NOAA] National Oceanic and Atmospheric Administration. 2007. Seafood importer and associated corporations receive imprisonment and fines. Retrieved from http://www.publicaffairs.noaa.gov/releases2007/jan07/ noaa07-r101.html.
Ngapo TM, Wilkinson BHP, Chong R. 1996. Ultrastructural changes of myofibrillar protein gelled with 1,5-glucono-delta-lactone at chilled temperatures. Meat Science. 42(1):15-23.
Nurilmala M, Nurhayati T, Syukur AG, Vitner Y, Agus SB, Budiardi T. 2015. Evaluation of nutritional and color on Indonesia and imported patin fish (Pangasius sp.) fillets. Advance Journal of Food Science and Technology. 8(8):576-582.
Nurilmala M, Ochiai Y. 2013. Methods for evaluating the quality of Tuna Meat. Journal of Ocean Technology. 8(Si):24-29.
Nurilmala M, Ushio H, Kaneko G, Ochiai Y. 2013. Assessment of commercial quality evaluation of yellowfin tuna (Thunnus albacares) meat based on myoglobin properties. Food Science Technology. 19(2):237-243.
O’Grady MN, Monahan FJ, Brunton NP. 2001. O ymyoglobin o idation in
bovine muscle-mechanistic studies. Journal of Food Science. 66:386-392. Ochiai Y, Chow CJ, Watabe S, Hashimoto K. 1988. Evaluation of tuna meat
26
Ochiai Y, Chow CJ, Yang JI, Lee PF. 2009. Effect of acid and alkaline pretreatment on the discoloration rates of dark muscle and myoglobin extract of skinned tilapia fillet during iced storage. Food Science and Technology. 75:1481-1488.
Orban E, Nevigato T, di Lena G, Masci M, Casini I, Gambelli L, Caproni R. 2008. New trend in the seafood market. Sutchi catfish (Pangasius hypophthalmus) fillets from vietnam: nutritional quality and safety aspects. Food Chemistry. 110:383-389.
Osawa S, Zhi-Hui S, Imura Y. 2004. Molecular Phylogeny and Evolution of Carabid Graound Beetles. Springer-Verlag Tokyo (JP): SNP Best-set Typesetter Ltd.
Pacheco-Aguilar R, Lugo-Sanchez ME, Robles-Burgueno MR. 2000. Postmortem biochemical characteristic of Monterey sardine muscle stored at 0 °C. Journal of Food Science. 65:40-47.
Paredi ME, Maltio NV, Crupkin M. 1990. Biochemical properties of actomyosin of cold storage striated adductor muscles of Aulacomya ater ater (Molina). Journal of Food Science. 55:1567-1570.
Pepe T, Trotta M, Di Marco I, Cennamo P, Anastasio A, Cortesi ML. 2005. Mitochondrial cytochrome b DNA sequence variation: an approach to fish species identification in processed fish products. Journal of Food Protection. 68:421-425.
Postnikova GB, Tselikova SV, Kolaeva SG, Solomonov NG. 1999. Myoglobin content in skeletal muscles of hibernating ground squirrels rises in autumn and winter. Comparative Biochemistry and Physiology: Part B. 124:35–37. Rasmussen RS, Morrissey MT. 2008. DNA-Based methods for the identification
of commercial fish and seafood species. Comprehensive Reviews in Food Science and Food Safety. 7:280-295.
Renerre M, Anton M, Gatellier P. 1992. Autooxidation of purified myoglobin from two bovine muscles. Meat Science. 32:331-342.
Renerre M, Labas R. 1987. Biochemical factors influencing metmyoglobin formation in beef muscles. Meat Science. 19:151-165.
Richards MP, Hultin HO. 2002. Contributions of blood and blood components to lipid oxidation in fish muscle. Journal of Agricultural and Food Chemistry. 50(3):555-564.
Sadili S. 1998. Marketing of pangasiid catfishes in Java and Sumatra, Indonesia. Di dalam: Legendre M, Parisele A, editor. The biological diversity and aquaculture of clariid and pangasiid in South-East Asia. 1998 Mei 11-15; Cantho, Vietnam. Perancis (FR): Para Graphic.21-26.
Sahara A, Prastowo J, Widayanti R, Kurniasih, Nurcahyo W. 2015. Kekerabatan genetik caplak Rhiphicephalus (Boophilus) microplus asal Indonesia berdasarkan sekuen internal transcribed spacer-2. Jurnal Veteriner. 16(3):310-319.
Sakai T, Ohtsubo S, Minami T, Terayama M. 2006. Effect of bleeding on hemoglobin contents and lipid oxidation in the skipjack muscle. Bioscience, Biotechnology and Biochemistry. 70(4):1006-1008.