UIN SYARIF HIDAYATULLAH JAKARTA
PERBANDINGAN KADAR DAN PROFIL DISOLUSI
SERTA MUTU FISIK TABLET GLIMEPIRID 2 MG
GENERIK DAN GENERIK BERMERK
SKRIPSI
ZAENAB SALSABILA AL-KAFF
1112102000084
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDAYATULLAH JAKARTA
PERBANDINGAN KADAR DAN PROFIL DISOLUSI
SERTA MUTU FISIK TABLET GLIMEPIRID 2 MG
GENERIK DAN GENERIK BERMERK
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ZAENAB SALSABILA AL-KAFF
1112102000084
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi ABSTRAK
Nama : Zaenab Salsabila Al-kaff Program Studi : Farmasi
Judul : Perbandingan Kadar dan Profil Disolusi serta Mutu Fisik Tablet Glimepirid 2 mg Generik dan Generik Bermerek
Glimepirid merupakan senyawa golongan sulfonilurea generasi ketiga yang digunakan untuk pengobatan diabetes melitus tipe II yang pada dosis rendah dapat memberikan onset cepat, durasi kerja yang lama dan efek samping hipoglikemia yang kecil. Glimepirid termasuk dalam Biopharmaceutical Classification System
(BCS) kelas II, yaitu permeabilitas tinggi namun kelarutannya rendah. Penelitian ini dilaksanakan untuk membandingkan mutu sediaan glimepirid. Metode pengambilan sampel yang digunakan dalam penelitian ini adalah purposive sampling. Sampel yang digunakan berjumlah 4 sampel, yaitu satu tablet glimepirid generik dan tiga generik bermerek. Terhadap keempat sampel tersebut dilakukan uji penetapan kadar, uji disolusi dan kualitas fisik berupa organoleptis, kekerasan dan keseragaman kandungan. Penetapan kadar dilakukan dengan menggunakan Kromatografi Cair Kinerja Tinggi (KCKT) dan uji disolusi menggunakan alat tipe II (bentuk dayung) yang berkecepatan 75 rpm dalam medium dapar fosfat pH 7,8. Hasil dari penetapan kadar tablet glimepirid generik, generik bermerek A, B dan C secara berturut-turut yaitu 98,19%, 99,69%, 98,92% dan 101,79%. Hasil dari uji disolusi menunjukkan bahwa keempat sampel tablet memiliki pola profil disolusi yang sama dengan persen kumulatif tablet glimepirid generik, generik bermerek A, B dan C secara berturut-turut adalah 93,79%, 96,34%, 95,17% dan 98,75%. Hasil uji kekerasan tablet glimepirid generik, generik bermerek A, B dan C yaitu 4,46 Kg, 7,33 Kg, 2,34 Kg dan 8,35 Kg. Hal ini menunjukkan bahwa tablet glimepirid generik bermerek B tidak memenuhi persyaratan, namun hal ini tidak mutlak karena tidak ada syarat baku dari buku resmi Farmakope Indonesia untuk uji kekerasan. Berdasarkan data yang diperoleh tidak ada perbedaan mutu dalam hal terpenuhinya syarat baku yang tercantum dalam Farmakope Indonesia edisi V.
vii ABSTRACT
Name : Zaenab Salsabila Al-kaff Program Study : Pharmacy
Title : Comparison of Assay, Dissolution Profile and Physical Quality of Generic and Branded Generic of 2 mg Glimepiride Tablet
Glimepiride is a third generation of sulfonylurea type compound that was used on Type II Diabetes Mellitus on a low dosage that can give a fast onset, long duration of action and small hypoglycemia side effect. Glimepiride was included in Class 2 of Biopharmaceutical Classification System (BCS), which means that it has a low level of solubility. This study was performed to test the quality of glimepiride tablet. The sampling method used in this research was purposive sampling. There were 4 samples that used in this study. 1 sample was a generic glimepiride, while the other 3 were branded generic glimepirides. Four of the samples were given assay test, dissolution profile and physical quality form of organoleptic, hardness and content similarity test. Methods that were used in this study were High Performance Liquid Chromatography (HPLC) method for assay and dissolution test using by type 2 (paddle shape) with 75 rpm speed in a medium of pH 7,8 phosphate buffer. Results from generic glimepiride, branded generic A, B and C tablets assay sequentially are 98,19%, 99,69%, 98,92% dan 101,79%. The dissolution test shows that all samples have the same dissolution profile, with cumulative percentage generic glimepiride, branded generic A, B and C sequentially are 93,79%, 96,34%, 95,17% and 98,75%. Results from hardness test of generic glimepiride and branded generic A, B and C tablets sequentially are 4,46 Kg, 7,33 Kg, 2,34 Kg dan 8,35 Kg. This result shows that branded generic B do not meet the requirement that was needed, however this result is not absolute due to the absence of standard requirement from Indonesian Pharmachopoeia. Based on data that was obtained, there was noquality difference in compliance requirement of the fifth edition ofIndonesianPharmachopoeia.
viii
KATA PENGANTAR
Alhamdulillah, rasa syukur serta pujian senantiasa kita panjatkan kehadirat
Allah SWT yang melimpah rahmat dan hidayah-Nya serta segala anugrah-nya
berupa kesehatan, pemikiran dan ide sehingga penulis dapat menyelesaikan
skripsi ini. Salawat serta salam semoga selalu tercurah kepada junjungan nabi
Muhammad SAW, keluarga, para sahabat dan pengikutnya yang senantiasa
mengikuti sunnahnya hingga akhir zaman.
Skripsi ini penulis susun untuk memenuhi salah satu syarat menempuh
ujian akhir guna memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi
Fakultas Kedokteran dan Imu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. Adapun judul skripsi ini adalah “Perbandingan Kadar dan Profil Disolusi serta Mutu Fisik Tablet Glimepirid 2 mg Generik dan Generik Bermerk”
Penulis menyadari bahwa skripsi ini tidak akan selesai dengan baik tanpa bantuan
dari berbagai pihak. Untuk itu, penulis mengucapkan terima kasih kepada:
1. Drs. Umar Mansur, M.Sc., Apt selaku pembimbing I dan Yuni Anggraeni
M.Farm., Apt selaku pembimbing II, yang telah meluangkan waktu,
tenaga dan pikiran serta dengan sabar membimbing dan mengajari
sehingga penulis dapat menyelesaikan skripsi ini.
2. Prof. Dr. H. Arif Sumantri, M.Kes selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Dr. Nurmeilis, M.Si., Apt selaku ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
4. Dr.Azrifitria, M.Si., Apt selaku Penasehat Akademik yang telah
membimbing dan memberikan saran dalam perkuliahan selama 4 tahun.
5. Ibu dan bapak Dosen serta Staf Akademik Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
6. Staf laboran : Kak Eris, Mba Rani, Kak Lisna, Kak Yaenab, Kak Walid,
Kak Ramadi, Kak Tiwi yang telah membantu penulis dalam
menyelesaikan skripsi ini.
7. Ayahanda tercinta, Ja’far Ahmad Al-kaff dan Ibunda tercinta, Ida Farida
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... x
DAFTAR ISI ... xi
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA ... 4
2.1 Uraian Zat Aktif ... 4
2.1.1 Monografi Zat Aktif ... 4
2.1.2 Efek Farmakologis ... 4
2.1.3 Penggunaan Terapeutik ... 4
2.1.4 Mekanisme Kerja ... 5
2.1.5 Farmakokinetik... 5
2.1.6 Efek Samping ... 6
2.2 Pengertian Generik dan Paten ... 6
2.2.1 Obat Generik ... 6
2.7 Kromatografi Cair Kinerja Tinggi (KCKT) ... 18
2.7.1 Cara Kerja KCKT... 18
2.7.2.5 Wadah Fase Gerak ... 20
2.7.2.6 Fase Gerak ... 20
2.8 Validasi Metode ... 21
xii
BAB 3 METODOLOGI PENELITIAN ... 23
3.1 Tempat dan Waktu Penelitian ... 23
3.2 Alat dan Bahan ... 23
3.2.1 Alat ... 23
3.2.2 Bahan ... 23
3.3 Prosedur Penelitian ... 23
3.3.1 Pengambilan sampel ... 23
3.3.2 Sifat Fisik ... 25
3.3.2.1 Uji Organoleptis ... 25
3.3.2.2 Uji Kekerasan ... 25
3.3.2.3 Keseragaman Kandungan ... 26
3.3.3 Penetapan Kadar ... 26
3.3.3.1 Pembuatan Dapar fosfat ... 26
3.3.3.2 Pembuatan Fase Gerak ... 26
3.3.3.3 Pembuatan Larutan Induk Glimepirid ... 26
3.3.3.4 Penetapan Panjang Gelombang ... 26
3.3.3.5 Verifikasi Metode ... 27
3.3.3.5.1 Linearitas ... 27
3.3.3.5.2 Akurasi... 27
3.3.3.6 Penetapan Kadar ... 27
3.3.4 Uji Disolusi ... 27
3.3.4.1 Pembuatan Larutan Induk ... 27
3.3.4.2 Penentuan Panjang Gelombang Maksimum ... 28
3.3.4.3 Pembuatan Kurva Kalibrasi ... 28
3.3.4.4 Uji Disolusi Sampel Tablet Glimepirid ... 28
BAB 4 HASIL DAN PEMBAHASAN ... 29
4.1 Hasil Evaluasi Sifat Fisik Tablet... 29
4.1.1Organoleptik ... 29
4.1.2 Uji Kekerasan ... 29
4.1.3 Keseragaman Kandungan ... 30
4.2 Penetapan Kadar ... 31
4.2.1 Panjang Gelombang Maksimum dalam Medium Fase Gerak ... 31
4.2.2 Kurva Kalibrasi ... 31
4.2.3 Akurasi ... 31
4.2.4 Penetapan Kadar ... 32
4.3 Uji Disolusi ... 33
4.3.1 Panjang Gelombang Maksimum dalam Medium Fosfat pH 7,8 ... 33
4.3.2 Kurva Kalibasi ... 34
4.3.3 Uji Disolusi ... 34
4.3.4 Analisa Statistik Uji Disolusi ... 36
BAB 5 KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
xiii
xiv
DAFTAR TABEL
Halaman
Tabel 2.1 Kriteria Penerimaan Hasil Uji Disolusi ...15
Tabel 3.1 Tablet Glimepirid Generik Bermerek yang Beredar di Pasaran ...24
Tabel 3.2 Tablet Glimepirid Generik yang Beredar di Pasaran ...25
Tabel 4.1 Hasil Uji Organoleptis ...29
Tabel 4.2 Hasil Uji Kekerasan ...30
Tabel 4.3 Hasil Uji Keseragaman Kandungan ...30
Tabel 4.4 Hasil Uji Akurasi ...32
Tabel 4.5 Hasil Penetapan Kadar ...33
Tabel 4.6 Hasil Uji Disolusi Tablet...35
xv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Glimepirid ...4
Gambar 2.2 Pengaduk Tipe 1 (Bentuk Keranjang ...13
Gambar 2.3 Pengaduk Tipe 2 (Bentuk Dayung) ...14
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alat Uji Disolusi ... 43
Lampiran 2. Spektrofotometri UV-VIS ... 43
Lampiran 3. Kromatografi Cair Kinerja Tinggi ... 44
Lampiran 4. Sonikator ... 44
Lampiran 5. Hardness Tester ... 45
Lampiran 6. Bagan Alur Penelitian ... 45
Lampiran 7. Sertifikat Analisis Natrium Dihidrogen Fosfat ... 46
Lampiran 8. Sertifikat Metanol Grade HPLC ... 47
Lampiran 9. Sertifikat Analisis Standar Glimepirid ... 48
Lampiran 10. Kromatogram Hasil Analisa Standar Glimepirid ... 50
Lampiran 11. Kromatogram Hasil Analisa Sampel ... 51
Lampiran 12. Kurva Kalibrasi Glimepirid Dalam Metanol: Fosfat ... 53
Lampiran 13. Kurva kalibrasi Glimepirid Dalam Fosfat pH 7,8 ... 53
Lampiran 14. Data Kurva Kalibrasi Dalam Metanol: Fosfat ... 54
Lampiran 15. Data Kurva Kalibrasi Dalam Fosfat pH 7,8 ... 54
Lampiran 16. Prosedur Pembuatan larutan yang Digunakan ... 55
Lampiran 17. Hasil Uji Akurasi ... 56
Lampiran 18. Hasil Uji Kekerasan Tablet... 56
Lampiran 19. Data Penetapan Kadar ... 57
Lampiran 20. Keseragaman Kandungan Tablet Generik dan Generik Bermerek A ... 58
Lampiran 21. Keseragaman Kandungan Tablet Bermerek A dan B ... 59
Lampiran 22. Hasil Persen Pelepasan Kumulatif Tablet Inovator ... 60
Lampiran 23. Hasil Persen Pelepasan Kumulatif Tablet Generik ... 61
Lampiran 24. Hasil Persen Pelepasan Kumulatif Tablet Bermerek A ... 62
Lampiran 25. Hasil Persen Pelepasan Kumulatif Tablet Bermerek B ... 63
Lampiran 26. Analisa Statistik Pelepasan Glimepirid ... 64
Lampiran 27. Perhitungan Persen Kadar Uji Penetapan Kadar ... 77
Lampiran 28. Perhitungan Persen Kadar Uji Keseragaman Kandungan ... 77
1
UIN Syarif Hidayatullah
PENDAHULUAN
1.1 Latar Belakang Masalah
Saat ini jenis obat yang beredar di pasaran terbagi atas obat generik dan
obat inovator atau paten. Obat generik ini pun dibagi lagi menjadi 2, yaitu obat
generik dan obat generik bermerk. Obat generik merupakan obat dengan nama
resmi International Nonpropietary Names (INN) yang telah ditetapkan dalam
Farmakope Indonesia atau buku standar lainnya untuk zat berkhasiat yang
dikandungnya. Obat generik bermerek atau bernama dagang merupakan obat
generik dengan nama dagang yang menggunakan nama milik produsen obat yang
bersangkutan. Obat inovator atau paten merupakan obat yang masih memiliki hak
paten dalam jangka waktu tertentu (Permenkes, 2010). Setelah habis masa
patennya, obat yang dulunya paten dengan merk dagangnya kemudian masuk ke
dalam kelompok obat generik bermerk atau obat bermerk (Idris dan Widjajarta,
2006).
Dalam sudut pandang masyarakat biasanya mutu obat generik kurang baik
dibandingkan dengan obat bermerk. Harga obat generik yang terbilang relatif
murah membuat masyarakat tidak percaya bahwa obat tersebut memiliki kualitas.
Kurangnya informasi seputar obat generik adalah salah satu faktor penyebab obat
generik dipandang sebelah mata oleh masyarakat (Idris dan Widjajarta, 2006).
Mutu dijadikan dasar acuan untuk menetapkan kebenaran khasiat (efikasi)
dan keamanan (safety). Mutu suatu sediaan obat dapat ditinjau dari berbagai aspek
antara lain aspek teknologi yang meliputi stabilitas fisik dan kimia dimana sediaan
obat (tablet, kapsul dan sediaan lainnya) harus memenuhi kriteria yang
dipersyaratkan Farmakope (Harianto dkk, 2006). Mutu obat yang berbeda antara
produk-produk obat dari zat berkhasiat sama bisa jadi karena perbedaan formula
yang digunakan, metode dari produk pabrik pembuat yang digunakan, kerasnya
prosedur kontrol kualitas dalam proses pembuatan, dan bahkan metode
penanganan, peralatan, pengemasan dan penyimpanan (Ansel dkk, 1999). Maka
dari itu kontrol kualitas terhadap obat generik sangat penting untuk membantu
UIN Syarif Hidayatullah
tentang obat generik yaitu sebesar 31,9%. Dimana hanya 14,1% yang memiliki
pemahaman mengenai obat generik yang benar, sedangkan 85,9% masih memiliki
pemahaman yang salah mengenai obat generik. Sumber informasi tentang obat
generik sendiri paling banyak diperoleh dari tenaga kesehatan, yaitu sebesar
63,1%. Oleh karena itu, masih sangat dibutuhkan informasi mengenai obat
generik secara strategik terutama di era Jaminan Kesehatan Nasional.
Salah satu obat generik yang beredar dipasaran adalah tablet Glimepirid
(GMP). Glimepirid adalah senyawa golongan sulfonilurea generasi ketiga yang
digunakan untuk pengobatan diabetes melitus tipe II yang pada dosis rendah dapat
memberikan onset cepat, durasi kerja yang lama dan efek samping hipoglikemia
yang kecil. Glimepirid termasuk dalam Biopharmaceutical Classification System
(BCS) kelas II, yaitu permeabilitas tinggi namun kelarutannya rendah (Ammar,
2006). Untuk obat yang mempunyai kelarutan rendah laju disolusi merupakan
tahap penentu pada proses absorpsi obat (Shargel & Yu, 1999; Leuner &
Dressman, 2000). Oleh karena itu dilakukan uji disolusi untuk mengetahui
seberapa banyak persentase zat aktif yang terlarut dan memberikan efek terapi di
dalam tubuh (Syamsuni, 2007).
Parameter penting lain untuk menentukan mutu obat adalah penetapan
kadar zat aktif, yang bertujuan untuk mengetahui apakah kadar zat aktif yang
terkandung di dalam suatu sediaan sesuai dengan yang tertera pada etiket dan
memenuhi syarat seperti yang tertera pada masing-masing monografi. Bila zat
aktif obat tidak memenuhi syarat maka obat tersebut kemungkinan tidak akan
memberikan efek terapi yang optimal, sehingga kedua uji ini merupakan faktor
penting dalam menentukan efektivitas suatu obat dalam tubuh manusia. Hal ini
tidak hanya dapat digunakan sebagai alat utama untuk memantau konsistensi dan
stabilitas produk obat tetapi juga sebagai teknik yang relatif cepat dan murah
untuk memprediksi penyerapan suatu sediaan obat (Zhang et. al, 2010).
Harga tablet Glimepirid generik adalah Rp. 945,- per tablet. Harga tablet
glimepirid inovator adalah Rp. 5.600,- per tablet, Glimepirid generik bermerk A
adalah Rp. 4.500,- per tablet dan generik bermerk B adalah Rp. 4.114,- per tablet.
Dari data tersebut dapat dikatakan bahwa harga tablet glimepirid generik bermerk
UIN Syarif Hidayatullah
pembuat obat tidak perlu menanggung biaya yang tinggi untuk melakukan riset
dan promosi. Sedangkan pada obat generik bermerk atau obat paten memiliki
biaya riset dan operasional yang tinggi dari biaya kemasan hingga promosi
sehingga harganya bisa jauh lebih mahal dari obat generik. Penetapan harga obat
generik sepenuhnya ditentukan pemerintah. Sementara harga obat bermerk dan
paten masih diserahkan pada mekanisme pasar karena di Indonesia belum ada
mekanisme regulasi harga obat (Anwar, 2010).
Untuk memastikan bahwa kualitas produk tablet glimepirid generik tidak
lebih rendah dari kualitas tablet glimepirid bermerek, maka dilakukan penelitian
perbandingan mutu fisik, profil disolusi serta penetapan kadar tablet glimepirid
generik dan generik bermerk.
1.2 Rumusan Masalah
Bagaimana perbandingan kadar, profil disolusi serta mutu fisik sediaan
tablet glimepirid generik dan generik bermerek?
1.3 Hipotesa
Berdasarkan latar belakang di atas, dapat dikemukakan suatu hipotesis
bahwa kadar, profil disolusi serta mutu fisik sediaan tablet glimepirid generik dan
generik bermerek tidak memiliki perbedaan bermakna.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui perbandingan kadar, profil
disolusi serta mutu fisik tablet glimepirid generik dan generik bermerek.
1.5 Manfaat Penelitian
Manfaat Penelitian ini adalah untuk memberikan informasi kepada
masyarakat, apoteker, dokter, perawat dan tenaga kesehatan lain tentang kualitas
4
UIN Syarif Hidayatullah
BAB 2
TINJAUAN PUSTAKA
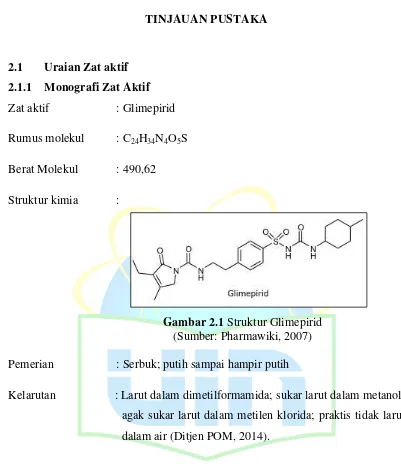
2.1 Uraian Zat aktif 2.1.1 Monografi Zat Aktif
Zat aktif : Glimepirid
Rumus molekul : C24H34N4O5S
Berat Molekul : 490,62
Struktur kimia :
Gambar 2.1 Struktur Glimepirid (Sumber: Pharmawiki, 2007)
Pemerian : Serbuk; putih sampai hampir putih
Kelarutan : Larut dalam dimetilformamida; sukar larut dalam metanol;
agak sukar larut dalam metilen klorida; praktis tidak larut
dalam air (Ditjen POM, 2014).
2.1.2 Efek farmakologis
Glimepirid adalah senyawa golongan sulfonilurea generasi ketiga yang
digunakan untuk pengobatan diabetes melitus tipe II yang pada dosis rendah dapat
memberikan onset cepat, durasi kerja yang lama dan efek samping hipoglikemia
yang kecil.
2.1.3 Penggunaan Terapeutik
Glimepirid merupakan obat hipoglikemik oral golongan sulfonilurea
UIN Syarif Hidayatullah
Diabetes Melitus Tipe 2. Pada DM tipe 2 terjadi defek sekresi insulin dari
pankreas, resistensi insulin di perifer dan gangguan regulasi produksi glukosa hati.
Terapi DM tipe 2 meliputi modifikasi gaya hidup termasuk di dalamnya diet dan
latihan jasmani serta terapi farmakologik berupa obat hipoglikemik oral (OHO)
dan insulin.
2.1.4 Mekanisme Kerja
Glimepiride memiliki efek pankreatik dan ekstrapankreatik. Efek
pankreatik berupa sekresi insulin, terjadi setelah obat ini berikatan dengan
reseptornya di sel Beta dan menyebabkan penutupan KATP channel yang
menimbulkan depolarisasi membran sel dan pelepasan insulin. Meskipun bekerja
melalui mekanisme yang sama, glimepiride terikat pada reseptor yang berbeda
dengan obat golongan sulfonilurea lainnya. Glimepiride terikat pada protein
dengan berat molekul 65 kD sedangkan sulfonilurea berikatan dengan protein
berberat molekul 140 kD. Perbedaan ini menyebabkan glimepiride lebih spesifik
terhadap sulfonilurea receptor (SUR1) pada sel Beta dibandingkan glibenclamide.
Implikasinya adalah turunnya risiko iskemia miokardium. Glimepiride
membutuhkan konsentrasi 3 kali lebih besar dibandingkan glibenclamide untuk
dapat menghambat KATP channel miokardium. Berbeda dari golongan sulfonilurea
lainnya yang meningkatkan sekresi insulin pada fase akut, glimepiride dikatakan
dapat memperbaiki baik fase akut maupun fase lambat sekresi insulin. Meskipun
demikian, dibutuhkan penelitian lebih lanjut untuk memperjelas mekanisme aksi
ini (Paulus W, Ignatia SM., 2004).
2.1.5 Farmakokinetik
Glimepiride diabsorpsi hampir sempurna melalui saluran cerna. Kadar
glimepiride darah akan menurun bila diberikan bersama-sama dengan makanan.
Volume distribusi glimepiride adalah 8,8 L dan berikatan dengan protein plasma
lebih dari 95%. Glimepiride mengalami metabolisme oksidasi di hati terutama
oleh enzim sitokrom P450 II C9. Metabolit glimepirid diekskresi melalui urin
UIN Syarif Hidayatullah
2.1.6 Efek Samping
Gejala saluran cerna dan sakit kepala. Gejala hematologik termasuk
trombositopenia, agranulositosis, dan anemia aplastik dapat terjadi walau jarang
sekali. Glimepirid dapat meningkatkan Anti Diuretik Hormon (ADH), dan dengan
frekuensi sangat jarang menyebabkan hiponatraemia dan fotosensitivitas.
Hipoglikemia dapat terjadi bila dosis tidak tepat atau diet terlalu ketat; juga pada
gangguan fungsi hati atau ginjal atau pada orang usia lanjut (Sukandar, 2008).
2.2 Pengertian Generik dan Paten 2.2.1 Obat Generik
Obat Generik menurut Peraturan Menteri Kesehatan No.
HK.02.02/MENKES/068/I/2010 adalah obat dengan nama resmi International
Nonpropietary Names (INN) yang telah ditetapkan dalam Farmakope Indonesia
atau buku standar lainnya untuk zat berkhasiat yang dikandungnya. Nama generik
ini ditempatkan sebagai judul dari monografi sediaan obat yang mengandung
nama generik tersebut sebagai zat tunggal.
Ada dua macam Obat generik yaitu obat generik tanpa merek dagang dan
obat generik dengan merek dagang. Obat generik bermerek atau bernama dagang
merupakan obat generik dengan nama dagang yang menggunakan nama milik
produsen obat yang bersangkutan (Permenkes, 2010). Satu nama generik dapat
diproduksi berbagai macam sediaan obat dengan nama dagang yang berlainan.
Produksi obat generik merupakan salah satu upaya penyediaan obat yang
bermutu dengan harga yang terjangkau oleh seluruh lapisan masyarakat. Obat
generik umumnya memiliki harga yang lebih murah, beberapa faktor yang
menyebabkan hal tersebut, antara lain:
1. Dalam harga obat nama dagang, terdapat komponen biaya promosi
yang cukup tinggi mencapai sekitar 50% dari HET (Harga Eceran
Tertinggi) baik melalui iklan untuk obat bebas/obat bebas terbatas dan
melalui detailer untuk obat keras, sedangkan obat generik tidak
UIN Syarif Hidayatullah
2. Harga obat dengan nama dagang biasanya ditetapkan berdasarkan
mekanisme pasar dengan memperhitungkan harga kompetitor,
sedangkan harga obat generik lebih didasarkan pada biaya kalkulasi
nyata (Yunarto N., 2010).
3. Harga obat dengan nama dagang biasanya mengikuti harga inovator
dari obat yang sama, sedang obat generik di Indonesia ditetapkan oleh
pemerintah melalui Kementerian Kesehatan (Yunarto N., 2010).
Di Indonesia, pembuatan obat generik maupun obat bermerek oleh Badan
Pengawasan Obat dan Makanan (BPOM) diatur dalam Pedoman Cara Pembuatan
Obat yang Baik (CPOB). Persyaratan registrasi obat sangat ketat, BPOM baru
akan menyetujui obat generik mendapatkan nomor registrasi dan beredar jika
sudah memenuhi syarat seperti: produsen memiliki sertifikat CPOB dari BPOM,
obat tersebut sudah tervalidasi baik proses, maupun analisanya, serta mesin dan
peralatan yang digunakan untuk produksi dan analisa sudah terkualifikasi. Selain
itu produk obat juga harus memenuhi seluruh standar yang digunakan dalam
identitas, kekuatan, kualitas dan kemuraian (Yunarto N., 2010).
Contoh obat generik antara lain Paracetamol, Diazepam, Dekstrometorfan,
Difenhidramin, Chlorpheniramin maleat, Amoksisilin, Eritrnomisin, dan lain -
lain. Sedangkan contoh obat generik bermerek antara lain Amoxsan (amoksisilin),
Voltadex (Natrium diklofenak), dll.
2.2.2 Obat Paten
Menurut Peraturan Menteri Kesehatan No.
HK.02.02/MENKES/068/I/2010 obat paten merupakan obat yang masih memiliki
hak paten. Berdasarkan Undang-Undang Nomor 14 Tahun 2001, paten diberikan
untuk jangka waktu selama 20 (dua puluh) tahun terhitung sejak tanggal
penerimaan dan jangka waktu itu tidak dapat diperpanjang. Selama masa 20 tahun
itulah, perusahan farmasi pemegang hak paten memiliki hak eksluksif di
Indonesia untuk memproduksi obat yang dimaksud.
Setelah habis masa patennya, obat yang dulunya paten dengan merk
dagangnya kemudian masuk ke dalam kelompok obat generik bermerk atau obat
UIN Syarif Hidayatullah
dipasarkan selama 20 tahun pertama tersebut tetap menjadi milik perusahaan yang
dulunya memiliki hak paten atas obat tersebut. Contoh dari obat paten antara lain
Norvasc®, Actic®, Imitrex®, Zymar® dan lain-lain.
2.3 Tablet
Tablet adalah sediaan padat, dibuat secara kempa-cetak berbentuk rata
atau cembung rangkap, umumnya bulat, mengandung satu jenis obat atau lebih
dengan atau tanpa zat tambahan. Zat tambahan yang digunakan dapat berfungsi
sebagai zat pengisi, zat pengikat, zat penghancur, dan zat pelicin (Anief, 1994).
Untuk menjaga mutu tablet tetap sama, dilakukan uji-uji sebagai berikut:
1. Uji Sifat Fisik
1.) Uji keseragaman sediaan
Keseragaman sediaan dapat ditetapkan dengan salah satu dari 2
Pengujian keseragaman kandungan dilakukan jika jumlah zat aktif
kurang dari 50 mg per tablet atau kurang dari 50% dari bobot satuan
sediaan (Siregar, 2008).
2.) Uji Keseragaman Ukuran
Diameter tablet tidak lebih dari 3X dan tidak kurang dari 1⅓ tebal
tablet (Anonim, 1979).Alat yang digunakan adalah jangka sorong. Sebuah
tablet diletakkan pada ujung alat dengan posisi horizontal, digerakkan
jangka sorongnya hingga menyentuh tablet, kemudian diameter tablet
dibaca pada skala.
3.) Uji kekerasan tablet
Pada umumnya tablet harus cukup keras dan tahan pecah waktu
dikemas, dikirim dan waktu penyimpanan tetapi tablet juga harus cukup
UIN Syarif Hidayatullah
dapat dipatahkan dengan jari bila tablet perlu dibagi dalam pemakaiannya.
Tablet diukur kekuatannya dalam kg, pound atau dalam satuan lainnya. Alat
yang digunakan sebagai pengukur kekerasan tablet biasanya adalah
hardness tester (Ansel, 1989).
4.) Uji keregasan tablet
Keregasan tablet dapat ditentukan dengan menggunakan alat
friabilator. Pengujian dilakukan pada kecepatan 25 rpm, tablet dijatuhkan
sejauh 6 inci pada setiap putaran, dijalankan sebanyak 100 putaran. Tablet
ditimbang sebelum dan sesudah diputar, kehilangan berat yang dibenarkan
yaitu lebih kecil dari 0,5% sampai 1% (Lachman, dkk, 1994).
5.) Uji Waktu hancur
Waktu hancur adalah waktu yang dibutuhkan tablet pecah menjadi
partikel-partikel kecil atau granul sebelum larut dan diabsorbsi. Peralatan uji
waktu hancur terdiri dari rak keranjang yang mempunyai 6 tabung yang
terletak vertikal di atas ayakan mesh nomor 10. Selama percobaan, tablet
diletakkan pada tiap lubang keranjang, kemudian keranjang tersebut
bergerak naik turun dalam larutan transparan(Ansel H.C., 1989).
Masing-masing sediaan tablet mempunyai prosedur uji waktu hancur dan
persyaratan tertentu. Uji waktu hancur tidak dilakukan jika pada etiket
dinyatakan tablet kunyah, tablet isap, tablet dengan pelepasan zat aktif
bertahap dalam jangka waktu tertentu (Siregar, 2008).
2. Uji penetapan kadar zat berkhasiat
Uji penetapan kadar zat berkhasiat dilakukan untuk mengetahui
apakah tablet tersebut memenuhi syarat sesuai dengan etiket. Bila kadar obat
tersebut tidak memenuhi syarat maka obat tersebut tidak memiliki efek terapi
yang baik dan tidak layak dikonsumsi. Uji penetapan kadar dilakukan dengan
menggunakan cara-cara yang sesuai pada masing-masing monografi antara
lain di Farmakope Indonesia (Dirjen POM, 1995).
3. Uji disolusi
Obat yang telah memenuhi persyaratan kekerasan, waktu hancur,
keregasan, keseragaman bobot, dan penetapan kadar, belum dapat menjamin
UIN Syarif Hidayatullah
dilakukan pada setiap produksi tablet. Disolusi adalah proses pemindahan
molekul obat dari bentuk padat kedalam larutan pada suatu medium (Dirjen
POM, 1995).
2.4 Penetapan Kadar Tablet
Penetapan kadar zat aktif bertujuan untuk mengetahui apakah kadar zat
aktif yang terkandung di dalam suatu sediaan sesuai dengan yang tertera pada
etiket dan memenuhi syarat seperti yang tertera pada masing-masing monografi.
Bila zat aktif obat tidak memenuhi syarat maka obat tersebut tidak akan
memberikan efek terapi dan juga tidak layak untuk dikonsumsi.
Kromatografi Cair Kinerja Tinggi (KCKT) paling sering digunakan untuk
menetapkan kadar senyawa-senyawa tertentu seperti asam amino,
asam-asam nukleat, dan protein-protein dalam cairan fisiologis; menentukan kadar
senyawa-senyawa aktif obat, produk hasil samping proses sintesis, atau
produk-produk degradasi dalam sediaan farmasi; memonitor sampel-sampel yang berasal
dari lingkungan; memurnikan senyawa dalam suatu campuran; memisahkan
polimer dan menentukan distribusi berat molekulnya dalam suatu campuran;
kontrol kualitas; dan mengikuti jalannya reaksi sintetis.
Dalam penetapan kadar zat aktif untuk glimepirid dapat dilakukan dengan
berbagai macam metode, antara lain:
1. Farmakope Indonesia edisi V (2014)
Metode penetapan kadar untuk tablet glimepirid dilakukan dengan
cara kromatografi cair kinerja tinggi. Dengan menggunakan fasa gerak
natrium fosfat monobasa P yang dilarutkan dalam air dan kemudian diatur
pH nya hingga 2,1-2,7 dengan penambahan asam fosfat 10%, serta
penambahan 500 ml asetonitril P. Pengencer dibuat dengan
mencampurkan asetonitril P-air (9:1). Larutan standar: sejumlah glimepirid
dilarutkan dalam pengencer hingga kadar lebih kurang 0,1 mg/ml. Larutan
uji: 5 tablet dimasukkan ke dalam labu ukur yang sesuai untuk
memperoleh kadar 0,1 mg/ml, berdasarkan jumlah yang tertera pada etiket.
Tambahkan air lebih kurang 10 % dari volume labu, kocok hingga semua
tablet larut. Tambahkan asetonitril P lebih kurang 70% volume labu dan
UIN Syarif Hidayatullah
menit, dengan sesekali dikocok. Biarkan hingga suhu ruang, tambahkan
asetonitril P sampai tanda dan saring. Sistem KCKT yang digunakan pada
metode ini dilengkapi dengan detector 228 nm dan kolom 4 mm x 12,5 cm
berisi bahan pengisi L1. Laju alir lebih kurang 1 ml/menit.
2. Kumar et al (2015) dalam Journal of Chemical and Pharmaceutical Research
Metode penetapan kadar untuk tablet gilmepirid dilakukan dengan
cara kromatografi cair kinerja tinggi. Fasa gerak yang digunakan
merupakan dapar fosfat 25% (7,0 g kalium dihidrogen orto-fosfat
dimasukkan ke dalam labu ukur 1000 ml, dilarutkan dengan air. Adjust
dengan asam fosfat hingga pH 3.0) dan metanol (Grade HPLC) 75%. Fasa
gerak juga dapat digunakan sebagai pengencer. Larutan standar: 10 mg
glimepirid dimasukkan ke dalam labu ukur 100 ml, ditambahkan 70 ml
pengencer dan sonikasi. Tambahkan dengan pengencer yang sama hingga
garis tanda. Dari larutan tersebut dipipet 1,0 ml dan dimasukkan ke dalam
labu ukur 10 ml, ditambahkan dengan pengencer hingga garis tanda untuk
mendapatkan konsentrasi akhir. Larutan uji: 10 mg glimepirid
dimasukkan ke dalam labu ukur 10 ml, ditambahkan 7 ml pengencer dan
sonikasi. Tambahkan dengan pengencer yang sama hingga garis
tanda.pipet 1,0 ml dari larutan dan masukkan ke dalam labu ukur 10 ml,
tambahkan dengan pengencer hingga garis tanda untuk mendapatkan
konsentrasi akhir. Sistem kromatografi yang digunakan dilengkapi dengan
detektor 254nm dan kolom 4,6 x 150 mm; 5 µm. Laju alir lebih kurang 1
mL per menit. Volume injeksi 20 µl.
2.5 Disolusi
Kadar obat dalam darah pada sediaan peroral dipengaruhi oleh proses
absorpsi dan kadar obat dalam darah ini menentukan efek sistemiknya. Obat
dalam bentuk sediaan padat mengalami berbagai tahap pelepasan dari bentuk
sediaan sebelum diabsorpsi. Tahapan tersebut meliputi disintegrasi, deagregasi
dan disolusi. Efektivitas dari suatu tablet dalam melepas obatnya untuk absorpsi
sistemik agaknya bergantung pada laju disintegrasi dari bentuk sediaan dan
UIN Syarif Hidayatullah
laju disolusi dari obat padat tersebut. Seringkali disolusi merupakan tahapan yang
membatasi atau tahap yang mengontrol laju bioabsorpsi obat-obat yang
mempunyai kelarutan rendah, karena tahapan ini seringkali merupakan tahapan
yang paling lambat dari berbagai tahapan yang ada dalam penglepasan obat dari
bentuk sediaannya dan perjalanannya ke dalam sirkulasi sistemik (Martin, 2008).
Proses disolusi merupakan langkah penentu dari proses absorbsi, maka
faktor-faktor yang mempengaruhi kecepatan disolusi akan mempengaruhi
kecepatan absorbsi bahan obatnya. Faktor-faktor yang mempengaruhi kecepatan
disolusi tersebut adalah :
1. Sifat-sifat fisika kimia obat
Sifat-sifat fisika kimia yang mempengaruhi laju disolusi meliputi :
kelarutan, betuk kristal, dan kompleksasi serta ukuran partikel (Shargel
dan Yu, 1999).
2. Faktor formulasi sediaan
Berkaitan dengan bentuk sediaan, bahan pembantu dan pengolahan
(processing). Pengaruh bentuk sediaan pada laju disolusi tergantung pada
kecepatan pelepasan zat aktif yang terkandung di dalamnya (Shargel dan
Yu, 1993).
3. Faktor alat uji disolusi dan parameter disolusi
Dapat meliputi : wadah, suhu, media pelarutan dan alat disolusi yang
digunakan, dan faktor-faktor lain seperti bentuk sediaan, lama
penyimpanan dan kondisi penyimpanan produk (Shargel dan Yu, 1993).
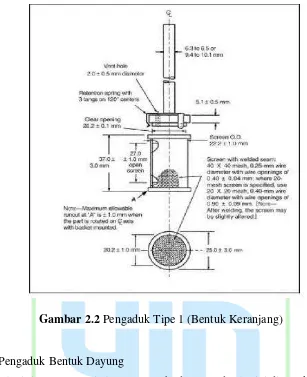
Ada 2 macam alat yang digunakan untuk uji disolusi yaitu jenis alat uji
disolusi dengan pengaduk berbentuk keranjang dan pengaduk berbentuk dayung.
a. Pengaduk Bentuk Keranjang
Alat ini terdiri dari sebuah wadah bertutup yang terbuat dari kaca atau
bahan transparan lain yang inert, suatu motor, suatu batang logam yang
digerakkan oleh motor dan keranjang berbentuk silinder. Sebagian wadah
tercelup di dalam suatu tangas air yang berukuran sedemikian sehingga
UIN Syarif Hidayatullah
pengujian berlangsung dan menjaga agar gerakan air dalam tangas air
halus dan tetap (Dirjen POM, 1995).
Gambar 2.2 Pengaduk Tipe 1 (Bentuk Keranjang)
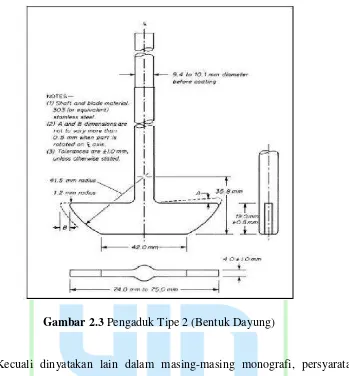
b. Pengaduk Bentuk Dayung
Alat ini sama seperti alat pertama, bedanya pada alat ini digunakan dayung
yang terdiri dari daun dan batang sebagai pengaduk. Sejumlah volume
media disolusi seperti yang tertera dalam masing-masing monografi
dimasukkan ke dalam wadah, pasang alat, biarkan media disolusi hingga
suhu 37oC ± 0,5o, dan angkat termometer. Masukkan 1 tablet atau 1 kapsul
ke dalam alat, hilangkan gelembung udara dari permukaan sediaan yang
diuji dan alat dijalankan pada laju kecepatan sesuai dengan yang tertera
pada masing-masing monografi. Dalam interval waktu yang ditetapkan
atau pada tiap waktu yang dinyatakan, cuplikan yang diambil adalah
UIN Syarif Hidayatullah
disolusi dan bagian atas dari keranjang berputar atau daun dari alat
dayung.
Gambar 2.3 Pengaduk Tipe 2 (Bentuk Dayung)
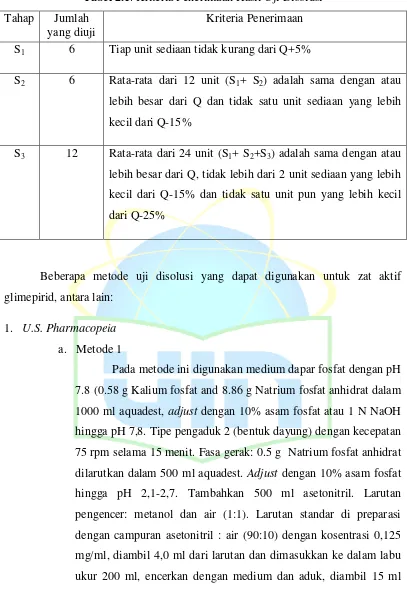
Kecuali dinyatakan lain dalam masing-masing monografi, persyaratan
dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan
tabel penerimaan. Pengujian dilanjutkan sampai tiga tahap kecuali bila hasil
pengujian memenuhi tahap S1 atau S2. Harga Q adalah jumlah zat aktif yang
terlarut seperti yang tertera dalam masing-masing monografi, dinyatakan dalam
persentase kadar pada etiket, angka 5% dan 15% dalam tabel adalah persentase
kadar pada etiket, dengan demikian mempunyai arti yang sama dengan Q (Dirjen
UIN Syarif Hidayatullah
Tabel 2.1. Kriteria Penerimaan Hasil Uji Disolusi Tahap Jumlah
lebih besar dari Q, tidak lebih dari 2 unit sediaan yang lebih
kecil dari Q-15% dan tidak satu unit pun yang lebih kecil
Pada metode ini digunakan medium dapar fosfat dengan pH
7.8 (0.58 g Kalium fosfat and 8.86 g Natrium fosfat anhidrat dalam
1000 ml aquadest, adjust dengan 10% asam fosfat atau 1 N NaOH
hingga pH 7,8. Tipe pengaduk 2 (bentuk dayung) dengan kecepatan
75 rpm selama 15 menit. Fasa gerak: 0.5 g Natrium fosfat anhidrat
dilarutkan dalam 500 ml aquadest. Adjust dengan 10% asam fosfat
hingga pH 2,1-2,7. Tambahkan 500 ml asetonitril. Larutan
pengencer: metanol dan air (1:1). Larutan standar di preparasi
dengan campuran asetonitril : air (90:10) dengan kosentrasi 0,125
mg/ml, diambil 4,0 ml dari larutan dan dimasukkan ke dalam labu
ukur 200 ml, encerkan dengan medium dan aduk, diambil 15 ml
dari larutan dan dimasukkan ke dalam labu ukur 50 ml, encerkan
dengan larutan pengencer hingga garis tanda dan aduk. Sehingga
UIN Syarif Hidayatullah
Larutan sampel: diambil sekitar 10 ml larutan uji dan dipindahkan
ke tabung sentrifuge. Sentrifuge selama 5 menit pada 2500 rpm.
Dipipet 3,0 ml dari supernatan dan dimasukkan ke dalam labu ukur
10 ml, encerkan dengan larutan pengencer hingga garis tanda, dan
aduk. Sistem kromatografi yang digunakan dilengkapi dengan
detektor UV 228 nm. Kolom: 4.0-mm × 12.5-cm; L1. Laju alir 1,0
ml/menit. Volume injeksi 50 µ L.
b. Metode 2
Jika produk sesuai dengan tes ini, pada pelabelannya menunjukkan
bahwa memenuhi disolusi USP metode 2. Medium: pH 7,8 dapar
fosfat (tambahkan 250 mL 0,2 M Kalium fosfat ke dalam 223 ml
0,2 M NaOH, encerkan dengan aquadest hingga 1 L, adjust dengan
0,2 M NaOH atau asam fosfat hingga pH 7,8 ; 900 ml. Tipe
pengaduk 2 dengan kecepatan 75 rpm selama 45 menit. Dapar pH
5,3: 4,0 g/L amonium asetat dalam aquadest, adjust dengan asam
asetat hingga pH mencapai 5,3. Fase gerak: asetonitril dan dapar
pH 5,3 (1:1). Pengencer: metanol dan asetonitril (1:1). Larutan
induk standar: 0,22 mg/ml glimepirid dalam pengencer. Larutan
standar: (L/1000) mg/ml dalam medium, dari larutan induk standar.
Dimana L adalah berat (mg) tablet dalam label. Dari larutan uji
diambil beberapa ml larutan kemudian disaring dengan penyaring
yang cocok. Sistem kromatografi yang digunakan dilengkapi
dengan detektor UV 225 nm. Kolom: 4.6-mm × 10-cm; 5- µm; L1.
Laju alir 1,3 ml/menit. Volume injeksi 100 µL.
2. Induri M., et al dalam Journal of Chemistry
Dalam jurnal ini uji disolusi dilakukan dengan menggunakan medium 900
ml dapar fosfat pH 7,8. Tipe pengaduk 2 dengan kecepatan 75 rpm selama 30
menit. Larutan induk standar: 10,0 mg standar dimasukkan ke dalam labu ukur
100 ml, sejumlah 30 ml NaOH ditambahkan kedalam labu dan sonikasi.
Tambahkan metanol hingga garis tanda. Larutan sampel: Dari larutan uji diambil
UIN Syarif Hidayatullah
diamati di spektrofotometri UV-VIS yang diukur pada panjang gelombang 225
nm.
2.6 Spektorfotometri Ultraviolet
Spekrofotometer sesuai dengan namanya adalah alat yang terdiri dari
spektrometer dan fotometer. Spektrometer menghasilkan sinar spektrum dengan
panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya
yang ditransmisikan atau yang diabsorpsi. Jadi, spektrofotometer digunakan untuk
mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan,
atau diemisikan sebagai fungsi panjang gelombang (Khopkar, 2008). Bila cahaya
(monokromatik maupun campuran) jatuh pada suatu medium homogen, sebagian
dari sinar masuk akan dipantulkan sebagian diserafp dalam medium itu, dan
sisanya diteruskan (Basset, dkk., 1994).
Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan
visual, yang dengan studi lebih mendalam dari absorpsi energi radiasi oleh
macam-macam zat kimia sehingga dilakukannya pengukuran ciri-ciri serta
kuantitatifnya dengan ketelitian yang lebih besar (Day dan Underwood, 1983).
Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan
sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang
diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar yang
diteruskan dengan intensitas sinar yang diserap jika tidak ada spesies penyerap
lainnya (Sudjaji dan Rohman, 2007).
Pengukuran serapan cahaya oleh larutan molekul diatur dengan hukum
Lambert- Beer, yang ditulis sebagai berikut:
Log I0/It = A = ε bc
Dengan I0 adalah intensitas radiasi yang masuk, It adalah intensitas radiasi
yang ditransmisikan, A dikenal sebagai absorbans dan merupakan ukuran jumlah cahaya yang diserap oleh sampel, ε adalah tetapan yang dikenal sebagai koefisien ekstingsi molar dan merupakan absorbans larutan 1 M analit tersebut, b adalah
panjang jalur sel dalam cm, biasanya 1 cm, dan c adalah konsentrasi analit dalam
UIN Syarif Hidayatullah
Dalam produk farmasi, konsentrasi dan jumlah biasanya dinyatakan dalam
gram atau miligram dan bukan dalam mol sehingga untuk keperluan analisis
produk ini, hukum Lambert-Beer ditulis dalam bentuk berikut ini:
A = A (1%, 1cm) bc
A adalah absorbans yang diukur, A (1%, 1cm) adalah absorbans larutan
1% b/v (g/100 ml) dalam satu sel berukuran 1 cm, b adalah panjang jalur dalam
cm, dan c adalah konsentrasi sampel dalam g/100 ml. Karena pengukuran
biasanya dibuat dalam sel berukuran 1 cm (Watson, 2010).
2.7 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi atau KCKT atau sering disebut dengan
HPLC (High Performance Liuid Chromatography) dikembangkan pada akhir
tahun 1960-an dan pada awal tahun 1970-an. Saat ini, KCKT merupakan teknik
pemisahan yang diterima secara luas dan paling cepat berkembang untuk analisis
dan pemurnian senyawa tertentu dalam suatu sampel.
Kegunaan umum KCKT adalah untuk: pemisahan sejumlah senyawa
organik, anorganik, maupun senyawa biologis; analisis ketidakmurnian
(impurities); analisis senyawa-senyawa tidak mudah menguap (non-volatil);
penentuan molekul-molekul netral, ionik, maupun zwitter ion; isolasi dan
pemurnian senyawa; pemisahan senyawa-senyawa yang strukturnya hampir sama;
pemisahan senyawa-senyawa dalam jumlah sekelumit (trace elements), dalam
jumlah banyak dan dalam skala proses industri. KCKT merupakan metode yang
tidak destruktif dan dapat digunakan baik untuk analisis kualitatif maupun
kuantitatif (Gandjar & Rohman, 2007 ; Harmita, 2006).
2.7.1 Cara Kerja KCKT
Kromatografi merupakan teknik dimana solut atau zat-zat terlarut terpisah
oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom
kromatografi. Pemisahan solut-solut ini diatur oleh distribusi solut dalam fase
gerak dan fase diam. Penggunaan kromatografi cair secara sukses terhadap suatu
masalah yang dihadapi membutuhkan penggabungan secara tepat dari berbagai
macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter
UIN Syarif Hidayatullah
Pada dasarnya, instrumentasi KCKT terdiri atas delapan komponen pokok,
yaitu: wadah fase gerak, sistem penghantaran fase gerak, alat untuk memasukkan
sampel, kolom, detektor, wadah penampung buangan fase gerak, tabung
penghubung, dan suatu komputer atau integrator atau perekam (Gandjar &
Rohman, 2007).
2.7.2 Komponen KCKT 2.7.2.1 Pompa
Pompa atau sistem penghantaran fase gerak pada KCKT bertujuan untuk
menjamin berlangsungnya proses penghantaran fase gerak secara tepat,
reprodusibel, konstan dan bebas dari gangguan. Pompa yang digunakan untuk
KCKT harus memenuhi syarat sebagaimana syarat wadah pelarut, yaitu pompa
harus inert terhadap fase gerak. Bahan pompa ang digunakan harus terbuat dari
bahan yang tahan terhadap eluen, seperti gelas, baja tahan karat, teflon dan batu
nilam (Gandjar & Rohman, 2007).
2.7.2.2 Injektor
Cuplikan harus dimasukkan ke dalam pangkal kolom (kepala kolom)
dengan cara diinjeksikan secara langsung ke dalam fase gerak yang mengalir
dibawah tekanan tertentu menuju kolom dengan menggunakan suntikkan yang
terbuat dari bahan tembaga tahan karat dan katup teflon yang dilengkapi dengan
keluk sampel (sample loop) internal dan eksternal. Diusahakan agar sesedikit
mungkin terjadi gangguan pada kemasan kolom (Gandjar & Rohman, 2007 :
Johnson & Stevenson, 1991).
2.7.2.3Kolom
Kolom merupakan jantung kromatograf yang berfungsi untuk memisahkan
masing-masing komponen. Untuk menahan tekanan tinggi, kolom dibuat dari
bahan yang kokoh seperti stainless steel atau campuran logam dengan gelas
UIN Syarif Hidayatullah
2.7.2.4 Detektor
Detektor berfungsi untuk mendeteksi atau mengidentifikasi adanya
komponen cuplikan yang ada dalam eluat dan mengukur jumlahnya. Detektor
pada KCKT dikelompokkan menjadi 2 golongan yaitu: detektor universal
(mampu mendeteksi zat secara umum, tidak bersifat spesifik dan selektif) seperti
detektor indeks bias dan detektor spektrometri massa; dan golongan detektor
spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti
UV-Vis, detektor fluoresensi dan elektrokimia (Gandjar & Rohman, 2007 :
Harmita, 2006).
2.7.2.5 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert). Adah pelarut kosong
ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini
biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Sebelum
digunakan, fase gerak ini harus dilakukan degassing (penghilangan gas), karena
adanya gas pada fase gerak akan berkumpul dengan komponen lain terutama di
pompa dan detektor sehingga akan mengacaukan analisis. Sedangkan adanya
partikel yang kecil dapat terkumpul dalam kolom atau dalam tabung yang sempit,
sehingga dapat mengakibatkan suatu kekosongan pada kolom atau tabung
tersebut. Oleh karena itu, fase gerak sebelum digunakan harus dsaring terlebih
dahulu untuk menghindari partikel-partikel kecil tersebut (Gandjar & Rohman,
2007).
2.7.2.6 Fase Gerak
Fase gerak merupakan suatu peubah yang dapat mempengaruhi proses
pemisahan dalam sistem KCKT. Fase gerak atau eluen biasanya terdiri atas
campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam
daya elusi dan resolusi. Daya elusi dan resolusi ini ditentukan oleh polaritas
keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel.
Untuk fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi
meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik
UIN Syarif Hidayatullah
meningkatnya polaritas pelarut (Gandjar & Rohman, 2007 : Johnson & Stevenson,
1991).
Fase gerak yang paling sering digunakan untuk pemisahan dengan fase
terbalik adalah campuran larutan bufer dengan metanol atau campuran air dengan
asetonitril. Untuk pemisahan dengan fase normal, fase gerak yang paling sering
digunakan adalah campuran pelarut-pelarut hidrokarbon dengan pelarut yang
terklorisasi atau menggunakan pelarut-pelarut jenis alkohol. Pemisahan dengan
fase normal ini kurang umum dibanding dengan fase terbalik (Gandjar &
Rohman, 2007).
2.8 Metode Validasi
Validasi metode analisis menurut United States Pharmacopeia (USP)
dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik,
reprodusibel dan tahan pada kisaran analit yang akan dianalisis.
2.8.1 Akurasi
Akurasi adalah kedekatan hasil penetapan yang diperoleh dengan hasil
sebenarnya. Akurasi dinyatakan sebagai hasil perolehan kembali dari analit yang
ditambahkan. Untuk pengujian senyawa obat, akurasi diperoleh dengan
membandingkan hasil rujukan dengan bahan rujukan standar. Syarat akurasi yang
baik yaitu 98-102%.
% ℎ � = ℎ � � ���ℎ � � %
(Harmita, 2006 : Johnson&Stevenson, 1991).
2.8.2 Linearitas
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transportasi matematik yang baik,
proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah
pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat
ditetapkan dengan kecermatan, keseksamaan dan linearitas yang dapat diterima.
Dalam prakteknya, digunakan satu seri larutan yang berbeda
UIN Syarif Hidayatullah
sering ditemukan rentang konsentrasi yang digunakan antara 0-200%, jumlah
sampel yang dianalisis sekurang-kurangnya delapan buah sampel.
� =�
Sxo : Standar deviasi dari fungsi
Parameter lain yang harus dihitung adalah simpangan baku residual (Sy)
� = √ Σ � − �−
Dimana Y1 : a+bx
23
UIN Syarif Hidayatullah
BAB 3
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian II dan laboratorium
Formulasi Sediaan Padat Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negeri Syarif Hidayatullah Jakarta pada bulan Januari – Juni 2016.
3.2 Alat dan Bahan 3.3.1 Alat
Alat-alat yang dibutuhkan dalam penelitian ini adalah Dissolution Tester
(ERWEKA), Spektrofotometer Ultraviolet (HITACHI U-2910), High
Performance Liquid Chomatoghraphy (Dionex), membran filter, sonicator
(Elmasonic), Stopwatch, Neraca analitik (KERN ACJ/AC5), pH meter (HORIBA),
mikro pipet, alat-alat gelas dan alat laboratorium lainnya.
3.3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah metanol (grade
HPLC), aquadest, aquabidest, asam fosfat, potassium dihydrogen ortho
phosphate, Dibasic sodium phosphate anhidrat, sodium dihydrogen phosphate
dihydrate (grade analisis), standar glimepirid, tablet glimepirid generik (Dexa
Medica), Amaryl (Aventis), Amadiab (LAPI) dan Metrix (Kalbe Farma).
3.3 Prosedur Penelitian
3.3.1 Teknik Pengambilan Sampel
Metode pengambilan sampel yang digunakan dalam penelitian ini adalah
purposive sampling. Teknik purposive sampling merupakan cara pengambilan
sampel sesuai dengan tujuan penelitian, yaitu penarikan sampel yang didasari
pada keperluan penelitian (Sugiyono, 2012). Sampel yang digunakan untuk
penelitian sebanyak 4 sampel, di mana terdapat 1 generik dan 3 generik bermerek.
Sampel diperoleh dari beberapa apotek di Jakarta Timur, di mana dipilih
UIN Syarif Hidayatullah
tahun kadaluarsa yang sama yaitu tahun 2017. Tempat pengambilan sampel
dipilih sesedikit mungkin atas alasan meminimalkan perbedaan faktor kesalahan
luar yang dapat menurunkan mutu obat begitu pula dengan pemilihan tahun
kadaluwarsa yang sama.
Sampel yang digunakan adalah tablet glimepirid generik dan tablet
glimepirid generik bermerk dengan tahun kadaluarsa yang sama yang diambil dari
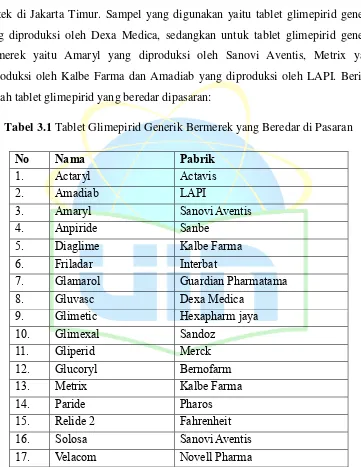
apotek di Jakarta Timur. Sampel yang digunakan yaitu tablet glimepirid generik
yang diproduksi oleh Dexa Medica, sedangkan untuk tablet glimepirid generik
bermerek yaitu Amaryl yang diproduksi oleh Sanovi Aventis, Metrix yang
diproduksi oleh Kalbe Farma dan Amadiab yang diproduksi oleh LAPI. Berikut
adalah tablet glimepirid yang beredar dipasaran:
Tabel 3.1 Tablet Glimepirid Generik Bermerek yang Beredar di Pasaran
UIN Syarif Hidayatullah
Tabel 3.2 Tablet Glimepirid Generik yang Beredar di Pasaran
No. Nama Pabrik
1. Glimepirid Hexapharm jaya
2. Glimepirid Kimia farma
3. Glimepirid Dexa Medica
Menurut Gay, jumlah sampel minimal yang dapat diterima yaitu 10% dari
populasi, namun untuk populasi yang sangat kecil diperlukan minimal 20% dari
populasi (Husein, 2005). Berikut adalah perhitungan jumlah sampel yang
digunakan terdapat dari nelitian:
Generik = 3 x = 0,6 atau = 1 sampel generik
Generik Bermerek = 17 x = 3,4 atau = 3 sampel generik bermerek
Pemilihan sampel generik (1 dari 3) atau generik bermerek (3 dari 17) ini
dipilih berdasarkan pertimbangan kelengkapan tersedianya tablet glimepirid 2 mg
yang beredar di beberapa apotek di Jakarta Timur dengan kecocokkan tahun
kadaluarsa yang sama atau mendekati sama satu sama lain.
3.3.2 Sifat Fisik 3.3.2.1Uji Organoleptis
Tablet diamati secara visual meliputi : warna (homogenitas), bentuk
(bundar, permukaan rata/cembung), cetakan (garis patah, tanda, logo, pabrik), dll.
3.3.2.2Uji Kekerasan
Uji kekerasan dilakukan dengan mengambil masing-masing 10 tablet dari
tiap sampel, yang diukur dengan memberi tekanan terhadap diameter tablet. Alat
yang biasa digunakan adalah hardness tester. Alat ini diharapkan dapat mengukur
berat yang diperlukan untuk memecahkan tablet. Persyaratan kekerasan tablet
umumnya berkisar 4-8 kg, bobot tersebut dianggap sebagai batas minimum untuk
UIN Syarif Hidayatullah
3.3.2.3 Keseragaman Kandungan
Dilakukan penetapan keseragaman sediaan yaitu keseragaman kandungan,
dengan cara ditimbang 10 sediaan satu per satu dan dihitung rata-ratanya,
kemudian ditetapkan kadar zat aktifnya dari masing-masing sediaan sesuai dengan
metode penetapan kadar. Kecuali dikatakan lain dalam masing-masing monografi
persyaratan keseragaman kandungan dipenuhi jika kadar zat aktif antara 85,0% -
115,0% dari yang tertera pada etiket dan simpangan baku relatifnya kurang dari
atau sama dengan 6,0% (Dirjen POM, 1995).
3.3.3 Penetapan Kadar
3.3.3.1Pembuatan Dapar Fosfat
Ditimbang seksama sejumlah 7,0 gram potassium dihydrogen ortho
phosphate, dimasukkan ke dalam labu ukur 1000 ml. Dilarutkan dengan aquadest
hingga garis tanda. Adjust pH akhir pada buffer hingga mencapai 3,0
menggunakan asam fosfat (Kumar et al., 2015).
3.3.3.2 Pembuatan Fase Gerak
Fase gerak dipreparasi dengan campuran 250 ml (25%) buffer dan 750 ml
(75%) metanol (grade HPLC) kemudian dihilangkan gelembungnya dengan
sonicator selama 10 menit. Kemudian larutan disaring menggunakan membran
filter 0,45 µ. Fase gerak dapat digunakan juga sebagai pelarut (Kumar et al.,
2015).
3.3.3.3 Pembuatan Larutan Induk Glimepirid
Ditimbang saksama sejumlah 50,0 mg standar glimepirid, dimasukkan ke
dalam labu ukur 100 ml. Ditambahkan pelarut fase gerak ke dalam labu hingga
garis tanda dan sonikasi (Kumar et al., 2015).
3.3.3.4 Penentuan Panjang Gelombang
Dibuat larutan standar glimepirid dengan konsentrasi 3 µg/mL, kemudian
dilakukan pemindaian dengan spektrofotometri UV-VIS pada panjang gelombang
UIN Syarif Hidayatullah
3.3.3.5 Verifikasi Metode 3.3.3.5.1 Uji Linearitas
Dibuat larutan standar glimepirid dengan konsentrasi 1, 2, 3, 4, 5 µg/mL,
kemudian masing-masing konsentrasi disuntikkan sebanyak 20 µl ke sistem
KCKT pada kondisi kolom C18 (4,6x150 mm, 5 µm), pH 3,0, laju alir 1,0
ml/menit dan panjang gelombang 254 nm. Lalu dicatat luas puncaknya yang
ditunjukkan pada kromatogram dan dibuat kurva kalibrasi serta dihitung
persamaan regresinya (y = a + bx). Dihitung koefisien korelasi (r) dari kurva
tersebut (Kumar et al., 2015).
3.3.3.5.2 Akurasi
Dibuat larutan glimepirid dengan konsentrasi 1 µg/mL, 3 µg/mL dan 5
µg/mL. Kemudian disuntikkan ke KCKT dengan volume penyuntikan 20 µl.
Dilakukan sebanyak tiga kali. Kemudian dihitung persentase akurasi (% diff) dari
masing-masing konsentrasi larutan tersebut (Kumar et al., 2015).
3.3.3.6 Penetapan Kadar
Ditimbang dan serbukkan tidak kurang dari 20 tablet. Timbang saksama
sejumlah serbuk tablet setara dengan lebih kurang 10 mg glimepirid, kemudian
dimasukkan ke dalam labu tentukur 25 ml. Pelarut fase gerak ditambahkan
kedalamnya hingga garis tanda dan sonikasi. Dipipet 125 µl dari larutan tersebut
dan dimasukkan ke dalam labu ukur 10 ml, kemudian ditambahkan pelarut hingga
garis tanda. Diinjeksikan lebih kurang 20 µl ke sistem KCKT dan dideteksi pada
panjang gelombang 254 nm dengan laju alir 1 mL/menit (Kumar et al., 2015).
3.3.4 Uji Disolusi
3.3.4.1 Pembuatan Larutan Induk
Dibuat larutan induk standar glimepirid dengan menimbang 50,0 mg
standar glimepirid, masukkan ke dalam labu ukur 25 ml, sejumlah 7,5 ml NaOH
0,1 M ditambahkan ke dalam labu dan sonikasi. Tambahkan metanol hingga garis
UIN Syarif Hidayatullah
3.3.4.2Penentuan Panjang Gelombang Maksimum
Dibuat larutan dengan konsentrasi 2 µg/mL dari larutan induk, kemudian
dideteksi dengan spektrofotometri UV-VIS pada panjang gelombang 200-400 nm.
Dicatat panjang gelombang maksimumnya (Induri M. et al., 2012).
3.3.4.3 Pembuatan Kurva Kalibrasi
Dibuat larutan dengan konsentrasi 0,5; 1; 1,5; 2; 2,5 dan 4 µg/mL dari
larutan induk. Masing-masing konsentrasi diamati absorbansinya di
spektrofotometri UV-VIS yang diukur pada panjang gelombang maksimum.
Digunakan metanol sebagai blanko (Induri M. et al., 2012).
3.3.4.4 Uji Disolusi Sampel Tablet Glimepirid yang Dijual di Apotek
Sebanyak 6 tablet glimepirid sampel dimasukkan ke dalam alat disolusi
dengan alat disolusi tipe 2 yang berisi medium dapar fosfat pH 7,8 sebanyak 900
ml pada suhu 37oC. Dengan kecepatan pengadukan 75 rpm selama 20 menit.
Pengambilan cuplikan sampel sebanyak 5 ml dilakukan pada detik ke 30, menit ke
1, 2, 3, 5, 10, 15, dan 20. Setiap pengambilan sampel diganti dengan media
disolusi dengan volume yang sama (Induri M. et al., 2012). Apabila hasil
pengujian tidak memenuhi tabel penerimaan untuk S1 yaitu tiap unit sediaan tidak
kurang dari Q+15%, maka pengujian dilanjutkan ke tahap S2 yaitu dengan
menguji kembali 6 tablet glimepirid lainnya. Rata-rata dari 12 unit tersebut
(S1+S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit pun yang
lebih kecil dari Q-15%. Apabila hasil pengujian tidak pula memenuhi tabel
penerimaan untuk S2, maka pengujian dilanjutkan sampai tahap S3. Tahap S3
dilakukan dengan menguji kembali 12 tablet glimepirid lainnya dengan rata-rata
dari 24 unit tersebut (S1+S2+S3) adalah sama dengan atau lebih besar dari Q,
tidak lebih dari 2 unit sediaan yang lebih kecil dari Q-15% dan tidak satu unit pun
29
UIN Syarif Hidayatullah
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Evaluasi Sifat Fisik Tablet Glimepirid
4.1.1 Hasil Uji Organoleptis
Pada pemeriksaan fisik berupa organoleptis tablet diamati secara visual.
Keempat sampel tablet memiliki warna, bentuk dan cetakan yang berbeda-beda.
Namun apabila dilihat dari sisi rabaan, keempat sampel tablet memiliki permukaan
yang halus tidak ada permukaan yang berlubang ataupun cacat.
Tabel 4.1 Hasil Uji Organoleptis
4.1.2 Kekerasan Tablet
Tablet yang baik harus cukup keras untuk dapat tahan, tidak pecah dan tidak
rapuh selama proses pengemasan, distribusi, penyimpanan, hingga saat digunakan.
Untuk itu, dilakukan uji kekerasan tablet. Berdasarkan literatur, kekerasan tablet
yang dianggap baik ialah minimal 4-10 Kg (Sulaiman, 2007). Uji kekerasan
dilakukan terhadap keempat sampel yang masing-masingnya menggunakan 10 tablet
uji. Pada tablet glimepirid generik bermerek B memiliki nilai kekerasan di bawah
persyaratan, yaitu 2,34 Kg. Ketiga sampel lain memiliki kekerasan rata-rata yang
berkisar antara 4,46 - 8,35 Kg, sehingga dapat dikatakan bahwa ketiganya memenuhi
persyartan uji kekerasan.
Bulat, permukaan rata Garis patah ditengah, logo pabrik (DX) &
Oval, permukaan rata Garis patah, logo pabrik (KALBE) Generik
bermerek C
Merah muda, homogen
UIN Syarif Hidayatullah
Tabel 4.2 Hasil Uji Kekerasan Tablet
Sampel Bobot rata-rata (mg)
Kekerasan (Kg)
Generik 168,55 4,46
Generik Bermerek A 171,00 7,33
Generik Bermerek B 51,12 2,34
Generik Bermerek C 170,42 8,35
Menurut Lachman dkk (1994), perbedaan kekerasan dapat terjadi karena
beberapa faktor seperti perbedaan tekanan kompresi yang diberikan atau perbedaan
massa granul yang mengisi die pada saat pencetakan tablet. Selain itu, berbedanya
nilai kekerasan juga dapat diakibatkan oleh variasi jenis dan jumlah bahan tambahan
yang digunakan pada formulasi. Bahan pengikat adalah contoh bahan tambahan yang
bisa menyebabkan meningkatnya kekerasan tablet bila digunakan terlalu banyak.
4.1.3 Keseragaman Kandungan
Hasil uji Keseragaman kandungan menunjukkan bahwa sepuluh tablet
generik, generik bermerek A, B, dan C memiliki kadar yang masuk dalam
persyaratan keseragaman kandungan yang ditetapkan oleh Farmakope Indonesia V
yaitu kadar glimepirid terletak antara 90% hingga 110% dari yang tertera pada etiket,
dan simpangan baku rekatif tidak lebih dari 6%.
Tabel 4.3 Hasil Uji Keseragaman Kandungan Tablet Glimepirid Generik dan Generik Bermerek
rata 98,67±1,73 99,88±1,92 98,90±1,60 100,83±1,90 RSD
UIN Syarif Hidayatullah
Dari tabel tersebut dapat dilihat bahwa hasil uji keseragaman kandungan
tablet glimepirid yang paling besar yaitu tablet glimepirid generik bermerek C
sebesar 100,83±1,90, disusul dengan tablet glimepirid generik A sebesar 99,88±1,92,
kemudian tablet glimepirid generik B sebesar 98,90±1,60 dan yang terakhir tablet
glimepirid generik sebesar 98,67±1,73. Hal ini berarti bahwa baik tablet glimepirid
generik maupun generik bermerek semuanya memenuhi persyaratan Farmakope
Indonesia edisi V.
Uji keseragaman kandungan ini dilakukan karena jumlah zat aktif tablet
glimepirid kurang dari 50 mg per tablet atau kurang dari 50% dari bobot satuan
sediaan, sehingga dapat menjamin bahwa setiap tablet mengandung jumlah zat aktif
sesuai spesifikasi dengan variasi yang kecil dalam batch. Selain itu, untuk
memastikan apabila uji disolusi memberikan hasil yang tidak semestinya hal itu
bukan dikarenakan jumlah kadar dari zat aktif yang dikandung dalam masing-masing
tablet.
4.2 Penetapan Kadar
4.2.1 Penentuan Panjang Gelombang pada Medium Fase Gerak (Metanol:Fosfat)
Penentuan panjang gelombang maksimum dalam medium fase gerak
(metanol:fosfat) terdeteksi pada panjang gelombang 254 nm. Menurut Kumar et al.,
dalam medium fase gerak (metanol:fosfat) glimepirid memberikan panjang
gelombang maksimum 254 nm. Hal ini sesuai dengan rujukan yang digunakan dalam
penelitian. Panjang gelombang maksimum dipilih karena pada panjang gelombang
tersebut zat akan memberikan respon yang maksimum, terutama apabila konsentrasi
analit yang akan dianalisis kecil konsentrasinya.
4.2.2 Kurva Kalibrasi
Kurva kalibrasi standar glimepirid dalam fase gerak metanol:dapar fosfat
(75:25) dihasilkan garis lurus dengan koefisien korelasi (r) sebesar 0,9996, nilai tersebut memenuhi syarat linearitas yaitu r ≥ 0,999 (Synder, Kirkland dan Glajch, 1997). Persamaan regresi linear yang diperoleh adalah y = 0,1665x + 0,1686.
Berdasarkan persamaan y = a + bx, maka diperoleh nilai a (intercept) = 0,1686 dan