SIFAT FISIK DAN KIMIA GELATIN TULANG SAPI DENGAN
PERENDAMAN ASAM KLORIDA PADA KONSENTRASI
DAN LAMA PERENDAMAN YANG BERBEDA
HAJRAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda adalah karya saya sendiri dengan arahan komisi pembimbimg dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 01 Januari 2006
Hajrawati
ABSTRAK
HAJRAWATI. Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman
Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda.
Dibimbing oleh RUDY PRIYANTO, EDDIE GURNADI dan SUHUT
SIMAMORA
Gelatin merupakan produk turunan protein yang diperoleh dari hidrolisis kolagen hewan yang terkandung dalam tulang dan kulit yang dapat diekstraksi melalui poses asam dan basa. Gelatin, sebagai salah satu hasil sampingan dari peternakan yang pengunaannya sangat luas yakni sebagai pengemulsi (emulsifier)dan penstabil (stabilizer), baik untuk produk pangan maupun non pangan. Tujuan penelitian ini adalah mengkaji pengaruh interaksi konsentrasi HCl dan lama perendaman terhadap kualitas gelatin tulang sapi.
Penelitian ini menggunakan rancangan acak lengkap faktorial dengan dua faktor, yaitu konsentrasi larutan HCl (2%, 3.5 % dan 5%) dan lama perendaman (24 jam, 36 jam dan 48 jam) dengan tiga kali ulangan. Peubah yang diamati adalah rendemen, pH, warna, kekuatan gel, viskositas, stabilitas emulsi kapasitas emulsi, kadar air, kadar abu, kadar protein, kadar lemak dan kadar kalsium.
ABSTRACT
HAJRAWATI. Physical and Chemical Properties of Bovine Bone Gelatin Following the Treatments of Chloride Acid and Soaking Time. Under the direction of RUDY PRIYANTO, EDDIE GURNADI, and SUHUT SIMAMORA
© Hak cipta milik Institut Pertanian Bogor, Tahun 2006 Hak cipta dilindungi
SIFAT FISIK DAN KIMIA GELATIN TULANG SAPI DENGAN
PERENDAMAN ASAM KLORIDA PADA KONSENTRASI
DAN LAMA PERENDAMAN YANG BERBEDA
HAJRAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda
Nama : Hajrawati NIM : D051030091
Disetujui Komisi Pembimbing
Dr. Ir. Rudy Priyanto Ketua
Prof. Dr. Drh .H. R. Eddie Gurnadi Ir. Suhut Simamora, MS Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Ternak
Dr. Ir. Nahrowi, M.Sc Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
PRAKATA
Puji dan syukur penulis panjatkan kepada Alloh S.W.T atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul: Kualitas gelatin tulang sapi dengan perendaman asam klorida pada konsentrasi dan lama perendaman yang berbeda.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Rudy Priyanto, Prof.Dr.Drh.H.R. Eddie Gurnadi dan Ir.Suhut Simamora, MS, masing-masing sebagai ketua dan anggota komisi pembimbing yang telah meluangkan waktu, tenaga dan pikiran walaupun di tengah-tengah kesibukan beliau untuk memberikan bimbingan dan nasehat kepada penulis sehingga tulisan ini dapat diselesaikan. Demikian pula kepada Bapak Dr. Ir. Nahrowi, M.Sc selaku Ketua Program Studi Ilmu Ternak serta Kepala Laboratorium Teknologi Agroindustri Badan Pengkajian dan Penerapan Teknologi (LTA BPPT) Serpong yang telah memberikan izin kepada penulis untuk melaksanakan penelitian di LTA BPPT Serpong.
Kepada Bapakku H. Syaiful Lompeng dan Ibuku Hj. Rahmawati, beserta semua keluarga, anakda menghaturkan sembah sujud dan terima kasih dengan penuh kerendahan serta rasa hormat sedalam-dalamnya, karena atas segala kasih sayang, pengorbanan moral, maupun material serta doa restu dan nasehatnya telah mendidik, membina dengan penuh kasih sayang agar penulis selalu tabah dan tawakal dalam menghadapi kesulitan dan senantiasa berusaha dan bekerja keras. Ungkapan terima kasih saya sampaikan kepada adikku tercinta Mutmainna, saya sangat menghargai kesabaran, ketekunan, ketabahan dalam membantu orang tua selama kakak sekolah, serta dorongan yang tak putus-putusnya sehingga mampu menghantarkan penulis untuk menyelesaikan seluruh rangkaian proses pendidikan, penelitian dan penulisan ini.
menyampaikan penghargaan dan ucapan terima kasih yang sedalam-dalamnya atas bantuan moril dan kerjasamanya selama penulis menempuh studi S-2.
Akhirnya, jika pembaca merasa tesis ada kekurangan, maka orang yang pertama merasa kekurangan adalah penulis sendiri. Namun kepada pembaca yang arif bijaksana penulis mengharapkan saran demi peningkatan mutu tesis ini pada masa berikutnya.
Semoga karya ilmiah ini bermanfaat dan dijadikan Alloh S.W.T sebagai amal saleh bekal penulis menempuh hidup di dunia ini dan di akhirat nanti. Amin.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Enrekang, Sulawesi Selatan pada tanggal 05 Oktober 1978. Penulis adalah anak dua dari tiga bersaudara dari pasangan Bapak H. Syaiful Lompeng dan Ibu Hj. Rahmawati.
Pendidikan formal penulis diawali tahun 1983 di SDN 157 Cakke, Enrekang, lulus tahun 1990. Tahun yang sama melanjutkan ke SMP Negeri 12-15 Kalosi, Enrekang, hingga lulus tahun 1993. Kemudian pada tahun 1993 penulis melanjutkan pendidikan di SMA Negeri 229 Cakke, Enrekang dan lulus pada tahun 1996.
Tahun 1997 penulis diterima sebagai mahasiswa Universitas Hasanuddin melalui jalur UMPTN dan tercatat sebagai mahasiswa Fakultas Peternakan, Program Studi Produksi Ternak. Pada tahun 2003, penulis di terima di Program Studi Ilmu Ternak Sekolah Pascasarjana Institut Pertanian Bogor.
SIFAT FISIK DAN KIMIA GELATIN TULANG SAPI DENGAN
PERENDAMAN ASAM KLORIDA PADA KONSENTRASI
DAN LAMA PERENDAMAN YANG BERBEDA
HAJRAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda adalah karya saya sendiri dengan arahan komisi pembimbimg dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 01 Januari 2006
Hajrawati
ABSTRAK
HAJRAWATI. Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman
Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda.
Dibimbing oleh RUDY PRIYANTO, EDDIE GURNADI dan SUHUT
SIMAMORA
Gelatin merupakan produk turunan protein yang diperoleh dari hidrolisis kolagen hewan yang terkandung dalam tulang dan kulit yang dapat diekstraksi melalui poses asam dan basa. Gelatin, sebagai salah satu hasil sampingan dari peternakan yang pengunaannya sangat luas yakni sebagai pengemulsi (emulsifier)dan penstabil (stabilizer), baik untuk produk pangan maupun non pangan. Tujuan penelitian ini adalah mengkaji pengaruh interaksi konsentrasi HCl dan lama perendaman terhadap kualitas gelatin tulang sapi.
Penelitian ini menggunakan rancangan acak lengkap faktorial dengan dua faktor, yaitu konsentrasi larutan HCl (2%, 3.5 % dan 5%) dan lama perendaman (24 jam, 36 jam dan 48 jam) dengan tiga kali ulangan. Peubah yang diamati adalah rendemen, pH, warna, kekuatan gel, viskositas, stabilitas emulsi kapasitas emulsi, kadar air, kadar abu, kadar protein, kadar lemak dan kadar kalsium.
ABSTRACT
HAJRAWATI. Physical and Chemical Properties of Bovine Bone Gelatin Following the Treatments of Chloride Acid and Soaking Time. Under the direction of RUDY PRIYANTO, EDDIE GURNADI, and SUHUT SIMAMORA
© Hak cipta milik Institut Pertanian Bogor, Tahun 2006 Hak cipta dilindungi
SIFAT FISIK DAN KIMIA GELATIN TULANG SAPI DENGAN
PERENDAMAN ASAM KLORIDA PADA KONSENTRASI
DAN LAMA PERENDAMAN YANG BERBEDA
HAJRAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Sifat Fisik dan Kimia Gelatin Tulang Sapi dengan Perendaman Asam Klorida pada Konsentrasi dan Lama Perendaman yang Berbeda
Nama : Hajrawati NIM : D051030091
Disetujui Komisi Pembimbing
Dr. Ir. Rudy Priyanto Ketua
Prof. Dr. Drh .H. R. Eddie Gurnadi Ir. Suhut Simamora, MS Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Ternak
Dr. Ir. Nahrowi, M.Sc Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
PRAKATA
Puji dan syukur penulis panjatkan kepada Alloh S.W.T atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul: Kualitas gelatin tulang sapi dengan perendaman asam klorida pada konsentrasi dan lama perendaman yang berbeda.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Rudy Priyanto, Prof.Dr.Drh.H.R. Eddie Gurnadi dan Ir.Suhut Simamora, MS, masing-masing sebagai ketua dan anggota komisi pembimbing yang telah meluangkan waktu, tenaga dan pikiran walaupun di tengah-tengah kesibukan beliau untuk memberikan bimbingan dan nasehat kepada penulis sehingga tulisan ini dapat diselesaikan. Demikian pula kepada Bapak Dr. Ir. Nahrowi, M.Sc selaku Ketua Program Studi Ilmu Ternak serta Kepala Laboratorium Teknologi Agroindustri Badan Pengkajian dan Penerapan Teknologi (LTA BPPT) Serpong yang telah memberikan izin kepada penulis untuk melaksanakan penelitian di LTA BPPT Serpong.
Kepada Bapakku H. Syaiful Lompeng dan Ibuku Hj. Rahmawati, beserta semua keluarga, anakda menghaturkan sembah sujud dan terima kasih dengan penuh kerendahan serta rasa hormat sedalam-dalamnya, karena atas segala kasih sayang, pengorbanan moral, maupun material serta doa restu dan nasehatnya telah mendidik, membina dengan penuh kasih sayang agar penulis selalu tabah dan tawakal dalam menghadapi kesulitan dan senantiasa berusaha dan bekerja keras. Ungkapan terima kasih saya sampaikan kepada adikku tercinta Mutmainna, saya sangat menghargai kesabaran, ketekunan, ketabahan dalam membantu orang tua selama kakak sekolah, serta dorongan yang tak putus-putusnya sehingga mampu menghantarkan penulis untuk menyelesaikan seluruh rangkaian proses pendidikan, penelitian dan penulisan ini.
menyampaikan penghargaan dan ucapan terima kasih yang sedalam-dalamnya atas bantuan moril dan kerjasamanya selama penulis menempuh studi S-2.
Akhirnya, jika pembaca merasa tesis ada kekurangan, maka orang yang pertama merasa kekurangan adalah penulis sendiri. Namun kepada pembaca yang arif bijaksana penulis mengharapkan saran demi peningkatan mutu tesis ini pada masa berikutnya.
Semoga karya ilmiah ini bermanfaat dan dijadikan Alloh S.W.T sebagai amal saleh bekal penulis menempuh hidup di dunia ini dan di akhirat nanti. Amin.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Enrekang, Sulawesi Selatan pada tanggal 05 Oktober 1978. Penulis adalah anak dua dari tiga bersaudara dari pasangan Bapak H. Syaiful Lompeng dan Ibu Hj. Rahmawati.
Pendidikan formal penulis diawali tahun 1983 di SDN 157 Cakke, Enrekang, lulus tahun 1990. Tahun yang sama melanjutkan ke SMP Negeri 12-15 Kalosi, Enrekang, hingga lulus tahun 1993. Kemudian pada tahun 1993 penulis melanjutkan pendidikan di SMA Negeri 229 Cakke, Enrekang dan lulus pada tahun 1996.
Tahun 1997 penulis diterima sebagai mahasiswa Universitas Hasanuddin melalui jalur UMPTN dan tercatat sebagai mahasiswa Fakultas Peternakan, Program Studi Produksi Ternak. Pada tahun 2003, penulis di terima di Program Studi Ilmu Ternak Sekolah Pascasarjana Institut Pertanian Bogor.
DAFTAR TABEL
Perbandingan tulang berongga dan tulang kompak .………
Penyebaran kolagen pada berbagai jaringan mamalia...
Komposisi asam amino non esensial dan esensial gelatin... ...
Tahapan proses ekstraksi kolagen secara bertingkat menghasilkan gelatin...
Standar mutu gelatin berdasarkan standar nasional Indonesia
No. 06-3735-1995 Gelatin Manufacturers Institut of America...
Sifat-sifat fungsional gelatin tipe A dan tipe B...
Analisa Proksimat tulang sapi...
Deskripsi hubungan lama suhu perebusan dan pelepasan daging serta kandungan lemak gelatin...
Jumlah mineral terlarut selama demineralisasi selama 10 hari... Rekapitulasi hasil analisis ragam terhadap sifat fisik gelatin tulang sapi
DAFTAR GAMBAR
Susunan molekul tropokolagen dari fibril kolagen...
Struktur kimia gelatin...
Tulang femur sapi...
Proses ekstraksi gelatin dari tulang sapi ...
Sheet gelatin tulang sapi...
Grafik hubungan konsentrasi HCl dan lama perendaman terhadap kekuatan gel gelatin...
Grafik hubungan konsentrasi dan lama perendaman terhadap viskositas gelatin...
Grafik hubungan konsentrasi dan lama perendaman terhadap kapasitas emulsi gelatin...
Skema emulsi minyak dalam air...
Grafik hubungan konsentrasi HCl dan lama perendaman terhadap notasi warna b gelatin...
Grafik hubungan konsentrasi HCl dan lama perendaman terhadap kadar air gelatin...
Grafik hubungan konsentrasi dan lama perendaman terhadap kadar protein gelatin...
DAFTAR LAMPIRAN
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap rendemen gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kekuatan gel gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap viskositas gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kapasitas emulsi gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap stabilitas emulsi gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap notasi warna L gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap warna b gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap pH gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kadar air gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kadar abu gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kadar protein gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kadar lemak gelatin...
Analisis ragam pengaruh konsentrasi HCl dan lama perendaman terhadap kadar kalsium gelatin ...
Hasil analisa gelatin komersial...
PENDAHULUAN
Latar BelakangTulang sapi sangat potensial untuk digunakan sebagai bahan baku pembuatan gelatin karena mencakup 7% dari bobot hidup (Romans et al. 1994). Jumlah ini bervariasi menurut spesies, jenis makanan, umur ternak dan sebagainya. Pada jumlah pemotongan sapi sebesar 1 789 849 ekor (Dirjetnak 2003) produksi tulang dapat mencapai 43 851 ton yang siap dimanfaatkan untuk pembuatan gelatin. Selama ini tulang sapi yang merupakan produk sampingan (animal by product) dari rumah pemotongan hewan belum dimanfaatkan secara optimal. Produksi tulang yang ada digunakan sebagai tepung tulang untuk campuran pakan ternak. Sementara itu pemanfaatan tulang sapi masih dapat ditingkatkan diantaranya sebagai bahan perekat, pembuatan gelatin dan sebagai adsorben dalam berbagai industri pangan seperti industri pemurnian gula (Kirk dan Othmer 1948).
Selama ini sumber utama gelatin yang banyak diteliti dan dimanfaatkan adalah berasal dari kulit sapi dan babi, namun penggunaan kulit sapi masih bersaing dengan industri penyamakan kulit. Oleh karena itu perlu dikembangkan gelatin dari sumber bahan baku yang lain.
Gelatin, sebagai salah satu hasil sampingan dari peternakan yang pengunaannya sangat luas, baik untuk produk pangan maupun non pangan. Gelatin merupakan produk turunan protein yang diperoleh dari hidrolisis kolagen hewan yang terkandung dalam tulang dan kulit (Gomez-Guillen dan Montero 2001). Gelatin masuk kategori pangan banyak dimanfaatkan sebagai; bahan penstabil (stabilizer), pembentuk gel (gelling agent), pengikat (binder), pengental (thickener), pengemulsi (emulsifier), perekat (adhesive) dan pembungkus makanan yang bersifat dapat dimakan (edible coating). Gelatin yang masuk kategori non pangan dimanfaatkan dalam industri farmasi dan kedokteran, industri teknik, industri kosmetik dan industri fotografi. Pasar terbesar gelatin adalah industri makanan yang meliputi 55% dari total pasar dunia. Industri farmasi menggunakan gelatin untuk menghasilkan hard dan soft capsule, microcapsule
Di Indonesia gelatin masih merupakan barang impor. Selama ini gelatin diimpor dari Jepang, Amerika, Argentina, Australia dan Perancis. Dengan ketergantungan terhadap impor dapat memberikan berbagai konsekuensi, diantaranya adalah harga gelatin yang relatif mahal serta kontrol kehalalan produk yang kurang memadai. Di pasaran pada saat ini, gelatin kebanyakan diproduksi dari kulit dan tulang sapi atau babi dengan harga Rp 80 000 per kilogram (BPS 2005).
Data statistik menunjukkan bahwa kebutuhan impor gelatin tahun 2004 sebesar 2 630 692 kg. Berdasarkan pada kenyataan tersebut di atas, maka upaya pemanfaatan hasil sisa pemotongan ternak tulang sapi merupakan alternatif yang perlu dipertimbangkan sebagai bahan baku pembuatan gelatin yang bernilai rupiah lebih tinggi.
Proses pembuatan gelatin dapat dibagi menjadi dua yakni, proses asam) dan proses basa (Hinterwaldner 1977). Pada proses asam, bahan baku direndam didalam larutan asam organik seperti asam klorida, asam sulfat, asam sulfit atau asam fosfat. Sedangkan pada proses basa bahan baku direndam pada larutan alkali misalnya air kapur (Poppe 1992). Kualitas gelatin yang dihasilkan selain dipengaruhi oleh larutan asam atau basa, juga dipengaruhi oleh lama perendamam.
Penggunaan asam (khususnya HCl) memiliki kelebihan dibanding yang lain karena asam mampu menguraikan serat kolagen lebih banyak dan cepat tanpa mempengaruhi kualitas gelatin yang dihasilkan. Waktu yang dibutuhkan dalam proses asam umumnya 10-48 jam Hinterwaldner (1977), jauh lebih cepat jika dibandingkan dengan proses basa.
Berdasarkan hal-hal tersebut di atas maka upaya pemanfaatan hasil sisa dari pemotongan ternak berupa tulang sapi untuk meningkatkan nilai hasil guna dalam bentuk gelatin sangat penting dilakukan dalam rangka diversifikasi hasil olahan produk hasil ikutan ternak dan tentunya bila berhasil akan membuka lapangan kerja baru bagi masyarakat. Dalam penelitian ini, pengkajian diarahkan kepada konsentrasi HCl dan lama perendaman yang akan memberikan mutu terbaik dari kualitas gelatin yang dihasilkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk memanfatkan tulang sapi sebagai bahan baku gelatin, sedang tujuan khususnya adalah :
1. Menentukan kombinasi yang tepat antara konsentrasi HCl dan lama perendaman dalam upaya menghasilkan gelatin yang berkualitas.
2. Membandingkan gelatin tulang sapi dengan standar yang ada.
Manfaat Penelitian
1. Meningkatkan daya guna hasil ikutan ternak dan salah satu upaya diversifikasi bahan baku pembuatan pembuatan gelatin yang murah, tetapi memiliki karakteristik fisik dan kimia yang sama dengan bahan lain.
2. Dengan diperolehnya beberapa informasi terutama bahan dan cara dari penelitian ini, maka diharapkan dapat bermanfaat sebagai sumber referensi untuk nantinya dapat diterapkan di industri dalam menghasilkan gelatin skala besar.
TINJAUAN PUSTAKA
Tulang SapiTulang merupakan jaringan yang dinamis yang secara kontinyu dapat diperbaharui dan direkonstruksi. Tulang memiliki pembuluh darah, pembuluh limfe dan syaraf. Tulang panjang seperti tulang paha (femur) memiliki bentuk seperti silinder dengan bagian ujung yang membesar. Bagian yang berbentuk silinder disebut diafisis yang terdiri dari tulang kompak sedangkan bagian ujung yang membesar terdiri dari tulang berongga dan disebut epifisis. Tulang kering terdiri dari bahan organik dan bahan anorganik dalam perbandingan 2:1. Penghilangan zat organik oleh panas tidak menyebabkan perubahan stuktur tulang secara keseluruhan, tetapi akan mengurangi berat tulang (Septimus 1961).
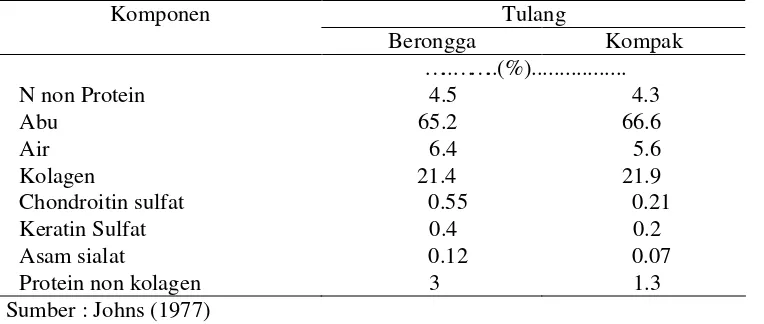
Menurut Johns (1977) mengemukakan bahwa tulang yang biasa digunakan dalam pembuatan gelatin adalah tulang kompak karena dapat diekstraksi lebih dari satu kali sehingga menghasilkan gelatin lebih banyak. Selain itu tulang kompak lebih mudah dipisahkan dari jaringan di sekitarnya dibanding dengan tulang berongga. Perbandingan komposisi tulang berongga dan tulang kompak dapat dilihat pada Tabel 1.
Tabel 1 Perbandingan tulang berongga dan tulang kompak
Komponen Tulang
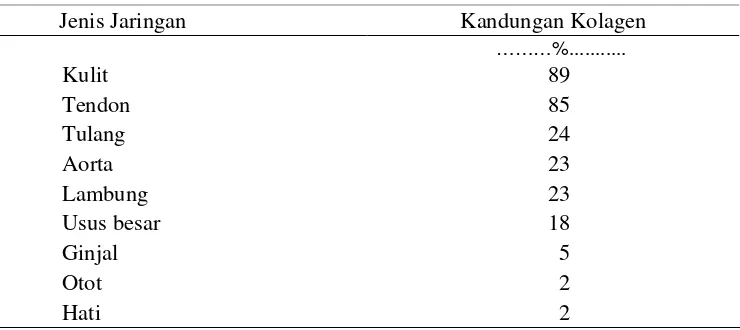
pada bangsa burung dan ikan, sedangkan pada avertebrata kolagen terdapat pada dinding sel (Ward dan Courts 1977). Penyebaran kolagen pada berbagai jaringan mamalia ditunjukkan Tabel 2.
Tabel 2 Penyebaran kolagen pada berbagai jaringan hewan mamalia
Jenis Jaringan Kandungan Kolagen
Sumber : Ward dan Courts 1977
Menurut Brown et al. (1997), kolagen merupakan kelompok protein struktural yang bersumber dari matriks ekstraseluler. Fibril kolagen merupakan struktur protein yang penting dalam kulit, tulang, dinding jaringan darah serta organ-organ bagian dalam. Sesuai dengan struktur alami, secara komersial kolagen banyak dimanfaatkan dalam dunia kedokteran, pangan dan industri perkulitan. Rantai peptida kolagen setiap individu sangat panjang dan mengandung kira-kira 1050 asam amino residu.
Kolagen yang berarti bahan pembentuk perekat merupakan komponen utama jaringan pengikat, yang bertindak sebagai elemen penahan tekanan pada semua mamalia dan ikan. Meskipun kolagen yang paling banyak terdapat dalam kulit, tendon dan tulang, serat kolagen meliputi setiap organ dan jaringan. Kolagen merupakan protein yang unik karena komposisi asam aminonya yang tinggi yaitu kandungan akan asam amino siklik, prolin dan hidroksiprolin, disamping sejumlah besar glisin dan alanin yang merupakan asam amino nonpolar gugus pendek (Glicksman 1969).
Molekul kolagen tersusun kira-kira dua puluh asam amino yang memiliki bentuk agak berbeda tergantung pada sumber bahan bakunya. Asam amino glisin, prolin dan hidroksiprolin merupakan asam amino utama kolagen. Asam-asam
amino aromatik dan sulfur terdapat dalam jumlah yang sedikit. Hidroksiprolin merupakan salah satu asam amino pembatas dalam berbagai protein (Ward dan Courts 1977).
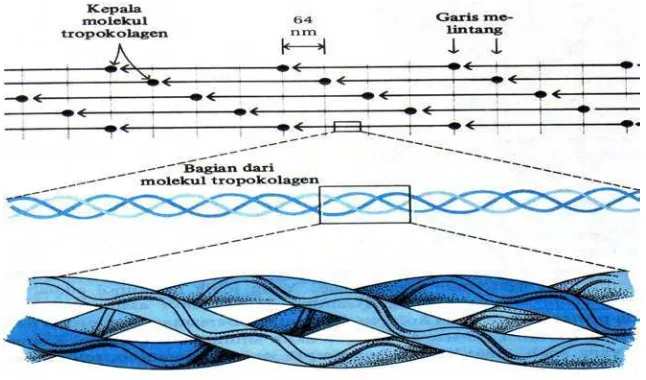
Fibril kolagen terdiri dari sub-unit polipeptida berulang yang disebut tropokolagen yang disusun dalam untaian paralel dari kepala sampai ekor (Gambar 1). Tropokolagen terdiri atas tiga rantai polipeptida yang terpilin erat menjadi tiga untaian atau lembaran panjang, tiap rantai polipeptida dalam tropokolagen juga merupakan satu heliks (Lehninger 1993).
Gambar 1 Susunan molekul tropokolagen dari fibril kolagen (Lehninger 1993).
Bila suatu protein dihidrolisis dengan asam, alkali atau enzim akan dihasilkan campuran asam-asam amino. Sebuah asam amino terdiri dari sebuah gugus amino, sebuah gugus karboksil, sebuah atom hidrogen, dan gugus R yang terikat pada sebuah atom C yang dikenal sebagai á, serta gugus R merupakan rantai cabang
(Winarno 1997).
Gelatin
Gelatin adalah suatu protein yang terdiri dari beberapa asam amino. Sifat-sifat yang dimiliki tergantung dari komposisi asam amino tersebut. Komposisi asam amino bervariasi tergantung pada sumber kolagen, spesies hewan penghasil jenis kolagen. Gelatin dan kolagen memiliki dalam komposisi kimianya yang berbeda (Eastoe dan Leach 1977).
Gelatin dapat diperoleh dengan cara denaturasi panas dari kolagen (Gelatine Food Science 2004). Pemanasan kolagen secara bertahap akan menyebabkan struktur rusak dan rantai-rantai akan terpisah. Berat molekul, bentuk konformasi sensitif terhadap perubahan temperatur yang dapat menghancurkan makro molekulnya (Wong 1989).
Menurut Leiner Davis Gelatin Co (2000) gelatin diperoleh dari hidrolisis terkontrol serat protein kolagen yang banyak ditemukan di alam sebagai unsur pokok dari kulit, tulang dan jaringan pengikat. Berdasarkan proses pembuatannya gelatin dapat dibagi menjadi dua tipe yaitu proses asam disebut gelatin tipe A dan gelatin yang diperoleh dari proses basa disebut gelatin tipe B.
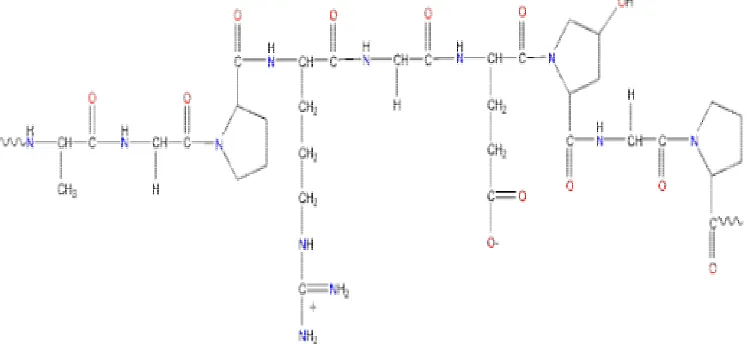
Menurut Poppe (1992), gelatin merupakan hasil hidrolisis parsial kolagen yang diperoleh melalui ekstraksi dalam air panas yang dikombinasikan dengan perlakuan alkali atau asam. Struktur kimia gelatin menurut Chaplin (2004) disajikan pada Gambar 2.
Gambar 2 Struktur kimia gelatin (Chaplin 2004).
Salah satu tipe struktur gelatin adalah –Ala-Gly-Pro-Arg-Gly-Glu-4Hyp-Gly-Pro- (Chaplin 2004). Gelatin merupakan senyawa turunan protein dari serat kolagen yang ada pada kulit, tulang dan tulang rawan. Susunan asam aminonya mirip dengan kolagen dimana glisin sebagai asam amino utama dan merupakan 2/3 dari seluruh asam amino yang menyusunnya, 1/3 asam amino yang tersisa terdiri dari prolin dan hidroksiprolin (Charley 1982).
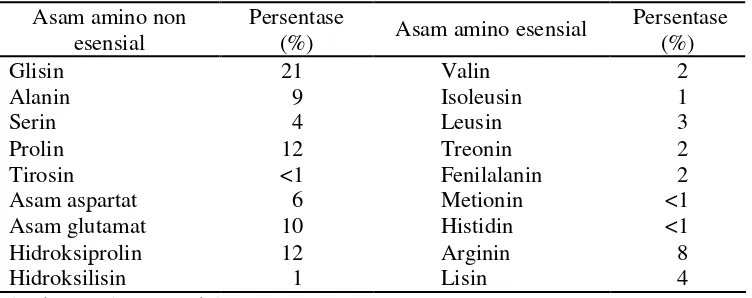
Parker (1982) menyatakan bahwa gelatin merupakan suatu polimer linier dari asam amino yang umumnya terjadi dari pengulangan asam amino glisin-prolin-prolin atau glisin-glisin-prolin-prolin-hidroksiglisin-prolin-prolin. Komposisi asam amino gelatin bervariasi tergantung pada spesies hewan penghasil, sumber kolagen dan jenis kolagen (Ward dan Courts 1977). Gelatin bukan termasuk protein yang lengkap karena kekurangannya akan asam amino esensial triptofan, tetapi gelatin mengandung sedikit asam amino yang jarang ditemui yaitu hidroksilisin (Glicksman 1969). Hasil penelitian Gelatine Food Science (2004) menyatakan bahwa komposisi asam-asam amino non esensial dan esensial gelatin tergantung pada bahan bakunya dan cara pembuatannya seperti tertera pada Tabel 3.
Tabel 3 Komposisi asam amino non esensial dan esensial gelatin
Asam amino non
Sumber : Gelatine Food Science (2004)
Gelatin merupakan protein jenis kolagen yang dihidrolisis dengan asam, alkali atau enzim sehingga dihasilkan campuran asam-asam amino. Gelatin mengandung asam amino non essensial yaitu asam glutamat yang tinggi yang sangat penting peranannya dalam pengolahan makanan, karena dapat menimbulkan cita rasa yang lesat (Winarno 1997).
Secara fisik gelatin dapat berbentuk bubuk, pasta maupun lembaran gelatin. Gelatin yang berbentuk lembaran dan butiran sebelum digunakan perlu direndam terlebih dahulu, sedangkan gelatin yang berbentuk bubuk langsung digunakan. Produk gelatin murni mempunyai sifat tidak berasa, tidak berbau dan memiliki warna sedikit kuning (Mrak dan Stewart 1957). Gelatin memiliki beberapa sifat yaitu dapat berubah secara reversible dari bentuk sol ke gel, membengkak atau
mengembang dalam air dingin, dapat membentuk film, mempengaruhi viskositas suatu bahan dan dapat melindungi sistem koloid (Parker 1982). Menurut Jones (1977) sifat gelatin yang dapat mengubah bentuk sol menjadi gel atau mengubah cairan menjadi padatan elastis yang bersifat reversible tersebut yang membedakan gelatin dengan gel hidrokoloid lain seperti pektin, pati, alginat, protein susu, dan albumin telur yang bentuk gelnya bersifat irreversible.
Pembuatan Gelatin
Menurut Hinterwaldner (1977), proses pembuatan gelatin dapat dibagi menjadi dua yaitu; gelatin tipe A (proses asam) dan gelatin tipe B (proses basa). Pada proses asam bahan baku direndam dalam larutan asam organik seperti asam klorida, asam sulfat, asam sulfit dan asam fosfat. Diantara asam organik tersebut yang paling baik dan umum digunakan adalah asam klorida (HCl). Konsentrasi HCl yang digunakan dalam pembuatan gelatin 1-5% dengan masa rendam selama 10-48 jam. Kelebihan HCl dibandingkan dengan jenis asam lain adalah mampu menguraikan serat kolagen lebih banyak dan cepat tanpa mempengaruhi kualitas gelatin yang dihasilkan serta mengubah serat kolagen triple heliks menjadi rantai tunggal (Ward dan Courts 1977). Sedangkan pada proses basa, perendaman bahan baku dilakukan dengan larutan alkali misalnya air kapur dengan masa rendamnya 8-12 minggu dan dihasilkan rantai ganda (Poppe 1992).
Proses pembuatan gelatin secara umum dibagi dalam tiga tahap yaitu pertama persiapan bahan baku yang berupa penghilangan komponen non kolagen dari bahan baku dengan atau tanpa pengurangan ikatan antara komponen kolagen, kedua konversi kolagen menjadi gelatin dan ketiga pemurnian serta perolehan gelatin dalam bentuk kering. Adapun tahap tahap pembentukan gelatin dari tulang sapi meliputi pembersihan, pemilihan dan pengecilan tulang, degreasing, demineralisasi, perendaman larutan asam, ekstraksi, pemekatan dan pengeringan (Hinterwaldner 1977). Lebih lanjut dinyatakan bahwa konversi kolagen menjadi gelatin dilakukan pada suhu ekstraksi terkontrol untuk mencegah kerusakan protein. Suhu ekstraksi yang digunakan antara 50-100 oC atau lebih rendah, sedangkan nilai pH ekstraksi dapat bervariasi untuk setiap metode. Proses pemurnian dilakukan dengan cara penyaringan yang bertujuan untuk
menghilangkan zat-zat lain yang tidak larut yang akan mengurangi kemurnian gelatin. Tahapan proses ekstraksi kolagen secara bertingkat menjadi gelatin disajikan pada Tabel 4.
Tabel 4 Tahapan proses ekstraksi kolagen secara bertingkat menghasilkan gelatin
Pemekatan larutan gelatin untuk meningkatkan total solid larutan sehingga mempercepat proses pengeringan dengan menggunakan evaporator. Menurut Hadiwiyoto (1983), pemekatan dilakukan selama 5 jam pada suhu 70 oC hingga kepekatan mencapai 25%-30%.
Pada prinsipnya terbentuk sifat-sifat gel akibat adanya pembentukan jala atau jaringan tiga dimensi oleh molekul polimer. Kunci utama dalam pembentukan gel (gelasi = gelation) adalah pembentukan ikatan silang (cross lingkages) diantara molekul-molekul polimer yang memperkuat jaringan gel. Ikatan-ikatan silang yang terdapat pada gel bahan pangan umumnya tidak permanen. Molekul- molekul polimer diikat longgar oleh sejumlah besar ikatan-ikatan yang lemah seperti ikatan hidrogen (Fardiaz 1989).
Salah satu sifat gelatin yang secara makromolekul berperan dalam pemanfaatannya adalah perubahan dari sol ke gel atau sebaliknya. Gel gelatin terbentuk oleh ikatan rantai molekul yang bersifat interaksi termasuk ikatan hidrogen, ikatan ion dan ikatan hidrofobik antar rantai. Perubahan sol ke gel atau sebaliknya dipengaruhi oleh perubahan suhu, komposisi pelarut dan pH (Yoshimura et al. 2000).
Sifat Fisik Gelatin
Salah satu sifat fisik yang penting pada gelatin adalah kekuatan untuk membentuk gel yang disebut sebagai kekuatan gel. Pembentukan gel merupakan hasil pembentukan ikatan hydrogen antar molekul gelatin sehingga dihasilkan gel
semi padat yang terikat dalam komponen air. Kekuatan gel dipengaruhi oleh pH, adanya komponen elektrolit dan non elektrolit serta bahan tambahan lainnya. Pengaruh asam, alkali, panas dan enzim proteolitik sebagai zat penghidrolisis akan merusak struktur gelatin sehingga gel tidak terbentuk. Viskositas gelatin sebagai larutan merupakan salah satu sifat yang penting juga. Viskositas dipengaruhi oleh interaksi hidrodinamik antar molekul gelatin, suhu, pH dan konsentrasi. Sifat fisik lainnya adalah titik pembentukan gel, kekeruhan, warna, kapasitas emulsi, dan stabilitas emulsi (Glicksman 1969). Berdasarkan Dewan Standarisasi Nasional No.06-3735-1995 (1995) dan Gelatin Manufacturers Institute of America (GMIA) (2001), karakteristik gelatin tertera pada Tabel 5.
Tabel 5 Standar mutu gelatin berdasarkan Standar Nasional Indonesia No. 06-3735 -1995 dan GMIA
Karakteristik SNI No. 06-3735-1995*
Warna Tidak berwarna sampai kekuningan
Bau, rasa Normal
Kadar air Maksimum 16%
Kadar abu Maksimum 3.25%
Kekuatan gel 50-300 bloom**
Viskositas 15-70 mps atau 1.5-7 cP**
pH 4.5-6.5**
Logam berat Maksimum 50 mg/kg
Arsen Maksimum 2 mg/kg
Tembaga Maksimum 30 mg/kg
Seng Maksimum 100 mg/kg
Sulfit Maksimum 1000 mg/kg
Sumber : *DSN (1995), ** GMIA (2001)
Gelatin mudah larut pada suhu 71 oC dan cenderung membentuk gel pada suhu 48 oC. Gelatin mudah larut dalam gliserol, manitol, sorbitol dan propilen, tetapi tidak larut dalam alkohol, aseton dan pelarut non polar seperti tetraklorida, protelium, ether dan karbon disulfida (Glicksman 1969).
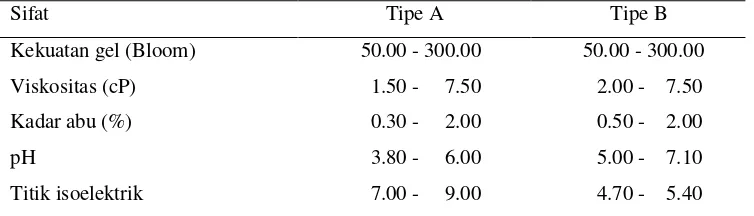
Sifat fisik maupun kimia gelatin tergantung pada kualitas bahan baku, pH, keberadaan zat-zat organik, metode ekstraksi, suhu dan konsentrasi (Parker 1982). Menurut Gelatin Manufacturers Institute of America (GMIA) (2001), beberapa sifat penting gelatin dapat dilihat pada Tabel 6.
Tabel 6 Sifat – sifat fungsional gelatin tipe A dan tipe B
Hasil penelitian Aryanti (1998), menunjukkan bahwa kualitas gelatin yang dihasilkan dari tulang domba bervariasi dengan nilai rendemen berkisar 1.64-9.43%, kadar protein 7.581%-86.79%, pH 2.94-3.84, viskositas 4.45 cP-6.85 cP dan kekuatan gel 187-808 g/cm2. Untuk variasai lama perendaman 10,29,dan 48 jam dengan menggunakan HCl 5 %. Hasil penelitian tersebut disimpulkan bahwa kualitas gelatin yang terbaik dengan kuantitas yang terbanyak diperoleh melalui perendaman dalam HCl 5% selama 29 jam dengan rendemen 8,4%, kadar protein 84.91 %, pH 3.64, viskositas 5.9 cP dan kekuatan gel 727.5 g/cm2.
Menurut Siringoringo (2000), kualitas gelatin yang berasal dari tulang domba dengan jenis perendaman basa 5%, 10%, dan 15% selama 6, 8, dan 10 minggu diperoleh rendemen berkisar 3.52-6.52%, kadar protein 71.98-83.32%, pH 5.08-5.09 dan viskositas 4.50 cP-8.39 cP serta kekuatan gel 49.98 g/cm2-113.95 g/cm2. Hasil penelitian ini disimpulkan bahwa penggunaan larutan basa 5% dengan lama perendaman 6 minggu menghasilkan kualitas yang terbaik dengan kuantitas yang tinggi yakni dengan nilai rendemen 5.70 % kadar protein 83.32%, pH 5.09, viskositas 4.50 cP dan kekuatan gel 113.95g/cm2.
Manfaat Gelatin
Gelatin merupakan koloid yang digunakan secara luas, sebagai koloid yang bersifat hidrofilik dapat digunakan untuk menstabilkan koloid yang bersifat hidrofobik. Sehingga efektif digunakan sebagai pengemulsi, dan penstabil dalam sistem emulsi (Glisksman 1969). Gelatin sebagai pelindung koloid dapat berguna dalam industri fotografi dan pelapisan logam dalam industri (Ward dan Courts 1977)
Gelatin dapat dimanfaatkan dalam berbagai produk pangan maupun non pangan. Industri pangan yang membutuhkan gelatin adalah industri permen, jelly, es krim, roti, saus, produk daging dan produk olahan susu. Sedangkan dalam industri non pangan, gelatin digunakan dalam industri kosmetik yaitu lipstik, shampo, krim pelindung kulit dari sinar matahari dan lotion; industri farmasi yaitu sebagai bahan baku kapsul atau pembungkus tablet obat; industri fotografi yaitu sebagai pengikat bahan peka cahaya, pembawa dan pelapis zat warna film,serta bahan industri lainnya seperti industri pembuatan lem, pelapis kertas, cat, bahan percetakan dan lain-lain (Poppe 1992).
Waktu dan Tempat Penelitian
Penelitian ini berlangsung dari bulan Januari sampai September 2005. Penelitian dilakukan di Laboratorium Teknologi Agroindustri Badan Pengkajian dan Penerapan Teknologi (LTA BPPT) yang terletak di kawasan PUSPITEK, Serpong, Tangerang. Analisa dilakukan di Laboratorium Kimia Pangan PAU, Laboratorium Rekayasa Bioproses Pangan PAU, Institut Pertanian Bogor, dan Laboratorium Balai Penelitian Pasca Panen (BALITPASCA), Bogor.
Materi Penelitian
Bahan dan Alat
Bahan baku digunakan dalam penelitian ini meliputi tulang sapi bagian paha belakang (os femur), diperoleh dari Rumah Potong Hewan (RPH), PT Celmor Perdana Indonesia Indonesia yang berada didalam kawasan kampus Institut Pertanian Bogor, Bogor. Tulang sapi segar disimpan dalam freezer sebelum dibawa ketempat penelitian di Serpong.
Gambar 3 Tulang femur sapi.
Bahan-bahan lain adalah gelatin komersial, asam klorida, serta bahan yang digunakan untuk analisis fisik dan kimia; H2SO4 pekat, larutan H2BO3, aquades,
NaOH, HCl 0.02 N dan selenium mixture.
Peralatan yang digunakan dalam pembuatan gelatin adalah timbangan, wadah plastik (ember dan baskom), pan plastik, mesin cuci, pisau, gergaji listrik, filter vakum, saringan dengan ukuran 100 mesh, 150 mesh, dan 200 mesh,
water batch, panci stainless stell, blender, termometer, gelas piala, gelas ukur,
oven, cawan petri, cawan porselin, tanur, labu kjeldahl, desikator, erlenmeyer, labu takar, chiller, pH meter, viskometer dan voland stevens Texture Analayzer, chromameter.
Metode Penelitian
Penelitian ini dilaksanakan dengan dua (2) tahap, yaitu penelitian pendahuluan dan penelitian utama. Sebelum dilakukan penelitian, terlebih dahulu dilakukan analisa proksimat terhadap tulang sapi yang akan digunakan. Hasil analisa proksimat pada tulang sapi (Tabel 7).
Tabel 7 Hasil analisa proksimat tulang sapi
Komponen Hasil analisa
Keterangan : Laboratorium Kimia Pangan, PAU (2005) Penelitian Pendahuluan
Penelitian pendahuluan ini bertujuan untuk memperoleh metode degreasing
yang efektif dan konsentrasi serta lama perendaman asam klorida yang optimum untuk demineralisasi. Hasil penelitian pendahuluan ini digunakan sebagai acuan pada penelitian utama.
Pada penelitian tahap ini dilakukan demineralisasi tulang sapi dengan menggunakan asam klorida. Konsentrasi HCl dan lama perendaman yang digunakan mengacu pada pernyataan Mrak dan Stewart (1957), yaitu konsentrasi 4%, 5%, 6%, 7% dengan lama perendaman masing-masing 10 hari, 12 hari, 14 hari. Pada penelitian ini diukur kadar kasium yang terlarut. Jumlah kadar kalsium yang paling tinggi terlarut dijadikan sebagai acuan untuk demineralisasi pada penelitian utama.
Degreasing (penghilangan lemak) dilakukan dengan beberapa metode untuk mendapatkan metode yang optimal. Menurut Hinterwaldner (1977) proses
tulang, yaitu antara 32-80 oC, sehingga dihasilkan kelarutan lemak yang optimum. Metode degreasing yang telah dilakukan pada penelitian ini dengan penggantian air rebusan tiap jam dapat dilihat pada Tabel 8.
Tabel 8 Deskripsi hubungan lama suhu perebusan dan pelepasan daging serta kandungan lemak gelatin
No Metode perebusan Deskripsi
1 Suhu 70 oC selama 2 jam Daging menempel pada tulang sangat keras dan sangat sukar untuk dilepaskan.
2 Suhu 70 oC selama 2 jam + nonnyl phenol 1 %
Daging menempel pada tulang sangat keras dan sangat sukar untuk dilepaskan
3 Suhu 80 oC selama 4 jam Daging menempel pada tulang cukup mudah dikeluarkan tetapi jaringam ikat sukar dilepaskan
4 Suhu 80 oC selama 4 jam + hexan
Daging menempel pada tulang mudah dikeluarkan tetapi kandungan lemak gelatin masih tinggi yakni 4.21 %
5 Suhu 100 oC selama 4 jam Daging dan semua kotoran mudah dilepaskan dari bagian tulang serta lemaknya semakin menurun.
Jumlah tulang yang diperoleh setelah didegreasing dan dikeringkan sebesar 78% dari tulang segar. Untuk menghilangkan mineral, tahap selanjutnya adalah penghilangan mineral (demineralisasi) sehingga tulang menjadi lunak yang disebut dengan ossein. Tahap demineralisasi dilakukan dengan cara merendam tulang dalam larutan asam kuat. Asam kuat yang digunakan adalah asam klorida (HCl) dengan konsentrasi 5%, 6% dan 7%. Hasil analisa jumlah mineral yang terlarut pada prosese demineralisasi dapat dilihat pada Tabel 9.
Tabel 9 Jumlah mineral terlarut selama demineralisasi selama 10 hari
Konsentrasi HCl Jumlah mineral yang terlarut
……(%)……. ……….(%)……….
5 16.48
6 17.32
7 14.98
Keterangan : Laboratorium Kimia Pangan, PAU (2005)
Berdasarkan hasil penelitian pendahuluan diperoleh jumlah mineral yang terlarut lebih banyak yakni 6%. Oleh sebab itu pada penelitian utama diberikan perlakuan untuk demineralisasi konsentrasi HCl 6%.
Penelitian Utama
Penelitian utama dilakukan berdasarkan demineralisasi yang terbaik dari penelitian pendahuluan. Sedangkan proses asam dilakukan dengan perendaman HCl pada konsentrasi 2%, 3.5% dan 5% dengan lama perendaman 24 jam, 36 jam dan 48 jam.
Penelitian utama ini bertujuan untuk mengkarakteristik gelatin dari tulang sapi dengan metode perendaman asam klorida dan membandingkan mutu gelatin pada konsentrasi dan lama perendaman yang berbeda sesuai perlakuan. Proses pembuatan gelatin dari tulang sapi dilakukan sebagai berikut :
Perlakuan Awal
Bahan baku dibersihkan dari sisa-sisa daging yang menempel dan
dipotong-potong dengan ukuran 3-5 cm2, dilakukan proses penghilangan lemak
(degreasing) dengan cara tulang sapi dimasak selama 4 jam pada suhu 100 oC. Selama proses degreasing, dilakukan pengadukan secara kontinyu dan air rebusan diganti setiap jam sehingga air rebusan tidak berminyak. Tulang yang telah didegreasing dijemur di bawah sinar matahari selama 2 hari untuk menghindari kerusakan bahan baku. Kemudian tulang dipotong lebih lanjut dengan ukuran tulang sapi menjadi 1-2 cm2. Pengecilan ukuran ini bertujuan untuk memperluas permukaan tulang sehingga dalam proses selanjutnyadapatberjalan efektif. Demineralisasi
Tulang direndam dalam larutan HCl 6% selama 10 hari. Tulang yang telah direndam dalam larutan asam ini disebut ossein dan dipisahkan dengan cara penyaringan dengan menggunakan kain tetra. Selanjutnya ossein dinetralkan dengan menggunakan air.
Proses Asam
Ossein yang dihasilkan dari perlakuan demineralisasi direndam dalam HCl dengan konsentrasi HCl 2%, 3.5% dan 5% dan lama perendaman 24 jam, 36 jam dan 48 jam. Selanjutnya ossein dinetralkan dengan menggunakan air.
Ekstraksi
Ossein diekstraksi dengan menempatkan ossein dalam panci stainless steel
dan ditambahkan aquades. Proses ekstraksi dalam tiga tahap, masing-masing tahap berlangsung pada temperatur 65 oC (5 jam), 75 oC (4 jam), 85 oC (3 jam)
dengan perbandingan ossein dan aquades 1 : 2. Filtrat diperoleh melalui filtrasi vakum (vacum filtration) secara bertahap pada suhu 50-70 oC dengan ukuran filter masing-masing tahap sebesar 100 mesh, 150 mesh dan 200 mesh.
Pemekatan
vakum pada suhu 55 oC hingga diperoleh tingkat kepekatan 15-25%. Pendinginan
Larutan gelatin yang diperoleh masih dalam keadaan encer. Kemudian dilakukan pendinginan dalam ruangan pendingin 10 oC.
Pengeringan
Gelatin yang telah berbentuk gel selanjutnya dikeringkan. Pengeringan dilakukan dengan menggunakan oven pada suhu 50 oC sampai diperoleh gelatin kering dengan kadar air pada kisaran 9-16%. Selanjutnya dilakukan proses penghalusan (grinding), sehingga diperoleh gelatin kering dalam bentuk butiran-butiran halus. Diagram alir proses pembuatan gelatin dari tulang sapi dapat lihat pada Gambar 4.
Peubah yang Diamati
Peubah yang diamati pada penelitian ini yaitu sifat fisik dan kimia gelatin. Sifat fisik yang diuji adalah rendemen, warna, kekuatan gel, viskositas, stabilitas emulsi dan kapasitas emulsi. Sedangkan sifat kimia yaitu pH, kadar air, kadar abu, kadar protein, kadar lemak dan kadar kalsium.
Rendemen
Rendemen diperoleh dari perbandingan berat kering sheet gelatin yang dihasilkan dengan bahan segar (tulang yang telah dibersihkan dari sisa daging dan lemak)(AOAC 1995). Rendemen dapat diperoleh dengan menggunakan rumus :
Rendemen (% ) = x 100%
Gambar 4 Proses ekstraksi gelatin dari tulang sapi (Modifikasi dari Glicksman 1969)
Demineralisasi (direndam dengan HCl 6% selama 10 hari)
Dicuci dengan air mengalir sampai pH netral (6–7) Dikeringkan dibawah sinar matahari selama 2 hari
Dibersihkan dari sisa daging dan dipotong-potong dengan ukuran 3-5 cm2
Dipotong-potong dengan ukuran 1- 2 cm2
Degreasing dengan cara dimasak pd suhu 100 oC selama 4 jam
Ossein direndam dengan HCl 2%, 3.5% dan 5% lama perendaman 24 jam, 36 jam dan 48 jam
Dicuci dengan air mengalir sampai pH netral (6–7) selama 9 jam
Ossein diekstraksi dlm waterbath pada suhu 65 oC (5jam), 75 oC (4 jam),dan 85 oC (3 jam)
Ekstrak disaring dgn saringan ukuran 100 mesh, 150 mesh dan 200 mesh
Dipekatkan dengan evaporator pada suhu 55 oC
Didinginkan dalam ruang pendingin dengan suhu 10 oC
Gelatin dicairkan lalu dicetak dalam pan-pan cetakan
Dikeringkan dalam oven pada suhu 50 oC selama 36 jam
Sheet gelatin Tulang sapi
Kekuatan Gel
Sampel sebanyak 6.67 gram dilarutkan dalam aquades sampai mencapai volume 100 ml dalam labu takar, kemudian dipindahkan dalam gelas piala 100 ml dipanaskan sebentar sampai gelatin larut kemudian didinginkan pada suhu 10 oC selama 17 jam. Gel yang terbentuk selanjutnya dianalisis menggunakan Volland-Stevens LFRA Texture Analizer. Dari grafik yang diperoleh ditentukan kekuatan gelnya sebagai berikut :
Kekuatan gel (dyne/cm2) = x 980 G F
Nilai kekuatan gel (dyne/cm2) dikonversikan ke nilai kekuatan gel (Bloom) dengan menggunakan rumus :
Kekuatan gel (Bloom) = 20 + 2.86.10-3 D Keterangan : F = tinggi grafik sebelum patah G = konstanta (0.07)
D = kekuatan gel (dyne/cm2) Viskositas
Viskositas gelatin diukur berdasarkan (British Standard 757 1975), dengan cara larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan aquades kemudian diukur viskositasnya dengan menggunakan alat Haake Viskometer.
Pengukuran ini dilakukan pada suhu 60 oC dengan laju geser 60 rpm
menggunakan spindel no. 1. Nilai viskositasnya dalam satuan centripoise (cP). Kapasitas Emulsi
Sebanyak 2 gram sampel dilarutkan dalam 40 ml aqudes, lalu pH diatur menjadi 8 sambil diaduk dengan magnetic stirrer selama 5 menit. Ditambahkan minyak jagung sebanyak 10 ml, pengadukan dilanjutkan selama 10 menit. Emulsi yang terbentuk lalu dipanaskan dalam penangas air pada suhu 85 oC selama 15 menit sambil sesekali diaduk. Selanjutnya diletakkan pada air mengalir selama 15 menit pada suhu 25 oC, setelah itu dilakukan sentrifuse pada 3000 rpm selama 25 menit. Butiran minyak yang tidak teremulsi dipisahkan, kemudian bahan ditimbang kembali. Kapasitas emulsi dinyatakan dengan persentase volume minyak yang teremulsi tiap gram sampel yang digunakan (ml/gr) ( Ige et al. 1984).
Stabilitas Emulsi
Sebanyak 10 gram sampel di suspensi dalam 100 ml aquades setelah itu ditambahkan air sampai 150 ml dan minyak jagung sebanyak 150 ml, kemudian diblender selama dua menit. Hasilnya dituang dalam tabung sentrifuse dan dipanaskan pada suhu 80 oC selama 30 menit. Air yang sudah tidak membentuk emulsi dipisahkan kemudian ditimbang (Sathe dan Salunkhe 1981). Stabilitas emulsi dinyatakan sebagai campuran yang masih membentuk emulsi setelah mengalami pemanasan dan dihitung menggunakan rumus :
Stablitas emulsi = x 100%
Larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan larutan aquades. Larutan sample dipanaskan pada suhu 70 oC dan dihomogenkan dengan
magnetic stirrer, kemudian diukur derajat keasamannya pada suhu kamar dengan pH meter(British Standard 757 1975).
Warna
Warna dihitung menggunakan alat chromameter tipe Minolta CR 300. Pada penelitian ini menggunakan sistem notasi Hunter yaitu dicirikan dengan tiga notasi warna L, a dan b. Notasi warna L menyatakan kecerahan (light) yang mempunyai nilai dari 0 (hitam) sampai 100 (putih). Nilai L menyatakan cahaya pantul yang menghasilkan warna kromatik putih, abu-abu dan hitam. Notasi a menyatakan warna kromatik campuran hijau-merah, dengan nilai +a (positif) dari 0 sampai +60 untuk warna merah dan nilai –a (negatif) dari 0 sampai -60 untuk warna hijau. Notasi b menyatakan warna kromatik campuran biru-kuning, dengan nilai +b (positif) dari 0 sampai +60 untuk warna kuning dan nilai –b (negatif) dari 0 sampai -60 untuk warna biru (Soekarto 1990).
Kadar Air
Cawan dikeringkan pada suhu 105 oC selama 1 jam kemudian didinginkan dan ditimbang. Sampel yang akan ditentukan kadar airnya ditimbang sebanyak 5 g. Cawan yang berisi sampel dimasukkan ke dalam oven bersuhu 105 oC sampai mencapai berat konstan (AOAC 1995). Kadar air dihitung berdasarkan persamaan berikut :
Kadar air (% bk) = x 100%
Sampel yang telah diuapkan airnya dimasukkan ke dalam tanur bersuhu 600 oC. Sebelumnya berat cawan kering dan berat sampel telah diketahui. Proses penguapan dilakukan sampai semua bahan berubah warna menjadi abu–abu kemudian contoh ditimbang (AOAC 1995). Kadar abu dihitung dengan menggunakan rumus :
Sampel seberat 0.2-0.05 gr dimasukkan dalam labu Kjeldahl 100 ml, kemudian ditambahkan 2-3 gr katalis (1.2 gr Na2SO4 dan 1 gr CuSO4 dan 2 ml
H2SO4 pekat. Dilakukan destruksi sampai larutan menjadi jernih. Setelah itu
didinginkan kemudian sampel didestilasi dan ditambahkan 35 ml aquades dan 10 ml NaOH 50%. Hasil destilasi dalam erlenmeyer 125 ml yang berisi 5 ml H3BO3 kemudian dititrasi dengan HCl 0.02 N dengan menggunakan indikator.
Hal yang sama dilakukan untuk blanko (AOAC 1995). Persentase nitrogen dan kadar protein kasar dihitung dengan rumus sebagai berikut :
Kadar nitrogen = x 100%
Sebanyak 5 gram sampel dibungkus dalam kertas saeing dan dimasukkan ke dalam labu soxhlet (labu sebelumnnya dikeringkan dalam oven, dimasukkan ke dalam desikator lalu ditimbang). Dimasukkan pelarut hexana kemudian dilakukan reflux selama 6 jam. Lalu labu hasil reflux dipanaskan dalam oven dengansuhu 105 oC (Apriyantono et al. 1989).
Kadar lemak ditentukan dengan rumus :
% Lemak = 100%
HCl ekstrak sebanyak 50 ml dipipet kedalam gelas piala 250 ml dan ditambahkan 100 ml pereaksi Chapman, kemudian dipanaskan diatas penangas air. Ditambahkan NH4OH pekat (27-27%), sambil diaduk hingga terbentuk warna
hijau (pH 4.6), lalu didiamkan sekurang-kurangnya 1 jam diatas penangas air dan jika sudah jernih dapat disaring. Endapan dan kertas saring dimasukkan kedalam gelas piala semula, larutkan dengan 20 ml H2SO4 (1:4) lalu ditambahkan ± 150 ml
H2O dan dipanaskan ditasa penangas air pada suhu 80-90 oC. Kemudian dititar
denga KMnO4 0.02 atau 0.05 N. Blanko dibuat dengan cara mengencerkan 2.5 ml
HCl 25% atau 8.8 ml HCl pekat hingga 100 ml, kemudian diambil 20 ml untuk blanko dan dikerjakan seperti contoh.
% CaO = 100%
Penelitian ini menggunakan rancangan acak lengkap faktorial dengan dua faktor, yaitu konsentrasi larutan HCl (2%, 3.5 % dan 5%) dan lama perendaman (24 jam, 36 jam dan 48 jam) dengan tiga kali ulangan. Model Matematika rancangan percobaan yang digunakan menurut Steel dan Torrie (1995) adalah :
Bj = Pengaruh lama perendaman pada taraf ke-j (dimana j =
24 jam, 36 jam dan 48 jam)
(AB)ij = Pengaruh interaksi konsentrasi HCl ke-i dan lama perendaman ke-j
å(ij)k = Galat percobaan ulangan ke-k (dimana k = 1, 2, 3)
Analisis Data
Data yang diperoleh dianalisis dengan menggunakan analisis ragam (ANOVA). General data diolah dengan prosedur General Linear Models (GLM) dari program SAS. Jika hasil analisis ragam berpengaruh nyata maka dilakukan uji lanjut Least Square Mean.
HASIL DAN PEMBAHASAN
Sifat Fisik Gelatin Tulang Sapi
Analisis fisik yang diukur dalam penelitian ini mencakup rendemen, kekuatan gel, viskositas, kapasitas emulsi, stabilitas emulsi, dan warna (Tabel 10).
Rendemen
Salah satu peubah yang penting dalam pembuatan gelatin adalah rendemen karena semakin besar rendemen yang dihasilkan maka semakin efisien dan efektifitas proses tersebut. Rendemen dihitung berdasarkan persentase berat gelatin yang dihasilkan terhadap berat awal tulang yang digunakan. Rendemen yang diperoleh dipengaruhi oleh jumlah kolagen yang terkonversi menjadi gelatin. Kandungan kolagen dalam tulang mamalia sebesar 24% lebih kecil dibanding jumlah kolagen yang terdapat pada kulit 89% namum apabila dibandingkan dengan penelitian pada kulit jumlah kolagen yang terkonversi menjadi gelatin hampir sama.
Gambar 5 Sheet gelatin tulang sapi.
Tabel 10 Rekapitulasi hasil analisis ragam terhadap sifat fisik gelatin tulang sapi
Keterangan : Angka yang diikuti superskrip berbeda pada baris dan kolom menunjukkan hasil berbeda sangat nyata (P<0.01)
Berdasarkan uji lanjut terhadap rendemen yang diperoleh pada berbagai konsentrasi HCl yang diterapkan, menunjukkan adanya perbedaan yang sangat nyata antara konsentrasi HCl 2%; 3.5%; dan 5%. Rendemen gelatin tertinggi diperoleh dari konsentrasi 5% dibandingkan dengan konsentrasi 3.5% dan 2%. Tingginya rendemen yang diperoleh pada perlakuan ini diduga pengaruh pH larutan. Hal ini mendukung pendapat Ward and Courts (1977) menyatakan transformasi kolagen menjadi gelatin dipengaruhi oleh pH, suhu dan waktu pemanasan.
Seperti yang terlihat pada Tabel 10 ada perbedaan sangat nyata (P<0.01) terhadap rendemen yang pada tiap taraf lama perendaman. Pada lama perendaman 48 jam diperoleh rata-rata rendemen sebesar 4.04±0.78% berbeda sangat nyata dengan lama perendaman 24 jam dan 36 jam dengan rata-rata rendemen dan 3.17±0.64% dan 3.70±0.62%. Fenomena ini mengindikasikan bahwa semakin lama waktu perendaman maka semakin banyak jumlah tripel heliks pada kolagen berubah menjadi rantai á, â, dan ã, sehingga lebih banyak kolagen yang terkonvesi menjadi gelatin.
Kekuatan Gel
Kekuatan gel sangat penting dalam penentuan perlakuan yang terbaik dalam proses pembuatan gelatin, karena salah satu sifat penting gelatin adalah mampu mengubah cairan menjadi padatan atau mengubah bentuk sol menjadi gel yang bersifat reversibel. Kemampuan inilah yang menyebabkan gelatin sangat luas penggunaannya, baik dalam bidang pangan maupun non pangan. Selanjutnya menurut Stainsby (1977) bahwa pembentukan gel terjadi karena pengembangan molekul gelatin pada waktu pemanasan. Panas akan membuka ikatan-ikatan pada molekul gelatin dan cairan yang semula bebas
mengalir menjadi terperangkap didalam struktur tersebut, sehingga menjadi kental. Setelah semua cairan terperangkap menjadi larutan kental larutan tersebut akan membentuk gel secara sempurna jika disimpan pada suhu refrigator 10 oC selama 17±2 jam.
Seperti yang terlihat pada Lampiran 2, hasil analisis ragam kekuatan gel gelatin nyata (P<0.05) dipengaruhi oleh interaksi antara konsentrasi HCl dan lama perendaman. Kombinasi konsentrasi HCl 2% dengan lama perendaman 24 jam menghasilkan kekuatan gel yang tertinggi (135.45±6.38), sedangkan kombinasi konsentrasi HCl 5% dengan lama perendaman 48 jam menghasilkan kekuatan gel yang paling rendah (31.11±2,68).
Kekuatan gel mengalami penurunan dengan peningkatan konsentrasi HCl dan lama perendaman (Gambar 6). Laju penurunan kekuatan gel antara konsentrasi 2%; 3.5% dan 5% masing-masing laju penurunannya adalah 1.43 Bloom/jam, 0.95 Bloom/jam dan 0.61 Bloom/jam.
1 0
Gambar 6 Grafik hubungan konsentrasi HCl dan lama perendaman terhadap kekuatan gel gelatin.
Hasil uji lanjut menunjukkan ada perbedaan yang sangat nyata (P<0.01) pada kekuatan gel gelatin tulang sapi yang dihasilkan dengan kombinasi konsentrasi HCl dan lama perendaman, namun pada konsentrasi 3.5% tidak ada dengan lama perendaman 36 jam dan 48 tidak ada perbedaan. Pada konsentrasi 5% tidak ada perbedaan kekuatan gel dengan lama perendaman 24 jam dan 36 jam.
Pembentukan gel selain dipengaruhi pH, adanya elektrolit dan non elektrolit serta aditif juga dipengaruhi oleh konsentrasi dan suhu. Semakin tinggi konsentrasi maka gel yang terbentuk semakin baik tetapi sebaliknya dengan suhu (Poppe 1992). Yoshimura et al. (2000) juga menyatakan bahwa kekuatan gel bertambah secara linier dengan penambahan konsentrasi gelatin. Pengukuran kekuatan gel pada penelitian ini dilakukan pada suhu dan konsentrasi yang sama sehingga kedua hal tersebut tidak mempengaruhi hasil kekuatan gel yang dihasilkan.
Viskositas
Viskositas merupakan sifat fisik gelatin yang penting setelah kekuatan gel, karena viskositas mempengaruhi sifat fisik gelatin yang lain seperti titik leleh, titik jendal dan stabilitas emulsi. Leiner (2000), viskositas gelatin berpengaruh terhadap sifat gel terutama titik pembentukan gel dan titik leleh, dimana viskositas
gelatin yang tinggi menghasilkan laju pelelehan dan pembentukan gel yang lebih tinggi dibanding gelatin yang viskositasnya rendah. Dan untuk stabilitas emulsi gelatin diperlukan viskositas yang tinggi.
Menurut Stainsby (1977), menyatakan bahwa viskositas berhubungan dengan berat molekul rara-rata gelatin (mendekati linear). Sedangkan berat molekul rata-rata berhubungan dengan panjang rantai asam aminonya. Semakin tinggi konsentrasi HCl yang digunakan, rantai asam amino strukturnya semakin terbuka menyebabkan rantai tersebut semakin pendek dan terjadi penurunan viskositas. Nilai viskositas yang dihasilkan pada penelitian ini berkisar antara 3.12-5.10 cP. Nilai ini memenuhi persyaratan seperti yang dikemukakan GMIA (2001) yaitu 1.50-7.50 cP, tetapi masih lebih rendah dibanding viskositas gelatin komersial (Lampiran 14).
Gambar 7Grafik hubungan konsentrasi dan lama perendaman terhadap viskositas gelatin.
Hasil analisis ragam (Lampiran 3) menunjukkan interaksi antara konsentrasi HCl dan lama perendaman berpengaruh nyata (P<0.05) terhadap viskositas gelatin tulang sapi. Berdasarkan hasil uji lanjut dengan menggunakan LSMean, menunjukkan bahwa interaksi konsentrasi dan lama perendaman berbeda sangat nyata (P<0.01). Pada kombinasi lama perendaman 24 jam dengan konsentrasi HCl 2% dan 3.5%; 2% dan 5% menunjukkan perbedaan yang sangat nyata, sedangkan pada konsentrasi 3.5% dan 5% tidak ada perbedaan. Untuk lama perendaman 36 jam dan 46 jam menunjukkan perbedaan yang sangat nyata (P<0.01) pada berbagai konsentrasi.
Stainsby (1977) menyatakan viskositas minimum pada saat titik isoelektrik dan maksimum kira-kira pada pH 3 dan pH 10.5. Nilai viskositas akan meningkat sejalan dengan penurunan suhu ekstraksi, peningkatan suhu sampai sekitar 40 oC mengakibatkan viskositas menurun secara eksponensial. Adanya elektrolit juga dapat menurunkan viskositas larutan. Konsentrasi gelatin mempengaruhi viskositas yaitu dengan penambahan konsentrasi gelatin menyebabkan koloid akan semakin kental sehingga ruang gerak antar molekul gelatin semakin sempit, kemungkinan terjadi penyatuan molekul gelatin (agregation) juga semakin kecil, ini akan mengakibatkan peningkatan nilai viskositas gelatin.
Kapasitas Emulsi
Kapasitas emulsi merupakan parameter yang menunjukkan seberapa banyaknya fase terdisfersi (volume minyak) yang dapat diemulsikan oleh gelatin (gram) yang telah dilarutkan dalam air, dinyatakan dalam persen. Dalam pembentukan emulsi gelatin, yang berperan adalah gugus polar bebas yang akan larut dalam fase air dan rantai hidrokarbon yang akan larut dalam fase minyak. Kapasitas emulsi erat kaitannya dengan kualitas gelatin sebagai pengemulsi. Kapasitas emulsi yang dihasilkan dari penelitian ini berkisar antara 69.87-109.71%. Hasil ini lebih rendah dari kapasitas emulsi gelatin komersial (Lampiran 14) yaitu 107.65%. Analisis ragam (Lampiran 4) menunjukkan interaksi antara konsentrasi HCl dan lama perendaman berpengaruh nyata terhadap kapasitas emulsi gelatin tulang sapi. Faktor tunggal yakni konsentrasi berpengaruh sangat nyata (P<0.01) terhadap kapasitas emulsi gelatin tulang sapi, namun lama perendaman tidak berpengaruh nyata.
Kapasitas emulsi yang tinggi berhubungan dengan proses perendaman. Pada proses perendaman terjadi pemecahan ikatan silang intermolekular dan intramolekuler (Wong 1989) yaitu pemecahan ikatan hidrogen dan ikatan hidrofobik yang membantu heliks kolagen tetap stabil. Pemecahan ini akan banyak menghasilkan rantai asam amino yang mempunyai dua bagian (bagian hidrofobik yang memiliki afinitas yang kecil terhadap air dan bagian hidrofilik yang mempunyai daya tarik terhadap air) yang berperan dalam pembentukan emulsi, sehinggga diasumsikan semakin tinggi pula kapasitas emulsi gelatin yang diperoleh.
70
Gambar 8 Grafik hubungan konsentrasi dan lama perendaman terhadap kapasitas emulsi gelatin.
Berdasarkan hasil uji lanjut dengan menggunakan LSMean, menunjukkan bahwa interaksi konsentrasi dan lama perendamam berbeda sangat nyata (P<0.01). Pada lama perendaman 24 jam dengan konsentrasi HCl 2% dan 5%; 3.5% dan 5% menunjukkan perbedaan sangat nyata, tetapi pada konsentrasi 2% dan 3.5% tidak ada perbedaan. Untuk lama perendaman 36 jam pada berbagai konsentrasi tidak ada perbedaan, sedangkan pada lama perendaman 48 jam hanya berebeda sangat nyata pada konsentrasi 2% dan 3.5%.
Stabilitas Emulsi
Stabilitas emulsi merupakan kemampuan untuk mempertahankan agar emulsi stabil atau tidak pecah selama penyimpanan. Gelatin selain berfungsi sebagai bahan pengemulsi (emulsifier), juga berfungsi untuk mempertahankan kestabilan emulsi (stabilizer). Semakin tinggi nilai stabilitas emulsi maka sifat fungsional gelatin sebagai stabilizer semakin bagus
Stabilitas emulsi gelatin tulang sapi yang diperoleh berkisar 51.71-59.21% dengan rataan umum 56.61% dan koefisien keragaman 2.49%. Analisis ragam (Lampiran 5) menunjukkan stabilitas emulsi tidak dipengaruhi oleh interaksi konsentrasi HCl dan lama perendaman begitu pula dengan faktor tunggal. Nilai stabilitas emulsi gelatin yang diperoleh dari penelitian tercantum dalam Tabel 11.
Stabilitas emulsi tergantung pada ukuran partikel fase terdispersi, tegangan permukaan partikel, perbedaan densitas dari kedua fase, viskositas, jenis dan jumlah pengemulsi yang digunakan. Glicksman (1969) menyatakan stabilitas emulsi semakin tidak stabil dalam kondisi viskositas yang semakin rendah karena globula-globula lemak semakin bebas bergerak dan membentuk agregat satu sama lainnya sehingga emulsinya tidak stabil.
Kemampuan gelatin untuk menstabilkan emulsi merupakan hasil dari kemampuan gelatin untuk mempertahankan aksi koloidnya yang membentuk lapisan tipis yang mengelilingi fase terdisperi. Lapisan tipis yang menyelubungi partikel dan lokasinya berada diantara kedua permukaan, yaitu antara senyawa terdispersi dan senyawa pendispersi atau tepatnya senyawa ini disebut lapisan interfasial. Kedua lapisan tersebut (senyawa terdispersi dan senyawa pendispersi) mempunyai tegangan yang disebut tegangan permukaan yang penting peranannya dalam sistem emulsi. Gelatin merupakan salah satu senyawa aktif permukaan yang mampu menurunkan tegangan antar permukaan tersebut (de Man 1997).
Air dan minyak merupakan cairan yang tidak saling berbaur, tetapi saling ingin terpisah (antagonistik) karena mempunyai berat jenis dan polaritas yang berbeda. Pada sistem emulsi keberadaan gelatin sebagai pengemulsi (emulsifier) berfungsi menjaga agar butir minyak tetap tersuspensi di dalam air. Winarno (1997) menyatakan daya kerja emulsifier terutama disebabkan oleh bentuk molekulnya yang dapat terikat baik pada minyak maupun air. Emulsifier
mempunyai dua sisi dengan sifat yang berbeda. Salah satu sisinya bersifat polar yang dapat berikatan dengan cairan yang bersifat polar (air), sedangkan sisi yang lainnya bersifat non polar yang berikatan dengan fase non polar (minyak) (Graham 1977). Proses pengukuran kapasitas emulsi disini merupakan jenis emulsi minyak dalam air (o/w) yaitu minyak sebagai fase terdispersi dan air sebagai fase pendispersi atau fase continous. Skema terjadinya emulsi minyak dalam air dapat dilihat pada Gambar 9.
Gambar 9 Skema emulsi minyak dalam air (Winarno 1997).
Butir-butir minyak yang telah terdispersi atau terpisah karena adanya tenaga mekanik (pengocokan) segera terselubungi oleh selaput tipis emulsifier (gelatin). Bagian molekul gelatin yang nonpolar larut dalam lapisan luar butir-butir minyak, sedangkan bagian yang polar menghadap ke pelarut (air).
Warna
Penentuan mutu bahan makanan pada umumnya ditentukan beberapa faktor diantaranya rasa, tekstur, nilai gizi dan sifat mikrobiologisnya, tetapi sebelum faktor-faktor lain dipertimbangkan, secara visual faktor warna yang mendapat perhatian pertama. Menurut Winarno (1997), cara pengukuran warna secara teliti dilakukan dengan mengukur komponen warna dalam besaran value, hue dan chroma. Nilai value menunjukkan gelap terangnya warna, nilau hue mewakili panjang gelombang yang dominan yang akan menentukan apakah warna tersebut merah, hijau atau kuning, sedangkan chroma menunjukkan intensitas warna. Ketiga komponen ini diukur dengan menggunakan alat khusus yang mengukur
kromatositas permukaan suatu bahan. Notasi Warna “L”
Notasi warna “L” merupakan notasi menunjukkan tingkat kecerahan (light) yang mempunyai kisaran nilai 0-100 (hitam-putih). Nilai L mengindikasikan cahaya pantul yang menghasilkan warna akromatik putih, abu-abu dan hitam (Soekarto 1990).
Rataan nilai notasi warna L gelatin tulang sapi berkisar 53.93-57.19. Kisaran nilai tersebut menunjukkan warna gelatin hasil penelitian ini ke warna cerah, jika dibandingkan dengan gelatin komersial (Lampiran 14) nilai kecerahan yang diperoleh yang sama. Hasil analis ragam (Lampiran 6) menunjukkan warna L gelatin tulang sapi tidak dipengaruhi interaksi konsentrasi HCl dan lama perendaman serta faktor tunggal.
Warna b
Notasi warna “b” merupakan notasi yang menyatakan warna kromatik campuran biru-kuning, dengan nilai +b (positip) memiliki interval 0 sampai 70 untuk warna kuning, sedangkan nilai -b (negatif) memiliki interval 0 sampai 70 untuk warna biru (Soekarto 1990).
Seperti yang terlihat pada Lampiran 7, berdasarkan nilai b gelatin tulang sapi yang dihasilkan pada penelitian ini berkisar 39.69-41.97 yang menunjukan warna kromatik kuning. Warna gelatin dapat dipengaruhi oleh metode pengeringan yang digunakan. Menurut Glicksman (1969), warna gelatin dipengaruhi oleh bahan baku yang digunakan, metode pembuatan dan jumlah ekstraksi
Hasil analisis ragam (Lampiran 7) menunjukkan bahwa warna b gelatin sangat nyata (P<0.01) dipengaruhi oleh interaksi konsentrasi HCl dan lama perendaman.
Gambar 10 Grafik hubungan konsentrasi HCl dan lama perendaman terhadap notasi warna b gelatin.
Berdasarkan hasil uji lanjut dengan menggunakan LSMean, menunjukkan bahwa interaksi konsentrasi dan lama perendamam berbeda sangat nyata (P<0,01). Pada lama perendaman 24 jam dan 48 jam pada berbagai konsentrasi HCl menunjukkan perbedaan yang sangat nyata terhadap warna b gelatin yang dihasilkan. Untuk lama perendaman 36 jam dengan konsentrasi HCl 3.5% dan 5% tidak ada perbedaan terhadap warna b gelatin tulang sapi.
Secara umum warna gelatin yang diperoleh pada penelitian ini adalah warna kuning gading, untuk lebih jelasnya dapat dilihat pada Lampiran 14. warna ini hampir mendekati warna gelatin komersial menurut Dewan Standarisasi Nasional (1995) yaitu tidak berwarna sampai kekuning-kuningan pucat.
Sifat Kimia Gelatin Tulang Sapi
Analisis kimia yang diukur dalam penelitian ini meliputi : pH, kadar air, kadar abu, kadar protein, kadar lemak dan kadar kalsium dapat dilihat pada Tabel 2. Nilai pH
Nilai pH merupakan salah satu sifat kimia gelatin yang penting, karena mempengaruhi sifat-sifat gelatin yang lainnya sehingga menentukan aplikasi selanjutnya. Nilai pH yang diperoleh dari penelitian ini berkisar 3.96-4.48 dengan rataan umum 4.30±0.17 (Tabel 11) dan koefisien keragaman 3.52%. Hasil ini sesuai dengan standar gelatin edible hasil proses asam yang ditetapkan oleh GMAP (2004) yaitu 3.8-5.5. Jamilah dan Harvinder (2001) menyatakan perbedaan pH gelatin mungkin juga disebabkan oleh tipe dan kekuatan asam yang bekerja selama proses ekstraksi berlangsung. Data lengkap pH yang diperoleh dari penelitian ini dapat dilihat dalam Tabel 11.
Hasil analisis ragam (Lampiran 8) menunjukkan tidak ada yang nyata terhadap pH gelatin. Kondisi ini menggambarkan bahwa semua perlakuan konsentrasi HCl dan lama perendaman menghasilkan respon yang sama, sehingga pengaruh konsentrasi HCl dan lama perendaman dapat diabaikan
Gelatin yang dihasilkan dari penelitian ini mempunyai pH yang rendah, ini diperkirakan karena pada saat proses perendaman HCl terjadi swelling
(pembengkakan) sehingga mengakibatkan terbukanya struktur koil kolagen dan HCl masuk dalam jaringan tersebut. Bila pada saat pencucian atau netralisasi tidak