KAJIAN EPIDEMIOLOGI VIRUS
AVIAN INFLUENZA
PADA DISTRIBUSI ANAK AYAM UMUR SATU HARI
SOPHIA SETYAWATI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Kajian Epidemiologi Virus
Avian Influenza Pada Distribusi Anak Ayam Umur Satu Hari adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2010
© Hak Cipta Milik IPB, Tahun 2010 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KAJIAN EPIDEMIOLOGI VIRUS
AVIAN INFLUENZA
PADA DISTRIBUSI ANAK AYAM UMUR SATU HARI
SOPHIA SETYAWATI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
SETYAWATI, S. Epidemiology Study of Avian Influenza virus in distribution of day old chick. Supervisors : RETNO D. SOEJOEDONO, EKOWATI HANDHARYANI and BAMBANG SUMIARTO
Avian Influenza (AI) or bird flu caused by AI virus subtype H5N1 is still present in Indonesia. The Department of Agriculture of Indonesia has banned poultry distribution from endemic area to non endemic area, except for distribution of day old chick (DOC). The aim of this research is to detect possible infection of AI virus in DOC that will be distributed from AI endemic area to AI non endemic area. Epidemiological data were collected through interviews. As much as 240 DOCs from farms in West Java and Banten were taken from Soekarno Hatta airport. Antibody titers were measured in every DOCs against AI virus with Haemaglutination Inhibition (HI) test. The AI virus detection in tissues (trachea, lung, heart, kidney, liver, and intestine) by using immunohistochemistry technique. Detection of AI virus using AI H5N1 monoclonal antibody with AEC as chromogen which will give the virus a reddish color. The result of this research showed 158 samples (65.8%) were positive of antigen AI H5N1 virus in tissues. From 158 samples positive, 65.8% of samples showed presence of antigen only in trachea, lung, intestine, and 34.2% were present in all tissues (trachea, lung, intestine, liver and kidney). Pooled samples of trachea, lung and egg yolk were tested for the presence of Influenza A viruses by using Reverse Transcriptase-Polymerase Chains Reactions (RT-PCR) with matrix primer pairs (FAI; RAI), positive samples were then further tested with H5 primer pairs (FH5; RH5) (Lee
et al. 2004). The result of this research showed 44 egg yolk samples (55%) were
positive of Influenza A. From the 44 samples positive, 19 samples (43.2%) were positive AIV Subtype H5 and 25 samples (56.8%) were positive another subtype (Hx). This research showed that AIV were able to spread by vertical transmission, because viral concentrations were highest in the egg yolk than the tracheas and lungs. Laboratory result and questioners were then analyzed using logistic analysis and Unweighted Least Squares Linear Regression. The highest prevalence AI distribution of DOC of this study was in Bogor (91.7%) and the lowest prevalence was Sukabumi (77.6%). The highest AI infection cases in broiler DOCs was found in Bogor district during rainy season. Transportation using private vehicle could minimize the risk of AI infection. From the result showed that DOCs were infected with AI virus with subclinical symptoms and DOC is one of the potential causes of the rapid AI spread in Indonesia, so cautious distribution to AI free areas need to be taken.
RINGKASAN
SETYAWATI, S. Kajian Epidemiologi Virus Avian Influenza Pada Distribusi Anak Ayam Umur Satu Hari. Dibimbing oleh : RETNO D. SOEJOEDONO, EKOWATI HANDHARYANI dan BAMBANG SUMIARTO
Virus AI patogenitas tinggi atau Highly PathogenicAvian Influenza (HPAI) saat ini telah menyebar dengan cepat hampir ke seluruh Wilayah Negara Republik Indonesia. Penanganan yang serius perlu segera dilakukan agar wabah AI tidak berkembang menjadi pandemi influenza. Jika dilihat dari jumlah kematian unggas, mulai Bulan Agustus 2003 hingga November 2005, kejadian AI cenderung mengalami penurunan tetapi wilayah yang terjangkit cenderung meluas.
Penelitian ini diharapkan dapat mengungkap informasi tentang kemungkinan anak ayam umur satu hari (DOC) terinfeksi atau membawa virus AI. Tujuan penelitian ini adalah mendeteksi keberadaan virus AI pada DOC menggunakan Teknik Pewarnaan Imunohistokimia (IHK), melakukan identifikasi virus AI yang berasal dari DOC dengan Reverse Transcriptase Polymerase Chain Reactions (RT-PCR) dan isolasi virus AI serta melakukan kajian epidemiologi adanya infeksi virus AI pada DOC.
Sampel yang digunakan pada penelitian ini adalah DOC final stock (FS) pedaging dan petelur yang berasal dari perusahaan pembibitan di daerah Jawa Barat dan Banten yang akan didistribusikan ke luar Pulau Jawa melalui Bandar Udara Soekarno Hatta dengan metode detect disease. Pengambilan sampel dilakukan pada Bulan April sampai dengan September 2008 dengan jumlah sampel sebanyak 240 ekor DOC dan diketahui presentase jumlah sampel asal Kabupaten Subang (42.5%), Cianjur (22.5%), Tanggerang (22.5%), Bogor (7.5%), dan Sukabumi (5%). Jumlah sampel DOC pedaging sebanyak 156 ekor (65%) dan DOC petelur sebanyak 84 ekor (35%). Pengambilan sampel dengan metode detect disease ini digunakan untuk mendeteksi penyakit AI pada DOC, apabila ditemukan 1 ekor positif maka dapat dikatakan DOC tersebut telah terinfeksi penyakit AI.
Setiap DOC diambil darahnya untuk melihat titer antibodi terhadap AI dengan uji hemaglutinasi inhibisi (HI). DOC tersebut kemudian dinekropsi dan diambil organ (trakea, paru-paru, usus, hati, ginjal) dan kuning telurnya untuk dideteksi keberadaan virus AI menggunakan teknik pewarnaan imunohistokimia (IHK) dan Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR).
Deteksi virus AI dengan metode IHK menggunakan antibodi monoklonal AI H5N1 dengan kromogen (AEC) yang akan memberi warna kemerahan pada virus AI. Hasil penelitian diketahui bahwa 158 sampel (65.8%) positif antigen AI H5N1 pada organ. Dari 158 sampel positif tersebut diketahui bahwa 104 sampel (65.8%) menunjukkan keberadaan antigen hanya pada trakea, paru-paru dan usus sedangkan 54 sampel (34.2%) ditemukan pada semua organ (trakea, paru-paru, usus, hati, ginjal) yang diteliti.
Identifikasi pada 80 sampel kuning telur DOC menunjukkan 44 sampel (55%) kuning telur positif Influenza A dan dari sampel positif Influenza A tersebut 19 sampel (43.2%) menunjukkan positif virus AI subtipe H5 dan 25 sampel (56.8%) positif AI subtipe lainnya (Hx).
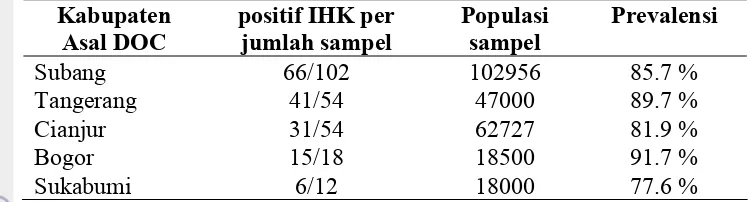
Data epidemiologi diperoleh dengan cara wawancara dan kuesioner. Hasil pemeriksaan laboratorium serta hasil kuesioner kemudian dianalisis dengan analisis logistik untuk mengetahui signifikansi asosiasi antara kejadian AI dan faktor risiko di peternakan sedangkan analisis regresi linier dilakukan untuk menganalisis prevalensi AI. Prevalensi AI tertinggi pada distribusi DOC terdapat pada Kabupaten Bogor (91.7%) dan prevalensi terendah terdapat pada Kabupaten Sukabumi (77.6%). Kasus tertinggi terjadi pada DOC pedaging diawal musim penghujan. Penggunaan alat transportasi milik perusahaan akan mengurangi risiko DOC terinfeksi oleh virus AI.
Hasil penelitian ini diketahui bahwa DOC telah terinfeksi oleh virus AI dengan gejala subklinis dan berpotensi sebagai salah satu penyebab cepatnya penyebaran AI di Indonesia, sehingga perlu diwaspadai pendistribusiannya ke daerah yang masih bebas AI.
Kata kunci : Anak ayam umur satu hari (DOC), Virus AI,
DAFTAR ISI
Halaman DAFTAR TABEL ………..………
DAFTAR GAMBAR ………..………...
DAFTAR LAMPIRAN ...
PENDAHULUAN ... Latar belakang ... Tujuan penelitian ... Manfaat penelitian ... Hipotesis ...
TINJAUAN PUSTAKA... Virus Avian Influenza... Morfologi virus ... Siklus Replikasi virus ... Variasi genetik ... Mutasi dan perubahan antigen... Hanyutan antigenik... Cara penularan ... Gejala klinis dan lesi ... Patogenesis virus avian influenza... Penanggulangan AI ...
DETEKSI VIRUS AVIAN INFLUENZA SUBTIPE H5N1 DENGAN TEKNIK IMUNOHISTOKIMIA ...
Abstract ... Abstrak ... Pendahuluan ... Metode Penelitian ... ... Hasil dan Pembahasan ... Simpulan ... Saran ...
ISOLASI DAN IDENTIFIKASI VIRUS AVIAN INFLUENZA SUBTIPE H5N1 PADA DOC...
KAJIAN EPIDEMIOLOGI PENYEBARAN VIRUS AVIAN
INFLUENZA PADA ANAK AYAM UMUR SATU HARI... Abstract ... Abstrak ... Pendahuluan ... Metode Penelitian ... Hasil dan Pembahasan ... Simpulan ... Saran ...
PEMBAHASAN UMUM ...
SIMPULAN UMUM ...
SARAN ...
DAFTAR PUSTAKA ...
LAMPIRAN ... 41 41 42 43 46 48 54 54
55
61
62
63
DAFTAR TABEL
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
Presentase distribusi antigen AI subtipe H5N1 pada organ DOC dengan metode IHK...
Primer untuk mengamplifikasi Virus AI H5N1 pada DOC...
Titer antibodi terhadap virus AI H5N1 ...
Hasil uji PCR pada kumpulan sampel organ DOC...
Hasil uji PCR sampel kuning telur DOC dengan primer matriks (FAI ; RAI) dan primer H5 (FH5 ; RH5)...
Hasil isolasi virus asal sampel kuning telur dengan uji RT-PCR...
Data lalulintas unggas DOC yang melalui Balai Besar Karantina Pertanian Soekarno Hatta pada tahun 2007...
Daftar pengambilan sampel pengujian tingkat 1 pada kemasan dengan berat bersih ± 1 kg sd 4.5 kg...
Hasil prevalensi AI asal DOC yang dilalulintaskan ...
Perbandingan titer antibodi DOC dengan hasil positif IHK... 21
31
33
34
35
38
47
48
49
DAFTAR GAMBAR
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
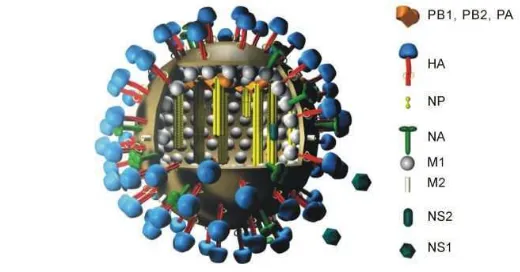
Struktur genetik virus avian influenza...
Replikasi virus influenza tipe A ...
Bagan patogenesis dan epidemiologi influenza unggas ...
Presentase hasil positif dan negatif IHK pada organ DOC...
Sampel organ dan kuning telur DOC yang diperiksa menggunakan RT-PCR...
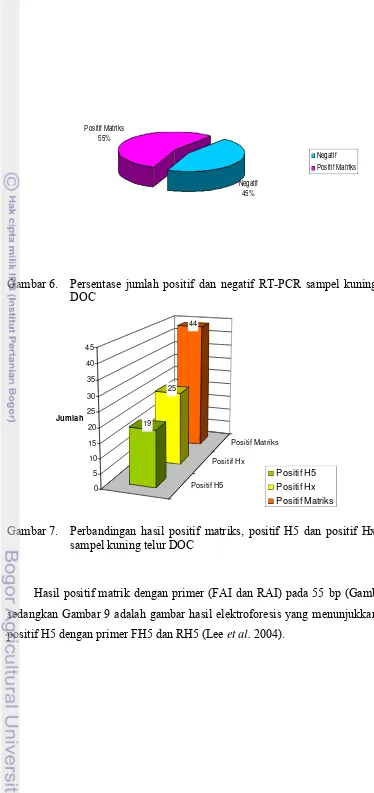
Persentase jumlah positif dan negatif RT-PCR sampel kuning telur DOC...
Perbandingan hasil positif matriks, positif H5 dan positif Hx pada sampel kuning telur DOC...
Hasil elektroforesis produk RT-PCR dengan primer matrik FAI dan RAI...
Hasil elektroforesis produk RT-PCR dengan primer FH5 dan RH5...
Wilk-Shapiro/Rankit Plot model Best Subset Regression...
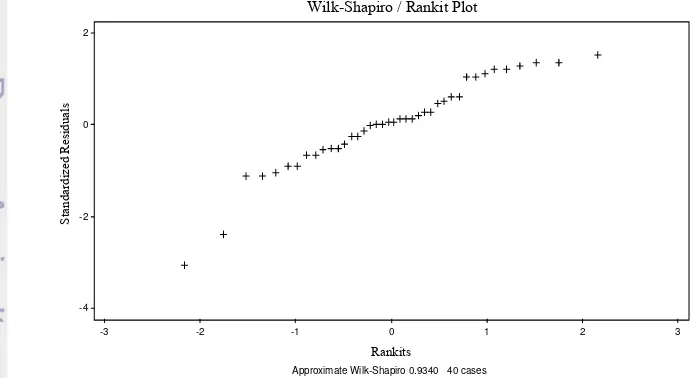
Histogram dari model Best Subset Regression...
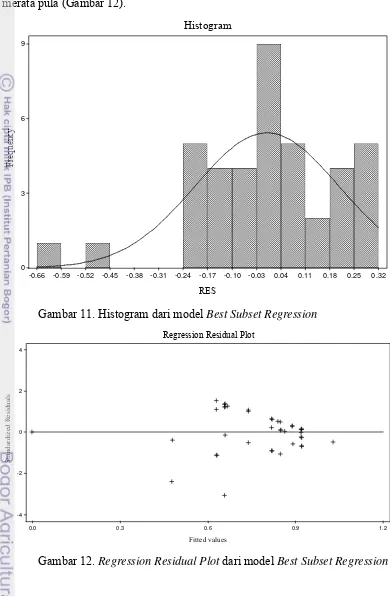
Regression Residual Plot dari model Best Subset Regression... 6
7
11
21
29
36
36
37
37
51
52
DAFTAR LAMPIRAN
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
Data Hasil Uji HI dan Uji IHK pada DOC……...
Penghitungan Kappaantara hasil uji imunohistokimia (IHK) dan uji Hemaglutinasi Inhibisi (HI) pada 240 sampel DOC...
Gambaran dengan metode imunohistokimia pada beberapa organ DOC yang terinfeksi virus AI H5N1………...
Hasil Uji PCR matriks dan H5 pada 80 sampel kuning telur DOC...
Penghitungan Kappa antara Uji Imunohistokimia dan Uji PCR pada 80 sampel DOC...
Penghitungan Statistik Diskriptif dan Distribusi Frekuensi Tingkat Ternak………..……….
Penghitungan Statistik Diskriptif dan Distribusi Frekuensi Tingkat Peternak…….………...
Penghitungan Logistic Regression infeksi virus AI pada tingkat ternak………
Hasil prevalensi AI pada setiap sampling DOC...
Penghitungan Model Best Subset Regression, Stepwise Regression
dan Unweighted Least Squares Linear Regression pada tingkat
Peternak………
Kuesioner Kajian Epidemiologi Virus Avian Influenza pada Distribusi Anak Ayam Umur Satu Hari……….
71
77
78
81
83
85
88
90
96
97
PENDAHULUAN
Latar Belakang
Penyakit Avian Influenza (AI) atau Highly Pathogenic Avian Influenza
(HPAI) saat ini telah menyebar hampir ke seluruh Wilayah Negara Republik
Indonesia dan berdampak sangat merugikan bagi peternakan unggas serta telah
menyebabkan kematian pada manusia di beberapa daerah. Penanganan yang
serius perlu segera dilakukan agar wabah AI tidak berkembang menjadi pandemi
influenza. Pandemi influenza akan berdampak sangat besar, mengakibatkan
kerugian ekonomi karena banyaknya unggas yang harus dimusnahkan serta
kerugian sosial karena banyaknya manusia yang sakit bahkan meninggal dunia.
Pada tahun 1997 wabah HPAI yang disebabkan oleh subtipe H5N1 telah
mengakibatkan 6 orang meninggal dunia di Hongkong (Suarez et al. 1998).
Kejadian HPAI di Indonesia diyakini berawal pada Bulan Agustus 2003
pada peternakan ayam ras komersial di Jawa Barat dan Jawa Tengah yang
kemudian meluas ke seluruh pulau Jawa, Bali, dan beberapa daerah di Sumatera
serta Kalimantan. Pada Tahun 2004 jumlah kematian unggas terus meningkat dan
menyebar ke-16 propinsi yang mencakup 100 kabupaten/kota. Mulai Bulan
Agustus 2003 hingga November 2005 jumlah kematian unggas cenderung
mengalami penurunan meski wilayah yang terjangkit cenderung meluas. Menteri
Pertanian secara resmi pada Bulan Januari 2004 mengumumkan bahwa virus AI
subtipe H5N1 telah masuk di Indonesia, dan sampai saat ini virus tersebut
dinyatakan endemik di 31 dari 33 propinsi di Indonesia.
Menurut Darminto (2006), berbagai usaha telah dilakukan untuk
memberantas dan mencegah penyebaran penyakit AI, namun penyakit yang
disebabkan oleh virus RNA dari famili Orthomyxoviridae ini sulit sekali
diberantas. Tindakan pencegahan melalui pengaturan distribusi unggas ke daerah
bebas telah dilakukan oleh pemerintah dengan melarang peredaran unggas dewasa
dan hanya mengijinkan lalulintas anak ayam umur satu hari (DOC), anak itik
umur satu hari (DOD), telur dan pakan ternak dari daerah tertular ke daerah bebas
memenuhi kebutuhan konsumen di daerah yang masih bebas AI tetapi tidak
memiliki peternakan komersial karena sentra industri peternakan unggas sebagian
besar terletak di Pulau Jawa yang merupakan daerah tertular. Sampai saat ini
belum diketahui dengan pasti penyebab wabah penyakit AI cepat sekali menyebar
ke seluruh Wilayah Indonesia walaupun pemerintah Indonesia telah
mengupayakan pencegahan serta pengendaliannya. Kondisi ini sangat
memprihatinkan karena timbul berbagai dugaan tentang penyebaran virus AI yang
mengakibatkan masyarakat menjadi takut berdekatan dengan unggas dan
mengkonsumsi produk unggas.
Wibawan (2006) menyatakan bahwa infeksi virus AI saat ini berbentuk
subklinis, yaitu hewan terlihat sehat tetapi sebenarnya sakit. Adanya kasus
penyakit yang tidak terdeteksi dengan tepat akan menyebabkan meluasnya kasus
AI di lapangan. Tingginya tingkat infeksi virus AI juga memungkinkan virus ini
bertahan dan memunculkan strain virus yang lebih patogen melalui proses mutasi
dan/atau genetic reassortment. Diversitas genetik virus AI pada reservoir hewan
liar kemungkinan juga berperan penting dalam proses keberlangsungan hidup
virus AI di alam (Easterday et al. 1997).
Food and Agriculture Organization (FAO 2007) melaporkan kejadian dan
uji eksperimental yang mengindikasi bahwa virus AI dapat diisolasi dari kuning
dan putih telur ayam di daerah wabah AI. Keberadaan virus AI pada telur
dilaporkan pula oleh Promkuntod (2006), dikatakan bahwa virus AI ditemukan
dalam campuran albumin dan cairan alantois serta oviduct burung puyuh jepang
(Coturnix coturnix japonica) yang terinfeksi secara alami. Bukti awal lapang dan
analisis data laboratorium mengindikasi bahwa virus dapat ditemukan di dalam
kuning dan putih telur yang dihasilkan oleh kelompok ayam pada situasi puncak
infeksi AI. Kemungkinan terjadinya penularan vertikal telah dikhawatirkan oleh
para pakar, tetapi belum dapat dibuktikan secara pasti (Akoso 2006). FAO(2008)
juga melaporkan bahwa kemungkinan DOC terinfeksi virus AI sangat kecil tetapi
DOC dapat menyebarkan AI karena terkontaminasi virus saat transportasi atau
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mendeteksi keberadaan virus AI pada DOC menggunakan Teknik Pewarnaan
Imunohistokimia (IHK).
2. Melakukan identifikasi virus AI yang berasal dari DOC dengan Reverse
Transcriptase Polymerase Chain Reactions (RT-PCR) dan isolasi virus AI.
3. Melakukan kajian epidemiologi adanya infeksi virus AI pada DOC.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat digunakan sebagai bahan
pertimbangan dalam menentukan kebijakan terutama di Badan Karantina
Pertanian dalam hal lalulintas unggas dan produknya.
Hipotesis
1. Virus AI dapat diisolasi dari telur ayam yang berasal dari daerah wabah, jadi
kemungkinan DOC yang dihasilkan juga terinfeksi virus AI.
2. Adanya kekebalan pada tubuh DOC akan menyebabkan timbulnya gejala
subklinis, sehingga hewan terlihat sehat namun memiliki kemampuan
shedding virus.
3. DOC berisiko dalam penyebaran AI karena DOC dapat terinfeksi setelah
TINJAUAN PUSTAKA
Virus Avian Influenza
Virus influenza terdiri dari beberapa tipe yaitu tipe A, tipe B dan tipe C.
Virus tipe A menyerang hewan, tetapi dapat menyebabkan epidemik pada
manusia. Sementara virus tipe B dan C tidak menyerang hewan, hanya
menyerang manusia (Soejoedono & Handharyani 2005). Pengelompokan virus
Influenza menjadi A, B dan C berdasarkan perbedaan nukleoprotein (NP) dan
matrix proteinnya (M) (Harder & Werner 2006). Nukleoprotein dan matrix
protein berperan pada pembentukan kapsid dan amplop viral (Pelczar & Chan
1986).
Avian Influenza (AI), disebut juga sebagai flu burung, fowl pest, fowl plaque
atau avian flu adalah suatu penyakit infeksius yang menyerang unggas dan
disebabkan oleh virus Influenza tipe A. Spesies burung sangat rentan terinfeksi
virus Influenza A dan unggas air diduga sebagai reservoir utama dari virus ini.
Virus ini termasuk famili Orthomyxoviridae yang berukuran 80-120 nm.
Berdasarkan hemaglutinin (H) dan neuroaminidase (N) pada amplop
(pembungkus luar virus) maka virus influenza ini dapat ditentukan subtipenya.
Hingga saat ini sudah dikenal ada 16 macam H antigen, yaitu H1 hingga H16, dan
sembilan N antigen, yaitu N1 hingga N9. Serotipe H16 diisolasi dari burung
camar berkepala hitam (black headed gull) yang ditemukan di Swedia dan
Belanda pada Tahun 1999, dipublikasikan pertama kali oleh Fouchier et al.
(2005). AI dibagi menjadi dua bentuk yaitu Highly pathogenic avian influenza
(HPAI) dan Low pathogenic avian influenza (LPAI). Infeksi virus AI yang sangat
virulen dan mengakibatkan penyakit bersifat akut berasal dari subtipe H5 dan H7,
B
tetapi banyak juga ditemukan isolat asal burung dari subtipe H5 dan H7B Byang
memiliki sifat virulensi rendahterhadap peternakan ayam (OIE 2000).
Virus influenza adalah partikel berselubung berbentuk bundar atau bulat
panjang, mengandung genom RNA rangkaian tunggal dengan jumlah lipatan
tersegmentasi sampai mencapai 8 segmen dan berpolaritas negatif. Virus ini relatif
perubahan pH atau kondisi nonisotonik, suhu (panas), dan kekeringan (Perez et al.
2005). Telah dibuktikan bahwa suspensi virus dalam air mampu mempertahankan
daya penularannya selama lebih dari 100 hari pada suhu 17°C. Di bawah minus
50°C virus dapat bertahan untuk waktu yang tidak terbatas.
Virus ini menginfeksi berbagai spesies hewan, termasuk ayam, ayam
mutiara, puyuh, burung merak, angsa dan itik, babi, kuda, singa laut serta pada
berbagai unggas air seperti itik, bebek, angsa dan burung camar. Selain itu juga
ditemukan pada burung peliharaan seperti burung beo, parkit, kakaktua, elang,
nuri. Di Indonesia, pernah terdeteksi H4N2 pada burung nuri (Dybing et al. 2000;
Tabbu 2001). Unggas air, burung camar dan burung-burung pantai diperkirakan
sebagai reservoir original. Burung yang terinfeksi biasanya tidak menunjukkan
gejala penyakit. Hampir semua virus AI lebih suka bereplikasi dalam saluran
pencernaan bebek liar, kemudian diekskresikan tingkat tinggi di dalam feces, dan
disebarkan melalui rute oral-fecal. Selanjutnya virus influenza A biasanya
menyebar ke spesies unggas lain dan hospes mamalia, termasuk manusia.
(Sturm-Ramirez et al. 2004). Selain pada saluran pencernaan, virus juga bereplikasi pada
saluran pernafasan (Tabbu 2001).
Hulse-Post et al. (2005) berpendapat bahwa itik piara telah menjadi
pembawa virus H5N1. Ini berarti itik piara yang hidup lepas diantara pemukiman
penduduk dapat membawa virus H5N1 yang mematikan tersebut tanpa sakit atau
muncul gejala klinis (Soeharsono 2006).
Morfologi Virus
Virion virus berbentuk spheric dengan diameter berukuran 80-120 nm.
Permukaan virion diselubungi dengan duri-duri proyektil yang berdekatan dengan
panjang duri 10 - 12 nm. Nukleokapsid berbentuk helix dan terdapat di dalam
amplop virus. Bentuk duri HA adalah trimer bentuk tangkai dan bentuk duri NA
adalah tetramer bentuk jamur (Easterday et al. 1997). Membran glikoprotein HA
berfungsi sebagai binding receptor pada sialyloligosaccharide dan fusi membran
glikoprotein pada pintu masuk sel, sedangkan membran glikoprotein NA
berfungsi sebagai enzim penghancur reseptor pada pelepasan virus (Ha et al.
perlindungan terhadap infeksi virus, aktivitas enzim Neuraminidase bertanggung
jawab pada pelepasan virus baru dari sel melalui aktivitasnya pada reseptor asam
neuraminik. Antibodi terhadap NA juga sangat penting dalam perlindungan,
terutama dengan mencegah penyebaran virus dari sel yang terinfeksi (Easterday et
al. 1997).
Genom dari virus ini berbentuk untai tunggal, bersegmen, masing-masing
segmennya ada dalam nucleocapsid yang terpisah. Segmen virus ada delapan
buah segmen berupa negative-sense single-stranded RNA, yang memungkinkan
untuk terjadinya genetic reassortment pada suatu sel yang mengalami infeksi
campuran oleh lebih dari satu virus dan akan menghasilkan sejumlah strain baru
yang berbeda dari strain asalnya. Negative-sense single-stranded RNA ini harus
membawa sebuah RNA dependent RNA polymerase (RdRp) pada virionnya karena
tidak disediakan oleh hospes. Berbeda dengan virus RNA positif sense, dimana
genomnya dapat langsung diterjemahkan dan tidak membutuhkan enzim
tranciptase dalam virionnya. Genom tersebut terdiri dari 10 gen pengkode protein
yang berbeda, yaitu delapan protein struktural dan dua protein non-struktural.
Kesepuluh genome pengkode tersebut terdiri dari tiga protein transkriptase yaitu
PB1, PB2 dan PA, dua glycoprotein permukaan yaitu hemagglutinin (HA) dan
neuraminidase (NA), dua protein matrix M1 dan M2, satu protein nucleocapsid
(NP), dan dua protein non-struktural NS1 dan NS2. Amplop glikoprotein dari
virus influenza A, HA dan NA tersebar di permukaan virion membentuk struktur
khas “spike-shaped”. Variasi antigenik pada glycoprotein tersebut dipakai untuk
menentukan subtipe virus influenza A (Gambar 2).
Siklus Replikasi Virus
Replikasi virus dimulai dengan adsorbsi virus ke reseptor glikoprotein yang
mengandung asam sialik pada permukaan sel (Gambar 3). Virus kemudian
memasuki sel dengan jalan endositosis melalui reseptor. Pembukaan terhadap pH
rendah dalam endosome, menghasilkan perubahan konformasi dalam
hemaglutinin, yang memperantarai fusi membran. Nukleokapsid kemudian
memasuki sitoplasma dan migrasi ke nukleus. Virus influenza menggunakan
mekanisme yang unik untuk menginisiasi transkripsi menggunakan viral
transkriptase. Enam mRNA monosistronik dihasilkan dan ditranslasi menjadi HA,
NA, NP dan tiga polimerase (PB1, PB2, dan PA). Melalui pembelahan mRNA
untuk gen NS dan M masing-masing menjadi dua mRNA, yang ditranslasi dalam
reading frame berbeda dan menghasilkan protein NS1, NS2, M1 dan M2.
Hemaglutinin dan neuraminiase diglikosilasi dalam retikulum endoplasma kasar,
dilengkapi di golgi, ditransportasikan ke permukaan dan melekat pada membran
sel (Easterday et al. 1997).
Syarat penting HA adalah pembelahan oleh protease sel hospes menjadi
HAB1B dan HAB2B yang dihubungkan dengan ikatan disulfida. Pembelahan dibutuhkan
untuk dihasilkannya virus yang infeksius. Setelah produksi dan pemasangan
protein viral dan RNA, virus keluar sel dengan jalan menguncup dari membran
Gambar 3. Replikasi virus Influenza tipe A (http://www. cbi.nlm nih.gov/ htbinpost/Entrez/query?uid=9927579&Form=6&db=m&Dopt=b) Variasi Antigenik
Diversitas antigenik virus influenza tipe A tampak terutama pada
glikoporitein permukaan (Perez et al. 2005). Determinan antigenik utama dari
virus influenza A dan B adalah glikoprotein transmembran hemaglutinin (H atau
HA) dan neuraminidase (N atau NA), yang mampu memicu terjadinya respon
imun dan respon yang spesifik terhadap subtipe virus. Respon ini sepenuhnya
bersifat protektil di dalam, tapi bersifat protektil parsial pada lintas subtipe yang
berbeda. Berdasarkan sifat antigenisitas dari glikoprotein-glikoprotein tersebut,
saat ini virus influenza dikelompokkan ke dalam 16 subtipe H (H1-H16) dan 9 N
(N1-N9). Kelompok-kelompok tersebut ditetapkan berdasarkan analisis
filogenetik terhadap nukleotida dan penetapan urutan (sequences) gen-gen HA
dan NA melalui cara deduksi asam amino (Harder et al. 2006).
Frekuensi variasi antigenik di antara virus influenza sangat tinggi dan
muncul melalui dua jalan yaitu drift dan shift. Jika determinan antigenik dari
glikoprotein HA dan NA membran dipengaruhi oleh mekanisme yang dipicu
kekebalan, proses tersebut disebut sebagai antigenic drift. Sebaliknya, antigenic
shift menunjukkan adanya perubahan mendadak dan mendalam dalam determinan
antigenik, yaitu pertukaran subtipe H dan/atau N, di dalam satu siklus tunggal
replikasi (Harder et al. 2006). Antigenik drift melibatkan perubahan minor
antigenik pada HA dan/atau NA, sedangkan antigenik shift melibatkan perubahan
antigenik mayor pada HA dan/atau NA (Easterday et al. 1997).
Mutasi dan Perubahan Antigen
Enzim RNA dependent RNA polymerase (RdRp) tidak mempunyai
mekanisme enzimatik perbaikan kesalahan replikasi, sehingga perubahan
nukleotida terjadi terus menerus. Berbeda dengan polimerase DNA yang hanya
mempunyai kesalahan 1 dari 10P
9
P
basa, kesalahan replikasi oleh RdRp adalah 1
dari 10P
4
P
nukleotida per siklus replikasi (review oleh Webster et al. 1992).
Substitusi titik/poin dapat dibedakan atas substitusi sinonim dan substitusi non
Substitusi sinonim adalah perubahan nukleotida tidak diikuti perubahan
ekspresi asam amino. Hal ini terjadi pada semua asam amino, kecuali metionin
dan triptopan yang hanya disandi oleh 1 kodon. Substitusi sinonim ini
menyebabkan kodon bias (ketidakseimbangan penggunaan kodon sinonim yang
menyandi asam amino). Kodon bias ini terlihat pada semua spesies di semua
bagian genom, baik daerah intron maupun ekson. Kodon bias tidak mengubah
fenotip produk ekspresi, sehingga kodon bias selalu ada dalam genom.
Penggunaan kodon pada gen berkorelasi dengan akurasi dan tingkat translasi.
Kodon pilihan biasanya adalah kodon dengan tRNA melimpah sehingga dapat
ditranslasi lebih cepat (Laver & Kotlar 2005; Wu & Freeland 2005).
Substitusi sinonim pada virus AI juga berkaitan dengan limpahan tRNA
(Plotkin & Dushoff 2003), tetapi karena translasi mRNA pada virus AI
menggunakan mekanisme translasi sel hospes, substitusi sinonim tersebut lebih
disebabkan oleh seleksi penyesuaian terhadap penggunaan kodon sel hospes. Hal
ini terjadi karena perbedaan penggunaan kodon antara virus dengan sel hospes
dapat mempercepat translasi protein (Garmory et al. 2003).
Substitusi nonsinonim adalah perubahan nukleotida diikuti dengan
perubahan ekspresi asam amino. Substitusi nonsinonim hanya terjadi pada bagian
tertentu dari gen yang mengalami tekanan. Semakin sering mengalami tekanan,
semakin tinggi substitusinya (Plotkin & Dushoff 2003). Adanya tekana seleksi
akan menyebabkan munculnya varian dengan tingkat efektifitas replikasi yang
tinggi (Jong et al. 2000). Tingkat perubahan asam amino virus di dalam tubuh
hospes (in vivo) lebih tinggi dibandingkan virus yang ditumbuhkan secara in vitro.
Ini menunjukkan bahwa tingginya tekanan imun berkorelasi dengan perubahan
asam amino (Nakajima et al. 2003).
Adaptasi selalu dilakukan oleh virus AI, baik adaptasi terhadap tekanan
imun maupun adaptasi pada spesies hospes baru (Voeten et al. 2000;
Taubenberger et al. 2005). Adaptasi merupakan kekuatan utama dari evolusi.
Perbedaan spesies hospes dan perbedaan tekanan menyebabkan perbedaan
kecepatan evolusi virus AI (Brown et al. 2001). Lama infeksi dan frekuensi
reinfeksi virus influenza pada manusia, menyebabkan tingginya tekanan seleksi
glikoprotein HA kira-kira 2 x 10P
-3
P nukleotida per posisi per replikasi (Webster et
al. 1992). Kecepatan mutasi HA tersebut lebih tinggi dibanding NA karena NA
bukan merupakan determinan antigenik utama dan jumlah NA pada permukaan
virion hanya 1/5 jumlah HA (Plotkin & Dushoff 2003).
Protein internal tidak berperan dalam pengikatan dengan reseptor sel hospes
dan tersembunyi dari antibodi, sehingga protein ini lebih stabil dibanding dengan
glikoprotein permukaan (Plotkin & Dushoff 2003; Berkhoff et al. 2005). Stuktur
dan fungsi protein internal juga sangat mendasar sehingga tidak menguntungkan
virus AI jika mutasi terjadi secara cepat. Hal ini menyebabkan virus AI
menghadapi konflik intragenom tentang kecepatan mutasi. Gen atau bagian
spesifik gen tertentu dalam genom tersebut mengalami seleksi positif untuk
berubah, sementara gen lain mengalami seleksi pemurnian untuk tidak berubah
(Plotkin & Dushoff 2003). Protein/regio protein yang fungsinya berkaitan erat
dengan pertahanan terhadap respon imun hospes, daya adaptasi dan patogenisitas
mempunyai tingkat substitusi nonsinonim lebih tinggi dibanding substitusi
sinonim (Plotkin & Dushoff 2003). Kecepatan substitusi nonsinonim gen sub unit
HA1 virus AI subtipe H3 sebesar 5.7 x 10P
-3
P
per posisi pertahun. Hal ini
disebabkan karena pada HA1 terdapat daerah antigenik, kantong pengikat reseptor
dan posisi glikosilasi (Bush et al. 1999).
Hanyutan Antigenik
Adaptasi terhadap tekanan imun hospes dilakukan oleh virus AI untuk
menghindar dari pengenalan dan netralisasi antibodi dan sel T sititoksik. Antibodi
netralisasi terhadap protein HA bersifat protektif melawan infeksi, sehingga
protein ini paling tinggi mengalami tekanan imun dibandingkan protein internal
(Berkhoff et al. 2005). Mekanisme virus AI untuk menghindar dari sistem imun
hospes merupakan tekanan untuk mutasi secara gradual sehingga muncul
strain-strain virus baru yang secara imunologik berbeda (hanyutan antigenik) (Horimoto
& Kawaoka 2001; Munch et al. 2001; Smith et al. 2004).
Hanyutan antigenik adalah perubahan secara periodik akibat mutasi genetik
sturktur glikoprotein permukaan virus AI sehingga antibodi yang telah terbentuk
keberadaan virus tersebut (Munch et al. 2001). Hanyutan antigenik berjalan
lambat namun progresif dan cenderung menimbulkan penyakit yang terbatas pada
kawasan tertentu (Tumpey et al. 2002; Swayne & Suarez 2003). Hanyutan
antigenik menuntut pembuatan vaksin selalu diperbarui mengikuti munculnya
strain baru (Plotkin et al. 2002; Smith et al 2004).
Cara Penularan
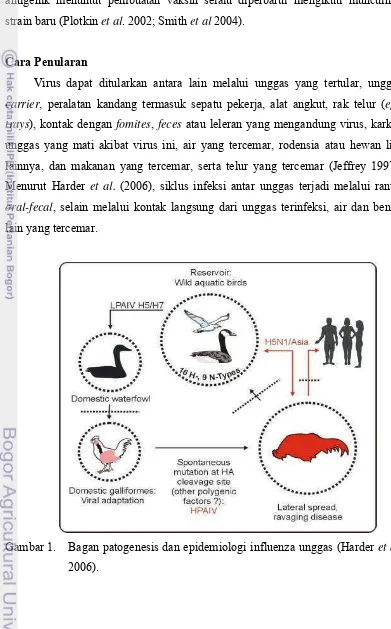
Virus dapat ditularkan antara lain melalui unggas yang tertular, unggas
carrier, peralatan kandang termasuk sepatu pekerja, alat angkut, rak telur (egg
trays), kontak dengan fomites, feces atau leleran yang mengandung virus, karkas
unggas yang mati akibat virus ini, air yang tercemar, rodensia atau hewan liar
lainnya, dan makanan yang tercemar, serta telur yang tercemar (Jeffrey 1997).
Menurut Harder et al. (2006), siklus infeksi antar unggas terjadi melalui rantai
oral-fecal, selain melalui kontak langsung dari unggas terinfeksi, air dan benda
lain yang tercemar.
Gambar 1. Bagan patogenesis dan epidemiologi influenza unggas (Harder et al.
Menurut Newman et al. (2006), virus AI dapat ditemukan dalam air liur,
leleran hidung dan feces, unggas lain dapat tertular jika kontak dengan
bahan-bahan tersebut. Karakteristik virus AI antara lain : 1) Virus ini dapat bertahan
hidup dalam waktu yang lama di lingkungan dengan temperatur yang cocok; 2).
Virus dapat bertahan hidup untuk waktu yang tidak terbatas pada material yang
dibekukan; 3). Virus dapat menyebabkan infeksi melalui aerosol yang berada di
udara, yang menempel pada mulut, hidung, wajah, atau terhisap masuk ke
paru-paru; 4). Satu gram bahan kontaminan yang mengandung virus cukup untuk
menginfeksi satu juta unggas.
Gejala Klinis dan Lesi
Gejala klinis yang paling sering terlihat adalah gangguan pernafasan, namun
gejala lain sangat bervariasi mulai dari tidak terlihat hingga penurunan produksi
telur atau fertilitas hingga gejala syaraf. Gejala klinis unggas yang terinfeksi
bentuk HPAI adalah diare berwarna hijau, sianosis dan edema pada kepala, pial
dan jengger, lakrimasi berlebihan, sinusitis, perdarahan jaringan subkutan yang
diikuti sianosis pada kulit terutama kaki. Sinusitis tidak biasa ditemukan pada
bebek, puyuh dan kalkun. Lokasi dan tingkat keparahan pada pemeriksaan
makroskopik sangat bervariasi dan dapat ditemukan hemoragi, transudasi, dan
nekrosis pada saluran respiratorium, gastrointestinal, integumentum dan
urogenital (Fraser et al. 1991; Tabbu 2001; Darminto 2006).
Virus avian influenza (AI) subtype H5N1, highly pathogenic pada ayam,
puyuh dan kalkun serta menyebabkan mortalitas 75-100 % dalam waktu 10 hari
setelah infeksi (Perkins & Swayne 2001). Pada sebuah peternakan ayam petelur
dengan populasi 34.640 ekor, AI dapat mengakibatkan kematian sebesar 43.3 %
(Nakatani et al. 2005). Sebuah peternakan itik lokal komersial di Korea Selatan
telah mengalami kematian sampai dengan 12 % akibat infeksi virus AI. Pengujian
pada mencit yang diinokulasi dengan menggunakan isolat virus AI H5 telah
menyebabkan kematian sebesar 75-100 % pada hari ke 6-8 setelah infeksi
Highly Pathogenic Avian Influenza adalah penyakit infeksi yang sangat luar
biasa, penyakit yang disebabkan oleh virus dan bersifat sistemik pada burung
yang menyebabkan tingginya angka kematian dan kesakitan. Perubahan pada saat
nekropsi ditemukan perubahan yang utama berupa multifokal nekrosis pada
pankreas serta pembesaran hati dan limpa (Kwon et al. 2005).
Gejala klinis yang timbul dari penyakit ini sangat bervariasi, tergantung
pada umur, jenis unggas dan faktor lingkungan. Gejala ini antara lain, mati
mendadak dengan atau sedikit gejala klinis, karakteristik infeksi saluran nafas,
lakrimasi yang berlebihan, sinusitis, odema pada kepala, kulit pada bagian yang
tidak berbulu menjadi kebiru-biruan, dan diare. Diagnosis penyakit ini tergantung
hasil isolasi virus dan uji sifat virulensi pada hospes. Diagnosis untuk tujuan
pengendalian penyakit berdasarkan sifat patogenitas secara in-vivo atau
determinasi molekulernya, adanya asam amino dasar pada lokasi cleavage site
dari hemaglutinin.
Patogenesis Virus Avian Influenza
Virus avian influenza sebagai patogen intraseluler memiliki mekanisme
untuk menghindari respon imun hospes sehingga virus dapat bertahan hidup dan
bereplikasi dalam tubuh hospes. Peningkatan kemampuan virus untuk
menghindari sistem imun hospes secara langsung berkorelasi dengan peningkatan
patogenisitas virus. Virus AI ini mempunyai berbagai mekanisme untuk
menghindar dari sistem imun bawaan dan respon imun perolehan hospes
(Coleman 2007).
Penanggulangan AI
Penyebaran virus AI secara global disebabkan oleh perdagangan unggas
dan/atau produk unggas serta pergerakan migratori unggas (Capua & Maragon
2006; Chen et al. 2006). Analisis penyebaran global virus AI di Asia
menunjukkan 9 dari 21 introduksi virus ke negara-negara Asia melalui
perdagangan unggas dan produk unggas. Burung migratori juga berperan pada
penyebaran dan introduksi virus AI subtipe H5N1 ke 3 dari 21 negara-negara di
Eropa terjadi melalui migratori unggas. Di Afrika, 2 dari 8 negara mengalami
introduksi virus AI subtipe H5N1 melalui pedagangan unggas dan 3 dari 8 negara
melalui migratori unggas (Kilpatrick et al. 2006).
Tindakan penanggulangan penyakit AI dilakukan sesuai dengan status
penyakit AI yang terdapat di suatu daerah tertentu, teknologi yang diperlukan
untuk penanggulangan disesuaikan dengan tingkat penyakitnya. Jika penyakit AI
belum masuk ke dalam daerah tertentu, tindakan yang dilakukan adalah
pencegahan dan penolakan, namun jika sudah masuk dan mewabah status
penyakit dinyatakan sebagai epidemik maka tindakan penanggulangan dilakukan
adalah pengendalian wabah untuk menghentikan bertambahnya kasus AI dan
DETECTION AVIAN INFLUENZA VIRUS SUBTYPE H5N1 BY
USING IMMUNOHISTOCHEMESTRY TECHNIQUE
ABSTRACT
Avian Influenza (AI) or bird flu caused by AI virus subtype H5N1 is still present in Indonesia. The Department of Agriculture of Indonesia has banned poultry distribution from endemic area to nonendemic area, except for distribution of day old chick (DOC). The aim of this research is to detect possible infection of AI virus in DOC that will be distributed from AI endemic area to AI non endemic area. As much as 240 DOCs from farms in West Java and Banten were taken from Soekarno Hatta airport. The AI virus detection in tissues (trachea, lung, heart, kidney, liver, and intestine) by using immunohistochemistry technique. Detection of AI virus using AI H5N1 monoclonal antibody with AEC as chromogen which will give the virus a reddish color. The result of this research showed 158 samples (65.8%) were positive of antigen AI H5N1 virus in tissues. From 158 positive samples, 104 samples (65.8%) showed presence of antigen only in trachea, lung and intestine, and 54 samples (34.2%) were present in all tissues (trachea, lung, intestine, liver and kidney). The results indicated that DOCs were infected with subclinical AI and distribution of DOCs is one of the potential causes of the rapid AI spread in Indonesia, so cautious distribution to AI free areas need to be taken.
DETEKSI VIRUS AVIAN INFLUENZA SUBTIPE H5N1
DENGAN TEKNIK IMUNOHISTOKIMIA
ABSTRAK
Avian influenza (AI) atau Flu Burung disebabkan oleh virus AI subtype H5N1 masih ada di Indonesia. Departemen Pertanian telah melarang peredaran unggas dari daerah endemik ke daerah non endemik kecuali peredaran anak ayam umur 1 hari (DOC). Penelitian ini bertujuan untuk mendeteksi kemungkinan infeksi virus AI pada DOC yang akan didistribusikan dari daerah endemik AI ke daerah non endemic AI. Sebanyak 240 ekor DOC yang berasal dari peternakan di daerah Jawa Barat dan Banten diambil di Bandar Udara Soekarno Hatta. Virus AI pada beberapa organ (trakea, paru-paru, usus, hati, ginjal) dideteksi menggunakan teknik pewarnaan imunohistokimia. Deteksi virus AI menggunakan antibodi monoklonal AI H5N1 dengan kromogen (AEC) yang akan memberi warna kemerahan pada virus AI. Hasil penelitian diketahui bahwa 158 sampel (65.8%) positif antigen AI H5N1 pada organ. Dari 158 sampel positif tersebut diketahui bahwa 104 sampel (65.8%) menunjukkan keberadaan antigen hanya pada trakea, paru-paru dan usus sedangkan 54 sampel (34.2%) ditemukan pada semua organ (trakea, paru-paru, usus, hati, ginjal) yang diteliti. Hasil penelitian ini diketahui bahwa anak ayam umur satu hari telah terinfeksi oleh virus AI secara subklinis dan DOC ini berpotensi sebagai salah satu penyebab penyebaran AI di Indonesia, sehingga perlu diwaspadai pendistribusiannya ke daerah yang masih bebas AI.
PENDAHULUAN
Avian Influenza (AI) yang disebabkan virus AI subtipe H5N1 saat ini telah
menyerang sejumlah peternakan unggas di Indonesia dan menyebabkan kerugian
ekonomi yang tidak sedikit. Penyakit AI dapat menjadi hambatan dalam
perdagangan ternak dan produk asal hewan baik secara regional, nasional,
maupun global karena produk yang dihasilkan menjadi tidak aman bagi
lingkungan budidaya ternak.
Unggas yang terinfeksi HPAI mengalami gejala klinis seperti diare berwarna
hijau, sianosis dan edema pada kepala, pial dan jengger, lakrimasi berlebihan,
sinusitis, perdarahan jaringan subkutan yang diikuti sianosis pada kulit terutama
kaki. Sinusitis tidak biasa ditemukan pada bebek, puyuh dan kalkun. Lokasi dan
tingkat keparahan pada pemeriksaan makroskopik juga sangat bervariasi dan
dapat ditemukan hemoragi, transudasi, dan nekrosis pada saluran respiratorium,
gastrointestinal, integumentum dan urogenital (Fraser et al. 1991; Tabbu 2001;
Darminto 2006).
Imunohistokimia (IHK) adalah metode alternatif yang sangat baik karena
relatif cepat, tidak mahal dan sedikit menggunakan laboratorium dan telah
menjadi metode baik dan terpercaya untuk diagnosa rutin dan aktifitas penelitian
(Ramos-Vara et al. 1999). Selain mengkombinasikan teknik anatomi, immunologi
dan biokimia untuk mengidentifikasi komponen spesifik pada jaringan melalui
reaksi antigen-antibodi spesifik, IHK memungkinkan pula untuk menggambarkan
distribusi komponen spesifik pada permukaan sel, di dalam sel, ataupun jaringan.
Berbeda dengan pewarnaan hematoksilin eosin meskipun lebih mudah, cepat dan
dapat menggambarkan jenis dan distribusi lesi tetapi tidak dapat mendeteksi
antigen virus karena ukurannya sangat kecil. Pewarnaan IHK berdasarkan reaksi
antigen antibodi kompleks sehingga apabila pada jaringan organ mengandung
antigen (virus subtipe H5N1) direaksikan dengan antisera anti H5N1 maka
antigen tersebut dapat dideteksi dan divisualisasikan dengan substrat tertentu
misalnya Amino Ethyl Carbazole (AEC) (Van Noorden 1986). Teknik pewarnaan
IHK ini memiliki keunggulan dibanding isolasi dan identifikasi virus AI H5N1
jam untuk mendeteksi antigen. Keunggulan lain dari metode ini yaitu reaksi warna
yang terjadi sebagai hasil ikatan antigen dan antibodi kompleks tergolong cukup
permanen sehingga tidak perlu dilihat dengan mikroskop fluorescens. Selain
visualisasi antigen, jaringan organ yang terinfeksi dan derajat keparahan lesi dapat
terlihat dengan jelas (Brown et al. 1992; Damayanti & Darminto 2001). Aplikasi
teknik IHK ini sudah terbukti akurat untuk mendeteksi antigen pada jaringan
organ ayam yang terinfeksi Lymphoid Leucosis (LL), New Castle Disease (ND),
Infectious Bursal Disease (IBD), Infectious Laryngotracheitis (LT), Fowl Pox,
Infectious Bronchitis (IB) (Owen et al. 1991) dan HPAI (Brown et al. 1992;
Hooper et al. 1995).
Antibodi yang digunakan untuk deteksi spesifik dapat berupa poliklonal atau
monoklonal. Antibodi monoklonal umumnya dianggap dapat menunjukkan hasil
spesifik. Antibodi monoklonal adalah antibodi yang memiliki idiotipe dan isotipe
yang sama. Idiotipe adalah bagian antibodi yang menentukan spesifisitasnya
(antigen binding surface), sedangkan isotipe adalah bagian antibodi yang
menentukan kelas-sub kelas dari antibodi maupun yang menentukan tipe-subtipe
suatu antibodi, dengan kata lain antibodi monoklonal adalah suatu antibodi yang
memiliki antigen binding surface yang sama, kelas-sub kelas maupun tipe-sub
tipe yang sama (Sudiana 2005). Antibodi poliklonal dibuat dengan menginjeksi
hewan dengan antigen peptida, dan setelah respon imun sekunder dirangsang
selanjutnya diisolasi antibodinya dari keseluruhan serum. Antibodi poliklonal
adalah pencampuran dari berbagai antibodi yang mengenali sejumlah epitop.
Penelitian ini bertujuan untuk mendeteksi keberadaan virus AI
menggunakan Teknik Pewarnaan IHK.
METODE PENELITIAN
Sampel Organ
Sampel yang digunakan pada penelitian ini adalah DOC final stock (FS)
pedaging dan petelur yang berasal dari perusahaan pembibitan di daerah Jawa
Udara Soekarno Hatta dengan metode detect disease yaitu apabila ditemukan 1
ekor positif maka dapat dikatakan DOC tersebut telah terjangkit penyakit AI.
Pengambilan sampel dilakukan pada Bulan April sampai dengan September 2008
dengan jumlah sampel sebanyak 240 ekor DOC.
Setiap DOC tersebut kemudian dinekropsi dan diambil organnya (trakea,
paru-paru, usus, hati dan ginjal), selanjutnya dibuat preparat histologi untuk
melihat keberadaan virus in situ secara imunohistokimia.
Pembuatan Preparat Histologi
Organ yang diperoleh dipotong setebal 0,5 cm dan difiksasi dalam larutan
buffered neutral formalin (BNF) 10% selama 24-48 jam, di proses menjadi blok
parafin kemudian dipotong setebal 3-4 μm dan ditempelkan pada slide preparat.
Slide preparat sebelumnya dilapisi dengan gelatin dengan cara melarutkan 2,5 g
gelatin dalam 300 ml air suhu 60°C kemudian didinginkan. Setelah dingin larutan
tersebut ditambah dengan 0,25 g Khromium potasium sulfat (CrK(SOB4B) kemudian
ditambahkan HB2BO sampai menjadi 500 ml. Slide direndam selama 1-2 menit
kemudian dikeringkan pada suhu ruang.
Selanjutnya preparat dideparafinisasi dengan larutan xylol III, II, I masing
masing 3 menit kemudian rehidrasi dengan alkohol konsentrasi menurun mulai
dari alkohol absolut I, II, III, 95%, 90%,80%, 70%, masing-masing 3 menit dan
terakhir pencucian dengan destilated water (DW) selama 3-5 menit. Selanjutnya
dicuci dengan Phosphat Buffer Saline (PBS) sebanyak 3x masing-masing 5-10
menit.
Pewarnaan Imunohistokimia
Deteksi virus AI dengan teknik IHK ini mengacu pada metode yang
dilakukan oleh Temasek Laboratoium Singapore dengan menggunakan buffer
citrat untuk unmasking antigenretrieval dan proses selanjutnya menggunakan kit
DakoCytomation. Bloking aktivitas endogenus menggunakan hidrogen peroksida
(HB2BOB2B) 3% selama 20 menit kemudian dicuci dengan 0,05 % PBS tween
selanjutnya direndam dalam susu skim 0,1% selama 30 menit dan dicuci kembali
H5N1 (CG1) (Astawa et al. 2007) dan diinkubasi selama 24 jam di suhu 4P
ο
P
C.
Setelah 24 jam preparat dibilas dengan PBS tween kemudian ditambahkan
antibodi sekunder yang akan berikatan dengan antibodi primer, dan selanjutnya
diinkubasi selama 1 jam. Pewarnaan menggunakan kromogen (AEC) dilakukan
setelah antibodi sekunder dibilas dengan destillated water (DW). Counterstain
menggunakan Lillie Mayer Hematoksilin untuk mendapatkan warna kebiruan
sebagai latar belakang jaringan dan antigen yang telah terwarnai dengan
kromogen berwarna kemerahan. Preparat yang telah diwarnai kemudian diamati
dengan menggunakan mikroskop. Hasil dinyatakan positif apabila ditemukan
antigen yang berwarna kemerahan dan hasil dinyatakan negatif apabila tidak
ditemukan antigen yang berwarna kemerahan.
HASIL DAN PEMBAHASAN
Dua ratus empat puluh sampel organ DOC (trakea, paru-paru, usus, hati dan
ginjal) dibuat menjadi preparat histologi pada slide yang telah dilapisi oleh gelatin
dan Khromium potasium sulfat (CrK(SOB4B). Selanjutnya dilakukan teknik
pewarnaan IHK menggunakan antibodi monoklonal H5N1 (CG1) sebagai antibodi
primernya. Pewarnaan antigen dengan menggunakan kromogen (AEC) sehingga
antigen akan terlihat berwarna kemerahan (Lampiran 3).
Hasil deteksi virus AI (antigen) pada 240 sampel organ DOC dengan teknik
IHK diperoleh hasil positif sebanyak 158 sampel (65.8%)(Gambar 4). Sebanyak
104 sampel (65.8 %) dari hasil 158 sampel positif menunjukkan antigen hanya
ditemukan pada organ trakea, paru-paru dan usus, sedangkan keberadaan antigen
yang ditemukan pada semua organ (trakea, paru-paru, usus, hati dan ginjal)
Persentase Hasil IHK
34.2
65.8
negatif
[image:33.595.104.509.37.842.2]positif
Gambar 4. Presentase hasil positif dan negatif IHK pada organ DOC
Tabel 1. Persentase distribusi antigen AI subtipe H5N1 pada organ DOC dengan metode IHK
No Distribusi antigen pada organ Jumlah Persentase
1. Trakea, paru-paru, usus 104 65.8 %
2. Semua organ (trakea, paru-paru, usus, hati, ginjal) 54 34.2 %
Total 158 100%
Virus influenza lebih menyukai bereplikasi pada saluran pencernaan dan
menyebabkan tingginya titer virus pada feses (Horimoto & Kawaoka 2001).
Kombinasi antara adanya reseptor sel terhadap antigen virus AI serta banyaknya
enzim proteolitik memungkinkan efisiensi replikasi virus influenza pada organ
usus dan proventrikulus (Slemons & Easterday 1998; Gambaryan et al. 2006).
Banyaknya enzim proteolitik pada saluran pencernaan akan mengaktifkan
pemotongan post translasi dari HA0 menjadi HA1 dan HA2 (Gurten & Klenk
1999). Pembelahan protein HA ini akan menyebabkan efisiensi replikasi virus AI
pada usus.
Virulensi dari virus AI diperankan oleh glikoprotein HA yang memulai
infeksi dengan memperantarai ikatan virus dengan sel reseptor dan dengan
mendorong pembebasan virus RNP melalui fusi membran. Aktivasi proteolitik
pasca-translasi dari prekursor molekul HA (HA0) menjadi subunit HA1 dan HA2
oleh protease hospes menghasilkan fusogenik domain pada terminal amino dari
sehingga aktivasi proteolitik dari molekul HA sangat penting untuk infektivitas
dan penyebaran virus melalui tubuh hospes (Gurten & Klenk 1999; Steinbauer
1999), selanjutnya terjadi pergeseran kerusakan organ sesuai dengan masuknya
virus ke dalam aliran darah. Kobayashi et al. (1996) menyatakan bahwa virus AI
bereplikasi secara efisien di dalam endotelium pembuluh darah dan sel
parenkhimal perivaskular yang tampaknya penting untuk penyebaran virus dan
infeksi sistemik, sehingga keterlibatan sistem kardiovaskular memainkan peranan
penting dalam patogenesis infeksi virus AI.
Banyaknya antigen yang terdeteksi pada organ paru-paru dan trakea karena
virus AI memiliki kecenderungan berkembang biak pada sel epitel bersilia di
saluran pernafasan. Organ saluran pernafasan merupakan sasaran utama virus AI,
sel-sel epitel saluran pernafasan rentan terhadap infeksi virus. Reseptor virus
adalah penentu tropism (respon organisme terhadap stimulus luar). Pada infeksi
AI, tempat ikatan protein virus diperlukan untuk ikatan ke galaktosa mengikat
asam sialik pada permukaan sel-sel hospes (Weis et al. 1988). Virus yang masuk
melalui inhalasi akan menembus mukosa saluran pernafasan dan melekat pada
reseptor galaktosa yang ada pada saluran pernafasan dilanjutkan dengan proses
endositosis dan fusi virus. Pada saat proses fusi, genom virus dilepaskan ke
sitoplasma sel terinfeksi selanjutnya genom akan bermigrasi ke nukleus. Di
nukleus inilah terjadi trankripsi dan replikasi virus (Cross et al. 2001). Virus AI
yang menginfeksi sel-sel epitel pernafasan akan bereplikasi dalam waktu
berjam-jam dan memproduksi sejumlah virion (Behrens & Stoll 2007). Coleman (2007)
menyatakan bahwa proses replikasi virus sangat cepat, sekitar 10 jam/siklus.
Antigen virus AI jarang ditemukan pada hati, ginjal dan jantung kemungkinan
karena infeksi virus AI masih pada tahap awal sehingga belum menyebar ke organ
viseral lainnya. Mo et al. (1997) berpendapat bahwa antigen dapat dideteksi pada
otak, jantung, paru-paru, pankreas dan ginjal dan diduga kuat virus HPAI
menyerang saluran pernafasan untuk kemudian bereplikasi di sini dan menyebar
ke semua organ viseral.
Derajad kerusakan akibat penyakit AI tergantung pada banyak faktor antara
lain virulensi dari virus, status kekebalan dan diet dari hospes adanya infeksi
dipengaruhi oleh peranan HA di mana memperantai ikatan virus dengan sel
reseptor dan mendorong pembebasan ribonukleoprotein virus melalui fusi
membran. HA virus AI yang tidak virulen biasanya hanya memecah dalam
sejumlah sel tertentu, sehingga hanya menyebabkan infeksi lokal di dalam saluran
pernafasan atau intestinal atau keduanya mengakibatkan infeksi yang ringan atau
tanpa gejala sama sekali. HA virus AI yang virulen mampu memecah pada
berbagi sel yang berbeda dari hospes, sehingga menyebabkan infeksi sistemik
yang mematikan pada unggas (Easterday et al. 1997).
Teknik pewarnaan IHK dapat diaplikasikan terhadap sejumlah organ
unggas. Sejumlah spesimen organ diproses sebagai preparat histopatologi dan
jaringan organ yang diduga mengandung virus flu burung direaksikan dengan
menggunakan kit DakoCytomation. Antigen yang terdapat pada jaringan organ
dapat divisualisasikan dengan penambahan pewarna/substrat AEC yang
menghasilkan warna coklat kemerahan. Teknik pewarnaan ini terbukti sangat
cepat dan akurat untuk mengkonfirmasi diagnosis pada preparat histopatologi dan
membuktikan bahwa hewan terinfeksi oleh virus AI subtipe H5N1. Antigen AI
subtipe H5N1 dapat dideteksi dengan sangat jelas pada pangkal Esofagus,
paru-paru, usus, limpa, ginjal dan ovarium. Antigen virus AI subtipe H5N1 ini dapat
dideteksi dengan baik menggunakan antibodi monoklonal karena antibodi
monoklonal hanya bereaksi dengan satu epitop struktur antigenik virus (Zheng et
al. 2001; Vareckova et al. 2002; Ohnishi et al. 2005).
Antibodi monoklonal yang digunakan pada penelitian ini adalah anti antigen
AI subtipe H5N1 yang diproduksi dari isolat Indonesia. Astawa et al. (2007)
berhasil mengisolasi 12 monoklonal yang spesifik terhadap virus AI dan 8
monoklonal (AG8, BC12, CC5, CG1, DD9, DF11, EA11 dan EE8) dapat
digunakan untuk mendeteksi virus AI pada organ bebek. Hasil uji dengan
menggunakan western blot diketahui bahwa 2 monoklonal (DD9 dan CC5) dari 8
monoklonal tersebut mengenali 2 pita protein dengan berat molekul 76 dan 58
kDa, sedangkan 3 monoklonal (CG1, EE8, dan AG8) bereaksi kuat terhadap
antigen AI pada organ bebek. Penggunaan antibodi monoklonal H5N1 (CG1)
pada penelitian ini karena antibodi tersebut bereaksi kuat terhadap antigen AI
protein HA virus dilaporkan memiliki senstifitas 100 % dan spesifisitas 99,1 %
dalam mengikat subtipe HA virus (Vareckova et al. 2002). Sama seperti pada
virus influenza manusia, antibodi monoklonal terhadap virus AI juga memiliki
derajat sensitifitas dan spesifisitas yang sama ketika digunakan untuk mendeteksi
antigen virus AI (Astawa et al. 2007).
Distribusi, lokasi dan jumlah antigen H5N1 yang terdapat pada organ
dipengaruhi oleh spesies dan umur unggas, strain virus, konsentrasi virus, rute
infeksi (Hooper et al. 1995; Suarez et al. 1998). Brown et al. (1992) melaporkan
sebaran antigen yang dideteksi pada organ ayam yang terserang HPAI dapat
dideteksi pada organ otak, jantung, ginjal terutama menempati area vaskular yaitu
pada epitel endotel pembuluh darah. Hooper et al. (1995) juga menunjukkan
bahwa virus HPAI dapat divisualisasikan pada kulit jengger, otak, jantung,
paru-paru, otot, skeletal, ginjal, limpa dan ovarium, kerusakan yang terjadi terlihat
menonjol pada daerah vaskuler semua pembuluh darah organ yang terinfeksi dan
hal ini berkolerasi positif dengan antigen yang dideteksi pada area tersebut.
Menurut Perkins & Swayne (2001), antigen HPAI juga dapat dijumpai pada otak,
pankreas, limpa, kelenjar adrenal dan ovarium.
Perubahan patologis jaringan organ DOC terlihat adanya infiltrasi limfosit
dan nekrosis (Setyawati 2008). Hal ini terjadi karena virus bereplikasi pada sel
sehingga menyebabkan degenerasi dan kematian sel (Cheville 2006). Menurut Mo
et al (1997), antigen dalam jumlah tinggi terlihat mengelilingi area yang
mengalami nekrosis tetapi relatif sedikit pada pusat nekrosis. Suarez et al. (1998)
juga membuktikan bahwa kapiler pembuluh darah mengalami hipertropi dan
berisi masa protein serta sel radang. Fenomena ini menimbulkan hambatan suplai
oksigen sehingga jaringan mengalami hipoksia yang berakibat nekrosis.
SIMPULAN
1. Sebanyak 158 sampel (65.8%) dari 240 sampel DOC yang dilalulintaskan
melalui Bandar Udara Soekarno Hatta menunjukkan hasil positif AI dengan
metode pemeriksaan IHK.
2. Antigen AI subtipe H5N1 yang ditemukan pada organ trakea, paru-paru dan
ditemukan pada seluruh organ yang diperiksa (trakea, paru-paru, usus, hati dan
ginjal) sebanyak 54 sampel (34.2%).
3. Infeksi virus AI yang menyerang DOC kemungkinan masih pada tahap awal
infeksi karena lebih banyak ditemukan pada saluran pernafasan dan
pencernaan daripada organ viseral lainnya.
SARAN
1. Perlu dilakukan deteksi keberadaan antigen AI subtipe H5N1 pada induk
ayam menjelang bertelur sehingga diperoleh kepastian adanya penularan
secara vertikal.
2. Perlu dilakukan deteksi keberadaan antigen AI subtipe H5N1 pada embrio
telur dari berbagai umur embrio.
3. Perlu adanya monoklonal isolat Indonesia lainnya untuk dalam pengujian IHK
IDENTIFICATION AND ISOLATION AVIAN INFLUENZA
VIRUS SUBTYPE H5N1 IN DOC
ABSTRACT
Day Old Chick (DOC) has been suspected to potentially spread and infect Avian Influenza Virus (AIV) to other poultry by importation and transportation from Java to other islands in Indonesia. The aim of this research is to detect and isolate AIV in DOC that can be infected to other animal through transportation from endemic area to another area in Indonesia. Antibody titers were measured in every DOC against AI virus with Haemagglutination Inhibition (HI) test. Pooled samples of trachea, lung and egg yolk were tested for the presence of Influenza A viruses by using Reverse Transcriptase-Polymerase Chains Reactions (RT-PCR) with matrix primer pairs (FAI; RAI), positive samples were then further tested with H5 primer pairs (FH5; RH5) (Lee et al. 2004). The result of this research showed 44 egg yolk samples (55%) were positive of Influenza A. From the 44 samples positive, 19 samples (43.2%) were positive AIV Subtype H5 and 25 samples (56.8%) were positive another subtypes (Hx). This research showed that AIV were able to spread by vertical transmission, because viral concentrations were highest in the egg yolk than tracheas and lungs.
Key words: Day Old Chick, Influenza A, Matrix primer, H5 subtype
IDENTIFIKASI DAN ISOLASI VIRUS AVIAN INFLUENZA
SUBTIPE H5N1 PADA DOC
ABSTRAK
Anak ayam umur 1 hari atau DOC dicurigai sebagai sumber penyebaran virus Avian Influenza ke unggas lain melalui importasi dan transportasi dari Pulau Jawa ke Pulau-Pulau lain di Indonesia. Penelitian ini dimaksudkan untuk mendeteksi dan mengisolasi virus AI pada DOC yang dilalulintaskan dari daerah yang endemis ke daerah lain di Indonesia. Setiap DOC diuji titer antibodinya dengan menggunakan uji Hemaglutinasi Inhibisi (HI). Kumpulan sampel organ trakea dan paru-paru serta kuning telur DOC diuji dengan Reverse Transcriptase-Polymerase Chains Reactions (RT-PCR) menggunakan primer matrik (FAI dan RAI) serta primer H5 (FH5 dan RH5) dari Lee et al. (2004). Hasil dari penelitian ini menunjukkan 44 sample (55%) kuning telur positif Influenza A dan dari sampel positif Influenza A tersebut 19 sampel (43.2%) menunjukkan positif virus AI subtipe H5 dan 25 sampel (56.8%) positif AI subtipe lainnya (Hx). Oleh karena kemungkinan virus AI dapat ditularkan melalui vertikal transmisi karena konsentrasi virus lebih banyak ditemukan pada kuning telur dibandingkan dengan di organ trakea maupun paru-paru DOC.
PENDAHULUAN
Wabah Avian Influenza (AI) telah mengakibatkan kehancuran bagi industri
ternak unggas, apalagi bagi peternak individual. Bagi negara berkembang yang
memerlukan unggas dan telur sebagai sumber utama protein, dampak wabah ini
sangat besar terhadap keadaan gizi rakyat (Harder et al. 2006), selain itu secara
nasional dapat mengganggu perekonomian, ketahanan pangan, dan keseimbangan
ekologis (Naipospos 2006).
Highly Pathogenic Avian Influenza (HPAI) merupakan penyakit zoonosis
asal unggas yang sangat fatal dan menular mengakibatkan gejala klinis pada
saluran pernafasan, gastrointestinal dan syaraf. Hampir semua unggas yang sudah
didomestikasi misalnya ayam, kalkun, burung puyuh, itik, angsa, bebek serta
unggas liar sangat peka terhadap infeksi virus ini. Penyakit ini dapat ditularkan
melalui sekresi hidung, mata, dan feses dari unggas terinfeksi yang masuk melalui
mulut, mata dan hidung. Feses yang terkontaminasi virus AI dapat bertahan
sampai waktu yang sangat lama terutama dalam keadaan sejuk dan lembab
(CIDRAP 2004).
Wibawan (2006) mengatakan saat ini kondisi virus AI sudah berbentuk
infeksi subklinik, yang berarti bahwa hewan terinfeksi virus AI namun tidak
menunjukkan gejala klinis sakit. Oleh karena itu penyakit yang tidak terdeteksi
dengan tepat akan menyebabkan meluasnya penyakit di lapangan. Penyebaran
penyakit AI sampai saat ini diduga akibat perpindahan unggas dewasa. Telur yang
telah terinfeksi secara vertikal dari induknya memiliki daya tetas rendah sehingga
anak ayam umur satu hari (DOC) tidak lazim terinfeksi virus AI subtipe H5N1
saat menetas. Peran DOC sebagai media penyebar virus AI belum banyak diteliti
dan diketahui oleh para ahli, sehingga perlu diteliti apakah virus AI dapat
menyebar bersama perpindahan DOC karena infeksi subklinis. FAO (2008)
menyebutkan bahwa DOC dapat tertular virus AI akibat terkontaminasi dari alat
angkut.
Penegakan diagnostik AI dapat dilakukan berdasarkan isolasi dan
karakterisasi virus. Isolasi virus sering dilakukan dengan menggunakan telur ayam
monkey kidney vero cell line. Secara serologik virus AI dapat diidentifikasi
dengan uji HI (hemagglutination inhibition), AGID (agar gel immunodiffusion) ,
ELISA (enzym linked immnunosorbent assay), imunohistokimia atau western
blot. Untuk mengkonfirmasi adanya virus AI dilakukan dengan konvensional
Reverse Transcriptase-Polymerase Chain Reaction (RT-PCR), real time RT-PCR
atau sekuensing genetik (OIE 2005 dan Kraft et al. 2005). FAO (2004)
menambahkan, screening test untuk virus AI secara cepat dapat menggunakan
rapid direct antigen detection test.
Karakteristik AI subtipe H5N1 dapat dilakukan dengan mengamplifikasi
cetakan DNA (DNA template) menggunakan RT-PCR atau sekuensing genetik.
Uji ini dapat digunakan pada unggas yang sakit ataupun yang mati. PCR sebagai
salah satu metode uji yang menggunakan teknologi biologi molekuler sangat
penting artinya bagi perkembangan diagnosa penyakit hewan. Kemampuan yang
dimiliki oleh teknologi PCR dalam memperbanyak DNA target yang dicari secara
spesifik akan bermanfaat dan dapat diandalkan untuk diagnosa penyakit yang
disebabkan oleh agen virus dan agen infeksius lainnya. Penelitian ini bertujuan
untuk mengidentifikasi virus AI pada DOC dengan RT-PCR serta melakukan
isolasi virus tersebut.
METODE PENELITIAN
Sampel penelitian ini adalah DOC pedaging dan petelur yang berasal dari
perusahaan pembibitan di daerah Jawa Barat dan Banten yang akan
didistribusikan ke luar Pulau Jawa melalui Bandar Udara Soekarno Hatta dengan
metode detect disease. Pengambilan sampel dilakukan pada Bulan April sampai
dengan September 2008 dengan jumlah sampel 240 ekor DOC.
Uji serologi dengan uji Hemaglutinasi Inhibisi (HI)
Sebanyak 240 ekor DOC diambil darahnya untuk uji serologis. Darah
diambil dari jantung menggunakan jarum suntik 1 ml (Terumo) kemudian
dibiarkan beberapa saat pada suhu ruang sampai terbentuk serum. Uji
Hemaglutinasi Inhibisi (HI) dilakukan untuk mengukur titer antibodi terhadap
virus AI menggunakan antigen AI H5N1 (BBalitvet) dan diamati adanya
hambatan serum terhadap haemaglutinasi antigen virus AI. Titer serum ditentukan
berdasarkan atas hambatan serum pada pengenceran tertinggi masih mampu
menghambat antigen (4 HAU) mengaglutinasi sel darah merah.
Sebanyak 25 μl PBS dimasukkan ke dalam 96 lubang cawan mikro dengan
dasar berbentuk V kemudian ditambah dengan serum yang akan diuji sebanyak
25 μl pada lubang pertama dan dilakukan pengenceran serial kelipatan 2 dari
lubang pertama sampai lubang ke-11, sedangkan lubang ke-12 dipergunakan
sebagai kontrol. Pada masing-masing lubang ditambahkan antigen virus AI H5N1
sebesar 4 HAU masing-masing 25 μl kecuali pada lubang ke-12 yang ditambah
dengan PBS, selanjutnya cawan mikro dikocok sebentar dan diinkubasi selama 15
menit pada suhu kamar. Pada seluruh lubang kemudian ditambah dengan 25 μl sel
darah merah 1% dan diinkubasi lagi selama 30 menit. Setelah itu diamati
terjadinya hambatan agglutinasi pada setiap lubang (OIE, 2005).
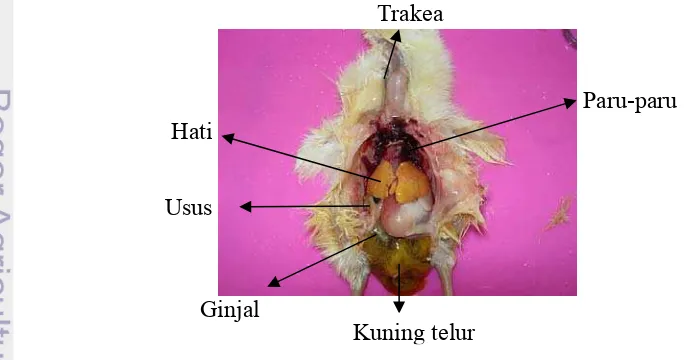
Pengambilan sampel organ dan kuning telur
Sebanyak 240 sampel DOC tersebut kemudian dinekropsi dan diambil
organnya (trakea, paru-paru, usus, hati dan ginjal) serta kuning telur yang masih
ada dalam tubuh DOC (Gambar 5) untuk diidentifikasi menggunakan RT-PCR.
Koleksi sampel organ dilakukan dengan cara mengumpulkan 6 organ yang sama
(pooling) setiap peternakan, sedangkan sampel kuning telur dikoleksi dari setiap
[image:41.595.119.464.537.717.2]individu DOC.
Gambar 5. Organ dan kuning telur DOC yang diperiksa menggunakan RT-PCR Kuning telur
Trakea
Usus Hati
Ginjal
Ekstraksi RNA virus
Potongan organ (trakea, paru-paru, usus, hati dan ginjal) dan kuning telur
diekstraksi menggunakan TRIZOLP
R
P
LS (Invitrogen). Sampel sebanyak 250 μl
dimasukkan ke dalam tabung mikro 1.5 ml dan ditambahkan 750 μl Trizol LS
kemudian divortex serta inkubasikan selama 5 menit pada suhu ruang. Selanjutnya
larutan ditambah dengan 250 μl kloroform, dicampur perlahan-lahan dan
diinkubasi 10-15 menit pada suhu ruang. Setelah itu kemudian larutan disentrifus
12.000 rpm selama 15 menit pada suhu 4P
o
P
C. Supernatan dipindahkan ke dalam
tabung mikro baru kemudian ditambahkan 500 μl isoprophil alkohol
(isopropanol), dicampur perlahan-lahan kemudian diinkubasikan pada suhu kamar
selama 10 menit. Setelah itu larutan disentrifus 12.000 rpm selama 20 menit pada
suhu 4P
o
P
C, kemudian supernatan dibuang dan pelet RNA dikoleksi. Endapan
dicuci dengan menggunakan ethanol 75% dalam DEPC (dingin) kemudian
divortek dan disentrifus 12.000 rpm selama 20 menit pada suhu 4P
o
P
C, supernatan
dibuang dan pelet dikeringkan selama kurang lebih 15 menit di udara terbuka.
Pada pelet yang telah kering, ditambahkan 10 μl RNAse free water kemudian
disimpan pada suhu –20P
ο
P
C sebelum digunakan untuk amplifikasi PCR.
Ekstraksi kuning telur sebelumnya diberi perlakuan dengan menambahkan
satu bagian kuning telur dengan satu bagian PBS, selanjutnya campuran divortek,
kemudian ditambahkan dengan dua bagian kloroform (Beck et al. 2003; Selleck
2005). Campuran ini diinkubasi pada suhu ruang selama 30 menit selanjutnya
disentrifus 3000 rpm selama 15 menit. Cairan yang berwarna putih jernih yang
terdapat pada lapisan atas digunakan untuk ekstraksi RNA.
Ekstraksi sampel organ sebelumnya diberi perlakuan dengan menggerus
setiap sampel organ (kumpulan dari 6 ekor DOC) dan diencerkan 1/100 PBS yang
telah ditambah dengan antibiotika penisilin dan streptomisin sebanyak 100 IU,
sentrifus 3000 rpm selama 10 menit. Supernatan diambil dan digunakan untuk
Identifikasi virus AI subtipe H5N1 dengan RT-PCR
Reaksi RT-PCR menggunakan Super ScriptP
TM
P
III One-Step RT-PCR sistem
dengan Platinum P
R
P Taq DNA Polymerase (Invitrogen, Cat. No. 12574-026).
Primer yang digunakan ada tiga macam yaitu primer gen matrik, primer H5 dan
[image:43.595.93.530.138.820.2]primer N1 (Tabel 2).
Tabel 2. Primer untuk mengamplifikasi virus AI H5N1 pada DOC
Primer Sekuen basa Fragmen Gen Produk
1P
a
P FAI: 5’GCA CTT GAT ATT GTG GAT TCT TGA TC’3 M 55bp