52
LAMPIRAN 1
DATA HASIL PERCOBAAN
L1.1 DATA HASIL PERCOBAAN
L1.1.1 Data Hasil Percobaan Penentuan Waktu Optimum
Tabel L1.1 menunjukkan data hasil percobaan penentuan waktu optimum pada variasi waktu 30, 60, 90, dan 120 menit.
Tabel L1.1 Data Hasil Percobaan Penentuan Waktu Optimum
Jenis Pektin Bobot Biosorben (gr) Waktu (menit) Nilai Absorptivitas Konsentrasi Sisa Logam Pb
(ppm)
Non-Modifikasi 1
30 0,0069 0,3044
60 0,0039 0,2437
90 0,0039 0,1387
120 0,0026 0,0669
Modifikasi 1
30 0,0031 0,0945
60 0,0007 0,0643
90 0.0016 0,0116
120 0,0015 0,1208
L1.1.2 Data Hasil Percobaan Pengaruh Bobot Biosorben
Tabel L1.2 menunjukkan data hasil percobaan pengaruh bobot biosorben pada variasi bobot 0,25; 0,50; 0,75; dan 1,00 gr.
Tabel L1.2 Data Hasil Percobaan Pengaruh Bobot Biosorben
Bobot Biosorben (gr) Waktu (menit) Nilai Absorptivitas Konsentrasi Sisa Logam Pb (ppm)
0,25
90
0,0359 1,6604
0,5 0,0135 0,6038
0,75 0,0076 0,3255
53
L1.1.3 Data Hasil Percobaan Pengaruh Ukuran Biosorben
Tabel L1.3 menunjukkan data hasil percobaan pengaruh ukuran biosorben pada variasi ukuran 60 dan 100 mesh.
Tabel L1.3 Data Hasil Percobaan Pengaruh Ukuran Biosorben
Ukuran Biosorben (mesh) Waktu (menit) Nilai Absorptivitas Konsentrasi Sisa Logam Pb (ppm)
60
90 0,0016 0,0116
100 -0,0015 -0,0912
L1.1.4 Data Hasil Percobaan Analisa Isoterm Adsorpsi
Tabel L1.4 menunjukkan data hasil percobaan yang digunakan untuk menghitung analisa isoterm Freundlich dan Langmuir pada variasi konsentrasi 15, 20, 25, 30, dan 35 ppm.
Tabel L1.4 Data Hasil Percobaan Analisa Isoterm Adsorpsi
Konsentrasi Awal Logam Pb
(ppm) Waktu (menit) Nilai Absorptivitas Konsentrasi Sisa Logam Pb (ppm)
15
90
0.0016 0,0116
18 0,0023 0,1333
21 0,0034 0,2144
27 0,0046 0,2685
24 0,0074 0,3946
L1.1.5 Data Hasil Analisa FTIR (Fourier Transform Infra Red)
Gambar L1.1 menunjukkan hasil uji analisa FTIR pektin non-modifikasi.
54
Gambar L1.2 menunjukkan hasil uji FTIR pektin modifikasi.
Gambar L2.2 Hasil Uji FTIR Pektin Modifikasi
L1.1.6 Data Hasil Analisa Penentuan Derajat Esterifikasi Pektin
Tabel L1.5 menunjukkan hasil analisa penentuan derajat esterifikasi pektin.
Tabel L1.5 Hasil Analisa Penentuan Derajat Esterifikasi Pektin
Jenis Pektin Initial Titration (ml) Final Titration (ml)
Pektin Markisa Non Modif 2,5 2,8
55
L1.2 DATA HASIL PERHITUNGAN
L1.2.1 Data Hasil Perhitungan Penentuan Waktu Optimum
Tabel L1.6 menunjukkan data hasil perhitungan penentuan waktu optimum pada variasi waktu 30, 60, 90, dan 120 menit.
Tabel L1.6 Data Hasil Perhitungan Penentuan Waktu Optimum
Jenis Pektin Massa Biosorben (gr) Konsentrasi Awal (ppm) Waktu (menit) Konsentrasi Akhir (ppm) Persentase Penyerapan (%)
Non-Modifikasi 1 15
30 0,3044 98.04
60 0,2437 98.38
90 0,1387 99,08
120 0,0669 99,52
Modifikasi 1 15
30 0,0945 99,37
60 0,0643 99,57
90 0,0116 99,92
120 0,1208 99,19
L1.2.2 Data Hasil Perhitungan Pengaruh Bobot Biosorben
Tabel L1.7 menunjukkan data hasil percobaan pengaruh bobot biosorben pada variasi bobot 0,25; 0,50; 0,75; dan 1,00 gr.
Tabel L1.7 Data Hasil Perhitungan Pengaruh Bobot Biosorben
Bobot Biosorben (gr) Konsentrasi Awal (ppm) Waktu (menit) Konsentrasi Akhir (ppm) Persentase Penyerapan (%) 0,25
15 90
1,6604 88,93
0,5 0,6038 95,97
0,75 0,3255 97,83
1 0,0116 99,92
L1.2.3 Data Hasil Perhitungan Pengaruh Ukuran Biosorben
Tabel L1.8 menunjukkan data hasil perhitungan pengaruh ukuran biosorben pada variasi ukuran 60 dan 100 mesh.
Tabel L1.8 Data Hasil Perhitungan Pengaruh Ukuran Biosorben
Massa Biosorben (gr) Konsentrasi Awal (ppm) Waktu (menit) Ukuran Biosorben (mesh) Konsentrasi Akhir (ppm) Persentase Penyerapan (%)
1 15 90 60 0,0116 99,92
56
L1.2.4 Data Hasil Perhitungan Analisa Isoterm Adsorpsi
Tabel L1.9 menunjukkan data hasil perhitungan yang digunakan untuk analisa isoterm adsorpsi dengan variasi konsentrasi 15, 20, 25, 30, dan 35 ppm.
Tabel L1.9 Data Hasil Perhitungan Analisa Isoterm Adsorpsi
Co (mg/L) Ce (mg/L) Qe (mg/g) Ce/Qe log Ce log Qe
15 0,0116 0,7494 0,0155 -1.9355 -0,1253
18 0,1333 0,8933 0,1492 -0,8752 -0,0490
21 0,2144 1,0393 0,2063 -0,6688 0,0167
24 0,2685 1,1866 0,2263 -0,5711 0,0743
27 0,3946 1,3303 0,2966 -0,4038 0,1239
L1.2.5 Data Hasil Perhitungan Analisa Derajat Esterifikasi Pektin
Tabel L1.10 menunjukkan data hasil perhitungan analisa derajat esterifikasi pektin.
Tabel L1.10 Data Hasil Perhitungan Analisa Derajat Esterifikasi Pektin
Jenis Pektin
Initial Titration
(ml)
Final Titration
(ml)
Derajat Esterifikasi (%)
Pektin Markisa Non Modif 2,5 2,8 52,83
57
LAMPIRAN 2
CONTOH HASIL PERHITUNGAN
L2.1 PERHITUNGAN PERSENTASE PENYERAPAN
Dari persamaan 3.1 dapat dihitung persentase penyerapan. Maka untuk contoh perhitungan diambil contoh yaitu absorpsi pada konsentrasi 15 ppm, massa biosorben 1 gr, ukuran partikel biosorben 60 mesh, waktu pengadukan selama 90 menit.
= 99,92 %
Keterangan:
C1 = konsentrasi awal larutan (mg/l) C2 = konsentrasi akhir larutan (mg/l)
L2.2 PERHITUNGAN ISOTERM ADSORPSI
Tabel L2.1 menunjukkan data yang digunakan untuk perhitungan isoterm adsorpsi.
Tabel L2.1 Data Penentuan Isoterm Adsorpsi
Co (mg/L) Ce (mg/L) Qe (mg/g) Ce/Qe log Ce log Qe
15 0.0116 0,7494 0,0155 -1.9355 -0,1253
18 0.1333 0.8933 0.1492 -0.8752 -0.0490
21 0.2144 1.0393 0.2063 -0.6688 0.0167
24 0.2685 1.1866 0.2263 -0.5711 0.0743
58
Diplot kurva isotherm yang dapat mewakili penyerapan ion logam Pb
Trial I (Isoterm Langmuir)
Diplot Ce vs dengan intersep adalah dan slope adalah . Kurva Ce vs dapat dilihat pada gambar L2.1.
Gambar L2.1 Kurva Isoterm Adsorpsi Langmuir Pektin Kulit Buah Markisa Terhadap Ion Logam Pb2+
Dari gambar L2.1 diperoleh persamaan isotherm Langmuir adalah y = 0,7181x + 0,0319. Maka dapat dihitung nilai bqm dan qm seperti cara berikut:
0,7181 =
qm =
qm = 1,3926
0,0319 =
bqm =
bqm = 31,348
59
Trial II (Isotherm Freundlich)
Untuk isotherm Freundlich akan diplot kurva log Ce vs log qe. Kurva tersebut akan memberikan nilai intersep adalah log k dan slope adalah . Kurva isotherm Freundlich dapat dilihat pada gambar L2.2.
Gambar L2.2 Kurva Isoterm Adsorpsi Freundlich Pektin Kulit Buah Markisa Terhadap Ion Logam Pb2+
Dari gambar L2.2 diperoleh persamaan isotherm Freundlich adalah y = 0,1472x + 0,1393. Maka dapat dihitung nilai n dan k dengan cara sebagai berikut:
0,1393 = log k k = 100,1393 k = 1,3782
0,1427 = n =
n = 7,0077
60
L2.3 PERHITUNGAN DERAJAT ESTERIFIKASI
Dari persamaan 4.1 dapat dihitung nilai derajat esterifikasi. Sebagai contoh diambil data pektin non-modifikasi dengan intial titration 2,5 ml dan final titration 2,8 ml.
DE =
= 52,83%
Keterangan:
DE = Degree of Esterification (%)
Final Titration = jumlah NaOH yang digunakan pada titrasi terakhir (ml)
61
LAMPIRAN 3
FOTO HASIL PERCOBAAN
L3.1 EKSTRAKSI PEKTIN
Gambar L3.1 Kulit Markisa Kuning Kering
62
Gambar L3.3 Penyaringan Filtrat Pektin
Gambar L3.4 Hasil Penyaringan Filtrat Pektin
63
Gambar L3.6 Penyaringan Gel Pektin
Gambar L3.7 Pencucian Gel Pektin
64
Gambar L3.9 Pektin Kering
L3.2 MODIFIKASI PEKTIN
Gambar L3.10 Hasil Pelarutan Pektin dan Pengaturan pH
65
Gambar L3.12 Penikubasian Pektin Dengan Es Batu
66
Gambar L3.14 Pencucian Pektin Dengan Aseton
Gambar L3.15 Pektin Hasil Penyaringan
67
L3.3 PROSES BIOSORPSI DENGAN LOGAM Pb
Gambar L3.17 Proses Pengkontakan Pektin dengan Logam
68
Gambar L3.19 Hasil Larutan Logam yang Telah Diadsorpsi
L3.4 ALAT ANALISA PEKTIN
69
45
DAFTAR PUSTAKA
[1] Misbachul Moenir. “Kajian Fitoremediasi Sebagai Alternatif Pemulihan Tanah Tercemar Logam Berat”. Jurnal Riset Teknologi Pencegahan dan Pencemaran Industri, Vol. 1 No. 2 : 115 – 123, 2010, Hal: 116.
[2] Nana Dyah Siswati, Tenti Indrawati dan Meliya Rahmah. “Biosorpsi Logam Berat Plumbum (Pb) Menggunakan Biomassa Phanerochaete Chrisosporium”. Jurnal Ilmiah Teknik Lingkungan, Vol. 1 No. 2, 2009, Hal: 68.
[3] Peraturan Menteri Lingkungan Hidup. “Baku Mutu Air Limbah Bagi Kawasan Industri”. Nomor 3, 2010.
[4] Nilanjana Das, P. Karthika, R. Vimala, dan V. Vinodhini. “Use of Natural Products as Biosorbent of Heavy Metals: An Overview”. Natural Product Radiance, Vol. 7(2) : 133-138, 2008, Hal: 113.
[5] A. G. Devi Prasad dan Mohammed Abdulsalam Abdullah. “Biosorption of Fe(II) from Aqueous Solution Using Tamarind Bark and Potato Peel Waste: Equilibrium and Kinetic Studies”. Journal of Applied Sciences in Environmental Sanitation, 4(3): 273-282, 2009, Hal. 274.
[6] Muhammad Aqeel Ashraf, Mohd. Jamil Maah, dan Ismail Yusoff. “Study of Banana peel (Musa sapientum) as a Cationic Biosorben”. American-Eurasian J. Agric & Environ, Sci 8(1): 7-17, ISSN: 1818-6769, 2010, Hal: 7.
[7] J. L. Gardea Torresday, G. de la Rosa, dan J. L Peralta-Videa. “Use of Phytofiltration Technologies in The Removal of Heavy Metals: A Review”. Pure Appl. Chem, Vol. 76, No. 4: 801-813, 2004, Hal: 802.
[8] L. Kurniasari, I. Riwayati, dan Suwardiyono. “Pektin Sebagai Alternatif Bahan Baku Biosorben Logam Berat”. Momentum, Vol. 8, No. 1: 1- 5, 2012, Hal: 1 – 2, 4.
[9] Yusuf Aprinando Sagala. “Kecernaan Kulit Buah Markisa (Pasiflora edulis sims F. edulis) Difermentasi Phanerochaete chrysosporium Pada Domba Lokal Fase Pertumbuhan”. Skripsi, Departemen Peternakan, Fakultas Pertanian, Universitas Sumatera Utara, Medan, 2010, Hal: 4.
[10] Hesti Meilina dan Illah Sailah. “Produksi Pektin Dari Kulit Jeruk Lemon (Citrus Medica)”. Prosiding Simposium Nasional Polimer V, ISSN: 1410-8720, 2005, Hal: 118 – 119.
46
[12] W. W. Wong, F. M. A. Abbas, M. T. Liong, dan M. E. Azhar. “Modification of Durian Rind Pectin for Improving Biosorbent Ability”. International Food Research Journal, 15(3): 363-365, 2008, Hal: 363 – 365.
[13] Y. N. Mata, M. L. Blazquez, A. Ballester, F. Gonzalez, dan J. A. Munoz. “Sugar-beet Pulp Pectin Gels as Biosorbent for Heavy Metals: Preparation and Determination of Biosorption and Desorption Characteristics”. Chemical Engineering Journal, 150: 289-301, 2009, Hal: 300.
[14] Angga Rajawane. “Biosorpsi Logam Berat Pb(II) Menggunakan Kulit Buah Kakao”. Skripsi, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Bogor, 2008, Hal: 11.
[15] Ankit Balaria dan Silke Schiewer. “Assessment of Biosorption Mechanism For Pb Binding By Citrus Pectin”. Separation and Purification Technology, 63: 577–581, 2008, Hal: 579.
[16] Flavio A. Pavan, Ana C. Mazzocato, Rosangela A. Jacques, dan Silvio L.P. Dias. “Ponkan Peel: A Potential Biosorbent For Removal of Pb(II) Ions From Aqueous Solution”. Biochemical Engineering Journal, 40: 357–362, 2008, Hal: 361.
[17] Oliveira, Eliana Monteiro Soares de dan Eder Dutra de Resende. “Yield of Albedo Flour and Pectin Content In The Rind of Yellow Passion Fruit”. Cienc. Tecnol. Aliment., Campinas, 32(3): 492-498, ISSN: 0101 – 2061, 2012, Hal: 493. [18] Shan Qin Liew, Nyuk Ling Chin, dan Yus Aniza Yusof. “Extraction and Characterization of Pectin from Passion Fruit Peels”. Agriculture and Agricultural Science Procedia, 2 : 231 – 236, 2014, Hal: 232 – 233.
[19] S. Simmaky dan G. Jaanaki. “Extraction and Characterization of Pectin From Yellow Passion Fruit (Passiflora edulis f. flavicarpa L) Endocarp Peel”. SAITM Research Symposium on Engineering Advancements, 2014, Hal: 27 – 28. [20] Asri Ismayati Sunarya. “Biosorpsi Cd(II) dan Pb(II) Menggunakan Kulit Jeruk Siam (Citrus reticulata). Skripsi, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Bogor, 2006, Hal: 5 – 8. [21] Karsinah, F. H. Silalahi, dan A. Manshur. “Eksplorasi Dan Karakterisasi Plasma Nutfah Tanaman Markisa”. Jurnal Holtikultura, 17(4): 297-298, 2007, Hal: 298 – 304.
[22] Surianta. “Sifat Fisik Dan Daya Simpan Buah Markisa Kuning (Passiflora flavicarpa) yang Dilapisi Kitosan. Skripsi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Bogor, 2011, Hal: 4.
47
[24] Evy Kurniawati, “Kualitas Jelly Kulit Buah Markisa (Passiflora edulis var. flavicarpa Degener) dengan Variasi Suhu dan Waktu Ekstraksi Pektin,” Skripsi, Program Sarjana Fakultas Teknobiologi Universitas Atmajaya, Yogyakarta, 2013, hal. 3.
[25] Eloisa Rovaris Pinheiro, Iolanda M. D. A. Silva, Luciano V. Gonzaga, Edna R. Amante, Reinaldo F. Teofilo, Marcia M. C. Ferreira, dan Renata D. M. C. Amboni. “Optimization of Extraction of High-Ester Pectin From Passion Fruit Peel (Passiflora edulis flavicarpa) With Citric Acid by Using Response Surface Methodology”. Bioresource Technology, 99 : 5561–5566, 2007, Hal: 5562.
[26] M. El-Nahal Dalia. “Effect of Using Pectin On Lead Toxicity”. The Journal of American Science, 6(12), 2010, Hal: 541
[27] B. R. Sharma, Naresh L., N. C. Dhuldhoya, S. U. Merchant and U. C. Merchant. “An Overview on Pectins”. Times Food Processing Journal, 2006, Hal: 44.
[28] Pranati Srivastava dan Rishabha Malviya. ”Sources of Pectin, Extraction and Its Applications in Pharmaceutical Industry – An Overview”. Indian Journal of Natural Products and Resources, Vol. 2(1): 10 – 18, 2011, Hal: 10.
[29] Apsara Madhav dan P. B. Pusphalatha. “Characterization of Pectin Extracted from Different Fruit Wastes”. Journal of Tropical Agriculture, 40: 53 – 55, 2002, Hal: 53
[30] Purwo Subagyo dan Zubaidi Achmad. “Pemungutan Pektin dari Kulit dan Ampas Apel Secara Ekstraksi”. EKSERGI, Volume X, Nomor 2, 2010, Hal: 47 – 48.
[31] Berry H. Satria dan Yusuf Ahda. “Pengolahan Limbah Kulit Pisang Menjadi Pektin Dengan Metode Ekstraksi”. Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang, 2009, Hal: 2.
[32] Afni Ramadhani. “Ekstraksi dan Karakterisasi Pektin Dari Limbah Kulit Semangka Secara Enzimatis Dengan Aspergillus niger”. Skripsi, Fakultas Tarbiyah dan Keguruan, Universitas Islam Negeri Sultas Syarif Kasim Riau, Pekanbaru, 2014, Hal: 18 – 19.
[33] Farida Hanum, Martha Angelina Tarigan, dan Irza Menka Deviliany Kaban. “Ekstraksi Pektin dari Kulit Buah Pisang Kepok (Musa Paradisiaca)”. Jurnal Teknik Kimia USU, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan, 2012, Hal: 50.
48
[35] I. Kacem, H. Majdoub and S. Roudesli. “Physicochemical Properties of Pectin from Retama Raetam Obtained Using Sequential Extraction”. Journal of Applied Sciences, 8(9): 1713 – 1719, ISSN: 1812 – 5654, 2008, Hal: 1718.
[36] Agus Budiyanto dan Yulianingsih. “Pengaruh Suhu dan Waktu Ekstraksi Terhadap Karakter Pektin Dari Ampas Jeruk Siam (Citrus nobilis L)”. Jurnal Pascapanen, 5(2): 37 – 44, 2008, Hal: 37 – 38.
[37] Akhmalludin dan Arie Kurniawan. “Pembuatan Pektin Dari Kulit Cokelat Dengan Cara Ekstraksi”. Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang, 2005.
[38] Eneida Sala Cossich, Celia Regina Granhen Tavares, dan Teresa Massako Kakuta Ravagnani. “Biosorption of Chromium (III) by Sargassum sp. Biomass”. Electronic Journal of Biotechnology, Vol. 5, No. 2, ISSN : 0717-3458, 2012, Hal: 133.
[39] G. M. Gadd. “Biotechnology”. Vol. 6 : 401 – 433, 1998, Hal: 410.
[40] N. Ahalya, T. V. Ramachandra dan R. D. Kanamadi. “Biosorption of Heavy Metals – Review Paper”.Research Journal of Chemistry and Environment, Vol. 7(4): 71-79, 2003, Hal: 72 – 73.
[41] Ade Apriliani. “Pemanfaatan Arang Ampas Tebu Sebagai Adsorben Ion Logam Cd, Cr, Cu, dan Pb Dalam Air Limbah”. Skripsi, Program Studi Kimia, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah, Jakarta, 2010, Hal: 12.
[42] Antonius Theodorus B. Rumajar. “Penjajakan Kadar Logam Berat Pb Pada Tanaman Kangkung Darat (Ipomea reptans Poir) Asal Kecamatan Medan Deli dan Kangkung Air (Ipomea aquatica Forsk) Asal Kecamatan Sunggal Kota Medan. Skripsi, Departemen Ilmu Tanah, Fakultas Pertanian, Universitas Sumatera Utara, Medan, 2010, Hal: 5.
[43] Ni Putu Diantariani dan K.G. Dharma Putra. “Penentuan Kandungan Logam Pb Dan Cr Pada Air dan Sedimen Di Sungai Ao Desa Sam Sam Kabupaten Tabanan”.Ecotrophic, Vol. 1, No. 2, ISSN 1907 – 5626, 2006, Hal: 2.
49
[45] Julhim S. Tangio. “Adsorpsi Logam Timbal (Pb) Dengan Menggunakan Biomassa Enceng Gondok (Eichhorniacrassipes)”. Jurnal Entropi, Vol. VIII, No.
1, 2013, Hal: 501.
[46] Maharani Indah Kartikasari. “Resin Pengkhelat Polistiren Divinilbenzen-4-(2 Piridilazo) Resorsinol: Sintesis dan Karakterisasi Retensi Ion Logam Pb2+”. Skripsi, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung, Bandung, 2008, Hal: 4 – 5.
[47] Heru Umbara dan Heny Santoso. “Faktor Bioakumulasi Timbal Pada Kerang Darah (Anadara granosa) Berdasarkan Studi Biokinetika Menggunakan Perunut 210Pb”. Prosiding PPI – PDIPTN Pustek Akselerator dan Proses Bahan – Batan, ISSN 0216 – 3128, 2007, Hal: 130 – 131.
[48] B. Koumanova dan P. Peeva-Antova. “Adsorption of p-Chlorophenol from Aqueous Solution on Bentonite and Perlite”. Journal of Hazardous Materials, Vol. 90, Issue 3, 2002, Hal: 232.
[49] Ai Nailil Muna SM. “Kinetika Adsorpsi Karbon Aktif Dari Batang Pisang
Sebagai Adsorben Untuk Penyerapan Ion Logam Cr(IV) Pada air Limbah Industri”. Tugas Akhir II, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Semarang, Semarang, 2011, Hal: 11. [50] Mehdi Rahimi dan Mehdi Vadi. “Langmuir, Freundlich and Tempkin Adsorption Isotherms of Propranolol on Multi-Wall Carbon Nanotube”. Journal Of Modern Drug Discovery and Drug Delivery Research, ISSN: 2348 –3776, 2014. Hal: 2.
[51] Bregas S. T. Sembodo. “Isoterm Kesetimbangan Adsorpsi Timbal Pada Abu Sekam Padi”. EKUILIBRIUM, Vol. 4, No. 2, Hal: 101.
[52] M. H. L Ribeiro, P. A. S Lourenco, J. P Monteiro, S. Ferreira-Dias. “Kinetics of Selective Adsorption of Impurities From A Crude Vegetable Oil in Hexane to Activated Earths and Carbons”. Original Paper. Eur Food Res Tecnol., 213: 132 – 138, 2001, Hal: 133.
[53] Wang Chunfeng, Li Jiansheng, Sun Xia, Wang Lianjun, dan Sun Xiuyun. “Evaluation of Zeolites Synthesized From Fly Ash as Potential Adsorbents For Wastewater Containing Heavy Metals”. Journal of Environmental Sciences, 21: 127–136, 2008, Hal: 133.
[54] Haryono, Dyah Setyo Pertiwi, Dian Indra Susanto, dan Dian Ismawaty. “Pengambilan Pektin dari Ampas Wortel Dengan Ekstraksi Menggunakan Pelarut HCl Encer”. Jurusan Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Nasional, Bandung, 2003, Hal: 2.
50
Cr(III) And Pb(II) From Aqueous Solution”. Separation and Purification Technology, 57: 193 – 198, 2007, Hal: 196.
[56] G. Annadurai, R. S. Juang, dan D. J. Lee. “Adsorption of Heavy Metals From Water Using Banana and Orange Peels”. Water Science and Technology, Vol. 47, No. 1: 185–190, 2002, Hal: 186 – 190.
[57] Siti Solikah dan Budi Utami. ‘Perbedaan Penggunaan Adsorben dari Zeolit Alam Teraktivasi dan Zeolit Terimmobilisasi Dithizon Untuk Penyerapan Ion Logam Tembaga (Cu2+)”. Seminar Nasional Kimia dan Pendidikan Kimia VI “Pemantapan Riset Kimia dan Asesmen Dalam Pembelajaran Berbasis Pendekatan Saintifik”, 2014, Hal: 350 – 351.
[58] Erhan Demirbas, Mehmet Kobya, Elif Senturk, dan Tuncay Ozkan. “Adsorption Kinetics For The Adsorbent of Chromium(VI) From Aqueous Solutions On The Activated Carbons Prepared From Agricultural Wastes”. Water SA, 30: 533 – 540, 2004, Hal: 536.
[59] L. M. Barros Junior, G. R. Macedo, M. M. L. Duarte, E. P. Silva, dan A. K. C. L. Lobato. “Biosorption of Cadmium Using The Fungus aspergillus niger”. Brazilian Journal of Chemical Engineering, Vol. 20, No. 3, 2003.
[60] Rizki Amaliah, Nursiah La Nafie, dan Sitti Fauziyah. “Pemanfaatan Karang Sebagai Biosorben Ion Logam”. ISSN 1411-2132, Marina Chimica Acta, Vol. 13, No. 1, 2012, Hal: 36 – 45.
[61] Murni Handayani dan Eko Sulistiyono. ”Uji Persamaan Langmuir Dan Freundlich Pada Penyerapan Limbah Chrom (VI) Oleh Zeolit”. Prosiding Seminar Nasional Sains dan Teknologi Nuklir PTNBR – BATAN, 2009, Hal: 133.
[62] Amun Amri, Supranto, dan M. Fahrurozi. “Kesetimbangan Adsorpsi Optional Campuran Biner Cd(II) dan Cr(III) dengan Zeolit Alam Terimpregnasi 2-merkaptobenzotiazol”. Jurnal Natur Indonesia, 6(2): 111 – 117, ISSN: 1410 – 9379. 2004, Hal: 112.
[63] Kusmiyati, Puspita Adi Lystanto, dan Kunthi Pratiwi. “Pemanfaatan Karbon Aktif Arang Batubara (KAAB) Untuk Menurunkan Kadar Ion Logam Berat Cu2+ Dan Ag+Pada Limbah Cair Industri”. Reaktor, Vol. 14, No. 1, 2012, Hal: 56. [64] Uruthira Kalapathy dan A. Proctor. “Effect of Acid Extraction and Alcohol Precipitation Conditions on The Yield Purity of Soy Hull Pectin”. Food Chemistry, 73: 393 – 396, Hal: 395.
51
[66] Wong Weng Wai, Abbas F.M. AlKarkhi, Azhar Mat Easa. “Comparing Biosorbent Ability of Modified Citrus and Durian Rind Pectin”. Carbohydrate Polymers, 79: 584–589, 2010, Hal: 585.
[67] Sherman, C. P. Hsu, Ph.D. “Infrared Spectroscopy”. Separation Sciences Research and Product Development Mallinckrodt, Inc., Mallinckrodt Baker Division, Chapter 15, Hal: 250.
[68] Dragana-Linda Mitic-Stojanovic, Aleksandra Zarubica, Milovan Purenovic, Danijela Bojic, Tatjana Andjelkovic, dan Аleksandar Lj. Bojic. “Biosorptive Removal of Pb2+, Cd2+ and Zn2+ Ions From Water by Lagenaria vulgaris Shell”. Water SA, Vol. 37, No. 3, ISSN: 0378 – 4738, 2011, Hal: 8.
[69] C. Garnier, M.A.V. Axelos, J.-F. Thibault. “Carbohydr”. Res. 240, 219, 1993.
16
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Kimia Organik, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 8 bulan.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan Penelitian
Pada penelitian ini bahan yang digunakan adalah:
1. Kulit markisa kuning dari beberapa pasar buah di Medan, Sibolangit dan Berastagi
2. Asam klorida (HCl) 3. Aquadest
4. Etanol 96%
5. Natrium hidroksida (NaOH) 6. Aseton (C3H6O)
7. Timbal (II) Sulfat (PbSO4)
3.2.2 Peralatan Penelitian
Peralatan yang digunakan dalam penelitian ini adalah: 1. Oven
2. Ayakan 60 dan 100 mesh 3. Alumunium foil
17 10. Termometer
11. Batang pengaduk 12. Kertas saring 13. Hot plate 14. Corong gelas 15. pH meter 16. Pipet tetes
17. Atomic Absorption Spectrophotometry (AAS) 18. Fourier Transform Infra Red (FTIR)
3.3 PROSEDUR PENELITIAN 3.3.1 Persiapan Analisis dan Kimia
a. Buah markisa dicuci dan dipisahkan dari dagingnya. b. Kulit buah markisa dikeringkan dengan oven pada 105oC. c. Kulit kering lalu diblender sampai halus.
3.3.2 Ekstraksi Pektin
Prosedur ekstraksi pektin diadopsi dari prosedur yang dilakukan Liew, dkk. [18] dan Simmaky dan Jaanaki [19] dengan sedikit modifikasi :
1. Tepung kulit markisa kering yang telah diperoleh ini kemudian ditambahkan air dengan perbandingan 1 : 15 (w/v) lalu campuran diaduk.
2. Campuran ditambahkan HCl 0,5 N sampai pH 2.
3. Campuran tersebut di panaskan diatas magnetic stirer pada kisaran suhu 60 – 70 oC selama 2 jam.
4. Campuran disaring dengan kain saring dan filtrat dibiarkan dingin sampai temperatur kamar.
5. Setelah itu ditambahkan alkohol 96 % dengan perbandingan 1 : 2 (v/v) dan dibiarkan selama 16 jam.
6. Campuran di saring dan didapatkan pektin basah.
18
8. Pektin kemudian dikeringkan dalam oven 40oC selama 24 jam, lalu di ayak 60 mesh.
3.3.3 Modifikasi Pektin
Prosedur modifikasi pektin diambil dari Wong, dkk. [12] dengan prosedur sebagai berikut:
1. Pektin dilarutkan dalam air suling sampai 1,5%.
2. pH ditingkatkan menjadi 10,0 dengan NaOH (3N) lalu diinkubasi pada 50 – 60oC selama 1 jam.
3. Lalu didinginkan hingga temperatur kamar.
4. pH disesuaikan menjadi 3 dengan 3N HCl dan disimpan semalaman.
5. Sampel diendapkan dengan 95% etanol dan diinkubasi dengan es batu selama 2 jam
6. Lalu disaring dan dicuci dengan aseton.
7. Dikeringkan pada oven vakum pada 25oC selama 8 jam. 8. Lalu diayak untuk mendapatkan ukuran 60 dan 100 mesh. 9. Selanjutnya ini diberi nama pektin dengan modifikasi.
3.3.4 Penentuan Waktu Optimum
Prosedur penentuan jumlah logam Pb(II) yang terjerap dalam biosorben dengan variasi waktu pengadukan dilakukan dengan mengadopsi prosedur yang dilakukan oleh Sunarya [20] yaitu:
1. 1 gr biosorben dimasukkan dalam 50 ml larutan tunggal Pb(II) dengan konsentrasi 15 ppm.
2. Campuran diaduk dengan magnetic stirrer 200 rpm selama selang waktu tertentu (30, 60, 90, dan 120 menit).
3. Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm. 4. Efisiensi Pb(II) yang terjerap oleh setiap gram sampel dapat dihitung dengan
rumus sebagai berikut:
19 Keterangan :
% Efisiensi = Efisiensi logam Pb(II) yang terjerap (%) C1 = konsentrasi larutan Pb(II) awal (ppm) C2 = konsentrasi larutan Pb(II) akhir (ppm)
3.3.5Pengaruh Bobot Biosorben
Prosedur penentuan jumlah logam Pb(II) yang terjerap dalam biosorben dengan variasi bobot biosorben dilakukan dengan mengadopsi prosedur yang dilakukan oleh Sunarya [20] yaitu:
1. Sejumlah massa (0,25; 0,50; 0,75 dan 1 gr) biosorben dimasukkan dalam 50 ml tunggal Pb(II) dengan konsentrasi 15 ppm.
2. Campuran diaduk dengan magnetic stirrer 200 rpm selama waktu optimum. 3. Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm. 4. Efisiensi Pb(II) yang terjerap oleh setiap gram sampel dapat dihitung dengan
rumus sebagai berikut:
% 100 x C C C Efisiensi % 1 2 1 (3.2) Keterangan :
% Efisiensi = Efisiensi logam Pb(II) yang terjerap (%) C1 = konsentrasi larutan Pb(II) awal (ppm) C2 = konsentrasi larutan Pb(II) akhir (ppm)
3.3.6 Pengaruh Ukuran Partikel Biosorben
Prosedur penentuan jumlah logam Pb(II) yang terjerap dalam biosorben dengan variasi ukuran partikel biosorben dilakukan dengan mengadopsi prosedur yang dilakukan oleh Sunarya [20] yaitu:
1. 1 gr biosorben dengan ukuran partikel yang berbeda (60 dan 100 mesh) masing-masing dimasukkan dalam 50 ml tunggal Pb(II) dengan konsentrasi 15 ppm.
20
4. Efisiensi Pb(II) yang terjerap oleh setiap gram sampel dapat dihitung dengan rumus sebagai berikut:
% 100 x C C C Efisiensi % 1 2 1 (3.3) Keterangan :
% Efisiensi = Efisiensi logam Pb(II) yang terjerap (%) C1 = konsentrasi larutan Pb(II) awal (ppm) C2 = konsentrasi larutan Pb(II) akhir (ppm)
3.3.7 Analisa Isoterm Adsorpsi Freundlich dan Langmuir
Analisa isoterm adsorpsi dilakukan dengan menggunakan persamaan-persamaan yang berlaku pada isoterm adsorpsi Freundlich dan Langmuir. Analisa dilakukan dengan menvariasikan konsentrasi yaitu 15, 18, 21, 24, dan 27 ppm dan diuji dengan AAS pada panjang gelombang 283,3 nm.
3.3.8 Analisa FTIR (Fourier Transform Infra Red)
Analisa FTIR dilakukan untuk mengetahui gugus fungsi yang terdapat pada pektin modifikasi dan dilakukan perbandingan dengan pektin non-modifikasi.
3.3.9 Penentuan Derajat Esterifikasi Pektin
Prosedur derajat esterifikasi pektin dilakukan dengan mengadopsi prosedur yang dilakukan oleh Liew, dkk. [18] yaitu:
1. 0,2 gram pektin kering di basahi dengan etanol dan dilarutkan dengan aquades dan diaduk sampai larut sepenuhnya.
2. Lalu campuran ditambahkan 3 tetes phenoftalein dan dititrasi dengan NaOH 0,1 N. Hasil titrasi dicatat dan di sebut dengan initial titration.
3. Lalu sampel ditambahkan 10 ml 0,1 N NaOH untuk menetralkan polygalacturonic acid dan sampel sampel dikocok kuat, setelah itu didiamkan
sselama 2 jam pada temperatur kamar untuk de-esterify.
21
5. Lalu sampel ditambahkan 3 tetes phenoftalein lagi dan dititrasi dengan NaOH 0,1 N dicatat volume yang digunakan dan disebut dengan final titration.
6. Berat jenis (densitas) adsorben dapat dihitung dengan rumus:
DE = (3.4)
Keterangan :
DE = Derajat Esterifikasi (%) Final Titration = jumlah NaOH yang digunakan pada titrasi terakhir (ml)
22
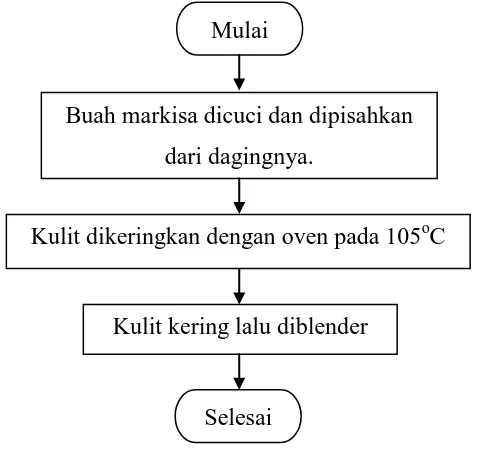
3.4 FLOWCHART PENELITIAN 3.4.1 Persiapan Analisis dan Kimia
Gambar 3.1 menunjukkan flowchart persiapan analisis dan kimia kulit markisa.
Gambar 3.1 Flowchart Persiapan Analisis dan Kimia
Mulai
Buah markisa dicuci dan dipisahkan dari dagingnya.
Kulit dikeringkan dengan oven pada 105oC
Kulit kering lalu diblender
[image:32.595.206.445.167.397.2]23
[image:33.595.136.485.97.649.2]3.4.2 Flowchart Ekstraksi Pektin
Gambar 3.2 menunjukkan flowchart ekstraksi pektin.
Gambar 3.2 Flowchart Ekstraksi Pektin
Mulai
Sejumlah massa kering ditambah air dengan perbandingan 1 : 15 (w/v)
pH dijadikan 2 dengan penambahan HCl 0,5 N
Dipanaskan sampai suhu 60 – 70oC sambil diaduk selama 2 jam
Disaring dengan kain saring
Filtrat dibiarkan dingin sampai temperatur kamar
Campuran di saring dan dicuci dengan alkohol asam
Dicuci dengan etanol 70% sampai pH netral
Dicuci dengan etanol 96%
Dikeringkan menggunakan oven pada suhu 40oC selama 24 jam
Diblender dan diayak 60 mesh
Selesai
Filtrat ditambahkan alkohol 96 % dengan perbandingan 1 : 2 (v/v) dan dibiarkan
24
[image:34.595.171.456.105.734.2]3.4.3 Flowchart Modifikasi Pektin
Gambar 3.3 menunjukkan flowchart modifikasi pektin.
Gambar 3.3 Flowchart Modifikasi Pektin
Mulai
Pektin dilarutkan dalam aquadest sampai 1,5%
pH ditingkatkan menjadi 10,0 dengan NaOH 3N
Diinkubasi pada 50 – 60oC selama 1 jam
Didinginkan hingga temperatur kamar
pH disesuaikan menjadi 3 dengan HCl 3N
Disimpan semalaman
Sampel diendapkan dengan 95% etanol
Diinkubasi pada 20oC selama 2 jam
Endapan disaring dan dicuci dengan aseton
Dikeringkan pada oven vakum pada 25oC selama 8 jam
Diayak 60 mesh
25
3.4.4 Flowchart Penentuan Waktu Optimum
Gambar 3.4 menunjukkan flowchart penentuan waktu optimum dengan variasi waktu pengadukan 30, 60, 90, dan 120 menit.
Gambar 3.4 Flowchart Penentuan Waktu Optimum
Mulai
1 gr biosorben dimasukkan ke dalam erlenmeyer
Ditambahkan 50 ml larutan kerja Pb(II) dengan konsentrasi 15 ppm
Diaduk dengan magnetic stirrer 200 rpm selama selang waktu 30,
60, 90, dan 120 menit
Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm
[image:35.595.139.508.120.430.2]26
3.4.5 Flowchart Pengaruh Bobot Biosorben
Gambar 3.5 menunjukkan flowchart pengaruh bobot biosorben dengan variasi bobot 0,25; 0,50; 0,75; dan 1 gr.
Gambar 3.5 Flowchart Pengaruh Bobot Biosorben
Mulai
0,25; 0,50; 0,75 dan 1 gr biosorben dimasukkan
masing-masing ke dalam erlenmeyer
Ditambahkan 50 ml larutan kerja Pb(II) dengan konsentrasi 15 ppm Diaduk dengan magnetic stirrer 200 rpm selama waktu optimum
Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm
[image:36.595.133.496.137.405.2]27
3.4.6 Flowchart Pengaruh Ukuran Partikel Biosorben
[image:37.595.139.512.146.445.2]Gambar 3.6 menunjukkan flowchart pengaruh ukuran partikel biosorben dengan variasi ukuran 60 dan 100 mesh.
Gambar 3.6 Flowchart Pengaruh Ukuran Partikel Biosorben
Mulai
Ditambahkan 50 ml larutan kerja Pb(II) dengan konsentrasi 15 ppm
Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm
Selesai
Diaduk dengan magnetic stirrer 200 rpm selama selang waktu optimum 1 gr biosorben dengan ukuran
yang berbeda (60 dan 100 mesh) masing-masing dimasukkan ke
28
3.4.7 Flowchart Analisa Isoterm Langmuir dan Freundlich
Gambar 3.7 menunjukkan flowchart analisa isoterm Langmuir dan Freundlich dengan variasi konsentrasi logam 15, 18, 21, 24, dan 27 ppm.
Gambar 3.7 Flowchart Analisa Isoterm Langmuir dan Freundlich
Mulai
1 gr biosorben dimasukkan ke dalam erlenmeyer
Disaring dan dianalisa dengan AAS pada panjang gelombang 283,3 nm
Selesai
Ditambahkan 50 ml larutan kerja Pb(II) dengan konsentrasi masing-masing 15, 18, 21, 24 dan 27 ppm
[image:38.595.131.514.108.414.2]29
[image:39.595.156.468.119.697.2]3.4.8 Flowchart Penentuan Derajat Esterifikasi Pektin
Gambar 3.8 menunjukkan flowchart penentuan derajat esterifikasi pektin.
Gambar 3.8 Flowchart Penentuan Derajat Esterifikasi Pektin
Mulai
0,2 gram pektin di basahi dengan etanol dan dilarutkan dengan
aquades
Campuran ditambahkan 3 tetes phenoftalein dan dititrasi dengan
NaOH 0,1 N
Hasil titrasi dicatat dan disebut Initial Titration
Sampel ditambahkan 10 ml NaOH 0,1 N
Sampel Dikocok kuat dan didiamkan 2 jam pada temperatur kamar
Selesai
Sampel ditambahkan 10 ml HCl 0,1 N dan dikocok sampe bening
Campuran ditambahkan 3 tetes phenoftalein dan dititrasi dengan
NaOH 0,1 N
30
BAB IV
HASIL DAN PEMBAHASAN
4.1 EKSTRAKSI PEKTIN
Albido dari kulit buah markisa dikeringkan dengan oven pada suhu 105oC lalu diblender sampai halus. Tepung kulit markisa ini ditambahkan air dengan perbandingan 1 : 15 (w/v), kemudian pH larutan diatur menjadi 2 dengan HCl 0,5 N. Ekstraksi dilakukan untuk mengambil kandungan pektin yang terdapat di dalam kulit, yang dilakukan pada suhu 60 – 70oC selama 2 jam. Hasil ekstraksi pektin kemudian disaring untuk diambil filtratnya. Filtrat kemudian didinginkan hingga suhu kamar. Pengendapan pektin dilakukan dengan menambahkan alkohol 96% dengan perbandingan 1 : 2 (v/v) lalu didiamkan selama 16 jam. Hasil pengendapan disaring untuk diambil gelnya. Kemudian gel pektin dicuci pertama dengan alkohol asam yang dibuat dengan cara 960 ml alkohol 96% ditambah HCl 4N sampai volumenya 1000 ml, lalu pencucian kedua dilakukan dengan alkohol 70% dan terakhir dengan alkohol 96%. Pektin kemudian dikeringkan dengan oven pada suhu 40oC selama 24 jam dan diayak 60 mesh.
[image:40.595.231.395.495.716.2]Gambar 4.1 menunjukkan hasil yang diperoleh dari ekstraksi pektin dari kulit buah markisa.
31
Dari gambar diatas dapat dilihat bahwa hasil ekstraksi pektin diperoleh gel berwarna kuning keputihan. Sedangkan hasil pengeringan diperoleh pektin kering sebanyak 1,5 – 2,5 gr. Menurut Akhmalludin dan Arie [37], pencucian pektin dengan alkohol tidak mempengaruhi banyaknya pektin yang dihasilkan, namun pektin yang dihasilkan memberikan warna yang lebih baik yaitu kuning keputihan.
4.2 MODIFIKASI PEKTIN
[image:41.595.221.403.432.676.2]Pektin kering yang diperoleh dari hasil ekstraksi lalu dimodifikasi yang berguna untuk meningkatkan kemampuan pektin dalam menyerap logam. Modifikasi pektin dilakukan dengan menggunakan modifikasi pH dan temperatur. pH pektin ditingkatkan menjadi basa hingga pH 10 dengan menggunakan NaOH, didinginkan hingga temperatur kamar dan diasamkan kembali dengan menggunakan HCl hingga pH 3. Hasil modifikasi ini nantinya diharapkan akan menghasilkan pektin dengan kadar metoksil yang lebih rendah.
Gambar 4.2 menunjukkan hasil yang diperoleh dari modifikasi pektin kulit buah markisa.
32
Hasil pektin yang diperoleh dari modifikasi adalah pektin berwarna coklat dan tidak terbentuk gel. Dapat dilihat perbedaan hasil banyak gel pektin yang diperoleh dari pektin non modifikasi dan pektin modifikasi. Pektin modifikasi memiliki gel yang lebih sedikit bahkan hampir tidak terlihat sama sekali dibandingkan dengan pektin non modifikasi. Pektin dengan kandungan metoksil rendah adalah pektin dengan derajat esterifikasi kurang dari 50%. Kekuatan pembentukan gel suatu senyawa akan lebih tinggi bila residu asam galakturonatnya dalam molekul juga besar, atau dengan kata lain pektin dengan kadar metoksil yang tinggi akan menghasilkan gel yang lebih banyak dibandingkan dengan pektin metoksil rendah [54]. Hal ini diperkuat oleh Kurniasari, dkk. [8] bahwa semakin rendah kadar metoksil pektin maka sifat pembentukan jellinya akan semakin berkurang.
Pektin bekerja pada pH 2 – 5 untuk menyerap logam. Jika pH lebih dari 5, maka banyaknya jumlah ion logam yang diserap akan menurun [55]. Modifikasi pektin dengan menggunakan alkali dan asam pernah diteliti oleh Annadurai, dkk. [56] dengan menggunakan HNO3 dan NaOH untuk menyerap logam Pb2+. Hasilnya menunjukkan bahwa perlakukan asam menunjukkan kapasitas adsorpsi yang lebih baik jika diikuti dengan perlakuan alkali dan air diawal treatment. Oleh karena itu modifikasi pektin dilakukan dengan perlakuan asam menggunakan HCl yang diikuti dengan perlakuan alkali diawal treatment. pH akhir pektin adalah 3 karena pektin bekerja pada pH asam yakni 2 – 5.
4.3 PENENTUAN WAKTU OPTIMUM
Biosorben pektin dari kulit buah markisa digunakan untuk mengadsorpsi larutan tunggal Pb(II). Konsentrasi larutan tunggal yang digunakan adalah 15 ppm sebanyak 50 ml dan ukuran partikel biosorben adalah 60 mesh sebanyak 1 gr. Sedangkan variasi waktu pengadukan yang digunakan untuk menentukan waktu optimum adalah 30, 60, 90, dan 120 menit.
33
tidak lagi mampu menyerap ion logam Pb2+ [57].Pada saat persentase penyerapan logam mencapai nilai optimum, maka lama proses biosorpsi tersebut diambil sebagai waktu optimum biosorpsi.
[image:43.595.133.475.195.386.2]Gambar 4.3 menunjukkan grafik pengaruh waktu biosorpsi terhadap persentase penyerapan ion logam Pb2+.
Gambar 4.3 Pengaruh Waktu Optimum Biosorpsi Terhadap Persentase Penyerapan Pb(II)
Dari gambar 4.3 dapat dilihat bahwa untuk pektin modifikasi selama selang waktu 30, 60, dan 90 menit terjadi peningkatan persentase penyerapan. Hal ini disebabkan oleh karena masih banyak gugus dari biosorben yang belum berinteraksi secara optimum dengan biosorbat. Pada menit ke 90 persentase penyerapan diperoleh sebesar 99,92%. Selanjutnya terjadi penurunan pada waktu 120 menit yang menunjukkan bahwa biosorben sudah mengalami titik kejenuhan. Hal ini menunjukkan bahwa pada waktu 90 menit telah terjadi kondisi kesetimbangan antara ion logam yang terlepas dan terikat kembali [57].
34
4.4 PENGARUH BOBOT BIOSORBEN
Biosorben pektin dari kulit buah markisa digunakan untuk mengadsorpsi larutan tunggal Pb(II). Konsentrasi larutan tunggal yang digunakan adalah 15 ppm sebanyak 50 ml, ukuran partikel biosorben adalah 60 mesh, dan waktu pengadukan diambil dari waktu optimum yakni 90 menit. Sedangkan variasi bobot biosorben yang digunakan adalah 0,25;0,50;0,75; dan 1 gr
[image:44.595.134.479.255.453.2]Gambar 4.4 menunjukkan grafik pengaruh bobot biosorben terhadap persentase penyerapan ion logam Pb2+.
Gambar 4.4 Pengaruh Bobot Biosorben Terhadap Persentase Penyerapan Pb(II)
Dari gambar 4.4 dapat dilihat bahwa semakin besar bobot biosorben maka persentase penyerapannya akan semakin besar.
35
4.5 PENGARUH UKURAN BIOSORBEN
Biosorben pektin dari kulit buah markisa digunakan untuk mengadsorpsi larutan tunggal Pb(II). Konsentrasi larutan tunggal yang digunakan adalah 15 ppm sebanyak 50 ml, dan waktu pengadukan diambil dari waktu optimum yakni 90 menit. Ukuran partikel yang digunakan 60 mesh dan 100 mesh, dimana ukuran 60 mesh adalah hasil ayakan yang lolos pada ukuran 60 mesh tetapi tertahan pada ukuran 80 mesh dan ukuran 100 mesh merupakan hasil ayakan yang lolos pada ukuran 100 mesh tetapi tertahan pada ayakan 140 mesh.
[image:45.595.132.482.298.494.2]Gambar 4.5 menunjukkan grafik pengaruh ukuran biosorben terhadap persentase penyerapan ion logam Pb2+.
Gambar 4.5 Pengaruh Ukuran Biosorben Terhadap Persentase Penyerapan Pb(II)
36
4.6 ANALISA ISOTERM ADSORPSI
Kelayakan dan efisiensi suatu proses biosorpsi tidak hanya bergantung pada sifat biosorben, tetapi juga pada konsentrasi larutan ion logam [60]. Setiap adsorben yang menyerap suatu zat satu dengan zat lain mempunyai pola isoterm adsorpsi yang berbeda. Hal ini dikarenakan terdapat faktor-faktor yang mempengaruhi dalam proses adsorpsi antara lain yaitu jenis adsorben, jenis zat yang diserap, luas permukaan adsorben, konsentrasi zat yang diadsorpsi dan suhu. [61].
[image:46.595.130.483.380.581.2]Data kesetimbangan biasanya digambarkan dalam bentuk kurva isoterm adsorpsi. Pendekatan dengan model terhadap kurva isoterm dapat membantu menganalisis karakteristik isoterm berupa kapasitas, afinitas, selektifitas serta mekanisme interaksi adsorpsi [62].
Gambar 4.6 menunjukkan grafik pola isoterm adsorpsi terhadap logam ion Pb.
Gambar 4.6 Pola Isoterm Adsorpsi Pektin Kulit Buah Markisa Terhadap Ion Logam Pb2+
37
berdasarkan asumsi bahwa ada permukaan heterogen dengan beberapa tipe pusat adsorpsi yang aktif. Model ini sering digunakan untuk menggambarkan adsorpsi senyawa organik dan inorganik dalam larutan. [63].
Model kinetika Langmuir dapat ditunjukkan sebagai berikut [53]: = ( ) Ce +
dimana:
Ce = konsentrasi adsorbat pada kesetimbangan pada fasa cair (mg/L) qe = konsentrasi adsorbat pada fasa padat/adsorben (mg/s)
1/qm = kemiringan atau sensitifitas qm = kapasitas adsorpsi optimum (mg/g) 1/(bqm) = intersep
bqm = konstanta kesetimbangan
Model kinetika Freundlich dapat ditunjukkan sebagai berikut [50]:
dimana:
Ce = konsentrasi adsorbat pada kesetimbangan pada fasa cair (mg/L) qe = konsentrasi adsorbat pada fasa padat/adsorben (mg/s)
38
[image:48.595.132.482.155.339.2]Gambar 4.7 menunjukkan kurva isoterm Langmuir pektin kulit buah markisa terhadap ion logam Pb2+.
Gambar 4.7 Kurva Isoterm Langmuir Pektin Kulit Buah Markisa Terhadap Ion Logam Pb2+
39
Gambar 4.8 menunjukkan kurva isoterm Freundlich pektin kulit buah markisa terhadap ion logam Pb2+.
Gambar 4.8 Kurva Isoterm Freundlich Pektin Kulit Buah Markisa Terhadap Ion Logam Pb2+
Dari gambar 4.8 dapat dilihat bahwa persamaan Freundich yang diperoleh adalah y = 0,1472 x + 0,1393. Dari persamaan ini diperoleh nilai k (konstanta adsorben) sebesar 1,3782 dan n (konstanta adsorben) sebesar 7,0077. Nilai R2 diperoleh sebesar 0,8243.
Berdasarkan nilai R2 yang diperoleh menunjukkan bahwa model isoterm Langmuir yang paling sesuai untuk biosorpsi logam ion Pb oleh pektin yang dari kulit buah markisa. Langmuir mengindikasikan proses biosorpsi ion logam memiliki cakupan lapis tunggal (monolayer) pada pektin. Dengan kata lain, biosorpsi ion logam Pb(II) pada pektin terjadi pada gugus fungsi pada permukaan pektin yang dianggap sebagai adsorpsi lapis tunggal.
4.7 ANALISA FTIR
[image:49.595.132.486.130.328.2]40
Gugus fungsional utama pada pektin biasanya terletak pada area bilangan gelombang 1000 – 2000 cm-1 [64]. Ikatan karboksil berada pada 1630 – 1650 cm-1 untuk kelompok karboksil bebas [65] dan 1730 – 1760 cm-1 untuk kelompok karboksil teresterifikasi [66].
Gambar 4.9 menunjukkan hasil spektrum FTIR untuk pektin non-modifikasi.
1141,86 cm-1 Gugus C-O eter 2877,79 cm-1 Gugus C-H (Aldehid) 1431,18 cm-1 Gugus NO2 2997,38 cm-1 Gugus O-H (Asam
Karboksilat) 1631,78 cm-1 Gugus keton amida 3398,57 cm-1 Gugus N-H 1732,08 cm-1 Gugus Ester (C=O)
[image:50.595.111.500.215.544.2]41
Gambar 4.10 menunjukkan hasil spektrum FTIR untuk pektin modifikasi.
1141,86 cm-1 Gugus C-O eter 1747,51 cm-1 Gugus Ester (C=O) 1219,01 cm-1 Gugus C-N (Amina
Alifatik)
2881,65 cm-1 Gugus C-H (Aldehid)
1431,18 cm-1 Gugus NO2 2997,38 cm-1 Gugus O-H (Asam Karboksilat)
1496,76 cm-1 Gugus Arene 3417,86 cm-1 Gugus N-H 1631,78 cm-1 Gugus Keton Amida
Gambar 4.10 Hasil Spektrum FTIR untuk Pektin Modifikasi
Dalam proses penyerapan logam oleh pektin, salah satu gugus yang berpengaruh adalah gugus karboksil. Kandungan gugus inilah yang merupakan kunci utama didalam pengikatan logam berat oleh pektin [68]. Pada hasil uji gugus pektin dapat dilihat bahwa panjang gelombang grup karboksil pada pektin adalah 1732,08 cm-1 untuk pektin non-modifikasi dan 1747,51 cm-1 pada pektin modifikasi. Sehingga dapat disimpulkan bahwa pektin non-modifikasi dan pektin modifikasi mampu menyerap logam karena keduanya mengandung gugus karboksil.
42
penyerapan logam Pb. Dari hasil penelitian menunjukkan bahwa pektin jenis HMP dan LMP mengandung gugus grup karboksil dengan panjang gelombang 1627,06 cm-1 untuk HMP dan 1624,19 cm-1 untuk LMP. Pada penelitian tersebut disimpulkan bahwa pengikatan logam berat Pb oleh pektin jenis HMP dan LMP dipengaruhi oleh adanya gugus karboksil pada pektin.
Pada gambar 4.9 dan 4.10 menunjukkan bahwa proses modifikasi mengubah struktur kerangka dari biosorben pektin, yang ditandai dengan adanya perubahan di sudut fraksi pada keduanya dan juga peningkatan nilai persen transmitansi cahaya infrared, dimana persen transmitansi pada pektin non-modifikasi lebih kecil daripada pektin non-modifikasi. Menurut Sherman [67], nilai absorbansi berbanding terbalik dengan transmitansi. Sehingga jika transmitansi besar, maka nilai absorbansinya kecil. Dari pernyataan tersebut dapat disimpulkan bahwa nilai absorbansi pektin modifikasi lebih kecil daripada pektin non-modifikasi.
4.8 ANALISA PENENTUAN DERAJAT ESTERIFIKASI PEKTIN MODIFIKASI DAN NON-MODIFIKASI
Pada penelitian ini derajat esterifikasi pektin dilakukan untuk melihat penurunan derajat esterifikasi pektin markisa setelah dimodifikasi. Sebanyak 0,2 gram pektin kering di basahi dengan etanol dan dilarutkan dengan aquades dan diaduk sampai larut sepenuhnya. Lalu campuran ditambahkan 3 tetes phenoftalein dan dititrasi dengan NaOH 0,1 N. Hasil titrasi dicatat dan di sebut dengan initial titration. Initial titration menunjukkan jumlah group korboksil bebas. Lalu sampel
ditambahkan 10 ml 0,1 N NaOH untuk menetralkan polygalacturonic acid dan sampel sampel dikocok kuat, setelah itu didiamkan sselama 2 jam pada temperatur kamar untuk de-esterify pectin. Setelah itu sampel ditambahkan HCl 0,1 N untuk menetralkan natrium hidroksida dan di kocok sampai warna pink sampel hilang. Lalu sampel ditambahkan 3 tetes phenoftalein lagi dan dititrasi dengan NaOH 0,1 N. Dicatat volume NaOH yang digunakan dan di sebut final titration. Final titration menunjukkan jumlah group karboksil teresterifikasi.
43
Tabel 4.1 Tabel Hasil Perhitungan Derajat Esterifikasi Pektin Non-Modifikasi Dan Pektin Modifikasi
Jenis Pektin
Initial Titration
(ml)
Final Titration
(ml)
Derajat Esterifikasi (%)
Pektin Markisa Non Modif 2,5 2,8 52,83
Pektin Markisa Modif 4,1 3,6 46,75
Tabel 4.1 menunjukkan data hasil penentuan derajat esterifikasi pektin non-modifikasi dan non-modifikasi, dimana diperoleh melalui hasil perhitungan dengan menggunakan rumus :
DE = (4.1)
Keterangan:
DE = Degree of Esterification (%)
Final Titration = jumlah NaOH yang digunakan pada titrasi terakhir (ml)
Initial Titration = jumlah NaOH yang digunakan pada titrasi awal (ml)
44
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian ini adalah:
1. Pada pektin tanpa modifikasi waktu optimal adalah 120 menit, bobot 1 gram dan ukuran partikel 60 mesh dengan efisiensi penyerapan logam Pb(II) 99,52%. Sedangkan pektin modifikasi waktu optimal adalah 90 menit, bobot 1 gram dan ukuran partikel 100 mesh dengan efisiensi penyerapan logam Pb(II) 100%.
2. Modifikasi pektin menambah panjang gelombang gugus grup karboksil yang merupakan kunci utama yang berpengaruh didalam pengikatan logam berat oleh pektin.
3. Dari hasil penentuan derajat esterifikasi pektin diketahui terjadinya penurunan derajat esterifikasi dari jenis HMP (High Metoksil Pektin DE>50) ke jenis LMP (Low Metoksil Pektin DE<50).
5.2` SARAN
Setelah dilakukan penelitian ini maka telah diketahui kemampuan penyerapan pektin dari kulit markisa kuning terhadap logam Pb(II). Namun perlu dilakukan beberapa penelitian lebih lanjut terhadap pektin untuk penyerapan logam Pb(II). Ada beberapa hal yang perlu dilakukan penelitian lanjutan seperti: 1. Perlu dilakukan variasi waktu pemanasan pada proses ekstraksi pektin untuk
melihat pengaruh lamanya waktu ekstraksi terhadap banyaknya jumlah pektin yang diperoleh.
2. Perlu dilakukan pencirian lebih lanjut biosorben pektin dari kulit markisa dengan SEM (Scanning Electron Microscopy) serta penentuan nilai entalpi dan energi aktivasi untuk mengetahui mekanisme biosorpsi yang terjadi. 3. Perlu dilakukan aplikasi langsung terhadap limbah cair industri dikarenakan
5
BAB II
TINJAUAN PUSTAKA
2.1 MARKISA KUNING (Passiflora edulis flavicarpa)
Markisa kuning merupakan salah satu kelompok markisa asam tergolong dalam famili Passifloraceae atau disebut buah Rola (Yellow Passion Fruit). Markisa kuning dapat dibudidayakan di daerah dataran rendah hingga pada ketinggian 600 m dpl., curah hujan antara 2.000 – 3.000 mm/tahun, dan suhu 22 – 32oC Berikut adalah ciri-ciri markisa kuning:
1. Merupakan tanaman herba atau berkayu, dan memiliki sulur.
2. Ruas batang lebih panjang dari pada markisa ungu 7-10 cm dengan sulur muda berwarna kecoklatan.
3. Bentuk daun menjari dengan ukuran daun lebih besar dan lebih tebal daripada markisa ungu, panjang daun 10 – 13 cm, dan lebar 9 – 12 cm, daun muda berwarna hijau, sedangkan tangkai berwarna hijau kecoklatan.
4. Ukuran bunga besar dengan mahkota tambahan berbentuk benang dan memencar berwarna ungu dengan ujung putih.
5. Buah muda berwarna hijau, sedangkan buah masak berwarna kuning muda dengan kulit yang tebal dan agak keras. Buah berbentuk bulat agak lonjong atau oval dengan sari buah berwarna kuning, rasanya asam manis dengan aroma seperti jambu biji [21].
6
Gambar 2.1 Buah Markisa [23]
Klasifikasi markisa kuning menurut Rukmana [23] adalah sebagai berikut: Kingdom : Plantae
Divisi : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotyledonae Ordo : Passiflorae Famili : Passifloraceae Genus : Passiflora
Spesies : Passiflora edulis var. flavicarpa
Dalam proses pengolahan markisa untuk menghasilkan sari buah markisa, juga dihasilkan limbah. Makin meningkatnya produksi pengolahan markisa berarti akan meningkat pula limbah yang dihasilkan. Bila dikaitkan dengan produksi markisa Indonesia pada tahun 2010 dan 51% dari buah markisa terdiri dari kulit, maka terdapat limbah kulit markisa sebanyak 67.314 ton yang belum dimanfaatkan. Padahal kulit markisa mengandung pektin yang tinggi yaitu sebesar 14% [24].
2.2 PEKTIN
7 O H OH H OH COOH H O H OH H OH COOCH3 H O O O H OH H OH COOCH3 H O O H OH H OH COOH H O O
Gambar 2.2 Rantai Molekul Pektin [10]
Pektin pertama kali diisolasi tahun 1825 oleh Heneri Bracannot. Kegunaan utamanya adalah sebagai gelling agent dan stabilizer pada berbagai industri pangan [28]. Selain dibidang pangan, pektin juga banyak digunakan pada bidang farmasi dan kedokteran misalnya sebagai penggumpal pada terapi darah [29].
Senyawa penyusun pektin yaitu:
1. Asam pektat, adalah pektin yang tidak mengandung gugus metil ester. Senyawa ini biasanya terdapat pada sayuran dan buah yang busuk atau yang terlalu matang.
2. Asam pektina (pektin), adalah asam poligalakturonat, yaitu asam yang mengandung gugus metil ester, dapat terikat dengan air membentuk jelly dan gula dalam suasana asam.
3. Protopektin, adalah komponen yang tidak larut dalam air, dapat dihirolisa dan terdispersi menjadi pektin dan pektinat [30].
Hasil ekstraksi pektin adalah berbentuk bubuk berwarna putih hingga coklat terang. Pada proses ekstraksi, sebagian gugus karboksil pada polimer pektin akan mengalami metilasi menjadi gugus metoksil. Senyawa hasil ekstraksi inilah yang disebut dengan asam pektinat (pektin). Nilai derajat metilasi menentukan suhu pembentukan gel, yakni semakin tinggi derajat metilasi maka suhu pembentukan gelnya juga akan semakin tinggi [31].
8
[image:58.595.112.518.166.446.2]Tabel 2.1 menunjukkan standar mutu pektin berdasarkan standar mutu International Pectin Producers Association.
Tabel 2.1 Standar Mutu Pektin Berdasarkan Standar Mutu Internasional Pectin Producers Association [33]
Faktor Mutu Kandungan
Kekuatan gel, grade min 150
Kandungan metoksil:
Pektin metoksil tinggi, % Pektin metoksil rendah, %
>7,12 2,5 – 7,12
Kadar asam galakturonat, % min 35
Kadar air, % maks 12
Kadar abu, % maks 10
Derajat esterifikasi untuk:
Pektin ester tinggi, % min Pektin ester rendah, % maks
50 50
Bilangan asetil, % 0,15 – 0,45
Berat ekivalen 600 - 800
2.3 EKSTRAKSI PEKTIN
Ekstraksi merupakan suatu proses pemisahan satu atau beberapa bahan dari satu padatan atau cairan, dengan menggunakan bahan pelarut pada suhu tertentu. Pada proses ekstraksi pektin, bahan baku dipanaskan dalam larutan asam encer untuk menghidrolisa protopektin yang tidak larut menjadi pektin yang larut [34].
Kondisi ekstraksi pektin berpengaruh terhadap karakteristik pectin, dan sifat fisik pektin tergantung dari karakteristik kimia pektin. Jika waktu ekstraksi pektin terlalu lama maka akan menyebabkan terjadinya hidrolisis pektin menjadi asam galakturonat. Pada kondisi asam, ikatan glikosidik gugus metil ester dari pektin cenderung terhidrolisis menghasilkan asam galakturonat [35] [36].
9
suhu selama proses ekstraksi. Sedangkan untuk proses pencucian pektin, pencucian dengan alkohol tidak mempengaruhi banyaknya jumlah pektin yang diperoleh, namun akan memberikan warna yang lebih baik yaitu putih kekuningan [37].
Pektin yang lebih mudah larut dalam air dapat diperoleh dengan memodifikasi pH dan suhu pada metode ekstraksi. Pektin yang diperoleh dengan cara ini memiliki rantai lebih pendek dan tidak bercabang sehingga akan lebih mudah larut dibandingkan pektin yang memiliki rantai yang lebih panjang [12].
2.4 BIOSORPSI
Proses penyerapan yang menggunakan material biologi (biomaterial) sebagai sorben disebut biosorpsi. Biosorpsi didefenisikan sebagai proses penggunaan bahan alami untuk mengikat logam berat [38]. Proses ini terjadi ketika ion logam berat mengikat dinding sel dengan dua cara yang berbeda, pertama pertukaran ion dimana ion monovalent dan divalent seperti Na, Mg, dan Ca pada dinding sel digantikan oleh ion-ion logam berat; dan kedua adalah pembentukan kompleks antara ion-ion logam berat dengan fungsional grup seperti karbonilm amini, thiol, hidroksi, posfat, dan hidroksi-karboksil yang berada pada dinding sel [39].
Proses biosorpsi logam berat dengan adsorben hayati merupakan proses yang kompleks dan mekanismenya bisa bervariasi tergantung bahan baku adsorbennya. Bila bahan baku biosorpsi adalah dari limbah pertanian, maka mekanisme yang mungkin adalah yang tidak tergantung pada metabolisme sel. Mekanisme biosorpsi pada bahan-bahan ini umumnya didasarkan pada interaksi kimia fisika antara ion logam dengan gugus fungsional yang ada pada permukaan sel. [40].
Tahap perpindahan yang terjadi adalah:
1. Perpindahan ion logam dari bagian larutan ke film pembatas yang ada di sekitar dinding sel.
10
4. Fase penyerapan yang terdiri dari pengikatan, pengompleksan, dan pengendapan didalam membran biomaterial [41].
2.5 LOGAM BERAT
Logam berat merupakan komponen alami tanah yang tidak dapat didegradasi maupun dihancurkan. Logam berat menjadi berbahaya dikarenakan sistem bioakumulasi, yaitu adanya peningkatan konsentrasi unsur kimia didalam tubuh mahluk hidup [42]. Beberapa jenis logam berat yang sering menimbulkan pencemaran adalah mercuri (Hg), khrom (Cr), kadmium (Cd), timbal (Pb) dan arsen (As) [1].
Logam berat umumnya bersifat racun, walaupun ada beberapa diantaranya dibutuhkan oleh tubuh dalam jumlah yang sangat kecil. Logam berat mampu terdistribusi ke bagian tubuh manusia melalui udara, makanan, dan air yang terkontaminasi oleh logam berat. Kontaminasi logam berat dalam jangka waktu yang panjang dapat mencapai jumlah yang membahayakan kesehatan manusia [43].
2.5.1 Timbal (Pb)
Timbal sering juga disebut sebagai timah hitam atau plumbum yang disimbolkan dengan Pb. Timbal pada tabel periodik unsur kimia termasuk dalam kelompok logam golongan IV-A dengan nomor atom (NA) 82 dan berat atom (BA) 207,2. Timbal merupakan suatu logam berat berwarna kelabu kebiruan dengan titik leleh 327oC dan titik didih 1.725oC. Pada suhu 550 – 600oC timbal menguap dan membentuk oksigen dalam udara lalu membentuk timbal oksida. [44].
11
Timbal pernah diaplikasikan sebagai tambahan pada bahan bakar yang bertujuan untuk meningkatkan nilai oktan dari suatu bahan bakar karena harga timbal relatif lebih murah. Jenis timbal yang digunakan adalah TEL yang dipercaya mampu menjaga dudukan katup mobil dari keausan sehingga lebih awet dan tahan lama. Namun kemudian ditemukan fakta bahwa penggunaan timbal pada bahan bakar dapat menjadi racun sehingga semakin lama penggunaannya semakin berkurang [46].
Timbal menyebabkan racun pada sistem saraf, hemetologic, hemetotoxic, dan mempengaruhi kerja ginjal. Konsumsi mingguan elemen ini yang direkomendasikan oleh WHO toleransinya bagi orang dewasa adalah 50 μg/kg berat badan dan untuk bayi atau anak-anak 25 μg/kg berat badan. Depkes RI membatasi kandungan Pb maksimum dalam makanan adalah 4 ppm, dan FAO membatasi maksimum 2 ppm. Gejala keracunan kronis timbal ditandai dengan rasa mual, anemia, sakit di sekitar perut dan dapat menyebabkan kelumpuhan. [47].
2.6 ISOTERM ADSORPSI
Hubungan kesetimbangan antara potensial kimia adsorbat dalam gas atau cairan dan potensial kimia adsorbat di permukaan adsorben pada suhu tetap dikatakan sebagai isoterm adsorpsi. Kesetimbangan tercapai jika laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya [48].
2.6.1 Isoterm Freundlich
Isoterm Freundlich mengasumsikan suatu permukaan adsorpsi yang heterogen dan perbedaan energi pada tapak aktif [48]. Selain itu model isoterm ini juga mengasumsikan bahwa terdapat lebih dari satu lapisan permukaan (multilayer) [47].
Persamaan Freundlich adalah sebagai berikut [50]:
(2.1)
12 dimana:
Ce = konsentrasi adsorbat pada kesetimbangan pada fasa cair (mg/L) qe = konsentrasi adsorbat pada fasa padat/adsorben (mg/s)
k = konstanta kesetimbangan n = konstanta kesetimbangan
2.6.2 Isoterm Langmuir
Model Isoterm Langmuir menunjukkan bahwa kesetimbangan terjadi apabila kecepatan adsorpsi sama dengan kecepatan desorpsi [51]. Menurut Ribeiro, et al [52], isoterm Langmuir mengasumsikan bahwa setiap tapak adsorpsi adalah ekuivalen dan kemampuan partikel untuk terikat di tapak tersebut tidak bergantung pada ditempati atau tidak ditempatinya tempat yang berdekatan. Dengan kata lain, permukaan adsorpsi digambarkan homogen.
Model kinetika Langmuir dapat ditunjukkan sebagai berikut [53]:
= ( ) Ce + (2.3) dimana:
Ce = konsentrasi adsorbat pada kesetimbangan pada fasa cair (mg/L) qe = konsentrasi adsorbat pada fasa padat/adsorben (mg/s)
1/qm = kemiringan atau sensitifitas qm = kapasitas adsorpsi optimum (mg/g) 1/(bqm) = intersep
bqm = konstanta kesetimbangan
2.7 ANALISA EKONOMI
13
menangani limbah kulit buah markisa adalah dengan cara mengubahnya menjadi suatu produk yang lebih berharga dengan proses yang efektif dan efisien.
Salah satu cara untuk meningkatnya nilai yang tinggi pada limbah kulit buah markisa adalah dengan membuat biosorben dari kulit buah markisa. Biosorben ini nantinya dapat diaplikasikan guna penyerapan dan penurunan konsentrasi limbah logam berat cair.
Produksi biosorben dari limbah kulit buah markisa dilakukan dengan tahapan sebagai berikut:
1. Mengeringkan kulit buah markisa lalu memperkecil ukuran untuk mempermudah proses ekstraksi.
2. Penambahan aquadest dengan perbandingan 1 : 15 (w/v), lalu pH diubah menjadi 2 dengan penambahan HCl 0,5 N.
3. Ekstraksi dilakukan dengan memanaskan larutan pada suhu 60 – 70oC sambil diaduk selama 2 jam
4. Penyaringan filtrat dan pendinginan filtrat sampai suhu kamar
5. Pengendapan filtrat pektin dengan menggunakan alkohol 1 : 2 (v/v) selama 16 jam.
6. Penyaringan gel pektin.
7. Pencucian gel pektin dengan alkohol asam, etanol 70% sampai pH netral, dan terakhir dengan etanol 96%.
8. Pengeringan untuk memperoleh pektin kering.
Pada penelitian ini dilakukan pemodifikasian hasil pektin yang diperoleh guna meningkatkan kemampuan dalam penyerapan logam berat. Proses modifikasi dilakukan dengan cara sebagai berikut:
1. Pektin kering dilarutkan dalam aquadest sampai 1,5%.
2. pH pektin ditingkatkan menjadi 10 dengan NaOH 3N dan dilakukan inkubasi pada suhu 50 – 60oC selama 1 jam.
3. Larutan didinginkan hingga temperatur kamar, kemudian pH diturunkan menjadi 3 dengan 3N HCl dan disimpan semalaman.
4. Pengendapan pektin menggunakan etanol 95% dan diinkubasi dalam wadah berisi es batu selama 2 jam.
14
6. Pengeringan pektin untuk memperoleh pektin kering.
[image:64.595.109.525.189.369.2]Berikut merupakan rincian biaya pembuatan bisorben dari limbah kulit buah markisa yang telah dilakukan selama penelitian. Perhitungan analisis ekonomi dapat dilihat pada tabel 2.2 dan 2.3 dibawah ini
Tabel 2.2 Perhitungan Biaya Pembelian Bahan Baku No. Biaya bahan baku Harga
(Rp) Satuan Kebutuhan Biaya (Rp)
1. Kulit markisa kuning 0 1 kg 80 gr 0
2. Asam klorida 500.000 1 L 65 ml 32.500
3. Natrium hidroksida 481.000 1 kg 12 gr 5.772
4. Alkohol 96% 20.000 1 L 1160 ml 23.200
5. Aseton 100 1 ml 100 ml 10.000
6. Air biasa 0 1 L 1300 ml 0
Total Rp. 71.472
Tabel 2.3 Perhitungan Biaya Kebutuhan Listrik
No. Alat Harga/ kWh Kebutuhan
(kW) Waktu Biaya (Rp)
1. Blender Rp.1.352 0,18 5 menit 20,28
2. Hot plate Rp.1.352 0,50 3 jam 2.028
3. Oven Rp.1.352 1,40 4 jam 7.571
Total Rp. 9.619, 48
- Total biaya produksi = Biaya pembelian bahan baku + kebutuhan listrik + biaya transportasi + biaya lain-lain
= Rp. 71.472 + Rp. 9.619,48 + Rp. 30.000,00 + Rp. 9.000,00
= Rp 120.091,48
- Harga jual pektin modifikasi =
15
Berdasarkan proses yang dilakukan pada penelitian ini didapat pektin sebanyak 2 gram dengan biaya produksi Rp. 120.091,48. Sehingga dapat diestimasi harga jual pektin seharga Rp. 60.045,74 / gram.
Nilai ekonomi yang dimiliki pektin cukup tinggi. Indonesia masih mengimpor pektin dengan harga eceran tepung pektin berkisar antara Rp 200.000 – Rp 300.000/kg [36]. Jika dibandingkan harga penjualan pektin kulit markisa kuning modifikasi ini dengan harga jual jual karbon aktif di pasaran, harga jual pektin dari proses ini lebih mahal. Namun pembuatan pektin modifikasi dengan proses ini layak dipertimbangkan, mengingat dengan proses ini dapat mengurangi limbah kulit markisa kuning dan dapat menghasilkan efisiensi penyerapan yang cukup tinggi.
Adapun keuntungan penggunaan biosorben pektin dari limbah kulit buah markisa antara lain:
1. Mengurangi pencemaran limbah pertanian 2. Meningkatkan nilai jual limbah pertanian.
3. Dapat mengurangi efek pencemaran lingkungan akibat limbah logam berat.
1
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Kontaminasi logam berat merupakan masalah serius yang dihadapi saat ini karena logam berat merupakan unsur logam yang sangat berbahaya. Jika tanah terkontaminasi oleh logam berat dengan kadar yang tinggi, maka akan merusak rantai makanan dan pada akhirnya akan membahayakan kehidupan manusia [1].
Penggunaan logam Pb yang cukup luas saat ini seperti pengaplikasian pada baterai, bensin, cat, dan lain-lain menyebabkan tingginya kemungki