i
PEMANFAATAN LIMBAH KULIT JERUK KEPROK (
Citrus
Reticulata Blanco syn
) SEBAGAI BAHAN PENGUAT
NANOKERTAS SELULOSA BAKTERI
DARI AIR KELAPA
SKRIPSI
REISYA ICHWANI
090802043
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2013
PEMANFAATAN LIMBAH KULIT JERUK KEPROK (
Citrus
Reticulata Blanco syn
) SEBAGAI BAHAN PENGUAT
NANOKERTAS SELULOSA BAKTERI
DARI AIR KELAPA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
REISYA ICHWANI
090802043
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2013
iii
PERSETUJUAN
Judul : PEMANFAATAN LIMBAH KULIT JERUK KEPROK
(Citrus Reticulata Blanco syn) SEBAGAI BAHAN
PENGUAT NANOKERTAS SELULOSA BAKTERI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA
Saharman Gea Ph,D Dr. Rumondang Bulan, MS NIP. 196811101999031001 NIP. 195408301985032001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PEMANFAATAN LIMBAH KULIT JERUK KEPROK (Citrus Reticulata Blanco syn) SEBAGAI BAHAN PENGUAT NANOKERTAS
SELULOSA BAKTERI DARI AIR KELAPA
SKRIPSI
Saya mengakui skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2013
REISYA ICHWANI
v
PENGHARGAAN
Bismillahirrahmanirrahim, syukur Alhamdulillah penulis ucapkan kehadirat Allah SWT
yang telah memberikan berkah dan kasih sayang-Nya sehingga skripsi ini dapat
diselesaikan dengan baik. Dalam berjalannya penulisan skripsi ini penulis ingin
mengucapkan terima kasih dan penghargaan kepada:
1. Ibunda tercinta, Syafura Darus yang dengan doa dan kerja kerasnya yang telah
membesarkan, menghidupi, menuntun, dan menemani penulis agar dapat menjadi orang
yang berguna bagi dunia dan akhirat. Terima kasih Ibu, Allah memang tidak pernah
tidur melihat perjuangan kita. Adinda Hasfi Rifky yang selalu memberi tawa dan
menampung cerita.
2. Ayah, Armaz Ma’mun yang dengan ikhlas mendidik penulis hingga dewasa ini. Pak
Saiful, Atok, Andong, Mualim dan keluarga besar Darus yang telah banyak membantu
dan menjadi motivator terbesar dalam berpendidikan hingga saat ini.
3. Ibu Dr. Rumondang Bulan, M.S. selaku ketua jurusan kimia FMIPA USU dan Bapak
Drs. Albert Pasaribu, M. Sc selaku sekretaris jurusan kimia.
4. Ibu Dr. Rumondang Bulan, M.S. sebagai dosen pembimbing I dan Bapak Saharman
Gea, Ph.D sebagai dosen pembimbing II yang telah banyak memberikan pengarahan
dan bimbingan hingga selesainya skripsi ini.
5. Drs.Amir Hamzah, MS , sebagai dosen wali penulis, dan seluruh Bapak dan Ibu dosen
yang telah banyak membantu selama penulis dalam masa studi untuk program sarjana
di FMIPA USU.
6. Bapak Saharman Gea, Ph.D dan Ibu Mutia, yang telah memberikan dukungan dan
motivasi yang luar biasa kepada penulis hingga dapat menyelesaikan skripsi ini dan
dapat menjadi tim yang mewakili Sumatera Utara dalam Pekan Karya Ilmiah Nasional
(PIMNAS) 2012 di Yogyakarta. Pembantu Rektor III Drs. Raja Bongsu Hutagalung
beserta staf ahli yang telah ikut serta mengantarkan kami. Segenap staf Biro
Kemahasiswaan Biro Rektor USU yang telah mengurus semua keperluan. DIKTI yang
7. Teman-teman seperjuangan kimia FMIPA USU terkhusus angkatan 2009 yang sangat
luar biasa. Kakak, abang, dan adik-adik di Departemen Kimia yang namanya tidak
dapat disebutkan satu persatu serta asisten Biokimia yang selalu memberikan semangat
dan perhatiannya di Laboratorium Biokimia / KBM FMIPA USU.
8. Keluarga besar HMI Komisariat FMIPA yang telah mengajarkan arti kerjasama, kerja
keras, tanggung jawab dan indahnya persaudaraan. Jayalah HMI. Yakin usaha sampai.
Dan semua pihak yang tidak bisa disebutkan namanya satu persatu memberikan
dukungan kepada penulis dalam menyelesaikan kuliah, penulis mengucapkan terima
kasih. Semoga Allah memberikan berkahnya kepada kita semua dan semoga skripsi ini
bermanfaat bagi kita semua.
Penulis
vii
ABSTRAK
ABSTRACT
ix
Bab 2. TINJAUAN PUSTAKA 2.1. Jeruk 6
3.2.5. Purifikasi selulosa bakteri 25
3.2.6 Disintegrasi selulosa bakteri 26
3.2.7 Preparasi kulit jeruk 26
3.2.8 Isolasi selulosa dari kulit jeruk 26
3.2.9 Pencampuran selulosa bakteri dengan selulosa dari kulit jeruk 27
BAB 4. HASIL DAN PEMBAHASAN 4.1. Hasil penelitian 36
BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan 46
5.2 Saran 46
DAFTAR PUSTAKA 47
xi
DAFTAR GAMBAR
HALAMAN
Gambar 2.1 Jeruk keprok 6
Gambar 2.2 Rumus molekul selulosa 9
Gambar 2.3 Bakteri Acetobacter xylinum 12
Gambar 2.4 Kurva tegangan dan regangan bahan polimer 21 Gambar 4.1 Kurva strain-stress untuk nanokertas (100 SB:0 KJ;
50 SB:50 KJ; 60 SB:40 KJ; 80 SB:20 KJ) 37 Gambar 4.2 Kurva temperatur-massa untuk nanokertas (100 SB : 0 KJ),
nanokertas (50 SB:50 KJ), dan selulosa kulit jeruk murni
(0 SB:100 KJ) 38
DAFTAR TABEL
HALAMAN
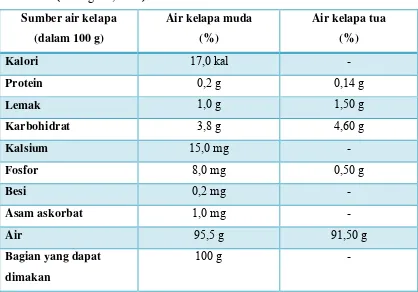
Tabel 2.1 Perbandingan komposisi air kelapa muda dengan air kelapa tua 8
Tabel 2.2 Sumber selulosa 9
Tabel 3.1 Komposisi selulosa bakteri dan selulosa kulit jeruk pada
tiap-tiap variasi perbandingan 28
Tabel 4.1 Kadar air bahan penyusun nanokertas 36
Tabel 4.2 Kadar air nanokertas 36
Tabel 4.3 Modulus Young’s nanokertas 42
xiii
DAFTAR LAMPIRAN
HALAMAN
Lampiran 1. Ukuran diameter serat dari nanokertas (50 SB:50 KJ) 53
Lampiran 2. Foto Nanokertas 54
Lampiran 3. Foto Mikrokertas (0 SB:100 KJ) 55
Lampiran 4. Foto pengukuran ketebalan dengan mikrometer sekrup digital 55 Lampiran 5. Perhitungan kadar air nanokertas 56
ABSTRAK
viii
ABSTRACT
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Konsumsi kertas dunia adalah sekitar 300 juta ton pada tahun 1996/1997 dan
diperkirakan akan naik sekitar 500 juta ton pada tahun 2011 (Hurter dan riccio, 1998).
Menurut asosiasi pulp dan kertas Indonesia (APKI), konsumsi kertas Indonesia
mencapai 5,2 juta ton pada tahun 2011 dan akan meningkat 3-5% pada tahun 2012.
Produksi kertas saat ini masih mengandalkan kayu sebagai bahan baku utama,
sedangkan proses reboisasi hutan memerlukan jangka waktu yang lama dibandingkan
dengan besarnya kebutuhan kertas Indonesia saat ini.
Faktanya sekitar 1 milyar ton kayu per tahun digunakan sebagai bahan bakar
dan kayu bangunan (Aspinall, 1983). Dibeberapa negara, kayu tidak tersedia dalam
jumlah yang cukup dengan permintaan pulp dan kertas yang terus meningkat
(Pahkala, 2001). Dilihat dari penggunaan bahan baku kayu yang telah berkurang
untuk pembuatan pulp kertas dan bertambahnya permintaan dari masyarakat untuk
produk kertas, bahan baku baru untuk pembuatan pulp seperti serat nonkayu mulai
diteliti secara meluas di dunia (Ververis et. al., 2004). Selulosa bakteri (selulosa
nonkayu) dapat dijadikan sebagai solusi bahan pengganti kertas yang terbarukan.
Satu hal yang terpenting dari selulosa bakteri adalah kemurnian seratnya, yaitu
tidak seperti serat selulosa yang berasal dari tumbuh-tumbuhan yang mengandung
hemiselulosa dan lignin yang sulit untuk dihilangkan (Bielecki et. al., 2004). Untuk
proses pemisahan hemiselulosa dan lignin dari pulp kertas tersebut masih
2
Selulosa bakteri merupakan selulosa yang terbentuk dari organisme
nonfotosintesis , dimana bakteri yang dapat menghasilkan selulosa bakteri termasuk
dalam famili Acetobacter, Rhizobium, Agrobacterium dan Sarcina (Jonas dan Farah,
1998). Selulosa Bakteri adalah suatu material murah, ramah lingkungan dan
merupakan hasil sintesis dengan bakteri “Acetobacter xylinum” Selulosa bakteri
memiliki diameter serat sebesar 4-7 nm (Ozawa dan Kikuchi, 2006). Oleh karena
ukuran diameter seratnya yang berukuran nanometer, maka kertas yang dihasilkan
oleh paduan selulosa bakteri disebut dengan nanokertas.
Kertas berkekuatan tinggi telah diproduksi dari selulosa bakteri yang disintesis
secara ekstraselular oleh bakteri Acetobacter xylinum. Dibandingkan dengan selulosa
dari kayu, selulosa bakteri memiliki kemurnian, kristalinitas, dan kekuatan tarik yang
lebih tinggi. Dengan demikian, Selulosa bakteri cocok digunakan sebagai bahan
penguat pada pulp kertas dengan metode disintegrasi dan mencampurkannya dengan
material berserat lainnya karena terlihat bahwa selulosa bakteri terfragmentasi pada
permukaan lainnya (Yamanaka et. al., 1989; Iguchi et. al., 2000).
Dari penelitian sebelumnya, Ververis (2006) menyebutkan bahwa
pencampuran biomassa alga, kulit jeruk dan lemon efektif dalam pembuatan pulp
kertas dengan penghematan sekitar 45% dari biaya bahan baku material. Gea (2010)
juga meyebutkan bahwa apple dan lobak memiliki potensi sebagai alternatif
pembuatan pulp kertas dan mudah diperoleh dimana-mana sebagai bahan makanan.
Sumatera Utara merupakan salah satu daerah penghasil jeruk keprok (Citrus
Reticulata Blanco syn) terbesar yaitu sejumlah 856.019 ton pada tahun 2010. Akibat
dari konsumsi jeruk yang banyak, maka akan timbul limbah kulit jeruk yang banyak
pula yang belum dimanfaatkan dan masih dibuang begitu saja. Pada penelitian ini,
penulis ingin memanfaatkan limbah kulit jeruk tersebut sebagai bahan baku yang
berpotensi dalam pembuatan pulp kertas. Selulosa bakteri dipadukan dengan selulosa
yang diisolasi dari kulit jeruk untuk menghasilkan kertas berukuran nanometer (10-9
m) yang diharapkan berpotensi dalam berbagai aplikasi penggunaan kertas, misalnya
sebagai bahan baku prangko, kertas sertifikat, bahan baku pembuatan uang dan kertas
1.2. Perumusan Masalah
1. Apakah limbah kulit jeruk dan selulosa bakteri dapat dimanfaatkan dalam
pembuatan nanokertas?
2. Apakah nanokertas yang dihasilkan dapat digunakan sebagai kertas
konvensional?
1.3. Pembatasan Masalah
Dalam penelitian ini objek masalah dibatasi sebgai berikut :
1. Kulit jeruk yang digunakan adalah kulit jeruk jenis keprok (Citrus Reticulata
Blanco syn) yang diperoleh dari limbah rumah makan Komda, Jl.Zainul Arifin
Medan. Jeruk keprok tersebut diperoleh dari Desa Siberteng, Kecamatan
Barusjahe, Kabupaten Karo.
2. Air kelapa tua dan muda yang digunakan adalah air kelapa dari Pasar
Tradisional Pringgan, Jl. D.I. Pandjaitan Medan.
3. Stater bakteri Acetobacter xylinum diperoleh dari hasil pengembangan industri
rumah tangga Nata de coco di Tembung.
4. Waktu fermentasi gel selulosa bakteri dilakukan selama 14 hari.
5. Pembuatan nanokertas dengan pencampuran selulosa bakteri yang telah
dihaluskan dan selulosa yang diisolasi dari kulit jeruk dengan perbandingan
A(100:0%), B(80:20%), C(60:40%), D(50:50%) dan E(0:100%) berdasarkan
berat keringnya.
6. Uji fisik dan mekanik dari kertas yang dihasilkan dilakukan uji morfologi
dengan scanning electron microscope (SEM), uji termal dengan
4
1.4. Tujuan Penelitian
Penelitian yang dilakukan bertujuan untuk :
1. Untuk memperoleh nanokertas dari hasil pencampuran antara selulosa bakteri
dengan kulit jeruk dengan kualitas terbaik.
2. Sebagai upaya dalam pemanfaatan limbah kulit jeruk dan residu dari air kelapa
tua.
3. Mengetahui kelayakan nanokertas sebagai alternatif kertas di pasaran, baik
sebagai bahan baku uang, sertifikat, maupun perangko.
1.5. Manfaat penelitian
Adapun manfaat dari penelitian ini adalah :
1. Bagi peneliti, menjadi inisiator untuk perkembangan nanoteknologi dan informasi
penelitian lebih lanjut, khususnya di Sumatera Utara Medan.
2. Bagi pemerintah dan masyarakat, penelitian ini dapat mengurangi keberadaan
limbah yang terdapat di sekitar wilayah tempat tinggal.
3. Bagi pengusaha, sebagai bahan alternatif untuk memproduksi kertas dengan harga
yang lebih hemat namun menghasilkan produk yang lebih berkualitas
dibandingkan kertas konvensional.
1.6. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia/Kimia Bahan Makanan FMIPA
USU, Laboratorium Penelitian FT USU, Laboratorium Geologi Kuarter Bandung,
1.7. Metodologi Penelitian
Penelitian ini adalah penelitian eksperimental laboratorium. Ada beberapa tahapan
penelitian yang dilakukan dalam pembuatan nanokertas. Adapun langkah-langkah
analisisnya adalah sebagai berikut :
1. Pembuatan stater selulosa bakteri
2. Penumbuhan selulosa bakteri ( Nata de coco )
3. Purifikasi dan desintegrasi selulosa bakteri ( Nata de coco )
4. Preparasi limbah kulit jeruk
5. Isolasi selulosa dari kulit jeruk
6. Pencampuran selulosa bakteri dengan selulosa yang diisolasi dari kulit jeruk
7. Uji fisik dan mekanik dari kertas yang dihasilkan dilakukan dengan uji
morfologi dengan SEM (Scanning Electron Microscope), uji termal dengan
TGA (Thermogravimetry Analysis), uji tensil dan uji kadar air.
Adapun variabel yang digunakan dalam pembuatan kertas adalah :
1. Variabel bebas yaitu massa selulosa bakteri yang telah dihaluskan
(100:80:60:50:0%) dan massa selulosa yang telah diisolasi dari kulit jeruk
(0:20:40:50:100%) dari massa keseluruhan.
2. Variabel tetap yaitu massa dari carboxyl methyl cellulose (CMC) pada setiap
perbandingan 20% dari massa keseluruhan.
3. Variabel terikat yaitu karakterisasi yang dilakukan meliputi uji morfologi
6
BAB 2
TINJAUAN PUSTAKA
2.1. Jeruk
Jeruk (Citrus sp.) termasuk dalam famili Rutaceae. Buah jeruk yang masak sempurna
mengandung air sebesar 77-92 %, gula 2-15 %, protein yang kurang dari 2 %, dan
asam sitrat 1-2 % (Ashari, 1995). Buah jeruk telah banyak digunakan untuk
menghasilkan jus dan produk makanan lainnya. Dalam proses produksi jus, sejumlah
besar limbah jeruk akan dihasilkan. Oleh karena limbah jeruk mengandung bahan
yang berharga, maka limbahnya harus dimanfaatkan untuk menghasilkan produk
bernilai tinggi (Goto et al., 2010).
Tanaman jeruk sudah lama dibudidayakan di Indonesia. Sumatera Utara
adalah daerah terbesar penghasil buah jeruk. Buah jeruk dinikmati karena segar
rasanya sebagai pelepas dahaga dan buah pencuci mulut. Buah jeruk dapat diolah
menjadi minuman, makanan, dan obat penurun demam (AAK, 1994).
Daerah pusat penghasil jeruk terpenting di Indonesia adalah Garut, Malang,
Cibinong yang tak berarti lagi saat ini. Beberapa daerah penghasil jeruk yang masih
bertahan hingga sekarang adalah Berassitepu (Sumatera Utara), Cilacap, Madura, dan
Palembang. Jeruk keprok (Citrus Reticulata Blanco syn) yang tumbuh di Berastagi
(Sumatera Utara) berasal dari Tiongkok Selatan yang hidup di daratan tinggi dengan
sinar matahari dan curah hujan 1900-2040 mm/tahun. Jeruk ini tumbuh pada curah
hujan tipe C yaitu 5-7 bulan basah dan 4-6 bulan kering (Joesoef, 1993). Buah jeruk
bukan hanya daging buahnya saja yang dapat dimanfaatkan untuk makanan, tetapi
kulitnya pun digunakan untuk pembuatan pektin ataupun pembuatan jelly. 500 gram
kulit jeruk dapat menghasilkan 14-18 gram pektin kering. Pektin adalah senyawa
polimer yang bersifat mengikat air, membentuk gel atau mengentalkan cairan
(Soelarso, 1996).
2.2. Tanaman Kelapa
Indonesia merupakan salah satu negara tropika yang terkenal karena hasil kelapanya
berlimpah, bahkan pernah menjadi pengekspor kelapa terbesar didunia. Tanaman
kelapa merupakan tanaman asli daerah tropis, dapat ditemukan tersebar di Indonesia.
Bagi Rakyat Indonesia, kelapa adalah salah satu komoditas terpenting setelah padi,
dan sumber pendapatan yang dapat diandalkan dari pemanfaatan tanah pekarangan
(Warismo, 1998).
Kelapa menghasilkan air sebanyak 50-150 ml per butir. Air kelapa sangat baik
digunakan sebagai bahan dalam pembuatan nata, karena mengandung nutrisi yang
dibutuhkan bagi pertumbuhan, perkembangbiakan, dan aktivitas bibit nata yang
berupa bakteri Acetobacter xylinum. Untuk Pertumbuhan dan aktivitasnya,
Acetobacter xylinum membutuhkan unsur makro dan mikro. Unsur makro terdiri atas
karbon dan nitrogen.
Air kelapa yang baik adalah air kelapa yang diperoleh dari kelapa tua optimal,
tidak terlalu tua dan tidak pula terlalu muda. Dalam air kelapa yang terlalu tua,
terkandung minyak dari kelapa yang dapat menghambat pertumbuhan bibit nata
8
Selulosa merupakan polimer yang paling melimpah di alam. Nama Selulosa
diciptakan oleh Anselme Payen, seorang ahli kimia fisika dan matematika Perancis.
Selulosa adalah bahan utama dari tanaman berkayu, yang memiliki keragaman
aplikasi yang berkisar dari perumahan ke kertas dan tekstil. Dapat dikatakan, selulosa
adalah salah satu senyawa kimia yang paling berpengaruh dalam sejarah budaya
manusia. Biasanya selulosa disertai berbagai zat lain, seperti lignin, di dinding sel
tumbuhan matriks. Dalam spesies tertentu, seperti kapas, selulosa terdapat dalam
bentuk murni tanpa bahan tambahan dan dalam beberapa kasus, seperti alga Valonia,
selulosa hampir benar-benar dalam bentuk Kristal (Kontturi, 2005).
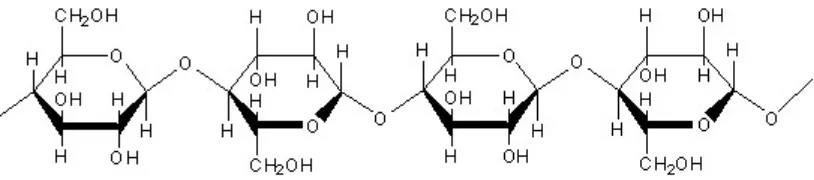
Selulosa merupakan salah satu jenis polisakarida. Dalam selulosa, molekul
glukosa dalam bentuk rantai panjang tidak bercabang yang mirip dengan amilosa.
Bagaimanapun, unit-unit dari glukosa dalam selulosa terikat pada ikatan β-1,4-
baris paralel oleh ikatan hidrogen diantara kelompok hidroksil pada rantai yang
berdekatan. Hal ini yang menyebabkan selulosa tidak dapat larut dalam air. Ini
memberikan struktur rigis ke dinding sel kayu dan serat yang lebih tahan terhadap
hidrolisis daripada pati (Timberlake, 2008).
Gambar 2.2 Rumus Molekul Selulosa (Gortner, 1938)
Sumber selulosa nanokristalin adalah mikrokristalin selulosa (kayu), bakteri
(Nata de coco), kapas, alga (Valonia) dan tunicate.
Tabel 2.2 Sumber Selulosa (Beck-Candanedo et. al., 2005)
Sumber Selulosa Panjang Jarak celah Aspek Ratio Tunicate 100 nm – micron 10-20 nm 5 to > 100 (tinggi)
Algal(Valonia) > 1000 nm 10 to 20 nm 50 to > 10 nm (tinggi)
Bacterial 100 nm – micron 5-10 x 30-50 nm 2 to > 100 (medium)
Kapas 200-350 nm 5 nm 20 to 70 (rendah)
Kayu 100 – 300 nm 3 – 5 nm 20 to 50 (rendah)
Polisakarida adalah makromolekul biologi yang terdapat luas di alam.
Polisakarida dapat dibedakan berdasarkan tempat morfologinya menjadi polisakarida
intraseluler dan ekstraseluler. Polisakarida intraseluler terletak didalam, atau sebagai
bagian pada membran sitoplasma; dinding sel polisakarida membentuk bagian
struktural pada dinding sel, dan polisakarida ekstraselular terletak diluar dinding sel.
Polisakarida ekstraseluler terdapat dalam dua bentuk yaitu lendir longgar, tidak
10
meningkatkan viskositas dalam medium cair; dan mikrokapsul atau kapsul, yang
menyatu dengan dinding sel. Mereka memiliki bentuk nyata dan berdiri sendiri, yang
hanya pelan-pelan diekstraksi dalam air atau garam. Oleh karena itu, memungkinkan
untuk memisahkan kapsul terpisah dan mikrokapsul dari lendir longgar dengan teknik
sentrifugasi.
Eksopolisakarida adalah polisakarida rantai panjang yang terdiri dari satuan
cabang berulang dari gula atau gula derivatif, terutama glukosa, galaktosa dan
rhamnosa dalam rasio yang berbeda. Polisakarida ini diklasifikasikan menjadi dua
kelompok yaitu homopolisakarida (selulosa, dekstran, mutan, pullulan, curdlan), dan
heteropolisakarida (gellan dan xanthan). Homopolisakarida terdiri dari satuan
berulang dari hanya satu jenis monosakarida (D-glukosa atau D-fruktosa), sedangkan
heteropolisakarida terdiri dari beberapa bentuk oligosakarida, yang mengandung 3-8
monosakarida, yang dihasilkan oleh berbagai mikroorganisme.
2.3.1. Selulosa Bakteri
Selulosa bakteri merupakan eksopolisakarida yang diproduksi oleh berbagai jenis
bakteri, seperti Gluconacetobacter (sebelumnya Acetobacter), Agrobacterium,
Aerobacter, Achromobacter, Azotobacter, Rhizobium, Sarcina, dan Salmonella.
Produksi selulosa dari Acetobacter xylinum pertama kali dilaporkan oleh Brown
(1886) yang mengamati sel-sel istirahat Acetobacter xylinum memproduksi selulosa
dengan adanya oksigen dan glukosa.
Rumus molekul selulosa bakteri (C6H10O5)n sama dengan selulosa yang berasal
dari tanaman, tetapi secara fisik keduanya memiliki fitur kimia yang berbeda. Bakteri
selulosa lebih disukai daripada selulosa tanaman karena dapat diperoleh dalam
kemurnian yang lebih tinggi, tingkat polimerisasi dan kristalinitas yang lebih tinggi
serta kekuatan tarik dan kapasitas menahan air yang tinggi (Chawla et. al., 2008).
Selulosa bakteri lebih cocok digunakan untuk memproduksi membran audio
berkualitas tinggi, kertas berkualitas tinggi, fuel-cell, industri makanan, material medis
seperti obat-obatan, dressing luka, kosmetik, dan tekstil (Czaja et. al., 2005; Zhou et.
Serat selulosa bakteri sekitar 100 kali lebih tipis daripada selulosa tanaman,
yang membuatnya menjadi bahan yang sangat berpori. Selulosa bakteri dengan
struktur jaringan pita yang unik memiliki dimensi pita kira-kira 3-4 nm untuk
ketebalan dan 70-130 nm untuk lebar. Jaringan pita ini dibentuk dari rantai agregat
menjadi sub-fibril, dimana lebarnya sekitar 1,5 nm, dan kemudian sub-fibril tersebut
dikristalisasi membentuk bundel yang merupakan bentuk sementara dari struktur pita
(Bielecki et. al., 2004; Jonas et. al., 1998; Yamanaka et. al., 2000).
Relatif tingginya biaya produksi selulosa dapat dibatasi pada bahan tambahan
produk serta bahan kimia khusus yang digunakan. Pengurangan biaya dalam
fermentasi dapat dibatasi dari biaya harga bahan baku substrat selulosa bakteri.
Akibatnya, produksi selulosa bakteri selalu mungkin lebih mahal daripada sumber
selulosa konvensional. Untuk alasan komersialisasi ini, keberhasilan penggunaan
selulosa bakteri bergantung pada ketepatan memilih aplikasi di mana kinerja yang
unggul dapat memberikannya nilai yang lebih tinggi.
Sebagai salah satu sumber selulosa yang dihasilkan dalam skala ilmiah,
selulosa bakteri diproduksi secara ektraselular yang salah satunya disintesis oleh
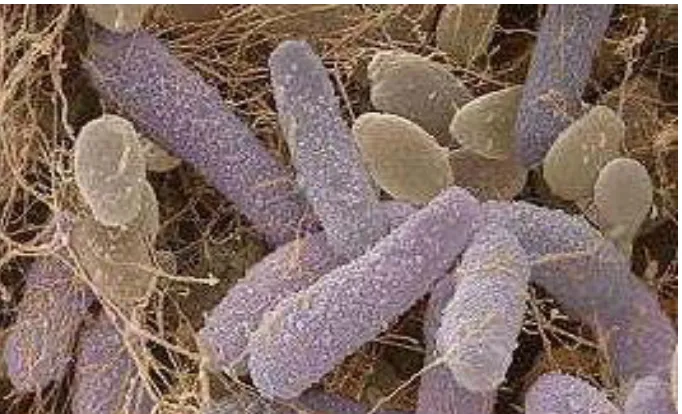
bakteri Acetobacter xylinum. Bakteri gram negatif Acetobacter xylinum merupakan
contoh selulosa sintesis dari bakteri prokariotik. Ini ditemukan sebagai lembaran
gelatin pada permukaan yang siap dibudidayakan di dalam laboratorium sebagai
sumber selulosa murni (Aspinall, 1983). Di Jepang, matriks selulosa bakteri dalam
limbah industri digunakan sebagai bahan pembuatan cuka tradisional (Ozawa et. al.,
2006).
2.4. Acetobacter
Sel Acetobacter sp. berbentuk elips atau tongkat yang melengkung. Kultur yang masih
muda merupakan bakteri gram negatif, sedangkan kultur yang sudah agak tua
merupakan bakteri dengan gram yang bervariasi. Acetobacter sp. merupakan bakteri
aerob yang memerlukan respirasi dalam metabolismenya. Acetobacter sp. dapat
mengoksidasi etanol menjadi asam asetat, juga dapat mengoksidasi asetat dan laktat
12
Berbagai spesies Acetobacter sp. dapat ditemukan pada buah-buahan dan
sayur-sayuran. Bakteri inilah yang menyebabkan pengasaman jus buah-buahan
(Banwart, 1981).
2.4.1. Acetobacter xylinum
Klasifikasi ilmiah dari Acetobacter xylinum :
Kerajaan : Bacteria
Divisio : Protophyta
Kelas : Schizomycetes
Ordo : Pseudomonadales
Famili : Pseudomonodaceae
Genus : Acetobacter
Spesies : Acetobacter xylinum (Budiyanto,2002)
Bakteri Acetobacter xylinum sering ditemukan dalam hubungan simbiosis
dengan berbagai tanaman seperti tanaman tebu dan kopi. Sebuah sel bakteri
Acetobacter xylinum tunggal mampu melakukan polimerisasi molekul glukosa
200.000 per detik menjadi rantai β-1,4-glikosidik yang kemudian diekskresikan ke
dalam medium disekitarnya membentuk ikatan pita mikroserat menyerupai lebar dan
struktur rata-rata serat tanaman dan alga.
Serat yang terbentuk di membran dengan sintase selulase dan hasilnya
dikeluarkan dari baris 50-80 pori-pori seperti lembaran sepanjang sumbu longitudinal
sel. Pembentukan ini menghasilkan matriks selulosa yang mengambang pada
permukaan, sehingga diperkirakan bakteri Acetobacter xylinum adalah sebuah bakteri
sebuah aerob obligat, yang tumbuh dengan adanya oksigen yang tinggi pada
permukaan medium (Muthukumarasamy, 2001).
Pengamatan mikroskop elektron menunjukkan bahwa selulosa yang dihasilkan
oleh bakteri Acetobacter xylinum terjadi dalam bentuk serat. Bakteri Acetobacter
xylinum telah diterapkan sebagai model mikroorganisme untuk studi dasar selulosa.
Acetobacter xylinum adalah bakteri yang paling sering dipelajari sebagai sumber
selulosa karena kemampuannya untuk menghasilkan tingkat polimer yang relatif
tinggi dari berbagai sumber karbon dan nitrogen. Selulosa bakteri diproduksi sebagai
gelatin membran dan dapat dicetak dengan berbagai bentuk dan ukuran tergantung
pada teknik fermentasi dan kondisi yang digunakan (Chawla et. al., 2008).
2.4.2. Pembuatan selulosa bakteri (Nata de coco)
Beberapa tahap kegiatan dalam pembuatan selulosa bakteri adalah sebagai berikut :
1. Preparasi
Tahap preparasi terdiri atas beberapa kegiatan sebagai berikut :
a. Penyaringan
Penyaringan bertujuan untuk memisahkan kotoran-kotoran atau benda
benda asing yang tercampur dengan air kelapa, seperti misalnya sisa gabut.
Penyaringan yang lebih baik apabila dilakukan dengan menggunakan kain
penyaring.
b. Penambahan gula pasir dan urea
Ketersediaan karbohidrat dan protein yang terdapat dalam air kelapa belum
mencukupi kebutuhan untuk pembentukan selulosa bakteri, kedalam air
14
Jenis sumber karbon bisa berupa bahan seperti misalnya glukosa, laktosa,
fruktosa. Demikian juga dengan jenis sumber nitrogen yang digunakan dapat berupa
nitrogen organik seperti misalnya protein, maupun nitrogen anorganik seperti
misalnya ammonium fosfat, ammonium sulfat, dan urea.
c. Perebusan
Perebusan dilakukan sampai mendidih dan dipertahankan selama 5-10
menit untuk meyakinkan bahwa mikroba kontaminan telah mati, dan juga
menyempurnakan pelarutan gula pasir yang ditambahkan.
d. Penambahan cuka
Tujuan penambahan cuka/asam asetat adalah untuk menurunkan pH air
kelapa dari sekitar 6,5 sampai mencapai pH 4,3, yang merupakan kondisi
optimal bagi pertumbuhan bakteri Acetobacter xylinum.
e. Pendinginan
Pendinginan paling baik dilakukan dengan cara membiarkan cairan dalam
nampan selama satu malam. Hal ini sekaligus untuk mengecek ada
tidaknya kontaminan yang tumbuh pada cairan.
2. Inokulasi, fermentasi, dan pengendaliannya
a. Pemberian bibit (inokulasi)
Pemberian bibit dilakukan apabila campuran air kelapa, urea, dan asam
asetat/cuka telah benar-benar dingin. Bila pemberian bibit dilakukan pada
waktu cairan air kelapa masih dalam keadaan panas atau hangat, maka
bibit bakteri Acetobacter xylinum dapat mengalami kematian, sehingga
proses fermentasi tidak dapat berlangsung.
b. Fermentasi atau pemeraman
Campuran air kelapa yang sudah diberi bibit, dibiarkan selama 14 hari agar
terjadi proses fermentasi dan terbentuklah selulosa bakteri (Pambayun,
2.4.3. Faktor-faktor yang mempengaruhi keberhasilan pembuatan selulosa bakteri (Nata de coco)
Faktor-faktor yang mempengaruhi produksi selulosa bakteri yang maksimal adalah
sebagai berikut.
1. Jenis dan konsentrasi medium
Medium fermentasi harus mengandung banyak karbohidrat (gula) disamping
vitamin dan mineral, karena pada hakekatnya selulosa bakteri tersebut adalah benang
– benang halus dari sel bakteri yang kaya akan selulosa yang diproduksi dari glukosa
oleh bakteri Acetobacter xylinum. Selulosa bakteri merupakan hasil fermentasi dari
bakteri Acetobacter xylinum, bakteri ini dapat tumbuh dan berkembang dalam medium
gula dan akan mengubah gula menjadi selulosa.
2. Jenis dan Konsentrasi starter
Pada umumnya bakteri Acetobacter xylinum merupakan starter yang lebih
produktif dari jenis starter lainnya, dan konsentrasi 5-10% merupakan konsentrasi
yang ideal.
3. Waktu Fermentasi
Waktu fermentasi yang digunakan dalam pembuatan selulosa bakteri
umumnya 2–4 minggu. Minggu ke 4 dari waktu fermentasi merupakan waktu
maksimal produksi selulosa bakteri, yang berarti lebih dari 4 minggu, kualitas selulosa
bakteri yang diproduksi akan menurun.
4. Temperatur Fermentasi
Pada umumnya temperatur fermentasi untuk pembuatan selulosa bakteri
adalah suhu kamar (28oC). Temperatur yang terlalu rendah atau terlalu tinggi akan
mengganggu pertumbuhan bakteri pembentuk selulosa, yang akhirnya juga
menghambat produksi selulosa bakteri.
5. pH Fermentasi
Derajat keasaman yang dibutuhkan dalam pembuatan selulosa bakteri adalah
3–5 atau dalam suasana asam. Pada kedua sisi pH optimum, aktifitas enzim seringkali
menurun dengan tajam. Suatu perubahan kecil pada pH dapat menimbulkan perbedaan
16
6. Jenis dan konsentrasi suplemen
Kandungan karbohidrat dalam bahan untuk pembuatan selulosa bakteri
merupakan bahan yang terpenting. Limbah dengan kadar karbohidrat rendah jika ingin
digunakan sebagai medium pembuatan nata perlu ditambahkan dengan gula pasir.
7. Tempat Fermentasi
Tempat fermentasi sebaiknya tidak terbuat dari logam karena mudah korosif
yang dapat mengganggu pertumbuhan mikroorganisme pembentuk selulosa bakteri.
Di samping itu, tempat fermentasi sebaiknya tidak terkena cahaya matahari langsung,
jauh dari sumber panas, dan harus berada dalam kondisi steril.
Selain itu, dalam pembuatan selulosa bakteri juga harus diperhatikan bahwa
selama proses penumbuhan berlangsung harus dihindari gerakan atau goncangan di
sekitar tempat fermentasi. Akibat adanya gerakan atau goncangan ini, akan
menenggelamkan lapisan selulosa bakteri yang telah terbentuk dan menyebabkan
terbentuknya lapisan selulosa bakteri yang baru yang terpisah dari selulosa bakteri
yang pertama. Hal ini menyebabkan ketebalan produksi selulosa bakteri tidak standar
(Budiyanto, 2002).
2.5. Nanoteknologi
''Nano'' adalah istilah yang menandakan nanometer (10-9 m). Konsep nanoteknologi
diperkenalkan pertama kali oleh Richard Feynman pada tahun 1959 pada pertemuan
American Physical Society. Sejak itu, nanoteknologi telah berkembang menjadi area
multidisiplin bidang ilmu terapan dan teknologi.
Nanoteknologi adalah kemampuan untuk bekerja pada skala sekitar 1-100 nm
sekitar untuk memahami, membuat, mengkarakterisasi dan menggunakan suatu
struktur materi, perangkat dan system dengan sifat baru yang berasal dari struktur
nanometer tersebut (Roco, 2003). Akibat ukurannya, nanopartikel memiliki luas
permukaan proporsional yang besar dan memiliki permukaan atom yang lebih besar
dibandingkan dengan partikel berukuran mikrometer (Boccuni et al., 2008; Kahn,
2006). Kontrol yang baik terhadap sifat tersebut berdampak menuntun ke pengetahuan
Penggunaan nanoteknologi berbasis biomaterial polimer adalah nanopartikel
pembawa obat, partikel miniemulsi, katalis polimer elektroda fuel cell terikat, lapis
demi lapis film polimer rakitan, electrospun nanofibers, imprint lithography, polimer
campuran dan nanokomposit. Bahkan di bidang nanokomposit, terdapat aplikasi
beragam seperti komposit penguat, sifat penghalang, tahan api, kosmetik dan sifat
bakterisida (Paul dan Robenson, 2008).
2.5.1. Nanokomposit
Komposit adalah material yang dibentuk dengan kombinasi dua atau lebih komponen.
Membatasi untuk polimer, definisi komposit termasuk plastik kopolimer yang
diperkuat, karet yang diisi karbon hitam, dan lain-lain. Oleh karena itu, istilah ini akan
mencakup papan serat, papan berpartikel, papan keras, papan isolasi, papan semen,
dan lain-lain. Papan ini memiliki persaingan dengan material teknik tradisional.
Dalam komposit, serat diperlukan sebagai mendukung bahan utama. Komposit serat
bersifat anisotropik dan heterogen, sehingga mekanika fraktur hanya dapat diterapkan
kepada mereka dengan pemesanan tertentu (Bhatnagar, 2004).
Tidak ada pengertian yang pasti tentang material komposit, tetapi dari banyak
studi yang dilakukan, memberikan beberapa indikasi untuk menjelaskan tentang
pengertiannya. Ada tiga hal penting yang termasuk dalam pengertian komposit untuk
penggunaannya dalam berbagai aplikasi:
1. Bahan ini terdiri dari dua atau lebih material yang berbeda sifat fisik dan
mekanisnya.
2. Komposit ini dapat dibuat dengan mencampurkan material-material berbeda sifat
ini dalam berbagai cara dimana pemasukan dari satu material ke dalam material
lainnya dengan suatu cara terkontrol untuk memperoleh sifat optimum.
3. Sifat-sifatnya unggul, dan cukup unik jika ditinjau dari beberapa hal, dibandingkan
dengan sifat dari komponen penyusunnya (Hull, 1998)
Komposit pada umumnya terdiri dari matriks dan pengisi (filler). Filler adalah
fase terdispersi yang tersebar dalam matriks sebagai fase kontinu (Simonsen, 2008).
18
(nanopartikel) akan menghasilkan nanokomposit. Nanopartikel memiliki luas
permukaan lebih besar secara proporsional dari pada partikel berukuran mikrometer,
dikarenakan interaksi filler dan matriks pada bahan yang dihasilkan. Selain penguat
nanometer, nanopartikel memiliki fungsi lain ketika ditambahkan kedalam suatu
polimer, seperti anti aktivitas mikroba, imobilisasi enzim, biosensing dan lain-lain
(Henriette dan Azeredo, 2009).
Penggunaan filler berukuran nanometer sebagai bahan penguat dalam
komposit biobasis telah diselidiki secara intensif. Dengan efek ukuran nanometer dan
area permukaan spesifik yang tinggi, nanofiller sangat potensial digunakan sebagai
penguat dalam material komposit. Muatan filler yang sangat kecil dan bersifat unik
dijadikan sebagai perbandingan dengan mikrokomposit konvensional lainnya (Grunert
dan winter, 2002; Samir et. al., 2005). Pada akhirnya, selulosa bakteri yang memiliki
struktur jaringan yang unik pada gabungan struktur pita yang dibentuk oleh nanoserat,
sering digunakan sebagai bahan penguat dalam polimer (Soykeabkaew et. al., 2009).
2.5.2. Nanokertas
Berdasarkan perkembangan nanoteknologi, terdapat kebutuhan untuk meninjau
metode terdahulu, metode kimia dan metode semi-kimia dalam industri kertas dan
kemasan. Nanokertas dihasilkan sebagai inovasi radikal dalam memperbaiki sifat
kertas sehingga menyebabkan peningkatan nilai tambah pada produk kertas dan
juga mempengaruhi pertumbuhan industri kertas (Kachlami dan Moghtader, 2012).
Istilah nanokertas menandai adanya komponen dasar kertas yang salah satu
ataupun keduanya berdimensi nanopartikel. Meniru proses pembuatan kertas, suspensi
selulosa nanoserat dapat digunakan untuk menyiapkan lembaran kertas sederhana
dengan menyaring suspensi tersebut untuk memperoleh gel basah dan menguapkan
kadar airnya. Nanoserat secara mekanik terikat dengan gel basah tersebut. Proses ini
akan menghasilkan nanokertas dengan kombinasi modulus Young’s, kekuatan tarik,
dan kekerasan yang baik. Nanokertas juga memiliki tingkat pemuaian termal yang
rendah dan karakter penahan oksigen yang baik. Beberapa prosedur penyiapan
panas gel basah, hot press, mengeringkan kandungan air, dan alat pembentuk
lembaran dinamik (Sehaqui et. al., 2010).
2.6. Scanning Electron Microscope (SEM)
Suatu berkas insiden elektron yang sangat halus discan menyilangi permukaan sampel
dalam sinkronisasi dengan berkas tersebut dalam sinar tabung katoda.
Elektron-elektron yang terhambur digunakan untuk memproduksi sinyal yang memodulasi
berkas dalam tabung sinar katoda, yang memproduksi suatu citra dengan kedalaman
medan yang besar dan penampakan yang hampir 3 dimensi.
Dalam penelitian morfologi permukaan SEM terbatas pemakaiannya, tetapi
memberikan informasi yang bermanfaat mengenai topologi permukaan dengan
resolusi berkisar 100 Å. Aplikasi-aplikasi yang khas mencakup penelitian
dispersi-dispersi pigmen dalam cat, pelepuhan atau peretakan koting, batas-batas fasa dalam
polipaduan yang tak dapat campur, struktur sel busa-busa polimer, dan kerusakan
pada bahan perekat. SEM teristimewa berharga dalam mengevaluasi betapa
penanaman (implant) bedah polimerik bereaksi baik dengan lingkungan bagian
tubuhnya (Stevens, 2000).
2.7. Analisis Termal
Analisis termal adalah sebuah istilah umum yang mencakup kelompok teknik terkait
dimana analisis termal merupakan parameter perubahan sifat fisik suatu properti
terhadap perubahan temperatur. Definisi ini memiliki kekurangan tertentu sehingga
dianjurkan untuk digantikan dengan, Analisis termal adalah sekelompok teknik
dimana sifat fisik dari suatu substansi yang diukur menjadi fungsi temperatur,
sedangkan substansinya menjadi subjek yang dikontrol oleh program temperatur.
Selain menjadi lebih akurat, definisi ini memiliki keuntungan bahwa hal itu
dapat disesuaikan dengan semua definisi teknik termoanalitik. Sebagai contoh,
thermogravimetry (TG) adalah suatu teknik dimana massa dari suatu substansi yang
20
dikontrol program temperatur. Hasilnya adalah kurva TG. Kurva TG dicatat
menggunakan thermobalance. Prinsip dari elemen thermobalance adalah
Microbalance elektronik, tungku, pemprogram temperatur, pengendali atmosfer dan
alat perekam output dari perangkat tersebut (Hatakeyama, 1998).
2.8. Kekuatan Tarik
Kekuatan tarik adalah salah satu sifat dasar dari bahan polimer yang terpenting dan
sering digunakan untuk karakteristik suatu bahan polimer. Kekuatan tarik suatu bahan
didefinisikan sebagai besarnya beban maksimum (Emaks) yang digunakan untuk
memutuskan spesimennya bahan dibagi dengan luas penampang awal (A0).
σ =
...(
2.1)keterangan :
σ = kekuatan tarik bahan ( )
F = tegangan maksimum ( kgf)
Ao = luas penampang ( mm2)
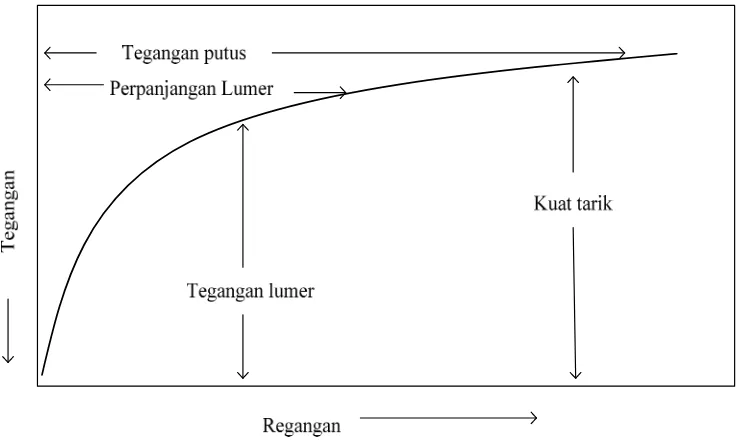
Bila suatu bahan dikenakan beban tarik yang disebut tegangan (gaya per
satuan luas), maka bahan akan mengalami perpanjangan (regangan). Kurva tegangan
terhadap regangan merupakan gambar karakteristik dari sifat mekanik suatu bahan.
Gambar 2.4 Kurva tegangan dan regangan bahan polimer
Disamping bersama kekuatan tarik (σ) sifat mekanik bahan juga diamati dari sifat
kemulurannya (ε) yang didefenisikan sebagai :
ε = x 100%... (2.2)
ε = kemuluran (%)
I0 = panjang spesimen mula-mula (mm)
24
3.2. Prosedur Penelitian 3.2.1. Pengambilan sampel
Sampel limbah air kelapa diperoleh dari pasar tradisional Pringgan Medan. Tanaman
kelapa dengan spesies Cocos Nucifera L. dan sampel limbah kulit jeruk keprok
diperoleh dari Rumah Makan Komda, Jl. Zainul Arifin Medan. Jeruk keprok tersebut
diperoleh dari Desa Siberteng, Kecamatan Barusjahe, Kabupaten Karo.
3.2.2. Pembuatan larutan pereaksi 3.2.2.1. Pembuatan larutan NaOH 2%
Ditimbang 20 g NaOH(s), kemudian dilarutkan dengan akuades di dalam labu takar 1
liter, dan diencerkan hingga garis tanda.
3.2.2.2. Pembuatan larutan NaOH 2,5%
Ditimbang 25 g NaOH(s), kemudian dilarutkan dengan akuades di dalam labu takar 1
liter, dan diencerkan hingga garis tanda.
3.2.2.3. Pembuatan larutan NaOCl 1,75%
Ditimbang 17,5 g NaOCl(s), kemudian dilarutkan dengan akuades di dalam labu takar 1
liter, dan diencerkan hingga garis tanda.
3.2.2.4. Pembuatan larutan NaOCl 2,5%
Ditimbang 25 g NaOCl(s), kemudian dilarutkan dengan akuades di dalam labu takar 1
liter, dan diencerkan hingga garis tanda.
3.2.2.5. Pembuatan larutan Na2SO3 2%
Ditimbang 20 g Na2SO3(s), kemudian dilarutkan dengan akuades di dalam labu takar 1
3.2.2.6. Pembuatan larutan (NH4)2C2O4 0,5%
Ditimbang 5 g (NH4)2C2O4(s), kemudian dilarutkan dengan akuades di dalam labu
takar 1 liter dan diencerkan dengan aquadest sampai garis tanda.
3.2.2.7. Pembuatan larutan HCl 0,05 N
Dipipet 4,2 mL HCl(aq), kemudian dilarutkan dengan akuades di dalam labu takar 1
liter dan diencerkan dengan aquadest sampai garis tanda.
3.2.3. Pembuatan Stater Selulosa Bakteri
Media kultur untuk produksi selulosa bakteri, setiap liter dari air kelapa tua
ditambahkan 3 g urea, 10 g gula pasir, dan 10 mL air kelapa muda. Media kultur ini
dimasak diatas kompor hingga mendidih, setelah itu didinginkan hingga temperatur
kamar. Keasaman dari media diatur menjadi pH=4 dengan menambahkan CH3COOH
glasial. Bibit dari bakteri Acetobacter xylinum diinokulasi ke dalam media kultur statis
selama 7 hari pada temperatur 28oC dalam botol kaca yang telah disterilisasi.
3.2.4. Penumbuhan Gel Selulosa Bakteri (Nata de coco)
Media kultur untuk produksi selulosa bakteri, setiap liter dari air kelapa tua
ditambahkan 3 g urea, 10 g gula pasir, dan 10 mL air kelapa muda. Media kultur ini
dimasak di atas kompor hingga mendidih, setelah itu didinginkan hingga temperatur
kamar. Keasaman dari media diatur menjadi pH=4 dengan menambahkan CH3COOH
glasial. Bibit dari bakteri Acetobacter xylinum diinokulasi ke dalam media kultur statis
selama 14 hari pada temperatur 28oC dalam media kaca 20cm x 20cm yang telah
disterilisasi.
3.2.5. Purifikasi Gel Selulosa Bakteri
Setelah dihasilkan beberapa gel selulosa bakteri, dibiarkan dalam saringan untuk
26
Gel yang ada dicuci dengan air keran yang mengalir , kemudian gel tersebut direndam
selama 1 malam dengan NaOH 2,5 %, setelah itu direndam dengan NaOCl 2,5 %.
Setelah itu, gel selulosa bakteri dicuci dengan air keran untuk menghilangkan pelarut
yang ada hingga pH mencapai kondisi netral (Gea, et. al, 2007).
3.2.6. Desintegrasi Gel Selulosa bakteri
Disintegrasi gel selulosa bakteri dilakukan dengan cara memotong-motong gel
selulosa bakteri (nata de coco), kemudian dihaluskan dengan blender. Ditentukan
kadar air dari gel selulosa bakteri.
3.2.7. Preparasi Kulit Jeruk
Kulit jeruk dibersihkan dengan air. Dikeringkan di bawah sinar matahari sampai
kering. Kemudian dihaluskan dengan blender 3 menit hingga menjadi serbuk halus.
3.2.8. Isolasi Selulosa dari Kulit Jeruk
Serbuk kulit jeruk 40 g diekstraksi dengan larutan azeotrope kloroform-heksana
(72:28) pada suhu 69oC selama 10 jam dalam alat soklet (Bicu et. al., 2011).
Kemudian diekstraksi dengan air panas pada suhu 60oC selama 4 jam, (NH4)2C2O4
0,5% pada suhu 80oC selama 4 jam, dan larutan HCl 0,05 N pada suhu 80oC selama 2
jam (Habibi et. al., 2008). Setelah itu disaring dan ampas dicuci hingga filtrat netral.
Selanjutnya didigesti dengan 300 mL larutan yang mengandung NaOH 2% dan
Na2SO3 2% pada suhu 50oC selama 1 jam. Kemudian disaring dan ampas dicuci
sampai netral. Selanjutnya dilakukan pemutihan dengan 250 mL larutan NaOCl 1,75%
pada temperatur mendidih selama 0,5 jam. Kemudian disaring dan ampas dicuci
sampai pH filtrat netral. Setelah itu, dilakukan pemurnian selulosa dari sampel dengan
500 mL larutan NaOH 17,5% pada suhu 80oC selama 0,5 jam. Kemudian disaring,
dicuci hingga filtrat netral. Dilanjutkan dengan pemutihan dengan NaOCl 1,75% pada
suhu 60oC selama 5 menit (Harahap, 2012). Ditentukan kadar air dari selulosa yang
3.2.9. Pencampuran Selulosa Bakteri dengan Selulosa dari Kulit Jeruk
Pembuatan Nanokertas dilakukan dengan pencampuran selulosa bakteri dan selulosa
yang diisolasi dari kulit jeruk dengan perbandingan A(100:0%), B(80:20%),
C(60:40%), D(50:50%) dan E(0:100%) berdasarkan perhitungan berat keringnya.
Campuran tersebut diaduk selama 2 jam kemudian disaring dan ditempatkan diatas
plat cetakan. Campuran yang telah dicetak dijemur selama 2 hari.
Berat teoritis setiap formulasi adalah 1 g, dengan penambahan carboxyl cethyl
cellulose (CMC) sebayak 0,2 g pada setiap formula. Perbandingan Selulosa bakteri :
selulosa kulit jeruk masing-masing formulasi adalah :
Formula A = (100 : 0%)
Kadar air selulosa bakteri (SB)
Pengujian kadar air dilakukan dengan metode gravimetri dimana sampel dipanaskan
pada suhu 110oC selama 2 jam dan didinginkan didalam desikator. Kemudian
ditimbang hingga berat sampel konstan. Berikut persamaan penentuan kadar air :
% Kadar air= x 100 %...(3.1)
Berdasarkan persamaan diatas, diperoleh kadar air sebesar 95,47 %, dan kadar
selulosa didalam selulosa bakteri sebesar 4,53 %.
Kadar air selulosa kulit jeruk (KJ)
Dengan perlakuan yang sama dengan selulosa bakteri, diperoleh kadar air dalam
selulosa kulit jeruk sebesar 94,37 %, dan kadar selulosa didalam kulit jeruk sebesar
28
Berdasarkan perhitungan terhadap berat kering masing- masing sampel, maka
massa sampel pada perbandingan selulosa bakteri yang telah dihaluskan dengan
selulosa kulit jeruk; A(100:0 %), B(80:20 %), C(60:40 %), D(50:50 %) dan E(0:100
%) ditunjukkan pada Tabel 3.1 di bawah ini.
No. Komposisi Nanokertas (%)
Massa BC (g)
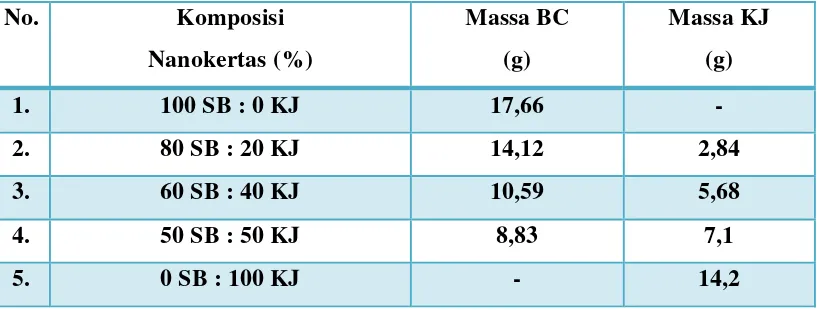
Massa KJ (g) 1. 100 SB : 0 KJ 17,66 - 2. 80 SB : 20 KJ 14,12 2,84 3. 60 SB : 40 KJ 10,59 5,68 4. 50 SB : 50 KJ 8,83 7,1
5. 0 SB : 100 KJ - 14,2
3.3. Parameter yang diamati 3.3.1. Penentuan kadar air
Pengujian kadar air dilakukan dengan metode gravimetri dimana sampel nanokertas
dipanaskan pada suhu 110oC didalam oven selama 2 jam dan didinginkan didalam
desikator. Kemudian nanokertas ditimbang hingga berat sampel konstan. Dihitung %
kadar air dengan persamaan (3.1).
3.3.2. Uji Morfologi
Nanokertas yang telah dicetak, diamati dengan pengamatan mikroskopik
menggunakan SEM diawali dengan merekatkan sampel dengan stab yang terbuat dari
logam spesimen older. Kemudian setelah sampel dibersihkan dengan alat peniup,
sampel dilapisi dengan emas dan palladium dalam mesin dionspater yang bertekanan
1492 x 10-2 atm. Sampel selanjutnya dimasukkan ke dalam ruangan yang khusus dan
kemudian disinari dengan pancaran elektron bertenaga 15 kV sehingga sampel
mengeluarkan elektron sekunder dan elektron terpental yang dapat dideteksi dan
detektor scientor yang kemudian diperkuat dengan suatu rangkaian listrik yang
menyebabkan timbulnya gambar chatode ray tube (CRT). Pemotretan dilakukan
setelah memilih bagian tertentu dari objek (sampel) dan perbesaran yang diinginkan
sehingga diperoleh foto yang baik dan jelas.
3.3.3.Uji Tensil
Uji tensil dilakukan dengan menggunakan mesin Instron Gotech Al-7000M untuk
mengukur modulus elastisitas dan kemuluran. Sebelum uji dilakukan, sampel
disiapkan dengan panjang dan tebal sampel sekitar 50,0 mm dan 15 mm. Kedua sisi
nanokertas dijepit pada alat untuk ditarik oleh beban yang ditentukan massanya.
Kecepatan pengukuran 1 mm/menit dan dilakukan pengujian sebanyak tiga kali untuk
30
3.3.4. Uji Ketahanan Termal
Karakterisasi ini menggunakan metode Thermogravimetri yang dilakukan dengan
Perkin Elmer Pyris TGA 7, kecepatan scan 20 oC /min dalam jarak temperatur 20-800
o
C. Sampel tersebut diuji di bawah aliran gas nitrogen. Uji ini digunakan untuk
3.4. Bagan Penelitian
3.4.1. Pembuatan Stater Selulosa Bakteri
Disaring
Dimasukkan kedalam panci
Ditambahkan 6 g urea
Ditambahkan 20 g gula pasir
Ditambahkan 20 mL air kelapa muda
Dipanaskan sambil diaduk hingga larut
Didinginkan
Ditambahkan CH3COOH glacial
hingga pH=4
Dimasukkan kedalam 10 botol kaca yang telah disterilisasi
Ditambahkan 200 mL stater
bakteri Acetobacter xylinum
Diinokulasi pada temperatur 28oC selama 8 hari
2 liter air kelapa tua
Residu Filtrat
Media selulosa bakteri
32
3.4.2 Pembuatan Selulosa bakteri (Nata de coco)
Disaring
Dimasukkan kedalam panci
Ditambahkan 3 g urea
Ditambahkan 10 g gula pasir
Ditambahkan 10 mL air kelapa muda
Dipanaskan sambil diaduk hingga larut
Didinginkan
Ditambahkan CH3COOH glacial
hingga pH=4
Dimasukkan kedalam media kaca 20 cm x 20 cm yang telah disterilisasi
Ditambahkan 100 mL stater
bakteri Acetobacter xylinum
Diinokulasi pada temperatur 28oC selama 14 hari
1 liter air kelapa tua
Residu Filtrat
Media selulosa bakteri
3.4.3 Purifikasi dan Disintegrasi Selulosa Bakteri
Dicuci dengan air
Direndam dengan 2,5% NaOH selama 1 malam
Direndam dengan 2,5% NaOCl selama 1 malam
Dicuci dengan air kembali
Dihaluskan dengan blender
Dihitung % kadar airnya Gel selulosa bakteri
34
3.4.4 Isolasi Selulosa dari Kulit Jeruk Keprok
Dibungkus dalam kertas saring
Diekstraksi dengan larutan azeotrope kloroform-heksana (72:28) pada suhu 69oC selama 10 jam dalam alat soklet (Bicu et. al., 2011)
Diekstraksi dengan air panas pada suhu 60oC selama 4 jam Disaring dan dicuci hingga filtrat netral
Diekstraksi dengan (NH4)2C2O4 0,5% pada suhu 60oC
selama 4 jam
Disaring dan dicuci hingga filtrat netral
Diekstraksi dengan HCl0,05 N pada suhu 80oC selama 2 jam Disaring dan dicuci hingga filtrat netral (Habibi et. al., 2008)
Didigesti dengan 750 mL larutan yang mengandung NaOH 2% dan Na2SO3 2% pada suhu 50o selama 1 jam
Disaring dan dicuci hingga filtrat netral
Diputihkan dengan 250 mL larutan NaOCl 1,75% pada suhu mendidih selama 0,5 jam
Disaring dan dicuci benar-benar dengan aquadest (Harahap, 2012) Dihitung % kadar airnya
40 g Serbuk Kulit Jeruk Keprok
3.4.5 Pencampuran Selulosa Bakteri yang telah dihaluskan dengan Selulosa yang diisolasi dari Kulit Jeruk
Dicampurkan kedua bahan berdasarkan berat keringnya dengan perbandingan
A(100 SB:0 KJ), B(80 SB:20 KJ), C(60
SB:40 KJ), D(50 SB:50 KJ) dan E(0
SB:100 KJ)
Distirer selama 2 jam hingga homogen
Dicetak diatas plat cetakan dan dijemur
selama 2 hari Selulosa bakteri yang telah
dihaluskan
Selulosa yang diisolasi dari
kulit jeruk
Nanokertas (selulosa bakteri + selulosa kulit jeruk + CMC)
Uji Kadar air Uji Morfologi
(SEM)
Uji Termal Uji Tensil CMC
36
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Penentuan kadar air
Berdasarkan dari hasil penelitian, diperoleh kadar air dari masing-masing komponen
penyusun nanokertas adalah sebagai berikut :
No. Bahan Kadar Air (%) Kadar Selulosa (%) 1. Selulosa Bakteri 95,47 4,53
2. Selulosa Kulit Jeruk 94,37 5,63
Selulosa bakteri (SB) dan selulosa yang diisolasi dari kulit jeruk (KJ) digunakan
sebagai bahan baku pembuatan nanokertas. Setelah proses pencampuran keduanya,
kemudian diuji kembali kadar airnya. Berikut disajikan kadar air Nanokertas pada
Tabel 4.2.
No. Komposisi Nanokertas (%) Kadar Air (%)
1. 100 SB : 0 KJ 7,142
2. 80 SB : 20 KJ 6,667
3. 60 SB : 40 KJ 7,692
4. 50 SB : 50 KJ 7,142
5. 0 SB : 100 KJ 7,692
Tabel 4.1. Kadar Air Bahan Penyusun Nanokertas
4.1.2. Pengujian Mekanik
Uji mekanik yang dilakukan adalah uji tarik atau tensil dengan menggunakan alat
Tensil Gotech Al-7000M dengan berat beban 2000 kgf. Uji tensil dilakukan untuk
mengetahui besar kekuatan nanokertas berdasarkan modulus Young’s yang diperoleh.
Kurva strain-stress yang dihasilkan terlihat pada Gambar 4.2 dibawah ini. Dari hasil
yang diperoleh, nanokertas (50 SB:50 KJ) adalah nanokertas yang memiliki kekuatan
tarik paling baik dengan besar modulus Young’s tertinggi yaitu sebesar 1,4 GPa.
Berikut disajikan kurva strain-stress nanokertas pada Gambar 4.2.
0,00 0,02 0,04 0,06 0,08 0,10
0 10 20 30
stress(MPa
)
strain(-)
50 SB:50 KJ
60 SB:40 KJ
80 SB:20 KJ
100 SB:0KJ
38
4.1.3. Pengujian Degradasi Termal
Uji degradasi terhadap termal dilakukan dengan alat termogravimetry analysis (TGA)
yang bertujuan untuk mengetahui perubahan massa nanokertas terhadap kenaikan
temperatur. Uji ini juga memberikan informasi terhadap hasil dekomposisi termal atau
massa residu yang dihasilkan. Pengujian degradasi termal ini dilakukan dengan besar
aliran gas nitrogen 15 ml/s, kenaikan temperatur 20 oC/s, dan menggunakan massa
sampel 20 mg untuk setiap variasi nanokertas. Kurva perubahan massa nanokertas
terhadap kenaikan temperatur disajikan pada Gambar 4.2. di bawah ini.
0 100 200 300 400 500 600
4.1.4. Pengujian Morfologi
Analisa permukaan dilakukan dengan Instrumen SEM JSM-6360 setelah memilih
bagian tertentu dari objek (sampel) yang tampak lebih homogen dan perbesaran yang
diinginkan agar diperoleh foto yang baik dan jelas. Nanokertas disinari dengan
pancaran elektron bertenaga 15 kV dengan perbesaran hingga 5000 kali.
Dari hasil yang diperoleh, uji morfologi dengan menggunakan alat SEM
menunjukkan bahwa nanokertas yang dihasilkan memenuhi kriteria dari
nanoteknologi sebagaimana yang terlihat pada Gambar 4.3. Nanoteknologi adalah
kemampuan suatu material bekerja pada skala 1-100 nm, dimana penggunaan
setidaknya salah satu ataupun keseluruhan komponen penyusun komposit berdimensi
nanometer. Dari gambar yang diperoleh, nanokertas (50 SB:50 KJ) yang dihasilkan
memenuhi dari kriteria nanoteknologi dengan perbesaran sebanyak 5000 kali. Gambar
hasil analisa morfologi menunjukkan bahwa besar diameter serat nanokertas berkisar
50 hingga 100 nm. Berikut disajikan Gambar 4.3. di bawah ini.
40
4.2. Pembahasan
4.2.1. Selulosa bakteri (SB)
Pembiakan bakteri Acetobacter xylinum dilakukan pada medium kultur air kelapa
yang telah dimasak dengan penambahan urea, air kelapa muda dan gula pasir sebagai
penambah nutrisi dari air kelapa. Penambahan air kelapa muda disini bertujuan untuk
memberikan jumlah vitamin untuk pertumbuhan bakteri. Penambahan CH3COOH
glasial dilakukan untuk menyesuaikan pH air kelapa yaitu pH 4. pH tersebut
merupakan kondisi optimal bagi pertumbuhan bakteri Acetobacter xylinum
(Pambayun, 2002). Pembuatan selulosa bakteri dilakukan dengan penambahan bibit
bakteri Acetobacter xylinum pada wadah steril dengan proses inokulasi selama 14 hari
yang bertujuan untuk menghasilkan selulosa bakteri yang optimal.
Selulosa bakteri yang dihasilkan, dipurifikasi dengan NaOH 2,5% dan NaOCl
2,5% untuk menghilangkan komponen organik bukan selulosa pada selulosa bakteri
seperti asam nukleat dan protein sisa dari kultur medium (Gea et. al., 2007). Selulosa
bakteri yang diperoleh mengandung 4,53 % selulosa.
4.2.2. Selulosa dari Kulit Jeruk (KJ)
Isolasi selulosa dari kulit jeruk dilakukan dengan mengekstraksi serbuk halus kulit
jeruk dengan menggunakan pelarut kloroform-heksana dengan perbandingan (72:28)
(Bicu et. al., 2011). Tahap ini dilakukan untuk memisahkan komponen bukanselulosa
dari kulit jeruk seperti lemak, resin, minyak, lilin, dan zat pewarna yang disebut
dengan fraksi larut lemak (liposoluble). Residu yang diperoleh diekstraksi kembali
dengan air panas, (NH4)2C2O4 0,5%, dan HCl0,05N untuk menghilangkan komposisi
pektin yang terkandung dalam kulit jeruk (Habibi et. al., 2008). Delignifikasi kulit
jeruk dilakukan dengan proses digesti menggunakan larutan NaOH 2% dan Na2SO3 2
%. Proses pemutihan pulp dilakukan dengan penambahan NaOCl 1,75% sehingga
derajat keputihan pulp naik tajam. Penambahan NaOH 17,5% digunakan untuk
mengendapkan selulosa sebelum diputihkan kembali kedua kalinya dengan NaOCl
1,75% (Harahap, 2012). Dari penelitian yang dilakukan, diperoleh selulosa kulit jeruk
dengan kadar selulosa 5,63 %.
4.2.3. Hasil Nanokertas
Dalam penelitian ini, selulosa bakteri yang telah diblender selama 20 menit
dicampurkan dengan selulosa yang telah diisolasi dari kulit jeruk dengan
menggunakan magnetik stirer selama 3 jam. Hal ini dilakukan agar kedua material
tersebut membentuk campuran yang merata dengan baik. Campuran yang diperoleh,
diperas untuk menghilangkan kandungan airnya dengan menggunakan wire mesh
untuk mempercepat waktu pengeringan. Setelah itu, campuran dicetak dan
dikeringkan selama 2 hari.
42
4.2.4. Hasil Pengujian Mekanik
Uji mekanik yang dilakukan adalah uji tarik yang bertujuan untuk mengetahui
peningkatan kekuatan nanokertas dari campuran selulosa bakteri (SB) dengan selulosa
dari kulit jeruk (KJ). Dari pengolahan data yang diperoleh, dihasilkan Modulus
Young’s dari masing-masing nanokertas yang disajikan pada Tabel 4.3.
No. Komposisi
Berdasarkan besar Modulus Young’s yang diperoleh, bahwa nanokertas dengan
perbandingan (50 SB:50 KJ) memiliki kekuatan tarik yang paling besar dibandingkan
dengan nanokertas dengan perbandingan komposisi lainnya. Hal ini diduga bahwa
terjadi interaksi antara selulosa bakteri (SB) dengan selulosa dari kulit jeruk (KJ),
dimana celah serat dari selulosa bakteri diduga diisi oleh selulosa dari kulit jeruk (KJ)
sehingga menghasilkan perpaduan yang lebih padat.
Berdasarkan penjelasan diatas diduga bahwa selulosa bakteri berperan sebagai
matriks dan selulosa yang diisolasi dari kulit jeruk berperan sebagai Filler. Dari data
yang diperoleh, terlihat bahwa semakin meningkatnya komposisi dari selulosa kulit
jeruk (KJ) yang ditambahkan pada nanokertas, maka kekuatan kertas semakin
meningkat sebagaimana terlihat dengan meningkatnya nilai modulus Young’s,
sehingga diduga kulit jeruk berperan sebagai bahan penguat pada nanokertas yang
dihasilkan.
4.2.5. Hasil Pengujian Degradasi Termal
Uji degradasi termal dilakukan untuk mengetahui perbandingan besar kehilangan
massa nanokertas terhadap meningkatnya temperatur. Kurva yang terlihat pada
Gambar 4.2. menunjukkan bahwa ketiga sampel yang diuji memberikan kurva
perubahan massa yang hampir sama, dimana perubahan massa yang terjadi dipisahkan
menjadi 3 bagian.
Bagian pertama, yaitu bagian yang menunjukkan terjadinya kehilangan massa
akibat penguapan air dan kehilangan komponen oraganik seperti protein pada
temperatur 50oC sampai 220oC. Bagian kedua, yaitu bagian yang menunjukkan
terjadinya kehilangan massa yang sangat tajam akibat dekomposisi termal pada
temperatur 220oC hingga 380oC. Bagian terakhir, yaitu pada temperatur 380oC hingga
500oC mungkin terjadi proses karbonisasi dari selulosa yang meningkatkan proses
dari degradasi termal. Nanokertas (50 SB:50 KJ) menunjukkan kurva yang berada
diantara selulosa bakteri (SB) dan selulosa yang diisolasi kulit jeruk (KJ). Berikut
disajikan hasil residu degradasi termal pada Tabel 4.4. di bawah ini.
No. Komposisi nanokertas
Analisa permukaan terhadap nanokertas dilakukan untuk mengamati dan mengukur
diameter serat dari nanokertas dengan menggunakan alat SEM Selulosa yang diisolasi
dari kulit jeruk menunjukkan permukaan yang lebih merata dengan memiliki diameter
serat yang berukuran mikrometer. Berikut disajikan hasil SEM dari selulosa yang
diisolasi dari kulit jeruk pada Gambar 4.6. di bawah ini.
44
Dari gambar yang diperoleh dengan menggunakan alat SEM, selulosa bakteri
menunjukkan permukaan dengan celah serat yang tampak lebih teratur dan halus.
Berikut disajikan gambar hasil SEM dari selulosa bakteri pada Gambar 4.7 di bawah
ini.
Gambar 4.6 Hasil SEM Mikrokertas (0 SB:100 KJ)
Dari gambar yang dihasilkan, terlihat bahwa nanokertas dengan komposisi (50
SB:50 KJ) menunjukkan serat yang tampak lebih padat setelah penggabungan kedua
komponen penyusunnya. Dari gambar yang dihasilkan, diduga bahwa celah selulosa
bakteri (SB) yang tampak teratur dan halus sebagaimana terlihat pada Gambar 4.7.
diisi oleh selulosa dari kulit jeruk (KJ) yang lebih merata, sehingga perpaduan dari
kedua komponen tersebut menyebabkan serat nanokertas tampak lebih padat. Berikut
disajikan pada Gambar 4.8. di bawah ini.
Gambar 4.8. Hasil SEM Nanokertas (50 SB:50 KJ)
46
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang diperoleh bahwa :
Nanokertas yang dihasilkan dari pencampuran selulosa bakteri dan selulosa kulit jeruk dengan perbandingan komposisi (50 SB:50 KJ) merupakan
nanokertas dengan kualitas terbaik dan memenuhi kriteria dari nanoteknologi,
karena memiliki diameter serat 50-100 nm sebagaimana terlihat pada analisa
morfologi.
Dari hasil penelitian bahwa limbah kulit jeruk dan air kelapa tua dapat
dimanfaatkan sebagai material baru untuk pembuatan kertas konvensional
sebagai alternatif penanganan limbah.
Dari hasil penelitian, bahwa nanokertas dari pencampuran selulosa bakteri dan selulosa kulit jeruk layak digunakan sebagai material pembuatan nanokertas
berdasarkan dari hasil uji tarik dimana, besar modulus Young’s yaitu sebesar
1,4 GPa dengan kadar air 7,412 %, dan massa residu pada nanokertas (50
SB:50 KJ) sebesar 3,05 mg, dimana ketahanan termal nanokertas berada di
antara kedua material penyusunnya yaitu selulosa bakteri dan selulosa yang
diisolasi dari kulit jeruk.
5.2. Saran
Berdasarkan hasil penelitian disarankan untuk membuat nanokertas dengan
memanfaatkan material lainnya seperti kulit terong belanda, atau tandan kosong
kelapa sawit sehingga ada alternatif terbaharukan untuk penanganan limbah dan
mengurangi penebangan hutan.
DAFTAR PUSTAKA
AAK. 1994. Budidaya Tanaman Jeruk. Yogyakarta: Kanisius.
Ashari, S. 1995. Holtikultura Aspek Budidaya. Jakarta : UI-Press.
Aspinall, G. O. 1983. The Polysaccharides Molecular Biology an International Series of Monographs and Textbooks.Volume 2. First Edition. Orlando : Academic Press,Inc.
Banwart, J. G. 1981. Basic Food Microbiology. New York : Van Nostrand Reinhold Company.
Bhatnagar, M. S. 2004. A textbook of polymer (Chemistry and Technology of Polymer): processing and applications. Volume II. NewDelhi : S. Chan & Company, Ltd.
Bielecki, S., Krystynowicz, A., Turkiewicz, M., Kalinowska, H.2004. Bacterial Sellulose. In: Polysaccharides I: Polysaccharides from prokaryotes.
Biopolymers. Volume 5. Weinheim: Wiley-Vch.
Bicu, I., Mustafa, F. 2011. Cellulose Extraction from Orange Peel using Sulfite Digestion Reagents. Bioresource Technology. 102, 10013-10019.
Boccuni, F., Rondinone, B., Petyx, C., Iavicoli, S. 2008. Potential occupational exposure to manufactured nanoparticles in Italy. Journal of Cleaner Production. 16, 949–956.
Brown, R. M., Saxena, I. M. 2007. Cellulose : Molecular and Structural Biology Selected Articles on the Synthesis, Structure, and Applications of Cellulose. Netherlands: Springer.
Budiyanto, K. A. 2004. Mikrobiologi Terapan. Edisi Pertama. Cetakan Ketiga. Malang: UMM Press.
Candanedo, B., Roman, M., Gray, D.G.. 2005. Effect of reaction conditions on the properties and behavior of wood cellulose nanocrystal suspensions.
Biomacromolecules. 6, 1048-54.
Chawla, P. R., Bajaj, I. S., Survase, S. A., Singhal, R. S. 2008. Microbial Cellulose: Fermentative Production and Applications. Food Technology Biotechnology. 47, 107–124.