POTENSI NANOPROPOLIS
Trigona
spp ASAL BUKITTINGGI
SEBAGAI PEMACU PERTUMBUHAN PADA
TIKUS PUTIH (
Sprague-Dawley
)
VITA ROSALINE FAHRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
VITA ROSALINE FAHRI. Potensi Nanopropolis
Trigona
spp Asal Bukittinggi
sebagai Pemacu Pertumbuhan pada Tikus Putih (
Sprague-Dawley
). Dibimbing
oleh AE ZAINAL HASAN dan I MADE ARTIKA.
Bahan-bahan yang umumnya dapat digunakan sebagai pemacu
pertumbuhan pada hewan ternak antara lain antibiotik, hormon, probiotik,
prebiotik, dan imunomodulator. Penggunaan antibiotik sebagai pemacu
pertumbuhan, dapat menimbulkan residu antibiotik dan resistensi mikrob. Solusi
alternatif adalah pemakaian antibakteri alami seperti propolis. Penelitian ini
bertujuan menentukan potensi nanopropolis
Trigona
spp asal Bukittinggi sebagai
Growth Promoter
secara
in vivo
pada tikus jantan
Sprague-Dawley
. Propolis
nanopartikel dibuat dengan teknik homogenisasi kecepatan tinggi disertai
penyalutan menggunakan maltodektrin dengan teknik penguapan pelarut. Ukuran
nanopropolis dianalisis dengan SEM. Pengamatan
in vivo
dilakukan dengan
mengamati bobot badan tikus dan menghitung jumlah
Escherichia coli
feses dan
usus menggunakan metode cawan sebar. Hasil SEM menunjukkan adanya ukuran
nanopropolis sebesar 100 nm. Potensi
Growth Promoter
tertinggi dilihat dari
persentase pertumbuhan badan tikus. Persentase tertinggi dicapai oleh
nanopropolis 2% dibandingkan kontrol positif dengan efektivitas nanopropolis 2%
sebesar 109% terhadap kontrol positif. Persentase pertumbuhan perlakuan
nanopropolis 2% 100 mg/KgBB, kontrol positif (ampisilin 250 mg/KgBB),
nanopropolis 1% 100 mg/KgBB,
raw
propolis 100 mg/KgBB, dan standar adalah
34,62%, 23,39%, 12,5%, 10,92%, dan 2,24%. Jumlah
E. coli
pada feses yang
paling stabil adalah perlakuan nanopropolis 2%.
ABSTRACT
VITA ROSALINE FAHRI. Potency of
Trigona
spp Nanopropolis from
Bukittinggi as Growth Promoter on White Rats (Sprague-Dawley). Under the
direction of AE ZAINAL HASAN and I MADE ARTIKA.
POTENSI NANOPROPOLIS
Trigona
spp ASAL BUKITTINGGI
SEBAGAI PEMACU PERTUMBUHAN PADA
TIKUS PUTIH (
Sprague-Dawley
)
VITA ROSALINE FAHRI
Skripsi
Sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Potensi Nanopropolis
Trigona
spp Asal Bukittinggi sebagai Pemacu
Pertumbuhan pada Tikus Putih (
Sprague-Dawley
)
Nama
: Vita Rosaline Fahri
NIM
: G84053417
Disetujui
Komisi Pembimbing
Ir. H. A.E. Zainal Hasan, M.Si Dr. Ir. I Made Artika, M.App.Sc
Ketua Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala nikmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul
Potensi Nanopropolis
Trigona
Spp Asal Bukittinggi sebagai Antibakteri untuk
Pemacu Pertumbuhan pada Tikus Putih (
Sprague-dawley
). Penelitian ini
dilaksanakan dari bulan Maret sampai dengan Juni 2009 di Laboratorium
Departemen Biokimia IPB. Penelitian ini terlaksana berkat bantuan dana dari Ir.
H.A.E. Zainal Hasan, M.Si dan Dr. Ir. I Made Artika, M.App.Sc. sebagai bagian
dari proyek penelitian tentang eksplorasi bahan alam antibiotika (propolis).
Terima kasih penulis sampaikan kepada Ir. H.A.E. Zainal Hasan, M.Si dan
Dr. Ir. I Made Artika, M.App.Sc atas bimbingan, pengarahan, dan saran-saran
yang diberikan dalam penulisan skripsi ini. Terima kasih kepada mba Desy K
Halim dan ka Dedy atas semangat dan dukungannya baik secara moril maupun
materil, dan seluruh staf laboratorium Biokimia (Pak Arya, Pak Yadi, Pak Nana,
Ibu Is, Ibu Mery, Ibu Tuti) atas kenangan indah kepada penulis selama penelitian.
Di samping itu, terima kasih penulis ucapkan kepada teman seperjuangan di lab
Biokimia (Olga, Saiful, Riza, Tanti, Rei, Puspa, Mira, Dini, Isty, dan Novan) yang
selalu memberi dukungan, perhatian, dan semangatnya. Terima kasih juga penulis
sampaikan kepada teman satu perjuangan Biokimia angkatan 2005 atas
kebersamaannya selama ini.
Penghargaan tertinggi penulis sampaikan kepada keluarga (Mama, Papa,
Irvan, Alamanda, dan Galang SA) tercinta atas perhatian, kasih sayang, semangat,
dan doanya. Semoga karya ilmiah ini bermanfaat bagi para pembaca dan ilmu
pengetahuan khususnya di bidang Biokimia.
Bogor, September 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 21 Februari 1987 dari
ayahanda Fahri dan ibunda Iis Kurniasih. Penulis merupakan putri pertama dari
tiga bersaudara. Tahun 2005 penulis lulus dari SMU Negeri 2 Bandar Lampung
dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur
Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Departemen Biokimia,
Fakultas matematika dan Ilmu pengetahuan Alam (FMIPA).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah Madu
Trigona
spp ... 2
Propolis ... 2
Pemacu Pertumbuhan (
Growth Promoter
) ... 4
Tikus sebagai Hewan Coba ... 4
Escherichia coli
... 4
Nanopartikel ... 5
BAHAN DAN METODE
Alat dan Bahan ... 5
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Nanopropolis ... 7
Kondisi Fisik dan Bobot Badan Hewan Coba (Pertumbuhan) ... 10
Analisis Antibakteri Metode TPC ... 12
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ... 15
DAFTAR GAMBAR
Halaman
1
Trigona
spp ... 2
2 Propolis dalam sarang lebah. ... 3
3 Hasil serbuk nanopropolis 1% dan 2% ... 9
4 Morfologi SEM nanopropolis 1% ... 9
5 Morfologi SEM nanopropolis 2% ... 10
6 Morfologi maltodekstrin perbesaran 200x (Anwar 2004) ... 10
7 Kondisi tikus. a) masa adaptasi dan b) masa akhir perlakuan ... 10
8 Bobot badan tikus masa adaptasi ... 11
9 Bobot badan tikus masa perlakuan ... 11
10 Jumlah
Escherichia coli
feses selama masa perlakuan ... 13
11 Jumlah
Escherichia coli
usus pada akhir perlakuan ... 15
DAFTAR LAMPIRAN
Halaman
1 Tahap Penelitian ... 19
2 Tahap ekstraksi propolis ... 20
3 Tahap pembuatan nanopropolis 2% ... 20
4 Rancangan percobaan hewan uji ... 21
5 Dosis pencekokan ... 22
6 Bobot badan tikus selama perlakuan ... 23
7 Hasil uji Anova pertumbuhan tikus menggunakan SAS ... 24
8 Jumlah sel
Escherichia coli
feses metode hitungan cawan ... 24
9 Hasil uji Anova jumlah
E.coli
feses masa perlakuan menggunakan SAS .... 25
10 Jumlah sel
E.coli
usus pada minggu akhir perlakuan metode TPC ... 25
11 Contoh hasil hitungan antibakteri metode cawan sebar ... 26
12 Profil tikus penelitian ... 26
PENDAHULUAN
Bagian dari saluran pencernaan yang paling banyak dihuni oleh bakteri adalah saluran usus. Bakteri dalam usus tidak hanya bersifat menguntungkan, tetapi ada juga yang bersifat merugikan, dan oportunistik. Bakteri menguntungkan karena dapat menjaga kesehatan dengan membantu pencernaan sedangkan bakteri merugikan bersifat patogen dengan menghasilkan kebusukan pada usus dan menghasilkan zat-zat yang bersifat karsinogen. Bakteri golongan oportunistik memiliki sifat apabila ada dalam saluran pencernaan pada jumlah yang melebihi batas maksimal akan menyebabkan timbulnya gangguan pada kesehatan saluran pencernaan. Bakteri yang masuk dalam golongan ini adalah Escherichia coli dan Streptococcus (Mitsuoka 1989, diacu dalam dalam Pertiwi 2008). Gangguan kesehatan saluran pencernaan ini juga mengakibatkan terhambatnya pertumbuhan.
Pemacu pertumbuhan adalah zat aditif yang ditambahkan ke dalam pakan ternak untuk mempercepat pertumbuhan dan meningkatkan produktivitas ternak. Senyawa antibiotik yang biasa digunakan sebagai pemacu pertumbuhan sebenarnya merupakan obat untuk membunuh atau menghambat pertumbuhan bakteri. Dalam bidang peternakan, beberapa senyawa antibiotik digunakan dalam peternakan pada dosis subterapi sebagai bahan pemacu pertumbuhan (Antibiotic Growth Promoters= AGPs). Pemacu pertumbuhan ini akan meningkatkan efisiensi pencernaan makanan pada hewan sehingga pertumbuhannya cepat (Fatoni 2008).
Adanya resistensi mikrob dan residu antibiotik pada produk ternak akibat penggunaan antibiotik telah mengilhami pencarian produk alternatif pengganti antibiotik. Resistensi bakteri ini sulit untuk ditangani. Strain bakteri yang telah ditemukan resisten terhadap antibiotik meliputi Salmonella spp, E.coli, dan Campylobacter spp (Evans dan Wegener 2003). Propolis merupakan alternatif baru obat yang dapat digunakan sebagai antibiotik alami. Kandungan antibakteri dalam propolis menyebabkan propolis dapat digunakan sebagai pemacu pertumbuhan baik pada manusia ataupun ternak. Propolis yang dihasilkan oleh lebah madu Trigona spp terbukti mampu berperan sebagai agen antibakteri pada Bacillus subtilis, Staphylococcus aureus, Escherichia coli, dan
Pseudomonas aeruginosa (Anggraini 2006). Oleh karena itu, dalam penelitian ini diharapkan propolis dapat dijadikan pemacu pertumbuhan (Growth Promoter) pada tikus putih Sprague Dawley sebagai hewan model untuk tujuan manusia.
Kandungan kimia propolis bergantung pada tumbuhan di sekitarnya, musim pengambilan, dan letak geografis tempat pengambilan. Sarang lebah sebagai sumber propolis dalam penelitian ini merupakan sarang lebah Trigona spp yang diperoleh dari daerah Bukittinggi Sumatera Barat. Fatoni (2008) menyatakan bahwa ekstrak propolis Bukittinggi pada konsentrasi 2,03% dapat menghambat bakteri patogen seperti E.coli. Penelitian yang dilakukan oleh Hasan (2006) menunjukkan bahwa propolis hasil ekstrak etanol 70% dapat digunakan sebagai senyawa antibakteri baik bakteri Gram positif (Staphylococcus aureus dan Bacillus subtilis) maupun bakteri Gram negatif (Escherichia coli).
Nanopartikel merupakan salah satu hasil teknologi nano baru yang makin pesat perkembangannya. Teknologi nano ini sudah banyak digunakan dalam bidang industri (nanokomposit, nanotubes), farmasi (pembuatan obat), dan pangan (pembuatan nano vitamin A). Propolis merupakan salah satu aplikasi untuk senyawa obat yang memiliki kelarutan yang kecil dalam air. Penggunaanya yang terbukti sebagai antibakteri dalam bentuk sediaan ekstrak dan mikro melatarbelakangi pembuatan sediaan propolis dalam bentuk nano yang akan meningkatkan luas permukaannya sehingga kemampuan untuk melarutnya pun semakin baik di dalam tubuh. Ukurannya yang nano dapat melewati membran luar bakteri sehingga senyawa-senyawa aktif antibakterinya dapat merusak dinding sel bakteri. Oleh karena itu, diharapkan dapat lebih efektif dan efisien dalam memacu pertumbuhan.
alami yang berfungsi sebagai pemacu pertumbuhan (Growth Promoter).
TINJAUAN PUSTAKA
Lebah Madu Trigona spp
Lebah madu Trigona spp merupakan serangga sosial hidup berkelompok membentuk suatu koloni yang termasuk ke dalam golongan stingless bee. Lebah madu Trigona spp Juga sering disebut dengan Melipona. Golongan stingless bee adalah golongan lebah yang menggigit akan tetapi tidak menyengat (Gambar 1). Lebah ini mudah dijumpai di daerah tropis dan sub tropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara. Koloninya terdiri atas 300-80.000 ekor lebah (Free 1982). Lebah Trigona spp diklasifikasikan dalam divisi Animalia, filum Arthopoda, kelas Insecta, ordo Hymenoptera, famili Apidae, genus Trigona, dan species Trigona spp (Sihombing 1997).
Koloni lebah madu terdiri atas dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan nonreproduktif (lebah pekerja). Satu sama lainnya dapat dibedakan dari bentuk, rupa, warna, dan tingkah laku. Satu koloni lebah hanya memiliki satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo dan Supapto 1980). Ratu memiliki ukuran paling besar dan paling menarik diantara lebah lainnya dalam koloni. Ratu hanya bertugas menghasilkan telur dan lebah jantan bertugas mengawini lebah ratu. Semua pekerjaan dilakukan oleh lebah pekerja, baik pekerjaan dalam sarang maupun luar sarang. Semua pembagian tugas dilakukan dengan teratur berdasarkan tingkatan usia (Sumoprastowo dan Supapto 1980).
Lebah madu Trigona spp menghasilkan jumlah madu yang sedikit bila dibandingkan dengan lebah Apis spp. Sarang lebah Trigona spp menghasilkan madu kurang lebih 1 kg/tahun sedangkan Apis spp menghasilkan madu mencapai 75 kg/tahun. Madu yang dihasilkan Trigona spp mempunyai aroma khusus, campuran rasa manis dan asam seperti lemon (Fatoni 2008). Menurut Singh (1962) kandungan madu pada Trigona spp lebih sedikit daripada golongan lebah lokal lain seperti Apis spp Madu yang terdapat pada Trigona spp juga sulit untuk diekstrak. Akan tetapi, kandungan propolis pada Trigona spplebih banyak daripada golongan Apis spp.
Gambar 1 Trigona spp. Propolis
Propolis merupakan nama generik dari resin lebah. Kata propolis berasal dari bahasa Yunani, yaitu ”pro” artinya sebelum atau pertahanan dan ”polis” artinya kota atau sarang lebah. Jadi, propolis adalah pertahanan kota atau disebut sebagai sistem pertahanan pada sarang lebah. Karena sifatnya yang lengket seperti lem, propolis disebut sebagai bee-glue. Propolis merupakan produk penting lebah selain madu, yang digunakan sebagai pertahanan ataupun bahan pengisi retakan pada struktur sarang.
Propolis sering disebut dengan bee glue atau lem lebah (Iraz et al. 2005). Propolis merupakan resin lengket yang dikumpulkan oleh lebah pekerja dari kuncup, kulit kayu, dan dari bagian tumbuhan lain (Gojmerac 1983). Resin-resin yang diperoleh dari bermacam-macam tumbuhan ini kemudian dicampur dengan saliva dan enzim lebah sehingga berbeda dari resin asalnya (Gambar 2). Propolis berwarna kuning sampai coklat tua, bahkan ada yang transparan. Perbedaan warna tersebut dipengaruhi oleh kandungan flavonoidnya. Propolis sangat dipengaruhi oleh faktor temperatur. Pada temperatur di bawah 15°C, propolis keras dan rapuh, tapi kembali lebih lengket pada temperatur yang lebih tinggi (25-45°C). Propolis umumnya meleleh pada temperatur 60-69°C dan beberapa sampel mempunyai titik leleh di atas 100°C (Woo 2004).
sehingga terlindungi dari serangan penyakit. Lebah madu sangat memerlukan propolis karena lebah madu sangat rentan dengan infeksi bakteri dan virus (Chinthapally et al. 1993). Propolis terbukti mampu menghambat pertumbuhan beberapa bakteri seperti Bacillus subtilis, Staphylococcus aureus, Escherichia coli, dan Pseudomonas aeruginosa (Anggraini 2006). Penelitian selanjutnya bahkan telah menguji propolis dari Trigona spp terhadap bakteri penyebab karies gigi yaitu Streptococcus mutans. Ternyata ekstrak propolis tersebut mampu menghambat pertumbuhan bakteri tersebut (Lasmayanty 2007).
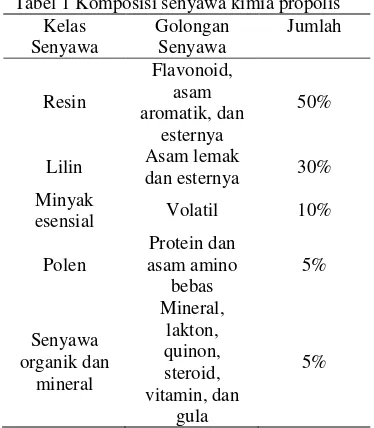
Gojmerac (1983) menyatakan bahwa propolis mengandung bahan campuran kompleks malam, resin, balsam, minyak, dan sedikit polen. Unsur aktif yang penting dalam bidang farmakologi adalah flavonoid (flavon, flavonol, flavonon) dan senyawa fenolat serta senyawa aromatik. Flavonoid berperan dalam pewarnaan tumbuhan. Senyawa flavonoid yang ada diantaranya adalah flavonol (galangin, kaemferol, quersetin), flavonon (pinocembrin dan pinosrobin), serta falvon (chrysin, acacetin, apigenin, ermanin). Beberapa senyawa fenolat yang ada diantaranya adalah hidroksisinamat, asam sinamat, vanilin, benzil alkohol, asam benzoat, kafeat, kumarat, serta asam ferulat. Berbeda dengan komposisi kimia yang dikandung oleh propolis, nilai nutrisi yang dikandung propolis sangat kecil, yaitu berasal dari protein, asam amino, mineral dan gula, serta vitamin dalam jumlah kecil seperti vitamin A, B1, B2, B6, C, dan E (Khismatulina 2005). Komponen kimia pada propolis dapat dilihat pada Tabel 1.
Propolis di dalam dunia pengobatan dimanfaatkan dalam penyembuhan berbagai penyakit. Manfaat propolis yang bermacam-macam ini dapat dimungkinkan karena kandungan kimianya yang beragam. Beberapa hasil penelitian menunjukkan bahwa propolis efektif sebagai antikanker, antivirus, antifungi, antibakteri, antioksidan, antiinflamasi, meningkatkan imunitas tubuh, memperkuat dan mempercepat regenerasi sel, dan lain-lain. Beberapa penelitian menyatakan propolis bersifat bakterisida, bakteriostatik, dan memiliki sifat antibiotik. Ada juga yang melaporkan ekstrak propolis ampuh untuk menyembuhkan luka, penyakit mulut dan kuku pada sapi, membunuh virus influenza dan membantu penyembuhan penyakit kulit. Seorang dokter gigi Rusia melaporkan, sebagai bahan anestesia 3-4%
ekstrak propolis 3-5 kali lebih efektif dari kokain (Gojmerac 1983).
Winingsih (2004) menyatakan propolis sebagai antibiotik alami. Menurutnya senyawa aktif yang memberikan efek antibakteri adalah pinochembrin, galangin, asam kafeat, dan asam ferulat. Senyawa antifunginya adalah pinocembrin, pinobanksin, asam kafeat, benzil ester, sakuranetin, dan pterostilbene sedangkan senyawa antiviralnya adalah asam kafeat, lutseolin, dan quersetin. Zat aktif yang diketahui sebagai antibiotik adalah asam kafeat. Zat ini efektif terhadap bakteri Gram positif dan negatif. Kelebihan propolis sebagai antibiotik alami dibandingkan dengan bahan sintetik adalah lebih aman serta dengan efek samping yang relatif kecil. Satu-satunya efek samping yang terjadi dan itu pun jarang yaitu timbulnya reaksi alergi. Selain itu, propolis sebagai antibiotik mempunyai selektivitas yang tinggi. Propolis hanya membunuh bakteri penyebab penyakit sedangkan mikrob yang berguna seperti flora usus relatif tidak terganggu.
Gambar 2 Propolis dalam sarang lebah. Tabel 1 Komposisi senyawa kimia propolis
Kelas Senyawa Golongan Senyawa Jumlah Resin Flavonoid, asam aromatik, dan esternya 50%
Lilin Asam lemak
dan esternya 30% Minyak
esensial Volatil 10%
Pemacu Pertumbuhan (Growth Promoter) Pemacu pertumbuhan adalah zat aditif yang ditambahkan ke dalam pakan ternak untuk mempercepat pertumbuhan dan meningkatkan produktivitas ternak. Bahan-bahan yang umumnya dapat digunakan sebagai pemacu pertumbuhan antara lain antibiotik, hormon, acidifer (asam-asam organik), probiotik, prebiotik, imunomodulator, dan beberapa obat herbal. Meskipun fungsi dari bahan-bahan ini sama, mereka memiliki cara kerja yang berbeda, yaitu melalui efisiensi dalam penyerapan pakan dan metabolisme saluran cerna, penyehatan saluran cerna atau penguatan sistem kekebalan tubuh yang bertujuan meningkatkan kesehatan dan peningkatan produktivitas ternak (Cheeke 1999).
Masyarakat telah lama mengenal dan menerapkan antibiotik sebagai Growth Promoter pada ternak. Akan tetapi, penggunaan antibiotik dinilai banyak memiliki kekurangan. Salah satu yang penting adalah bahwa penggunaan antibiotik pada pakan hewan sebagai pemacu pertumbuhan telah mengakibatkan pertumbuhan bakteri yang resisten terhadap antibiotik yang umum digunakan untuk terapi infeksi pada manusia (Naim 2003).
Mekanisme kerja antibiotik ini belum jelas, namun dipercaya banyak peneliti bahwa antibiotik ini menekan populasi bakteri pada saluran pencernaan. Estimasi energi yang hilang sekitar 6% dari diet pada babi karena fermentasi mikrob dalam usus. Jika populasi dapat dikendalikan, maka kehilangan energi tersebut dapat dialihkan untuk pertumbuhan. Mekanisme kerja pemacu pertumbuhan juga belum diketahui secara pasti. Percobaan menggunakan ayam bebas penyakit menunjukkan bahwa pemacu pertumbuhan berhubungan erat dengan daya antibakteri. Empat hipotesis diusulkan untuk menjelaskan kerja pemacu pertumbuhan yaitu, (1) makanan tidak lagi dicerna bakteri sehingga semua makanan dicerna inang, (2) absorbsi makanan dapat meningkat karena rintangan di usus halus berkurang, (3) antibiotik dapat menurunkan produksi toksin oleh bakteri usus, dan (4) turunnya kejadian infeksi subklinis di dalam usus (Feigher dan Dashkevicz 1987).
Tikus sebagai Hewan Coba Seperti mencit, tikus (terutama Rattus Norvegicus Albino) sering menjadi subjek medis dan percobaan biologi lainnya. Hal ini karena mereka mempunyai kematangan
seksual yang tumbuh sehat serta mudah dipelihara dan dikembangbiakan. Ilmuwan telah mengawinkan banyak galur atau ”keturunan” tikus terutama untuk percobaan. Dibandingkan dengan mencit, tikus lebih relevan dengan manusia dan lebih mudah dalam pengamatan (Muchtadi 1989).
Tikus adalah hewan pengerat yang mudah berkembang biak, mudah dipelihara dalam jumlah banyak. Tikus yang baru lahir biasanya memiliki berat badan 5-6 gram dan memiliki kecepatan tumbuh sebesar 5 gram /hari. Umumnya berat badan tikus dewasa rata-rata 200-250 gram, tetapi bervariasi tergantung pada galurnya. Tikus jantan tua dapat mencapai 500 gram dan tikus betina jarang lebih dari 350 gram (Mangkoewidjojo dan Smith 1988). Beberapa karakteristik tikus adalah nocturnal (aktif pada malam hari), tidak mempunyai kantong empedu (gall blader), tidak dapat mengeluarkan isi perutnya (muntah) dan tidak pernah berhenti tumbuh, meskipun kecepatannya menurun setelah berumur seratus hari (Muchtadi 1989). Muchtadi (1989) juga menyatakan bahwa zat-zat gizi yang diperlukan untuk pertumbuhan tikus hampir sama dengan manusia yaitu karbohidrat, lemak, protein, mineral, dan vitamin.
Tikus merupakan spesies hewan kedua yang paling sering digunakan dalam riset dan pengujian biomedis. Tikus mempunyai sejumlah karakteristik yang menyebabkan hewan tersebut ideal sebagai hewan model yaitu tersedia secara komersil, memiliki keseragaman genetik, tidak mahal, murah pemeliharaannya, mudah penanganannya, mudah beradaptasi dengan lingkungan dan suasana baru, parameter fisiologisnya dapat diukur, mempunyai mikroflora yang sudah dikenal, beberapa mempunyai penyakit spontan yang berguna dalam pemodelan, umur yang pendek memungkinkan untuk mempelajari efek-efek pengobatan pada kesehatan, dan sekuen genom tikus telah lengkap diketahui pada tahun 2004 (Rand 2004, diacu dalam Sulistiyani 2005).
Escherichia coli
E. coli termasuk famili Enterobacteriaceae. Bentuknya batang atau koma, berukuran 1.1-1.5 x 2.0-6.0 µm, terdapat tunggal atau berpasangan dan dalam rantai pendek serta merupakan bakteri Gram negatif. Bakteri ini tidak berkapsul dan tidak berspora, tumbuh baik pada pH optimum 7.0-7.5 serta suhu optimum 37°C. E. Coli membentuk koloni berwarna putih hingga kekuningan, dan permukaannya bergelombang di atas agar (Fardiaz 1983; Pelczar dan Chan 1988), bersifat nonmotil dan hidup secara anaerob fakultatif (Holt et al. 1994).
Biasanya E.coli bergerak dengan flagella peritrik. E. coli memilki macam-macam fibria atau pili sesuai struktur spesifitas antigen, antara lain filamentus dan proteinaceus. Fibria merupakan rangkaian hidrofobik dan merupakan organ spesifik yang bersifat adhesi. Hal itu merupakan faktor virulensi yang penting. E. coli menyebabkan diare sangat sering di seluruh dunia. E. coli diklasifikasikan oleh sifat-sifat virulensinya dan setiap grup menimbulkan penyakit melalui mekanisme yang berbeda.
Klasifikasi E. coli antara lain (Collier 1998): a). Enteropathogenic E.coli (EPEC), infeksinya melibatkan gen EPEC adherence factor (EAF), menyebabkan perubahan konsentrasi kalsium intraseluller dan arsitektur sitoskleton di bawah membran mikrovilus. b). Enterotoxigenic E.coli (ETEC) menghasilkan toksin stabil dan labil (ST dan LT) menyebabkan akumilasi cGMP pada sel target, elektrolit dan cairan sekresi pada lumen usus. c). Enterohaemorrhagic E.coli (EHEC) menghasilkan verotoksin, EHEC berhubungan dengan holitis hemoragik, bentuk diare yang berat dan dengan sindroma uremia hemolitik. d). Enterohaemorrhagic E.coli (EIEC) menimbulkan penyakit melalui invansinya ke sel epital mukosa usus. Diare ini ditemukan hanya pada manusia. e). Entero Adherent E.coli (EAEC) menyebabkan diare akut dan kronik pada masyarakat di negara berkembang.
Nanopartikel
Nanoteknologi merupakan istilah yang digunakan untuk menggambarkan teknologi yang berkaitan dengan materi super kecil (nano). Dalam SI unit, nanometer didefinisikan sebagai 1×10–9 meter ((1/milyar) meter). Sampai saat ini nanopartikel telah diaplikasikan dalam berbagai bidang seperti elektronik,
kedokteran, industri kimia dan kosmetik dan
juga kedirgantaraan. Dalam
perkembangannya, prospek teknologi ini akan semakin meningkat seiring dengan ditemukannya aplikasi-aplikasi baru lainnya.
Nanopartikel termasuk golongan Solid Colloidal Drug Delivery System, dan merupakan dasar dari sistem penghantaran obat yang bersifat dapat diuraikan oleh tubuh. (biodegradeable) dan tidak toksik. Nanopartikel adalah suatu preparat parenteral dan dapat disimpan dalam bentuk padat. Sediaan nanopartikel ini setelah penyimpanan setahun masih dapat diencerkan kembali menjadi larutan colloidal yang baik dan masih mempunyai sifat-sifat in vivo dan in vitro yang tidak berubah. Shelf-life -nya sendiri masih belum diketahui (Wiraatmaja H 1984).
Pembuatan nanopartikel dalam bidang farmasi sedang berkembang dengan pesat. Faktor keterbatasan pelarutan obat yang digunakan secara oral menjadi pendekatan utama untuk meningkatkan kemampuannya menyerap sehingga dapat terurai menjadi cairan di dalam usus (Hue et al. 2004). Pengurangan atau pengecilan ukuran partikel yang memiliki kelarutan yang kecil akan meningkatkan luas permukaan sehingga akan meningkatkan penguraiaan partikel yang menyebabkan kelarutannya meningkat (Dressman et al. 1998; Hörter dan Dressman 2001). Ada dua proses utama yang dapat digunakan untuk membuat partikel menjadi ukuran kecil (nano) yang biasa digunakan untuk membuat partikel obat dengan alat pemurnian tinggi, yaitu wet-grinding in agitated grinding media mills (Merisko-Liversidge et al. 2003) dan high-pressure homogenisation (Müller et al. 2000 ; Müller et al. 2001).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah propolis kasar Trigona spp yang berasal dari Bukittinggi Padang, tikus jantan Sprague-Dawley dengan berat 50-100 gram, media selektif Escherichia coli (Eosin metilene Blue (EMB), etanol 70%, propilen glikol (PG) teknis, maltodekstrin, akuades, larutan fisiologis (NaCl 0.9%), pakan standar tikus, akaudes, dan ampisilin generik 250 mg produksi kimia farma.
shaker, rotavapor, vacuum dryer, laminar air flow cabinet, wrap, cawan petri, batang penyebar, jarum ose, beberapa alat gelas, pipet ukur 5 mL, pipet ukur 25 mL mikropipet, inkubator suhu, neraca analitik, termos, kertas saring, High Energy Milling (HEM), SEM S500 Coating unit, JSA-65 10LA Analytical Scanning Electron Microscope (Jeol) (SEM), plat platinum, pelapis emas, dan peralatan nekropsi tikus.
Metode Penelitian
Ekstraksi Propolis Trigona spp
Propolis diekstraksi menggunakan metode Harbone (1987) dan Matienzo dan Lamorena (2004). Ekstraksi dilakukan dengan maserasi, yaitu dengan pelarut alkohol 70% dengan satu kali pengulangan. Sebanyak kira-kira 200 gram propolis kasar Trigona spp direndam dengan 650 mL etanol 70%. Suspensi tersebut ditutup dan dikocok dengan shaker di ruang gelap selama satu minggu. Setelah itu, suspensi tersebut disaring, filtratnya diambil, dan residunya dimaserasi kembali. Selanjutnya filtrat tersebut diambil setiap hari selama enam hari. Setelah enam hari, teknik maserasi diakhiri yaitu ditandai dengan warna filtrat terakhir yang berwarna jernih. Seluruh filtrat yang terkumpul kemudian dipekatkan dengan rotavapor pada suhu 40°C. Ekstrak pekat yang diperoleh kemudian ditimbang untuk mendapatkan nilai rendemennya.
Pembuatan Nanopartikel Propolis (modifikasi Bhaskar et al. 2009)
Pembuatan Nanopropolis 1%. Ekstrak propolis pekat sebanyak 1 gram dilarutkan dengan propilen glikol sebanyak 1:1 yang disebut dengan ekstrak etanol propolis 100 % (EEP 100%). Selanjutnya EEP 100% dilarutkan dengan 120 mL etanol 70%.
Bahan penyalut maltodekstrin sebanyak 94 gram dilarutkan dalam akuades 80 mL dan ditambahkan Mg stearat sebanyak 5 gram lalu diaduk dengan pengaduk magnetik (stirrer) sampai tercampur rata, kemudian dengan cepat dihomogenisasi pada kecepatan 22.000 rpm selama 30 menit. Setelah 30 menit penyalut dihomogenisasi, propolis yang telah terlarut dengan etanol 70% dicampurkan dan dengan cepat campuran dihomogenisasi kembali pada kecepatan 22.000 rpm selama 30 menit. Setelah itu, larutan dikeringkan dengan vacuum dryer pada suhu 40˚C. Serbuk yang terbentuk kemudian dihaluskan dan disamaratakan
dengan High Energy Milling (HEM) kecepatan ± 916 rpm dan frekuensi 28,8 Hz selama 15 menit. Hasil nanopropolis diidentifikasi ukuranya menggunakan SEM.
Pembuatan Nanopropolis 2%. Ekstrak propolis pekat sebanyak 2 gram dilarutkan dengan propilen glikol sebanyak 1:1 yang disebut dengan ekstrak etanol propolis 100 % (EEP 100%). Selanjutnya EEP 100% dilarutkan dengan 120 mL etanol 70%.
Bahan penyalut maltodekstrin sebanyak 93 gram dilarutkan dalam akuades 80 mL dan ditambahkan Mg stearat sebanyak 5 gram lalu diaduk dengan pengaduk magnetik (stirrer) sampai tercampur rata, kemudian dengan cepat dihomogenisasi pada kecepatan 22.000 rpm selama 30 menit. Setelah 30 menit penyalut dihomogenisasi, propolis yang telah terlarut dengan etanol 70% dicampurkan dan dengan cepat campuran dihomogenisasi kembali pada kecepatan 22.000 rpm selama 30 menit. Setelah itu, larutan dikeringkan dengan vacuum dryer pada suhu 40˚C. Serbuk yang terbentuk kemudian dihaluskan dan disamaratakan dengan High Energy Milling (HEM) kecepatan ± 916 rpm dan frekuensi 28,8 Hz selama 15 menit. Hasil nanopropolis diidentifikasi ukurannya menggunakan SEM. Karakterisasi Sampel dengan SEM
Sampel dikarakterisasi dengan menggunakan alat JSA-65 10LA Analytical Scanning Electron Microscope (Jeol) di PTBIN BATAN. Plat platinum disiapkan lalu diambil secuplik sampel dan diletakkan pada permukan plat. Sampel terlebih dahulu dicoating (dilapisi) dengan emas. Pelapisan dilakukan dengan cara sampel yang telah ditempelkan pada permukaan plat platinum yang memiliki dua sisi kemudian dimasukkan ke dalam alat SEM S500 coating unit selama ± 15 menit. Sampel yang telah dilapisi, lalu diamati dengan SEM, yaitu sampel dimasukkan ke dalam alat SEM yang telah tersambung dengan komputer. Kemudian SEM diatur vakum dan diamati pada tegangan 7 kV. Perbesaran dapat diatur saat pengamatan.
dan makanannya. Sebelum dan selama perlakuan, tikus diberikan pakan standar dan minum akuades. Bobot badan tikus dan jumlah pakan yang dimakan diamati setiap hari.
Hewan uji dibagi menjadi 5 kelompok dengan 5 ekor tikus dalam setiap kelompok. Kelompok I (standar) diberikan pakan standar dan air minum akuades dan juga dicekok akuades (untuk menyamakan perlakuan) setiap tiga hari sekali selama 25 hari. Kelompok II (kontrol positif) diberikan pakan standar, air minum akuades, dan dicekok larutan ampisilin generik 250 mg/KgBB setiap tiga hari sekali selama 25 hari. Kelompok III (raw propolis) diberikan pakan standar, air minum akuades, dan dicekok raw propolis 100 mg/KgBB setiap tiga hari sekali selama 25 hari. Kelompok IV diberikan pakan standar, air minum akuades, dan dicekok nanopropolis 1% 100 mg/KgBB setiap tiga hari sekali selama 25 hari. Terakhir, kelompok V diberikan pakan standar, air minum, dan dicekok nanopropolis 2% 100 mg/KgBB setiap tiga hari sekali selama 25 hari.
Pengamatan Klinis
Pengamatan Fisik. Pengamatan fisik hewan uji meliputi berat badan (ditimbang sampai minggu ke-4 saat akan dinekropsi), warna mata, warna feses, dan tingkah laku yang diamati setiap harinya. Tingkah laku yang diamati meliputi mobilitas.
Penghitungan (Kuantitas) Bakteri Metode Hitungan Cawan. Feses tikus diambil setiap 7 hari sekali untuk dihitung jumlah E.coli yang ada. Sebanyak 0,5 gram feses dilarutkan dalam cairan fisiologis (NaCl 0,9%) sebanyak 4,5 mL. Feses dilarutkan dengan cairan fisiologis, dikocok hingga merata dan terlarut. Kemudian larutan tersebut diencerkan hingga pengenceran 1:1000. Secara aseptik, dipipet 0.1 mL sampel lalu masing-masing diteteskan ke dalam cawan petri yang berisi media EMB padat lalu sampel disebar dan diratakan dengan spreader. Setelah itu, cawan-cawan petri tersebut diinkubasi pada 37°C selam 24 jam. Koloni dihitung secara manual. Hal yang sama dilakukan untuk bakteri usus.
Nekropsi Tikus. Setelah perlakuan selama 25 hari, tikus dibiarkan selama tiga hari (selama persiapan nekropsi) dengan tetap ditimbang bobot badannya. Kemudian tepat di minggu ke-4 tikus dinekropsi untuk diambil sampel bakteri E.coli dari usus besar tikus. Bakteri usus ini dihitung menggunakan
metode hitungan cawan (TPC) sama seperti menghitung E.coli pada feses. Nekropsi dilakukan di kandang tikus Biokimia, Institut Pertanian Bogor.
Analisis Statistik
Analisis data akan dilakukan menggunakan metode Rancangan Acak Lengkap (RAL) in time untuk hitungan bakteri metode TPC sedangkan untuk persentase pertumbuhannya digunakan RAL. Berikut ini merupakan model rancangannya RAL in time (Mattjik dan Sumertajaya 2002):
Yijk = µ + i + j+ ( jk) + ( )ij + ijk
Keterangan:
Yijk = Pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Pengaruh rataan umum
i = Pengaruh perlakuan ke-i, i = 1,2,3,4,5 j = Pengaruh waktu ke-j
jk = Pengaruh acak waktu
( )ij= Pengaruh interaksi perlakuan ke-i dan waktu ke-j
ij = Pengaruh acak pada perlakuan ke-i dan ulangan ke-j, j = 1,2,3,4,5 Berikut ini merupakan model rancangannya RAL (Mattjik dan Sumertajaya 2002):
Yijk = µ + i + ijk
Keterangan:
Yijk = Pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Pengaruh rataan umum
i = Pengaruh perlakuan ke-i, i = 1,2,3,4, ij = Pengaruh acak pada perlakuan ke-i
dan ulangan ke-j, j = 1,2,3,4,5
Data yang diperoleh akan dianalisis dengan ANOVA (Analysis of Variance) pada selang kepercayaan 95% dan taraf 0,05. Uji lanjut yang digunakan adalah uji Duncan. Seluruh data dianalisis dengan menggunakan program SAS.
HASIL DAN PEMBAHASAN
Nanopropolis Formula Penyalutan Nanopropolis
konsentrasi 2,03% dapat menghambat bakteri patogen seperti E.coli. Waktu penguraian mikrokapsulasi 2% dan 4% pada rumen sapi terhadap Escherichia coli terjadi pada jam ke-3 dengan diameter zona bening mikrokapsulasi 2% lebih kecil dibandingkan mikrokapsulasi 4% (Saputra 2009) sehingga digunakan konsentrasi 2% untuk tikus karena penyampaian makanannya yang lebih cepat sampai saluran pencernaan dibandingkan sapi.
Produk hasil enzimatis pati umumnya memiliki sifat yang tidak hidroskopis, meningkatkan viskositas, membentuk matriks hidrogel, mempunyai daya rekat, dan ada yang larut dalam air (Anwar 2004). Maltodekstrin (MDE) merupakan salah satu hasil hidrolisis enzimatis dari pati. Penggunaan MDE dalam dunia farmasi masih sangat terbatas tidak sepopuler penggunaannya dalam industri makanan. Maltodekstrin dalam formulasi penyalutan nanopropolis ini berperan sebagai bahan penyalut. Maltodekstrin bersifat tidak hidroskopis, tidak berasa, dan tidak berbau, dan dalam bentuk serbuk atau granul putih (Rowe et al. 2006). Alasan pemilihan maltodekstrin sebagai bahan penyalut adalah larut dalam air, murah, tidak mempunyai sifat lipofilik, tidak hidroskopis, mempunyai daya rekat, dan dapat membentuk matriks hidrogel. Selain itu, maltodekstrin memiliki struktur yang lebih pendek dibanding pati sehingga pada saat penyalutan menghasilkan enkapsulasi yang lebih kering, berukuran seragam, dan tidak lengket.
Penggunaan MDE umumnya
ditambahkan dengan magnesium stearat (MgSt). Magnesium stearat dalam dunia farmasi biasa digunakan sebagai pelicin dalam pembuatan obat tablet yang bertujuan, yaitu mempercepat aliran granul dalam corong ke dalam rongga cetakan, mencegah melekatnya granul pada cetakan selama pengeluaran tablet, mengurangi gesekan antar tablet dan dinding cetakan ketika dilempar dari mesin. Magnesium stearat yang digunakan dalam penelitian ini adalah 5% dan memiliki beberapa fungsi, yaitu mencegah menempelnya granul pada dinding vacuum dryer sehingga mempermudah penyalutan, memberikan penampilan yang bagus, selain itu fungsinya dalam tubuh adalah sebagai pelicin dalam rongga mulut sehingga mempermudah aliran granul ke dalam tubuh dan sebagai diintegran (pemisah bentuk) sehingga senyawa aktif dapat terlepas dari bahan pengikat dan bahan pengisinya.
Metode Nanopropolis
Nanopropolis pada penelitian ini dibuat dengan menggunakan metode gabungan homogenizer modifikasi metode Bahskar et al. 2009 dengan metode penyalutan teknik penguapan pelarut (Sutriyo et al. 2004). Teknik penyalutan tersebut dipilih berdasarkan jenis penyalut yang digunakan, yaitu maltodekstrin sedangkan metode homogenisasi ini sudah banyak digunakan secara sekala besar dalam industri farmasi untuk membuat nanopartikel (Rainer et al. 2000). Homogenisasi dengan kecepatan tinggi tersebut bertujuan untuk mengecilkan ukuran dan dengan tumbukan cepat berkali-kali menyebabkan terjadinya interaksi antara penyalut dan propolis yang akan mempermudah penyalutan.
Pembuatan nanopropolis tersalut diawali dengan pembuatan penyalutnya terlebih dahulu yaitu maltodekstrin yang telah dilarutkan dengan air dan ditambahkan magnesium stearat kemudian diaduk dengan stirrer sampai tercampur lalu dihomogenisasi pada kecepatan 22.000 rpm selama 30 menit. Hasil homogenisasi, larutan tersebut dicampur dengan EEP 100% (ekstrak propolis dan propilen glikol) yang telah dilarutkan kembali dengan etanol 70% lalu dihomogenisasi kembali pada kecepatan dan suhu yang sama.
Keseragaman pencampuran menjadi faktor penting dalam pembuatan enkapsulasi. Campuran yang belum melarut dengan sempurna akan menyebabkan bahan inti atau komponen aktif tidak tersalut sempurna oleh bahan penyalut. Selain itu, dalam penelitian tentang mikrokapsulasi, Sutriyo et al. (2004) mengungkapkan bahwa ukuran mikrokapsul yang dihasilkan sangat dipengaruhi oleh kecepatan dan lama pengadukan. Pengadukan yang cepat akan menghasilkan ukuran mikrokapsul yang kecil, begitupun sebaliknya. Kecepatan pengadukan yang digunakan dalam penelitian ini 22.000 rpm. Kecepatan tersebut jauh lebih tinggi dari kecepatan yang digunakan pada penelitian Sutriyo et al. (2004), yaitu 3000 rpm dengan hasil distribusi ukuran partikel antara 425 sampai lebih besar dari 850 mikron.
tinggi sehingga pada proses ini tidak akan merusak komponen aktif propolis. Prinsip teknik vacuum drying adalah dengan menarik pelarut-pelarut keluar dari campuran menggunakan suhu sekitar 40°C pada kondisi vakum.
Nanopropolis yang dihasilkan berbentuk serbuk yang sangat kering, serbuk tersebut masih kasar dan bergerombol. Pengeringan menyebabkan air dalam gel akan menguap sehingga memperkecil ukuran kapsul. Ikatan hidrogen gel dengan air menjadi hilang dan akan terbentuk ikatan hidrogen baru antarkapsul. Hal tersebut berakibat pada bergerombolnya beberapa kapsul ketika sudah kering (Silva et al. 2006). Untuk menghaluskan dan meratakan ukuran digunakan HEM (High Energy milling) dengan kecepatan ± 916 rpm dan frekuensi 28,8 Hz selama 15 menit. HEM memiliki prinsip menghaluskan dengan 3 arah yaitu vertikal, horizontal, dan rotasi. Bola besi yang dimasukkan bersamaan dengan sampel di dalam tabung merupakan alat penggerusnya, dengan bobot sampel kurang lebih setengahnya bobot bola. Serbuk yang dihasilkan (Gambar 4) berwarna putih dan halus.
A B
Gambar 4 Hasil serbuk nanopropolis. A) nanopropolis 1% dan B) nanopropolis 2%.
Karakterisasi SEM Nanopropolis
Karakterisasi dengan Scanning Electron Microscopy (SEM) dilakukan untuk mengetahui morfologi dan ukuran nanopropolis tersalut. Sebelum sampel dianalisis dengan SEM, terlebih dahulu sampel dicoating. Sampel diletakkan pada plat platinum yang memiliki dua sisi kemudian dilapis dengan emas yang berfungsi untuk menghasilkan interaksi pancaran elektron pada sampel. Sampel yang telah dilapisi diamati menggunakan SEM dengan tegangan 7 kV dan pada kondisi vakum.
Hasil observasi dengan SEM baik pada nanopropolis 1% (Gambar 5) dan 2% (Gambar 6), morfologi partikel sampel
terlihat tidak seragam (bentuknya tidak simetris) dengan tepian yang kurang rata, namun dengan persebaran yang sudah jelas (tidak bergerombol). Hal ini serupa dengan observasi SEM maltodekstrin (Gambar 7) yang dihasilkan Anwar et al. (2004) dengan bentuk partikel yang tidak seragam. Bentuk yang tidak simetris ini disebabkan dari proses keluarnya cairan dari campuran akibat pengeringan sehingga bentuknya yang tidak beraturan.
Pengambilan gambar diambil secara acak. nanopropolis 1% dengan perbesaran 20.000x dapat dilihat bahwa ukurannya masih belum seragam, ukuran partikel terkecil yang masih terukur sebesar 192 nm, 273 nm, dan masih ada yang berukuran > 800 nm. Hasil untuk nanopropolis 2% dengan perbesaran 10.000x ukuran partikel terkecil yang masih terukur sebesar 100 nm, 141 nm, 322 nm, dan > 700 nm. Pengambilan gambar dilakukan dengan perbesaran yang berbeda, hal tersebut dikarenakan pencarian gambar terpilih yang terbaik yang dapat dilihat.
Pada penelitian ini distribusi ukuran partikel tidak dianalisis secara khusus. Namun, pengamatan secara acak, umumnya distribusi ukuran dari kedua sampel (1% dan 2%) berada dalam kisaran 100 sampai lebih besar dari 800 nanometer, dengan partikel terbesar berada pada nanopropolis 1% yaitu lebih besar dari 800 nm. Hasil ini sesuai dengan Sutriyo et al. 2004 menyatakan bahwa perbedaan distribusi ukuran partikel dipengaruhi oleh jumlah penyalut yang digunakan sebagai pembentuk dinding.
Gambar 5 Morfologi SEM Nanopropolis 1%
perbesaran 20.000x. Ukuran
Gambar 6 Morfologi SEM Nanopropolis 2%
perbesaran 10.000x. Ukuran
nanopropolis yang tampak yaitu 141 nm, 100 nm, dan 322 nm.
Gambar 7 Morfologi SEM maltodekstrin perbesaran 200x (Anwar 2004).
Kondisi Fisik dan Bobot Badan Hewan Coba (Pertumbuhan)
Terdapat beberapa persamaan dan perbedaan fisik tikus yang terlihat pada saat sebelum dan setelah pemberian perlakuan. (Tabel 2) warna mata, tingkah laku, dan warna urin terlihat sama pada saat sebelum dan sesudah perlakuan, yaitu berwarna merah, dengan tingkah laku normal, dan warna urin kuning jernih. Tetapi terdapat perbedaan pada feses yang dihasilkan pada kelompok tikus yang telah diberi perlakaun berwarna cokelat lebih tua dibandingkan dengan yang tidak diberi perlakuan, teksturnyapun lebih lunak, dan lebih berbau. Pada saat masa adaptasi, tikus adaptasi berpostur kecil dan lebih sedikit beraktifitas. Berbeda dengan tikus setelah masa adaptasi yang lebih aktif dan banyak beraktifitas (Gambar 8).
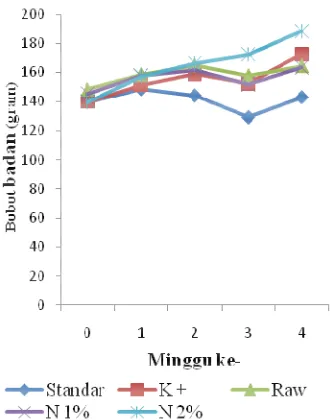
Selama masa adaptasi semua tikus mengalami kenaikan bobot badan (Gambar 9) secara keseluruhan sebesar 52,26% dibandingkan keadaan awal (bobot badan tikus pada saat pertama kali). Rata-rata bobot badan semua tikus pada awal masa adaptasi sebesar 93,68 ± 6,83 gram sedangkan pada akhir masa adaptasi bobot badan rata-ratanya sebesar 142,64 ± 4,10 gram. Kenaikan bobot badan ini terjadi pada semua tikus pada masing-masing kelompok yang nantinya akan diberi perlakuan berbeda. Berdasarkan uji ANOVA dengan uji lanjut Duncan, kenaikan bobot badan antara kelompok satu dengan kelompok yang lainnya tidak berbeda nyata (P<0,05%). Artinya, kenaikan bobot badan masing-masing kelompok tidak dipengaruhi oleh faktor dari luar karena kelompok-kelompok tersebut belum diberi perlakuan. Hal ini menunjukkan bahwa kondisi tikus dalam keadaan sehat dan dalam masa pertumbuhan.
Kenaikan bobot badan untuk setiap kelompok masih terjadi pada minggu pertama setelah pencekokan, ini menunjukkan bahwa tikus tidak mengalami stres saat pencekokan dan penyalutan ekstrak menyebabkan ekstrak memiliki rasa enak sehingga tidak mempengaruhi nafsu makan tikus (Gambar 10). Namun, pada minggu ke-2 setelah pencekokan terjadi penurunan bobot badan. Penurunan tersebut berlanjut sampai minggu ke-3 setelah pencekokan. Kemudian terjadi kenaikan lagi saat menuju minggu ke-4. Tabel 2 Kondisi fisik hewan coba
Parameter Keterangan
Normal Perlakuan Warna mata
Warna feses Tekstur feses Tingkah laku Warna urin
Merah Cokelat Padat Normal Kuning jernih
Merah Cokelat tua Lunak Normal Kuning jernih
A B
Penurunan dan peningkatan bobot badan ini dapat dikarenakan adanya perubahan jumlah populasi mikroflora bakteri yang ada di sistem pencernaan. Kondisi badan dapat mempengaruhi jumlah mikroflora pencernaan yang tercermin dari efisiensi pencernaan makanan oleh mikroflora dalam saluran pencernaan sehingga berdampak pada pertumbuhannya. Hal ini akan dibahas lebih dalam berikutnya.
Nilai pertumbuhan tikus, dapat tercermin dari persentase pertumbuhannya, yaitu selisih bobot badan akhir perlakuan dengan awal perlakuan terhadap bobot badan awal perlakuan. Persentase pertumbuhan masing-masing perlakuan, yaitu standar sebesar 2.44%, kontrol positif sebesar 23.39%, raw propolis sebesar 10.92%, nanopropolis 1% sebesar 12.5%, dan nanopropolis 2% sebesar 34,62%. Nilai ini menunjukkan bahwa tikus perlakuan nanopropolis 2% memiliki pertumbuhan yang paling tinggi dibandingkan dengan perlakuan yang lain. Jika dibandingkan dengan kontrol positif, tikus perlakuan nanopropolis 2% ini juga memiliki pertumbuhan yang lebih tinggi. Pertumbuhan yang terkecil adalah kelompok perlakuan standar.
Berdasarkan statistik ANOVA, dengan uji lanjut Duncan, persentase pertumbuhan nanopropolis 2% berbeda nyata (P<0.05%) terhadap kelompok perlakuan standar, kontrol positif, raw propolis, dan nanopropolis 1% sedangkan untuk standar, kontrol positif, raw propolis, dan nanopropolis 1% untuk masing-masing perlakuan persentase pertumbuhannya tidak berbeda nyata (P<0.05%). Artinya, hanya persentase nanopropolis 2% yang nilai pertumbuhannya berbeda nyata terhadap perlakuan yang lain.
Gambar 9 Bobot badan tikus selama masa adaptasi.
Gambar 10 Bobot badan tikus selama masa perlakuan.
Dosis propolis yang digunakan sebesar 100 mg/KgBB. Ini merupakan standar pemberian dosis propolis untuk manusia (Krell 1998), dosis ini kemudian dikonversi untuk tikus dengan konversi bobot badan tikus dianggap 200 gram/KgBB manusia sedangkan untuk ampisilin yang digunakan adalah obat generik produksi kimia farma dengan dosis 250 mg/KgBB yang merupakan dosis subterapi yang biasa digunakan untuk Growth Promoter pada hewan ternak. Dosis inipun dikonversi untuk bobot badan tikus. Pencekokan dilakukan setiap 3 hari sekali untuk meminimalisir adanya pengaruh pencekokan terhadap nafsu makan tikus.
Kelompok nanopropolis 2% memiliki potensi yang lebih besar sebagai Growth Promoter dibandingkan kontrol positif (perlakuan yang diberi ampisilin 250 mg/KgBB) dengan efektivitas nanoproplis 2% sebasar 109% terhadap kontrol positif. Nanopropolis 2% memiliki pertumbuhan yang paling cepat dan stabil setiap minggunya diantara kelompok perlakuan yang lain. Nanopropolis 1% memiliki pertumbuhan yang sama dengan perlakuan raw propolis (propolis yang belum diekstrak). Perlakuan standar memiliki pertumbuhan yang paling rendah (perlakuan yang hanya diberi akuades) dibandingkan kelompok perlakuan yang lain.
sistem pencernaan sampai usus besar yang merupakan target yang akan dicapai (menghambat pertumbuhan bakteri E.coli yang menyebabkan penyakit diare). Raw propolis sebelum dicekokan ke tikus, terlebih dahulu dilarutkan dengan propilen glikol 1:1 untuk mempermudah pelarutan, kemudian ditambahkan akuades. Pelarutan dengan propilen glikol (memiliki daya antibakteri) ini dimungkinkan yang menjadikan raw propolis mempunyai aktivitas antibakteri yang sama dengan nanopropolis 1% dan memiliki pertumbuhan yang lebih stabil dibandingkan dengan standar.
Pemberian ampisilin (kontrol positif) pada dosis subterapi (250 mg/KgBB) dapat dijadikan sebagai Growth Promoter. Secara umum, mekanisme antibiotik ampisilin adalah mencegah penggabungan asam N-asetilmuramat ke dalam struktur peptidoglikan yang merupakan salah satu bagian penting dalam dinding sel bakteri. Penghambatan ini mengakibatkan lemahnya struktur dinding sel bakteri sehingga tidak dapat menahan kuatnya tekanan dari cairan sitoplasma.
Propolis sebagai antibakteri alami memiliki beberapa mekanisme tergantung dari senyawa aktifnya. Analisis fitokimia propolis asal Bukittinggi senyawa aktif sebagai antibakterinya hanya mengandung flavonoid dan tanin (Fatoni 2008). Fungsi dari senyawa fenol, yaitu flavonoid memiliki kemampuan untuk mengikat protein ekstraseluler dan protein integral yang bergabung dalam dinding sel sehingga permeabilitas dinding sel terganggu dan akhirnya dinding sel pecah karena tidak kuat menahan sitoplasma sedangkan tanin memiliki kemampuan dalam menginaktifkan protein enzim dan lapisan protein transport (Murphy 1999, diacu dalam Lasmayanty 2007).
Jika dibandingkan dengan kontrol positif (ampisilin 250 mg/KgBB), nanoproplis 2% 100 mg/KgBB memiliki potensi yang lebih tinggi sebagai Growth Promoter. Hal ini terkait dengan senyawa-senyawa yang terkandung dalam propolis dan ampisislin. Meskipun kandungan terbesar dari propolis adalah senyawa aktifnya sebesar 50% yang digunakan sebagai antibiotik alami tetapi propolis juga memiliki beberapa persen senyawa lain seperti, asam lemak pada lilin, protein dan asam amino, serta karbohidrat. Senyawa-senyawa tersebut juga berperan dalam peningkatkan bobot badan. Selain itu, adanya penyalutan dengan maltodekstrin
pada nanopropolis 2% juga dapat menambah persenyawaan berenergi yang dapat menambah bobot badan tikus sedangkan ampisilin hanya mengandung senyawa aktif yang berperan sebagai antibiotik.
Analisis Antibakteri Metode TPC Metode yang digunakan dalam penentuan aktivitas antibakteri adalah hitungan cawan metode cawan sebar. Metode ini dipilih karena mudah dan umum digunakan dalam uji aktivitas antibakteri. Metode hitungan cawan bersifat kuantitatif yang didasarkan atas anggapan bahwa setiap sel yang dapat hidup di dalam larutan sampel akan berkembang menjadi satu koloni.
Media yang digunakan untuk menumbuhkan E.coli yaitu Eosin Metilene Blue. Media EMB adalah media spesifik yang digunakan untuk isolasi dan diferensiasi bakteri Enteric basilli (Holt et al. 2004). Komposisi media EMB yaitu enzim pemecah gelatin, kalium fosfat, pewarna (eosin Y dan biru metilena), laktosa, sukrosa, dan agar. Bakteri Gram positif dihambat pada media EMB. Pada media ini, E. coli akan tumbuh dengan ciri-ciri berwarna biru-hitam, inti berwana hijau gelap, dan berkilau metalik jika terkena cahaya. Alasan penggunaan ampisilin sebagai kontrol positif karena antibiotik ini yang sering digunakan untuk ditambahkan pada pakan ternak sebagai Growth Promoter. Ampisilin merupakan antibiotik yang memiliki spektrum yang luas terhadap berbagai bakteri Gram positif maupun Gram negatif.
nanopropolis 1%, dan 2% tidak berbeda secara nyata (P<0,05).
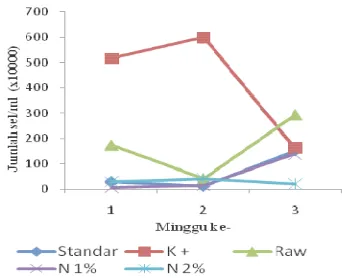
Terlihat (Gambar 11) Kontrol positif, pada minggu ke-1 setelah pencekokan ampisilin, memiliki jumlah Escherichia coli yang terbesar dibandingkan dengan perlakuan lain tetapi setelah minggu ke-2 memasuki minggu ke-3, kontrol positif terjadi penurunan yang sangat tajam mendekati standar. Kondisi yang fluktuatif pada kontrol positif menunjukkan bahwa terjadi ketidakseimbangan mikroflora, khususnya Escherichia coli setelah pemberian ampisilin. Hal ini dicerminkan juga dari jumlah rata-rata Escheriachia coli kontrol positif yang jika dibandingkan dengan kelompok perlakuan yang lain, kontrol positif memiliki jumlah E. coli terbesar kedua setelah standar.
Hasil ini menunjukkan bahwa kontrol positif memiliki daya hambat bakteri yang paling kecil khususnya Escherichia coli dibandingkan dengan perlakuan raw propolis, nanopropolis 1%, dan nanopropolis 2% pada minggu ke-1 dan ke-2 setelah pencekokan. Hal ini, terkait dengan sifat antibakteri ampisilin yang merupakan antibakteri spektrum luas yang menyebabkan ampisilin juga dapat menekan bakteri-bakteri gram positif dan gram negatif lain sehingga tidak spesifik menghambat bakteri patogen (E. coli). Kemudian pengaruh ampisilin terhadap E. coli baru terlihat pada minggu 3 dan ke-4 dengan adanya penurunan yang drastis jumlah E. coli.
Jumlah Escherichia coli pada minggu ke-1 pencekokan raw propolis juga masih tertinggi kedua mendekati kontrol positif, dan mengalami kenaikan setelah pencekokan minggu ke-2 sedangkan jumlah Escherichia coli untuk standar, nanopropolis 1%, dan 2% mendekati sama. Namun, standar dan nanopropolis 1% mengalami peningkatan populasi Escherichia coli saat memasuki minggu ke-3 pencekokan. Selain itu, standar memiliki jumlah rata-rata E. coli terbanyak dibandingkan dengan perlakuan yang lain. Jumlah E. coli Nanopropolis 2% tetap stabil di setiap minggunya dengan jumlah rata-rata E.coli yang paling kecil dibandingkan perlakuan yang lain.
Pemberian nanopropolis 2% tidak mengubah keseimbangan mikroflora dalam saluran pencernaan tikus dengan cara mengendalikan populasi Escherichia coli dalam taraf yang tidak membahayakan bagi kesehatan saluran pencernaan. Dengan tujuan bahwa apabila keseimbangan mikroflora dalam usus baik maka fungsi saluran
pencernaan yang optimum akan tercapai, sebaliknya jika keseimbangan mikroflora dalam saluran pencernaan terganggu maka fungsi saluran pencernaan pun akan terganggu (Bourlioux et al. 2003).
Jumlah Escherichia coli yang terhitung pada feses sangat berkaitan dengan bobot badan. Pada minggu ke-3 perlakuan, grafik pertumbuhan bobot badan untuk standar, raw propolis, dan nanopropolis 1% mengalami penurunan bobot badan yang signifikan, hal ini dibarengi dengan peningkatan jumlah Escherichia coli pada feses. Berbeda halnya dengan kontrol positif, penurunan bobot badannya akibat perubahan yang fluktuatif pada jumlah Escherichia coli fesesnya tetapi penurunan E. coli feses kontrol positif di minggu ke-3 juga dicerminkan pada peningkatan bobot badan saat menuju minggu ke-4 sedangkan untuk bobot badan tikus nanopropolis 2% pada minggu ke-3 cenderung lebih stabil menuju peningkatan bobot badan. Hal ini terlihat dari jumlah Escherichia coli nanopropolis 2% yang stabil dari awal hingga akhir perlakuan dan cenderung menurun.
Keadaan tersebut menunjukkan bahwa tikus yang diberi nanopropolis 2% dapat mempertahankan keseimbangan mikroflora dalam saluran pencernaan khususnya Escherichia coli. Keseimbangan jumlah Escherichia coli feses setiap minggunya pada nanopropolis 2% berkaitan dengan mekanismennya sebagai Growth Promoter. Jumlah Escherichia coli dipertahankan stabil dari minggu awal hingga akhir perlakuan (jumlah E. coli paling kecil dengan penurunan dan kenaikan yang tidak signifikan setiap minggunya). Sebaliknya, penurunan jumlah Escherichia coli kontrol positif yang fluktuatif menunjukkan mekanisme ampisilin dalam menekan jumlah populasi E.coli secara drastis.
Keuntungan dari penggunaan propolis adalah propolis bersifat sebagai antibiotik alami yang dapat menghambat pertumbuhan bakteri patogen tanpa mematikan bakteri yang menguntungkan bagi tubuh sedangkan antibiotik sintetik bersifat sebagai bakteriosidal yang mematikan seluruh bakteri bahkan bakteri yang menguntungkan. Selain itu, penggunaan antibiotik secara terus menerus dapat menyebabkan beberapa bakteri menjadi resisten karena bakteri dapat secara mudah beradaptasi dengan keadaan tersebut (Fajrina 2009).
Jumlah dosis infektif Escherichia coli berbeda-beda tergantung dari kemampuan virulensinya, strain yang berbeda dapat menimbulkan virulensi yang berbeda. Dosis infektifnya adalah E. coli enteropatogenik sebesar 106 - 1010, enterotoksigenik 106 – 108, enteroinvansif 108, enterohemoragik 101 – 103 sedangkan populasi Escherichia coli dalam feses pada kondisi normal adalah 108 -109 sel/mL (Mitsuoka 1989, diacu dalam Pertiwi 2008).
Rata-rata jumlah E.coli hasil penelitian ini yaitu standar, kontrol positif, raw propolis, nanopropolis 1%, dan nanopropolis 2% sebesar 6,43 x 105; 4,39 x 106; 1,70 x 106; 5,27 x 105; 3,11 x 105 sel/mL. Hasil tersebut menunjukkan bahwa jumlah E.coli pada semua tikus perlakuan berada di bawah jumlah normal. Hal ini dapat dikarenakan tikus dalam penelitian ini merupakan tikus jantan lepas sapih yang sedang dalam masa pertumbuhan dengan bobot akhir < 210 gram. Selain itu, jika dibandingkan dengan perlakuan standar. Standar memiliki jumlah rata-rata E. coli sebesar 105 sel/mL sedangkan jumlah rata-rata E.coli pada perlakuan lain berkisar antara 105-106 sel/mL. Hal ini menunjukkan bahwa jumlah rata-rata E. coli pada semua perlakuan lain berada pada jumlah normal. Kondisi ini didukung dengan pengamatan kondisi fisik tikus yang normal. Hanya jumlah E. coli setiap minggunya saja yang tidak stabil.
Perkembangan suatu makhluk hidup akan menyebabkan terjadinya perubahan pada jumlah populasi mikroflora dalam usus makhluk hidup tersebut (Nakazawa dan Hasono 1992, diacu dalam Pertiwi 2008). Makanan dapat memodifikasi ekologi enteromikroba saluran pencernaan, maka dapat diperkirakan jika karnivorisme akan merangsang pertumbuhan mikroflora tertentu (Peterson 1975). Perubahan ini terjadi seiring dengan makin beragamnya asupan makanan yang dikonsumsi oleh makhluk hidup
tersebut. Tikus pada awal penelitian ini merupakan tikus lepas sapih yang sebelumnya hanya mengkonsumsi air susu dari induknya. Pemberian pakan yang terdiri atas komponen yang beragam akan berpengaruh pada kondisi mikroflora saluran pencernaan tikus tersebut.
Bakteri pada Usus (Escherichia coli) Escherichia coli merupakan bakteri patogen alami yang terdapat di dalam saluran pencernaan. Bakteri ini berkembangbiak dalam saluran pencernaan bagian kolon (usus besar). Populasi Escherichia coli dalam saluran pencernaan dapat berubah tergantung pada pola makan, susunan makanan yang dikonsumsi serta stres yang dialami oleh makhluk hidup. Berdasarkan data yang diperoleh, jumlah Escherichia coli pada usus yang tertinggi masih standar, diikuti raw propolis, kontrol positif, nanopropolis 1%, dan terakhir nanopropolis 2% (Gambar 12).
Hasil yang didapat menunjukkan bahwa jumlah Escherichia coli standar pada usus sebanding dengan jumlah Escherichia coli minggu terakhir yang tergambar pada grafik feses yaitu 105 sel/mL sedangkan kontrol positif, raw propolis, nanopropolis 1%, dan nanopropolis 2% memiliki jumlah Escherichia coli pada usus yang lebih rendah dibandinghan minggu terakhir pada feses. Hal ini diperkirakan karena jumlah E. Coli kontrol positif pada minggu terakhir (ke-4) saat pengambilan kotoran usus semakin menurun dibandingkan jumlah E.coli feses terakhir yang diambil pada minggu ke-3, ini terlihat dari semakin menurunnya E. Coli kontrol positif pada grafik feses dibarengi dengan peningkatan bobot bada di minggu ke-4 sedangkan propolis memiliki kemampuan dalam merangsang sistem imun tubuh.
organisme di dalam saluran cerna (Widiasih 2004).
Propolis sebagai pemacu pertumbuhan merupakan alternatif yang aman apabila dibandingkan dengan penggunaan antibiotik sintetik. Salah satu peran penting propolis adalah merangsang imunitas sedangkan beberapa obat-obatan medis sintetik justru dapat menekan imunitas (Fajrina 2009). Senyawa flavonoid dalam propolis dapat meningkatkan sistem kekebalan tubuh, terutama dalam proses fagositosis yaitu bersama-sama dengan neutrofil melemahkan dinding sel bahan asing yang berbahaya bagi tubuh sehingga dinding sel bahan tersebut akan melemah dan akan mengalami lisis. Selain flavonoid, aktifitas ini disebabkan oleh adanya vitamin B kompleks, vitamin C, vitamin E, dan provitamin A yang dapat melapisi struktur sel sehingga tubuh memiliki pertahanan terhadap mikroorganisme (Krell 1996).
Gambar 12 Jumlah sel/mL Escherichia coli Usus pada minggu akhir
perlakuan.
SIMPULAN DAN SARAN
Nanopropolis tersalut yang dihasilkan berwana putih dan halus. Hasil SEM menunjukkan adanya ukuran nanopropolis sebesar 100 nm. Potensi Growth Promoter tertinggi dilihat dari persentase pertumbuhan badan tikus. Persentase tertinggi dicapai oleh nanopropolis 2% dibandingkan kontrol positif dengan efektivitas nanopropolis 2% sebesar 109% terhadap kontrol positif. Persentase pertumbuhan untuk masing-masing perlakuan nanopropolis 2% 100 mg/KgBB, kontrol positif (ampisilin 250 mg/KgBB), nanopropolis 1% 100 mg/KgBB,
raw propolis 100 mg/KgBB, dan standar adalah 34,62%, 23,39%, 12,5%, 10,92%, dan 2,24%. Jumlah E. coli pada feses yang paling stabil adalah perlakuan nanopropolis 2%. Kemampuan propolis sebagai Growth Promoter, selain karena kandungan senyawa aktifnya juga karena adanya beberapa senyawa yang dapat meningkatkan bobot badan serta beberapa vitamin yang dapat membantu dalam mekanisme sistem imun tubuh.
Perlu dilakukan uji lanjut pengoptimuman kecepatan dan waktu homogenisasi untuk menghasilkan nanopropolis yang lebih kecil dengan ukuran yang lebih seragam dan pengujian umum untuk mengetahui distribusi ukuran nanopropolis. Selain itu, dapat dilakukan pengujian in vivo dengan penambahan waktu perlakuan untuk melihat pengaruhnya dalam jangka waktu yang lebih lama dan pengujian nanopropolis sebagai sistem imun terkait dengan Growth Promoter.
DAFTAR PUSTAKA
Anggraini AD. 2006. Potensi propolis lebah madu Trigona spp. sebagai bahan antibakteri [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Anwar E et al. 2004. Pemanfaatan
maltodekstrin pati terigu sebagai eksipien dalam formula sediaan tablet dan niosom. Majalah Ilmu Kefarmasian 1:34-46.
Bhaskar K et al. 2009. Lipid nanoparticles for transdermal delivery of flurbiprofen: formulation, in vitro, ex vivo and in vivo studies. Lipids in Health and Disease 8:6-7.
Bourlioux P, Kolletzko B, Guarner F, Braesco V. 2003. The intestine and its microflora are partners for the protection of the host: report on the Danone symposium “The Inteligent Intestine”, held in Paris, June 14, 2002. Am J Clin Nutr 78:675-83. Cheeke PR. 1999. Applied Animal Nutrition:
Feeds and Feeding second adition. Oregon: Prentice Hall.
Collier L. 1998. Microbiology and Microbial Infections 9th Edition. New York: Oxford University Pr.
Dharmayanti NLP, Sulistyowati E, Tejolaksono MN, Prasetya R. 2000. Efektivitas pemberian propolis lebah dan royal jeli pada abses yang disebabkan Sthapylococcus aureus. Berita Biologi 5:41-48.
Dressman JB, Amidon GL, Reppas C, Shah VP. 1998. Dissolution testing as a prognostic tool for oral drug absorption: immediate release dosage forms. Pharmaceutical Research 15:11-22.
Evans MC, HC Wegener. 2003. Antimicrobial growth promoters and Salmonella spp, Campylobacter spp in poultry and swine, Denmark. Emerging Infectious Diseases 9:489-492.
Fajrina HI. 2009. Ketahanan tablet propolis Trigona spp Sebagai antibakteri terhadap cairan rumen in vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Fardiaz S. 1983. Mikrobiologi Keamanan Pangan. Bogor: PAU Pangan dan Gizi, Institut Pertanian Bogor. Fatoni A. 2008. Pengaruh propolis Trigona
spp asal Bukittinggi terhadap beberapa bakteri usus halus sapi dan penelusuran komponen aktifnya
[tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Feighner SD, Dashkevicz MP. 1987. Subtherapeutic levels of antibiotics in poultry feeds and their effects on weight gain, feed efficiency, and bacterial cholytaurin hidrolase activity. Appl Environ Microbial 53:331-336.
Free JB.1982.Bees and Mankind. London: George Allen & Unkwin.
Gojmerac WL. 1983. Bee, Beekeeping, Honey and Pollinationi. Wesport: Avi. Harbone HB. 1987. Metode Fitokimia I. Ed ke-2, Padmawinat K, penerjemah; Bandung: ITB. Terjemahan dari: Phytochemical Methode.
Hasan, AEZ. 2006. Potensi Propolis Lebah
Madu Trigona spp sebagai Bahan Antibakteri. Bogor: Seminar Nasional HKI.
Holt JG, Krieg NR, Sneath PH, Stanley JT, Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore: Williams & Wilkins. Holt, Harris, Teague. 2004. A new culture
medium for the isolation of Bacillus typhosa from stools. J Infect Dis 18:596.
Horter D, Dressman J B. 2001. Influence of physicochemical properties on dissolution of drugs in the gastrointestinal tract. Advanced Drug Delivery Reviews 46:75-87.
Hue J, Jhonston KP, Williams III RO. 2004. Nanoparticle engineering process for enhancing the dissolution rates of poorly water soluble drugs. Drug Development and IndustrialPharmacy 3:233-245.
Iraz et al. 2005. Dose dependent effects of caffeic acid phenethyl ester on heart rate and blood pressure in rats. Eur J Gen Med 2: 69-75.
Khismatulina N. 2005. Apitherapy. Rusia: Mobile Ltd.
Krell R. 1996. Value-Added Products from Bee Keeping. United Nations Rome: FAO. http://www.fao.org/docrep.htm [27 Maret 2009].
Lasmayanty M. 2007. Potensi antibakteri propolis lebah madu Trigona spp terhadap bakteri kariogenik (Streptococcus mutans) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mangkoewidjojo S, Smith JB. 1988. Pemeliharaan, Pembiakan, dan Penggunaan Hewan Percobaan di daerah Tropis. Jakarta: UI Pr. Mantienzo AC, Lamorena M. 2004.
Mattjik AA, Sumertajaya M. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Bogor: IPB Pr.
Merisko-Liversidge E, Liversidge GG, Cooper RR. 2003. Nanosizing: a formulation approach for poorly-water-soluble compounds. European Journal of Pharmaceutical Sciences 18:113-120.
Muller RH, Krause K, Mader K, penemu; PCT Patent Application. Method for controlled production of ultrafine microparticles and nanoparticles. 2001/03670 A1 July 10, 2000. Muller RH, Jacobs C, Kayser O. 2001.
Nanosuspensions as particulate drug formulation in therapy rational for development and what we can expect for the future. Advanced Drug DeliveryReviews 4