(Pimpinella pruatjan Molk.)
RITA NINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul “ Penyimpanan dengan Pertumbuhan Minimal dan Regenerasi In Vitro Purwoceng (Pimpinella pruatjan Molk.)” merupakan gagasan dan karya saya bersama pembimbing yang belum pernah dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Bogor, Januari 2009
of Purwoceng (Pimpinella pruatjan Molk.). Under supervision of RITA MEGIA and IRENG DARWATI.
Purwoceng (Pimpinella pruatjan Molk.) is an Indonesian indigenous medicinal plant with a high economic value. Its root can be used as an aphrodisiac, diuretic and tonic. Recently its population in natural habit has extinct because of highly exploitation without any replanting activities. So this species is categorized as an endangered plant. Therefore, special effort need to be done to conserve it immediatelly. Preliminary study has found that purwoceng can be conserved by minimal growth not more than four months. This experiment aimed at finding the best treatment to conserve this species for a longer periode storage (8 months), evaluated regenerating ability and leaf anatomical structure after storage. In vitro axillary buds without leaves were conserved on DKW medium suplemented with 2.5% sucrose, combination sorbitol (0,1,2,3,4,5%) and paclobutrazol (0,1,3,5 ppm) for 8 months. Regenerating ability was taken for 3 months on regenerated medium. Leaf anatomical structure was microscopically observed on leaf paradermal and cross section. The results showed that combination between sorbitol and paclobutrazol can preserve purwoceng for 8 months but regenerating ability decreased by the increase of both sorbitol and paclobutrazol consentration.There was difference in the leaf anatomical structure on regenerated after storage culture. The best treatment to preserve purwoceng for 8 months were 1% sorbitol - 0 ppm paclobutrazol (S1P0) or 3% sorbitol - 1 ppm paclobutrazol (S3P1). That because during preservation, the culture of these treatments showed slow growth rate with dwarf morphology in S3P1, but during regeneration they showed high growth rate, high shoots multiplication and 100 % survival with normally culture.
In Vitro Purwoceng (Pimpinella pruatjan Molk.). Dibimbing oleh RITA MEGIA dan IRENG DARWATI.
Purwoceng merupakan tanaman obat asli Indonesia yang memiliki nilai ekonomi tinggi. Akarnya memiliki khasiat afrodisiak yaitu dapat meningkatkan gairah seksual dan meningkatkan ereksi, melancarkan air seni (diuretik) dan meningkatkan stamina tubuh (tonik). Saat ini populasi purwoceng di habitat alaminya sudah punah akibat eksploitasi secara besar-besaran sebagai bahan baku jamu tanpa adanya usaha penanaman kembali. Selain itu purwoceng sulit dibudidayakan di luar habitat alaminya karena memiliki persyaratan tumbuh yang spesifik. Oleh karena itu purwoceng dikategorikan sebagai tanaman langka yang sangat dilindungi. Untuk menghindari kepunahan purwoceng perlu dilakukan upaya konservasi sesegera mungkin.
Konservasi in vitro tanaman purwoceng melalui pertumbuhan minimal menggunakan paklobutrazol 1 ppm pernah dilaporkan, namun hasilnya kurang memuaskan dimana kultur tidak dapat disimpan dalam waktu lebih dari empat bulan. Upaya untuk meningkatkan umur penyimpanan purwoceng dapat dilakukan dengan menggunakan secara bersama-sama dua faktor penghambat pertumbuhan yaitu regulator osmotik sorbitol dan retardan pertumbuhan paklobutrazol. Dalam penyimpanan, diharapkan kultur tidak hanya mampu disimpan lama namun harus memiliki daya regenerasi yang tetap tinggi. Tujuan penelitian ini untuk mendapatkan konsentrasi perlakuan terbaik dalam penyimpanan secara in vitro purwoceng dengan periode lebih lama (8 bulan), menguji daya regenerasi, stabilitas struktur morfologi dan anatomi daun regenerasi pasca penyimpanan. Formulasi terbaik diharapkan dapat diterapkan secara rutin sebagai protokol penyimpanan in vitro di bank gen untuk menghindari kepunahan spesies langka ini.
Kuncup aksiler in vitro tanpa daun berukuran ± 2 mm disimpan dalam media DKW + sukrosa 2.5% yang mengandung kombinasi sorbitol (0,1,2,3,4,5%) dan paklobutrazol (0,1,3,5 ppm). Dengan demikian jumlah total perlakuan 24 unit. Satu unit (botol) perlakuan mengandung 3 tunas dengan ulangan 6 kali. Kultur diinkubasi selama 8 bulan pada suhu 20 – 25°C dan fotoperiodisitas 16 jam terang dengan intensitas cahaya 800 – 1000 lux. Pada akhir penyimpanan, kultur disubkultur ke media regenerasi selama 3 bulan untuk menguji daya regenerasi setelah penyimpanan. Media regenerasi yaitu media perbanyakan (multiplikasi) terdiri dari media DKW + BA 4 ppm + Thidiazuron (TDZ) 0.4 ppm + Glutamin 100 ppm dengan penambahan GA3 3 ppm. Pengamatan karakter morfologi dan
seiring peningkatan konsentrasi perlakuan. Selain itu kultur masih mempertahankan morfologi kerdil pada konsentrasi perlakuan tertentu meskipun sudah diregenerasi. Pengaruh sorbitol dan paklobutrazol selama penyimpanan masih bertahan atau persisten. Hasil pengamatan terhadap karakter anatomi menunjukkan terdapat perbedaan antara daun kontrol (yang tidak disimpan) dengan daun regenerasi pasca penyimpanan. Secara umum rata-rata semua karakter anatomi daun perlakuan mengalami penurunan kecuali kerapatan stomata. Kombinasi perlakuan terbaik yaitu sorbitol 1% - paklobutrazol 0 ppm (S1P0) atau sorbitol 3 % - paklobutrazol 1 ppm (S3P1). Kultur pada kedua kombinasi perlakuan tersebut memiliki pertumbuhan lambat saat penyimpanan dengan morfologi kerdil pada S3P1 namun ketika diregenerasi menunjukkan kecepatan pertumbuhan dan multiplikasi tunas yang cukup tinggi, daya hidup mencapai 100% dengan morfologi normal dan subur.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
(Pimpinella pruatjan Molk.)
RITA NINGSIH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : G351060441
Disetujui Komisi Pembimbing
Dr. Rita Megia, D.E.A Dr. Ireng Darwati
Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S, D.E.A Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
limpahan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini.
Penulis menyadari sepenuhnya bahwa sangatlah sulit untuk menyelesaikan penelitian dan penyusunan tesis ini tanpa bantuan dari berbagai pihak. Oleh karena itu dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih serta penghargaan yang setinggi-tingginya kepada :
1. Dr. Rita Megia, D.E.A selaku ketua komisi pembimbing atas semua jerih payah dan waktu yang telah diluangkan untuk memberikan bimbingan, arahan dan kemudahan kepada penulis dari mulai penelitian sampai terselesaikannya tesis ini.
2. Dr. Ireng Darwati selaku anggota komisi pembimbing atas ilmu, waktu dan bimbingan yang diberikan kepada penulis dengan penuh kesabaran sehingga tesis ini dapat terselesaikan.
3. Dr. Ir. Diah Ratnadewi selaku dosen penguji atas kritik dan sarannya untuk kesempurnaan tesis ini.
4. Dekan Sekolah Pascasarjana IPB dan Ketua Program Studi Biologi atas kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan Pascasarjana di IPB.
5. Dr. Ir. Juliarni, M.Agr dan Ika Roostika T., SP., Msi atas bimbingan dan nasihat selama penulis melaksanakan penelitian.
6. Laboratorium Ekofisiologi Balai Penelitian Tanaman Obat dan Aromatik (Balittro) dan Laboratorium Anatomi Tumbuhan Departemen Biologi FMIPA IPB yang telah menyediakan fasilitas untuk melakukan penelitian.
7. Islamic Development Bank (IDB) dan Proyek Kerja Sama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) yang telah membiayai penelitian ini.
8. Retno Agustarini, mbak Susi, bu Rohmah, mbak Tini, Dania, Wirda, Ucu, pa Ujang, pa Naryo, pa Muzuni, bu Sih dan semua pihak yang tidak dapat penulis sebutkan satu persatu, penulis mengucapkan terima kasih yang sebesar-besarnya atas bantuan kerjasama dan dukungannya selama ini.
Secara khusus, penulis sampaikan rasa terima kasih yang tulus kepada suami tercinta Drs. H. Abdul Halim L., M.Li atas segala pengorbanan baik moril maupun materil, dorongan, kesabaran, pengertian dan doanya. Kepada bapak dan ibu tercinta yang tiada mengenal lelah selalu mendoakan penulis sampai saat ini, penulis sampaikan terima kasih yang tiada batas. Untuk adikku Acih Astuti W. dan ananda Asykar Fathoni Syukriyah H. terima kasih atas pengorbanan dan perjuangannya melewati hari-hari yang berat bersama penulis. Semoga Allah SWT senantiasa melimpahkan rahmat dan kasih sayang-Nya kepada mereka, amien.
Akhirnya penulis berharap semoga tulisan ini dapat bermanfaat dan dapat memberikan sumbangan bagi perkembangan purwoceng di Indonesia.
Bogor, Januari 2009
Penulis dilahirkan di Bandung pada tanggal 11 Agustus 1977 sebagai anak pertama dari pasangan Suparman dan Elis Rohimah. Penulis merupakan putri pertama dari lima bersaudara. Penulis menikah dengan Drs. H. Abdul Halim L., M.Li dan dikaruniai putra Asykar Fathoni Syukriyah H. berusia 8 tahun.
Pendidikan sarjana ditempuh di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam ITB Bandung, lulus pada tahun 2001. Pada tahun 2006, penulis mendapatkan kesempatan untuk melanjutkan studi S2 pada Program Studi Biologi, Sub Program Studi Fisiologi, Genetika dan Biologi Molekuler, sekolah Pascasarjana Institut Pertanian Bogor (IPB), dengan beasiswa dari Proyek Kerjasama Pengembangan Universitas Haluoleo dengan Islamic Development Bank (IDB).
(Pimpinella pruatjan Molk.)
RITA NINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul “ Penyimpanan dengan Pertumbuhan Minimal dan Regenerasi In Vitro Purwoceng (Pimpinella pruatjan Molk.)” merupakan gagasan dan karya saya bersama pembimbing yang belum pernah dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Bogor, Januari 2009
of Purwoceng (Pimpinella pruatjan Molk.). Under supervision of RITA MEGIA and IRENG DARWATI.
Purwoceng (Pimpinella pruatjan Molk.) is an Indonesian indigenous medicinal plant with a high economic value. Its root can be used as an aphrodisiac, diuretic and tonic. Recently its population in natural habit has extinct because of highly exploitation without any replanting activities. So this species is categorized as an endangered plant. Therefore, special effort need to be done to conserve it immediatelly. Preliminary study has found that purwoceng can be conserved by minimal growth not more than four months. This experiment aimed at finding the best treatment to conserve this species for a longer periode storage (8 months), evaluated regenerating ability and leaf anatomical structure after storage. In vitro axillary buds without leaves were conserved on DKW medium suplemented with 2.5% sucrose, combination sorbitol (0,1,2,3,4,5%) and paclobutrazol (0,1,3,5 ppm) for 8 months. Regenerating ability was taken for 3 months on regenerated medium. Leaf anatomical structure was microscopically observed on leaf paradermal and cross section. The results showed that combination between sorbitol and paclobutrazol can preserve purwoceng for 8 months but regenerating ability decreased by the increase of both sorbitol and paclobutrazol consentration.There was difference in the leaf anatomical structure on regenerated after storage culture. The best treatment to preserve purwoceng for 8 months were 1% sorbitol - 0 ppm paclobutrazol (S1P0) or 3% sorbitol - 1 ppm paclobutrazol (S3P1). That because during preservation, the culture of these treatments showed slow growth rate with dwarf morphology in S3P1, but during regeneration they showed high growth rate, high shoots multiplication and 100 % survival with normally culture.
In Vitro Purwoceng (Pimpinella pruatjan Molk.). Dibimbing oleh RITA MEGIA dan IRENG DARWATI.
Purwoceng merupakan tanaman obat asli Indonesia yang memiliki nilai ekonomi tinggi. Akarnya memiliki khasiat afrodisiak yaitu dapat meningkatkan gairah seksual dan meningkatkan ereksi, melancarkan air seni (diuretik) dan meningkatkan stamina tubuh (tonik). Saat ini populasi purwoceng di habitat alaminya sudah punah akibat eksploitasi secara besar-besaran sebagai bahan baku jamu tanpa adanya usaha penanaman kembali. Selain itu purwoceng sulit dibudidayakan di luar habitat alaminya karena memiliki persyaratan tumbuh yang spesifik. Oleh karena itu purwoceng dikategorikan sebagai tanaman langka yang sangat dilindungi. Untuk menghindari kepunahan purwoceng perlu dilakukan upaya konservasi sesegera mungkin.
Konservasi in vitro tanaman purwoceng melalui pertumbuhan minimal menggunakan paklobutrazol 1 ppm pernah dilaporkan, namun hasilnya kurang memuaskan dimana kultur tidak dapat disimpan dalam waktu lebih dari empat bulan. Upaya untuk meningkatkan umur penyimpanan purwoceng dapat dilakukan dengan menggunakan secara bersama-sama dua faktor penghambat pertumbuhan yaitu regulator osmotik sorbitol dan retardan pertumbuhan paklobutrazol. Dalam penyimpanan, diharapkan kultur tidak hanya mampu disimpan lama namun harus memiliki daya regenerasi yang tetap tinggi. Tujuan penelitian ini untuk mendapatkan konsentrasi perlakuan terbaik dalam penyimpanan secara in vitro purwoceng dengan periode lebih lama (8 bulan), menguji daya regenerasi, stabilitas struktur morfologi dan anatomi daun regenerasi pasca penyimpanan. Formulasi terbaik diharapkan dapat diterapkan secara rutin sebagai protokol penyimpanan in vitro di bank gen untuk menghindari kepunahan spesies langka ini.
Kuncup aksiler in vitro tanpa daun berukuran ± 2 mm disimpan dalam media DKW + sukrosa 2.5% yang mengandung kombinasi sorbitol (0,1,2,3,4,5%) dan paklobutrazol (0,1,3,5 ppm). Dengan demikian jumlah total perlakuan 24 unit. Satu unit (botol) perlakuan mengandung 3 tunas dengan ulangan 6 kali. Kultur diinkubasi selama 8 bulan pada suhu 20 – 25°C dan fotoperiodisitas 16 jam terang dengan intensitas cahaya 800 – 1000 lux. Pada akhir penyimpanan, kultur disubkultur ke media regenerasi selama 3 bulan untuk menguji daya regenerasi setelah penyimpanan. Media regenerasi yaitu media perbanyakan (multiplikasi) terdiri dari media DKW + BA 4 ppm + Thidiazuron (TDZ) 0.4 ppm + Glutamin 100 ppm dengan penambahan GA3 3 ppm. Pengamatan karakter morfologi dan
seiring peningkatan konsentrasi perlakuan. Selain itu kultur masih mempertahankan morfologi kerdil pada konsentrasi perlakuan tertentu meskipun sudah diregenerasi. Pengaruh sorbitol dan paklobutrazol selama penyimpanan masih bertahan atau persisten. Hasil pengamatan terhadap karakter anatomi menunjukkan terdapat perbedaan antara daun kontrol (yang tidak disimpan) dengan daun regenerasi pasca penyimpanan. Secara umum rata-rata semua karakter anatomi daun perlakuan mengalami penurunan kecuali kerapatan stomata. Kombinasi perlakuan terbaik yaitu sorbitol 1% - paklobutrazol 0 ppm (S1P0) atau sorbitol 3 % - paklobutrazol 1 ppm (S3P1). Kultur pada kedua kombinasi perlakuan tersebut memiliki pertumbuhan lambat saat penyimpanan dengan morfologi kerdil pada S3P1 namun ketika diregenerasi menunjukkan kecepatan pertumbuhan dan multiplikasi tunas yang cukup tinggi, daya hidup mencapai 100% dengan morfologi normal dan subur.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
(Pimpinella pruatjan Molk.)
RITA NINGSIH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : G351060441
Disetujui Komisi Pembimbing
Dr. Rita Megia, D.E.A Dr. Ireng Darwati
Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S, D.E.A Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
limpahan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini.
Penulis menyadari sepenuhnya bahwa sangatlah sulit untuk menyelesaikan penelitian dan penyusunan tesis ini tanpa bantuan dari berbagai pihak. Oleh karena itu dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih serta penghargaan yang setinggi-tingginya kepada :
1. Dr. Rita Megia, D.E.A selaku ketua komisi pembimbing atas semua jerih payah dan waktu yang telah diluangkan untuk memberikan bimbingan, arahan dan kemudahan kepada penulis dari mulai penelitian sampai terselesaikannya tesis ini.
2. Dr. Ireng Darwati selaku anggota komisi pembimbing atas ilmu, waktu dan bimbingan yang diberikan kepada penulis dengan penuh kesabaran sehingga tesis ini dapat terselesaikan.
3. Dr. Ir. Diah Ratnadewi selaku dosen penguji atas kritik dan sarannya untuk kesempurnaan tesis ini.
4. Dekan Sekolah Pascasarjana IPB dan Ketua Program Studi Biologi atas kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan Pascasarjana di IPB.
5. Dr. Ir. Juliarni, M.Agr dan Ika Roostika T., SP., Msi atas bimbingan dan nasihat selama penulis melaksanakan penelitian.
6. Laboratorium Ekofisiologi Balai Penelitian Tanaman Obat dan Aromatik (Balittro) dan Laboratorium Anatomi Tumbuhan Departemen Biologi FMIPA IPB yang telah menyediakan fasilitas untuk melakukan penelitian.
7. Islamic Development Bank (IDB) dan Proyek Kerja Sama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) yang telah membiayai penelitian ini.
8. Retno Agustarini, mbak Susi, bu Rohmah, mbak Tini, Dania, Wirda, Ucu, pa Ujang, pa Naryo, pa Muzuni, bu Sih dan semua pihak yang tidak dapat penulis sebutkan satu persatu, penulis mengucapkan terima kasih yang sebesar-besarnya atas bantuan kerjasama dan dukungannya selama ini.
Secara khusus, penulis sampaikan rasa terima kasih yang tulus kepada suami tercinta Drs. H. Abdul Halim L., M.Li atas segala pengorbanan baik moril maupun materil, dorongan, kesabaran, pengertian dan doanya. Kepada bapak dan ibu tercinta yang tiada mengenal lelah selalu mendoakan penulis sampai saat ini, penulis sampaikan terima kasih yang tiada batas. Untuk adikku Acih Astuti W. dan ananda Asykar Fathoni Syukriyah H. terima kasih atas pengorbanan dan perjuangannya melewati hari-hari yang berat bersama penulis. Semoga Allah SWT senantiasa melimpahkan rahmat dan kasih sayang-Nya kepada mereka, amien.
Akhirnya penulis berharap semoga tulisan ini dapat bermanfaat dan dapat memberikan sumbangan bagi perkembangan purwoceng di Indonesia.
Bogor, Januari 2009
Penulis dilahirkan di Bandung pada tanggal 11 Agustus 1977 sebagai anak pertama dari pasangan Suparman dan Elis Rohimah. Penulis merupakan putri pertama dari lima bersaudara. Penulis menikah dengan Drs. H. Abdul Halim L., M.Li dan dikaruniai putra Asykar Fathoni Syukriyah H. berusia 8 tahun.
Pendidikan sarjana ditempuh di Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam ITB Bandung, lulus pada tahun 2001. Pada tahun 2006, penulis mendapatkan kesempatan untuk melanjutkan studi S2 pada Program Studi Biologi, Sub Program Studi Fisiologi, Genetika dan Biologi Molekuler, sekolah Pascasarjana Institut Pertanian Bogor (IPB), dengan beasiswa dari Proyek Kerjasama Pengembangan Universitas Haluoleo dengan Islamic Development Bank (IDB).
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN... xv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesis Penelitian ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA Botani Purwoceng ... 5
Mikropropagasi dan Regenerasi Purwoceng... 6
Penyimpanan dengan Pertumbuhan Minimal ... 7
Regulator Osmotik dan Retardan Pertumbuhan... 9
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 12
Metode Penelitian ... 12
Penyimpanan In Vitro ... 12
Pengujian Daya Regenerasi Pasca Penyimpanan... 14
Pengujian Stabilitas Karakter Anatomi ... 14
Rancangan Percobaan dan Analisis Data ... 15
HASIL DAN PEMBAHASAN Penyimpanan In Vitro ... 17
Regenerasi Pasca Penyimpanan ... 24
Struktur Anatomi Daun ... 29
Penentuan Kombinasi Terbaik ... 40
SIMPULAN DAN SARAN Simpulan ... 43
Saran ... 43
DAFTAR PUSTAKA ... 44
1 Rincian kombinasi perlakuan sorbitol dan paklobutrazol ... 16
2 Pengaruh tunggal sorbitol dan paklobutrazol terhadap jumlah tunas
pada bulan ke-4 penyimpanan ………... 21
3 Pengaruh sorbitol dan paklobutrazol terhadap jumlah tunas pada
bulan ke-8 penyimpanan ……… 21
4 Interaksi sorbitol dan paklobutrazol terhadap tebal epidermis
atas daun regenerasi pasca penyimpanan 4 bulan ... 34
5 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap tebal
epidermis atas daun regenerasi pasca penyimpanan 8 bulan ... 35
6 Interaksi sorbitol dan paklobutrazol terhadap tebal epidermis
bawah daun regenerasi pasca penyimpanan 4 bulan ... 35
7 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap tebal
epidermis bawah daun regenerasi pasca penyimpanan 8 bulan ... 36
8 Interaksi sorbitol dan paklobutrazol terhadap tebal mesofil
daun regenerasi pasca penyimpanan 4 bulan ... 36
9 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap tebal
mesofil daun regenerasi pasca penyimpanan 8 bulan ... 37
10 Rekapitulasi data beberapa kandididat perlakuan terbaik pada
1 Tanaman purwoceng (Pimpinella pruatjan Molk.) ... 5
2 Struktur kimia sorbitol ... 9
3 Struktur kimia paklobutrazol ... 10
4 Diagram alir tahapan penelitian ……….. 13
5 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap pertumbuhan kultur selama 4 dan 8 bulan penyimpanan ... 18
6 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap daya hidup
kultur (%) pada akhir penyimpanan 4 dan 8 bulan... 22
7 Morfologi kultur akhir bulan ke-4 penyimpanan ... 23
8 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap pertumbuhan kultur selama 3 bulan regenerasi ... 25
9 Interaksi sorbitol dan paklobutrazol terhadap jumlah tunas pada
akhir bulan ke-3 regenerasi ... 26
10 Pengaruh kombinasi sorbitol dan paklobutrazol terhadap daya hidup
kultur pada akhir bulan ke-3 regenerasi ... 27
11 Morfologi kultur akhir bulan ke- 3 regenerasi ... 28
12 Variasi morfologi daun hasil regenerasi ... 28
13 Interaksi sorbitol dan paklobutrazol terhadap kerapatan stomata
akhir bulan ke-3 regenerasi ... 30
14 Interaksi sorbitol dan paklobutrazol terhadap
panjang stomata daun akhir bulan ke-3 regenerasi ... 31
15 Interaksi sorbitol dan paklobutrazol terhadap
lebar stomata daun akhir bulan ke-3 regenerasi ... 32
16 Stomata daun bulan ke-3 regenerasi ... 33
17 Sayatan melintang daun purwoceng lapang dan kultur in vitro ... 38
18 Sayatan melintang daun hasil regenerasi
1 Mekanisme penghambatan paklobutrazol
terhadap sintesis giberelin ... 50
2 Perbandingan formulasi media dasar MS dan DKW... 51
Latar Belakang
Industri obat tradisional Indonesia berkembang pesat, baik sebelum maupun
selama krisis multidimensional melanda Indonesia. Pesatnya perkembangan
industri obat tercermin dari jumlah perusahaan pendukungnya. Pada tahun 1981,
jumlah perusahaan obat baru mencapai 165 buah, namun pada tahun 1991 dan
tahun 2000, jumlah tersebut meningkat masing-masing menjadi 427 dan 985
perusahaan (Hasanah & Rusmin 2006).
Sekitar 80% pasokan bahan baku industri obat tradisional masih
mengandalkan hasil pemanenan dari hutan atau habitat alami, sisanya dipasok dari
hasil budidaya secara tradisional yang pada umumnya sebagai usaha sampingan.
Hal ini menyebabkan terjadinya erosi genetik sehingga 54 jenis tanaman obat
menjadi langka. (Proyek Pengelolaan dan Pemulihan Kerusakan Lingkungan dan
Fakultas Kehutanan IPB 2001).
Eksploitasi besar-besaran dari habitat alami menimbulkan permasalahan
serius bagi kelestarian tanaman obat di Indonesia. Menurut Zuhud et al. (2001)
selain pemanenan tanaman obat yang berlebihan, masalah kelestarian juga timbul
akibat adanya a) kerusakan habitat karena eksploitasi kayu, konversi hutan,
perladangan berpindah dan lain-lain, b) punahnya budaya dan pengetahuan
tradisional/lokal di dalam atau sekitar hutan, c) ketidakseimbangan penawaran dan
permintaan akan tanaman obat, d) lambatnya pengembangan budidaya, e)
rendahnya harga tanaman obat, f) kurangnya kebijakan perundangan pelestarian,
g) kelembagaan pelestarian tanaman obat.
Akibatnya banyak tanaman yang terancam punah atau paling tidak sudah
sulit dijumpai di alam Indonesia. Salah satunya adalah Purwoceng (Pimpinella
pruatjan Molk.) yang merupakan tanaman obat langka asli Indonesia dengan
kategori endangered atau hampir punah (Rivai et al. 1992). Bahkan tanaman ini
termasuk dalam Appendix I berdasarkan CITES (Convention on International
Trading in Endangered Species of Wild Flora and Fauna) yang berarti sangat
dilindungi.
Purwoceng hidup secara endemik di daerah pegunungan seperti Dataran
Tinggi Dieng (Heyne 1987), namun saat ini keberadaan di habitat alaminya sudah
punah (Rahardjo 2003). Selain itu purwoceng juga sulit dibudidayakan di luar
habitatnya. Menurut Rahardjo (2004) tanaman purwoceng berhasil dibudidayakan
secara kecil-kecilan oleh petani di habitat aslinya yaitu sekitar desa Sekunang
Dataran Tinggi Dieng pada ketinggian tempat 1800 - 3500 m dpl, suhu antara 13
– 17°C dan kelembaban udara 65 – 85%.
Purwoceng merupakan tanaman obat bernilai ekonomi tinggi. Akarnya
dilaporkan berkhasiat sebagai afrodisiak (meningkatkan gairah seksual dan
menimbulkan ereksi), diuretik (melancarkan air seni) dan tonik (menjaga stamina
tubuh). Khasiat utama yang bersifat komersial sebagai obat afrodisiak. Hasil uji
klinis membuktikan, ekstrak akar purwoceng mengandung aktivitas androgenik
dan estrogenik, (Caropeboka 1980; Heyne 1987; Hernani & Yuliani, 1990).
Khasiat purwoceng tidak kalah dengan ginseng yang berasal dari China atau
Korea (Hernani & Yuliani 1990; Rahardjo 2004).
Mengingat nilai ekonomis dan statusnya yang langka, untuk menghindari
kepunahan tanaman purwoceng, perlu dilakukan upaya konservasi sesegera
mungkin. Upaya konservasi secara in situ (pada habitatnya) hampir tidak mungkin
dilakukan karena habitat asli tanaman ini sudah punah dengan rusaknya hutan
konservasi sebagai akibat kegiatan eksploitasi yang berlebihan. Dengan demikian,
konservasi ex situ (di luar habitatnya) lebih sesuai untuk diterapkan.
Konservasi ex situ di lapang menghadapi kendala disebabkan purwoceng
sulit dibudidayakan di luar habitatnya, karena memerlukan persyaratan agronomis
yang spesifik. Selain itu, konservasi di lapang menghadapi resiko hilangnya
populasi tanaman tersebut karena cekaman biotik (hama dan penyakit) dan abiotik
(kekeringan, kebanjiran dan kebakaran). Pemeliharaan tanaman di lapang juga
akan membutuhkan lahan, tenaga, waktu, dan biaya yang besar.
Teknologi kultur in vitro merupakan teknologi alternatif yang dapat
diterapkan untuk menghindari kepunahan tanaman purwoceng. Teknik ini cukup
praktis, hemat lahan, tenaga kerja, biaya dan waktu, kelebihan lainnya kultur
plasma nutfah selain itu lebih menjamin dari kehilangan genotip akibat cekaman
biotik dan abiotik yang banyak terjadi di kebun koleksi (Gati dan Mariska 1997).
Konservasi in vitro sebagai koleksi aktif dapat diterapkan dengan
menggunakan teknik pertumbuhan minimal untuk penyimpanan jangka menengah
(Withers 1991). Untuk mencapai tujuan tersebut umumnya digunakan senyawa
penghambat pertumbuhan seperti paklobutrazol, cicocel, ancimidol dan inhibitor
asam absisat serta komponen osmotik seperti sorbitol atau manitol (Chawla 2002;
Whiters 1985; Wilkin & Dodds 1983).
Penyimpanan jangka menengah menggunakan sorbitol 3% sebagai regulator
osmotik telah dilakukan oleh Fletcher (1994) terhadap tanaman asparagus.
Hasilnya eksplan mampu bertahan sampai 2 tahun dan 100% berhasil ditransfer ke
tanah di rumah kaca. Menurut Unnikrishnan et al. (2001) perlakuan sorbitol 5 %
dan sukrosa 60 % terhadap kultur meristem ubi kayu, memberikan pengaruh
penghambatan yang lebih nyata dibanding manitol selama 4 bulan, sedangkan
pemberian sorbitol 30 % dan sukrosa 30% dapat memperpanjang umur simpan
sampai 12 bulan dengan viabilitas cukup baik dan daya regenerasi mencapai 78
sampai 90%.
Berbagai jenis tanaman lainnya yang telah berhasil disimpan dengan teknik
pertumbuhan minimal adalah ubi jalar (Roostika & Sunarlim 2006), ubi kayu
(Sunarlim & Zuraida 2001), kentang hitam (Roostika & Mariska 2004), talas
(Dewi 2002), kentang dan pisang (Ashmore 1997), daun dewa (Gati &
Purnamaningsih 2005), pule pandak (Gati & Mariska 2001).
Konservasi in vitro tanaman purwoceng melalui pertumbuhan minimal
pernah dilaporkan, namun hasilnya kurang memuaskan dimana kultur tidak dapat
disimpan dalam waktu lebih dari empat bulan. Hasil penelitian tersebut
menunjukkan, media terbaik untuk penyimpanan yaitu DKW dengan retardan
yang cocok yaitu paklobutrazol 5 ppm (Rahayu & Sunarlim 2002). Oleh karena
itu diperlukan pengembangan metode penyimpanan melalui teknik pertumbuhan
minimal untuk memperpanjang masa simpan kultur tanpa tindakan subkultur
secara berulang-ulang. Pemberian secara bersama-sama regulator osmotik sorbitol
dan retardan pertumbuhan paklobutrazol diharapkan dapat memperpanjang umur
Kondisi yang diharapkan di dalam konservasi in vitro yaitu kultur dapat
disimpan selama mungkin dengan viabilitas tinggi tanpa menyebabkan penurunan
daya regenerasi. Retardan tumbuh maupun regulator osmotik pada taraf
konsentrasi tertentu berpotensi menginduksi perubahan sejumlah karakter
morfologi, anatomi, fisiologi bahkan mutasi. Hal ini menyebabkan menurunnya
daya regenerasi kultur pasca penyimpanan. Untuk itu pengujian daya regenerasi,
karakter morfologi dan anatomi pasca penyimpanan perlu dilakukan.
Tujuan Penelitian
1. Mendapatkan konsentrasi perlakuan sorbitol dan paklobutrazol terbaik untuk
menyimpan kultur purwoceng selama 4 dan 8 bulan.
2. Menguji daya regenerasi, stabilitas karakter morfologi dan anatomi kultur
purwoceng pasca kedua periode simpan.
3. Membandingkan daya regenerasi, stabilitas karakter morfologi dan anatomi
kultur purwoceng pasca kedua periode simpan.
Hipotesis Penelitian
1. Terdapat satu atau lebih konsentrasi perlakuan sorbitol dan paklobutrazol
terbaik untuk menyimpan kultur purwoceng selama 4 dan 8 bulan.
2. Tidak terjadi penurunan daya regenerasi maupun perbedaan karakter
morfologi dan anatomi kultur purwoceng pasca kedua periode simpan.
3. Tidak terdapat perbedaan daya regenerasi maupun karakter morfologi dan
anatomi kultur purwoceng antara kedua periode simpan.
Manfaat Penelitian
Formulasi terbaik sorbitol dan paklobutrazol dalam memperpanjang umur
simpan kultur in vitro purwoceng, diharapkan dapat diterapkan secara rutin
sebagai protokol penyimpanan melalui pertumbuhan minimal di bank gen.
Dengan aplikasi teknik konservasi in vitro ini maka kepunahan spesies langka
tersebut dapat dihindari. Selain itu, koleksi aktif (yang disimpan dengan
pertumbuhan minimal) dapat diperbanyak kembali untuk keperluan produksi bibit
TINJAUAN PUSTAKA
Botani Purwoceng
Purwoceng adalah istilah dalam bahasa Jawa bagi tumbuhan yang memiliki
nama ilmiah Pimpinella pruatjan Molk. Biasa juga disebut gebangan depok
(Jawa), antanan gunung (Sunda) atau suripandak abang. Purwoceng hidup secara
endemik di daerah pegunungan seperti Dataran Tinggi Dieng dan Gunung Lawu
di Jawa Tengah, Gunung Pangrango dan Gunung Galunggung di Jawa Barat, serta
di Pegunungan Tengger dan Iyang di Jawa Timur (Heyne 1987).
Tanaman dari kelas dikotil dan famili apiaceae yang memiliki nama sinonim
Pimpinella alpina Kds, merupakan tanaman terna perenial dengan struktur batang
roset. Tangkai daun mendatar sehingga tajuk tanaman menutupi permukaan tanah
hampir membentuk bulatan, dengan diameter 33.9 – 50 cm. Purwoceng memiliki
daun majemuk berhadapan berpasang-pasangan berjumlah 18.9 – 24.8
helai/tanaman, di ujung tangkai terdapat daun tunggal. Bentuk anak daun
membulat dengan tepi bergerigi. Warna permukaan atas daun hijau dan bawah
daun hijau keputihan.Tangkai daun memiliki panjang 8.6 – 13.1 cm tumbuh rapat
menutupi batang, seolah batang tidak ada. Warna pangkal daun pada umumnya
berwarna merah kecoklatan dan panjang daun 20.1 – 28.2 cm. Tanaman berbunga
majemuk membentuk bunga payung, setiap tandan bunga yang berbentuk payung
tersebut terdapat lebih kurang 5 – 10 bunga. Sistem perakaran tunggang dengan
akar utama membesar seolah membentuk umbi seperti bentuk ginseng tetapi tidak
[image:30.595.222.403.578.720.2]sebesar ginseng (Rahardjo et al. 2005; Rostiana et al. 2007).
Mikropropagasi dan Regenerasi Purwoceng
Purwoceng merupakan tanaman obat langka yang cukup potensial untuk
dikembangkan sebagai sumber bahan baku afrodisiak. Dalam mendukung
budidaya dan pengadaan sumber eksplan untuk keperluan berbagai topik kajian
tentang tanaman ini, diperlukan jumlah bahan yang memadai, salah satunya
melalui teknik perbanyakan in vitro atau mikropropagasi. Kestabilan teknik
mikropropagasi dan regenerasi merupakan syarat utama yang harus dipenuhi
sebelum melakukan studi penyimpanan secara in vitro.
Metode regenerasi dapat ditempuh melalui organogenesis maupun
embriogenesis somatik (Roostika et al. 2005). Purwoceng dapat diregenerasikan
secara in vitro melalui organogenesis proliferasi tunas aksilar. Kondisi inkubasi
terbaik untuk regenerasi adalah dalam growth chamber dengan temperatur 9°C
dan penyinaran dengan insensitas cahaya 1000 lux. Adapun media dasar terbaik
yaitu DKW yang mengandung 4 ppm BA dan 100 ppm arginin. Sumber eksplan
berupa kuncup aksiler tanpa daun. Dengan kondisi tersebut kultur mampu
menghasilkan 2.8 tunas pada minggu ke-10. Induksi perakaran paling cepat 40
hari dengan persentase perakaran paling tinggi (100%) dapat ditempuh melalui
penambahan NAA 1 ppm pada media DKW (Roostika et al. 2006).
Kultur yang telah melampaui periode penyimpanan diharapkan tidak
mengalami penurunan daya tumbuh pada media regenerasi, dan tidak
menimbulkan perubahan karakter morfologi maupun anatomi. Retardan
pertumbuhan dan cekaman air menimbulkan perubahan luas daun, kerapatan
stomata, kandungan klorofil, protein, bahkan lebih jauh lagi perubahan pada
tingkat ultrastruktur (Kasele et al. 1995; Utrillas & Alegre 1997). Pada penelitian
Gati dan Purnamaningsih (2005), tunas daun dewa yang telah disimpan selama 7
bulan dalam 4 ppm paklobutrazol tetap memiliki daya tumbuh yang tinggi setelah
dikulturkan pada media regenerasi MS + 2 ppm BA, selain itu tunas yang berakar
selama masa simpan dapat langsung diaklimatisasi di rumah kaca. Demikian pula
Saldana dan Garcia de la Rosa (1996) melaporkan bahwa tidak ada perbedaan
pertumbuhan pada tanaman kentang umur 1 bulan setelah disimpan dalam 250
ppm paklobutrazol selama 4 bulan.
Pengumpulan plasma nutfah di kebun koleksi sangat berisiko dan juga
membutuhkan lahan, waktu, tenaga dan biaya yang cukup besar. Konservasi in
vitro merupakan solusi yang tepat untuk permasalahan di atas. Untuk memperoleh
hasil yang optimal dalam penyimpanan in vitro, ada beberapa prinsip yang dapat
diterapkan yaitu : meminimumkan pertumbuhan biakan sehingga interval waktu
subkultur lebih panjang, memelihara agar viabilitas tunas yang disimpan tidak
menurun dan mencegah terjadinya variasi somaklonal (Gati 1999).
Teknik penyimpanan in vitro mempunyai beberapa kelebihan, seperti
penghematan lahan, tenaga kerja, biaya dan waktu, biakan dapat segera
diperbanyak apabila diperlukan, juga kemudahan dalam pertukaran plasma nutfah
dan bebas dari gangguan hama dan penyakit. Namun adapula beberapa kendala
dalam pemanfaatannya yaitu butuh tenaga trampil, dan analisis kestabilan genetik
pada materi yang disimpan setiap periode tertentu (Ashmore 1997). Selain itu
risiko kematian atau kehilangan genotip pun tetap ada. Oleh karena itu kebun
koleksi plasma nutfah tetap diperlukan (Mariska et al. 1996).
Penyimpanan plasma nutfah secara in vitro salah satunya ditempuh melalui
pertumbuhan lambat atau minimal. Pada penyimpanan ini eksplan dikondisikan
tumbuh dalam keadaan sub optimal dimana pertumbuhan berlangsung sangat
lambat. Metode ini memiliki beberapa keuntungan antara lain bahan yang
disimpan siap pakai apabila diperlukan, mudah diamati kondisinya, dan bahan
dengan mudah disimpan kembali (Wilkins & Dodds 1983).
Beberapa faktor yang dapat digunakan untuk pertumbuhan minimal adalah:
1. Menurunkan temperatur inkubasi (4 – 12°C) atau (20°C) (Hu & Wang 1983).
Sebelum perlakuan, tunas dikultur terlebih dahulu selama 3 – 4 minggu pada
kondisi pertumbuhan standar, setelah itu dipindahkan ke kondisi perlakuan
dengan fotoperiodisitas 16 jam dan intensitas cahaya rendah, sekitar 50 lux
(Chawla 2002).
2. Mengurangi atau menghilangkan beberapa faktor esensial untuk pertumbuhan
normal seperti pengenceran media dasar dan mengurangi konsentrasi zat
pengatur tumbuh (Debrunais et al. 1992; Wilkin & Dodds 1983).
3. Meningkatkan tekanan osmotik dengan menambahkan bahan osmotik seperti
Dengan adanya bahan osmotik maka potensial osmotik media menjadi lebih
rendah dan menyebabkan penyerapan unsur hara oleh sel tanaman menjadi
lambat (Bessembinder et al. 1993; Wilkins & Dodds 1983).
4. Menambahkan inhibitor asam absisat dan zat pelambat tumbuh (retardan)
ancimidol, cicocel, atau paklobutrazol untuk menghambat pembelahan dan
pemanjangan sel (Harijono 1990; Withers 1985).
5. Memperkecil luas tempat penyimpanan (Negri et al. 1995).
Bahan tanaman yang sebaiknya disimpan pada kultur in vitro adalah
meristem, karena meristem adalah bagian tanaman yang bebas penyakit dan
mudah diregenerasikan karena terdiri dari kumpulan sel yang aktif membelah.
Eksplan berupa suspensi sel atau kalus jarang dilakukan karena dikhawatirkan
terjadi penyimpangan genetik (Grout 1995). Kultur kalus pun tidak dianjurkan
karena menyebabkan penurunan sintesis produk sekunder, dan juga penurunan
kecepatan tumbuh pada media pemulihan (Withers 1991).
Penyimpanan dengan menurunkan temperatur sudah banyak memberikan
hasil, beberapa keuntungan dari penyimpanan tersebut menurut Mariska et al.
(1996) antara lain : (a) suhu rendah menghambat pertumbuhan dan perkembangan
tanaman secara alami, dan secara nyata dapat memperpanjang masa simpan; (b)
tingkat mutasi pada biakan lebih rendah; (c) lebih praktis sehingga
memungkinkan penyediaan plasma nutfah yang siap dimanfaatkan setiap waktu,
dan (d) bahan tanaman yang disimpan dapat dipertahankan dalam keadaan haploid
karena pada suhu lebih tinggi akan merubah bahan tanaman menjadi diploid.
Namun metode tersebut sulit dilakukan di negara-negara berkembang disebabkan
mahalnya fasilitas penyimpanan dengan suhu yang dapat diatur, juga pasokan
listrik yang kadang-kadang sering terganggu. Beberapa tanaman yang sudah
berhasil disimpan menggunakan temperatur rendah antara lain : kentang, ubi kayu
dan ubi jalar, pisang, apel (Bannerjee & De Langhe 1985; Wilkins & Dodds
1983). Namun metode yang paling banyak diterapkan adalah dengan
menggunakan zat pelambat pertumbuhan (retardan), inhibitor osmotik atau
Regulator Osmotik dan Retardan Pertumbuhan
Regulator osmotik (osmoregulator) merupakan suatu zat yang dapat
menurunkan pertumbuhan tanaman dengan cara mempengaruhi tekanan osmotik
dalam media kultur. Sorbitol dan manitol merupakan jenis osmoregulator yang
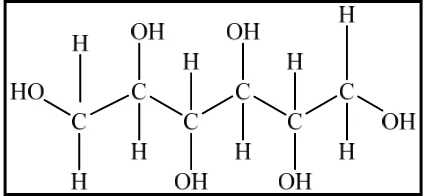
dianjurkan (Grout 1995). Sorbitol adalah gula alkohol yang dimetabolismekan
dengan kecepatan sangat rendah, berasal dari glukosa yang mengalami reduksi
pada gugus aldehid menjadi hidroksil. Struktur kimia sorbitol adalah sebagai
[image:34.595.206.419.276.374.2]berikut :
Gambar 2 Struktur kimia sorbitol
Penambahan manitol maupun sorbitol ke dalam media kultur menghambat
pertumbuhan dan perkembangan tanaman kultur tanpa mempengaruhi sifat
genetiknya (Gamborg & Shyluk 1981 dalam Dewi 2002), sehingga sorbitol dapat
digunakan untuk konservasi in vitro. Penyimpanan tiga aksesi talas (Colocasia
esculenta) secara in vitro berhasil dilakukan melalui penambahan manitol 40 %
pada media MS (Dewi 2002). Penyimpanan talas lebih lama sampai tiga tahun
diperoleh melalui kombinasi perlakuan manitol dan temperatur 9°C
(Bessembinder et al. 1993). Kultur tunas pisang Musa balbisiana ‘Kluai Hin’
yang disimpan dalam media dengan penambahan sukrosa 10 % memberikan hasil
yang lebih baik diikuti berturut-turut oleh perlakuan glukosa 30 % dan sorbitol 50
%, dan lebih baik responnya bila dikultur pada temperatur 25°C dengan
fotoperiodisitas 16 jam selama 6 bulan (Promsorn & Kanchanapoom 2006).
Tanaman asparagus pun berhasil disimpan selama 2 tahun dalam media MS
dengan penambahan sukrosa 3%, sorbitol 4%, 0.4 ppm thiamin, 200 ppm
glutamin, 100 ppm inositol, 1 ppm ancimidol dan 0.8% agar, bahkan setelah
Retardan pertumbuhan atau zat pelambat pertumbuhan juga biasa digunakan
untuk menghambat pertumbuhan kultur, seperti paklobutrazol, ancimidol, cicocel
(CCC), Alar, B9, uniconazol, asam absisat, fospon D, maleik hidrazid,
diaminiazid (B995) (Chawla 2002; Wilkins & Dodds 1983; Pinhero & Fletcher
1994; Withers 1991). Zat pelambat tumbuh adalah senyawa-senyawa organik
sintetik yang dapat menghambat perpanjangan sel pada meristem sub apikal,
mengurangi laju perpanjangan batang bila diberikan pada tanaman yang responsif,
tanpa mempengaruhi pertumbuhan dan perkembangan daun (Dicks 1979 diacu
dalam Gati 1999 dan Wattimena 1987). Mekanisme penghambatan oleh retardan
pertumbuhan dapat dilihat pada lampiran 1.
Paklobutrazol merupakan anggota golongan triazol mempunyai rumus
empirik C15H20ClN3O dengan rumus kimia (2-RS, 3 RS)-1 (4-m klorofenil) – 4,4
dimetil – 2 (1 H-1, 2, 4-triazol 1-Y1)- pentan-3-01. Paklobutrazol disebut juga
PP333 (Anonim1, 2005). Paklobutrazol secara komersil memiliki dua
stereoisomer (diastereoisomer 2RS, 3RS). Bentuk enansiomer (2S,3S) memiliki
peranan sebagai zat pengatur tumbuh pada tanaman dengan menghambat
biosintesis GA lebih spesifik, sedangkan enansiomer (2R, 3R) lebih aktif dalam
menghambat biosintesis sterol (Rademacher 2000). Struktur kimia paklobutrazol
adalah sebagai berikut :
N N
N
HO
Cl
Pengaruhnya antara lain menghambat panjang batang, meningkatkan
panjang trikoma, meningkatkan pembentukan lapisan lilin pada kutikula,
meningkatkan kandungan klorofil serta meningkatkan pertumbuhan akar (Pinhero
& Fletcher 1994). Zat pelambat tumbuh ini dapat pula menurunkan metabolisme
sel dan menghambat pertumbuhan vegetatif. Daya kerjanya antara lain
menghambat biosintesis giberelin, menurunkan kadar ABA, etilen dan IAA akan
tetapi meningkatkan kandungan sitokinin serta berperan sebagai senyawa proteksi
terhadap stress abiotik (Anonim2 2005; Methouachi et al. 1996).
Penyimpanan daun dewa (Gynura procumbens) menggunakan paklobutrazol
4 ppm atau ABA 5 ppm yang dalam media dasar ½ MS (Gati & Purnamaningsih
2005), tanaman pule pandak (Rauvolfia serpentina) menggunakan paklobutrazol
0.75 ppm dalam media MS dapat menghambat kultur selama 6 bulan (Gati &
Mariska 2001). Sunarlim et al. (2000) menemukan bahwa semakin tinggi
konsentrasi paklobutrazol ataupun ancimidol sampai 5 ppm, semakin pendek
kultur purwoceng, daun makin kecil tetapi jumlahnya semakin banyak. Adapun
pada tanaman ubi kayu, penambahan paklobutrazol 3 ppm pada media MS dapat
menghambat pertumbuhan selama enam bulan, sementara itu pada perlakuan
ABA 1 ppm dapat lebih lama lagi sampai 10 bulan (Sunarlim & Zuraida 2001).
Penyimpanan purwoceng berhasil dilakukan pada media dasar DKW dengan
penambahan ancimidol 1.5 ppm, namun hanya bertahan sampai empat bulan saja
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Ekofisiologi Balai Penelitian
Tanaman Obat dan Aromatik (Balittro) dan Laboratorium Anatomi Tumbuhan
Departemen Biologi FMIPA-IPB pada bulan Agustus 2007 sampai Oktober 2008.
Metode Penelitian
Penelitian terdiri dari tiga tahap meliputi : 1) penyimpanan secara in vitro,
2) pengujian daya regenerasi pasca penyimpanan dan 3) pengujian stabilitas
karakter morfologi dan anatomi purwoceng pasca penyimpanan. Diagram alir
tahapan penelitian dapat dilihat pada gambar 4.
Penyimpanan In Vitro
Eksplan berupa kuncup aksiler in vitro tanpa daun berukuran ± 2 mm
disimpan dalam media DKW (lampiran 2) + sukrosa 2.5% yang mengandung
kombinasi inhibitor osmotik dan retardan pertumbuhan secara aseptik di dalam
Laminar Air Flow Cabinet (LAFC). Inhibitor osmotik yang diuji yaitu sorbitol
dengan lima tingkatan konsentrasi dan satu kontrol (0, 1, 2, 3, 4 dan 5%),
sedangkan retardan pertumbuhan yaitu paklobutrazol dengan tiga tingkatan
konsentrasi dan satu kontrol (0, 1, 3 dan 5 ppm). Dengan demikian jumlah total
perlakuan 24 unit. Satu unit (botol) perlakuan mengandung 3 eksplan dengan
jumlah ulangan 6 kali. Kultur diinkubasikan di dalam rak kultur pada suhu 20 –
25°C dan fotoperiodisitas 16 jam terang dengan intensitas cahaya 800 – 1000 lux.
Penyimpanan kultur meliputi dua periode yaitu 4 dan 8 bulan.
Peubah yang diamati meliputi : jumlah tunas, daya hidup dan morfologi
kultur yang diamati secara visual pada bulan terakhir penyimpanan, sedangkan
Kuncup aksiler in vitro tanpa daun
Disimpan selama 4 dan 8 bulan dalam 24 kombinasi perlakuan
sorbitol dan paklobutrazol
Pengujian daya regenerasi selama 3 bulan
setelah penyimpanan 4 dan 8 bulan
Pengujian karakter anatomi daun bulan ke-3 regenerasi setelah penyimpanan
4 dan 8 bulan
Penentuan kombinasi perlakuan terbaik untuk penyimpanan 8 bulan
[image:38.595.219.431.98.654.2]Kombinasi terbaik sorbitol dan paklobutrazol
Pengujian DayaRegenerasi Pasca Penyimpanan
Pada akhir kedua periode penyimpanan, kultur dipindahkan ke media
regenerasi untuk diuji daya regenerasinya pasca penyimpanan. Sebelumnya daun
layu dan bagian kultur yang mati dibuang. Media regenerasi yaitu media
perbanyakan (multiplikasi) terdiri dari media DKW + BA 4 ppm + TDZ 0.4 ppm
+ Glutamin 100 ppm (Roostika et al. 2005) dengan penambahan GA3 3 ppm.
Regenerasi berlangsung selama tiga bulan. Peubah yang diamati meliputi : jumlah
tunas, daya hidup dan morfologi kultur yang diamati secara visual pada akhir
masa regenerasi, sedangkan bobot basah kultur ditimbang setiap bulan.
Pengujian Stabilitas Karakter Anatomi
Pengamatan karakter anatomi daun dilakukan secara mikrokopis terhadap
preparat irisan paradermal dan melintang daun. Preparat paradermal daun dibuat
dengan metode preparat utuh (whole mount) menurut Johansen (1940) yang
dimodifikasi. Tahapannya adalah : daun difiksasi dalam alkohol 70% selama 3
malam, dicuci selanjutnya disayat menggunakan silet. Hasil sayatan paradermal
direndam dalam larutan pemutih (sodium hipoklorit 5.25%) (v/v) selama 10
menit, sayatan dicuci, selanjutnya dilakukan pewarnaan menggunakan safranin
2% (b/v) selama 3 menit. Sayatan dicuci kembali kemudian diletakkan di atas
gelas objek, ditetesi gliserin 30% lalu ditutup dengan gelas penutup dan diberikan
cat kuku pada sekeliling tepi gelas penutup.
Karakter anatomi daun dari preparat paradermal yang diamati adalah bentuk
sel epidermis, kerapatan dan ukuran stomata (panjang dan lebar) yang dihitung
berdasarkan persamaan :
Kerapatan Stomata = Jumlah Stomata / Luas Daun (mm2)
(Salisbury 1928 diacu dalam Wilmer 1983)
Pengamatan kerapatan stomata dilakukan sebanyak 3 ulangan, setiap
ulangan meliputi dua luas bidang pandang yang dipilih secara acak, sedangkan
pengukuran panjang dan lebar stomata dilakukan 3 ulangan setiap ulangan
Preparat irisan melintang daun dibuat melalui metoda parafin dengan
menggunakan dehidran n-butanol (Nakamura 1995). Sampel daun yang kira-kira
berukuran sama difiksasi dalam larutan FAA (formalin, asam asetat glasial,
alkohol 50%) selama 24 jam. Selanjutnya dilalukan ke dalam seri larutan dehidran
II sampai VII masing-masing selama 1 jam kecuali dehidran VII diulang satu kali.
Setelah itu diinfiltrasi dengan parafin dan dehidran VII 1 : 1 selama 8 jam pada
suhu kamar, lalu dipindahkan ke oven 58ºC semalam. Selanjutnya campuran
parafin dan dehidran VII dibuang lalu diganti parafin murni, infiltrasi dilanjutkan
3 malam. Berikutnya sampel daun dalam parafin dicetak ke dalam wadah khusus,
setelah dingin blok sampel ditempelkan pada pemegang bahan (holder) pada
mikrotom. Blok sampel diiris melintang dengan ketebalan 10 µm menggunakan
mikrotom putar Yamato RV-240. Pita parafin hasil irisan ditempel pada gelas
objek yang diberi gliserin-albumin (1 : 1) dan akuades lalu dikeringkan di atas
warming tray semalam. Preparat setengah jadi dilalukan pada seri larutan
pewarnaan alkohol-xilol. Preparat diwarnai dengan safranin 2% (b/v) selama 3
malam dan fast green 0.5 % (b/v) selama 1.5 jam, ditetesi entelan lalu ditutup
dengan gelas penutup.
Karakter anatomi irisan melintang daun meliputi : tebal epidermis atas dan
bawah, tebal mesofil serta kualitatif struktur daun. Pengamatan dilakukan
sebanyak 3 ulangan di bawah mikroskop cahaya pada perbesaran 100 dan 400X.
Pengambilan foto dilakukan dengan menggunakan fotomikroskop Olympus CX
40 yang disambungkan dengan kamera Olympus OM-20 pada perbesaran yang
sama.
Rancangan Percobaan dan Analisis Data
Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak
Lengkap (RAL). Faktor pertama konsentrasi sorbitol dan faktor kedua
konsentrasi paklobutrazol. Data dianalisis dengan ANOVA dilanjutkan dengan
uji Duncan Multi Range Test (DMRT) pada taraf α = 5% menggunakan program
Tabel 1 Rincian kombinasi perlakuan sorbitol dan paklobutrazol
Sorbitol (S)
Paklobutrazol (P) 0 1 2 3 4 5
0 S0P0 S1P0 S2P0 S3P0 S4P0 S5P0
1 S0P1 S1P1 S2P1 S3P1 S4P1 S5P1
3 S0P3 S1P3 S2P3 S3P3 S4P3 S5P3
5 S0P5 S1P5 S2P5 S3P5 S4P5 S5P5
Keterangan : S0P0 = kontrol
SxP0 = perlakuan sorbitol x %,
S0Py = perlakuan paklobutrazol y ppm
SxPy = perlakuan kombinasi sorbitol x % dan paklobutrazol y ppm
HASIL DAN PEMBAHASAN
Penyimpanan In Vitro
Hasil penelitian sebelumnya tentang penyimpanan in vitro kultur
purwoceng menunjukkan bahwa pemberian ancimidol 1.5 ppm maupun
paklobutrazol 5 ppm dalam media tidak mampu menyimpan kultur lebih dari 4
bulan (Rahayu & Sunarlim 2002). Upaya peningkatan umur penyimpanan
dilakukan melalui pemberian kombinasi regulator osmotik dan retardan
pertumbuhan dalam hal ini sorbitol dan paklobutrazol. Perlakuan secara
bersamaan kedua faktor tersebut pada tingkatan konsentrasi tertentu dapat
menimbulkan cekaman atau mampu menghambat pertumbuhan sehingga kultur
dapat disimpan lebih lama. Oleh karena itu penelitian ini dilakukan pada dua
periode penyimpanan yaitu 4 dan 8 bulan.
Penambahan sorbitol dan paklobutrazol secara tunggal pada media
penyimpanan sudah banyak dilakukan untuk menghambat laju pertumbuhan
sampai kondisi sub optimal, sehingga kultur mampu bertahan selama jangka
waktu penyimpanan tertentu. Penggunaan secara bersama-sama regulator osmotik
manitol dan zat penghambat tumbuh paklobutrazol secara bersamaan terhadap
penyimpanan tunas nilam telah dilaporkan oleh Gati (1999), hasilnya adalah
kombinasi manitol 3% dan paklobutrazol 5 ppm mampu menyimpan kultur
sampai 6 bulan dan tumbuh normal pada media regenerasi. Kombinasi lebih dari
satu macam faktor stres seperti suhu rendah dengan inhibitor osmotik, dalam
beberapa kasus memberikan hasil lebih baik tetapi pada kasus lain justru berakibat
fatal karena dapat menimbulkan kerusakan pada eksplan (Withers 1991).
Pengaruh kombinasi sorbitol dan paklobutrazol terhadap pertumbuhan
kultur selama penyimpanan, diamati terhadap sejumlah peubah sebagai berikut :
Bobot Basah
Hasil penelitian menunjukkan, kultur pada semua kombinasi perlakuan (24
kombinasi) mampu bertahan hidup sampai bulan ke-4 penyimpanan, namun
mengalami penghambatan pertumbuhan (diwakili peubah bobot basah) yang
maupun paklobutrazol (kontrol/S0P0), dimana rata-rata bobot basah bulan ke-4
penyimpanan mencapai 0.36 g. Penghambatan mulai terlihat pada kombinasi
perlakuan sorbitol 0% dan paklobutrazol 3 ppm (S0P3) disusul S3P0. Adapun
pertumbuhan minimum dicapai oleh kombinasi perlakuan sorbitol dan
paklobutrazol konsentrasi tinggi yaitu sorbitol 5% dan paklobutrazol 5 ppm
dengan rata-rata bobot basah hanya 0.04 g pada bulan ke-4 penyimpanan. Namun
secara umum kultur pada semua kombinasi perlakuan masih berada pada kondisi
pertumbuhan yang baik sehingga penyimpanan dilanjutkan sampai 8 bulan
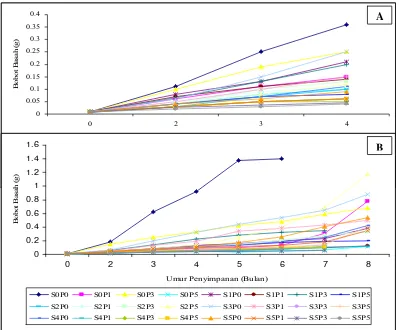
(Gambar 5A). 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
0 2 3 4
Umur Penyimpanan (Bulan)
[image:43.595.113.512.274.604.2]Bo b o t Ba sa h ( g )
Gambar 5 Pengaruh kombinasi sorbitol (S;%) dan paklobutrazol (P;ppm) terhadap pertumbuhan kultur (bobot basah; g) selama 4 bulan penyimpanan (A) dan 8 bulan penyimpanan (B).
Pada penyimpanan 8 bulan, dari 24 kombinasi perlakuan yang bertahan
hidup hanya 17 kombinasi pelakuan, sisanya mati sebelum mencapai 8 bulan.
Kultur pada kontrol hanya mampu hidup 6 bulan dan kultur pada 6 kombinasi
S0P0 S0P1 S0P3 S0P5 S1P0 S1P1 S1P3 S1P5
S2P0 S2P1 S2P3 S2P5 S3P0 S3P1 S3P3 S3P5
S4P0 S4P1 S4P3 S4P5 S5P0 S5P1 S5P3 S5P5
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
0 2 3 4 5 6 7 8
Umur Penyimpanan (Bulan)
B obot B a sa h ( g)
S0P0 S0P1 S0P3 S0P5 S1P0 S1P1 S1P3 S1P5
S2P0 S2P1 S2P3 S2P5 S3P0 S3P1 S3P3 S3P5
S4P0 S4P1 S4P3 S4P5 S5P0 S5P1 S5P3 S5P5
A
perlakuan yang tidak bertahan hidup mengalami kematian pada bulan ke-6 atau
ke-7 penyimpanan.
Pertumbuhan kultur pada perlakuan sangat berbeda dibandingkan kontrol.
Pertumbuhan kultur kontrol berlangsung sangat cepat mulai bulan ke-2 sampai
bulan ke-5, namun bulan selanjutnya terjadi stagnasi dan akhirnya kultur mati.
Pertumbuhan kultur pada kombinasi perlakuan sorbitol dan paklobutrazol selama
8 bulan terlihat bervariasi, ada yang masih tumbuh, ada yang stagnan bahkan
adapula yang mati sebelum mencapai bulan ke-8 penyimpanan. Kultur yang tidak
bertahan sampai bulan ke-8 berasal dari perlakuan dengan konsentrasi tinggi
seperti sorbitol 5% dan paklobutrazol 5 ppm (Gambar 5B). Kematian kultur
diduga akibat efek toksik perlakuan selama penyimpanan.
Kombinasi sorbitol dan paklobutrazol berpengaruh nyata dalam menekan
pertumbuhan kultur selama 4 bulan. Pertumbuhan paling rendah terdapat pada
kombinasi perlakuan dengan konsentrasi paling tinggi yaitu sorbitol 5 % dan
paklo 5 ppm (S5P5).
Kultur pada kondisi kontrol pun tidak bertahan, namun penyebabnya karena
pertumbuhan yang sangat cepat memicu penuaan dan kematian yang lebih cepat
juga. Proses metabolisme yang berlangsung dengan cepat menyebabkan kultur
cepat besar sehingga kandungan nutrisi dalam media semakin cepat habis.
Menurut (Salisbury & Ross 1992) ketersediaan unsur hara berpengaruh terhadap
penuaan dan kematian sel.
Sorbitol merupakan senyawa osmoregulator yang menyebabkan penurunan
potensial osmotik dalam media kultur dan menginduksi peningkatan konsentrasi
zat terlarut dalam sel sebagai usaha untuk memelihara turgiditas sel (Salisbury &
Ross 1992). Pada tanaman yang mengalami stres osmotik, air menjadi faktor
pembatas di dalam sejumlah proses fisiologis dan biokimia sehingga dapat
mempengaruhi laju pembelahan dan pembesaran sel tanaman.
Paklobutrazol menyebabkan penghambatan pada pembelahan, pembesaran
sel dan sedikit mempengaruhi pembentukan daun, sehingga kultur yang
dihasilkan kerdil dengan daun yang bertumpuk. Kondisi ini menyebabkan ketidak
kultur terhambat. Apabila hal ini berlangsung dalam periode yang cukup lama dan
dalam konsentrasi perlakuan tinggi pada akhirnya akan mengakibatkan kematian.
Kultur pada beberapa kombinasi perlakuan mengalami penghambatan
pertumbuhan tanpa menimbulkan efek kematian sampai bulan ke-8 penyimpanan.
Kombinasi perlakuan tersebut di antaranya S0P1, S0P3, S1P0, S1P5, S3P1 dan
S5P0. Kondisi pertumbuhan yang diharapkan selama penyimpanan yaitu lambat
namun tidak sampai tercekam. Pertumbuhan yang terlampau lambat justru
menyebabkan kematian pada saat penyimpanan atau saat regenerasi. Grafik
pertumbuhan S0P1, S0P3, S1P0, S3P1 dan S5P0 berada di posisi tengah
sedangkan S1P5 berada dibawahnya sehingga kombinasi perlakuan ini masih
cukup baik untuk penyimpanan.
Pertumbuhan lambat disebabkan karena paklobutrazol pada konsentrasi tertentu mampu menghambat oksidasi prekursor giberelin yaitu ent-kaurene
menjadi ent-kaurenoic acid yang akhirnya menghambat biosintesis giberelin
(Methoachi et al. 1996 dan Rademacher 2000), sedangkan giberelin memiliki
peranan penting dalam menginduksi perpanjangan batang dan menghilangkan
dormansi tunas (Saliabury & Ross 1992). Menurut Croker et al. (1995) perlakuan
paklobutrazol menyebabkan akumulasi ent-kaurene pada skutelum gandum. Hal
ini menunjukkan terganggunya aktivitas enzim ent-kaurene oksidase yang
berperan dalam mengoksidasi ent-kaurene menjadi ent-kaurenoic acid. Selain itu,
sorbitol dapat menurunkan potensial osmotik media sehingga penyerapan nutrisi
oleh sel berlangsung lebih lambat yang pada akhirnya menghambat pembelahan
sel (Bessembinder et al. 1993).
Jumlah Tunas
Jumlah tunas dipengaruhi secara nyata oleh faktor sorbitol dan
paklobutrazol secara tunggal menurut hasil analisis ragam pada bulan ke-4
penyimpanan. Pada perlakuan sorbitol, jumlah tunas paling tinggi terdapat pada
perlakuan sorbitol 1 ppm (2.5 tunas) melebihi kontrol (2.1 tunas), namun menurut
hasil uji lanjut Duncan tidak berbeda nyata terhadap kontrol. Pengaruh sorbitol
terhadap jumlah tunas lebih rendah dari kontrol pada konsentrasi 4 dan 5 ppm.
yang nyata terhadap jumlah tunas dibandingkan kontrol, tetapi tidak berbeda nyata
terhadap sesamanya. Jumlah tertinggi diperoleh pada perlakuan kontrol yaitu 2.1
tunas dan terendah pada perlakuan paklobutrazol 3 ppm yaitu 1.7 tunas (Tabel 2).
Perlakuan tunggal sorbitol dan paklobutrazol menghambat multiplikasi
tunas pada bulan ke-4 penyimpanan, namun penghambatan terlihat lebih nyata
pada perlakuan paklobutrazol dimana mulai konsentrasi 1 ppm sudah menurunkan
jumlah tunas secara nyata terhadap kontrol.
Tabel 2 Pengaruh tunggal sorbitol (S;%) dan paklobutrazol (P;ppm) terhadap jumlah tunas pada bulan ke-4 penyimpanan.
Jumlah Tunas Rataan
Perlakuan P0 P1 P3 P5 Sorbitol
S0 2.5 1.8 2.1 1.8 2.1 ab
S1 2.6 2.1 2.5 2.6 2.5 a
S2 1.8 1.9 1.7 2.0 1.9 bc
S3 2.4 2.1 1.6 1.3 1.9 bc
S4 1.5 1.2 1.1 1.3 1.3 d
S5 1.8 1.4 1.2 1.5 1.5 cd
Rataan 2.1 a 1.8 b 1.7 b 1.8 b Paklobutrazol
Keterangan : Angka yang diikuti oleh huruf yang sama dalam satu kolom dan satu baris yang sama tidak berbeda nyata pada taraf uji 5% (DMRT).
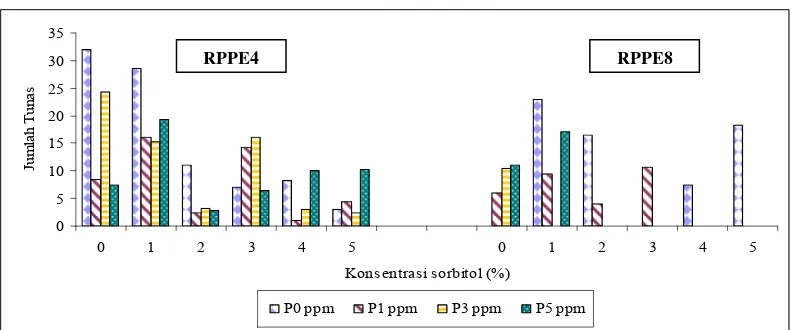
Jumlah tunas pada bulan ke-8 bervariasi baik pada perlakuan sorbitol
maupun paklobutrazol, hal ini disebabkan banyaknya eksplan yang mati sehingga
mempengaruhi nilai rata-rata jumlah tunas (Tabel 3).
Tabel 3 Pengaruh sorbitol (S;%) dan paklobutrazol (P;ppm) terhadap jumlah tunas pada bulan ke-8 penyimpanan.
Jumlah Tunas Rataan
Perlakuan P0 P1 P3 P5 Sorbitol
S0 x 1.7 2.5 2.0 2.1
S1 4.4 2.0 x x 3.2
S2 1.5 2.8 x 6.5 3.6
S3 4.1 2.7 x x 3.4
S4 2.4 x x x 2.4
S5 5.1 x x x 5.1
Rataan 3.5 2.3 2.5 4.25
Paklobutrazol
Paklobutrazol menghambat sintesis giberelin di dalam tanaman, akibatnya
pembelahan dan pemanjangan sel terhambat selain itu tunas tetap dorman. Hal ini
menyebabkan kultur sulit untuk membentuk tunas baru. Sedangkan pengaruh
sorbitol terhadap pembentukan tunas disebabkan karena stres osmotik yang
dialami tanaman dapat menghambat pembelahan sel, pemanjangan sel dan
sejumlah proses fisiologis penting dalam tanaman yang akhirnya menghambat
pembentukkan tunas baru.
Daya Hidup Kultur
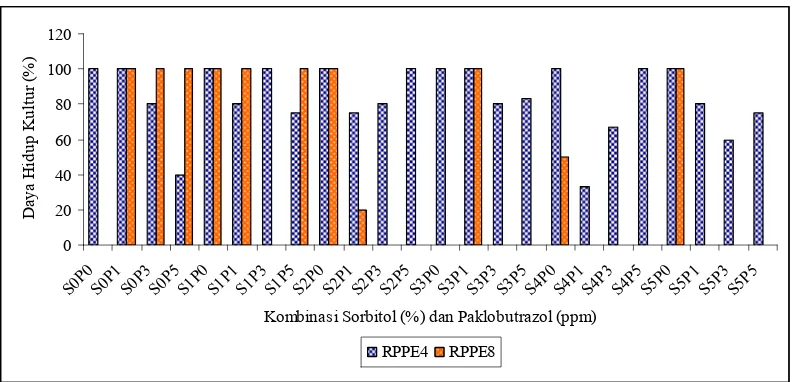
Daya hidup kultur pada akhir bulan ke-4 penyimpanan secara umum tinggi
sekitar 73 – 100%, namun menurun drastis pada bulan ke-8 penyimpanan.
Penurunan drastis umumnya terlihat pada kultur yang diberi perlakuan
paklobutrazol seperti S1P5 dan S5P1. Daya hidup kultur kontrol dan beberapa
kombinasi perlakuan memiliki persentase 0, sebab tidak mampu hidup sampai
akhir bulan ke-8 penyimpanan (Gambar 6).
Kultur yang tidak dapat bertahan sampai akhir bulan ke-8 terdapat pada
kombinasi perlakuan berikut : S3P3, S4P1, S4P3, S4P5, S5P3 dan S5P5. Selain
kontrol, kombinasi perlakuan yang tidak mampu mempertahankan viabilitas
kultur selama penyimpanan terdiri dari sorbitol dan paklobutrazol dengan
konsentrasi tinggi. Perlakuan kedua faktor dengan konsentrasi tinggi ini
menyebabkan kultur tidak hanya terhambat pertumbuhannya, tapi bahkan
mengalami stres, sehingga tidak mampu menjaga viabilitasnya selama periode
penyimpanan. 0 20 40 60 80 100 120
S0P0S0P1 S0P3S0P5S1P0 S1P1 S1P3S1P5S2P0 S2P1S2P3S2P5 S3P0S3P1S3P3S3P5S4P0S4P1S4P3 S4P5S5P0S5P1S5P3S5P5
Kombinasi Sorbitol (%) dan Paklobutrazol (ppm)
D aya H idup K ul tur ( % )
PE4 PE8
Morfologi Kultur
Pengaruh penghambatan sorbitol dan paklobutrazol terlihat pula pada
morfologi kultur. Pada kontrol, daun sudah menyentuh tepi botol dan
menunjukkan tanda-tanda penuaan (Gambar 7A), sedangkan kultur pada
kombinasi perlakuan sorbitol dan paklobutrazol seperti S3P1 relatif masih hijau
dan segar namun kultur tampak roset dan kerdil pada akhir bulan ke-4
penyimpanan (Gambar 7D). Perlakuan sorbitol dan paklobutrazol pada
konsentrasi tinggi membuat eksplan tidak mampu lebih lanjut menghasilkan daun
maupun tunas selama penyimpanan, eksplan terlihat kuning kecoklatan dan
sebagian daun mati pada akhir bulan ke-4 penyimpanan (Gambar 7B & F).
A B
C D E F
[image:48.595.115.501.297.532.2]G H I J
Gambar 7 Morfologi kultur akhir bulan ke-4 penyimpanan : (A) Kontrol (B) S0P5, (C) S1P0, (D) S3P1, (E) S5P0, (F) S5P5 dan bulan ke-8 penyimpanan : (G) S0P5, (H) S1P0, (I) S3P1 dan (J) S5P0.
Perlakuan kombinasi sorbitol dan paklobutrazol misalnya S3P1
menyebabkan kultur menjadi kerdil, helaian daun relatif lebih tebal dan sempit,
tangkai daun pendek dan lebar serta warna kultur lebih hijau pada penyimpanan 4
bulan. Paklobutrazol dikenal sebagai senyawa pengerdil tanaman (Effendi 1992)
mempunyai aktivitas menghambat pemanjangan batang dan meningkatkan
kandungan klorofil (Wang et al. 1986; Pinhero dan Fletcher 1994), sedangkan
sorbitol sebagai pemicu stres kekeringan, menyebabkan penurunan luas daun
Pada akhir bulan ke-8 penyimpanan, kultur sudah menunjukkan tanda-tanda
penuaan dan kematian (Gambar 6G, H, I & J). Hal ini disebabkan kandungan
nutrisi yang semakin berkurang dan stres perlakuan. Kondisi kultur yang
diharapkan selama penyimpanan adalah kerdil dengan jumlah tunas sedikit
sehingga unsur hara dalam media tidak cepat habis dan botol tidak cepat penuh,
sehingga kultur dapat disimpan lebih lama.
Regenerasi Pasca Penyimpanan
Kultur yang masih hidup pada akhir bulan ke-4 dan ke-8 penyimpanan
dipindahkan ke media regenerasi selama 3 bulan untuk pengujian daya regenerasi
pasca penyimpanan. Sebelum dipindahkan daun layu dan bagian kultur yang mati
dibuang terlebih dahulu, untuk menghindari keracunan akibat senyawa toksik dari
jaringan mati dan meminimumkan resiko kontaminasi.
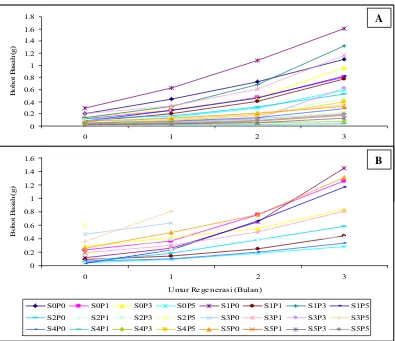
Pertumbuhan kultur dalam media regenerasi pasca penyimpanan, diukur
dengan cara menimbang bobot basah setiap bulan selama 3 bulan. Pertumbuhan
kultur pada berbagai kombinasi perlakuan selama 3 bulan regenerasi pasca
penyimpanan 4 bulan terlihat bervariasi. Kultur pada kombinasi perlakuan S1P0
memiliki kecepatan pertumbuhan paling tinggi melampaui kontrol, disusul
kombinasi S1P3 dan S3P1. Kecepatan pertumbuhan rendah dialami kultur yang
telah disimpan dalam kombinasi perlakuan dengan konsentrasi tinggi seperti
S4P1, S4P3, S5P1, S5P3 dan S5P5 (Gambar 8A).
Kultur yang telah disimpan selama 4 bulan, mengalami pertumbuhan sangat
cepat pada media regenerasi. Namun masih terlihat adanya perbedaan kecepatan
pertumbuhan pada berbagai kombinasi perlakuan. Hal ini menunjukkan bahwa
efek penghambatan sorbitol dan paklobutrazol selama penyimpanan masih
terbawa meskipun kultur sudah dipindah ke media regenerasi selama 3 bulan.
Demikian pula kultur yang telah disimpan 8 bulan menunjukkan
pertumbuhan yang bervariasi selama 3 bulan regenerasi. Kultur kontrol tidak
diregenerasikan karena sudah mati pada bulan ke-6 penyimpanan. Kultur pada
beberapa kombinasi perlakuan mengalami kematian pada bulan ke-1 dan ke-2
perlakuan S0P1, S1P0, S5P0 dan S1P5 adapun pertumbuhan kultur pada
kombinasi perlakuan S0P3 dan S3P1 cukup cepat (Gambar 8B).
Pertumbuhan yang diwakili peubah bobot basah mengalami penurunan
seiring meningkatnya konsentrasi perlakuan. Berbeda dengan hasil penelitian
Dewi (2002) yang menyatakan bahwa tanaman talas dari semua perlakuan manitol
dapat tumbuh dengan normal pada media regenerasi setelah penyimpanan 6 bulan.
Demikian pula Fletcher (1994) menemukan bahwa tanaman asparagus yang
disimpan 24 bulan dalam media yang mengandung sorbitol, tidak mengalami
penurunan kemampuan propagasi atau tetap vigor pada media regenerasi.
Bobot basah kultur bulan ke-3 regenerasi setelah 4 bulan penyimpanan bila
dibandingkan dengan bobot basah kultur yang telah disimpan 8 bulan, secara
umum mengalami penurunan.
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2 3
Umur Penyimpanan (Bulan)
[image:50.595.115.510.332.673.2]B o bot B a sa h ( g )
Gambar 8 Pengaruh kombinasi sorbitol (S;%) dan paklobutrazol (P;ppm) terhadap pertumbuhan kultur (bobot basah; g) selama 3 bulan regenerasi pasca penyimpanan 4 bulan (A) dan 8 bulan (B).
0 1
S0P0 S0P1 S0P3 S0P5 S1P0 S1P1 S1P3 S1P5
S2P0 S2P1 S2P3 S2P5 S3P0 S3P1 S3P3 S3P5
S4P0 S4P1 S4P3 S4P5 S5P0 S5P1 S5P3 S5P5
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
0 1 2 3
Umur Regeneras i (Bulan)
Bo b o t Ba sa h ( g )
S0P0 S0P1 S0P3 S0P5 S1P0 S1P1 S1P3 S1P5
S2P0 S2P1 S2P3 S2P5 S3P0 S3P1 S3P3 S3P5
S4P0 S4P1 S4P3 S4P5 S5P0 S5P1 S5P3 S5P5
A
Jumlah Tunas
Menurut hasil analisis ragam interaksi sorbitol dan paklobutrazol selama
penyimpanan berpengaruh nyata terhadap peubah jumlah tunas pada akhir bu