INDUKSI VARIASI SOMAKLONAL
DAN SELEKSI
IN VITRO
MENGGUNAKAN PEG
UNTUK IDENTIFIKASI VARIAN KACANG TANAH
YANG TOLERAN CEKAMAN KEKERINGAN
ENNI SUWARSI RAHAYU
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI DISERTASI DANSUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi saya yang berjudul
”INDUKSI VARIASI SOMAKLONAL DAN SELEKSI IN VITRO MENGGUNAKAN
PEG UNTUK IDENTIFIKASI VARIAN KACANG TANAH YANG TOLERAN
CEKAMAN KEKERINGAN” adalah hasil penelitian saya yang merupakan bagian
dari serangkaian penelitian HIBAH TIM PASCASARJANA angkatan I, tahun
ke-1, 2 dan 3 (2003-2005) yang berjudul ”Rekayasa Genetika dan Seleksi in vitro
untuk Mendapatkan Plasma Nutfah Kacang Tanah dengan Novel Characters –
Toleran terhadap Stres Kekeringan dan Resisten Penyakit Busuk Batang
Sclerotium” yang diketuai oleh Prof.Dr.Ir. Sudarsono, M.Sc. dan didanai oleh
Departemen Pendidikan Nasional. Disertasi ini belum pernah diajukan untuk
memperoleh gelar dalam program sejenis di perguruan tinggi manapun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2007
Enni Suwarsi Rahayu
ABSTRACT
ENNI SUWARSI RAHAYU. Induction of Somaclonal Variation and In Vitro
Selection Using PEG for Identification of Drought Tolerant Peanut Variants. Under direction of SUDARSONO, HAJRIAL ASWIDINNOOR, SATRIYAS ILYAS and EDI GUHARDJA.
Drought stress tolerance of peanut cultivar having certain mechanism without decreasing the yield needed to be developed. Somaclonal variation has been successfully used to obtain variant lines with improved drought stress tolerance. In this case, induction of somaclonal variation is followed by in vitro selection on selective medium containing polyethylene-glycol (PEG). The objective of this research were 1) to develop suitable in vitro selection method to obtain peanut somatic embryo that can tolerate stress due to addition of PEG in the selective medium, 2) to determine somaclonal variant indication of peanut, 3) to obtain plant population having somaclonal variation regenerated from in vitro selected somatic embryo, 4) to obtain somaclonal variant plants that are drought stress tolerance, and 5) to identify physiological mechanism involved in peanut drought stress tolerance.
In order to develop suitable in vitro selection method, several experiments were conducted to evaluate the effectiveness of polyethylene glycol (PEG)-6000 as in vitro selective agent; to determine the effective concentration of PEG to inhibit growth and development of seedling, epycotyl and somatic embryo; to evaluate tolerance of the peanut cultivars against PEG stress; and to determine changes in total proline content due to PEG stress. Results of the experiment indicated that addition of PEG 6000 into MS-0 medium inhibited growth and development of peanut seedling, epycotyl, and somatic embryo, but increased the tissue damage score and total proline content of epicotyl. Addition of PEG 6000 might be used to simulate drought stress under in vitro condition. PEG at 15% concentration was effective for inhibiting growth and development of peanut tissue. Based on these results, an in vitro selection method was developed to screen peanut somatic embryo that was drought stress tolerant, by maintaining somatic embryo for three months with three times sub-culturing in selective media MS with addition of 16 µM picloram and 15% PEG 6000.
A number of PEG induced stress insensitive somatic embryos were identified after culturing 500 clumps of embryogenic tissue of peanut cv. Kelinci with three consecutive passages on medium containing 15% PEG. Germination of selected somatic embryos and regeneration of plantlets resulted in 24 peanut R0 lines, nine lines of them produced normal R0:1 seed. In addition, a number of somatic embryos were identified after culturing clumps of embryogenic tissue with three consecutive passages on medium without PEG. Germination of cultured somatic embryos and regeneration plantlets resulted in 38 peanut R0 lines, 20 lines of them produced normal R0:1 seeds. The R1 somaclonal population of both was obtained by planting R0:1 seeds in glass-house, and then R2 somaclonal population was obtained by planting R1:2 seeds produced by R1 somaclones. These R0, R1 and R2 population were evaluated for both qualitative and quantitative characters.
iv
wide branching, excessive branching, leaf variegation, leaflet number abnormality, leaf pointed tip, ‘rosette’ leaf, complete sterility and male sterility. Plants regenerated from in vitro cultured have higher variation level than plants from in vitro selected somatic embryo. Variant phenotype of quantitative characters included plants with significantly higher plant dry weight, plant height, root dry weight and pod weight. There were four lines with significantly higher root dry weight, and three lines with significantly higher pod weight.The R1 and R2 populations were also evaluated to identify the drought stress tolerant lines. Drought stress was induced by pouring 15% PEG solution and by reducing watering. To induce stress by pouring 15% PEG, variant peanut seedlings were grown individually in plastic pot (600 ml) containing a mixture of burst rice-hull and manure (1:1, v/v). The seedlings were poured with PEG solution (15%) every two days since four leaves stage seven weeks after planting. Inducing drought stress by reducing watering was conducted by growing plants in polybag (50 cm) containing a mixture of top soil, sand and manure (2:1:1, v/v). These plants were divided into two groups. One group was subjected to stress condition periodically during vegetative and generative periods (12 – 80 days after planting) by watering them only after their 75% leaves have wilted; the other group was grown optimally by watering every two days.
The results of the experiments indicated 1) stress induced by PEG 15% solution at vegetative period reduced shoot growth, but did not affect negatively on root growth, 2) effect of drought stress at vegetative and generative periods on root and shoot growth were different between one population to another, 3) plant regenerated from in vitro cultured and in vitro selected somatic embryo have higher tolerance level to stress induced by PEG than the standard plant, 4) nine lines of progeny of plants regenerated from in vitro cultured and in vitro selected embryo somatic had drought stress tolerance character, and two of them had higher pod number than standard plant, both in optimal and stress condition, 5) the reduction of stomata density and the increase of leaf total proline content play sufficient role, while root/shoot ratio and primary root length did not play a significant role in plant tolerance to drought stress.
In conclusions, the induction somaclonal variation followed or didn’t follow by in vitro selection using PEG 15% were effective to obtain somaclonal variant that tolerate to drought stress without intensive root growth mechanism. Evaluation of drought stress tolerance resulted in four lines (2, 11.3, K0-30.1 and K15-4) that tolerate to drought stress and had higher pod weight than the standard plant.
RINGKASAN
ENNI SUWARSI RAHAYU. Induksi Variasi Somaklonal dan Seleksi In Vitro
Menggunakan PEG untuk Identifikasi Varian Kacang Tanah yang Toleran Cekaman Kekeringan. Dibimbing oleh SUDARSONO, HAJRIAL ASWIDINNOOR, SATRIYAS ILYAS dan EDI GUHARDJA.
Kultivar kacang tanah yang toleran terhadap cekaman kekeringan dengan mekanisme yang tidak menurunkan hasil panen masih perlu dikembangkan. Variasi somaklonal telah berhasil dimanfaatkan untuk menginduksi galur varian yang meningkat toleransinya terhadap kekeringan. Dalam penelitian ini induksi variasi somaklonal diikuti oleh seleksi in vitro dalam media selektif yang mengandung PEG. Penelitian bertujuan untuk 1) mengetahui metode seleksi in vitro yang efektif dalam rangka memperoleh ES kacang tanah yang toleran terhadap potensial air rendah, 2) mengetahui indikasi varian somaklonal kacang tanah, 3) memperoleh populasi tanaman varian somaklonal hasil seleksi in vitro, 4) memperoleh populasi tanaman varian somaklonal yang toleran terhadap cekaman kekeringan, dan 5) mengetahui mekanisme toleransi tanaman kacang tanah terhadap cekaman kekeringan secara fisiologis.
Untuk mengembangkan metode seleksi in vitro yang efektif dilakukan percobaan yang bertujuan menguji efektivitas PEG 6000 sebagai bahan penyeleksi dalam media in-vitrodengan mengevaluasi respon kecambah, tunas dan embrio somatik kacang tanah terhadap kondisi cekaman oleh PEG, menentukan konsentrasi PEG yang efektif menghambat pertumbuhan dan perkembangan jaringan eksplan, menentukan konsentrasi PEG sub-letal, dan mengukur perubahan kandungan prolina total jaringan akibat cekaman PEG. Dari hasil percobaan disimpulkan bahwa penambahan larutan PEG dalam media in-vitro memberikan kondisi cekaman yang ditandai dengan terhambatnya perkembangan eksplan dan peningkatan kandungan prolina dalam jaringan seperti respon terhadap cekaman kekeringan. Konsentrasi PEG 15% efektif menghambat pertumbuhan dan perkembangan jaringan eksplan dan merupakan konsentrasi sub letal yang dapat menapis jaringan dengan sifat yang toleran dari jaringan lain dengan sifat peka terhadap cekaman akibat PEG.
Berdasarkan hal ini dikembangkan metode seleksi in vitro untuk menapis embrio somatik kacang tanah yang toleran terhadap cekaman kekeringan, yaitu dengan memelihara embrio somatik varian selama tiga bulan dalam media selektif MS dengan fitohormon pikloram 16µM ditambah PEG 15%.
vi
Hasil evaluasi tersebut menunjukkan terdapat variasi somaklonal karakter kualitatif dan kuantitatif pada populasi R0, R1 dan R2. Variasi karakter kualitatif yang muncul meliputi percabangan melebar, percabangan berlebihan, daun pentafoliat, steril partial, steril total, daun roset, daun varigata, ujung daun meruncing, daun hexafoliat, dan daun oktafoliat. Variasi pada populasi tanaman hasil kultur in vitro lebih beragam dibandingkan pada populasi tanaman hasil seleksi in vitro. Variasi karakter kuantitatif yang bersifat positif tampak pada karakter bobot kering tajuk, tinggi tanaman, bobot kering akar dan bobot polong bernas. Ada empat galur tanaman yang me mpunyai variasi positif untuk bobot kering akar, dan tiga galur untuk bobot polong bernas.Populasi tanaman R1 dan R2 juga dievaluasi untuk mengidentifikasi galur yang toleran terhadap cekaman kekeringan. Cekaman kekeringan diinduksi dengan dua metode, yaitu dengan penyiraman PEG 15% dan dengan pengurangan penyiraman air. Untuk menginduksi cekaman dengan penyiraman PEG 15%, kecambah kacang tanah ditanam dalam pot plastik (600 ml) yang berisi media campuran arang sekam dan pupuk kandang (1:1, v/v). Kecambah disiram dengan larutan PEG 6000 15% setiap dua hari sekali, mulai tanaman mempunyai empat daun hingga berumur tujuh minggu. Induksi cekaman kekeringan melalui pengurangan penyiraman air dilakukan dengan menumbuhkan tanaman dalam polibag (diameter 50 cm) yang berisi media campuran tanah, pasir dan pupuk kandang (2:1:1, v/v). Tanaman-tanaman tersebut dibagi menjadi dua kelompok. Kelompok pertama diberi perlakuan cekaman kekeringan secara individual dengan menyiram air hanya setelah 75% daun yang dimiliki tanaman tersebut layu, sedangkan kelompok lain diberi penyiraman optimum setiap dua hari sekali.
Hasil percobaan menunjukkan 1) cekaman akibat penyiraman larutan PEG 15% pada fase vegetatif nyata menurunkan pertumbuhan tajuk, tetapi tidak berpengaruh terhadap pertumbuhan akar, 2) pengaruh cekaman kekeringan akibat pengurangan penyiraman air terhadap pertumbuhan tajuk dan akar berbeda antar populasi, 3) tanaman hasil kultur in vitro dan seleksi in vitro mempunyai tingkat toleransi terhadap cekaman kekeringan yang lebih tinggi dibandingkan tanaman standar, 4) diperoleh sembilan galur tanaman hasil kultur dan seleksi in vitro yang toleran terhadap cekaman kekeringan, dua di antaranya mempunyai jumlah polong bernas lebih tinggi dibandingkan tanaman standar, baik pada kondisi optimum maupun cekaman, 5) penurunan densitas stomata dan peningkatan kadar prolina total memainkan peran yang cukup berarti dalam mekanisme terhadap cekaman kekeringan, tetapi panjang akar primer dan nisbah akar/tajuk tidak berperan dalam mekanisme toleransi terhadap cekaman kekeringan.
Dari hasil semua tahap percobaan di atas, disimpulkan bahwa induksi variasi somaklonal dengan atau tanpa disertai seleksi in vitro menggunakan PEG 15% efektif untuk memperoleh tanaman varian somaklonal kacang tanah yang toleran terhadap kekeringan, dengan mekanisme yang tidak melalui pertumbuhan akar yang intensif. Dari evaluasi toleransi terhadap cekaman kekeringan diperoleh empat galur, yaitu K0-2, K0-11.3, K0-30.1 dan K15-4 yang toleran terhadap cekaman kekeringan dan mempunyai bobot polong bernas lebih besar daripada tanaman standar.
Hak cipta milik Institut Pertanian Bogor,
tahun 2007
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian
Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi,
viii
INDUKSI VARIASI SOMAKLONAL DAN
SELEKSI
IN VITRO
MENGGUNAKAN PEG
UNTUK IDENTIFIKASI VARIAN KACANG TANAH
YANG TOLERAN CEKAMAN KEKERINGAN
ENNI SUWARSI RAHAYU
Disertasi
sebagai salah satu syarat untuk memperoleh gelar doktor pada Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Disertasi : Induksi Variasi Somaklonal dan Seleksi In Vitro Menggunakan PEG untuk Identifikasi Varian Kacang Tanah yang Toleran Cekaman Kekeringan
Nama : Enni Suwarsi Rahayu
NRM : A. 361020041
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. Sudarsono, MSc. Ketua
Dr. Ir. Hajrial Aswidinnoor, MSc. Anggota
Dr.Ir. Satriyas Ilyas, MS Anggota
Prof.Dr.Ir. Edi Guhardja, MSc. Anggota
Diketahui :
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr.Ir. Satriyas Ilyas, MS Prof.Dr.Ir. Khairil Anwar Notodiputro, MS
x
PRAKATA
Alhamdulillahirabbil alamin, segala puji bagi Allah Tuhan semesta alam.
Atas izin dan petunjuk Allah Yang Maha Rahman dan Rahim pada akhirnya
penulis dapat menyelesaikan penelitian dan penulisan disertasi yang berjudul
”Induksi Variasi Somaklonal dan Seleksi In vitro Menggunakan PEG untuk
Identifikasi Varian Kacang Tanah yang Toleran Cekaman Kekeringan”. Disertasi
ini merupakan salah satu syarat untuk mendapatkan gelar doktor dari Institut
Pertanian Bogor.
Disertasi ini disusun berdasarkan serangkaian penelitian yang merupakan
bagian dari penelitian Hibah Tim Pasca Sarjana angkatan I, tahun 1, 2 dan 3
(tahun 2003 – 2005) yang berjudul ”Rekayasa Genetika dan Seleksi in-Vitro
untuk Mendapatkan Plasma Nutfah Kacang Tanah dengan Novel Characters –
Toleran terhadap Stres Kekeringan dan Resisten Penyakit Busuk Batang
Sclerotium” yang diketuai oleh Prof.Dr.Ir. Sudarsono, M.Sc. dan didanai oleh
Departemen Pendidikan Nasional.
Penelitian dan penulisan disertasi ini dapat diselesaikan karena peran dan
bantuan berbagai pihak. Oleh karena itu pada kesempatan ini penulis sampaikan
terima kasih yang sebesar-besarnya kepada:
1. Rektor Universitas Negeri Semarang yang telah memberi ijin untuk
menempuh studi program doktor,
2. Sekolah Pasca Sarjana IPB dan Program Studi Agronomi SPS IP B yang
telah menerima penulis sebagai mahasiswa program doktor pada tahun
2002,
3. Departemen Pendidikan Nasional, yang telah memberikan dana studi
selama tujuh semester melaui BPPS tahun 2002 – 2006 dan dana
penelitian melalui penelitian Hibah Tim Pascasarjana angkatan I tahun 1, 2
dan 3 (tahun 2003 – 2005),
4. Bapak Prof.Dr.Ir. Sudarsono, MSc. selaku Ketua Komisi Pembimbing, yang
telah memprakarsai penelitian Hibah Tim Pascasarjana yang merupakan
sumber utama dana penelitian disertasi ini, dan yang telah memberikan
bimbingan intensif dalam pelaksanaan penelitian, analisis data, penulisan
publikasi serta penulisan naskah disertasi,
5. Bapak Dr.Ir. Hajrial Aswidinnoor, MSc, Ibu Dr.Ir. Satriyas Ilyas, MS dan
yang telah memberikan bimbingan, arahan, dukungan moril yang sangat
bermanfaat dalam penulisan disertasi,
6. Penguji Luar Komisi Dr. Ir. Yudiwanti, MS, Dr.Ir. Sriani Sujiprihati, MS dan
Dr. Ir. Ika Mariska S.; yang telah memberikan saran perbaikan yang sangat
berarti dalam penulisan disertasi,
7. Rekan-rekan Tim Peneliti di Laboratorium Biologi Molekuler Tanaman
Faperta IPB : Dr.Ir. Yusnita, MSc, Dr.Ir. Endang Pujihartati, MSi, Dr. Ir.
Farid Hemon, MSc, Dr.Ir. Ahmad Riduan, MSi, Dr. Ir. Dwi Hapsoro, MSc,
Dr.Ir. Zuyasna, MSc., Ir. Yusniwati, MSi; atas persahabatan dan kesediaan
menjadi mitra diskusi yang handal,
8. Rekan-rekan dari Jurusan Biologi Universitas Negeri Semarang yang
bersama-sama menempuh studi S3 di IPB : Ir. Amin Retnoningsih, MSi,
Dra. Margareta Rahayuningsih, MSi, drh. R.Susanti, MP, Niken Subekti,
Ssi, MSi dan Drs. Y.Ulung Anggraito, MSi.; atas persahabatan dan
dukungan secara moril
9. Rekan-rekan teknisi di Laboratorium PMB Faperta IPB (Susilawati, Agus)
dan di Balitbiogen Bogor (Pak Juanda) atas bantuannya dalam
pelaksanaan penelitian,
10. Semua pihak yang telah membantu dalam pelaksanaan penelitian dan
ujian yang tidak dapat penulis sebutkan satu persatu.
Secara khusus terima kasih dan penghargaan penulis sampaikan kepada
suami tercinta Drs.H. Tri Widayat K. atas keikhlasannya memberi ijin, doa,
kesabaran, dukungan moril serta materiil yang tidak terhingga nilainya; sehingga
penulis merasa bahwa keberhasilan ini adalah keberhasilan berdua. Juga
kepada anak-anak tersayang K. Widayati Ajiningtyas (Tyas), K. Wiidyo Aji
Bagaskoro (Aji) dan K. Widyan Radityo Ilmiaji (Adit) atas keikhlasan, kesabaran
dan dukungan moril yang diberikan.
Semoga segala dukungan dan bantuan yang dilakukan dalam
penyelesaian penelitian dan penulisan disertasi ini dapat dinilai sebagai ibadah
oleh Allah SWT, baik bagi penulis maupun semua pihak yang telah
berperanserta. Amin. Akhirnya penulis berharap semoga hasil penelitian ini
membawa manfaat bagi yang membutuhkan.
Bogor, Juli 2007
xii
RIWAYAT HIDUP
Penulis lahir di Cilacap Jawa Tengah pada tanggal 16 September 1960,
merupakan anak pertama dari Bapak Soekadi (almarhum) dan Ibu Soewarti.
Pendidikan sarjana ditempuh di Jurusan Pendidikan Biologi FPMIPA IKIP
Semarang, lulus pada tahun 1983. Pada tahun 1995 lulus dari jenjang S2
Program Studi Biologi Program Pasca Sarjana Universitas Gadjah Mada
Yogyakarta, kemudian sejak tahun 2002 terdaftar sebagai mahasiswa program
doktor di Sekolah Pascasarjana IPB. Beasiswa pendidikan pascasarjana
diperoleh dari Departemen Pendidikan Nasional.
Sejak tahun 1986 sampai sekarang tercatat sebagai staf pengajar jurusan
Biologi FMIPA Universitas Negeri Semarang (Unnes). Sejak menjadi staf
pengajar penulis aktif dalam sejumlah kegiatan penelitian dan pengabdian
masyarakat dengan dana dari Departemen Pendidikan Nasional, dan dalam
berbagai pelatihan serta seminar ilmiah tingkat regional maupun nasional.
Selama mengikuti program S3, penulis bersama Komisi Pembimbing telah
menulis beberapa artikel dari hasil penelitian selama studi. Poster dan karya
ilmiah berjudul ”Cekaman oleh PEG dalam media in vitro dan penapisan
toleransi kacang tanah terhadap kekeringan” telah disajikan pada Seminar
Nasional PERIPI di Bogor, tanggal 5 – 7 Agustus 2004. Sebuah artikel telah
diterbitkan di jurnal ilmiah terakreditasi, yaitu Berkala Penelitian Hayati volume 11
(1):39-48 tahun 2005 yang berjudul ”Polietilena glikol (PEG) dalam media in vitro
menyebabkan kondisi cekaman yang menghambat perkembangan tunas kacang
tanah (Arachis hypogaea L.)”. Sebuah artikel lain berjudul ”Seleksi in vitro
embrio somatik kacang tanah pada medium dengan polietilen glikol untuk
stimulasi kondisi cekaman kekeringan” telah dimuat di jurnal ilmiah terakreditasi
Biosfera volume 23 (1) tahun 2006.
DAFTAR ISI
Halaman
DAFTAR TABEL xiii
DAFTAR GAMBAR xix
DAFTAR ISTILAH xxii
I PENDAHULUAN
Latar Belakang ... 1
Tujuan Penelitian ... 3
Pendekatan Masalah dan Strategi Penelitian ... 3
II TINJAUAN PUSTAKA Variasi Somaklonal Kacang Tanah ... 9
Pengaruh Cekaman Kekeringan terhadap Tanaman ... 11
Mekanisme Toleransi Tanaman terhadap Cekaman Keke-ringan ... 13 Seleksi in Vitro untuk Toleransi terhadap Cekaman Kekeringan ... 17 III EFEKTIVITAS POLIETILENA GLIKOL SEBAGAI BAHAN PENYELEKSI SIFAT TOLERANSI TERHADAP CEKAMAN KEKERINGAN DALAM MEDIA IN VITRO Abstrak ... 20
Abstract ... 21
Pendahuluan ... 22
Bahan dan Metode Bahan Tanaman dan Perlakuan PEG ... 24
Perkecambahan dan Pertumbuhan Tunas ... 24
Respon Eksplan terhadap Cekaman PEG ... 24
Pengamatan dan Analisis Data ... 25
Pengukuran Kandungan Prolina Jaringan Eksplan ... 26
Hasil Respon Eksplan Kecambah terhadap Cekaman PEG 27 Respon Eksplan TDK terhadap Cekaman PEG ... 30
Respon Eksplan TTK terhadap Cekaman PEG ... 31
Akumulasi Prolina akibat Cekaman PEG ... 32
Pembahasan ... 35
Simpulan ... 40
IV SELEKSI IN VITRO EMBRIO SOMATIK KACANG TANAH PADA MEDIA DENGAN POLIETILENA GLIKOL YANG MENSIMULASIKAN KEKERINGAN Abstrak ... 41
Abstract ... 42
Pendahuluan ... 43
xiv
Evaluasi Respon ES Kacang Tanah terhadapCekaman PEG ……… 44
Seleksi ES dalam Media Selektif dengan PEG Konsentrasi Sub-letal ………. 45
Regenerasi Tanaman R0 dari ES Hasil Seleksi in vitro 45 Hasil Respon ES Kacang Tanah terhadap Cekaman PEG .. 46
Konsentrasi Sub-letal PEG ... 47
ES Kacang Tanah yang Insensitif terhadap PEG Konsentrasi Sub-letal ... 48
Tanaman R0 dari ES Hasil Seleksi in vitro ... 50
Pembahasan ... 51
Simpulan ... 53
V VARIAN KUALITATIF DAN KUANTITATIF KACANG TANAH HASIL KULTUR IN VITRO DAN HASIL SELEKSI IN VITRO Abstrak ... 54
Abstract ... 55
Pendahuluan ... 56
Bahan dan Metode Bahan Tanaman dan Induksi Variasi Somaklonal ... 57
Pertumbuhan ES Varian dalam Media Kultur dan Media Selektif serta Regenerasinya menjadi Tanaman R0 ... 57
Penanaman dan Pemeliharaan Tanaman R0, R1 dan R2 ... 58
Penentuan Varian ... 59
Hasil Tanaman R0, R1 dan R2 ... 60
Varian Kualitatif ... 59
Varian Kuantitatif ... 63
Pembahasan ... 68
Simpulan ... 71
VI TOLERANSI GALUR KACANG TANAH HASIL KULTUR DAN SELEKSI IN VITRO TERHADAP CEKAM AN AKIBAT PENYIRAMAN PEG Abstrak ... 73
Abstract ... 74
Pendahuluan ... 75
Bahan dan Metode Bahan Tanaman ... 76
Evaluasi Respon terhadap Cekaman PEG ... 76
Analisis Respon terhadap Cekaman PEG ………. 78
Hasil Respon Pertumbuhan Tanaman Kacang Tanah terhadap Cekaman PEG ... 80
Toleransi terhadap Cekaman PEG ... 85
Mekanisme Toleransi terhadap Cekaman PEG ... 86
Pembahasan ... 88
VII TOLERANSI GALUR KACANG TANAH HASIL KULTUR DAN SELEKSI IN VITRO TERHADAP CEKAMAN KEKERINGAN
Abstrak ... 94
Abstract ... 95
Pendahuluan ... 96
Bahan dan Metode Bahan Tanaman ... 97
Evaluasi Respon terhadap Cekaman Kekeringan ... 98
Evaluasi Toleransi Tanaman terhadap Cekaman Kekeringan ... 99
Analisis Mekanisme Toleransi terhadap Cekaman Kekeringan ... 99
Hasil Respon Pertumbuhan Tajuk terhadap Cekaman Kekeringan ... 100
Respon Pertumbuhan Akar terhadap Cekaman Kekeringan ………... 102
Respon Hasil terhadap Cekaman Kekeringan ……….. 105
Toleransi Galur Kacang Tanah Varian terhadap Cekaman Kekeringan ... 107
Mekanisme Toleransi terhadap Cekaman Kekeringan... 108
Pembahasan ... 110
Simpulan ... 116
VIII PEMBAHASAN UMUM ... 117
IX SIMPULAN DAN SARAN Simpulan ... 125
Saran ... 127
X DAFTAR PUSTAKA ... 128
LAMPIRAN ... 137
xvi
DAFTAR TABEL
Halaman
1 Pengaruh konsentrasi PEG dalam medium in vitro terhadap PET, PDT dan PAT dari sembilan kultivar kacang
tanah ... 28
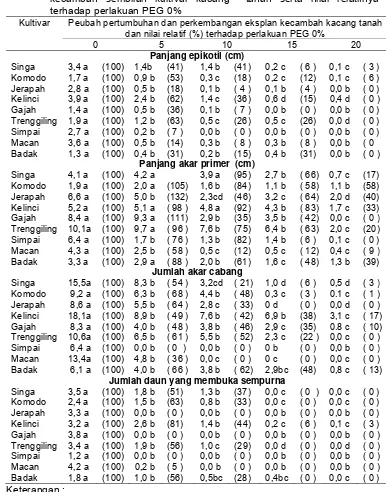
2 Pengaruh konsentrasi PEG dalam medium in vitro terhadap panjang epikotil, panjang akar utama, jumlah akar cabang dan jumlah daun kecambah sembilan kultivar kacang tanah serta nilai relatifnya terhadap perlakuan
PEG 0% ... 29
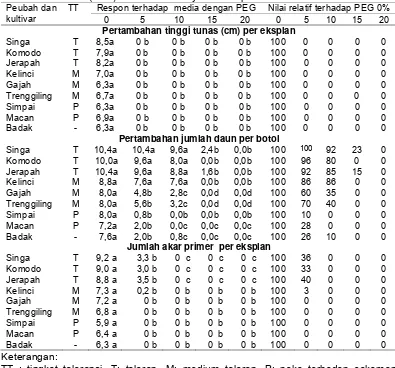
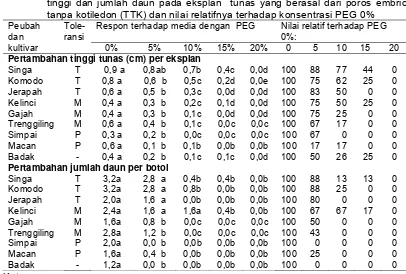
3 Pengaruh konsentrasi PEG terhadap pertambahan tinggi, jumlah daun dan jumlah akar utama pada eksplan tunas yang berasal dari benih dengan kotiledon (TDK) dan nilai
relatifnya terhadap konsentrasi PEG 0% ... 30
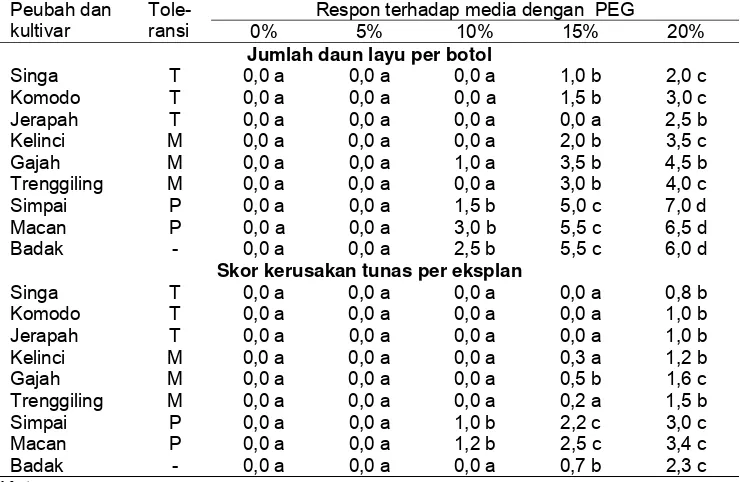
4 Pengaruh konsentrasi PEG terhadap jumlah daun layu dan skor kerusakan tunas pada eksplan tunas yang
berasal dari benih dengan kotiledon (TDK) ... 32
5 Pengaruh konsentrasi PEG terhadap jumlah daun layu per botol pada eksplan tunas yang berasal dari poros embrio
tanpa kotiledon (TTK) ... 33
6 Pengaruh konsentrasi PEG dalam medium in vitro terhadap pertambahan tinggi dan jumlah daun pada eksplan tunas yang berasal dari poros embrio tanpa kotiledon (TTK) dan nilai relatifnya terhadap konsentrasi PEG 0% ...
33
7 Pengaruh konsentrasi PEG terhadap persentase eksplan yang hidup, rataan embrio somatik (ES) yang terbentuk per eksplan dan jumlah total ES kacang tanah kultivar Badak, Kelinci, Singa, dan Zebra setelah tiga bulan dalam media selektif ...
47
8 Persentase penurunan jumlah eksplan yang hidup, rataan embrio somatik (ES) per eksplan dan jumlah total ES kacang tanah kultivar Badak, Kelinci, Singa, dan Zebra setelah tiga bulan dalam media selektif dengan penambahan PEG 6000 5%, 10%, 15% atau 20%
dibandingkan dengan media PEG 0% ... 48
9 Jenis, frekuensi dan persentase varian kualitatif pada tanaman hasil kultur in vitro (K0) dan seleksi in vitro (K15)
10 Rataan nilai dan ragam karakter kuantitatif pertumbuhan tajuk pada populasi tanaman hasil kultur in vitro dan hasil
seleksi in vitro generasi R0, R1 zuriat R0 dan R2 zuriat R1 63
11 Rataan nilai dan ragam karakter kuantitatif pertumbuhan akar dan hasil pada populasi tanaman hasil kultur in vitro dan hasil seleksi in vitro generasi R0, R1 zuriat R0, dan
R2 zuriat R1 pada kacang tanah kultivar Kelinci ... 64
12 Nomor-nomor galur dari populasi R1-K0, K0 dan R2-K15 yang dievaluasi toleransinya terhadap cekaman PEG
15% ... 77
13 Kriteria penentuan respon tanaman berdasarkan nilai
intensitas kerusakan daun (IKD) ... 79
14 Rataan nilai dan ragam tinggi tanaman, jumlah daun, berat basah dan berat kering tajuk tanaman kacang tanah kultivar Kelinci populasi standar, R1-K0, K0 dan
R2-K15 dalam kondisi optimum dan cekaman PEG 15% ... 81
15 Rataan nilai dan ragam bobot basah, bobot kering akar dan panjang akar primer tanaman kacang tanah kultivar Kelinci populasi standar, R1-K0, R2-K0 dan R2-K15 dalam
kondisi optimum dan cekaman PEG 15% ... 83
16 Biomassa pada kondisi cekaman PEG 15% dan kondisi optimum galur-galur tanaman kacang tanah kultivar Kelinci yang teridentifikasi toleran terhadap cekaman
kekeringan berdasarkan nilai S ... 87
17 Nomor-nomor galur tanaman dari populasi R1-K0, R2-K0 dan R2-K15 yang dievaluasi toleransinya terhadap
cekaman PEG 15% ... 97
18 Rataan nilai dan ragam peubah-peubah pertumbuhan tajuk tanaman kacang tanah kultivar Kelinci populasi tanaman standar, R1-K0, R2-K0, dan R2-K15 dalam
kondisi optimum dan kondisi cekaman kekeringan ... 102
19 Rataan nilai dan ragam panjang akar primer, jumlah akar cabang, bobot basah dan bobot kering akar kacang tanah kultivar Kelinci populasi tanaman standar, R1-K0, R2-K0, dan R2-K15 dalam kondisi optimum dan kondisi cekaman
kekeringan ... 104
20 Rataan nilai dan ragam jumlah polong total dan jumlah polong bernas kacang tanah kultivar Kelinci populasi tanaman standar, R1-K0, R2-K0, dan R2-K15 dalam
xviii
21 Karakteristik galur-galur tanaman kacang tanah populasiR1-K0, R2-K0 dan R2-K15 yang teridentifikasi toleran
terhadap kekeringan ... 113
22 Galur kacang tanah kultivar Kelinci populasi tanaman hasil kultur dan hasil seleksi in vitro yang teridentifikasi toleran terhadap cekaman PEG dan cekaman
DAFTAR GAMBAR
Halaman
1 Diagram alir strategi penelitian dan keterkaitan antar
percobaan dari seluruh kegiatan penelitian ... 8
2 Media selektif berupa media cair MS (Murashige-Skoog 1962) tanpa zat pengatur tumbuh (MS-0) dengan
penam-bahan berbagai konsentrasi PEG 6000 ... 25
3 Kriteria penentuan skor kerusakan eksplan tunas kacang tanah setelah ditanam dalam media selektif selama enam
minggu ... 26
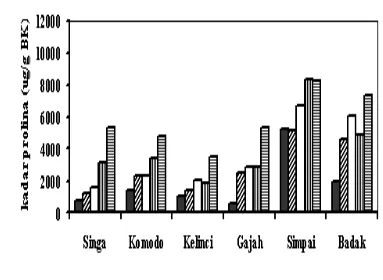
4 Pengaruh konsentrasi PEG terhadap kadar prolina total jaringan pada eksplan tunas yang berasal dari benih dengan kotiledon (TDK) kacang tanah kultivar Singa, Komodo, Kelinci, Gajah, Simpai dan Badak, setelah
ditanam selama enam minggu dalam media selektif .... 34
5 Morfologi kecambah yang tumbuh pada media selektif yang mengandung PEG (dari kiri ke kanan) konsentrasi 0, 5, 10, 15 dan 20% pada kacang tanah kultivar Sng (Singa), Kmd (Komodo), Jrp (Jerapah), Klc (Kelinci), Gjh (Gajah), Trg (Trenggiling), Bdk (Badak), Mcn (Macan),
Smp (Simpai)... 35
6 Pertumbuhan ES kacang tanah kultivar Badak (B), Kelinci (K), Singa (S), dan Zebra (Z), setelah tiga kali sub-kultur masing-masing satu bulan dalam media selektif PEG
dengan konsentrasi 0%, 5%, 10%, 15% dan 20% ... 49
7 Regenerasi ES kacang tanah hasil seleksi in vitro dalam
media selektif dengan penambahan PEG 15% ……… 50
8 Pola percabangan pada tanaman kacang tanah yang
diregenerasikan dari ES hasil kultur dan seleksi in vitro .... 59
9 Varian kualitatif pada tanaman kacang tanah hasil kultur
dan seleksi in vitro ... 62
10 Distribusi frekuensi tinggi tanaman dan bobot kering tajuk kacang tanah populasi tanaman standar, tanaman hasil
kultur dan seleksi in vitro ... 65
11 Distribusi frekuensi jumlah akar cabang primer dan bobot kering akar tanaman standar serta tanaman hasil kultur
xx
12 Distribusi frekuensi jumlah polong bernas dan bobotpolong bernas tanaman standar serta tanaman hasil kultur
dan seleksi in vitro ... 67
13 Skor kerusakan daun kacang tanah kultivar Kelinci akibat penyiraman larutan PEG 15% pada media arang sekam di
rumah kaca ... 79
14 Distribusi frekuensi jumlah daun per tanaman pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro dalam kondisi optimum dan cekaman PEG
15% ... 82
15 Distribusi frekuensi bobot tajuk kering pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro
dalam kondisi optimum dan cekaman PEG 15% ... 83
16 Distribusi frekuensi bobot akar kering pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro
dalam kondisi optimum dan cekaman PEG 15% ... 84
17 Distribusi frekuensi panjang akar pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro dalam
kondisi optimum dan cekaman PEG 15% ... 84
18 Keragaan tanaman kacang tanah kultivar Kelinci yang tumbuh dalam kondisi optimum dan dalam kondisi cekaman akibat penyiraman PEG 15% ...
85
19 Distribusi frekuensi respon tanaman yang ditumbuhkan dari benih, ES hasil kultur in vitro (R1-K0, R2-K0) dan ES hasil seleksi in vitro (R2-K15) terhadap cekaman PEG
15% berdasarkan nilai indeks kerusakan daun ... 86
20 Distribusi frekuensi respon tanaman yang ditumbuhkan dari benih, ES hasil kultur in vitro (R1-K0, R2-K0), dan ES hasil seleksi in vitro (R2-K15) terhadap cekaman PEG 15% berdasarkan indeks sensitivitas terhadap kekeringan
yang dihitung menggunakan nilai biomassa ... 86
21 Regresi antara nilai indeks kerusakan daun (IKD) dengan dengan nisbah akar/tajuk dan panjang akar primer pada populasi tanaman standar (x) dan R1-K0, K0 dan R2-K15 yang teridentifikasi agak toleran (¦ ), agak peka (? )
dan peka (? ) ... 87
22 Regresi antara nilai ISK yang dihitung menggunakan biomassa tanaman dengan nisbah akar/tajuk dan dengan panjang akar primer pada populasi tanaman standar (x) dan R1-K0, R2-K0 dan R2-K15 yang teridentifikasi toleran
23 Keragaan tanaman kacang tanah dalam (a) kondisi optimum dan (b) kondisi cekaman ...
101
24 Distribusi frekuensi bobot kering tajuk pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro
dalam kondisi optimum dan cekaman kekeringan ... 103
25 Distribusi frekuensi bobot kering akar pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro
dalam kondisi optimum dan cekaman kekeringan ... 105
26 Distribusi frekuensi jumlah polong bernas pada populasi tanaman standar, tanaman hasil kultur dan seleksi in vitro
dalam kondisi optimum dan cekaman kekeringan ... 106
27 Distribusi frekuensi kandungan prolina (µg/g) dalam kondisi optimum dan cekaman kekeringan pada tanaman
kacang tanah populasi standar, R0-K0, R1-K0 dan R2-K15 107
28 Distribusi frekuensi respon tananan standar, R1-K0, R2-K0, R2-K15 terhadap cekaman kekeringan berdasarkan indeks sensitivitas terhadap cekaman kekeringan yang
dihitung menggunakan jumlah polong bernas... 108
29 Hubungan antara indeks sensitivitas kekeringan(ISK) yang dihitung berdasarkan jumlah polong bernas dengan peningkatan kadar prolina dan densitas stomata pada tanaman kacang tanah populasi tanaman standar (x) dan populasi R1-K0, R2-K0 dan R2-K15 yang teridentifikasi
toleran (¦ ), medium toleran (? ) dan peka (? ) ... 109
30 Distribusi frekuensi densitas stomata pada tanaman
kacang tanah populasi standar, R1-K0, R2-K0 dan R2-K15 109
31 Hubungan antara ISK dengan panjang akar dan nisbah akar/tajuk pada tanaman kacang tanah pada populasi tanaman standar (x) dan R1-K0, R2-K0 dan R2-K15 yang
xxii
DAFTAR ISTILAH
Bahan penyeleksi (selective agent)
bahan kimia yang dapat menapis sel/jaringan dengan sifat yang diinginkan (dalam hal ini yang toleran terhadap cekaman kekeringan) di antara sel/jaringan lain dengan sifat yang tidak diinginkan
Cekaman kekeringan
kondisi ketersediaan air media tanam yang tidak memadai baik jumlah maupun distribusinya, yang terjadi pada sebagian atau sepanjang siklus hidup tanaman sehingga tanaman tidak dapat mengekspresikan potensi genetiknya
Densitas stomata
(dalam penelitian ini) jumlah stomata per satuan luas (cm2) pada jaringan epidermis bawah daun, dihitung menggunakan mi krometer
Embrio somatik
embrio yang terbentuk dari sel vegetatif, dalam penelitian ini dari leaflet (calon daun) embrio zigotik
Generasi R0
tanaman yang merupakan hasil regenerasi jaringan dari kultur in vitro
Generasi R1
tanaman yang merupakan zuriat dari tanaman generasi R0
Generasi R2
tanaman yang merupakan zuriat dari tanaman generasi R1
Kalus embriogen
kalus yang mengandung sel-sel yang berpotensi untuk berkembang menjadi embrio
Karakter kualitatif
karakter yang nilainya tidak berdasarkan pengukuran, menghasilkan variasi berupa kelompok-kelompok yang diskret
Karakter kuantitatif
karakter yang nilainya diperoleh dari pengukuran, menghasilkan variasi yang bersifat kontinyu
Kultur in vitro
(dalam penelitian ini) pembudidayaan embrio somatik pada media MS padat dengan penambahan pikloram 16 µM menjadi plantlet
Medium toleran
Mekanisme avoidance (ketahanan)
mekanisme respon terhadap cekaman kekeringan yang ditunjukkan dengan kemampuan tanaman untuk mempertahankan potensial air jaringan yang relatif tinggi pada saat mengalami cekaman kekeringan
Mekanisme escape (pelarian)
mekanisme respon terhadap cekaman kekeringan yang ditunjukkan dengan kemampuan tanaman untuk menyelesaikan siklus hidupnya sebelum terjadi cekaman kekeringan sehingga tidak mengalami cekaman
Mekanisme tolerance (toleran)
mekanisme respon terhadap cekaman kekeringan yang ditunjukkan dengan kemampuan tanaman untuk bertahan hidup dengan potensial air jaringan yang rendah
Nisbah akar/tajuk
ratio bobot kering akar dan tajuk
Osmolit
senyawa yang terlarut dalam plasma sel yang dapat berperan untuk mempertahankan potensial osmotik sel dan melindungi kerusakan struktur sel akibat senyawa radikal pada saat mengalami cekaman
Peka
respon tanaman yang tidak mampu mempertahankan diri atau mengatasi pengaruh cekaman kekeringan, yang ditunjukkan dengan menurunnya pertumbuhan dan atau hasil panen secara signifikan pada kondisi cekaman kekeringan
Picloram
asam 4-amino, 3.5.6.trikhloropikolinat, suatu herbisida yang dalam konsentrasi rendah berperan sebagai fitohormon auksin
PEG (poly ethylene glycol)
senyawa polimer yang tersusun atas sub unit etilen-oksida, yang mampu mengikat molekul air pada atom oksigennya dengan ikatan hidrogen
Potensial osmotik
potensi suatu larutan untuk melakukan osmosis atau menarik molekul air, yang nilainya negatif dan ditentukan oleh konsentrasi larutan, suhu, konstanta gas dan konstanta ionisasi
Prolina
salah satu jenis asam amino yang terlarut dalam plasma sel dan dapat berperan sebagai osmolit
Seleksi in vitro
xxiv
Toleran
respon tanaman yang mampu mempertahankan diri atau mengatasi pengaruh cekaman kekeringan, yang ditunjukkan dengan menurunnya pertumbuhan dan atau hasil panen yang tidak signifikan pada kondisi cekaman kekeringan
Varian somaklonal
karakter yang mengalami variasi somaklonal
Varian somaklonal genetik
karakter yang mengalami variasi somaklonal yang pada umumnya bersifat ir-reversibel dan diwariskan kepada keturunannya
Varian somaklonal epigenetik
karakter yang mengalami variasi somaklonal yang merupakan modifikasi ekspresi genetik, biasanya bersifat reversibel dan tidak diwariskan
Varian somaklonal positif
karakter yang mengalami variasi somaklonal yang lebih unggul dibanding tanaman standar
Variasi somaklonal
1
I. PENDAHULUAN
Latar Belakang
Kacang tanah (Arachis hypogaea L.) merupakan salah satu komoditas pertanian yang potensial untuk dikembangkan di Indonesia. Komoditas ini adaptatif di daerah tropis, dan mempunyai arti penting sebagai bahan pangan bergizi tinggi, pakan ternak yang potensial, dan tanaman rotasi yang efektif. Sebagai bahan pangan biji kacang tanah mengandung lemak, protein, vitamin B dan E yang relatif tinggi (Maesen dan Somaatmadja 1993, Moss dan Rao 1995). Antara tahun 2000 – 2004 produksi kacang tanah Indonesia berkisar antara 736,5 – 839,1 ton, dengan hasil panen faktual rata-rata sebesar 1,08 – 1,16 ton per hektar (BPS 2005), lebih rendah dibandingkan hasil panen dalam skala penelitian yang dapat mencapai lebih dari 2 ton per hektar (Hidajat et al. 1999). Hal tersebut menyebabkan Indonesia harus mengimpor kacang tanah untuk memenuhi kebutuhan masyarakat. Oleh karena itu perlu dilakukan upaya peningkatan produksi kacang tanah.
Upaya peningkatan produksi kacang tanah baik melalui perluasan lahan penanaman maupun peningkatan produktivitas menghadapi berbagai cekaman abiotik. Cekaman abiotik utama adalah kekeringan yang pada masa mendatang diduga akan semakin parah karena berkurangnya distribusi air ke sektor pertanian akibat besarnya kebutuhan air pada sektor non-pertanian, menurunnya daya retensi tanah dan kualitas lingkungan (Makarim 2005). Di samping itu usaha tani kacang tanah, yang bukan merupakan tanaman pangan utama di Indonesia, pada umumnya dilakukan di lahan kering atau pada akhir musim penghujan, sehingga berpeluang besar mengalami kekurangan air atau cekaman kekeringan.
Air merupakan faktor pembatas utama yang menentukan tercapai tidaknya potensi hasil tanaman. Bila air yang terserap tanaman berkurang, maka semua proses biokimia di dalam tanaman akan terhambat dan pertumbuhan serta produksi akan menurun. Produksi kacang tanah dapat menurun hingga 50% akibat cekaman kekeringan (Makarim 2005). Periode kritis tanaman kacang tanah terhadap kekeringan adalah umur 3, 25, 50 dan 75 hari (Balitkabi 2004).
2
ditoleransi, cekaman kekeringan tidak menimbulkan pengaruh seperti yang terjadi pada kultivar peka. Oleh karena itu untuk budidaya kacang tanah di lahan kering atau musim kering diperlukan kultivar yang toleran cekaman abiotik, terutama cekaman kekeringan, sehingga peningkatan hasil yang diharapkan dapat terwujud.
Sampai saat ini, di antara 22 kultivar kacang tanah yang dilepas Departemen Pertanian, hanya enam kultivar yaitu Komodo, Biawak, Jerapah, Panther, Singa dan Turangga yang diidentifikasi toleran terhadap cekaman kekeringan (Hidajat et al. 1999). Pada umumnya mekanisme toleransi yang dilakukan oleh kultivar toleran adalah melalui pembentukan akar yang intensif sehingga dapat menurunkan hasil. Kultivar toleran dengan mekanisme yang tidak menurunkan hasil lebih diinginkan (Williams dan Boote 1995). Karakter tersebut merupakan hal yang sangat penting untuk diupayakan pada kacang tanah sebab genotipe dengan potensial daya hasil tinggi pada kondisi irigasi optimum biasanya sangat peka terhadap kekeringan. Sebaliknya, genotipe yang memberikan hasil baik pada kondisi tercekam kekeringan, mungkin tidak menjamin hasil yang lebih baik pada kondisi irigasi optimum (Gupta 1997) karena besarnya kemampuan pertumbuhan biomassa (perakaran). Berdasarkan hal itu pengembangan kultivar kacang tanah toleran kekeringan masih diperlukan.
Untuk mengembangkan kultivar yang toleran terhadap kekeringan dengan mekanisme yang berbeda diperlukan keragaman baru sifat toleransi pada plasma nutfah kacang tanah. Peningkatan keragaman sifat toleransi dapat dilakukan secara in vitro melalui kultur jaringan. Teknik ini berpotensi untuk menghasilkan varian somaklonal yang mempunyai karakteristik tertentu. Varian yang secara alamiah terjadi acak pada berbagai karakter tersebut kemudian diseleksi dalam media selektif yang sesuai sehingga diperoleh varian dengan sifat yang diinginkan. Dengan menggunakan seleksi in vitro, intensitas seleksi lebih besar dan homogen sehingga dapat meningkatkan efisiensi didapatkannya varian tanaman dengan sifat-sifat yang diharapkan (Specht dan Graef 1996).
3
ketersediaan eksplan dan tidak mengakibatkan khimera (Maluszynski 1995). Pada regenerasi embrio somatik eksplan diinduksi berturut-turut menjadi kalus, embrio somatik, dan tunas. Karena embrio somatik berasal dari sel tunggal, maka frekuensi terbentuknya varian relatif besar.
Untuk mendapatkan varian yang toleran terhadap cekaman kekeringan digunakan bahan seleksi yang dapat mensimulasikan kondisi kekeringan di lapang. Ada beberapa bahan seleksi yang dapat digunakan, antara lain manitol, sorbitol, dan PEG (poly ethylene glycol). Dibandingkan agen seleksi yang lain, PEG (terutama yang mempunyai berat molekul lebih dari 3500) mempunyai kelebihan yaitu tidak dapat diserap oleh tanaman. PEG yang ditambahkan ke dalam media kultur dapat menurunkan potensial air media secara homogen karena sifatnya yang larut sempurna dalam air. Besarnya penurunan potensial air tergantung pada konsentrasi dan berat molekul PEG (Michel dan Kaufmann 1973, Steuter 1981). Bila varian yang toleran terhadap potensial air rendah tersebut dapat diperoleh dan dapat diregenerasikan menjadi tanaman maka kemungkinan besar akan berkembang menjadi tanaman yang toleran terhadap cekaman kekeringan.
Tujuan Penelitian
1. Mengetahui metode seleksi in vitro yang efektif dalam rangka memperoleh ES kacang tanah yang toleran terhadap potensial air rendah
2. Mengetahui indikasi varian somaklonal kacang tanah
3. Memperoleh populasi tanaman varian somaklonal hasil seleksi in vitro
4. Memperoleh populasi tanaman varian somaklonal yang toleran terhadap cekaman kekeringan
5. Menduga mekanisme toleransi tanaman kacang tanah terhadap cekaman kekeringan secara fisiologis
Pendekatan Masalah dan Strategi Penelitian
Untuk mencapai tujuan tersebut harus dilakukan tahap-tahap seperti disebut di bawah ini.
1. Mengembangkan populasi embrio somatik (ES) kacang tanah dan varian somaklonal
4
3. Menyeleksi populasi varian dalam media selektif in vitro untuk mengidentifikasi varian yang toleran terhadap potensial air rendah
4. Meregenerasikan varian yang toleran terhadap potensial air rendah menjadi populasi tanaman lengkap
5. Mengevaluasi karakter kualitatif dan kuantitatif populasi tanaman yang diregenerasikan dari ES varian hasil seleksi in vitro untuk mengidentifikasi adanya variasi di antara populasi tanaman yang diperoleh
6. Mengevaluasi respon tanaman hasil seleksi in vitro terhadap cekaman kekeringan dengan beberapa pendekatan, untuk mengidentifikasi adanya tanaman varian yang toleran terhadap cekaman kekeringan
7. Menganalisis secara fisiologis populasi tanaman yang toleran untuk menentukan mekanisme toleransi terhadap cekaman kekeringan.
Untuk dapat melakukan tahap-tahap tersebut dibutuhkan:
1. metode induksi ES dan variasi somaklonal untuk memperoleh ES varian somaklonal,
2. metode seleksi in vitro untuk mendapatkan ES varian somaklonal yang toleran cekaman kekeringan,
3. metode regenerasi ES menjadi tanaman lengkap,
4. indikasi adanya varian somaklonal pada karakter kualitatif dan kuantitatif 5. metode evaluasi respon tanaman terhadap cekaman kekeringan, dan
6. metode analisis fisiologis untuk penentuan mekanisme toleransi tanaman terhadap cekaman kekeringan.
Metode induksi ES kacang tanah yang efektif telah berhasil dikembangkan menggunakan eksplan leaflet dengan media MS-P16 yaitu media MS (Murashige – Skoog) ditambah zat pengatur tumbuh golongan auksin yaitu pikloram (amino trichloropicolinic acid) sebanyak 16 μM/l. Metode ini terbukti cukup efektif menginduksi ES primer dan sekunder paling tidak untuk 16 kultivar kacang tanah yang diuji (Nursusilawati 2003).
5
dapat digunakan sebagai bahan penyeleksi kacang tanah dalam kondisi ex vitro
untuk memperoleh tanaman yang toleran terhadap cekaman kekeringan, namun efektivitasnya secara in vitro masih perlu diteliti.
Metode regenerasi tanaman kacang tanah dari ES telah dapat dikembangkan secara efektif, yang meliputi tahap maturasi, perkecambahan, dan pengakaran. Maturasi dilakukan dengan menumbuhkan ES dalam media MSAC, yaitu media MS tanpa fitohormon ditambah active charcoal (arang aktif) 2 g/l agar ES berkembang sempurna. ES sekunder yang telah mengalami tahap maturasi kemudian dikecambahkan dalam media MS yang ditambah BAP
(6-benzylamino purine, zat pengatur tumbuh sejenis sitokinin) sebanyak 22 μM sampai terbentuk tunas. Tunas yang tumbuh dipilih yang mempunyai panjang 2 – 3 cm, kemudian dipindahkan ke media pengakaran yang tersusun dari media MS ditambah NAA (naphtalene acetic acid, zat pengatur tumbuh sejenis auksin) sebanyak 10 mg/l selama satu minggu. Setelah itu dipindahkan lagi ke MSAC dan ditumbuhkan sampai membentuk akar yang sempurna yang biasanya berlangsung selama 4 minggu. Dalam semua tahap tersebut kultur diinkubasikan dalam ruang kultur dengan temperatur konstan 24o C dalam kondisi terang terus menerus. Tunas yang telah berakar akan berkembang menjadi plantlet yang siap diaklimatisasi (Nursusilawati 2003).
Berdasarkan hal-hal tersebut maka strategi penelitian yang harus dilakukan adalah sebagai berikut:
1. mengembangkan metode seleksi in vitro dalam rangka memperoleh ES kacang tanah yang toleran terhadap potensial air rendah dengan mengkaji pengaruh konsentrasi PEG terhadap pertumbuhan jaringan kacang tanah secara in vitro, dan menentukan konsentrasi sub-letal PEG pada sejumlah kultivar kacang tanah yang dilaporkan sebagai kultivar toleran, medium dan peka terhadap cekaman kekeringan,
2. menginduksi terjadinya ES sekunder dan varian somaklonal tanpa seleksi PEG dan meregenerasikannya menjadi tanaman lengkap untuk mengetahui indikasi varian somaklonal kacang tanah,
6
4. mengevaluasi respon tanaman varian somaklonal terhadap cekaman kekeringan yang dilakukan secara ex vitro di rumah kaca untuk memperoleh populasi tanaman varian somaklonal yang toleran terhadap cekaman kekeringan, dan
5. menganalisis secara fisiologis untuk mengetahui mekanisme toleransi terhadap cekaman kekeringan.
7
8
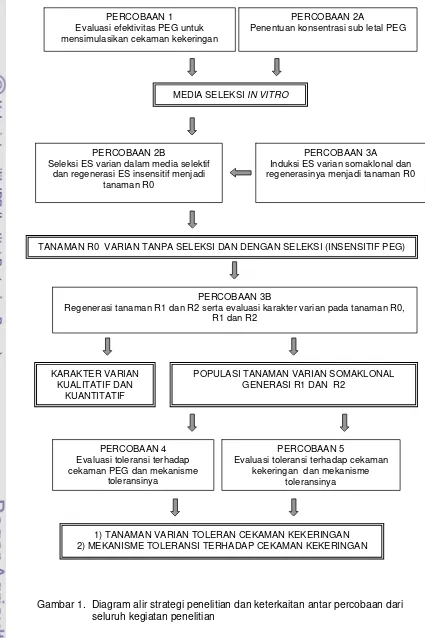
Gambar 1. Diagram alir strategi penelitian dan keterkaitan antar percobaan dari seluruh kegiatan penelitian
PERCOBAAN 1 Evaluasi efektivitas PEG untuk mensimulasikan cekaman kekeringan
PERCOBAAN 2A
Penentuan konsentrasi sub letal PEG
MEDIA SELEKSI IN VITRO
PERCOBAAN 2B
Seleksi ES varian dalam media selektif dan regenerasi ES insensitif menjadi
tanaman R0
PERCOBAAN 3A Induksi ES varian somaklonal dan regenerasinya menjadi tanaman R0
TANAMAN R0 VARIAN TANPA SELEKSI DAN DENGAN SELEKSI (INSENSITIF PEG)
PERCOBAAN 3B
Regenerasi tanaman R1 dan R2 serta evaluasi karakter varian pada tanaman R0, R1 dan R2
KARAKTER VARIAN KUALITATIF DAN
KUANTITATIF
POPULASI TANAMAN VARIAN SOMAKLONAL GENERASI R1 DAN R2
PERCOBAAN 4 Evaluasi toleransi terhadap cekaman PEG dan mekanisme
toleransinya
PERCOBAAN 5
Evaluasi toleransi terhadap cekaman kekeringan dan mekanisme
toleransinya
II. TINJAUAN PUSTAKA
Variasi Somaklonal Kacang Tanah
Pengembangan galur tanaman yang mempunyai karakter tertentu dapat
dilakukan apabila di dalam plasma nutfah terdapat materi genetik yang
mengendalikan mekanisme karakter yang diinginkan. Semakin besar keragaman
genetik dalam plasma nutfah, semakin besar pula peluang untuk mendapatkan
materi genetik yang diharapkan. Peningkatan keragaman genetik dapat
dilakukan melalui kultur jaringan. Media kultur jaringan dapat menginduksi
perubahan genetik karena kondisi in vitro memungkinkan pembelahan sel terjadi
sangat cepat sehingga memberi peluang terjadinya error yang tinggi. Dalam
kegiatan pemuliaan perubahan ini justru memberi keuntungan karena
meningkatkan keragaman sifat. Keragaman ini disebut variasi somaklonal (Larkin
dan Scrowcrot 1981, Larkin et al. 1989, Bouharmont 1994, Wikipedia 2006).
Pengembangan keragaman genetik tanaman melalui induksi variasi
somaklonal pada hakekatnya hampir sama dengan pengembangan dengan
teknik mutasi. Tingkat mutasi yang terjadi secara alamiah, buatan maupun
dalam kultur in vitro rata-rata sebesar 0,0001% (Duncan et al. 1995), namun
dibandingkan mutasi alamiah dan buatan, frekuensi terjadinya mutasi pada kultur
in vitro jauh lebih tinggi (Larkin et al. 1989) karena populasi yang ditangani
berjumlah sangat besar. Pada satu botol kultur terdapat jutaan sel dan setiap sel
mempunyai peluang mengalami mutasi atau membentuk sel varian. Keduanya,
teknik mutasi dan induksi variasi somaklonal, menghasilkan tanaman regeneran
dengan perubahan sifat yang menguntungkan ataupun merugikan, namun
perubahan yang merugikan pada variasi somaklonal terbukti lebih sedikit
(Duncan et al. 1995).
Variasi somaklonal merupakan fenomena umum yang dapat terjadi pada
semua sistem regenerasi tanaman yang melibatkan fase kalus. Sebagian besar
variasi somaklonal yang tampak pada tanaman regeneran dihasilkan selama
tahap kultur jaringan. Hal ini dapat dilihat melalui peningkatan frekuensi
kromosom yang abnormal sejalan dengan lamanya kultur. Beberapa variasi yang
terjadi pada tanaman varian mungkin dihasilkan pula dari variasi yang ada pada
eksplan. Perubahan genetik seperti mutasi gen, duplikasi, aneusomatik dan
khimera juga dapat terjadi pada sel atau jaringan tanaman dalam kondisi in vivo.
10
variasi yang muncul dalam kondisi in vivo dan in vitro. Kontribusi relatif
keduanya mungkin berbeda antar kasus, tergantung pada genotipe tanaman,
tipe kultur, medium kultur, umur kultur dan sebagainya (Larkin dan Scowcroft
1981, Larkin et al. 1989, Wikipedia 2006).
Perubahan genetik selama pertumbuhan dan regenerasi in vitro dapat
terjadi pada genom inti maupun genom organela. Perubahan-perubahan tersebut
ada beberapa tipe, yaitu perubahan jumlah genom (monoploid, diploid, sampai
poliploid), perubahan jumlah kromosom (monosomi, trisomi, tetrasomi atau
nulisomi), perubahan struktur kromosom (translokasi, duplikasi, delesi, inversi,
kromosom disentrik atau telosentrik) dan perubahan struktur DNA yang meliputi
mutasi gen, pindah silang mitotik, metilasi yang mengakibatkan inaktivasi gen,
dan mutasi insersi akibat transposon (Bouharmont 1994, Karp 1995) .
Ada beberapa faktor yang dapat mempengaruhi ada tidaknya dan
intensitas variasi yang dihasilkan dari kultur. Menurut Karp (1995), faktor-faktor
tersebut berasal dari (1) eksplan, yang meliputi tingkat perkembangan eksplan,
jenis eksplan, konstitusi genetik atau genotipe tanaman, dan dari (2) kondisi
kultur, yang meliputi panjang waktu kultur, penambahan zat pengatur tumbuh
dan bahan penyeleksi dalam media kultur. Tingkat perkembangan merupakan
faktor kunci variasi somaklonal. Pada tingkat perkembangan yang belum
terorganisasi mekanisme instabilitas genetik lebih mudah terjadi. Jadi makin
awal tingkat perkembangan eksplan dan makin panjang waktu yang diperlukan
dalam tahap ini, makin besar peluang untuk menghasilkan variasi somaklonal.
Selain itu jenis, paduan dan konsentrasi hormon yang dipakai dalam media
kultur, serta konsentrasi nutrien seperti Ca dan EDTA juga mempengaruhi
terjadinya variasi somaklonal.
Melalui induksi variasi somaklonal diharapkan dapat diperoleh varian
dengan sifat-sifat yang diinginkan dalam jumlah yang memadai. Sepuluh dari 100
varian somaklon pada tembakau mempunyai sifat-sifat agronomi yang positif
(Larkin dan Scowcroft 1981). Pada tanaman gandum regeneran terjadi variasi
somaklonal sebesar 5% untuk sifat morfologi dan biokimia. Karakter tersebut,
baik yang dikendalikan secara monogenik maupun poligenik, terbukti diturunkan
sampai dua generasi (Larkin et al. 1984). Frekuensi variasi somaklonal pada
tanaman kedelai antara lain dipengaruhi oleh konsentrasi auksin dalam media
tumbuh. Pada media dengan 22,5 μM 2.4.D terbentuk varian sebesar 40%,
al. 1991). Penelitian Claxton et al. (1998) menunjukkan bahwa pada Rorippa
nasturtium-aquaticum terjadi 25% variasi somaklonal dalam beberapa karakter
morfologi dan ploidi. Frekuensi varian somaklonal sebesar 1,0% diketahui terjadi
pada Picea mariana dan 1,6% pada P. glauca, yang dapat dikelompokkan
menjadi 9 tipe sifat morfologi dan fisiologi (Tremblay et al. 1999).
Intensitas perubahan karakter yang tampak pada tanaman varian
somaklonal tidak sama antar kasus. Perubahan tersebut dapat sangat besar
sehingga tanaman tampak abnormal, namun mungkin pula hanya sebagian kecil
sedangkan sebagian besar karakter lain tetap menyerupai induknya. Varian
yang fungsional untuk perbaikan sifat tanaman adalah yang mengalami
perubahan kecil (yang positif/diinginkan) yang bersifat stabil, durable, dan
diwariskan secara Mendelian, dengan tetap mempertahankan sebagian besar
sifat seperti induknya. Hal ini dilaporkan dapat terjadi sehingga variasi
somaklonal memungkinkan untuk mengubah satu atau beberapa karakter
tertentu yang diinginkan dengan tetap mempertahankan karakter unggul yang
dimiliki induk (Hawbaker et al. 1993, Duncan et al. 1995).
Karakter yang berubah pada variasi somaklonal dapat merupakan karakter
morfologi, biokimia, fisiologi maupun molekuler. Variasi morfologi dan fisiologi
yang dihasilkan dari variasi somaklonal yang telah diteliti pada berbagai tanaman
meliputi perubahan ukuran dan warna bunga, warna dan morfologi daun, tinggi
tanaman, resistensi terhadap penyakit dan waktu panen (Wikipedia 2006).
Variasi morfologi dan fisiologi meliputi filotaksis, jumlah anak daun, jumlah
percabangan, sterilitas polen, dan kadar prolin tampak pada somaklon kedelai
(Widoretno 2002). Varian yang tampak pada varian kacang tanah adalah jumlah
cabang, panjang gynofor, jumlah anak daun, dan ukuran polong (Yusnita 2005).
Pengaruh Cekaman Kekeringan terhadap Tanaman
Ditinjau dari segi agronomi kekeringan merupakan kondisi ketersediaan air
yang tidak memadai baik jumlah maupun distribusinya, meliputi simpanan air
bawah tanah dan kelembaban tanah, yang terjadi pada sebagian atau
sepanjang siklus hidup tanaman sehingga tanaman tidak dapat mengekspesikan
potensi genetiknya (Mitra 2001). Kekeringan mengakibatkan cekaman osmotik
pada tanaman yaitu mengurangi aktivitas air dan menyebabkan hilangnya turgor
sel. Cekaman osmotik merupakan cekaman multidimensi yang dapat
12
perkembangan karena air berperan sangat vital dalam kehidupan tanaman. Air
merupakan komponen penting dalam metabolisme, yaitu sebagai komponen
protoplasma, bahan fotosintesis, pelarut sebagian besar senyawa, media
transportasi, pengatur suhu dan faktor yang memungkinkan terjadinya reaksi
kimia. Oleh karena itu pengaruh kekurangan air pada tanaman bersifat sangat
kompleks (Salisbury dan Ross 1992, Blum 1996, Mundree et al. 2002).
Intensitas pengaruh cekaman kekeringan terhadap tanaman ditentukan oleh
tingkat cekaman dan fase pertumbuhan tanaman saat mengalami cekaman.
Cekaman kekeringan dapat mempengaruhi berbagai mekanisme seluler,
biokimia dan fisiologi. Pada tingkat seluler kekeringan mengakibatkan kehilangan
air protoplasmik sehingga konsentrasi ion meningkat, menghambat fungsi-fungsi
metabolik, dan meningkatkan kemungkinan terjadinya interaksi antar molekul
yang dapat menyebabkan denaturasi protein dan fusi membran (Mundree et al.
2002). Selain itu kekeringan menurunkan kandungan klorofil daun, kadar protein
khlorofil dan fotosistem II pada gandum (Shimada et al. 1992; Gaspar et al.
2002), degradasi protein D1 pada pusat reaksi fotosistem II dan kerusakan
membran serta dinding sel (Pieters et al. 2003).
Pengaruh kekeringan terhadap mekanisme biokimia dan fisiologi antara lain
menurunkan kecepatan fiksasi dan akumulasi N (Masyudi dan Peterson 1991),
transportasi fotosintat dan transpirasi (Pookpadi et al. 1990; Vieira et al. 1992),
dan kecepatan fotosintesis (Loggini et al. 1999). Menurut Mundree et al (2002)
cekaman kekeringan cenderung merusak sistem transport elektron sehingga
mendorong terbentuknya radikal oksigen bebas (reactive oxygen species atau
ROS) pada organela tempat terjadinya metabolisme yang melibatkan transport
elektron atau yang melakukan oksidasi, yaitu khloroplas, mitokhondria dan
mikrobodi. ROS pada umumnya merusak komponen penting dalam sel seperti
DNA, protein dan lipid, serta mengakibatkan gangguan pada integritas
membran, aktivitas enzim dan struktur intra seluler.
Pengaruh cekaman kekeringan pada tahap perkembangan vegetatif dan
generatif tampak pada berbagai organ. Menurut Blum (1996) kekeringan
berpengaruh terhadap vigor dan pemunculan kecambah di atas tanah, namun
pada kecambah jagung justru meningkatkan diameter akar utama (Schmidhalter
et al. 1998). Kekeringan menurunkan pemanjangan daun (Schmidhalter et al.
1998) dan pertumbuhan primordia daun pertama pada jagung (Zhongjin dan
relatif, dan luas daun Phaseolus vulgaris (Franca et al. 2000), luas helaian
daun, jumlah daun per tanaman, luas daun total per tanaman, dan rasio
akar/batang pada empat spesies Quercus (Fotelli et al. 2000). Cekaman
kekeringan menurunkan bobot biji dan bobot kering polong (Pookpadi et al.
1992), kualitas biji (Franca-Neto et al. 1993), volume bunga dan nektar serta
konsentrasi gula dalam nektar Epilobium angustifolium (Caroll et al. 2001). Pada
jagung cekaman kekeringan menurunkan hasil karena mengurangi efisiensi
penggunaan cahaya (Earl et al. 2003).
Pada kacang tanah kekeringan mempengaruhi penyerapan kalsium oleh
polong dan fiksasi nitrogen. Jika kekeringan terjadi pada tanaman yang telah
mencapai tahap panen, ada kemungkinan biji terkontaminasi oleh aflatoksin yang
mengakibatkan biji beracun dan tidak layak makan baik oleh manusia maupun
ternak (Sharma dan Lavanya 2002, Ham 2004). Vorasoot et al. (2003)
mengemukakan bahwa pada empat kultivar kacang tanah di Thailand kekeringan
berpengaruh pada hasil dan beberapa karakter agronomi. Kekeringan tingkat
sedang (kadar air setengah kapasitas lapang) menurunkan jumlah polong,
jumlah biji per tanaman, ukuran biji dan berat biji. Pada cekaman kekeringan
tingkat tinggi (kadar air ¼ kapasitas lapang) hampir semua polong gugur.
Mekanisme Toleransi Tanaman terhadap Cekaman Kekeringan
Mekanisme respon terhadap cekaman kekeringan terjadi melalui proses
signal transduction. Proses tersebut melibatkan reseptor sebagai penerima
signal, phosphoprotein cascade sebagai penghantar signal, dan trans-acting
factor sebagai pengaktif gen yang mengendalikan respon. Pada tanaman
tertentu ABA (absisic acid) berperan sebagai reseptor sekunder yang
menghubungkan reseptor utama di membran dengan phosphoprotein cascade,
namun pada tanaman lain ABA tidak berperan (Mundree et al. 2002).
Menurut Mitra (2001) mekanisme respon terhadap kekeringan dapat
dibedakan menjadi tiga yaitu mekanisme escape (pelarian), avoidance
(ketahanan) dan tolerance (toleransi). Pelarian merupakan kemampuan
tanaman untuk menyelesaikan siklus hidupnya sebelum terjadi cekaman
kekeringan sehingga tidak mengalami cekaman. Ketahanan adalah
kemampuan tanaman untuk mempertahankan potensial air jaringan yang relatif
tinggi pada saat mengalami kekeringan, sedangkan toleransi adalah kemampuan
14
Pada umumnya tanaman melakukan lebih dari satu mekanisme respon
dalam waktu yang sama. Mekanisme ketahanan pada berbagai tanaman
merupakan faktor penting dalam menghadapi cekaman kekeringan. Hasil tinggi
di bawah kondisi cekaman kekeringan pada beberapa tanaman tertentu lebih
disebabkan oleh mekanisme ketahanan dibandingkan mekanisme toleransi
cekaman kekeringan (Ndunguru et al. 1995). Ketahanan dilakukan dengan cara
mengurangi kehilangan air lewat daun dan meningkatkan kemampuan akar
dalam menyerap air tanah. Faktor yang memiliki kontribusi pada ketahanan
terhadap cekaman kekeringan adalah (1) pertumbuhan akar yang ekstensif dan
dalam (sering kali menjadi faktor yang paling penting); (2) penutupan stomata
untuk mengurangi kehilangan air; (3) penggulungan daun untuk mengurangi luas
daun yang terpapar lingkungan; (4) deposit lilin pada epicuticular untuk
menghambat kehilangan air (Sullivan 1983).
Mekanisme toleransi juga mempunyai kontribusi yang tinggi dalam
mempertahankan hasil di bawah kondisi cekaman. Pada hakekatnya toleransi
meliputi aktivitas-aktivitas yang bertujuan untuk mencegah atau mengurangi
kerusakan, menjaga kondisi homeostatik, dan mempertahankan agar
pertumbuhan dapat tetap berlangsung meskipun dengan kecepatan yang lebih
rendah. Untuk mencapai tujuan tersebut, aktivitas dalam mekanisme toleransi
dapat digolongkan menjadi tiga, yaitu: (1) detoksifikasi khususnya terhadap ROS
melalui pembentukan protein stres dan osmolit yang kompatibel, (2) menjaga
keseimbangan osmotik, dan (3) regulasi pertumbuhan dengan menurunkan
kecepatan fotosintesis, pembelahan dan pembentangan sel (Mundree et al
2002).
Protein stres yang dibentuk dalam menghadapi cekaman kekeringan dapat
dibedakan menjadi (a) protein fungsional, antara lain berupa enzim kunci
biosintesis osmolit, enzim antioksidan, protein proteksi, dan (b) protein regulator,
antara lain berupa trans acting factor. Osmolit selain berperan dalam
detoksifikasi, juga berperan dalam keseimbangan osmotik yaitu
mempertahankan tekanan turgor sel (Serraj dan Sinclair 2002, Mundree et al
2002).
Respon tanaman terhadap cekaman kekeringan sangat bervariasi tergantung
pada spesies, tingkat cekaman, lamanya cekaman, tahap perkembangan
tanaman ketika terjadi cekaman dan tingkat toleransi tanaman (Mullet dan
terhadap ROS secara efisien dengan membentuk enzim-enzim anti-oksidan
(misalnya katalase, peroksidase, dismutase), membentuk senyawa penghilang
radikal (misalnya karotenoid, askorbat, tokoferol-glutation tereduksi); dan
mengembangkan struktur untuk meminimalkan pembentukan ROS. Pada
tanaman rentan sistem penghilangan radikal cepat jenuh dan akibatnya
kerusakan tidak dapat dihindari (Mundree et al. 2002).
Pada gandum yang mengalami kekeringan terjadi penurunan kandungan
glutation baik pada kultivar yang rentan maupun toleran terhadap kekeringan,
namun kultivar yang rentan menunjukkan peningkatan aktivitas glutation
reduktase (Loggini et al. 1999). Stres kekeringan menginduksi akumulasi ABA
dan meningkatkan pembentukan ROS serta aktivitas enzim-enzim antioksidan
seperti SOD (superoxide dismutase), CAT (catalase), APX (ascorbate
peroxidase) dan GR (gluthatione reductase) pada daun jagung (Mingyi dan
Jianhua 2002).
Detoksifikasi senyawa radikal juga dilakukan dengan pembentukan osmolit
yang kompatibel yang dapat berperan sebagai penghilang radikal, agen
proteksi untuk stabilisasi protein selama cekaman dan pelindung DNA dari efek
degradasi akibat ROS. Selain itu osmolit juga berperan dalam menjaga
homeostasi osmotik agar sel tetap turgor. Oleh karena itu osmolit disebut pula
osmoprotektan. Ada bermacam-macam senyawa osmolit antara lain dari
kelompok polyol (sorbitol), gula (rafinose, sukrose, trehalose), asam amino
(prolin), betain dan komponen lain yang terlarut dalam plasma sel. Molekul gula
selain berperan sebagai osmoprotektan, juga dapat mempertahankan stabilitas
membran sel dengan menjaga permukaan membran dari hidrasi dan mencegah
fusi komponen-komponen membran (Munns 2002, Serraj dan Sinclair 2002).
Osmolit yang dibentuk oleh spesies bersifat spesifik, misalnya alfalfa, padi,
dan canola membentuk prolin (Girousse et al. 1996, Iyer dan Caplan 1998, Gibon
et al. 2000); Populus membentuk protein sejenis dehidrin (Pelah et al. 1997),
prolin dan sukrose (Watanabe et al. 2000); kedelai mengakumulasi pinitol yang
merupakan senyawa inositol (Guo dan Osterhuis 1997) dan prolin (Zheng dan Li
2000; Widoretno 2002); jagung membentuk sukrose (Zinselmeier et al. 1999) dan
prolin (Verslues dan Sharp 1999). Ryegrass yang mengalami kekeringan
mengakumulasi fruktan pada jaringan daun, khususnya pada bagian pelepah
dan dasar daun yang meristematik, tetapi tidak meningkatkan pembentukan
16
sukrose mengalami peningkatan (Amiard 2003). Kacang tanah kultivar Jerapah
dan Singa yang sebelumnya dilaporkan toleran, jika mengalami cekaman
kekeringan mengakumulasi prolin jauh lebih besar dibanding kultivar yang
rentan. Kultivar toleran dapat mempertahankan kandungan gula total saat
tercekam kekeringan, sementara pada kultivar rentan kandungan gula total
menurun (Sudarsono et al. 2004).
Homeostasi atau keseimbangan ionik bertujuan untuk mempertahankan
konsentrasi ion di tingkat seluler, jaringan dan tanaman. Hal tersebut dilakukan
dengan menambah jumlah vakuola, mengaktifkan mekanisme pompa ion,
saluran ion, transporter ion dan ATP-ase vakuolar. Konsentrasi ion di sitoplasma
dipertahankan pada rentang tertentu sehingga proses-proses fisiologi normal
dapat dilakukan (Mundree et al. 2002). Pada tanaman yang rentan, jika terjadi
cekaman kekeringan turgor sel turun sehingga menimbulkan hambatan mekanik
pada dinding dan membran sel yang tidak dapat balik. Tetapi pada tanaman
yang toleran, kerusakan mekanik dapat ditanggulangi antara lain dengan
mengurangi volume sel secara signifikan akibat mengerutnya dinding sel, atau
mempertahankan volume sel dengan pembentukan vakuola kecil dalam jumlah
banyak (Mundree et al. 2002).
Regulasi pertumbuhan pada umumnya dilakukan melalui pengaturan
pembukaan stomata dan aktivitas ABA untuk menurunkan intensitas fotosintesis
dan perbanyakan sel. Kultivar kapas yang toleran dapat mempertahankan
konduktan stomata dan fotosintesis seperti tanaman yang tidak mengalami
cekaman sehingga hanya mengalami penurunan potensial osmotik sebesar 20–
25%, sedangkan potensial air tidak nyata menurun. Sebaliknya p