OPTIMASI TRANSFORMASI EKSPLAN TEBU
MENGGUNAKAN GEN P5CS MELALUI
AGROBACTERIUM TUMEFACIENS
DWI SUBIYARTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Optimasi Transformasi Eksplan Tebu menggunakan Gen P5CS melalui Agrobacterium tumefaciens
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Tesis ini merupakan bagian dari Proyek Penelitian Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI), PT Riset Perkebunan Nasional (RPN) berkerja sama dengan Pusat Penelitian dan Pengembangan Perkebunan (PUSLITBANGBUN) DIPA APBN Tahun 2012 untuk publikasi nasional atas nama Dr. Hayati Minarsih, MSc. dan tim. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2013
Dwi Subiyarti
RINGKASAN
DWI SUBIYARTI. Optimasi Transformasi Eksplan Tebu menggunakan Gen P5CS melalui Agrobacterium tumefaciens. Dibimbing oleh LAKSMI AMBARSARI dan HAYATI MINARSIH.
Transformasi genetik merupakan salah satu upaya yang ditempuh untuk merakit tebu (Saccharum officinarum L.) yang toleran terhadap cekaman kekeringan. Gen P5CS berperan dalam biosintesis asam amino prolin yang terakumulasi saat tanaman mengalami cekaman kekeringan. Tujuan penelitian ini adalah untuk merakit tebu yang teleran terhadap kekeringan melalui optimasi transformasi eksplan tebu menggunakan gen P5CS melalui variasi strain A. tumefaciens, sumber eksplan dan varietas tebu.
Penelitian ini dilakukan melalui tahap sebagai berikut verifikasi gen P5CS koleksi BPBPI (Balai Penelitian Bioteknologi Perkebunan Indonesia), transformasi A. tumefaciens (Wang 2006), transformasi eksplan tebu (Sain et al.
1994) dan regenerasi tebu transforman.
Gen P5CS koleksi telah diverifikasi melalui analisis PCR dan elektroforesis gel agarosa menunjukkan adanya pita tunggal dengan ukuran 2.4 kb sama dengan kontrol positif. Hal ini menyakinkan bahwa benar gen P5CS dan selanjutnya siap digunakan untuk transformasi A. tumefaciens.
Gen P5CS koleksi BPBPI berada dalam plasmid pBI121 yang tersusun dalam konstruk rekombinan pBI-P5CS ditransformasikan ke A. tumefaciens strain GV3101, LBA4404 dan AGL1. Konstruk rekombinan pBI-P5CS asal tanaman
Vigna aconitifolia berhasil dengan baik ditransformasikan ke dalam sel A. tumefaciens strain GV3101, LBA4404 dan AGL1 yang ditumbuhkan dengan antibiotik yang sesuai. Strain GV3101 dan LBA4404 menggunakan antibiotik kanamisin dan rifampisin, sedangkan strain AGL1 antibiotik yang ditambahkan adalah kanamisin, rifampisin dan ampisilin masing-masing 50 ppm. Konfirmasi keberhasilan transformasi dilakukan dengan pengamatan pertumbuhan koloni transforman di media seleksi dan analisis PCR koloni menggunakan primer spesifik P5CS utuh. Hasil pengamatan menunjukkan bahwa A. tumefaciens
transforman tumbuh di media seleksi. Selain itu, hasil analisis PCR dan elektroforesis gel agarosa menunjukkan adanya pita tunggal dengan ukuran 2.4 kb sama dengan kontrol positif. Hal tersebut menunjukkan keberhasilan transformasi
A. tumefaciens dan selanjutnya siap digunakan untuk transformasi eksplan tebu. Sumber eksplan tebu yang digunakan dalam penelitian ini terdiri atas tiga jenis, yaitu kalus yang ditanam di media padat, kalus embriogenik dan embrio somatik yang diperoleh melalui metode Temporary Immersion System (TIS) atau Sistem Perendaman Sesaat (SPS) serta tebu dengan varietas Kidang Kencana, PS 881 dan PS 891. Ko-kultivasi dilakukan di media MS dengan penambahan asetosiringon 100 ppm di ruang kultur selama dua hari. Seleksi tebu transforman dilakukan di media MS dengan penambahan kanamisin 50 ppm dan sefotaksim 500 ppm. Eksplan yang tidak ditransformasi ditanam di media MS sebagai kontrol positif sedangkan kontrol negatif ditanam di media seleksi.
PCR untuk melihat keberhasilan dan kestabilan transformasi. Uji histokimia GUS untuk menguji keberadaan konstruk gen P5CS menunjukkan hasil positif dengan adanya pewarnaan biru. Demikian pula dengan analisis PCR menggunakan primer spesifik P5CS dari daerah terkonservasi gen P5CS menunjukkan adanya amplifikasi DNA yang berukuran sekitar 1.2 kb dan 700 bp untuk primer NPTII sama dengan kontrol positif. Hasil pengujian menunjukkan kedua gen telah masuk ke genom tebu.
Pertumbuhan tunas transforman sebagian masih mengalami albino dan penurunan tingkat hijau daun. Oleh karena itu, pada media regenerasi MS penambahan glukosa 1% dan putresin dengan variasi konsentrasi 0 ppm, 10 ppm dan 30 ppm. Terlihat adanya peningkatan warna hijau tunas transforman setelah tumbuh di media regenerasi selama 2 bulan dengan konsentrasi putresin yang optimum adalah 30 ppm. Planlet transforman siap diaklimatisasi dan diuji lebih lanjut kestabilan transformasi gen P5CS.
Serangkaian hasil penelitian dapat disimpulkan bahwa transformasi eksplan tebu menggunakan gen P5CS melalui A. tumefaciens telah berhasil dilakukan. Strain A. tumefaciens yang paling optimum sebagai media transformasi gen P5CS pada tebu adalah LBA4404. Sumber eksplan yang paling optimum adalah embrio somatik hasil kultur SPS. Sedangkan, pertumbuhan tebu transforman varietas Kidang Kencana terlihat paling baik dibandingkan dengan varietsaa PS 881 dan PS 891.
SUMMARY
DWI SUBIYARTI. Optimization Sugarcane Explants Transformation of P5CS Gene using Agrobacterium tumefaciens. Supervised by LAKSMI AMBARSARI and HAYATI MINARSIH.
Genetic transformation is one of the attempt in generating sugarcane (Saccharum officinarum L.) that are tolerant to drought stress. P5CS gene has a role in prolin biosynthesis, the amino acid that accumulating in water stress condition. Transformation of a P5CS gene construct into plant cells in conjunction with regeneration for transgenic plantlets should develop sugarcane tolerant to drought stress. The aim of this research is to generate drought-tolerant sugarcane through optimization transformation which includes the strain of Agrobacterium tumefaciens, a good source of sugarcane eksplant and varieties.
This study was done through verification of IBRIEC (Indonesian Biotechnology Research Institute for Estate Crops) P5CS gene collection A. Tumefaciens transformation (Wang 2006), sugarcane explants transformation (Sain 1994) and sugarcane transformant regeneration.
Verification of P5CS gene collection was PCR analysed by specific primers P5CS full lenght. PCR and gel electrophoresis showed a single band agarose and the same size of 2.4 kb with positive control. It is convinced that the P5CS gene has been isolated and transformed into A. tumefaciens.
IBRIEC collection P5CS genes in plasmid pBI121 were arranged in a recombinant construct of PBI-P5CS transformed into A. tumefaciens strain GV3101, LBA4404 and AGL1. Recombinant constructs PBI- P5CS from Vigna aconitifolia (V. aconitifolia) successfully transformed into cell A. tumefaciens
were grown with appropriate antibiotics. Strain GV3101 and LBA4404 used 50 ppm kanamycin and rifampicin respectively, while antibiotics were added in AGL1 strain is 50 ppm kanamycin, rifampicin and ampicillin respectively. The existence of P5CS gene in A. tumefaciens was tested by observing the growth of transformed colonies in media selection and colony PCR analysis using specific primers P5CS full lenght. The results showed that A. tumefaciens transformants were grown in selection media. PCR and gel electrophoresis analysis showed a single band agarose and same size of 2.4 kb with positive control. This showed the success of the transformation A. tumefaciens and used to explants sugar cane transformation.
Sugarcane explants used in this research was included calli grown in solid medium, embryogenic calli and somatic embryos with MS medium derived from Temporary Immersion System (TIS) culture with three varieties Kidang Kencana, PS 881 and PS 891. Co-cultivation medium used solid MS medium with acetosyringon in room temperature for two days. Transgenes selection was done in solid MS with antibiotics 50 ppm kanamycin and 500 ppm cefotaxime. Explants were not transformed cultured in MS media as positive control negative control while planted in the media selection.
regions of specific primers P5CS and NPTII. GUS histochemical test for the presence of P5CS gene constructs showed positive results in the presence of blue staining. DNA amplification showed that expected bent size at 1.2 kb and 700 bp for primers NPTII. The results of this examination proved that both transgenes were inserted in the sugarcane genomes.
The test results are stable sugarcane transformants through histochemical GUS test and PCR analysis showed stable transformants sugarcane. Growth of transformants on selection media indicated P5CS gene via A. tumefaciens
transformation has been successfully performed on sugarcane.
Regeneration of transformed sugarcane in the MS medium with the addition of 1% glucose and putrescine with various concentration of 0 ppm, 10 ppm and 30 ppm. Green shoots transformant were increased after growth in regeneration medium for 2 months with the optimum concentration of putrescine was 30 ppm. Transformant plantlets ready tobe acclimatized and to be further tested stability of P5CS gene.
It can be concluded that A. tumefaciens strain LBA4404 was the most effective transformation media of P5CS gene on sugarcane. The regeneration of Kidang Kencana transformants was better than the other two varieties, PS 881 and PS 891. Whilst, the best performance of transformants based on the source of explants was somatic embryo.
Keywords: drought stress, embryogenic calli, somatic embryos, proline
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
OPTIMASI TRANSFORMASI EKSPLAN TEBU
MENGGUNAKAN GEN P5CS MELALUI
AGROBACTERIUM TUMEFACIENS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Optimasi Transformasi Eksplan Tebu menggunakan Gen P5CS melalui Agrobacterium tumefaciens
Nama : Dwi Subiyarti NIM : G851110011
Disetujui oleh Komisi Pembimbing
Dr Laksmi Ambarsari, MS Ketua
Dr Hayati Minarsih, MSc Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur kepada Allah subhanahu wa ta’ala yang telah melimpahkan rahmat dan hidayah-Nya, sehingga karya ilmiah berjudul Optimasi Transformasi Eksplan Tebu menggunakan Gen P5CS melalui Agrobacterium tumefaciens dapat diselesaikan.
Penulis mengucapkan penghargaan dan terima kasih kepada: 1. Ibu Dr. Laksmi Ambarsari, MS. selaku ketua Komisi Pembimbing.
2. Ibu Dr. Hayati Minarsih, MSc. selaku anggota Komisi Pembimbing dan Penanggung jawab penelitian di Laboratorium Biokimia dan Biologi Molekuler BPBPI yang telah memberi kesempatan kepada penulis untuk ikut serta dalam penelitian ini.
3. Triyono, MT. suamiku sayang yang telah memberikan kesempatan penulis untuk terus belajar.
4. Bapak Dr. Priyono, ADS selaku Kepala BPBPI sekarang dan Bapak Dr. Ir. H. Darmono Taniwiryono, MSc. selaku Kepala BPBPI sebelumnya atas izin penelitian dan seluruh keluarga BPBPI yang membantu penelitian ini.
5. Bapak Soekarno Mismana Putra, SSi; Bapak Imron Riyadi, MSi; Ibu Niyyah Fitranty, SSi; Ibu Marini, Amd dan Saudari Rizqi Emilia.
6. Mama, Papa, Mamak, Bapak, Kakak, Adik dan keponakan tersayang yang senantiasa mendoakan dan memberi dukungan.
7. Teman-teman angkatan 2011 Biokimia S2 (Endri Purwanti, SSi; Djihan Ryn Pratiwi, SSi; Edy Sukmara, SSi; Rahardian Pratama, SSi; Welly Anggraini dan Septiani C. Palilingan, SSi) dan Mba Martha Sari, MSi atas dukungan, kerja sama dan motivasinya.
8. Semua pihak yang telah membantu baik secara langsung maupun tidak langsung, sehingga penelitian ini dapat diselesaikan.
Semoga Allah subhanahu wa ta’ala memberi keberkahan dan karya ilmiah ini dapat bermanfaat. Amiin.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL xvi
DAFTAR GAMBAR xvi
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis Penelitian 2
Manfaat Penelitian 2
METODE 3
Waktu dan Tempat Penelitian 3
Alat dan Bahan 3
Strategi Penelitian 3
Prosedur Penelitian 4
HASIL DAN PEMBAHASAN 12
Gen P5CS 12
A. tumefaciens Transforman 17
Tebu Transforman 21
Hasil Verifikasi Tebu Transforman 24
Hasil Pengujian Kestabilan Tebu Transforman 33
Hasil Regenerasi Tebu Transforman 35
SIMPULAN DAN SARAN 39
Simpulan 39
Saran 39
DAFTAR PUSTAKA 40
LAMPIRAN 41
DAFTAR TABEL
Karakteristik strain A. tumefaciens 19
Pertumbuhan tebu transforman (16 minggu) 27 Pertumbuhan tebu transforman berdasarkan varietas tebu yang
digunakan (16 minggu) 29
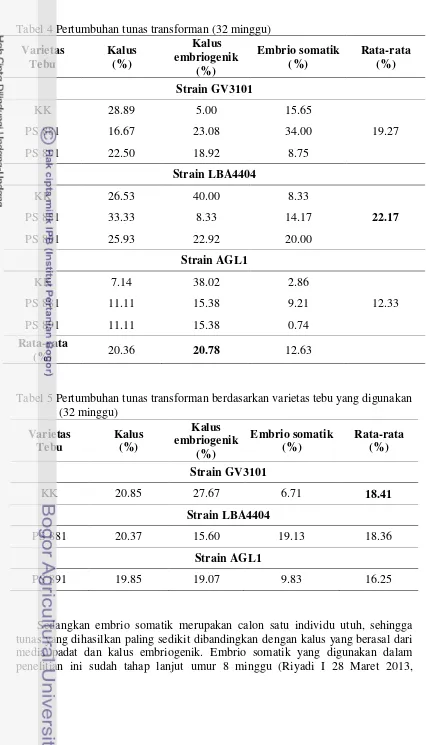
Pertumbuhan tunas transforman (32 minggu) 30
Pertumbuhan tunas transforman berdasarkan varietas tebu yang
digunakan (32 minggu) 30
Tingkat hijau daun tunas transforman 36
DAFTAR GAMBAR
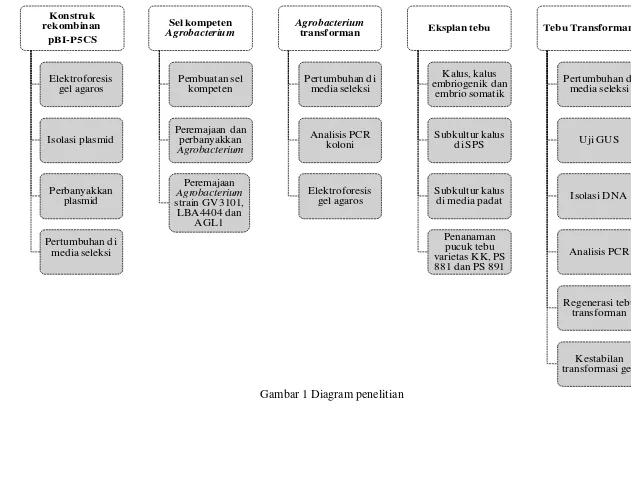
Diagram penelitian 5
Skema jalur biosintesis prolin pada tanaman 13
Peta Restriksi Konstruk Plasmid pBI-P5CS 14
Pertumbuhan bakteri di media seleksi 15
Hasil database menggunakan BLASTN 2.1.3 16 Elektroforegram hasil PCR dengan primer spesifik start stop 16 Interaksi A. tumefaciens dengan sel tumbuhan 18 Pertumbuhan koloni hasil transformasi konstruk rekombinan pBI-
P5CS ke A. tumefaciens 19
Elektroforegram hasil transformasi pBI-P5CS ke A. tumefaciens
A. tumefaciens 20
Pertumbuhan kalus di media MS 22
Sumber eksplan yang siap ditransformasi 23
Hasil uji histokimia GUS 24
Reaksi pembentukan warna biru 25
Perbandingan pertumbuhan tebu 26
Tebu transforman di media ko-kultivasi 28
Elektroforegram hasil PCR menggunakan primer spesifik P5CS CS tebu
transforman 31
Elektroforegram hasil PCR menggunakan primer spesifik NPTII pada
tebu transforman 32
Hasil uji histokimia GUS tunas transforman 33
Elektroforegram hasil PCR menggunakan primer spesifik P5CS CS tunas transforman 34 Elektroforegram hasil PCR menggunakan primer spesifik NPTII
tunas transforman 35
Tunas transforman 36
Pertumbuhan tunas transforman di media dengan penambahan putresin
(8 minggu) 38
Planlet tebu di media cair 38
DAFTAR LAMPIRAN
Komposisi media MS untuk induksi kalus dan regenerasi planlet 46
PENDAHULUAN
Latar Belakang
Kebutuhan bibit tebu semakin meningkat seiring meningkatnya produksi gula menuju swasembada gula tahun 2014. Sekitar 1.5-2 milyar bibit tebu per tahun harus tersedia, sementara penggunaan varietas tebu unggul masih terbatas. Selain itu, luas lahan perkebunan tebu semakin menurun dan saat ini bergeser ke lahan-lahan marjinal. Pemanfaatan lahan-lahan marjinal memerlukan tanaman tebu yang memiliki produktivitas tinggi dan toleran terhadap cekaman abiotik, khususnya toleran kekeringan.
Varietas unggul tebu (Saccharum officinarum L.) memiliki ciri-ciri antara lain produktivitas gula tinggi (nilai rendemen 13%), mudah dikepras dan toleran terhadap cekaman biotik (tahan terhadap hama dan penyakit) maupun cekaman abiotik (tahan kekeringan, genangan air, kadar garam tinggi, kadar nitrogen rendah dan sebagainya) (Tim Penulis PS 1992).
Salah satu upaya yang ditempuh adalah melalui rekayasa genetik guna merakit tebu yang toleran kekeringan. Upaya ini terbukti mampu menghasilkan tanaman yang memiliki sifat-sifat unggul (Manuhara 2006). Keberhasilan perakitan tanaman transgenik unggul dipengaruhi oleh beberapa faktor, antara lain (1) adanya sistem transformasi dan regenerasi yang mapan, (2) konstruk gen pembawa sifat unggul yang berfungsi dan sesuai serta (3) varietas tanaman anjuran baik atas dasar karakter agronomis maupun kemudahan teknis (Minarsih 2003). Selain itu, juga ditunjukkan dengan keberhasilan pertumbuhan tanaman baru yang normal, fertil dan dapat mengekspresikan gen baru hasil insersi (Manuhara 2006).
Beberapa hasil penelitian telah (Ananda 2004; Wulandari 2005; Nurkhasanah 2007; Susiyanti et al. 2007) dilaporkan bahwa transformasi tebu menggunakan gen fitase telah berhasil dilakukan agar tahan di lahan dengan kadar fosfat rendah. Selain itu, Eka et al. (1997) juga telah berhasil merakit tebu yang tahan terhadap penggerek batang (Chillo auricillius), stem borer (pembuat lubang pada batang) (Ali 2006), virus kuning daun (Sugarcane yellow leaf virus, SCYLV) (Gilbert et al. 2009) dan jamur (Khamrit et al. 2012).
Perakitan tebu toleran kekeringan dapat diupayakan dengan melakukan transformasi gen P5CS yang menyandi enzim ∆1-Pyrroline-5-carboxylate synthetase (P5CS). Gen P5CS berperan dalam biosintesis prolin yaitu asam amino yang berperan sebagai senyawa osmoprotektan yang diakumulasi saat tanaman mengalami cekaman kekeringan atau cekaman osmotik (Bray 1997).
2
Perumusan Masalah
Transformasi eksplan tebu menggunakan gen P5CS melalui A. tumefaciens
telah berhasil diperoleh tebu transforman yang memiliki sifat toleran terhadap kekeringan. Transformasi kalus embriogenik tebu varietas PS 851 dan PS 862 asal media padat menggunakan gen P5CS melalui A. tumefaciens strain LBA4404 masih belum optimal karena menghadapi beberapa kendala seperti terhambatnya pertumbuhan transforman, terbentuknya planlet albino atau bulai, kimera,
browning (pencoklatan pada eksplan dan media) dan vigor yang lemah. Oleh sebab itu perlu dilakukan optimasi penggunaan strain A. tumefaciens, sumber eksplan dan varietas tebu agar diperoleh tebu transgenik yang memiliki sifat toleran terhadap kekeringan dengan pertumbuhan transforman yang cepat, warna planlet hijau, tidak kimera dan vigor yang kuat.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk merakit tebu yang teloren terhadap kekeringan melalui optimasi transformasi eksplan tebu menggunakan gen P5CS melalui variasi strain A. tumefaciens, sumber eksplan dan varietas tebu.
Hipotesis Penelitian
Perakitan tebu toleran kekeringan dapat dilakukan melalui transformasi eksplan tebu menggunakan strain A. tumefaciens yang efektif, sumber eksplan dan varietas tebu yang optimum.
Manfaat Penelitian
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia dan Biologi Molekuler serta Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) Jalan Taman Kencana No. 1 Bogor. Penelitian ini dimulai dari bulan Maret 2012-Juni 2013.
Alat dan Bahan
Alat yang digunakan adalah alat gelas, ose, bunsen, autoklaf, rak kultur, pipet mikro, mikrotips, neraca analitik Sartorius® ED4252-CW, Allegra 64R
Centrifuge-Beckman Coulter, tabung sentrifus, mikrosentrifus Eppendorf 5415R, tabung Eppendorf, shaker incubator ES20-Biosan, laminar air flow ESCO, pH meter (Docu pHmeter Sartorius®), magnetic stirrer, seperangkat alat PCR TPersonal BIOMETRA®, seperangkat elektroforesis TOYLAB, botol kultur steril,
vortex mixer CORNING LSE®, water bath, Speed Vacum DNA, lemari pendingin, mikrofilter, sarung tangan, plastik, karet, pinset, pisau dan seperangkat spektrofotometer Thermo Scientific Multiskan GO.
Bahan yang digunakan adalah media MS (Murashige dan Skoog 1962) untuk induksi kalus dan media regenerasi yang komposisinya terdapat pada Lampiran 2, media LB (Luria-Bertani) (Lampiran 2), aluminium foil, serbuk agarosa, buffer TBE (Tris Borat EDTA), kit isolasi plasmid (GenJETTM plasmid miniprep kit, Fermentas life sciences), kit bahan campuran PCR (Fermentas life sciences), primer spesifik P5CS dari sekuen CDS gen P5CS V. aconitifolia (start 5’-CGG GGG TTC ATG AAG GAC G-γ’ dan stop 5’-GAA TCG TTA AAC ATT GTG GAC C-γ’), primer spesifik P5CS dari daerah terkonservasi sekuen CDS gen P5CS V. aconitifolia (CS forward 5’-TAC TGA GAC TGT GAA GTC GC-γ’ dan CS reverse 5’-ATG GCA TTG CAG GCT GCC G-γ’), primer spesifik NPTII (Neomycin Phosphotransferase II), akuades, Gel red, loading dye, nitrogen cair, tusuk gigi, masker, alkohol, antibiotik rifampisin, kanamisin, ampisilin, sefotaksim, asetosiringon, putresin, glukosa dan pereaksi untuk GUS assay (Uji
histokimia GUS/ -glukoronidase).
Kalus dari media padat, kalus embriogenik dan embrio somatik tebu varietas PS 881, PS 891 dan Kidang Kencana (KK). Strain A. tumefaciens strain LBA4404, GV3103 dan AGL1 (dari Dr. Sony Suhandono, Sekolah Ilmu dan Teknologi Hayati, Institut Teknologi Bandung) serta konstruk rekombinan pBI-P5CS Vigna aconitifolia (V. aconitifolia) dari Dr. Desh Pal S. Verma, Ohio State University, USA.
Strategi Penelitian
4
seleksi, perbanyakkan plasmid, isolasi konstruk rekombinan pBI-P5CS dan elektroforesis gel agarosa (2) transformasi konstruk rekombinan pBI-P5CS ke A. tumefaciens yang meliputi pertumbuhan A. tumefaciens starin GV3101, LBA4404 dan AGL1 koleksi di media seleksi, peremajaan dan perbanyakkan, pembuatan sel kompeten dan transformasi konstruk rekombinan pBI-P5CS sel kompeten A. tumefaciens, (3) pengujian Agrobacterium transforman yang meliputi pertumbuhan di media seleksi, analisis PCR koloni dan elektroforesis gel agarosa, (4) transformasi gen ke eksplan meliputi penyiapan pucuk tebu, subkultur kalus di media padat, subkultur kalus melalui metode SPS dan transformasi gen melalui A. tumefaciens ke eksplan tebu serta (5) pengujian tebu transforman meliputi perhitungan persentase pertumbuhan tunas transforman di media seleksi, uji GUS, isolasi DNA, analisis PCR, regenerasi tebu transforman dan kestabilan transformasi gen (Gambar 1).
Prosedur Penelitian
Kultur jaringan tanaman tebu
Penanaman pucuk tebu untuk penyiapan kalus (Minarsih 2003)
Pucuk tebu varietas varietas KK, PS 881 dan PS 891 disiapkan dengan memisahkan pucuk yang masih muda (daun menggulung) yaitu sekitar 20 cm pada jaringan meristem. Pucuk tebu direndam dalam alkohol dan disterilisasi dengan memanaskannya di atas pembakar spiritus beberapa saat. Setelah itu, bagian kulit terluar pucuk tebu dikupas, direndam kembali dalam alkohol, dipanaskan dan diulangi sebanyak 2 kali hingga mendapat pucuk yang lunak.
Sekitar 0.2-0.5 cm dari pangkal tunas, batang pucuk muda dipotong-potong menjadi 12 bagian kecil. Kemudian, potongan pucuk ditanam di media MS dan diinkubasi di ruang kultur tanpa cahaya selama 4 minggu. Penanaman pucuk tebu dilakukan dilakukan secara aseptis dalam laminar air flow. Pembuatan media MS dengan komposisi bahan yang digunakan dapat dilihat pada Lampiran 1.
Penyiapan kalus embriogenik dan embrio somatik (Mordocco et al. 2009) Kalus embriogenik dan embrio somatik varietas KK, PS 881 dan PS 891 disiapkan di Laboratorium Biak Sel dan Mikropropagasi BPBPI, Ciomas melalui metode Temporary Immersion System (TIS) atau Sistem Perendaman Sesaat (SPS). Kalus yang berasal dari pucuk tebu ketiga varietas disubkultur sebanyak 2-4 kali. Kemudian, sebanyak 0.5 gram kalus dimasukkan dalam bejana SPS RITA® dan dilakukan secara aseptis dalam laminar air flow. Bejana SPS RITA® kemudian dihubungkan dengan pompa dan automatic timer (Autonic). Program
6
Transformasi genetik
Peremajaan A. tumefaciens
A. tumefaciens strain GV3103, LBA4404 dan AGL1 ditanam kembali dalam media YEP (Yeast Extract Peptone) padat yang baru (Lampiran 2). Media seleksi YEP dengan penambahan antibiotik rifampisin 50 ppm digunakan untuk A. tumefaciens strain GV3101 dan LBA4404. Sedangkan untuk strain AGL1 antibiotik yang ditambahkan ke dalam media YEP adalah rifampisin 50 ppm dan ampisilin 50 ppm. Penyiapan media dan penanaman A. tumefaciens dilakukan secara aseptis dalam laminar air flow. A. tumefaciens di media baru kemudian diinkubasi tanpa cahaya selama 2 hari untuk strain GV3103 dan LBA4404 serta 3 hari untuk strain AGL1 pada suhu 28 oC. Pembuatan media dan peremajaan A. tumefaciens dilakukan secara aseptis dalam laminar air flow.
Pembuatan Sel Kompeten (Wang 2006)
Pembuatan sel kompeten menggunakan metode pembekuan (Thaw Method). Sebanyak 100 µ L A. tumefaciens strain GV3101, LBA4404 dan AGL1 dimasukkan ke dalam 100 mL media YEP cair (Lampiran 2) dengan antibiotik rifampisin 50 ppm untuk strain GV3101 dan LBA4404. Sedangkan strain AGL1 antibiotik yang ditambahkan adalah rifampisin 50 ppm dan ampisilin 50 ppm. Campuran diinkubasi pada suhu 28 oC tanpa cahaya dan dikocok pada kecepatan 120 rpm hingga memperoleh nilai OD600 0.55-0.65 (OD600, optical density pada
panjang gelombang 600 nm). Lalu, suspensi biakan disentrifugasi selama 10 menit pada kecepatan 10000 rpm dan suhu 4 oC. Setelah itu, supernatan dibuang dan pelet disuspensikan ke dalam 5 mL larutan CaCl2 20 mM dingin. Campuran
disentrifugasi kembali selama 10 menit pada kecepatan 10000 rpm dan suhu 4 oC. Selanjutnya, supernatan dibuang dan pelet disuspensikan dalam 1 mL larutan CaCl2 20 mM dingin. Campuran kemudian dibagi ke dalam tabung Eppendorf
masing-masing 100 μL dalam kondisi dingin dan dimasukkan ke dalam nitrogen cair yang selanjutnya disimpan pada suhu -70 oC untuk digunakan sekali pakai. Pembuatan sel kompeten dilakukan secara aseptis dalam laminar air flow.
Transformasi Agrobacterium (Wang 2006)
Sebanyak 1 μL plasmid (pBI-P5CS) dan 5 μL sel kompeten A. tumefaciens
dimasukkanke dalam 2 mL media YEP (tanpa antibiotik). Campuran dimasukkan ke dalam nitrogen cair selama 5 menit dan selanjutnya dipindahkan pada suhu 37
o
C selama 5-10 menit. Selanjutnya, campuran dimasukkan ke dalam media YEP 2 mL dan diinkubasi selama 2-4 jam pada suhu 28 oC serta dihomogenkan. Setelah itu, campuran disentrifugasi selama 2 menit pada kecepatan 10000 rpm dan suhu 4
o
7 diinkubasi tanpa cahaya pada suhu 28 oC selama 2 hari untuk strain GV3103 dan LBA4404 serta 3 hari untuk strain AGL1. Transformasi konstruk rekombinan pBI-P5CS ke A. tumefaciens dilakukan secara aseptis dalam laminar air flow.
Transformasi eksplan tebu (Sain et al. 1994)
Gen P5CS dalam konstruk rekombinan pBI-P5CS ditransformasi ke eksplan kalus asal media padat, kalus embriogenik dan embrio somatik yang berasal dari kultur SPS melalui perantara A. tumefaciens. A. tumefaciens transforman diremajakan terlebih dahulu dalam 5 mL media LB cair dengan penambahan antibiotik rifampisin 50 ppm dan kanamisin 50 ppm untuk A. tumefaciens strain LBA4404 dan GV3101. Sedangkan penambahan antibiotik rifampisin 50 ppm, ampisilin 50 ppm dan kanamisin 50 ppm ke media LB cair untuk strain AGL1. A. tumefaciens yang telah ditransformasi kemudian diinkubasi dan dikocok pada suhu 28 oC tanpa cahaya selama 2 hari untuk strain GV3103 dan LBA4404 serta 3 hari untuk strain AGL1.
A. tumefaciens segar sebanyak 1 mL kemudian diremajakan kembali ke media LB baru sebanyak 10 mL dengan antibiotik yang sesuai. Campuran diinkubasi pada suhu 28 oC tanpa cahaya dan dikocok pada kecepatan 120 rpm hingga memperoleh nilai OD600 = 0.55-0.65. Selanjutnya, suspensi biakan
disentrifugasi pada kecepatan 10000 rpm selama 2 menit. Pelet yang dihasilkan dilarutkan dengan larutan MS cair dan ditambah asetosiringon 100 ppm.
Larutan kemudian digunakan untuk inokulasi eksplan selama 15 menit tanpa cahaya. Lalu, eksplan diserapkeringkan dengan kertas tisu steril. Segera setelah itu, eksplan diko-kultivasi pada media MS padat dengan asetosiringon 100 ppm dan diinkubasi selama 2 hari di ruang kultur tanpa cahaya. Jika A. tumefaciens
tumbuh signifikan, maka eksplan dicuci dengan media MS cair atau akuades steril hingga bersih. Apabila pertumbuhan A. tumefaciens tidak nyata, maka eksplan dapat langsung dipindahkan ke MS padat yang mengandung sefotaksim 500 ppm dan diinkubasi di ruang kultur tanpa cahaya selama 7 hari.
Eksplan kemudian disubkultur ke media seleksi dengan penambahan kanamisin 50 ppm dan sefotaksim 500 ppm selama 4 minggu di ruang kultur gelap. Selanjutnya, eksplan disubkultur dan diinkubasi di ruang terang pada media yang sama untuk inisiasi tunas. Eksplan yang tidak ditransformasi ditanam di media MS sebagai kontrol positif sedangkan kontrol negatif ditanam di media seleksi. Proses penambahan antibiotik, penyiapan eksplan dan subkultur dilakukan secara aseptis dalam laminar air flow.
8
Pengujian molekuler
Uji koleksi konstruk rekombinan pBI-P5CS
Pengujian ini dilakukan untuk mengetahui apakah plasmid koleksi berada dalam Escherichia coli (E. coli) atau sudah dalam A. tumefaciens. Koleksi konstruk rekombinan pBI-P5CS sebanyak 10 μL ditambahkan dalam media LB sebanyak 25 mL dalam botol kecil yang sudah disterilisasi.
Seleksi antibiotik koleksi konstruk rekombinan pBI-P5CS disiapkan dalam dua botol kecil. Botol pertama berisi media LB sebanyak 25 mL ditambah antibiotik rifampisin 50 ppm dan kanamisin 50 ppm kemudian dikocok pada kecepatan 250 rpm dan suhu 28 oC selama 2 hari. Apabila tumbuh (kuning keruh) maka dapat dipastikan bahwa konstruk rekombinan pBI-P5CS sudah berada dalam A. tumefaciens. Sedangkan botol kecil yang kedua berisi media LB sebanyak 25 mL ditambah antibiotik kanamisin 50 ppm dan diinkubasi pada suhu 37 oC hingga 18 jam sambil dikocok pada kecepatan 250 rpm. Apabila tumbuh, maka dapat disimpulkan bahwa konstruk rekombinan pBI-P5CS masih berada dalam E. coli yang selanjutnya harus diisolasi untuk mendapatkan pBI-P5CS.
Isolasi konstruk rekombinan pBI-P5CS
Isolasi konstruk rekombinan pBI-P5CS dalam E. coli dilakukan untuk mendapatkan konstruk rekombinan pBI-P5CS yang akan ditransformasi ke A. tumefaciens. Isolasi ini dilakukan dengan menggunakan GeneJETTM Plasmid miniprep kit (Fermantas life science kit).
Sebanyak 4 mL kultur bakteri koleksi konstruk rekombinan pBI-P5CS disentrifugasi pada kecepatan 12000 rpm selama 1 menit. Supernatan dibuang dan ditambahkan Resuspesion buffer sebanyak β50 μL. Larutan kemudian dihomogenkan dengan vortex hingga larut. Setelah itu, campuran ditambah larutan Lysis buffer sebanyak β50 μL dan dihomogenkan dengan cara dibolak-balik 4-6 kali. Lalu, campuran ditambah larutan Neutralization buffer sebanyak
γ50 μL dan dihomogenkan dengan cara dibolak-balik 4-6 kali. Kemudian, campuran disentrifugasi pada kecepatan 12000 rpm dan suhu 25 oC selama 5 menit.
Supernatan dibuang dan pelet yang diperoleh ditambah larutan Wash solution
sebanyak 700 μL dalam tabung berfilter. Setelah itu, tabung berfilter disentrifugasi pada kecepatan 12000 rpm selama 2 menit. Lalu, supernatan dibuang dan ditambah larutan Wash solution sebanyak 700 μL. Campuran selanjutnya disentrifugasi kembali pada kecepatan 12000 rpm selama 2 menit.
Supernatan dibuang dan tabung berfilter diganti dengan Eppendorf steril 1.5 mL. Kemudian, filtrat ditambah larutan Ellution buffer sebanyak γ0 μL, didiamkan selama 2 menit pada suhu kamar dan selanjutnya disentrifugasi pada kecepatan 13000 rpm selama 2 menit. Tabung berfilter dibuang dan akhirnya
9 Isolasi DNA tebu transforman (Orozco-Castillo et al. 1994)
Isolasi DNA tebu transforman dilakukan sebelum DNA dianalisis PCR. Sebanyak 0.1 gram tebu transforman yang sudah diseleksi dimasukkan ke dalam tabung Eppendorf 2 mL. Kemudian, tebu transforman ditambah nitrogen cair dan ditumbuk hingga halus. Selanjutnya, serbuk tebu transforman ditambah larutan buffer ekstraksi sebanyak 1 mL yang telah dipanaskan dan ditambahkan larutan -merkaptoetanol 1% sebanyak 10 μL. Campuran kemudian dihomogenkan dengan cara dibolak-balik hingga homogen dan dipanaskan selama 30 menit pada suhu 65
o
C.
Larutan ekstrak buffer kemudian dibiarkan hingga dingin di suhu kamar. Setelah itu, larutan ditambah campuran kloroform:isoamilalkohol (24:1) (larutan KI) sebanyak 1 mL dan dihomogenkan dengan cara dibolak-balik. Setelah itu, campuran disentrifugasi pada kecepatan 11000 rpm dan suhu 25 oC selama 10 menit. Lapisan bagian atas dipipet ke tabung Eppendorf yang baru dan diekstrak kembali dengan larutan KI sebanyak volume cairan yang diperoleh. Kemudian campuran disentrifugasi kembali pada kecepatan 11000 rpm dan suhu 25 oC selama 10 menit.
Cairan bagian atas dipipet ke tabung Eppendorf yang baru dan ditambahkan larutan isopropanol sebanyak 1 kali volume cairan yang diperoleh. Setelah itu, campuran dikocok perlahan hingga homogen dan disimpan dalam lemari pendingin pada suhu 4 oC selama 30 menit. Setelah itu, campuran disentrifugasi pada kecepatan 11000 rpm selama 10 menit. Supernatan dibuang dan pelet DNA dikeringkan dengan cara membalikkan tabung Eppendorf.
Pelet DNA dilarutkan dalam 100 μL larutan buffer TE (Tris-EDTA). Kemudian, larutan ditambah 10 μL larutan CH3COONa 3 M pH 5.2 dan etanol
absolut sebanyak 250 μL. Setelah itu, campuran dihomogenkan dan disimpan dalam lemari pendingin (-20 oC) selama 30 menit. Selanjutnya, campuran disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Supernatan dibuang dan pelet DNA dicuci dengan larutan etanol 70% sebanyak 50-100 μL dan dikeringkan dengan Speed Vacum DNA.
Pelet yang sudah kering dilarutkan dalam 100 μL buffer TE atau ddH2O,
ditambahkan RNase sebanyak β5 μL/ mL dan diinkubasi pada suhu 37 oC selama 30 menit. DNA tebu transforman yang telah diperoleh selanjutnya dianalisis PCR. Kualitas DNA lebih lanjut dapat diuji dengan elektroforesis gel agarosa 1% dan konsentrasinya diukur dengan spektrofotometer pada panjang gelombang 230, 260 dan 280 nm.
Verifikasi konstruk rekombinan pBI-P5CS (Minarsih 2003)
Verifikasi konstruk rekombinan pBI-P5CS dilakukan untuk menyakinkan hasil isolasi menggunakan PCR (Polimerase Chain Reactions). Reaksi PCR menghasilkan DNA konstruk rekombinan pBI-P5CS yang telah diperbanyak. Keberadaan plasmid yang diinginkan dapat dilihat dengan elektroforesis gel agarosa. Reagen yang digunakan berasal dari Fermentas life science. Sebanyak 5
μL larutan buffer dNTP 1 μL, primer spesifik P5CS start dan stop masing-masing sebanyak 2 μL, Taq polymerase sebanyak 0.6 μL, 1 μL DNA plasmid hasil isolasi yang telah diencerkan 10 kali dan ditambah ddH2O (molecular water) hingga
10
Program PCR diatur sebagai berikut: pre denaturasi 94 oC selama 10 menit, denaturasi 94 oC selama 30 menit, penempelan (annealing) 58 oC selama 30 detik, tahap penyempurnaan reaksi (perpanjangan rantai DNA) 72 oC selama 4 menit dan stabilisasi reaksi pada suhu 10 oC. Hasil PCR dianalisis menggunakan metode elektroforesis untuk mengetahui ukuran plasmid.
Verifikasi gen NPTII dan gen P5CS (primer spesifik P5CS CS) tebu transforman dilakukan dengan program yang sama dengan primer spesifik P5CS
start dan stop. Suhu annealing untuk primer NPTII adalah 55 oC (Minarsih 2003). Sedangkan, program PCR koloni ditambahkan tahap lisis sebelum pre denaturasi. Pengaturan program lisis sebagai berikut suhu 96 oC selama 5 menit, 50 oC selama 1 menit 30 detik, 96 oC selama 1 menit 30 detik, 45 oC selama 1 menit 30 detik, 96 oC selama 1 menit dan 40 oC selama 1 menit.
Kontrol positif menggunakan template DNA rekombinan pBI-P5CS. Sedangkan kontrol negatif menggunakan molecular water sebagai template. Keduanya disiapkan dan direaksikan bersama setiap melakukan analisis PCR.
Elektroforesis
Sampel DNA dianalisis dengan elektroforesis gel agarosa untuk konfirmasi ukuran pBI-P5CS dan DNA tebu transforman setelah dianalisis PCR. Gel agarosa konsentrasi 1% dimasukkan dalam bejana elektroforesis dan sebanyak β μL sampel dimasukkan dalam sumur. Kemudian, gel agarosa dielektroforesis dengan tegangan 75 volt. Hasil elektroforesis diamati dan difoto di atas UV
transluminator, sehingga dapat dilihat ukuran dari plasmid pBI-P5CS dalam satuan bp (base pair/ pasang basa) dibandingkan dengan marka 1 kb Plus DNA Ladder dari Invitrogen.
Uji histokimia GUS (Jefferson 1987)
Pengujian GUS dilakukan pada eksplan yang telah ditransformasi. Reagen yang digunakan adalah larutan X-Gluc (5-Bromo-4-chloro-3-indolyl- -D-glucuronic acid) 1 mM; K3Fe(CN)6 0.1 mM; K4Fe(CN)6 0.1 mM; triton 3% dan
fosfat buffer (NaH2PO4/NaHPO4) 50 mM dengan pH 7.0. Tebu transforman
diinkubasi dalam larutan reagen selama 24 jam pada suhu 37 oC tanpa cahaya. Setelah itu, tebu transforman dicuci dengan alkohol dan diamati warna biru yang terbentuk.
Regenerasi tebu transforman
11 Verifikasi kestabilan tebu transforman
12
HASIL DAN PEMBAHASAN
Gen P5CS
Tebu termasuk dalam famili Poaceae, genus Saccharum dan spesies Saccharum officinarum L. (Benson 1957) yang dapat tumbuh di daerah tropis dan subtropis (James 2004). Kebutuhan tebu sebagai bahan baku utama pembuatan gula meningkat, untuk memenuhi program pemerintah yaitu swasembada gula tahun 2014. Oleh karena itu, perlu penyediaan bibit tebu yang cukup. Salah satu kendala yang dihadapi adalah adanya perubahan musim dan lahan yang terbatas. Berbagai upaya telah dilakukan untuk merakit tebu yang cocok ditanam di lahan marjinal mulai metode konvensional hingga modern.
Kekeringan adalah faktor utama yang mempengaruhi pertumbuhan, perkembangan, ketahanan dan produktivitas tanaman. Kekeringan tidak hanya permasalahan utama di lahan marjinal tetapi juga di lahan optimum pada kondisi iklim di lahan kering. Respon tanaman terhadap toleran kekeringan bervariasi. Secara molekuler diantaranya adalah dengan mengakumulasi senyawa osmoprotektan (Bray 1997). Prolin merupakan asam amino yang berperan sebagai senyawa osmoprotektan.
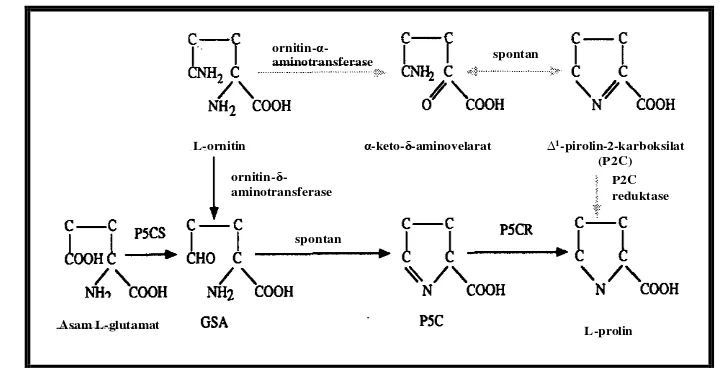
Sintesis prolin pada tanaman tingkat tinggi dapat melalui dua jalur yaitu jalur glutamat (Glu) dan jalur ornitin (Orn) (Gambar 2) (Delauney dan Verma 1993). Saat tanaman mengalami cekaman, prolin diproduksi secara langsung melalui jalur Glu. Sedangkan saat kondisi normal, tanaman menggunakan ornitin sebagai prekursor melalui jalur Orn untuk menghasilkan prolin (Aprile et al. 2009).
Jalur Glu dimulai dengan konversi asam glutamat menjadi glutamat -semialdehid (GSA) yang dikatalisis oleh enzim ∆1-pyrroline-5-carboxylate synthetase (P5CS). Selanjutnya, GSA diubah menjadi ∆1-pyrroline-5-carboxylate
(P5C) secara spontan. Akhirnya L-prolin terbentuk dari P5C yang dikatalisis oleh enzim ∆1-pyrroline-5-carboxylate reductase (P5CR). Sintesis prolin melalui jalur Glu dapat meningkat pada kondisi tanaman mengalami cekaman kekeringan (Delauney dan Verma 1993).
Sintesis prolin melalui jalur Orn dimulai dengan konversi L-ornitin menjadi
α-keto-δ-amonivelarat yang dikatalisis oleh enzim ornitin-α-aminotransferase dan secara spontan diubah menjadi ∆1- pyrroline-2-carboxylate (P2C). Akhirnya L-prolin terbentuk dari P2C yang dikatalisis oleh enzim ∆1-pyrroline-2-carboxylate reductase (P2CR). Selain itu, L-ornitin juga dapat diubah menjadi GSA yang dikatalisis oleh enzim ornitin-δ-aminotransferase (OAT) dan selanjutnya dibentuk prolin melalui jalur Glu.
Gen P5CS merupakan gen yang menyandi enzim P5CS. Enzim P5CS dianggap sebagai enzim pengatur utama dalam sintesis prolin dan meningkatkan pengaturan produksi prolin pada saat tanaman mengalami cekaman (Aprile et al. 2009). Selain itu, gen P5CS merupakan penyandi enzim yang menjadi faktor pembatas dalam biosintesis prolin pada tanaman tingkat tinggi (Hu et al. 1992).
13
membrane yang terdiri atas 3575 klon cDNA dari pustaka daun tebu dan hasilnya dikonfirmasi menggunakan analisis Real Time PCR. Hasil penelitian menunjukkan terdapat 165 gen yang terekspresi saat stress air, tetapi hanya 94% yang diatur saat stress dan baru 49 gen yang sudah diketahui identitasnya salah
Gambar 2 Skema jalur biosintesis prolin pada tanaman (Delauney dan Verma 1993)
Ket:
P2C = ∆1-pyrroline-2-carboxylate (∆1-pirolin-2-karboksilat)
P2CR = ∆1-pyrroline-2-carboxylate reductase (∆1-pirolin-2-karboksilat redutase) P5C = ∆1-pyrroline-5-carboxylate (∆1-pirolin-5-karboksilat)
P5CR = ∆1-pyrroline-5-carboxylate reductase (∆1-pirolin-5-karboksilat reduktase) P5CS = ∆1-pyrroline-5-carboxylate synthetase (∆1-pirolin-5-karbosilat sintetase) GSA = glutamate- -semialdehide (glutamat- -semialdehid)
Penelitian tembakau dan tebu transgenik yang diintroduksi gen P5CS dengan perlakuan kondisi toleran kekeringan menunjukkan konsentrasi prolin meningkat dan lebih tinggi dibandingkan dengan tanaman kontrol (non-transgenik) (Minarsih 2003). Selain itu, transformasi kalus kelapa sawit menggunakan gen P5CS telah berhasil mendapatkan kalus transforman yang memiliki sifat toleran terhadap kekeringan (Usmani 2011).
Transformasi eksplan tebu menggunakan gen P5CS telah berhasil dilakukan secara biologis melalui A. tumefaciens dan secara fisik dengan particle bombardment. Hasil penelitian menunjukkan penggunaan Agrobacterium terbukti lebih efektif dan efisien dalam transfer konstruk transgen P5CS ke dalam kalus tebu daripada metode particle bombrdment. Tebu transforman yang dihasilkan mengalami pertumbuhan yang lebih lambat dibandingkan dengan kontrol positif, regenerasi planlet tebu transgenik bulai dan memiliki vigor yang lemah (Minarsih 2003).
14
daerah NOS-γ’. Hasil konstruksi dimasukkan ke dalam EcoRl pada vektor bagian pBI121. Vektor tersebut juga mengandung NPTII dan uidA (GUS) daerah penyandi yang digunakan untuk seleksi tanaman transgenik pada antibiotik kanamisin. Peta restriksi konstruk rekombinan menunjukkan daerah label cDNA P5CS yang ditandai dengan marka oleh ATG pada nukleotida yang ke-37 dan TAA ke-2185 serta daerah lainnya (Kavi Kishor et al. 1995).
Gambar 3 Peta Restriksi Konstruk Rekombinan pBI-P5CS (Kishor et al. 1995)
Plasmid pBI121 telah banyak digunakan untuk transformasi tanaman. Ukuran lengkap sekuen plasmid pBI121 adalah 14758 bp dengan daerah T-DNA 6193 bp yang mengandung batas kanan (right border, RB) gen NPTII sebagai penanda seleksi dan gen GUS sebagai gen reporter di batas kiri (left border, LB) (Chen et al. 2003).
Tahap awal penelitian ini adalah menguji keberadaan koleksi pBI-P5CS BPBPI. Konstruk rekombinan pBI-P5CS koleksi diuji untuk mengetahui keberadaan plasmidnya di E. coli atau A. tumefaciens. Pengujian keberadaan plasmid dilakukan pada dua botol kultur dengan media LB sebagai media pertumbuhan. Penambahan antibiotik rifampisin bertujuan untuk menyeleksi pertumbuhan A. tumefaciens. Sedangkan antibiotik kanamisin merupakan penyeleksi konstruk rekombinan pBI-P5CS, yaitu pengujian keberadaan gen NPTII (Kishor et al. 1995).
Botol pertama, media LB cair ditambahkan antibiotik rifampisin 50 ppm dan kanamisin 50 ppm kemudian dikocok pada kecepatan 250 rpm dan suhu 28 oC selama 2 hari tanpa cahaya. Media tersebut merupakan media seleksi untuk pertumbuhan A. tumefaciens (Venkatachalam et al. 2000; Minarsih 2003; Heikal
et al. 2008). Sedangkan botol kedua, media LB cair ditambah antibiotik kanamisin 50 ppm dan diinkubasi pada suhu 37 oC hingga 18 jam sambil dikocok pada kecepatan 250 rpm. Botol kedua merupakan media seleksi untuk pertumbuhan E. coli (Chandrasekharaiah et al. 2004).
Pengamatan hari pertama belum menunjukkan perubahan warna campuran pada kedua botol kultur. Suspensi biakan masih berwarna coklat tua. Hasil inkubasi hari kedua juga tidak menunjukkan adanya perubahan warna campuran pada botol pertama. Hal ini menunjukkan bahwa bakteri tidak tumbuh. Sedangkan botol kedua terjadi perubahan warna campuran menjadi kuning keruh yang
15 menunjukkan adanya pertumbuhan bakteri. Hasil inkubasi mengindikasikan bahwa koleksi konstruk rekombinan pBI-P5CS berada dalam E. coli (Gambar 4).
a b
Gambar 4 Pertumbuhan bakteri di media seleksi
a. Suspensi biakan A. tumefaciens dan b. Suspensi biakan
E. coli
Konstruk rekombinan pBI-P5CS dalam E. coli kemudian diisolasi untuk mendapatkan konstruk rekombinan pBI-P5CS yang akan ditransformasi ke A. tumefaciens. Isolasi konstruk rekombinan pBI-P5CS dilakukan dengan menggunakan GeneJETTM Plasmid miniprep kit (Fermantas life science kit). Proses isolasi diawali dengan peremajaan koleksi konstruk rekombinan pBI-P5CS dalam bakteri yang bertujuan untuk mendapatkan bakteri yang masih muda dan segar.
Pengujian kebenaran konstruk rekombinan pBI-P5CS hasil isolasi dianalisis menggunakan PCR dengan primer spesifik P5CS dan elektroforesis gel agarosa yang dibandingkan dengan kontrol positif. Program PCR yang digunakan telah dioptimasi untuk mendapatkan suhu annealing yang optimum yaitu 58 oC. Primer spesifik P5CS yang digunakan dalam penelitian ini adalah primer yang dirancang untuk mengidentifikasi adanya gen P5CS menggunakan BLASTN 2.1.3 atas dasar daerah terkonservasi dan cDNA utuh gen P5CS V. aconitivolia (Gambar 5) (Minarsih 2003).
Hasil analisis BLASTN 2.1.3 menunjukkan perbandingan homologi P5CS V. aconitifolia dengan spesies lainnya. Gen P5CS telah dimiliki tanaman secara alami, termasuk juga tebu. Transformasi eksplan tebu menggunakan gen P5CS akan meningkatkan ketahanan tebu ketika mengalami cekaman kekeringan. Selain itu, pada proses pengkajian keamanan pangan tidak akan seketat apabila fungsi transgen di dalam tanaman merupakan sesuatu yang baru. Termasuk dalam hal ini adalah pengkajian kemungkinana protein baru terekspresi dari transgen yang dapat menyebabkan alergi atau toksik terhadap konsumen (Minarsih 2003).
Pasangan primer untuk cDNA P5CS utuh digunakan untuk verifikasi hasil isolasi konstruk rekombinan pBI-P5CS dari E. coli dan A. tumefaciens
16
Gambar 5 Hasil database menggunakan BLASTN 2.1.3 (Minarsih 2003) a. Diagram homologi P5CS V. aconitifolia dengan spesies lainnya b. Primer DNA yang dirancang atas dasar daerah terkonservasi dan cDNA utuh
Amplifikasi menggunakan primer spesifik P5CS start stop menghasilkan pita DNA dengan ukuran sekitar 2.4 kb seperti terlihat pada Gambar 6. Satu pita yang terbentuk berukuran besar dan tebal seperti kontrol positif . Kontrol positif yang digunakan adalah DNA plasmid pBI-P5CS koleksi BPBPI. Hal tersebut menyakinkan keberhasilan isolasi konstruk rekombinan pBI-P5CS.
a
b
Gambar 6 Elektroforegram hasil PCR dengan primer spesifik P5CS start stop a. Kontrol positif dan b. pBI-P5CS konstruk rekombinan pBI-P5CS hasil isolasi
Ukuran pita DNA hasil PCR menggunakan primer spesifik P5CS start stop
sangat kecil dibandingkan dengan ukuran plasmid pBI121, yaitu 2400:14758. Hal ini menunjukkan bahwa yang teramplifikasi adalah gen P5CS utuh. Plasmid
17 pBI121 tidak ikut teramplifikasi, sehingga primer P5CS start stop merupakan primer spesifik untuk gen P5CS. Hal ini menunjukkan bahwa ukuran gen P5CS utuh adalah sekitar 2.4 kb seperti yang dilaporkan Minarsih (2003) dan Soltani et al. (2007). Hal tersebut menyakinkan kembali bahwa gen P5CS telah terisolasi dan siap ditransformasikan ke A. tumefaciens.
A. tumefaciens
A. tumefaciens adalah salah satu bakteri tanah gram negatif berbentuk batang (Alonso dan Espinosa 1993). Taksonomi A. tumefaciens sebagai berikut: Bakteria (Domain); Proteobakteria (Filum); Alfaproteobakteria (Kelas); Rhizobiales (Orde); Rhizobiaceae (Famili); Agrobacterium (Genus): A. tumefaciens (spesies) (Young 2008).
A. tumefaciens mampu mentransfer bagian DNA tertentu (T-DNA) dari plasmid Ti (tumor inducing) yang kemudian berintegrasi ke genom tanaman target (Riva et al. 1998). Proses transfer gen dari A. tumefaciens ke dalam sel tumbuhan terdiri dari beberapa tahap: (1) kolonisasi bakteri (2) induksi sistem virulen bakteri (3) tahap transfer T-DNA kompleks (4) transfer T-DNA dan (5) integrasi T-DNA ke dalam genom tanaman (Riva et al. 1998).
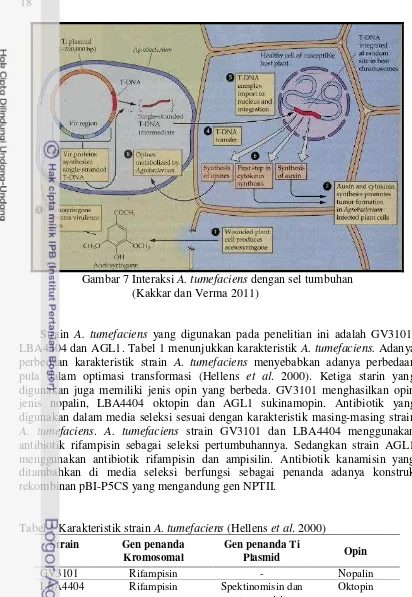
Mekanisme interaksi A. tumefaciens dapat dilihat pada Gambar 7 (Kakkar dan Verma 2011). Interaksi yang terjadi adalah sebagai berikut: (1) sel tumbuhan yang terluka menghasilkan senyawa fenolik asetosiringon, (2) asetosiringon dalam
Agrobacterium mengaktivasi gen virulen (vir), (3) protein virulen yang dihasilkan untuk mensintesis T-DNA rantai tunggal, (4) T-DNA rantai tunggal intermediet masuk ke dalam sel tumbuhan , (5) T-DNA kompleks yang terbentuk masuk inti sel dan terintegrasi. T-DNA terintegrasi secara acak di situs kromosom tumbuhan. (6) tahap awal sintesis sitokinin, (7) sitokinin dan sintesis auksin yang kemudian memicu terbentuknya tumor pada tumbuhan yang terinfeksi Agrobacterium dan (8) sintesis opin yang selanjutnya digunakan untuk metabolisme A. tumefaciens.
Opin adalah produk kondensasi dari asam amino dengan asam keto atau gula. Opin merupakan sumber utama nitrogen dan karbon untuk pertumbuhan
Agrobacterium. A. tumefaciens diklasifikasikan berdasarkan jenis opin. Umumnya
18
Gambar 7 Interaksi A. tumefaciens dengan sel tumbuhan (Kakkar dan Verma 2011)
Strain A. tumefaciens yang digunakan pada penelitian ini adalah GV3101, LBA4404 dan AGL1. Tabel 1 menunjukkan karakteristik A. tumefaciens. Adanya perbedaan karakteristik strain A. tumefaciens menyebabkan adanya perbedaan pula dalam optimasi transformasi (Hellens et al. 2000). Ketiga starin yang digunakan juga memiliki jenis opin yang berbeda. GV3101 menghasilkan opin jenis nopalin, LBA4404 oktopin dan AGL1 sukinamopin. Antibiotik yang digunakan dalam media seleksi sesuai dengan karakteristik masing-masing strain
A. tumefaciens. A. tumefaciens strain GV3101 dan LBA4404 menggunakan antibiotik rifampisin sebagai seleksi pertumbuhannya. Sedangkan strain AGL1 menggunakan antibiotik rifampisin dan ampisilin. Antibiotik kanamisin yang ditambahkan di media seleksi berfungsi sebagai penanda adanya konstruk rekombinan pBI-P5CS yang mengandung gen NPTII.
Tabel 1 Karakteristik strain A. tumefaciens (Hellens et al. 2000)
Strain Gen penanda
Kromosomal
Gen penanda Ti
Plasmid Opin
GV3101 Rifampisin - Nopalin
LBA4404 Rifampisin Spektinomisin dan streptomisin
Oktopin
AGL1 Rifampisin, Karbenisilin/ Ampisilin
- Sukinamopin
19 kompeten A. tumefaciens dibuat dengan cara menumbuhkan A. tumefaciens dalam media YEP cair hingga mencapai nilai OD600 = 0.55-0.65 agar mendapatkan
jumlah bakteri yang optimum pada fase pertumbuhan. Konsentrasi yang dibutuhkan untuk transformasi adalah 1x106 sel/ mL (Bibiana 1994).
Keberhasilan transformasi konstruk rekombinan pBI-P5CS ke dalam A. tumefaciens strain GV3101, LBA4404 dan AGL1 ditunjukkan dengan adanya pertumbuhan koloni pada suhu 28 oC yang diinkubasi di media seleksi (Venkatachalam et al. 2000; Minarsih 2003; Heikal et al. 2008). Media seleksi yang digunakan adalah media LB padat dengan penambahan antibiotik rifampisin 50 ppm dan kanamisin 50 ppm untuk strain GV3101 dan LBA4404 yang diinkubasi selama 2 hari tanpa cahaya. Sedangkan strain AGL1 diinkubasi selama 3 hari tanpa cahaya di media LB padat dengan penambahan antibiotik rifampisin 50 ppm, ampisilin 50 ppm dan kanamisin 50 ppm (Gambar 8).
a
b
c
Gambar 8 Pertumbuhan koloni hasil transformasi konstruk rekombinan pBI- P5CS ke A. tumefaciens. a. Koloni transforman A. tumefaciens strain LBA4404, b. Koloni transforman A. tumefaciens strain AGL1 dan c. Koloni transforman A. tumefaciens strain GV3101
Pengamatan dilakukan mulai hari pertama setelah transformasi untuk melihat pertumbuhan koloni A. tumefaciens transforman. Pada hari pertama belum tampak pertumbuhan koloni A. tumefaciens transforman. Hari kedua dilakukan pengamatan kembali dan terlihat mulai tumbuh koloni-koloni tunggal, bulat, kecil dan berwarna putih kekuningan untuk strain GV3101 dan LBA4404 seperti terlihat pada Gambar 8. Terlihat adanya koloni yang menyebar merata di permukaan media seleksi. A. tumefaciens strain AGL1 baru terlihat pertumbuhan koloni transforman di media seleksi pada hari ketiga. Terlihat juga adanya koloni-koloni tunggal, bulat, kecil dan berwarna putih kekuningan yang menyebar merata di permukaan media seleksi. Pertumbuhan koloni di media seleksi menunjukkan adanya pertumbuhan A. tumefaciens transforman yang mengandung konstruk rekombinan pBI-P5CS.
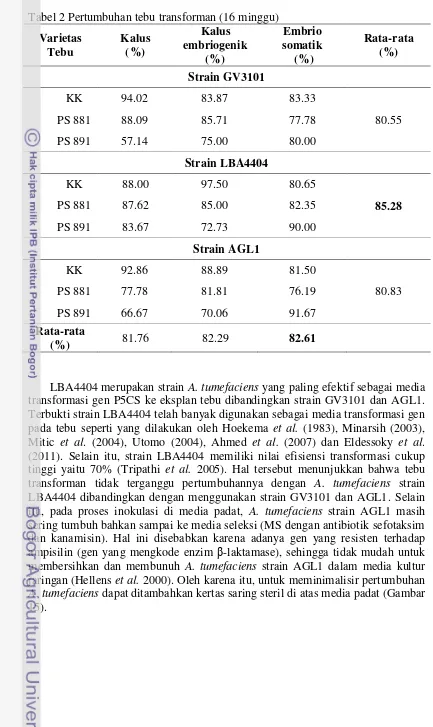
Apabila dibandingkan waktu kultur A. tumefaciens, maka strain AGL1 (3 hari) membutuhkan waktu inkubasi yang lebih lama dibandingkan strain GV3101 dan LBA4404 (2 hari). Selain itu, jumlah total koloni yang tumbuh dari ketiga strain yang digunakan terlihat strain LBA4404 menunjukkan pertumbuhan koloni dengan jumlah yang lebih banyak. Hal ini menunjukkan bahwa strain LBA4404 memiliki pertumbuhan yang optimum dibandingkan dengan strain GV3101 dan AGL1.
Transfomasi A. tumefaciens menggunakan gen P5CS dilakukan sebanyak satu kali dan ditumbuhkan ke media seleksi 3 cawan petri untuk masing-masing strain
20
transforman diuji lebih lanjut dengan analisis PCR koloni untuk memastikan kembali keberadaan konstruk rekombinan pBI-P5CS. Koloni transforman yang dipilih adalah koloni tunggal yang letaknya terpisah dari koloni lain dan diambil dari 10 titik yang berbeda dalam satu cawan petri. Koloni dari ketiga strain A. tumefaciens selanjutnya dianalisis PCR koloni dengan primer spesifik P5CS start stop dan elektroforesis gel agarosa. Elektroforegram menunjukkan adanya pita pada ukuran 2.4 kb sama dengan kontrol positif (Gambar 9). Hal tersebut seperti dilaporkan Minarsih (2003) dan Soltani et al. (2007) bahwa ukuran gen P5CS utuh sekitar 2.4 kb. Ukuran pita DNA menunjukkan ukuran yang sama dengan elektroforegram hasil PCR DNA plasmid rekombinan pBI-P5CS menggunakan primer spesifik P5CS start stop. Hasil tersebut menunjukkan bahwa konstruk rekombinan pBI-P5CS telah berhasil ditransformasi ke A. tumefaciens.
1 2 3 4 5 6 7
Gambar 9 Elektroforegram hasil transformasi pBI-P5CS ke A. tumefaciens.
1 kontrol positif, 2 – 3 koloni 1 dan 3 strain AGL1; 4 – 5 koloni 1 dan 2 strain LBA4404 dan 6 – 7 koloni 1 dan 2 strain GV3101
Elektroforegram menunjukkan pita DNA yang tunggal dan cukup tebal pada ukuran yang sama dengan kontrol positif. Kontrol positif yang digunakan adalah DNA plasmid pBI-P5CS koleksi BPBPI. Dari semua koloni yang dianalisis PCR menunjukkan adanya pita pada ukuran 2.4 kb, tetapi memiliki kualitas pita yang berbeda-beda. Elektroforegram tersebut menjadi dasar pemilihan koloni yang selanjutnya akan digunakan untuk transformasi gen P5CS ke eksplan tebu. Pemilihan koloni didasarkan pada pita DNA yang tunggal, tebal dan jelas. Terlihat pita DNA dari strain LBA4404 menunjukkan pita yang jelas dan cukup tebal. Hal ini menunjukkan bahwa analisis PCR dengan menggunakan DNA template asal A. tumefaciens strain LBA4404 paling optimum dibandingkan dengan kedua strain yang lain.
Tebu Transforman
Transformasi gen merupakan salah satu metode penggabungan gen asing yang bertujuan untuk mendapatkan organisme dengan sifat-sifat tertentu, sehingga menghasilkan organisme yang lebih baik. Misalnya pada tanaman dengan pembuatan tanaman yang toleran suhu tinggi, suhu rendah, kekeringan, resisten
21 terhadap organisme pengganggu tanaman serta kuantitas dan kualitas hasil yang baik dari tanaman alami.
Transfer gen ini dapat dilakukan dengan beberapa metode, yaitu metode transformasi protoplas, biolistik atau microprojectile bombardment dan transformasi biologis menggunakan A. tumefaciens (Hansen dan Wright 1999). Penggunaan A. tumefaciens telah banyak digunakan sebagai media transformasi, antara lain pada tanaman tembakau (Hoekema et al. 1983; Hansen et al. 1994), kapas (Hansen et al. 1994), buncis (Jaiwal et al. 2001), padi dan kedelai (Ke et al. 2001), jagung (Utomo 2004), kopi robusta (Siswanto et al. 2003) dan tebu (Fitranty et al. 2003; Minarsih 2003; Susiyanti et al. 2007; Sugiharto dan Safitri 2011). Penggunaan A. tumefaciens sebagai media transformasi pada berbagai tanaman dikotil dan monokotil telah terbukti karena tingkat keberhasilan dan kestabilan gen yang tinggi, spesifik, mengurangi kimera serta lebih ekonomis dibandingkan dengan metode transformasi yang lain.
Kultur jaringan digunakan hampir di seluruh proses transformasi untuk efisiensi transfer gen, seleksi dan regenerasi transforman (Shah et al. 2009). Perkembangan kultur jaringan tebu diawali dengan keberhasilan Hawaiian Sugar Planters Association Experiment Station menginduksi kalus melalui kultur in vitro (Nickell 1964). Selanjutnya, Heinz dan Mee (1969) melaporkan keberhasilan meregenerasi kultur kalus menjadi planlet tebu menggunakan media MS (Murashige dan Skoog 1962) yang telah dimodifikasi. Hal tersebut menjadi titik tolak perkembangan penelitian kultur jaringan tebu yang kemudian diterapkan dalam berbagai aspek seperti mikropropagasi, pemuliaan, konservasi plasma nutfah, eliminasi patogen sistemik dan rekayasa genetik (Lakshmanan et al.
2005).
Regenerasi kultur jaringan dapat dilakukan melalui organogenesis dan somatik embriogenesis. Metode somatik embriogenesis merupakan teknologi yang dapat memperbanyak tanaman secara seragam dan dalam jumlah yang sangat banyak karena berasal dari satu sel. Transformasi genetik ke sel-sel embrioid atau embrio somatik saat ini dianggap sebagai metode terbaik untuk menghindari terjadinya kimera (Deo et al. 2010). Dalam transformasi genetik, kimera adalah kondisi di mana transformasi gen yang tidak sempurna pada seluruh bagian transforman atau hanya sebagian yang tertransformasi, misalnya hanya pada daun. Kimera pada transformasi genetik dapat disebabkan karena (1) proses organogenesis tunas saat mulai membentuk asal multiseluler (Zhu et al.
2007), (2) toleransi endogen menyebabkan tidak efektifnya agen selektif lemah dan (3) mekanisme perlindungan diri (cross protection) (Park et al. 1998)
Eksplan yang digunakan dalam penelitian ini berasal dari penanaman pucuk tebu ketiga varietas yaitu KK, PS 881 dan PS 891 yang sudah mengalami dua kali subkultur (Gambar 10). Pucuk tebu merupakan bagian daun muda yang masih menggulung. Kalus dari eksplan meristem daun tersebut dihasilkan dari jaringan parenkimatis yang belum mengalami diferensiasi (Minarsih 2003). Penanaman pucuk tebu dilakukan sebanyak 2-3 kali hingga diperoleh jumlah kalus yang sesuai dengan kebutuhan proses transformasi.
22
dan kering. Selanjutnya, kalus subkultur di media yang sama sebanyak 2 kali hingga diperoleh kalus yang berwarna putih, kering dan sudah mengalami proliferasi. Kalus ini digunakan sebagai eksplan kalus asal media padat dan lebih lanjut digunakan untuk menghasilkan kalus embriogenik dan embrio somatik.
a b
Gambar 10 Pertumbuhan kalus di media MS
a. Pertumbuhan kalus dari potongan pucuk tebu b. Pertumbuhan kalus yang telah disubkultur
Kalus embriogenik dan embrio somatik diperoleh dari kultur cair SPS berturut-turut selama 6 minggu dan 8 minggu. Prinsip kerja SPS adalah bahan tanam hanya terpapar sebentar dalam medium, sehingga paparan dengan udara lebih lama dan kekurangan oksigen yang sering terjadi pada kultur cair dapat diatasi (Sumaryono et al. 2007).
Kalus embriogenik umur 6 minggu pada fase globular dan embrio somatik umur 8 minggu (Synman et al. 2000) pada fase embrio awal yang siap digunakan sebagai eksplan target transformasi. Embrio somatik dicirikan adanya bentuk yang lebih besar membulat dan mulai terpisah atau dapat dipisahkan per individu dengan warna lebih jelas dan terang yaitu keputihan atau putih-kekuningan. Selain itu, embrio somatik memiliki 2 titik tumbuh, yaitu calon tunas dan akar.
Gambar 11 menunjukkan sumber eksplan yang digunakan dalam penelitian ini. Eksplan tebu yang digunakan dalam penelitian ini adalah kalus asal media padat (8 minggu), kalus embriogenik (14 minggu) dan embrio somatik (16 minggu) asal kultur SPS. Selain adanya perbedaan umur eksplan tebu yang digunakan juga terlihat adanya perbedaan morfologi sumber eksplan. Kalus asal media padat yang digunakan diseleksi untuk mendapatkan kalus yang berwarna putih dan kering. Kalus embriogenik juga diseleksi untuk mendapatkan kalus embriogenik yang seragam. Sedangkan embrio somatik diseleksi untuk mendapatkan embrio somatik yang bulat, utuh dan berwana putih kekuningan.
23 Transformasi ketiga sumber eksplan, ketiga varietas tebu melalui ketiga strain
A. tumefaciens dilakukan sebanyak 3 kali. Masing-masing sebanyak sekitar 0.5 gram eksplan ditransformasi dan ditanam dalam botol kultur sekitar 100 buah.
a1 a2 a3
b1 b2 b3
c1 c2 c3
Gambar 11 Sumber eksplan yang siap ditransformasi
a. Kalus, b. Kalus embriogenik, c. Embrio somatik dan 1. Varietas KK, 2. Varietas PS 881, 3. Varietas PS 891.
Mula-mula A. tumefaciens transforman disiapkan untuk mendapatkan kultur yang segar agar proses transformasi optimum. Eksplan tebu terlebih dahulu dipisahkan dan sedikit dilukai untuk memacu produksi asetosiringon. Selain itu, asetosiringon 100 ppm juga ditambahkan saat eksplan tebu diinokulasi. Eksplan tebu diinokulasi dengan A. tumefaciens transforman dan ditumbuhkan di media MS padat dengan penambahan asetosiringon 100 ppm selama 2 hari di ruang kultur tanpa cahaya. Penambahan asetosiringon di media kultur dengan konsentrasi 100 ppm atau lebih bertujuan untuk meningkatkan efektifitas dan efisiensi A. tumefaciens dalam transfer konstruk gen P5CS ke dalam eksplan tebu (Fitranty et al. 2003). Lalu, eksplan disubkultur ke media MS padat dengan penambahan sefotaksim 500 ppm (Hossain et al. 2007; Setyati et al. 2007) selama 7 hari di ruang kultur tanpa cahaya. Sefotaksim merupakan antibiotik yang menghambat pertumbuhan A. tumefaciens. Inokulasi ini bertujuan agar A. tumefaciens tidak mengganggu pertumbuhan tanaman transforman. Mekanisme kerja sefotaksim adalah dengan menghambat sintesa dinding sel A. tumefaciens
dengan mengganggu cross-linking akhir peptidoglikan dan mengaktifkan enzim otolitik dinding sel.
24
tebu transforman di media seleksi dilakukan selama 4 minggu di ruang kultur tanpa cahaya. Subkultur selanjutnya di media MS untuk inisisasi tunas dan akar dengan penambahan antibiotik kanamisin 50 ppm dan sefotaksim 500 ppm hingga terbentuk planlet (sekitar 32 minggu). Perlakuan tersebut di atas dilakukan di ruang kultur terang dan disubkultur setiap 4 minggu ke media baru.
Hasil Verifikasi Tebu Transforman
Pengujian tanaman hasil transformasi dapat dilakukan dengan dua cara yaitu skrening untuk ekspresi gen reporter (misalnya gen GUS) dan seleksi tanaman transforman yang tahan terhadap agen penyeleksi (antibiotik) (Jouanin et al.
1993). Tebu transforman pada penelitian ini diuji dengan dua cara yaitu skrening untuk ekspresi gen GUS melalui uji histokimia GUS dan seleksi tanaman transforman yang tahan terhadap agen penyeleksi menggunakan antibiotik kanamisin.
Uji histokimia GUS diuji menggunakan metode Jefferson (1987) karena sudah umum digunakan dan relatif lebih mudah dibandingkan dengan metode lainnya. Gen GUS mengkode enzim -glukuronidase (GUS) yang ditandai dengan terbentuknya warna biru pada eksplan transforman, sehingga mengindikasikan bahwa transformasi konstruk gen P5CS telah berhasil dilakukan ke tebu (Gambar 12). Aktivitas enzim tersebut dapat divisualisasikan dengan kehadiran substrat X-Gluc (5-bromo-4-chloro-3-indolyl- -D-glucuronic acid) yang terurai, sehingga membentuk senyawa antara melalui reaksi dimerisasi oksidatif yang menghasilkan senyawa dikloro-dibromoindigo (ClBr-indigo) yang berwarna biru.
aa bb c
Gambar 12 Hasil uji histokimia GUS
a. Eksplan transforman dalam reagen GUS b. Eksplan transforman berwarna biru
25 pereaksi GUS yang menunjukkan adanya gen GUS yang telarut. Hasil uji histokimia GUS tersebut dapat mengindikasikan bahwa transformasi eksplan tebu telah berhasil dilakukan.
Gen GUS hanya akan diekpresikan pada sel tanaman dan tidak pada
Agrobacterium, karena adanya intron pada daerah N-terminal dari sekuens gen
gusA (Jouanin et al. 1993). Uji GUS merupakan metode untuk melihat ekspresi gen GUS pada tanaman transgenik walaupun sifatnya destruktif (merusak tanaman transforman). Gambar 3 menunjukkan adanya gen GUS yang menyandi
enzim -glukuronidase, sehingga mengindikasikan bahwa konstruk gen P5CS telah tertransformasi ke dalam eksplan.
Reaksi pembentukan warna biru dapat dilihat pada Gambar 13. Substrat X-gluc diubah menjadi asam glukoronat dengan diaktivasi enzim -glukuronidase. Selanjutnya, asam glukoronat mengalami oksidasi dan dimerisasi membentuk senyawa 5,5’-dibromo-4,4’-dikloro-indigo terlarut yang berwarna biru. Warna biru dapat dilihat pada larutan pereaksi GUS dan tebu transforman yang diuji.
Gambar 13 Reaksi pembentukan warna biru
Seleksi tanaman transforman selanjutnya dilihat ketahanannya terhadap agen penyeleksi, antibiotik kanamisin. Antibiotik kanamisin 50 ppm ditambahan di media seleksi MS untuk melihat keberadaan konstruk rekombinan pBI-P5CS yang mengandung gen NPTII di tebu transforman. Selain itu, antibiotik sefotaksim 500 ppm ditambahkan juga di media MS untuk menghambat pertumbuhan A. tumefaciens.