ABSTRACT
YENI SETIORINI. Immunohistochemical Profile of Immunoglobulin A (IgA) in the Small Intestinal Rats-treated with Lactic Acid Bacteria (BAL) and Enterophatogenic Escherichia coli (EPEC). Under direction of TUTIK WRESDIYATI.
This study was conducted to evaluate the effect of Lactobacillus plantarum and Lactobacillus fermentum on the immunohistochemical profile of immunoglobulin A (IgA) and the intestinal mucosa thickness of Enteropathogenic E. coli (EPEC) treated rats. A total of 90 male Sparague Dawley rats were used in this study. They were divided into 6 groups: (1) negative control treated group, (2) Lactobacillus plantarum treated group, (3) Lactobacillus fermentum treated group, (4) Lactobacillus plantarum and EPEC treated group, (5) Lactobacillus fermentum and EPEC treated group, and (6) EPEC treated (positive control) group. The results showed that both Lactobacillus fermentum and Lactobacillus plantarum treatment for 2 to 3 weeks increased the thickness of rat’s mucosal small intestine. In the EPEC treated rats, either Lactobacillus fermentum and Lactobacillus plantarum treatment for 2 weeks increased the thickness of rat’s mucosal small intestine. Lactobacillus fermentum treatment for 2 weeks increased the content of IgA in rat’s mucosal small intestine at both conditions; with and without EPEC treatment. Lactobacillus plantarum treatment for 2 weeks only increased the content of IgA in rat’s duodenum and jejunum, while in the EPEC treated rats, Lactobacillus plantarum treatment for 2 weeks could maintained the content of IgA in rat’s mucosal small intestine. Lactobacillus fermentum gave better effect than Lactobacillus plantarum on increasing the content of IgA in rat’s small intestine.
ESCHERICHIA COLI
(EPEC)
YENI SETIORINI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Deteksi Secara Imunohistokimia Imunoglobulin A (IgA) pada Usus Halus Tikus yang Diberi Bakteri Asam Laktat (BAL) dan Enteropatogenik Escherichia coli (EPEC) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2012
Enterophatogenic Escherichia coli (EPEC). Under direction of TUTIK WRESDIYATI.
This study was conducted to evaluate the effect of Lactobacillus plantarum and Lactobacillus fermentum on the immunohistochemical profile of immunoglobulin A (IgA) and the intestinal mucosa thickness of Enteropathogenic E. coli (EPEC) treated rats. A total of 90 male Sparague Dawley rats were used in this study. They were divided into 6 groups: (1) negative control treated group, (2) Lactobacillus plantarum treated group, (3) Lactobacillus fermentum treated group, (4) Lactobacillus plantarum and EPEC treated group, (5) Lactobacillus fermentum and EPEC treated group, and (6) EPEC treated (positive control) group. The results showed that both Lactobacillus fermentum and Lactobacillus plantarum treatment for 2 to 3 weeks increased the thickness of rat’s mucosal small intestine. In the EPEC treated rats, either Lactobacillus fermentum and Lactobacillus plantarum treatment for 2 weeks increased the thickness of rat’s mucosal small intestine. Lactobacillus fermentum treatment for 2 weeks increased the content of IgA in rat’s mucosal small intestine at both conditions; with and without EPEC treatment. Lactobacillus plantarum treatment for 2 weeks only increased the content of IgA in rat’s duodenum and jejunum, while in the EPEC treated rats, Lactobacillus plantarum treatment for 2 weeks could maintained the content of IgA in rat’s mucosal small intestine. Lactobacillus fermentum gave better effect than Lactobacillus plantarum on increasing the content of IgA in rat’s small intestine.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ESCHERICHIA COLI
(EPEC)
YENI SETIORINI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Deteksi Secara Imunohistokimia Imunoglobulin A (IgA) pada Usus Halus Tikus yang Diberi Bakteri Asam Laktat (BAL) dan Enteropatogenik Escherichia coli (EPEC) Nama : Yeni Setiorini
NIM : B04070047
Disetujui
Prof. drh. Tutik Wresdiyati, Ph.D, PAVet Ketua
Diketahui
drh. Agus Setiyono, MS, Ph. D Wakil Dekan Fakultas Kedokteran Hewan
Penulis dilahirkan di Brebes pada tanggal 11 Juni 1989 dari ayah Maskuri, S.Pd dan ibu Ina Munifah. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2007 penulis lulus SMA Negeri 1 Kec. Bumiayu dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis diterima di Fakultas Kedokteran Hewan.
DAFTAR ISI Halaman DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... PENDAHULUAN
Latar Belakang ... Tujuan ... TINJAUAN PUSTAKA
Hewan Percobaan Tikus (Rattus norvegicus)... Usus Halus... Escherichia coli... Prebiotik dan Probiotik ... Imunoglobulin A ... Imunohistokimia ... Penelitian Sebelumnya... METODE PENELITIAN
Alur Penelitian ... Tempat dan Waktu Penelitian ... Alat dan Bahan Penelitian ... Prosedur Pelaksanaan ...
Halaman 1. Gejala klinis, epidemiologi, dan faktor virulensi dari berbagai
galur E. coli ... 2. Komposisi campuran ransum basal tikus... 3. Kelompok tikus perlakuan ... 4. Rata-rata tebal mukosa duodenum, jejunum, dan ileum pada
terminasi hari ke-8, hari ke-15, dan hari ke-22... 5. Kandungan imunoglobulin A (IgA) pada mukosa duodenum,
jejunum, dan ileum pada terminasi hari ke-8, hari ke-15, dan hari ke-22 ...
9 20 21
26
DAFTAR LAMPIRAN
Halaman 1. Prosedur pembuatan sediaan...
2. Prosedur pewarnaan Hematoksilin-eosin (HE)...
3. Prosedur pewarnaan Imunoglobulin A (IgA) secara imunohistokimia ...
4. Analisis statistika ketebalan mukosa duodenum (ANOVA) pada terminasi hari ke-8 ...
5. Analisis statistika ketebalan mukosa jejunum (ANOVA) pada terminasi hari ke-8 ...
6. Analisis statistika ketebalan mukosa ileum (ANOVA) pada terminasi hari ke-8 ...
7. Analisis statistika ketebalan mukosa duodenum (ANOVA) pada terminasi hari ke-15 ...
8. Analisis statistika ketebalan mukosa jejunum (ANOVA) pada terminasi hari ke-15 ...
9. Analisis statistika ketebalan mukosa ileum (ANOVA) pada terminasi hari ke-15 ...
10.Analisis statistika ketebalan mukosa duodenum (ANOVA) pada terminasi hari ke-22 ...
11.Analisis statistika ketebalan mukosa jejunum (ANOVA) pada terminasi hari ke-22 ...
12.Analisis statistika ketebalan mukosa ileum (ANOVA) pada terminasi hari ke-22 ...
65
66
67
68
69
70
71
72
73
74
75
Latar Belakang
Saluran pencernaan merupakan organ yang aktif secara metabolis karena selalu
terekspos oleh berbagai macam zat selama proses mencerna makanan. Makanan
kemungkinan mengandung kontaminan yang merugikan saluran pencernaan. Dengan
demikian saluran pencernaan merupakan organ yang rentan terhadap gangguan.
Gangguan saluran pencernaan bervariasi dari yang ringan hingga yang berat dan
dapat menimbulkan kematian bila tidak ditangani dengan baik. Gangguan saluran
pencernaan dapat dicegah dengan menjaga keseimbangan mikroflora alami yang
terdapat pada saluran pencernaan. Saluran pencernaan orang dewasa mempunyai luas
permukaan sekitar 200 m
2(Mayer 2003).
Saluran pencernaan juga berhubungan langsung dengan lingkungan luar,
sehingga dapat menjadi tempat keluar masuknya mikroorganisme patogen (Tamime
2005). Mikroorganisme patogen yang terdapat dalam saluran pencernaan secara
potensial dapat merusak mukosa saluran pencernaan (Sarkovic
et al
. 2005).
Enteropathogenic Escherichia coli
(EPEC) merupakan mikroorganisme patogen yang
melekat pada permukaan sel epitel usus dan dapat menyebabkan diare (Michail dan
Abernathy 2002). Diare didefinisikan sebagai buang air besar dengan kondisi feses
yang tidak berbentuk atau cair dengan frekuensi lebih dari 3 kali selama 24 jam.
WHO menyatakan ada sekitar 4 milyar kasus diare setiap tahun dengan tingkat
mortalitas 3-4 juta per tahun (Zein
et al.
2004).
Upaya yang dapat dilakukan masyarakat untuk mengurangi gangguan saluran
pencernaan diantaranya dengan mengonsumsi pangan fungsional. Salah satu pangan
fungsional yang berkhasiat pada saluran pencernaan dan diminati oleh masyarakat
adalah probiotik. Probiotik merupakan mikroorganisme hidup yang dapat
memberikan efek yang menguntungkan pada saluran pencernaan inang (Parassol
et
al
. 2005). Probiotik yang biasa digunakan pada produk pangan adalah bakteri asam
laktat (BAL), terutama galur
Lactobacillus
,
Bifidobacterium
, dan beberapa dari
2
pakan hewan yang mengandung probiotik untuk meningkatkan kesehatan saluran
pencernaan.
Bakteri asam laktat mampu mengurangi gangguan saluran pencernaan, mampu
menstimulir pergerakan peristaltik di usus, sehingga transit feses akan lebih singkat,
serta mampu menghambat mikroorgnisme patogen sehingga dapat mencegah
terjadinya diare dan infeksi (Gill dan Guarner 2004). BAL juga dapat bersifat sebagai
imunomodulator untuk meningkatkan daya tahan tubuh (Erickson dan Hubbard
2000). Beberapa peneliti juga melaporkan bahwa mengkonsumsi BAL golongan
Lactobacillus
mampu meningkatkan sistem imun seluler dan humoral diantaranya
peningkatan populasi dan proliferasi sel limfosit, produksi sitokin interferon-
Ȗ
(IFN-Ȗ
), interleukin-12 (IL-12), IL-10, sel imun Th, serta imunoglobulin (Ig) A, IgE, IgG,
dan IgM (Gackowska
et al.
2006; Attaouri
et al.
2002).
Imunoglobulin A merupakan protein yang dihasilkan oleh sel limfosit B dan
merupakan imunoglobulin utama yang ditemukan pada mukosa, salah satunya adalah
pada mukosa saluran pencernaan. IgA pada saluran pencernaan berperan memblok
perlekatan mikroorganisme patogen pada sel epitel usus (Wilson 2005). Pada proses
eliminasi antigen yang terdapat pada mukosa saluran pencernaan, IgA tidak
mengundang timbulnya reaksi radang yang hebat karena berfungsi melindungi
mukosa yang lembut (Yamamato
et al
. 2004).
Kandungan IgA pada saluran pencernaan dapat dideteksi menggunakan metode
immunohistokimia. Prinsip imunohistokimia adalah adanya ikatan antigen-antibodi.
Immunohistokimia mampu mendeteksi suatu molekul yang ada pada jaringan dengan
menggunakan antibodi poliklonal atau antibodi monoklonal terhadap molekul yang
akan dideteksi (reaksi antigen-antibodi). Immunohistokimia mampu memberikan
hasil berupa gambaran secara kualitatif maupun kuantitatif berdasarkan intensitas
warna yang terbentuk seperti warna coklat (Sofian dan Kompono 2006).
Arief
et al.
(2008) telah menemukan 10 BAL isolat lokal yang diambil dari
daging sapi bangsa peranakan Ongol yang dijual di berbagai pasar tradisional di
daerah Bogor, Jawa Barat. BAL yang ditemukan ini sudah diuji secara
in vitro
Indonesia untuk pengembangan pangan probiotik nasional. Isolat lokal mempunyai
keunggulan sangat
adaptable
dengan kondisi lingkungan Indonesia sehingga tidak
memerlukan rekayasa dan manipulasi sifat asli isolat tersebut (Farida 2006). Astawan
et al
. (2009) telah meneliti kemampuan bakterisidal dari 10 jenis isolat BAL terhadap
bakteri Enteropatogenik
E. coli
(EPEC) secara
in vitro
. Hasilnya didapatkan dua
spesies BAL yang mempunyai kemampuan terbaik dalam melawan EPEC, yaitu
Lactobacillus plantarum
dan
Lactobacillus fermentum
.
Penelitian ini dilakukan untuk menguji pengaruh bakteri asam laktat
L.
plantarum
dan
L. fermentum
secara
in vivo
menggunakan tikus percobaan
untuk
melihat sifat fungsionalnya sebagai bakteri asam laktat yang mampu menghambat
pertumbuhan bakteri Enteropatogenik
E. coli
(EPEC) dan sebagai imunomodulator
dalam meningkatkan produksi IgA. Pengaruh tersebut dilihat dari profil
imunohistokimia IgA dan histologi tebal mukosa pada usus halus tikus percobaan
yang dipapar bakteri Enteropathogenik
E. coli
(EPEC).
Tujuan
Tujuan penelitian ini adalah untuk menganalisa pengaruh pemberian bakteri asam
laktat
L. plantarum
dan
L. fermentum
terhadap profil imunohistokimia
Immunoglobulin A (IgA) dan histologi tebal mukosa pada usus halus tikus percobaan
TINJAUAN PUSTAKA
Hewan Percobaan Tikus (Rattus norvegicus)
Hewan percobaan atau hewan laboratorium adalah hewan yang sengaja
dipelihara dan diternakan untuk dipakai sebagai hewan model guna mempelajari
dan mengembangkan berbagai macam bidang ilmu dalam skala penelitian atau
pengamatan laboratorik. Penggunaan hewan percobaan untuk penelitian banyak
dilakukan di bidang fisiologi, farmakologi, biokimia, patologi, dan komparatif
zoologi. Di bidang ilmu kedokteran selain untuk penelitian, hewan percobaan juga
sering digunakan sebagai keperluan diagnostik. Berbagai jenis hewan yang umum
digunakan sebagai hewan percobaan, yaitu mencit, tikus, marmut, kelinci,
hamster, unggas, kambing, domba, sapi, kerbau, kuda, dan simpanse (Malole dan
Pramono 1989).
Penggunaan hewan percobaan untuk pengujian secara in vivo biasanya menunjukkan hasil deviasi yang besar dibandingkan dengan percobaan in vitro, karena adanya variasi biologis. Supaya variasi tersebut minimal, hewan-hewan
yang mempunyai spesies yang sama atau strain yang sama, usia yang sama, dan
jenis kelamin yang sama, dipelihara pada kondisi yang sama pula (Malole dan
Pramono 1989).
Hewan percobaan yang umum digunakan dalam penelitian ilmiah adalah
tikus. Tikus (Rattus norvegicus) telah diketahui sifat-sifatnya secara sempurna, mudah dipelihara, dan merupakan hewan yang relatif sehat dan cocok untuk
berbagai penelitian. Ciri-ciri morfologi Rattus norvegicus antara lain memiliki berat 150-600 gram, hidung tumpul dan badan besar dengan panjang 18-25 cm,
kepala dan badan lebih pendek dari ekornya, serta telinga relatif kecil dan tidak
lebih dari 20-23 mm (Depkes 2011).
Terdapat tiga galur atau varietas tikus yang memiliki kekhususan tertentu
yang biasa digunakan sebagai hewan percobaan yaitu galur Sprague dawley berwarna albino putih, berkepala kecil dan ekornya lebih panjang dari badannya,
digunakan dalam penelitian adalah galur Sprague Dawley berjenis kelamin jantan berumur kurang lebih 2 bulan. Tikus Sprague Dawley dengan jenis kelamin betina tidak digunakan karena kondisi hormonal yang sangat berfluktuasi pada saat
mulai beranjak dewasa, sehingga dikhawatirkan akan memberikan respon yang
berbeda dan dapat mempengaruhi hasil penelitian (Kesenja 2005). Tikus putih
galur ini mempunyai daya tahan terhadap penyakit dan cukup agresif
dibandingkan dengan galur lainnya (Harkness dan Wagner 1983).
Menurut Besselsen (2004) dan Depkes (2011) taksonomi tikus adalah:
Kingdom : Animalia
Filum : Chordata
Subfilum : Vertebrata
Kelas : Mamalia
Subkelas : Theria
Ordo : Rodensia
Subordo : Sciurognathi
Famili : Muridae
Subfamili : Murinae
Genus : Rattus
Spesies : Rattus norvegicus
Ada dua sifat utama yang membedakan tikus dengan hewan percobaan
lainnya, yaitu tikus tidak dapat muntah karena struktur anatomi yang tidak lazim
pada tempat bermuara esofagus ke dalam lambung sehingga mempermudah
proses pencekokan perlakuan menggunakan sonde lambung, dan tidak
mempunyai kandung empedu (Smith dan Mangkoewidjojo 1988). Selain itu, tikus
hanya mempunyai kelenjar keringat di telapak kaki. Ekor tikus menjadi bagian
badan yang paling penting untuk mengurangi panas tubuh. Mekanisme
perlindungan lain adalah tikus akan mengeluarkan banyak ludah dan menutupi
bulunya dengan ludah tersebut (Sirois 2005). Skematis sistem saluran pencernaan
6
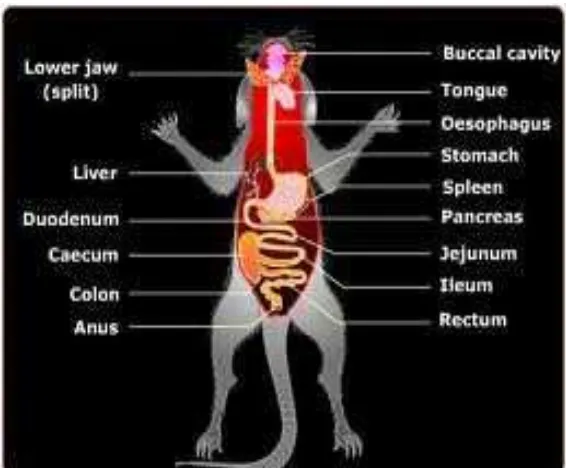
Gambar 1 Sistem Saluran Pencernaan Tikus (Anonim 2010).
Pertumbuhan dan perkembangan tubuh tikus tergantung pada efisiensi
makanan yang diberikan dan juga sangat dipengaruhi oleh metabolisme basal
tubuh tikus itu sendiri (Robinson 1972). Beberapa faktor penting yang dapat
meningkatkan metabolisme basal tubuh hewan adalah suhu lingkungan, jenis
kelamin, umur, keadaan psikologis hewan, dan suhu badan (Ganong 1999).
Usus Halus
Usus halus terdiri dari duodenum, jejunum, dan ileum. Duodenum pada
manusia memiliki panjang sekitar 25 cm terikat erat pada dinding dorsal abdomen
dan sebagian besar terlatak retroperitoneal. Jalannya berbentuk seperti huruf C
yang mengitari pankreas dan ujung distalnya menyatu dengan jejunum yang
terikat pada dinding dorsal rongga melalui mesenterium. Jejunum dapat bergerak
bebas pada mesenteriumnya dan merupakan dua-perlima bagian proksimal usus
halus. Sedangkan ileum merupakan sisa tiga-perlimanya. Dinding usus halus
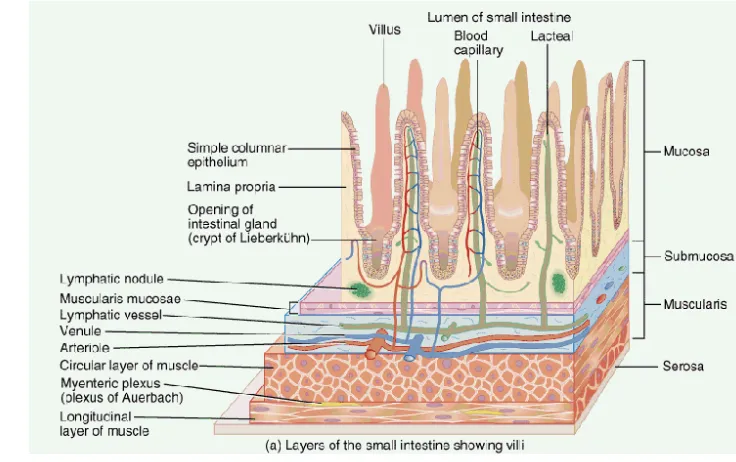
terdiri atas empat lapis konsentris yaitu mukosa, submukosa, muskularis, dan
serosa (Leeson et al. 1996) (Gambar 2).
Lapisan mukosa terdiri dari lamina epitel, lamina propia, dan muskularis
yang digunakan untuk memperluas permukaan. Pada permukaan epitel vili
terdapat mikrovili yang dapat meningkatkan efisiensi penyerapan nutrisi. Pada
usus halus juga terdapat sel goblet yang menghasilkan mukus sebagai pelindung
mukosa usus (Colville dan Joanna 2002).
Membran mukosa adalah lingkungan yang unik dimana banyak spesies
mikroorganisme yang berbeda dapat hidup dan berekspresi. Terdapat 1014 mikroorganisme dari 200 spesies, 40-50 genus hidup pada permukaan tersebut,
dan 99% dari populasi mikroorganisme pada membran mukosa terjadi di bagian
distal usus halus dan di bagian proksimal kolon (Herich dan Levkut 2002).
Membran mukosa dalam suatu tubuh berkontak langsung dengan lingkungan
luar dan membran mukosa juga terkolonisasi oleh mikroorganisme yang berbeda
dalam jumlah yang besar. Permukaan mukosa dilindungi oleh banyak mekanisme
pertahanan yang memastikan perlindungan yang efektif dengan memproduksi
imunoglobulin A (IgA), mukus, dan kriptoprotektif peptida. Mikroorganisme
dapat mempengaruhi struktur mukosa, fungsi, dan perkembangan sistem imun
(Herich dan Levkut 2002).
8
Fungsional epitel usus tergantung pada populasi mikroorganisme di dalam
usus, masuknya mikroorganisme patogen, penyusun yang merugikan dalam lumen
usus, dan mukosa usus yang terpapar antigen. Secara fisiologis bahwa populasi
mikroorganisme normal terdapat dalam usus. Pada manusia sehat, berisi 0-103 cfu/ml dalam perut, 0-105 cfu/ml pada jejunum, 103-109 cfu/ml pada ileum, dan 1010-1012 cfu/ml di usus (Hao dan Lee 2004).
Mikroorganisme usus berfungsi sebagai aktivitas metabolik yang mampu
menyimpan energi dan nutrisi yang dibutuhkan oleh epitel usus, serta
perlindungan terhadap serangan mikroorganisme yang merugikan.
Mikroorganisme normal yang ada di saluran pencernaan dapat mencegah
pertumbuhan yang berlebihan dari mikroorganisme patogen dalam saluran
pencernaan (Harish dan Varghese 2006).
Kemampuan saluran pencernaan untuk mencerna makanan tergantung pada
aktivitas mikroorganisme. Mikroorganisme indigenus suatu waktu akan
menyebabkan infeksi pada saluran pencernaan (Berg 1996). Apabila aktivitas
mikroorganisme dalam usus halus berubah akibat hadirnya mikroorganisme
patogen seperti E. coli dan Sallmonela sp., sehingga proses pencernaan menjadi terganggu (Berg 1996). Hal ini karena keseimbangan jumlah dan jenis
mikroorganisme pada usus halus sangat mempengaruhi kesehatan. Lactobacillus dan Bifidobacterium secara umum merupakan mikroorganisme nonpatogen yang secara alami ada di dalam usus (Weizman et al. 2005).
Escherichia coli
Suwito (2010) menglasifikasikan E. coli berdasarkan ciri khusus dari sifat-sifat virulensinya dan setiap kelompok menimbulkan penyakit melalui mekanisme
Tabel 1 Gejala klinis, epidemiologi, dan faktor virulensi dari berbagai galur E. coli (Suwito 2010)
Strain Gejala klinis Epidemiologi Faktor virulensi
EPEC Diare berair Pada anak-anak
Melekat pada
mukosa usus dan
merusak vili-vili
usus
EHEC
Diare berair,
hemoragik
kolitis,
hemolitik
uremik sindrom
Food born, water
borne Shiga like toxin
ETEC Diare berair Traveler diare
Pili, heat labile dan heat stable enterotoksin
EAEC Diare berlendir Pada anak-anak Pili, sitotoksin
EIEC Disentri, diare
berair Food borne Seluler invasif
Enterotoksin akan mempengaruhi sekresi cairan saluran pencernaan. Pada
saluran pencernaan manusia, EPEC akan menyebakan atrofi dan nekrosis usus.
Pada anak-anak, EPEC menyebabkan diare, sedangkan EHEC akan membentuk
koloni pada saluran pencernaan sehingga mengakibatkan pendarahan dan
terjadinya atrofi mikrovili sel-sel epitel usus (Suwito 2010; Clarke et al. 2002). EPEC melekat pada sel mukosa yang kecil dan menimbulkan kerusakan pada
epitel melalui pembentukan mikrokoloni yang ditunjukkan dengan perlekatan
yang terlokalisasi (Savkovic et al. 2005). Selain itu, pada dosis 105 – 1010 sel EPEC dapat menyebabkan diare yang durasinya kurang lebih lima hari (Janda dan
Abbot 2006; Lodes et al. 2004).
EPEC adalah salah satu mikroorganisme patogen yang dapat menyebabkan
lesi attaching dan effacing (A/E) pada sel usus. Ciri dari patogen A/E adalah terletak pada tumpuannya di permukaan sel epitel inang dan menyebabkan
10
mukosa deodenum dan proksimal jejunum. EPEC menimbulkan kerusakan pada
epitel jejunum melalui pembentukan mikrokoloni yang ditunjukkan dengan
pelekatan yang terlokalisasi (Moat et al. 2002).
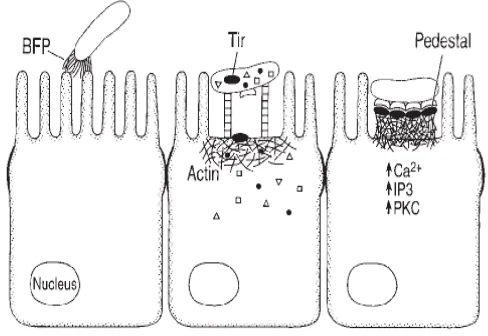
Infeksi EPEC pada sel epitel dapat dilihat pada Gambar 3. EPEC pada sel
epitel membentuk perlekatan dan tidak memperlihatkan adanya lesio. Awal
penyerangan EPEC pada sel epitel diperantarai adanya bundle-forming pilus (BFP) yang merupakan suatu fimbria tipe IV yang terlibat dalam virulensi,
autoagregasi, dan perlekatan lokal bakteri ke sel inang (Blank dan Donnenberg
2001). Setelah perlekatan awal terjadi, mikrovili terganggu dan EPEC
mengeluarkan beberapa faktor virulensi dan mensekresikan reseptor Tir
(translicated intimin receptor) ke dalam sel inang. EPEC mengikat Tir melalui membran luar protein, intimin. Sinyal transduksi terjadi di dalam sel inang,
termasuk aktivasi protein kinase C (PKC), inositol triphosphat (IP3), dan
pelepasan Ca2+. Beberapa protein sitoskeleton termasuk aktin, menjadi tempat perlekatan EPEC. Akhirnya, terjadi penyusunan kembali sitoskeletal setelah
Tir-intimin berikatan, dan menghasilkan formasi pedestal-like structure (Lu dan Walker 2001).
Prebiotik dan Probiotik
Prebiotik merupakan pangan yang dapat memacu pertumbuhan bakteri
probiotik, agar dapat diperoleh kondisi fisiologis dan metabolik yang dapat
memberikan perlindungan pada saluran pencernaan, khususnya usus halus dan
kolon (Zakaria 2003). Probiotik didefinisikan sebagai bakteri hidup yang
diberikan sebagai suplemen makanan yang mempunyai pengaruh yang
menguntungkan terhadap kesehatan, dengan memperbaiki keseimbangan
mikroflora usus. Efek yang menguntungkan dari bakteri tersebut dapat mencegah
dan mengobati kondisi patologik usus bila bakteri tersebut diberikan secara oral
(Karuniawati 2010; Maurad dan Meriem 2008; Lisal 2005).
Karakteristik probiotik yang diinginkan dari satu strain spesifik adalah mempunyai kapasitas untuk bertahan hidup, melakukan kolonisasi dan
metabolisme dalam saluran pencernaan, mampu mempertahankan keseimbangan
mikroflora usus, mampu menstimulasi sistem imun, dan bersifat nonpatogen
(Gibson dan Fuller 2000). Efikasi dari beberapa probiotik tergantung dari genus,
spesies dan strain. Tidak semua bakteri tahan asam mempunyai efek probiotik. Probiotik multipel strain lebih efektif daripada single strain (Cornelius dan Van 2004).
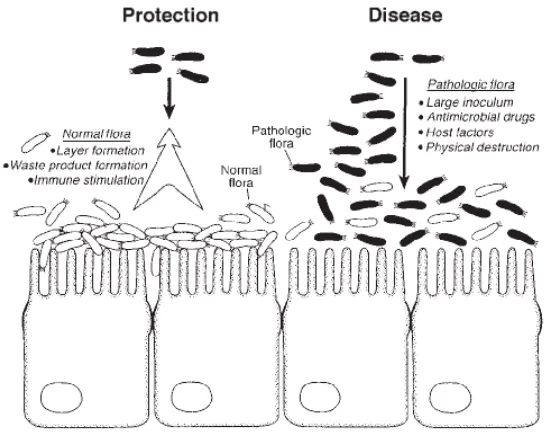
Mekanisme probiotik bersaing dengan mikroorganisme patogen di dalam usus
dapat dilihat pada Gambar 4. Probiotik dapat meningkatkan pertahanan dengan
menduduki usus dalam jumlah besar dan beragam. Hal ini dapat mencegah
kolonisasi mikroorganisme patogen, menghasilkan senyawa antimikroba, asam
lemak jenuh, dan dimodifikasi dengan asam empedu yang dapat menciptakan
lingkungan lumen yang kurang baik untuk pertumbuhan mikroorganisme patogen,
serta mampu merangsang sistem imun. Penyakit pada usus akan terjadi jika
perkembangan mikrorganisme patogen yang terlalu banyak dan terganggunya
12
Gambar 4 Mekanisme probiotik berkompetisi dengan bakteri patogen (Lu dan Walker 2001).
Salah satu jenis bakteri yang umum terdapat di daging adalah bakteri asam
laktat (BAL). Arief et al. (2008) melaporkan bahwa BAL golongan Lactobacillus, Lactococcus, dan Streptococcus dari daging sapi bangsa Peranakan Ongol yang dijual di berbagai pasar tradisional daerah Bogor mampu bertahan pada kondisi
saluran pencernaan seperti pH saluran pencernaan dan garam empedu, serta
memiliki aktivitas antimikroba terhadap bakteri patogen. Kemampuan bakterisidal
terhadap bakteri patogen ini disebabkan bakteri ini mampu menghasilkan senyawa
bioaktif asam laktat, asam asetat, dan senyawa bakteriosin.
Bakteri asam laktat termasuk mikroorganisme probiotik yang berpengaruh
positif terhadap mikroflora di saluran pencernaan. Bakteri asam laktat juga
termasuk kelompok bakteri yang dapat mengeliminasi kerusakan pada saluran
pencernaan dan beberapa gangguan pencernaan berupa inflamasi pada saluran
pencernaan. Jika bakteri asam laktat mampu bertahan lama dalam usus maka akan
menstimulir pergerakan peristaltik di usus, sehingga transit feses akan lebih
singkat. Selain itu, bakteri asam laktat mampu menghambat bakteri patogen
sehingga dapat mencegah terjadinya diare dan infeksi (Gill dan Guarner 2004).
Bakteri asam laktat juga dapat bersifat sebagai imunomodulator untuk
Bakteri asam laktat mampu menstimulasi sistem imun karena adanya senyawa
peptidoglikan dan lipopolisakarida dalam dinding sel (Surono 2004). Bakteri asam
laktat juga merangsang aktivitas sel imun yang spesifik dan nonspesifik. Sistem
imun spesifik dapat dibagi menjadi dua kategori yaitu sistem imun spesifik
humoral dan sistem imun spesifik seluler. Antibodi yang diproduksi dalam sel
plasma mediasi dari sistem imun spesifik humoral. Sistem imun spesifik seluler
dimediasi oleh limphosit T yang berproliferasi setelah kontak dengan antigen,
produk sitokin, dan menyebabkan aktivitas pada sel kekebalan yang lain (Tizard
2000).
Bakteri asam laktat mampu meningkatkan sistem imun spesifik humoral.
Berdasarkan penelitian bahwa produksi IgA akan meningkat jika mendapatkan
bakteri asam laktat. Pemberian bakteri asam laktat golongan Lactobacillus dapat memberikan efek kesehatan bagi inang seperti mencegah terjadinya infeksi
saluran pencernaan, meningkatkan respon imunlokal, dan meningkatkan produksi
IgA. Produksi IgA kemudian disekresikan ke lumen usus untuk mencegah
penempelan mikroorganisme patogen seperti, Salmonella typhimurium di mukosa usus (Isolauri 2001).
L. plantarum merupakan bakteri gram positif yang tidak patogen dan secara alami terdapat dalam saliva dan saluran pencernaan. L. plantarum merupakan bakteri asam laktat yang biasa digunakan dalam makanan fermentasi. L. plantarum mampu bertahan pada kondisi lambung (pH rendah) dan adanya garam empedu. L. plantarum juga mampu melindungi sel epitel usus terhadap induksi E. coli (Bixquert 2009). L. plantarum mampu tumbuh dengan baik pada pH 2-3 dan pada pH antara 4-6.5 terjadi peningkatan populasi (Anukam dan
Koyama 2007). Sedangkan L. fermentum mampu tumbuh baik pada kisaran pH 2-3 dan garam empedu 0.2-3-1% (Klayraung et al. 2008).
Imunoglobulin A (IgA)
Sistem imunitas mukosa saluran pencernaan merupakan bagian sistem
imunitas yang penting dan berlawanan sifatnya dari sistem imunitas sistemik.
Sistem imunitas mukosa lebih bersifat menekan imunitas. Hal ini disebabkan oleh
14
berhadapan dengan banyak antigen yang terdiri dari mikroorganisme patogen,
antigen makanan, dan virus dalam jumlah yang lebih besar dibandingkan sistem
imunitas sistemik. Antigen-antigen tersebut dicegah agar tidak menempel mukosa
saluran pencernaan dengan pengikatan oleh IgA, barier fisik dan kimiawi dengan
enzim-enzim yang ada pada mukosa saluran pencernaan. Mamalia memproduksi
IgA dan antibodi lain paling sedikit 80% pada semua sel plasma dan terlokalisasi
pada lamina propria saluran pencernaan (Van et al. 2001).
Imunoglobulin A (IgA) merupakan protein yang dihasilkan oleh sel limfosit B
dan merupakan immunoglobulin utama yang ditemukan pada mukosa. Limfosit B
merupakan limfosit terbesar di temukan di lamina propria yang fungsi efektor
utamanya adalah sekresi antibodi terutama IgA yang berperan mencegah
perlekatan mikroba ke sel epitel usus (Wilson 2005). IgA terdapat di air liur, air
mata, sekresi bronkus, mukosa hidung, cairan prostat, sekresi vagina, dan mukus
dari usus halus sebagai pertahanan primer tubuh. Sekresi IgA tidak menimbulkan
respon inflamasi sehingga sekresi IgA ideal untuk menjaga permukaan mukosa
dari antigen dengan cara mencegah perlekatan antigen pada epitel (Surono 2004)
dan berfungsi melindungi mukosa yang lembut (Yamamato et al. 2004).
Mekanisme pertahanan sistem imun adaptif di permukaan mukosa merupakan
suatu sistem yang diperantarai antibodi IgA sekretori, kelas imunoglobulin
predominan dalam sekresi eksternal manusia. Imunoglobulin ini tahan terhadap
protease sehingga cocok berfungsi pada sekresi mukosa. Induksi IgA melawan
patogen mukosa dan antigen protein terlarut bergantung pada sel T helper.
Perubahan sel B menjadi sel B penghasil IgA dipengaruhi oleh TGF-ȕ dan
iterleukin (IL)10 bersama-sama dengan IL-4. Sel T di mukosa menghasilkan
TGF-ȕ, IL-10 dan IL-4 dalam jumlah yang banyak dan sel epitelial mukosa
menghasilkan TGF-ȕ dan IL-10. Hal tersebut dapat menjadi petunjuk bahwa
maturasi sel B penghasil IgA melibatkan lingkungan mikro mukosa yaitu sel
Imunohistokimia
Kandungan Imunoglobulin A (IgA) pada usus halus dapat dideteksi dengan
menggunakan metode imunohistokimia (Wresdiyati et al. 2006; Ramos-Vara 2005). Imunohistokimia sebagai suatu metode untuk mendeteksi suatu molekul
yang ada di jaringan dengan menggunakan antibodi poliklonal atau monoklonal
terhadap molekul yang akan dideteksi (merupakan reaksi antigen-antibodi) dan
dapat memberikan gambaran kualitatif dan kuantitatif dari intensitas warna yang
terbentuk. Poliklonal antibodi memiliki affinitas dan reaktivitas yang lebih tinggi
dibandingkan dengan monoklonal antibodi, tetapi poliklonal antibodi kurang
spesifik. Teknik imunohistokimia dapat digunakan untuk mempelajari distribusi
enzim yang spesifik pada struktur sel intak (normal/lengkap), mendeteksi
komponen sel, biomakromolekul seperti protein dan karbohidrat (Sofian dan
Kampono 2006).
Prinsip dari teknik imunohistokimia adalah adanya ikatan antigen-antibodi
yang digunakan untuk mendeteksi suatu molekul dalam jaringan. Teknik
immunohistokimia ini menggunakan dua antibodi yaitu antibodi primer dan
antibodi sekunder yang telah dikonjugasi dengan peroksidase. Pada jaringan,
antibodi primer akan berikatan dengan antigen (molekul) jaringan yang dideteksi,
dalam penelitian ini adalah IgA. Prinsip immunohistokimia dengan metode
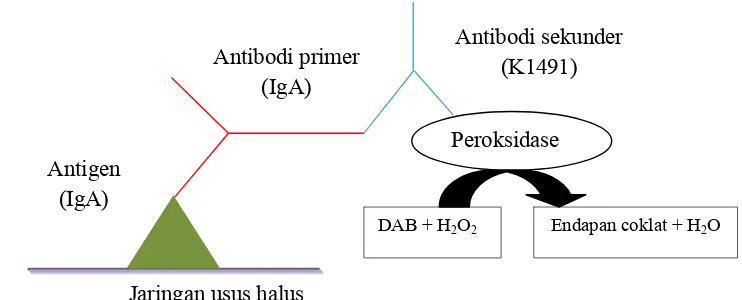
polimer peroksidase dapat dilihat pada Gambar 5.
Gambar 5 Prinsip teknik pewarnaan imunohistokimia (Wresdiyati et al. 2006). Jaringan usus halus
Antibodi sekunder (K1491) Antibodi primer
(IgA)
Antigen (IgA)
Peroksidase
16
Immunoglobulin A (IgA) yang terdapat pada mukosa usus halus dikenal
sebagai antigen. Antibodi primer (anti IgA) berikatan dengan antigen (IgA),
kemudian antibodi sekunder yang telah dikonjugasi peroksidase bereaksi dengan
antibodi primer dan membentuk ikatan antigen-antibodi. Agar IgA dapat
tervisualisasi, perlu dilabel menggunakan kromogen. Pada penelitian ini
menggunakan kromogen DAB (Diaminobenzidine) yang dapat membentuk
endapan warna coklat. DAB tidak larut dalam pelarut organik. Peroksidase yang
terkonjugasi pada antibodi sekunder berfungsi untuk mengkatalis reaksi antara
kromogen (DAB) dan hidrogen peroksida (H2O2) sehingga terbentuk endapan warna coklat. Warna coklat menunjukkan keberadaan IgA. Semakin tua intensitas
dan semakin luas distribusi warna coklatnya maka semakin banyak kandungan
IgA-nya. Couterstain menggunakan hematoksilin (biru) untuk membentuk kontras warna agar dapat menghindari kebingungan dengan endapan kromogen (Van
2002).
Penelitian Sebelumnya
Kriteria dasar yang ditetapkan oleh FAO/WHO (2002) serta kesepakatan
internasional mengenai probiotik dipenuhi oleh suatu bakteri asam laktat jika akan
digunakan sebagai probiotik, yaitu kemampuannya untuk bertahan pada kondisi
lambung (pH rendah) dan adanya garam empedu, serta penghambat terhadap
bakteri patogen. Arief et al. (2008) telah melakukan isolasi bakteri asam laktat golongan Lactobacillus, Lactococcus, dan Streptococcus dari daging sapi bangsa Peranakan Ongol yang dijual di berbagai pasar tradisional daerah Bogor. BAL
tersebut selanjutnya diuji kemampuannya bertahan pada kondisi sesuai saluran
pencernaan manusia antara lain, pH saluran pencernaan dan garam empedu, serta
aktivitas antimikrobanya terhadap bakteri patogen. Hasil penelitian pendahuluan
tersebut menunjukkan bahwa terdapat 10 jenis bakteri asam laktat isolat indigenus
yang mempunyai kemampuan bertahan pada pH 2 dan pH usus yaitu pada nilai
pH 7.2, serta pada kondisi garam empedu 0.5% sesuai dengan kondisi saluran
pencernaan. Selain itu, bakteri asam laktat tersebut juga mempunyai aktivitas
Kesepuluh jenis BAL hasil seleksi awal Arief et al. (2008) tersebut adalah spesies Lactobacillus spp, Lactococcus spp, dan Streptococcus spp. BAL tersebut mempunyai kemampuan bakterisidal terhadap mikroba patogen karena kedua
bakteri tersebut mampu menghasilkan senyawa bioaktif asam laktat, asam asetat,
serta senyawa bakteriosin. Berdasarkan kriteria dasar probiotik yang dikeluarkan
oleh FAO/WHO (2002), kesepuluh isolat indigenus bakteri asam laktat tersebut
dapat dinyatakan sebagai probiotik.
Untuk mengetahui sifat fungsional lainnya, khususnya sebagai bakteri
probiotik yang mampu menghambat pertumbuhan bakteri enteropatogenik
penyebab diare, maka kesepuluh isolat indigenus BAL tersebut perlu diuji
kemampuannya. Kemampuan bakterisidal BAL terhadap bakteri enteropatogenik
khususnya EPEC dapat dilakukan baik secara in vivo maupun in vitro. Pengujian secara in vivo pada hewan percobaan akan menunjukkan hasil yang mendekati kondisi kejadian sebenarnya baik pada hewan maupun manusia. Astawan et al. (2009) telah meneliti kemampuan bakterisidal dari 10 jenis isolat BAL terhadap
bakteri Enteropatogenik Escherichia coli (EPEC) secara in vitro. Hasilnya didapatkan dua spesies BAL yang mempunyai kemampuan terbaik dalam
melawan EPEC, yaitu L. plantarum dan L. fermentum. Kedua bakteri asam laktat (BAL) inilah yang dipakai dalam penelitian ini.
METODE PENELITIAN
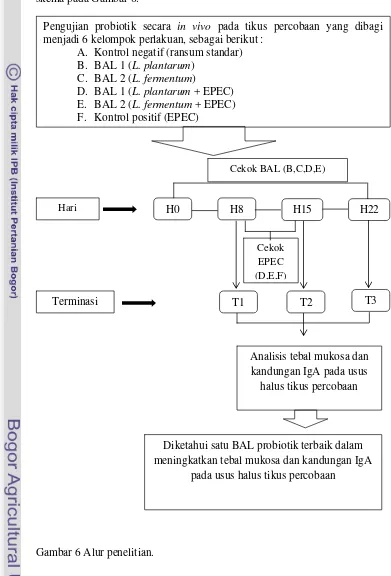
Alur penelitian yang akan dilakukan secara umum digambarkan dalam skema pada Gambar 6.
Gambar 6 Alur penelitian.
Pengujian probiotik secara in vivo pada tikus percobaan yang dibagi menjadi 6 kelompok perlakuan, sebagai berikut :
A. Kontrol negatif (ransum standar) B. BAL 1 (L. plantarum)
C. BAL 2 (L. fermentum)
D. BAL 1 (L. plantarum + EPEC) E. BAL 2 (L. fermentum + EPEC) F. Kontrol positif (EPEC)
Hari H0 H8 H15 H22
T1 T2 T3
Terminasi
Cekok EPEC (D,E,F)
Cekok BAL (B,C,D,E)
Analisis tebal mukosa dan kandungan IgA pada usus
halus tikus percobaan
Diketahui satu BAL probiotik terbaik dalam meningkatkan tebal mukosa dan kandungan IgA
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Departemen Ilmu dan Teknologi Pangan, FATETA, kandang hewan SEAFAST Center dan Laboratorium Histologi, Departemen Anatomi, Fisiologi, dan Farmakologi, FKH, Institut Pertanian Bogor pada bulan Juli-Agustus 2009 dan dilanjutkan pada bulan Januari-Februari 2010.
Alat dan Bahan Penelitian
Alat yang digunakan terdiri atas seperangkat alat bedah (gunting, pinset, alas bedah), pisau silet, gelas piala, erlenmeyer, botol sampel, kapas, kertas tissue, benang, alluminium foil, tissue basket, exhause fan, pipet tetes, pipet mohr, mikropipet, gelas ukur, cup embedding, objek glass, coverglass, inkubator, waterbath, mikrotom putar (rotatory microtom), tabung ependorf, kotak preparat, pensil, dan kamera.
20
Prosedur pelaksanaan
1. Kandang dan perlengkapan
Kandang yang digunakan adalah kandang yang berukuran 17.5 x 23.75 x 17.5 cm, dengan jumlah sesuai dengan jumlah tikus yang digunakan. Kandang tersebut dari stainless steel. Kandang tikus berlokasi pada tempat yang bebas dari suara ribut, terjaga dari asap industri, dan polutan lainnya. Lantai kandang mudah dibersihkan dan disanitasi. Suhu optimum ruangan untuk tikus adalah 22-24oC dan kelembaban udara 50-60% dengan ventilasi yang cukup (namun tidak ada jendela yang terbuka).
2. Ransum
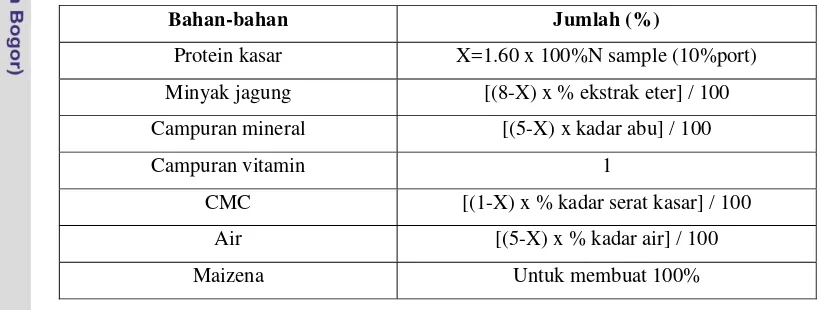
[image:31.612.103.513.389.544.2]Komposisi ransum basal disusun berdasarkan standar AOAC (2005) (Arief et al. 2010) yaitu mengandung karbohidrat, protein, lemak, mineral, vitamin, dan air. Komposisi ransum untuk tikus percobaan adalah sebagai berikut :
Tabel 2 Komposisi campuran ransum basal tikus AOAC (2005) (Arief et al. 2010)
Bahan-bahan Jumlah (%)
Protein kasar X=1.60 x 100%N sample (10%port)
Minyak jagung [(8-X) x % ekstrak eter] / 100
Campuran mineral [(5-X) x kadar abu] / 100
Campuran vitamin 1
CMC [(1-X) x % kadar serat kasar] / 100
Air [(5-X) x % kadar air] / 100
Maizena Untuk membuat 100%
3. Perlakuan hewan percobaan
fermentum, dan EPEC diberikan pada tikus percobaan secara per oral menggunakan sonde.
Tabel 3 Kelompok tikus perlakuan
Kelompok tikus Perlakuan
A Tikus yang diberi ransum standar dan dicekok akuades mulai hari
ke-1 sampai hari ke-21 (kontrol negatif).
B Tikus yang diberi ransum standar dan dicekok L. plantarum mulai
dari hari ke-1 sampai hari ke-21.
C Tikus yang diberi ransum standar Pencekokan L. fermentum mulai
dari hari ke-1 sampai hari ke-21.
D
Tikus yang diberi ransum standar dan dicekok L. plantarum hari ke-1
sampai hari ke-21 diselingi dengan pencekokan EPEC pada hari ke-8 sampai ke-14.
E
Tikus yang diberi ransum standar dan dicekok L. fermentum mulai
hari ke-1 sampai hari ke-21 diselingi dengan pencekokan EPEC pada hari ke-8 sampai ke-14.
F
Tikus yang diberi ransum standar dan dicekok akuades mulai hari ke-1 sampai hari ke-21, diselingi dengan pencekokan EPEC mulai hari ke-8 sampai hari ke-14.
4. Sampling organ usus halus
Proses terminasi (pengakhiran perlakuan) dan sampling organ usus halus dilakukan tiga kali yaitu pada hari ke-8 (T1), hari ke-15 (T2), dan hari ke-22 (T3). Saat tikus diterminasi, jaringan usus halus beserta lambungnya diambil kemudian dicuci dengan NaCl 0.9%. Jaringan lalu disimpan dan difiksasi selama 24 jam dalam larutan Bouin.
5. Pemrosesan jaringan
22
akuades yang dipanaskan dalam waterbath (suhu 37oC). Selanjutnya jaringan diletakkan pada gelas objek dan dimasukkan ke dalam inkubator 40oC selama minimal 24 jam.
6. Pewarnaan
Sebelum tahap pewarnaan, dilakukan deparafinisasi dan rehidrasi dengan cara mencelupkan sediaan jaringan ke dalam xylol III, II, dan I masing-masing selama 5 menit dilanjutkan dengan alkohol absolut III, II, dan I, alkohol 95%, 90%, 80%, dan 70% masing-masing selama 3 menit. Dicuci dengan air kran selama 5 menit dilanjutkan dengan akuades.
Pewarnaan Hematoksilin-Eosin (HE)
Pewarnaan jaringan diawali dengan pemberian hematoksilin selama 3 menit, lalu direndam dalam air kran selama 10 menit dan akuades selama 5 menit, dilanjutkan pewarnaan dengan Eosin selama 2 menit. Tahap pewarnaan diakhiri dengan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, II masing-masing beberapa detik, kemudian absolut III selama 1 menit. Lalu dilanjutkan dengan clearing pada xylol I, II selama beberapa detik dan xylol III selama satu menit, diakhiri dengan mounting (penutupan sediaan dengan coverglass) menggunakan entellan. Sediaan jaringan yang telah selesai diwarnai kemudian diamati dan dipotret.
Pewarnaan Imunohistokimia terhadap IgA
Setelah inkubasi, preparat dicuci dengan PBS sebanyak tiga kali masing-masing 10 menit. Selanjutkan preparat diinkubasi di dalam antibodi sekunder Dako Envision Peroksidase System (50-60 µl) selama 60 menit pada suhu 37oC pada kondisi gelap. Hasil reaksi antigen dengan antibodi divisualisasikan dengan menggunakan DAB (Diamino Benzidin) selama 30 menit (gelap) yang selanjutnya diberi counterstain hematoksilin. Setelah itu dilakukan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, II masing-masing beberapa detik, kemudian absolut III selama 1 menit. Lalu dilanjutkan dengan clearing pada xylol I, II selama beberapa detik dan xylol III selama satu menit, diakhiri dengan mounting. Setelah itu, preparat imunohistokimia siap untuk diamati di bawah mikroskop.
7. Analisis data
Analisis Tebal Mukosa Usus Halus
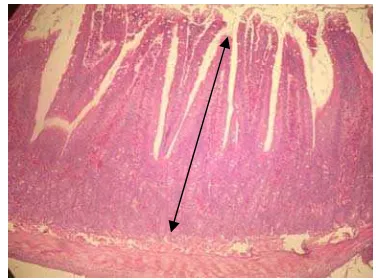
[image:34.612.224.412.526.666.2]Hasil pewarnaan HE diamati dengan menggunakan mikroskop cahaya terhadap gambaran umum histologi organ usus halus. Data yang diambil berupa tebal mukosa usus halus (duodenum, jejunum, dan ileum). Pengamatan histologi usus halus tikus percobaan dengan menghitung rata-rata tebal mukosa setiap 10 vili per preparat usus. Hasil pengukuran dianalisa secara statistik dengan rancangan acak lengkap ANOVA. Apabila ada yang berbeda nyata dilakukan uji lanjut Duncan. Tebal mukosa usus halus ditunjukkan dengan tanda ( ) pada Gambar 7.
24
Analisis imunohistokimia
Data yang diambil dari pewarnaan imunohistokimia adalah data kualitatif mengenai kandungan IgA pada jaringan usus halus yang didasarkan pada intensitas dan distribusi warna coklat yang dihasilkan dari pewarnaan IgA. Warna coklat merupakan reaksi positif (+) terhadap keberadaan IgA dan warna biru merupakan reaksi negatif (-) terhadap keberadaan IgA. Semakin banyak dan semakin tua warna coklat yang dihasilkan, berarti semakin banyak nilai (+) nya yang berarti semakin tinggi kandungan IgA nya.
Latar Belakang
Saluran pencernaan merupakan organ yang aktif secara metabolis karena selalu
terekspos oleh berbagai macam zat selama proses mencerna makanan. Makanan
kemungkinan mengandung kontaminan yang merugikan saluran pencernaan. Dengan
demikian saluran pencernaan merupakan organ yang rentan terhadap gangguan.
Gangguan saluran pencernaan bervariasi dari yang ringan hingga yang berat dan
dapat menimbulkan kematian bila tidak ditangani dengan baik. Gangguan saluran
pencernaan dapat dicegah dengan menjaga keseimbangan mikroflora alami yang
terdapat pada saluran pencernaan. Saluran pencernaan orang dewasa mempunyai luas
permukaan sekitar 200 m
2(Mayer 2003).
Saluran pencernaan juga berhubungan langsung dengan lingkungan luar,
sehingga dapat menjadi tempat keluar masuknya mikroorganisme patogen (Tamime
2005). Mikroorganisme patogen yang terdapat dalam saluran pencernaan secara
potensial dapat merusak mukosa saluran pencernaan (Sarkovic
et al
. 2005).
Enteropathogenic Escherichia coli
(EPEC) merupakan mikroorganisme patogen yang
melekat pada permukaan sel epitel usus dan dapat menyebabkan diare (Michail dan
Abernathy 2002). Diare didefinisikan sebagai buang air besar dengan kondisi feses
yang tidak berbentuk atau cair dengan frekuensi lebih dari 3 kali selama 24 jam.
WHO menyatakan ada sekitar 4 milyar kasus diare setiap tahun dengan tingkat
mortalitas 3-4 juta per tahun (Zein
et al.
2004).
Upaya yang dapat dilakukan masyarakat untuk mengurangi gangguan saluran
pencernaan diantaranya dengan mengonsumsi pangan fungsional. Salah satu pangan
fungsional yang berkhasiat pada saluran pencernaan dan diminati oleh masyarakat
adalah probiotik. Probiotik merupakan mikroorganisme hidup yang dapat
memberikan efek yang menguntungkan pada saluran pencernaan inang (Parassol
et
al
. 2005). Probiotik yang biasa digunakan pada produk pangan adalah bakteri asam
laktat (BAL), terutama galur
Lactobacillus
,
Bifidobacterium
, dan beberapa dari
2
pakan hewan yang mengandung probiotik untuk meningkatkan kesehatan saluran
pencernaan.
Bakteri asam laktat mampu mengurangi gangguan saluran pencernaan, mampu
menstimulir pergerakan peristaltik di usus, sehingga transit feses akan lebih singkat,
serta mampu menghambat mikroorgnisme patogen sehingga dapat mencegah
terjadinya diare dan infeksi (Gill dan Guarner 2004). BAL juga dapat bersifat sebagai
imunomodulator untuk meningkatkan daya tahan tubuh (Erickson dan Hubbard
2000). Beberapa peneliti juga melaporkan bahwa mengkonsumsi BAL golongan
Lactobacillus
mampu meningkatkan sistem imun seluler dan humoral diantaranya
peningkatan populasi dan proliferasi sel limfosit, produksi sitokin interferon-
Ȗ
(IFN-Ȗ
), interleukin-12 (IL-12), IL-10, sel imun Th, serta imunoglobulin (Ig) A, IgE, IgG,
dan IgM (Gackowska
et al.
2006; Attaouri
et al.
2002).
Imunoglobulin A merupakan protein yang dihasilkan oleh sel limfosit B dan
merupakan imunoglobulin utama yang ditemukan pada mukosa, salah satunya adalah
pada mukosa saluran pencernaan. IgA pada saluran pencernaan berperan memblok
perlekatan mikroorganisme patogen pada sel epitel usus (Wilson 2005). Pada proses
eliminasi antigen yang terdapat pada mukosa saluran pencernaan, IgA tidak
mengundang timbulnya reaksi radang yang hebat karena berfungsi melindungi
mukosa yang lembut (Yamamato
et al
. 2004).
Kandungan IgA pada saluran pencernaan dapat dideteksi menggunakan metode
immunohistokimia. Prinsip imunohistokimia adalah adanya ikatan antigen-antibodi.
Immunohistokimia mampu mendeteksi suatu molekul yang ada pada jaringan dengan
menggunakan antibodi poliklonal atau antibodi monoklonal terhadap molekul yang
akan dideteksi (reaksi antigen-antibodi). Immunohistokimia mampu memberikan
hasil berupa gambaran secara kualitatif maupun kuantitatif berdasarkan intensitas
warna yang terbentuk seperti warna coklat (Sofian dan Kompono 2006).
Arief
et al.
(2008) telah menemukan 10 BAL isolat lokal yang diambil dari
daging sapi bangsa peranakan Ongol yang dijual di berbagai pasar tradisional di
daerah Bogor, Jawa Barat. BAL yang ditemukan ini sudah diuji secara
in vitro
Indonesia untuk pengembangan pangan probiotik nasional. Isolat lokal mempunyai
keunggulan sangat
adaptable
dengan kondisi lingkungan Indonesia sehingga tidak
memerlukan rekayasa dan manipulasi sifat asli isolat tersebut (Farida 2006). Astawan
et al
. (2009) telah meneliti kemampuan bakterisidal dari 10 jenis isolat BAL terhadap
bakteri Enteropatogenik
E. coli
(EPEC) secara
in vitro
. Hasilnya didapatkan dua
spesies BAL yang mempunyai kemampuan terbaik dalam melawan EPEC, yaitu
Lactobacillus plantarum
dan
Lactobacillus fermentum
.
Penelitian ini dilakukan untuk menguji pengaruh bakteri asam laktat
L.
plantarum
dan
L. fermentum
secara
in vivo
menggunakan tikus percobaan
untuk
melihat sifat fungsionalnya sebagai bakteri asam laktat yang mampu menghambat
pertumbuhan bakteri Enteropatogenik
E. coli
(EPEC) dan sebagai imunomodulator
dalam meningkatkan produksi IgA. Pengaruh tersebut dilihat dari profil
imunohistokimia IgA dan histologi tebal mukosa pada usus halus tikus percobaan
yang dipapar bakteri Enteropathogenik
E. coli
(EPEC).
Tujuan
Tujuan penelitian ini adalah untuk menganalisa pengaruh pemberian bakteri asam
laktat
L. plantarum
dan
L. fermentum
terhadap profil imunohistokimia
Immunoglobulin A (IgA) dan histologi tebal mukosa pada usus halus tikus percobaan
TINJAUAN PUSTAKA
Hewan Percobaan Tikus (Rattus norvegicus)
Hewan percobaan atau hewan laboratorium adalah hewan yang sengaja
dipelihara dan diternakan untuk dipakai sebagai hewan model guna mempelajari
dan mengembangkan berbagai macam bidang ilmu dalam skala penelitian atau
pengamatan laboratorik. Penggunaan hewan percobaan untuk penelitian banyak
dilakukan di bidang fisiologi, farmakologi, biokimia, patologi, dan komparatif
zoologi. Di bidang ilmu kedokteran selain untuk penelitian, hewan percobaan juga
sering digunakan sebagai keperluan diagnostik. Berbagai jenis hewan yang umum
digunakan sebagai hewan percobaan, yaitu mencit, tikus, marmut, kelinci,
hamster, unggas, kambing, domba, sapi, kerbau, kuda, dan simpanse (Malole dan
Pramono 1989).
Penggunaan hewan percobaan untuk pengujian secara in vivo biasanya menunjukkan hasil deviasi yang besar dibandingkan dengan percobaan in vitro, karena adanya variasi biologis. Supaya variasi tersebut minimal, hewan-hewan
yang mempunyai spesies yang sama atau strain yang sama, usia yang sama, dan
jenis kelamin yang sama, dipelihara pada kondisi yang sama pula (Malole dan
Pramono 1989).
Hewan percobaan yang umum digunakan dalam penelitian ilmiah adalah
tikus. Tikus (Rattus norvegicus) telah diketahui sifat-sifatnya secara sempurna, mudah dipelihara, dan merupakan hewan yang relatif sehat dan cocok untuk
berbagai penelitian. Ciri-ciri morfologi Rattus norvegicus antara lain memiliki berat 150-600 gram, hidung tumpul dan badan besar dengan panjang 18-25 cm,
kepala dan badan lebih pendek dari ekornya, serta telinga relatif kecil dan tidak
lebih dari 20-23 mm (Depkes 2011).
Terdapat tiga galur atau varietas tikus yang memiliki kekhususan tertentu
yang biasa digunakan sebagai hewan percobaan yaitu galur Sprague dawley berwarna albino putih, berkepala kecil dan ekornya lebih panjang dari badannya,
digunakan dalam penelitian adalah galur Sprague Dawley berjenis kelamin jantan berumur kurang lebih 2 bulan. Tikus Sprague Dawley dengan jenis kelamin betina tidak digunakan karena kondisi hormonal yang sangat berfluktuasi pada saat
mulai beranjak dewasa, sehingga dikhawatirkan akan memberikan respon yang
berbeda dan dapat mempengaruhi hasil penelitian (Kesenja 2005). Tikus putih
galur ini mempunyai daya tahan terhadap penyakit dan cukup agresif
dibandingkan dengan galur lainnya (Harkness dan Wagner 1983).
Menurut Besselsen (2004) dan Depkes (2011) taksonomi tikus adalah:
Kingdom : Animalia
Filum : Chordata
Subfilum : Vertebrata
Kelas : Mamalia
Subkelas : Theria
Ordo : Rodensia
Subordo : Sciurognathi
Famili : Muridae
Subfamili : Murinae
Genus : Rattus
Spesies : Rattus norvegicus
Ada dua sifat utama yang membedakan tikus dengan hewan percobaan
lainnya, yaitu tikus tidak dapat muntah karena struktur anatomi yang tidak lazim
pada tempat bermuara esofagus ke dalam lambung sehingga mempermudah
proses pencekokan perlakuan menggunakan sonde lambung, dan tidak
mempunyai kandung empedu (Smith dan Mangkoewidjojo 1988). Selain itu, tikus
hanya mempunyai kelenjar keringat di telapak kaki. Ekor tikus menjadi bagian
badan yang paling penting untuk mengurangi panas tubuh. Mekanisme
perlindungan lain adalah tikus akan mengeluarkan banyak ludah dan menutupi
bulunya dengan ludah tersebut (Sirois 2005). Skematis sistem saluran pencernaan
6
[image:41.612.191.474.80.314.2]
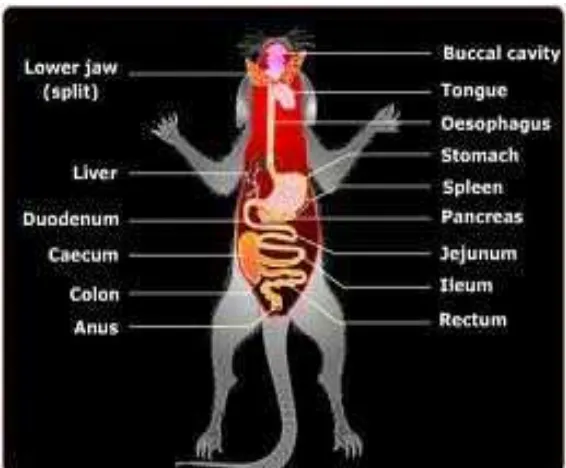
Gambar 1 Sistem Saluran Pencernaan Tikus (Anonim 2010).
Pertumbuhan dan perkembangan tubuh tikus tergantung pada efisiensi
makanan yang diberikan dan juga sangat dipengaruhi oleh metabolisme basal
tubuh tikus itu sendiri (Robinson 1972). Beberapa faktor penting yang dapat
meningkatkan metabolisme basal tubuh hewan adalah suhu lingkungan, jenis
kelamin, umur, keadaan psikologis hewan, dan suhu badan (Ganong 1999).
Usus Halus
Usus halus terdiri dari duodenum, jejunum, dan ileum. Duodenum pada
manusia memiliki panjang sekitar 25 cm terikat erat pada dinding dorsal abdomen
dan sebagian besar terlatak retroperitoneal. Jalannya berbentuk seperti huruf C
yang mengitari pankreas dan ujung distalnya menyatu dengan jejunum yang
terikat pada dinding dorsal rongga melalui mesenterium. Jejunum dapat bergerak
bebas pada mesenteriumnya dan merupakan dua-perlima bagian proksimal usus
halus. Sedangkan ileum merupakan sisa tiga-perlimanya. Dinding usus halus
terdiri atas empat lapis konsentris yaitu mukosa, submukosa, muskularis, dan
serosa (Leeson et al. 1996) (Gambar 2).
Lapisan mukosa terdiri dari lamina epitel, lamina propia, dan muskularis
yang digunakan untuk memperluas permukaan. Pada permukaan epitel vili
terdapat mikrovili yang dapat meningkatkan efisiensi penyerapan nutrisi. Pada
usus halus juga terdapat sel goblet yang menghasilkan mukus sebagai pelindung
mukosa usus (Colville dan Joanna 2002).
Membran mukosa adalah lingkungan yang unik dimana banyak spesies
mikroorganisme yang berbeda dapat hidup dan berekspresi. Terdapat 1014 mikroorganisme dari 200 spesies, 40-50 genus hidup pada permukaan tersebut,
dan 99% dari populasi mikroorganisme pada membran mukosa terjadi di bagian
distal usus halus dan di bagian proksimal kolon (Herich dan Levkut 2002).
Membran mukosa dalam suatu tubuh berkontak langsung dengan lingkungan
luar dan membran mukosa juga terkolonisasi oleh mikroorganisme yang berbeda
dalam jumlah yang besar. Permukaan mukosa dilindungi oleh banyak mekanisme
pertahanan yang memastikan perlindungan yang efektif dengan memproduksi
imunoglobulin A (IgA), mukus, dan kriptoprotektif peptida. Mikroorganisme
dapat mempengaruhi struktur mukosa, fungsi, dan perkembangan sistem imun
(Herich dan Levkut 2002).
[image:42.612.135.503.412.643.2]8
Fungsional epitel usus tergantung pada populasi mikroorganisme di dalam
usus, masuknya mikroorganisme patogen, penyusun yang merugikan dalam lumen
usus, dan mukosa usus yang terpapar antigen. Secara fisiologis bahwa populasi
mikroorganisme normal terdapat dalam usus. Pada manusia sehat, berisi 0-103 cfu/ml dalam perut, 0-105 cfu/ml pada jejunum, 103-109 cfu/ml pada ileum, dan 1010-1012 cfu/ml di usus (Hao dan Lee 2004).
Mikroorganisme usus berfungsi sebagai aktivitas metabolik yang mampu
menyimpan energi dan nutrisi yang dibutuhkan oleh epitel usus, serta
perlindungan terhadap serangan mikroorganisme yang merugikan.
Mikroorganisme normal yang ada di saluran pencernaan dapat mencegah
pertumbuhan yang berlebihan dari mikroorganisme patogen dalam saluran
pencernaan (Harish dan Varghese 2006).
Kemampuan saluran pencernaan untuk mencerna makanan tergantung pada
aktivitas mikroorganisme. Mikroorganisme indigenus suatu waktu akan
menyebabkan infeksi pada saluran pencernaan (Berg 1996). Apabila aktivitas
mikroorganisme dalam usus halus berubah akibat hadirnya mikroorganisme
patogen seperti E. coli dan Sallmonela sp., sehingga proses pencernaan menjadi terganggu (Berg 1996). Hal ini karena keseimbangan jumlah dan jenis
mikroorganisme pada usus halus sangat mempengaruhi kesehatan. Lactobacillus dan Bifidobacterium secara umum merupakan mikroorganisme nonpatogen yang secara alami ada di dalam usus (Weizman et al. 2005).
Escherichia coli
Suwito (2010) menglasifikasikan E. coli berdasarkan ciri khusus dari sifat-sifat virulensinya dan setiap kelompok menimbulkan penyakit melalui mekanisme
Tabel 1 Gejala klinis, epidemiologi, dan faktor virulensi dari berbagai galur E. coli (Suwito 2010)
Strain Gejala klinis Epidemiologi Faktor virulensi
EPEC Diare berair Pada anak-anak
Melekat pada
mukosa usus dan
merusak vili-vili
usus
EHEC
Diare berair,
hemoragik
kolitis,
hemolitik
uremik sindrom
Food born, water
borne Shiga like toxin
ETEC Diare berair Traveler diare
Pili, heat labile dan heat stable enterotoksin
EAEC Diare berlendir Pada anak-anak Pili, sitotoksin
EIEC Disentri, diare
berair Food borne Seluler invasif
Enterotoksin akan mempengaruhi sekresi cairan saluran pencernaan. Pada
saluran pencernaan manusia, EPEC akan menyebakan atrofi dan nekrosis usus.
Pada anak-anak, EPEC menyebabkan diare, sedangkan EHEC akan membentuk
koloni pada saluran pencernaan sehingga mengakibatkan pendarahan dan
terjadinya atrofi mikrovili sel-sel epitel usus (Suwito 2010; Clarke et al. 2002). EPEC melekat pada sel mukosa yang kecil dan menimbulkan kerusakan pada
epitel melalui pembentukan mikrokoloni yang ditunjukkan dengan perlekatan
yang terlokalisasi (Savkovic et al. 2005). Selain itu, pada dosis 105 – 1010 sel EPEC dapat menyebabkan diare yang durasinya kurang lebih lima hari (Janda dan
Abbot 2006; Lodes et al. 2004).
EPEC adalah salah satu mikroorganisme patogen yang dapat menyebabkan
lesi attaching dan effacing (A/E) pada sel usus. Ciri dari patogen A/E adalah terletak pada tumpuannya di permukaan sel epitel inang dan menyebabkan
10
mukosa deodenum dan proksimal jejunum. EPEC menimbulkan kerusakan pada
epitel jejunum melalui pembentukan mikrokoloni yang ditunjukkan dengan
pelekatan yang terlokalisasi (Moat et al. 2002).
Infeksi EPEC pada sel epitel dapat dilihat pada Gambar 3. EPEC pada sel
epitel membentuk perlekatan dan tidak memperlihatkan adanya lesio. Awal
penyerangan EPEC pada sel epitel diperantarai adanya bundle-forming pilus (BFP) yang merupakan suatu fimbria tipe IV yang terlibat dalam virulensi,
autoagregasi, dan perlekatan lokal bakteri ke sel inang (Blank dan Donnenberg
2001). Setelah perlekatan awal terjadi, mikrovili terganggu dan EPEC
mengeluarkan beberapa faktor virulensi dan mensekresikan reseptor Tir
(translicated intimin receptor) ke dalam sel inang. EPEC mengikat Tir melalui membran luar protein, intimin. Sinyal transduksi terjadi di dalam sel inang,
termasuk aktivasi protein kinase C (PKC), inositol triphosphat (IP3), dan
pelepasan Ca2+. Beberapa protein sitoskeleton termasuk aktin, menjadi tempat perlekatan EPEC. Akhirnya, terjadi penyusunan kembali sitoskeletal setelah
Tir-intimin berikatan, dan menghasilkan formasi pedestal-like structure (Lu dan Walker 2001).
[image:45.612.205.449.435.603.2]Prebiotik dan Probiotik
Prebiotik merupakan pangan yang dapat memacu pertumbuhan bakteri
probiotik, agar dapat diperoleh kondisi fisiologis dan metabolik yang dapat
memberikan perlindungan pada saluran pencernaan, khususnya usus halus dan
kolon (Zakaria 2003). Probiotik didefinisikan sebagai bakteri hidup yang
diberikan sebagai suplemen makanan yang mempunyai pengaruh yang
menguntungkan terhadap kesehatan, dengan memperbaiki keseimbangan
mikroflora usus. Efek yang menguntungkan dari bakteri tersebut dapat mencegah
dan mengobati kondisi patologik usus bila bakteri tersebut diberikan secara oral
(Karuniawati 2010; Maurad dan Meriem 2008; Lisal 2005).
Karakteristik probiotik yang diinginkan dari satu strain spesifik adalah mempunyai kapasitas untuk bertahan hidup, melakukan kolonisasi dan
metabolisme dalam saluran pencernaan, mampu mempertahankan keseimbangan
mikroflora usus, mampu menstimulasi sistem imun, dan bersifat nonpatogen
(Gibson dan Fuller 2000). Efikasi dari beberapa probiotik tergantung dari genus,
spesies dan strain. Tidak semua bakteri tahan asam mempunyai efek probiotik. Probiotik multipel strain lebih efektif daripada single strain (Cornelius dan Van 2004).
Mekanisme probiotik bersaing dengan mikroorganisme patogen di dalam usus
dapat dilihat pada Gambar 4. Probiotik dapat meningkatkan pertahanan dengan
menduduki usus dalam jumlah besar dan beragam. Hal ini dapat mencegah
kolonisasi mikroorganisme patogen, menghasilkan senyawa antimikroba, asam
lemak jenuh, dan dimodifikasi dengan asam empedu yang dapat menciptakan
lingkungan lumen yang kurang baik untuk pertumbuhan mikroorganisme patogen,
serta mampu merangsang sistem imun. Penyakit pada usus akan terjadi jika
perkembangan mikrorganisme patogen yang terlalu banyak dan terganggunya
12
[image:47.612.192.465.84.302.2]
Gambar 4 Mekanisme probiotik berkompetisi dengan bakteri patogen (Lu dan Walker 2001).
Salah satu jenis bakteri yang umum terdapat di daging adalah bakteri asam
laktat (BAL). Arief et al. (2008) melaporkan bahwa BAL golongan Lactobacillus, Lactococcus, dan Streptococcus dari daging sapi bangsa Peranakan Ongol yang dijual di berbagai pasar tradisional daerah Bogor mampu bertahan pada kondisi
saluran pencernaan seperti pH saluran pencernaan dan garam empedu, serta
memiliki aktivitas antimikroba terhadap bakteri patogen. Kemampuan bakterisidal
terhadap bakteri patogen ini disebabkan bakteri ini mampu menghasilkan senyawa
bioaktif asam laktat, asam asetat, dan senyawa bakteriosin.
Bakteri asam laktat termasuk mikroorganisme probiotik yang berpengaruh
positif terhadap mikroflora di saluran pencernaan. Bakteri asam laktat juga
termasuk kelompok bakteri yang dapat mengeliminasi kerusakan pada saluran
pencernaan dan beberapa gangguan pencernaan berupa inflamasi pada saluran
pencernaan. Jika bakteri asam laktat mampu bertahan lama dalam usus maka akan
menstimulir pergerakan peristaltik di usus, sehingga transit feses akan lebih
singkat. Selain itu, bakteri asam laktat mampu menghambat bakteri patogen
sehingga dapat mencegah terjadinya diare dan infeksi (Gill dan Guarner 2004).
Bakteri asam laktat juga dapat bersifat sebagai imunomodulator untuk
Bakteri asam laktat mampu menstimulasi sistem imun karena adanya senyawa
peptidoglikan dan lipopolisakarida dalam dinding sel (Surono 2004). Bakteri asam
laktat juga merangsang aktivitas sel imun yang spesifik dan nonspesifik. Sistem
imun spesifik dapat dibagi menjadi dua kategori yaitu sistem imun spesifik
humoral dan sistem imun spesifik seluler. Antibodi yang diproduksi dalam sel
plasma mediasi dari sistem imun spesifik humoral. Sistem imun spesifik seluler
dimediasi oleh limphosit T yang berproliferasi setelah kontak dengan antigen,
produk sitokin, dan menyebabkan aktivitas pada sel kekebalan yang lain (Tizard
2000).
Bakteri asam laktat mampu meningkatkan sistem imun spesifik humoral.
Berdasarkan penelitian bahwa produksi IgA akan meningkat jika mendapatkan
bakteri asam laktat. Pemberian bakteri asam laktat golongan Lactobacillus dapat memberikan efek kesehatan bagi inang seperti mencegah terjadinya infeksi
saluran pencernaan, meningkatkan respon imunlokal, dan meningkatkan produksi
IgA. Produksi IgA kemudian disekresikan ke lumen usus untuk mencegah
penempelan mikroorganisme patogen seperti, Salmonella typhimurium di mukosa usus (Isolauri 2001).
L. plantarum merupakan bakteri gram positif yang tidak patogen dan secara alami terdapat dalam saliva dan saluran pencernaan. L. plantarum merupakan bakteri asam laktat yang biasa digunakan dalam makanan fermentasi. L. plantarum mampu bertahan pada kondisi lambung (pH rendah) dan adanya garam empedu. L. plantarum juga mampu melindungi sel epitel usus terhadap induksi E. coli (Bixquert 2009). L. plantarum mampu tumbuh dengan baik pada pH 2-3 dan pada pH antara 4-6.5 terjadi peningkatan populasi (Anukam dan
Koyama 2007). Sedangkan L. fermentum mampu tumbuh baik pada kisaran pH 2-3 dan garam empedu 0.2-3-1% (Klayraung et al. 2008).
Imunoglobulin A (IgA)
Sistem imunitas mukosa saluran pencernaan merupakan bagian sistem
imunitas yang penting dan berlawanan sifatnya dari sistem imunitas sistemik.
Sistem imunitas mukosa lebih bersifat menekan imunitas. Hal ini disebabkan oleh
14
berhadapan dengan banyak antigen yang terdiri dari mikroorganisme patogen,
antigen makanan, dan virus dalam jumlah yang lebih besar dibandingkan sistem
imunitas sistemik. Antigen-antigen tersebut dicegah agar tidak menempel mukosa
saluran pencernaan dengan pengikatan oleh IgA, barier fisik dan kimiawi dengan
enzim-enzim yang ada pada mukosa saluran pencernaan. Mamalia memproduksi
IgA dan antibodi lain paling sedikit 80% pada semua sel plasma dan terlokalisasi
pada lamina propria saluran pencernaan (Van et al. 2001).
Imunoglobulin A (IgA) merupakan protein yang dihasilkan oleh sel limfosit B
dan merupakan immunoglobulin utama yang ditemukan pada mukosa. Limfosit B
merupakan limfosit terbesar di temukan di lamina propria yang fungsi efektor
utamanya adalah sekresi antibodi terutama IgA yang berperan mencegah
perlekatan mikroba ke sel epitel usus (Wilson 2005). IgA terdapat di air liur, air
mata, sekresi bronkus, mukosa hidung, cairan prostat, sekresi vagina, dan mukus
dari usus halus sebagai pertahanan primer tubuh. Sekresi IgA tidak menimbulkan
respon inflamasi sehingga sekresi IgA ideal untuk menjaga permukaan mukosa
dari antigen dengan cara mencegah perlekatan antigen pada epitel (Surono 2004)
dan berfungsi melindungi mukosa yang lembut (Yamamato et al. 2004).
Mekanisme pertahanan sistem imun adaptif di permukaan mukosa merupakan
suatu sistem yang diperantarai antibodi IgA sekretori, kelas imunoglobulin
predominan dalam sekresi eksternal manusia. Imunoglobulin ini tahan terhadap
protease sehingga cocok berfungsi pada sekresi mukosa. Induksi IgA melawan
patogen mukosa dan antigen protein terlarut bergantung pada sel T helper.
Perubahan sel B menjadi sel B penghasil IgA dipengaruhi oleh TGF-ȕ dan
iterleukin (IL)10 bersama-sama dengan IL-4. Sel T di mukosa menghasilkan
TGF-ȕ, IL-10 dan IL-4 dalam jumlah yang banyak dan sel epitelial mukosa
menghasilkan TGF-ȕ dan IL-10. Hal tersebut dapat menjadi petunjuk bahwa
maturasi sel B penghasil IgA melibatkan lingkungan mikro mukosa yaitu sel