UJI ANTAGONISME ISOLAT MUTAN Sclerotium rolfsii Sacc. TERHADAP ISOLAT TIPE LIAR Sclerotium rolfsii Sacc. DI LABORATORIUM
SKRIPSI
OLEH :
NURAINUN NASUTION 080302049
HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
UJI ANTAGONISME ISOLAT MUTAN Sclerotium rolfsii Sacc. TERHADAP ISOLAT TIPE LIAR Sclerotium rolfsii Sacc. DI LABORATORIUM
SKRIPSI
OLEH :
NURAINUN NASUTION 080302049
HPT
Skripsi Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana
di Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Disetujui Oleh : Komisi Pembimbing
(Dr. Ir. Hasanuddin M.S.)
Ketua Anggota
(Prof. Dr. Ir. Darma Bakti M.S.)
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
ABSTRACT
Nurainun Nasution, “Antagonism test between mutated isolate of Sclerotium rolfsii Sacc. against wild type isolate of Sclerotium rolfsii Sacc. in laboratory, supervised by Hasanuddin and Darma Bakti. This research aims to
determine ability from mutated isolate of S. rolfsii to inhibit wild type isolate of S. rolfsii’s growth in laboratory. It was conducted in Plant Pathology Laboratory,
Faculty of Agriculture, University of Sumatra Utara, Medan from September until November 2012. It was done by using Completely Randomized Design Non Factorial with 7 treatments and 3 replications.
This research’s result showed that highest percentage of inhibiting zones contained at 10 minutes UV irradiated isolate (M2) at 67,63 % and the lowest
were at 30 minutes UV irradiated isolate (M6) at 52,80 %. Macroschopis of S. rolfsii experience of the change at 15 and 30 minutes UV irradiated isolate (M3 and M6) were in the form of colony more dense and compact, myselium like
cotton and hyphae in the form of refinement. Mutated isolate of S. rolfsii at 15, 20, 25, 30 minutes UV irradiated able to inhibit wild type isolate of S. rolfsii from producing sclerotia. UV Irradiation length is inversely proportional with mutated
of S. rolfsii’s growth speed and 30 minutes UV irradiated isolate decreasing S. rolfsii’s pathogenecity and virulency towards plants.
ABSTRAK
Nurainun Nasution, “Uji antagonisme isolat mutan Sclerotium rolfsii Sacc. terhadap isolat tipe liar Sclerotium rolfsii Sacc. di laboratorium” dibawah bimbingan Hasanuddin dan Darma Bakti. Penelitian ini bertujuan untuk mengetahui kemampuan isolat mutan S. rolfsii dalam menghambat pertumbuhan isolat tipe liar S. rolfsii di laboratorium. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan September sampai November 2012. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan 7 perlakuan dan 3 ulangan.
Hasil penelitian menunjukkan bahwa persentase daerah hambatan tertinggi terdapat pada isolat yang dipapari UV 10 menit (M2) sebesar 67,63 % dan terendah pada isolat yang dipapari UV 30 menit (M6) sebesar 52,80 %. Makroskopis dari S. rolfsii mengalami perubahan pada isolat yang dipapari UV selama 15 dan 30 menit (M3 dan M6) yaitu koloni rapat, miselium seperti kapas dan hifa halus. Isolat mutan S. rolfsii yang dipapari UV selama 15, 20, 25, dan 30 menit mampu menghambat pembentukan sklerotia isolat tipe liar S. rolfsii. Lama penyinaran berbanding terbalik dengan kecepatan pertumbuhan koloni dan
pemaparan UV selama 30 menit (M6) menurunkan patogenesitas dan virulensi S. rolfsii terhadap tanaman.
RIWAYAT HIDUP
Penulis (Nurainun Nasution) lahir di Air Batu, Kabupaten Asahan pada
tanggal 10 Februari 1990. Anak ke-empat dari empat bersaudara, dengan Ayahanda Sabari Nasution dan Ibunda Kusinem. Adapun riwayat pendidikan penulis adalah sebagai berikut:
Pendidikan Formal:
- Tahun 2002 penulis lulus dari SD Negeri 010041 Air Batu
- Tahun 2005 penulis lulus dari SMP Swasta Yapendak Air batu - Tahun 2008 penulis lulus dari SMA Negeri 2 Kisaran
- Tahun 2008 penulis diterima sebagai mahasiswa Universitas Sumatera
Utara melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN), di Fakultas Pertanian, Program Studi Hama dan Penyakit
Tumbuhan. Pendidikan Informal:
- Tahun 2008-2012 sebagai anggota Ikatan Mahasiswa Perlindungan
Tanaman (IMAPTAN), Fakultas Pertanian Universitas Sumatera Utara. - Tahun 2008-2012 sebagai anggota dan pengurus Komunikasi Muslim
(KOMUS) Hama dan Penyakit Tumbuhan , Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2009-2011 sebagai pengurus Unit Kegiatan Mahasiswa Merpati
Putih (UKM-MP) Universitas Sumatera Utara.
- Tahun 2010 mengikuti Seminar Pertanian dengan tema “Meningkatkan
- Tahun 2011 mengikuti Seminar Pertanian dengan tema “Meningkatkan Ketahanan Pangan Nasional” yang dilaksanakan oleh BKM Al- Mukhlisin
Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2011 melaksanakan Praktek Kerja Lapangan (PKL) di PT. Perkebunan Nusantara III (PERSERO) Unit Tanah Raja, Perbaungan.
- Tahun 2012 mengikuti seminar Nasional dan Rapat Tahunan BKS-PTN Wilayah Barat bidang ilmu pertanian dengan tema “Pertanian Presisi
Menuju Pertanian Berkelanjutan.
- Tahun 2012 sebagai asisten Laboratorium Bioteknologi Pertanian, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2012 sebagai asisten Laboratorium Mikrobiologi Pertanian, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2012 sebagai asisten Laboratorium Dasar Perlindungan Tanaman, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2012 sebagai asisten Laboratorium Mikrobiologi Akuatik, Fakultas
Pertanian Universitas Sumatera Utara.
- Tahun 2012 sebagai asisten Laboratorium Hama dan Penyakit Ikan,
Fakultas Pertanian Universitas Sumatera Utara.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Allah SWT karena berkat
rahmat dan kasih-Nya penulis dapat menyelesaikan skripsi ini dengan baik.
Adapun judul dari skripsi ini adalah “Uji Antagonisme Isolat Mutan Sclerotium rolfsii Sacc Terhadap Isolat Tipe Liar Sclerotium rolfsii Sacc di
Laboratorium”, disusun untuk mengembangkan ilmu pengetahuan terhadap S. rolfsii yang menyerang berbagai tanaman salah satunya tanaman kedelai, dan
sebagai salah satu syarat untuk memperoleh gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis juga mengucapkan terima kasih
kepada Dr. Ir. Hasanuddin M.S., selaku ketua komisi pembimbing dan Prof. Dr. Ir. Darma Bakti M.S., selaku anggota komisi pembimbing yang telah
banyak membimbing penulis dalam menyelesaikan skripsi ini, kepada Dr. Lisnawita, S.P., M.Si., selaku dosen penguji yang telah memberikan banyak
saran yang sifatnya membangun, serta Ir. Mukhtar Iskandar Pinem, M.Agr.,
selaku moderator dalam seminar hasil penelitian penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh
karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang
membantu. Semoga bermanfaat bagi pihak-pihak yang membutuhkan. Medan, April 2013
DAFTAR ISI
Pengendalian penyakit ... 8
Mutasi mikroorganisme ... 9
BAHAN DAN METODE Tempat dan waktu penelitian ... 13
Bahan dan alat ... 13
Bahan ... 13
Alat ... 13
Metode penelitian ... 13
Pelaksanaan penelitian ... 15
Pembuatan Media PDA ... 15
Penyediaan sumber inokulum ... 15
Isolat tipe liar S. rolfsii. ... 15
Isolat mutan S. rolfsii ... 16
Uji antagonisme isolat mutan S. rolfsii terhadap tipe liar ... 16
Uji patogenesitas isolat mutan S. rolfsii. ... 17
Persiapan media tanam ... 17
Penanaman benih kedelai ... 17
Perbanyakan isolat mutan S. rolfsii ... 17
Peubah amatan ... 18
Kemampuan antagonis isolat mutan S. rolfsii terhadap tipe liar ... 18
Morfologi isolat mutan S. rolfsii ... 18
Diameter koloni isolat mutan S. rolfsii ... 19
Pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat tipe liar S. rolfsii. ... 19
Luas pertumbuhan koloni isolat mutan S. rolfsii ... 19
Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii. ... 20
Jumlah sklerotia isolat mutan S. rolfsii. ... 20
Pengaruh isolat mutan S. rolfsii terhadap Jumlah sklerotia koloni isolat tipe liar S. rolfsii ... 20
Patogenesitas isolat mutan S. rolfsii ... 20
HASIL DAN PEMBAHASAN Kemampuan antagonis isolat mutan S. rolfsii terhadap tipe liar ... 21
Morfologi isolat mutan S. rolfsii ... 25
Makroskopis ... 25
Mikroskopis ... 27
Diameter koloni isolat mutan S. rolfsii. ... 28
Pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat tipe liar S. rolfsii ... 30
Luas pertumbuhan koloni isolat mutan S. rolfsii ... 32
Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii ... 35
Jumlah sklerotia isolat mutan S. rolfsii. ... 38
Pengaruh isolat mutan S. rolfsii terhadap Jumlah sklerotia koloni isolat tipe liar S. rolfsii ... 41
Patogenesitas isolat mutan S. rolfsii ... 45
KESIMPULAN DAN SARAN Kesimpulan ... 50
Saran ... 50 DAFTAR PUSTAKA
DAFTAR GAMBAR
No Keterangan Gambar Hal
1. Biakan murni S. rolfsii. ... 6
2. Tanaman kedelai yang terserang S. rolfsii dan tanah di sekitar perakaran tanaman terserang ... 8
3. Lampu UV ... 10
4. Bagan peletakan kedua isolat pada cawan petri ... 17
5. Histogram beda uji rataan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii ... 23
6. Pengujian antagonisme dengan menggunakan metode dual culture .... 24
7 Fotomikrograf mating type S. rolfsii perbesaran 1000 x ... 24
8 Biakan isolat S. rolfsii 3 hsi ... 25
9 Fotomikrograf dari isolat mutan S. rolfsii dari kiri ke kanan ... 27
10 Histogram beda uji rataan diameter koloni isolat mutan S. rolfsii ... 29
11 Histogram beda uji rataan pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat tipe liar S. rolfsii ... 31
12 Histogram beda uji rataan pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii ... 34
13 Histogram jumlah sklerotia isolat mutan S. rolfsii... 36
14 Histogram beda uji rataan pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii ... 37
15 Pembentukan sklerotia pada perlakuan M3 (kiri) dan perlakuan M6 16 Pembentukan sklerotia pada perlakuan M (kanan) pada 4 msi ... 38
1 17 Tanaman kedelai yang telah diaplikasikan isolat mutan S. rolfsii ... 41
... 39
18 Perbandingan perakaran kedelai antara kontrol dengan perlakuan ... 42
DAFTAR TABEL
No Keterangan Tabel Hal
1. Beda uji rataan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii ... 22 2. Morfologi isolat mutan S. rolfsii secara makroskopis ... 25 3. Beda uji rataan rataan diameter koloni isolat mutan S. rolfsii ... 28 4 Beda uji rataan pengaruh isolat mutan S. rolfsii
terhadap diameter koloni isolat tipe liar S. rolfsii ... 30 5 Beda uji rataan luas pertumbuhan koloni isolat mutan S. rolfsii ... 32 6 Beda uji rataan pengaruh isolat mutan S. rolfsii
terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii ... 33 7 Beda uji rataan jumlah sklerotia dari isolat mutan S. rolfsii ... 35 8 Beda uji rataan pengaruh isolat mutan S. rolfsii
terhadap jumlah sklerotia isolat tipe liar S. rolfsii ... 37 9 Beda uji rataan keparahan penyakit isolat mutan S. rolfsii terhadap
DAFTAR LAMPIRAN
No Keterangan Tabel Hal
1 Bagan penelitian ... 49
2 Kemampuan antagonis isolat mutan dan tipe liar S. rolfsii terhadap isolat liar pada pengamatan 3 Hsi ... 51
3 Kemampuan antagonis isolat mutan dan tipe liar S. rolfsii terhadap isolat liar pada pengamatan 4 Hsi ... 53
4 Diameter koloni isolat mutan S. rolfsii pada pengamatan 1 Hsi ... 55
5 Diameter koloni isolat mutan S. rolfsii pada pengamatan 2 Hsi ... 57
6 Diameter koloni isolat mutan S. rolfsii pada pengamatan 3 Hsi ... 59
7 Pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat
11 Luas pertumbuhan isolat mutan S. rolfsii pada pengamatan 1 Hsi ... 69
12 Luas pertumbuhan isolat mutan S. rolfsii pada pengamatan 2 Hsi ... 71
13 Luas pertumbuhan isolat mutan S. rolfsii pada pengamatan 3 Hsi ... 73
14 Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii pada pengamatan 1 Hsi ... 75
15 Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii pada pengamatan 2 Hsi ... 77
16 Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii pada pengamatan 3 Hsi ... 79
17 Pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii pada pengamatan 4 Hsi ... 81
18 Jumlah sklerotia isolat mutan S. rolfsii pada pengamatan 1 Msi ... 83
19 Jumlah sklerotia isolat mutan S. rolfsii pada pengamatan 2 Msi ... 85
20 Jumlah sklerotia isolat mutan S. rolfsii pada pengamatan 3 Msi ... 87
21 Jumlah sklerotia isolat mutan S. rolfsii pada pengamatan 4 Msi ... 89
22 Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii pada pengamatan 1 Msi ... 91
23 Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii pada pengamatan 2 Msi ... 92
24 Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii pada pengamatan 3 Msi ... 94
25 Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii pada pengamatan 4 Msi ... 96
29 Persentase keparahan penyakit isolat mutan S. rolfsii pada
pengamatan 4 Hsi ... 104
30 Persentase keparahan penyakit isolat mutan S. rolfsii pada pengamatan 5 Hsi ... 106
31 Media beras sebagai bahan perbanyakan isolat mutan S. rolfsii. ... 108
32 Saat penginokulasian isolat mutan S. rolfsii ... 108
33 Pengamatan patogenesitas pada 3 hsi ... 108
34 Pengamatan patogenesitas pada 4 hsi ... 108
35 Perakaran tanaman kedelai setelah pengaplikasian isolat mutan ... 109
36 Rangkuman kegiatan selama penelitian ... 109
37 Deskripsi tanaman kedelai varietas anjasmoro ... 110
ABSTRACT
Nurainun Nasution, “Antagonism test between mutated isolate of Sclerotium rolfsii Sacc. against wild type isolate of Sclerotium rolfsii Sacc. in laboratory, supervised by Hasanuddin and Darma Bakti. This research aims to
determine ability from mutated isolate of S. rolfsii to inhibit wild type isolate of S. rolfsii’s growth in laboratory. It was conducted in Plant Pathology Laboratory,
Faculty of Agriculture, University of Sumatra Utara, Medan from September until November 2012. It was done by using Completely Randomized Design Non Factorial with 7 treatments and 3 replications.
This research’s result showed that highest percentage of inhibiting zones contained at 10 minutes UV irradiated isolate (M2) at 67,63 % and the lowest
were at 30 minutes UV irradiated isolate (M6) at 52,80 %. Macroschopis of S. rolfsii experience of the change at 15 and 30 minutes UV irradiated isolate (M3 and M6) were in the form of colony more dense and compact, myselium like
cotton and hyphae in the form of refinement. Mutated isolate of S. rolfsii at 15, 20, 25, 30 minutes UV irradiated able to inhibit wild type isolate of S. rolfsii from producing sclerotia. UV Irradiation length is inversely proportional with mutated
of S. rolfsii’s growth speed and 30 minutes UV irradiated isolate decreasing S. rolfsii’s pathogenecity and virulency towards plants.
ABSTRAK
Nurainun Nasution, “Uji antagonisme isolat mutan Sclerotium rolfsii Sacc. terhadap isolat tipe liar Sclerotium rolfsii Sacc. di laboratorium” dibawah bimbingan Hasanuddin dan Darma Bakti. Penelitian ini bertujuan untuk mengetahui kemampuan isolat mutan S. rolfsii dalam menghambat pertumbuhan isolat tipe liar S. rolfsii di laboratorium. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan September sampai November 2012. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Non Faktorial dengan 7 perlakuan dan 3 ulangan.
Hasil penelitian menunjukkan bahwa persentase daerah hambatan tertinggi terdapat pada isolat yang dipapari UV 10 menit (M2) sebesar 67,63 % dan terendah pada isolat yang dipapari UV 30 menit (M6) sebesar 52,80 %. Makroskopis dari S. rolfsii mengalami perubahan pada isolat yang dipapari UV selama 15 dan 30 menit (M3 dan M6) yaitu koloni rapat, miselium seperti kapas dan hifa halus. Isolat mutan S. rolfsii yang dipapari UV selama 15, 20, 25, dan 30 menit mampu menghambat pembentukan sklerotia isolat tipe liar S. rolfsii. Lama penyinaran berbanding terbalik dengan kecepatan pertumbuhan koloni dan
pemaparan UV selama 30 menit (M6) menurunkan patogenesitas dan virulensi S. rolfsii terhadap tanaman.
PENDAHULUAN Latar Belakang
Kedelai merupakan tanaman pangan yang tumbuh tegak. Kedelai jenis liar Glycine ururiencis, merupakan kedelai yang menurunkan berbagai kedelai yang kita kenal sekarang (Glycine max (L) Merril). Berasal dari daerah Manshukuo
(Cina Utara). Di Indonesia, dibudidayakan mulai abad ke-17 sebagai tanaman pangan dan pupuk hijau. Penyebaran tanaman kedelai ke Indonesia berasal dari
daerah Manshukuo menyebar ke daerah Mansyuria, Jepang (Asia Timur) dan ke negara-negara lain di Amerika dan Afrika (Kantor Deputi Menegristek, 2011).
Kedelai kaya akan protein yang memiliki arti penting sebagai sumber
protein nabati untuk peningkatan gizi dan mengatasi penyakit kurang gizi seperti busung lapar. Perkembangan manfaat kedelai di samping sebagai sumber protein, makanan berbahan kedelai dapat dipakai juga sebagai penurun cholesterol darah
yang dapat mencegah penyakit jantung. Oleh karena itu, ke depan proyeksi kebutuhan kedelai akan meningkat seiring dengan kesadaran masyarakat tentang
makanan sehat. Produk kedelai sebagai bahan olahan pangan berpotensi dan berperan dalam menumbuhkembangkan industri kecil menengah bahkan sebagai komoditas ekspor (Simatupang et al. 2005).
Kedelai dapat dikembangkan sebagai suatu komoditas unggul. Hal ini disebabkan tersedianya potensi sumber daya lahan dan manusia yang dapat
Menurut Deptan (2006), kebutuhan akan kedelai meningkat tiap tahunnya, sejalan dengan meningkatnya pertumbuhan penduduk. Komoditas per kapita
kedelai saat ini ± 8 kg/kapita/tahun. Diperkirakan setiap tahunnya kebutuhan akan kedelai adalah ± 1,8 juta Ton dan bungkil kedelai sebesar ± 1,1 juta Ton.
Luas panen dan produksi tanaman kedelai Indonesia 5 tahun terakhir
adalah: tahun 2006 mencapai 747.611 Ton dengan luas panen 580.534 Ha, tahun 2007 mengalami penurunan yaitu 592.534 Ton dengan luas panen
459.116 Ha, tahun 2008 mengalami peningkatan yaitu 775.710 Ton dengan luas panen 590.956 Ha, berlanjut di tahun 2009 mencapai 974.512 Ton dengan luas panen 722.791 Ha, tahun 2010 kembali mengalami penurunan yaitu 907.031 Ton
dengan luas panen 660.823 Ha (BPS, 2011).
Luas panen dan produksi tanaman kedelai Sumatera Utara 5 tahun terakhir
adalah: tahun 2006 mencapai 7.042 Ton dengan luas panen 6.311 Ha., tahun 2007 mengalami penurunan yaitu 4.345 Ton dengan luas panen 3.747 Ha, tahun 2008 mengalami peningkatan yaitu 11.647 Ton dengan luas panen 9.597 Ha, yang
kemudian berlanjut di tahun 2009 mencapai 14.206 Ton dengan luas panen 11.494 Ha, dan tahun 2010 mengalami penurunan yaitu 9.439 Ton dengan luas
panen 7.803 Ha (BPS, 2011).
Berbagai upaya telah dilakukan untuk memacu peningkatan produksi menuju swasembada kedelai. Penggalian potensi sumber pertumbuhan produksi
kedelai kembali digiatkan terutama perluasan areal tanam dan peningkatan produktivitas. Produksi kedelai saat ini belum dapat mencukupi permintaan
bahan pangan dan pakan ternak yang mengandung protein nabati tinggi (Nasikhah, 2008).
Menurut Martoredjo (1992), salah satu penghambat dalam peningkatan
produksi kedelai adalah penyakit yang disebabkan oleh jamur patogen. Jamur merupakan patogen terpenting karena jumlahnya yang sangat banyak dan
beberapa jenis jamur menjadi patogen pada beberapa komoditas pertanian. Sclerotium rolfsii merupakan salah satu jamur patogen, jamur tersebut merupakan
penyebab penyakit layu.
Penyakit yang disebabkan oleh S. rolfsii merupakan penyakit potensial pada tanaman kedelai karena tanaman yang terserang akan mati dan patogen dapat
bertahan lama di dalam tanah dalam bentuk sklerotia. Penyakit ini sering ditemukan pada tanaman kedelai baik lahan kering, tadah hujan maupun pasang
surut dengan intensitas serangan sebesar 5-55%. Tingkat serangan lebih dari 5 % di lapang sudah dapat merugikan secara ekonomi, tanaman kedelai yang terserang hasilnya akan rendah atau sama sekali gagal panen (Semangun, 2004). Menurut
Agrios (1997), S. rolfsii adalah penyebab penyakit busuk batang, merupakan patogen tular tanah yang dapat menyerang kedelai, kubis-kubisan,
tanaman famili Cucurbitaceae, seledri, jagung manis, selada, okra, bawang, lada, kentang, tomat, krisan, kapas, tembakau dan sebagainya
Patogen tular tanah pada tanaman dapat secara signifikan mengurangi
hasil dan kualitas dari tanaman. Infeksi simultan dari patogen tular tanah ini terkadang beberapa diantaranya mengakibatkan penyakit kompleks yang dapat
lingkungan sangat kompleks, sehingga menjadi tantangan untuk memahami
semua aspek penyakit yang disebabkan oleh patogen tular tanah ini (Koike et al. 2003).
Usaha untuk menurunkan nilai kerusakan yang disebabkan oleh jamur S. rolfsii telah banyak dilakukan. Penggunaan fungisida kimiawi sering menjadi
pilihan utama dalam mengendalikan penyakit busuk pangkal batang S. rolfsii, Namun fungisida dapat memberikan dampak negatif baik pada pengguna, sasaran
maupun terhadap lingkungan (Wudianto, 1997).
Melihat kenyataan yang demikian, maka diperlukan upaya pengendalian yang lebih ramah lingkungan. Cara pengendalian yang saat ini sedang
dikembangkan dan merupakan alternatif yang aman dibandingkan dengan menggunakan cara kimia adalah mengendalikan secara hayati dengan
menggunakan mikroorganisme antagonis (Nasikhah, 2008). Menurut Hasanuddin (2003), mikroorganisme yang bersifat antagonis mempunyai pengaruh berlawanan terhadap mikroorganisme patogenik sehingga dapat dimanfaatkan sebagai suatu
komponen dalam upaya pengendalian.
Pengendalian hayati adalah pemberian mikroba antagonis dan perlakuan
tertentu untuk meningkatkan aktivitas mikroba tanah seperti pemberian bahan organik yang bertujuan agar mikroba antagonis menjadi tinggi aktivitasnya. Mikroba antagonis adalah mikroba yang aktivitasnya berdampak negatif terhadap
kehidupan patogen (Abadi, 2003).
Pengendalian penyakit yang disebabkan oleh patogen tular tanah dengan
pengendali hayati. Untuk itulah, dalam usaha mengintroduksi agens pengendali hayati, banyak metode yang saat ini dapat dilakukan salah satunya dengan
mengisolasi strain nonpatogenik, baik itu berasal dari tanah supresif terhadap
penyakit layu (Alabouvette et al. 1996), dari jaringan akar tanaman (Yamaguchi et al. 1992), atau dari tipe liar (wild type) patogen itu sendiri yang
dibuat menjadi mutan melalui berbagai perlakuan mutasi (Freeman et al. 2002). Penggunaan sinar ultraviolet (UV) untuk memutasi strain patogenik (liar) menjadi
strain nonpatogenik sudah dipraktekkan sejak lama. Sinar UV diketahui mampu menginduksi terjadinya mutasi pada mikroba, baik pada kondisi alamiah maupun laboratorium (Pelczar & Chan, 1986).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kemampuan isolat mutan S. rolfsii dalam menghambat pertumbuhan koloni isolat tipe liar S. rolfsii di
laboratorium.
Hipotesis Penelitian
Isolat mutan S. rolfsii dapat menjadi agen hayati antagonis terhadap isolat tipe liar (patogen S. rolfsii) di laboratorium.
Kegunaan Penelitian
− Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di
Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA Biologi S. rolfsii
Menurut Alexopoulus & Mims (1979) jamur S. rolfsii dapat
diklasifikasikan sebagai berikut : Kingdom : Mycetaceae; Devisio : Mycopyta; Class : Deuteromycetes; Ordo : Mycelia Steril; Famili : Agonomycetaceae;
Genus : Sclerotium; Species : S. rolfsii Sacc.
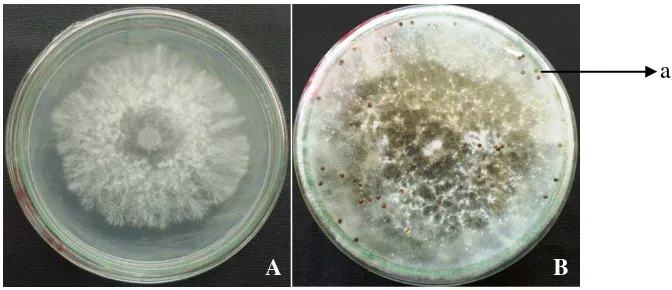
Gambar 1. Biakan S. rolfsii (A) berumur 3 hari (B) berumur 3 minggu (a) sklerotia
Sclerotium mempunyai kulit yang kuat sehingga tahan terhadap suhu
tinggi dan kekeringan. Di dalam tanah Sclerotium dapat bertahan sampai 6-7 tahun. Dalam cuaca kering Sclerotium dapat mengeriput, tetapi ini justru akan
berkecambah dengan cepat jika kembali berada di lingkungan yang lembab (Semangun, 2004). Pada dasarnya ada dua jenis hifa yang dihasilkan S. rolfsii yaitu kasar dan lurus dengan ukuran sel (2-9 μm x 150-250 μm) (Fichtner, 2006)
dan miselium yang terdiri dari benang-benang berwarna putih, tersusun seperti
bulu dan kapas (Gambar 1 A). Di sini jamur tidak membentuk spora
(Semangun, 2004)
Untuk pemencaran dan untuk mempertahankan diri jamur membentuk sejumlah sklerotia (Gambar 1 B.a). Butir-butir ini mudah sekali lepas dan
A B
terangkut air (Semangun, 2004). Pada prinsipnya sklerotia terbentuk pada musim hujan dan menjadi inokulum pertama untuk penyakit. Berada dekat dengan
permukaan tanah, sklerotia mungkin ada bebas di dalam tanah atau berasosiasi dengan sisa tanaman. Sklerotia yang terkubur dalam di dalam tanah mungkin hidup lebih kurang selama setahun, ketika berada di permukaan tanah kembali
aktif dan mungkin berkecambah pada respon alkohol dan bahan-bahan yang lain mudah menguap yang berasal dari dekomposisi bahan tanaman (Fichtner, 2006). Menurut Punja & Rahe (2001), untuk menjaga struktur pelindung, sklerotia terdiri
dari hifa yang aktif. Suhu optimum untuk pertumbuhan sklerotia adalah 27-30° C dan tidak aktif pada suhu dibawah 0°
Menurut Ferreira & Boley (1992), ukuran sklerotia mempunyai banyak bentuk yang dihasilkan oleh miselium, bulat dan putih ketika muda kemudian
menjadi coklat gelap sampai hitam. Fichtner (2006) menyebutkan bahwa sklerotia mempunyai ukuran diameter (0,5 mm-2,0 mm) yang mulai berkembang setelah 4-7 hari dari pertumbuhan miselium.
C.
Gejala Serangan
S. rolfsii pertama sekali menyerang batang, meskipun mungkin menginfeksi beberapa bagian tanaman dibawah kondisi lingkungan yang sesuai termasuk akar, buah, petiole, daun dan bunga. Tanda pertama infeksi, meskipun biasanya tidak terdeteksi, adalah coklat gelap pada batang atau di bawah tanah.
Gejala pertama yang mungkin adalah proses penguningan dan kelayuan pada daun (Gambar 2 A). Gejala berikutnya (Gambar 2 B) terlihat lapisan putih atau benang
Gambar 2. (A) tanaman kedelai yang terserang S. rolfsii (B) tanah di sekitar perakaran tanaman terserang.
Penyakit ini sering juga disebut sebagai busuk pangkal batang atau busuk Sclerotium. S. rolfsii dapat menyerang kecambah atau semai dan menyebabkan penyakit semai (damping off). Dalam keadaan sangat lembab jamur juga dapat
menyerang daun, tangkai, dan polong. Tanaman yang berumur 2-3 minggu paling rentan terhadap S. rolfsii (Semangun, 2004).
Pengendalian Penyakit
Pengendalian penyakit S. rolfsii dapat dilakukan dengan beberapa cara diantaranya memecahkan masalah lahan, pergiliran tanaman dengan jagung, padi,
dan tanaman graminae lainnya, jangan menutup tanah dengan sisa tanaman yang sama setelah musim tanam, memperhatikan keberadaan gulma pada musim tanam, dan penggunaan fungisida yang berformulasi debu (Lucas et al. 1985). Selain
fungisida, Rahaju (2007) menyebutkan bahwa menggunakan mikroba yang bersifat antagonis merupakan salah satu alternatif pengendalian patogen tular
tanah.
Menurut Yusriadi (2004), cara pengendalian biologi perlu dipertimbangkan
untuk menekan perkembangan penyakit layu. Pengendalian penyakit layu dengan menggunakan mikroorganisme belum banyak dilakukan di Indonesia, karena masih terbatasnya mikroorganisme yang berpotensi sebagai agens pengendali
hayati bagi penyakit-penyakit yang bersifat patogen tular tanah. Menurut Cook & Baker (1996), keberhasilan pengendalian hayati sangat ditentukan oleh jenis dan jumlah inokulum antagonis yang diberikan, jenis patogen yang akan dikendalikan, dan faktor lingkungan yang mempengaruhi, serta cara aplikasi ke dalam tanah.
Menurut Pracaya (1991), dalam pengendalian hayati pengertian antagonisme adalah gangguan atau hambatan terhadap proses kehidupan
(pertumbuhan, perbanyakan, infeksi, penyebaran, dan lain-lain) dari suatu organisme (patogen) oleh organisme lain (antagonis). Proses ini dapat terjadi antara organisme dalam satu spesies maupun antar genus dan spesies yang
berbeda.
Mutasi Mikroorganisme
Mutasi merupakan perubahan genetik yang dapat diwariskan dan bagian evolusi yang penting. Apabila perubahan terjadi dalam pertumbuhan normal, perubahan ini disebut mutasi spontan. Skala waktu untuk laju mutasi tidak
dinyatakan dalam satuan jam atau hari melainkan dalam generasi (Pelczar & Chan, 2007).
Sinar Ultra Violet (UV) adalah salah satu penyebab terjadinya mutasi, dimana sinar ini akan melepaskan energi sehingga menyebabkan eksitasi elektron sehingga ion-ion menjadi reaktif dan memungkinkan perubahan susunan kimia
DNA. Mutasi dapat berakibat pada kesalahan menyandi protein dan keadaan ini jika tidak bersifat letal, biasanya menimbulkan penampakan fenotip yang berbeda
Salah satu sifat sinar UV (Gambar 3 B) adalah daya penetrasi yang sangat rendah. Selapis kaca tipis pun sudah mampu menahan sebagian besar sinar UV.
Oleh karena itu, sinar UV hanya dapat efektif untuk mengendalikan mikroorganisme pada permukaan yang terpapar langsung oleh sinar UV, atau mikroba berada di dekat permukaan medium yang transparan (Atlas, 1994).
Gambar 3. Lampu UV yang digunakan selama percobaan berlangsung (A) Lampu UV (B) keadaan lampu UV setelah dihidupkan
Radiasi sinar UV pada proses mutagenesis dapat mengubah patogen menjadi nonpatogenik (Freeman et al. 2002). Mekanisme yang menyebabkan
patogen berubah menjadi nonpatogenik ini, disebabkan oleh adanya perubahan biokimia pada strain nonpatogenik tersebut, yaitu berkurangnya
produksi enzimpektik lyase ekstraseluler, menurunnya aktifitas
polygalacturonase, dan terjadinya defisiensi sekresi enzim ekstraseluler (Yamaguchi et al. 1992).
Radiasi UV dapat dibagi menjadi panjang gelombang berkisar
380–200 nm dan UV vakum dengan panjang gelombang berkisar 200–10 nm. Tingkat inaktifasi mikroorganisme sangat tergantung pada dosis UV yang
digunakan. Kinetika inaktifasi mikroorganisme pada desinfeksi menggunakan UV mengikuti hukum Chick, pada persamaan berikut:
A
N = No . e Dengan:
-k.I.t
N = jumlah mikroorganisme setelah dipapari UV pada waktu pemaparan (t) No = jumlah mikroorganisme awal (t=0)
k = koef. Tingkat inaktifasi mikroorganisme selama waktu tertentu (tergantung pada faktor kualitas air)
I = intensitas UV
Bryan et al. 1992; White, 1992; USEPA, 1996; dalam Cahyonugroho, 2010, memodifikasi persamaan tersebut menjadi persamaan berikut:
In N/No = -k.I.t
Tanda negatif pada persamaan tersebut mengindikasi adanya penurunan
dari jumlah mikroorganisme setelah waktu tertentu. Berdasarkan persamaan hukum Chick, maka jumlah mikroorganisme yang tersisa dapat dihitung sebagai fungsi dosis dan waktu pemaparan (Susanti et al. 2009).
Sadana et al. (1979) melaporkan dalam penelitiannya bahwa pemaparan irradiasi UV selama 20 menit terhadap isolat S. rolfsii berpengaruh terhadap
kecepatan pertumbuhan dari isolat mutan yang terbentuk jika dibandingkan dengan tetuanya.
Susanti et al. (2009), melaporkan dalam penelitiannya terhadap isolat Fusarium oxysporum f.sp lycopersici yang telah dimutasi memiliki kemampuan
dan ketahanan untuk mentoleransi pengaruh-pengaruh yang bersifat
merugikan menyebabkan beberapa konidia jamur dapat tetap ditumbuhkan
pada media biakan. Selain itu, terjadi perubahan pigmen dari strain F. oxysporum f.sp lycopersici bersifat genetis sehingga secara konsisten
diturunkan ke keturunannya, dan ada yang bersifat sementara. Perubahan pigmen yang bersifat sementara ini mungkin hanya disebabkan oleh kerusakan pigmen
keturunannya. Selain itu pada salah satu isolat, kembalinya warna pigmen ini mungkin disebabkan jamur tersebut karena memiliki kemampuan untuk
memperbaiki kerusakan yang disebabkan oleh sinar UV. Selanjutnya pada pengujian patogenesitas F. oxysporum f.sp lycopersici, isolat-isolat yang diinokulasikan pada tanaman tomat baik dengan cara perendaman akar tanaman
tomat atau pencampuran pada media tanam, menunjukkan adanya perubahan tingkat patogenesitas yang berbeda. Berdasarkan hasil tersebut, hanya dua isolat
yang masih tetap bersifat patogenik, sedangkan isolat-isolat lainnya mengalami kehilangan patogenesitasnya. Day (1974), dalam penelitiannya diperoleh informasi bahwa mutanPenicillium expansum dan F. oxysporum f. sp. lycopersici
METODOLOGI PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian Universitas Sumatera Utara,
pada ketinggian tempat ± 25 meter dpl (di atas permukaan laut) pada bulan
September sampai November 2012. Bahan dan Alat
Bahan
Adapun bahan yang digunakan dalam melaksanakan penelitian ini adalah,
aquades, Media Potato Dextrose Agar (PDA), tanaman kedelai yang terserang
S. rolfsii, benih kedelai varietas Anjasmoro, cling wrap, kapas, alkohol, air suling steril, spritus, alumunium foil, dan kertas steencil, beras, klorox.
Alat
Adapun alat yang digunakan pada penelitian ini adalah cawan petri, erlemeyer, cutter, handsprayer, batang pengaduk, mikroskop binokuler, autoklaf,
lampu bunsen, timbangan analitik, Laminar Air Flow, lampu UV dengan kriteria
short wave ultraviolet (Model EVF-240C/F, 230 VOLTS, 50 HZ 17 AMPS) 15 watt panjang gelombang 254 nm, tabung reaksi, polibeg, inkubator, oven, hot plate, mikropipet, pipet ukur, mortar, pestel, beaker glass, jarum inokulum,
pinset, glass root (batang L), kotak peletakan UV, jangka sorong.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL)
Isolat Mutan (M) : M0 M
: Kontrol (Tanpa Pemaparan)
1 M
: Pemaparan selama 5 menit
2 M
: Pemaparan selama 10 menit
3 M
: Pemaparan selama 15 menit
4 M
: Pemaparan selama 20 menit
5 M
: Pemaparan selama 25 menit
6
Dengan jumlah ulangan diperoleh dengan menggunakan rumus =
: Pemaparan selama 30 menit
(t-1)r ≥ 15
Ulangan yang digunakan adalah sebanyak 3 ulangan, Total unit percobaan : 21 Percobaan
Bagan penelitian yang dilaksanakan adalah sebagai berikut:
Data hasil penelitian dianalisis menggunakan sidik ragam dengan model linier sebagai berikut :
Yij Dimana :
= µ + αi + ∑ij
Yij
µ = efek nilai
= Respon atau nilai pengamatan pada perlakuan ke-i dan kelompok ke-j
αi = efek blok dari taraf ke-i
∑ij = efek error
(Sastrosupadi, 2000).
Pelaksanaan Penelitian
1. Pembuatan Media PDA
Kentang 250 g dipotong dadu kecil kemudian direbus dalam 1 liter air.
Setelah air mendidih dan kentang matang, disaring dan diambil air saringannya. Selanjutnya dekstrosa 20 g dan agar 20 g dimasukkan dalam air hasil saringan. Dipanaskan lagi sampai agar larut dan homogen. Setelah mendidih disaring dan
ditambah air sampai volume akhir 1 liter, dimasukkan dalam erlemeyer kemudian disumbat kapas dan ditutup dengan alumunium foil, disterilkan dengan autoclave pada suhu 121°C dengan tekanan 15 psi selama 15 menit (Nasikhah, 2008).
2. Penyediaan Sumber Inokulum a. Isolat TipeLiar S. rolfsii
Isolat tipe liar S. rolfsii diisolasi dari perakaran atau pangkal batang
tanaman kedelai yang terinfeksi S. rolfsii. Bagian tanaman tersebut didisinfeksi
PDA. Selanjutnya biakan diinkubasi selama 5 hari pada suhu kamar. Jamur yang tumbuh diamati secara makroskopis dan mikroskopis. Hasil pengamatan
diidentifikasi berdasarkan deskripsi yang dikemukakan oleh Barnett dan Hunter (1972). Biakan murni hasil isolasi jamur S. rolfsiidiperbanyak dalam Media PDA dan diinkubasi pada suhu kamar selama 5 hari (Astiko et al. 2009).
b. Isolat Mutan S. rolfsii
Disediakan 8-10 sklerotia, lalu digerus dengan menggunakan mortar dan
pestel steril kemudian ditambahkan 2 ml air steril. Selanjutnya 1 ml suspensi sklerotia yang telah digerus dimasukkan ke dalam tabung reaksi berisi 9 ml air steril. Setelah dilakukan pengenceran 10-1, diambil suspensi sklerotia sebanyak
0,1 ml kemudian dituang dan diratakan di seluruh permukaan Media PDA. Selanjutnya Media PDA tersebut dipaparkan terhadap radiasi lampu UV 15 W
dengan panjang gelombang 254 nm dengan waktu pemaparan sesuai perlakuan. Jarak antara sklerotia yang diradiasi dengan lampu UV adalah 20 cm. Setelah irradiasi dengan sinar UV, sklerotia tersebut diinkubasi selama 48 jam dengan
suhu 30°
3. Uji Antagonisme Isolat Mutan S. rolfsii Terhadap Isolat Tipe Liar
S. rolfsiidi Laboratorium
C, setelah itu diamati bentuk morfologi dari isolat mutan yang terbentuk (Sadana et al. 1979).
Pengujian kemampuan penghambatan isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsiidilakukan pada cawan petri diameter 9 cm yang telah diisi Media PDA. Selanjutnya isolat mutan S. rolfsii ditanam pada sisi kiri media
biakan, sedangkan isolat liar S. rolfsii ditanam di tengah. Selanjutnya pertumbuhan dari kedua jamur tersebut diamati mulai 3 hari setelah inokulasi (hsi)
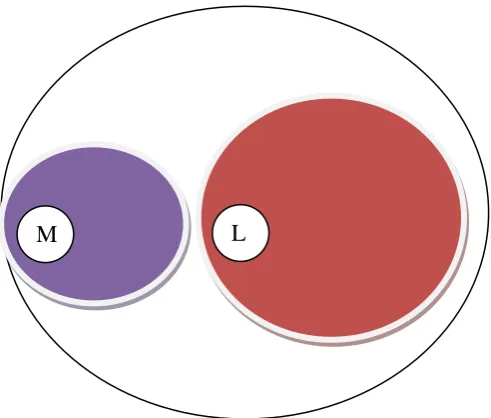
Gambar 4. Bagan peletakan kedua isolat dalam cawan petri dengan metode dual culture
Keterangan:
M = isolat mutan S. rolfsii L = tipe liar S. rolfsii
4. Uji Patogenesitas Isolat Mutan S. rolfsii a. Persiapan Media Tanam
Media tanam yang digunakan adalah tanah ultisol yang telah disterilisasi lalu dimasukkan ke dalam polibeg ukuran ¼ kg.
b. Penanaman Benih Kedelai
Pada setiap polibeg ditanam 2 benih kedelai dengan 3 ulangan.
Selanjutnya dipilih 1 tanaman yang paling sehat untuk diinokulasi isolat mutan S. rolfsii.
c. Perbanyakan Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii diperbanyak dengan cara diinokulasi pada media beras 10 g steril (Lampiran 31). Kemudian biakan diinkubasi selama 7 hari pada
suhu kamar. Selanjutnya biakan siap diaplikasikan ke tanaman kedelai setelah media beras ditumbuhi isolat mutan S. rolfsii (Nasikhah, 2008).
d. Inokulasi Isolat Mutan S. rolfsii
Inokulasi isolat mutan S. rolfsii dilakukan setelah tanaman kedelai
berumur 2 Minggu di sekitar perakaran dan pangkal batang tanaman
(Astiko et al. 2009).
Peubah Amatan
1. Kemampuan Antagonis Isolat Mutan S. rolfsii Terhadap Isolat Tipe Liar S. rolfsii
Pengamatan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar dilakukan dengan mengukur daerah hambatan yang dihasilkan isolat
mutan S. rolfsii terhadap isolat tipe liar S. rolfsii. Persentase hambatan pertumbuhan (%) diamati pada umur 3 hsi sampai pertumbuhan koloni memenuhi cawan petri dengan menggunakan rumus:
R1 – R
= jari-jari isolat tipe liar yang menjauhi isolat mutan S. rolfsii 2 = jari-jari isolat tipe liar yang mendekati isolat mutan S. rolfsii (Fokkema, 1976 dalam Rahaju, 2007).
2. Morfologi Isolat Mutan S. rolfsii
Pengamatan morfologi dari isolat mutan S. rolfsii diamati setelah suspensi
gerusan sklerotia yang diirradiasi sinar UV diinkubasi selama 48 jam (2 hsi). Pengamatan dilakukan secara makroskopis dan mikroskopis. Secara makroskopis
meliputi warna, bentuk, kerapatan koloni serta jenis miselium dan hifa. Secara mikroskopis, dilakukan pengamatan hifa dan miselium dari isolat mutan S. rolfsii
3. Diameter Koloni Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii dibiakkan dengan metode one point (satu titik) pada
media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran diameter koloni isolat mutan S. rolfsii mulai dari 1-3 hsi, dengan cara
mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan koloni tersebut. Perhitungan diameter koloni dilakukan dengan menggunakan jangka sorong.
4. Pengaruh Isolat Mutan S. rolfsii Terhadap Diameter Koloni Isolat Tipe Liar S. rolfsii
Isolat mutan S. rolfsii dan isolat tipe liar S. rolfsii dibiakkan dengan
metode two point (dua titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran diameter koloni isolat tipe liar S. rolfsii
mulai dari 1-4 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola
perkembangan koloni tersebut. Perhitungan diameter koloni dilakukan dengan menggunakan jangka sorong.
5. Luas Pertumbuhan Koloni Isolat Mutan S. rolfsii
Isolat mutan S. rolfsii dibiakkan dengan metode one point (satu titik) pada
media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran luas pertumbuhan koloni isolat mutan S. rolfsii mulai dari 1-3 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri
menggunakan plastik transparan lalu digambar mengikuti pola perkembangan
6. Pengaruh Isolat Mutan S. rolfsii Terhadap Luas Pertumbuhan Koloni Isolat Tipe Liar S. rolfsii
Isolat mutan S. rolfsii dan isolat tipe liar S. rolfsii dibiakkan dengan
metode two point (dua titik) pada media PDA di cawan petri berdiameter 9 cm volume 20 ml/petri, dilakukan pengukuran luas pertumbuhan koloni isolat tipe liar S. rolfsii mulai dari 1-4 hsi, dengan cara mempolakan bentuk perkembangan koloni pada cawan petri menggunakan plastik transparan lalu digambar mengikuti pola perkembangan koloni tersebut. Perhitungan luas pertumbuhan koloni dengan
menggunakan leaf area meter.
7. Jumlah Sklerotia dari Isolat Mutan S. rolfsii
Jumlah sklerotia dari isolat mutan S. rolfsii diamati mulai 1 minggu setelah
inokulasi (msi) hingga 4 msi.
8. Pengaruh Isolat Mutan S. rolfsii Terhadap Jumlah Sklerotia Isolat Tipe Liar S. rolfsii
Pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia dari isolat tipe liar S. rolfsii diamati mulai 1-4 msi.
9. Patogenesitas Isolat Mutan S. rolfsii
Pengamatan terhadap patogenesitas dari isolat mutan S. rolfsii diamati tiap hari. Tanaman yang menunjukkan gejala kelayuan (terserang) dinilai berdasarkan
skala di bawah ini:
Skala 1 = tidak ada gejala kelayuan
Skala 2 = sebagian daun layu (ringan) Skala 3 = secara umum daun layu (sedang) Skala 4 = layu permanen
Keparahan penyakit isolat mutan S. rolfsii dihitung berdasarkan nilai skala yang diperoleh dengan menggunakan rumus yang digunakan oleh Direktorat
Perlindungan Tanaman, Direktorat Jenderal Produksi Tanaman Pangan (2000) sbb:
∑ (ni x vi
KP = --- x 100 % )
Z x N Keterangan :
KP = Keparahan Penyakit
ni = Jumlah tanaman atau bagian tanaman contoh dengan skala kerusakan v
v
i i
N = Jumlah tanaman atau bagian tanaman contoh yang diamati = Nilai skala kerusakan contoh ke-i
HASIL DAN PEMBAHASAN
1. Kemampuan Antagonis Isolat Mutan S. rolfsii Terhadap Isolat Tipe Liar S. rolfsii
Analisis sidik ragam kemampuan antagonis isolat mutan S. rolfsii terhadap
isolat tipe liar S. rolfsii dapat dilihat pada Tabel 1 (Lampiran 2-3).
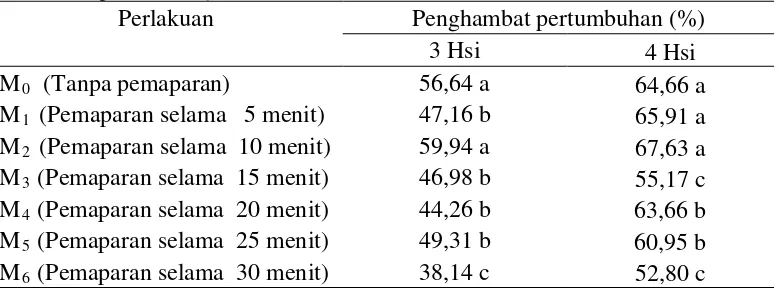
Tabel 1. Beda uji rataan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii
Perlakuan Penghambat pertumbuhan (%)
3 Hsi 4 Hsi
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Hsi = Hari setelah inokulasi
Tabel 1 menunjukkan bahwa kemampuan antagonis tertinggi terdapat pada
perlakuan M2 (pemaparan 10 menit) sebesar 59,94% (3 hsi pada Gambar 6 B) dan 67,63 % (4 hsi) yang diikuti perlakuan M1 (pemaparan 5 menit) dan M0 (tanpa
pemaparan). Sedangkan kemampuan antagonis terendah terdapat pada perlakuan M6 (pemaparan 30 menit) sebesar 38,14 % (3 hsi pada Gambar 6 A) dan 52,80 % (4 hsi). Hal ini menunjukkan bahwa waktu pemaparan UV berpengaruh terhadap
0 UV dalam menginduksi perubahan secara genetis pada patogen, sehingga dapat mengubah patogen menjadi nonpatogenik.
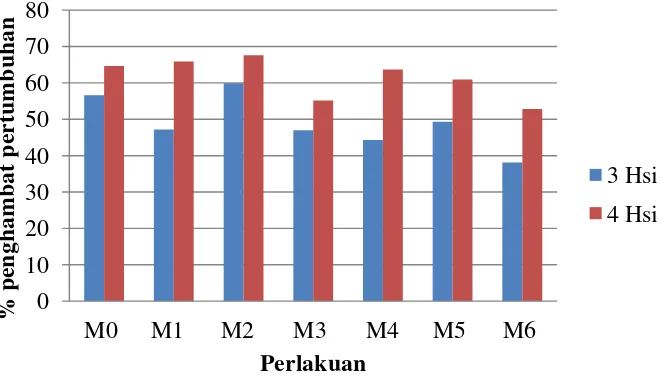
Gambar 5. Histogram beda uji rataan kemampuan antagonis isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii
Pada 3 hsi (Gambar 5) diketahui bahwa kemampuan antagonis dari perlakuan M6 (pemaparan 30 menit) (38,14 %) berbeda sangat nyata dalam menghambat pertumbuhan isolat tipe liar S. rolfsii dibandingkan semua perlakuan.
Pada 4 hsi, perlakuan M0 (tanpa pemaparan), M1 (pemaparan 5 menit) dan M2 (pemaparan 10 menit) berbeda nyata dengan perlakuan lainnya. Hal ini
mengindikasikan bahwa penetrasi sinar UV terhadap isolat S. rolfsii menyebabkan pertumbuhan yang relatif kurang stabil sehingga berpengaruh terhadap kemampuan antagonis dari masing-masing isolat. Selain itu, S. rolfsii yang dipapari dengan waktu yang lebih singkat, mampu menghambat pertumbuhan tipe liarnya (pemaparan 5 dan 10 menit) dan tidak berbeda nyata
dengan perlakuan M0 (tanpa pemaparan). Hal ini menunjukkan bahwa isolat tipe liar S. rolfsii memiliki kemampuan untuk memberikan hambatan pertumbuhan
terhadap sesamanya (satu species) dalam hal perebutan nutrisi dan ruang tumbuh.
dipapari selama 5 dan 10 menit dalam menekan populasi atau aktifitas dari S. rolfsii berupa kompetisi. Pracaya (1991), menyebutkan bahwa dalam
pengendalian hayati pengertian antagonisme adalah gangguan atau hambatan terhadap proses kehidupan (pertumbuhan, perbanyakan, infeksi, penyebaran, dan lain-lain) dari suatu organisme (patogen) oleh organisme lain (antagonis). Proses
ini dapat terjadi antara organisme dalam satu spesies maupun antar genus dan spesies yang berbeda.
Gambar 6. Pengujian antagonisme dengan menggunakan metode dual culture pada 3 hsi (A) perlakuan M6 (B) perlakuan M2
Pertemuan miselium antara kedua isolat menghasilkan sebuah perkawinan
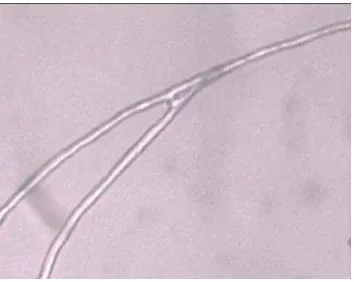
(mating type). Mating type merupakan perkawinan secara seksual yang dilakukan oleh S. rolfsii. Menurut Schooley (1997) bahwa perkembangan jamur secara seksual terjadi ketika dengan tipe perkawinan (mating type) yang berbeda
bersentuhan kemudian melebur membentuk zigot. Pengamatan mating type secara mikroskopis dapat dilihat pada Gambar 7.
Gambar 7. Fotomikrograf mating type S. rolfsii perbesaran 1000 x
2. Morfologi Isolat Mutan S. rolfsii a. Makroskopis
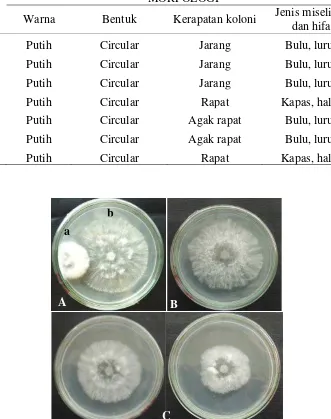
Morfologi isolat mutan S. rolfsii secara makroskopis dapat dilihat pada
Tabel 2 dan Gambar 8.
Tabel 2. Morfologi isolat mutan S. rolfsii secara makroskopis
KODE
MORFOLOGI
Warna Bentuk Kerapatan koloni Jenis miselium dan hifa
M0 Putih Circular Jarang Bulu, lurus
M1 Putih Circular Jarang Bulu, lurus
M2 Putih Circular Jarang Bulu, lurus
M3 Putih Circular Rapat Kapas, halus
M4 Putih Circular Agak rapat Bulu, lurus
M5 Putih Circular Agak rapat Bulu, lurus
M6 Putih Circular Rapat Kapas, halus
Gambar 8. Biakan isolat S. rolfsii 3 hsi (A) Perlakuan M6 dengan metode dual culture
(B) biakan M0 (C) biakan M6 (kanan) dan biakan M3 (kiri) (a) isolat mutan S. rolfsii (b) isolat liar S. rolfsii
a
A B
C
Tabel 2 dan Gambar 8 A menunjukkan perbedaan morfologi antara isolat mutan S. rolfsii (Gambar 8 A.a) dengan isolat tipe liar S. rolfsii (Gambar 8 A.b).
Perlakuan M3 dan M6 (pemaparan 15 dan 30 menit) koloni lebih rapat (Gambar 8 C) dibandingkan koloni tipe liarnya (Gambar 8 B). Kerapatan koloni
pada perlakuan M4 dan M5 (pemaparan 20 dan 25 menit) agak rapat
dibandingkan koloni perlakuan M0, M1 dan M2
Pengamatan jenis miselium dan hifa yang terbentuk juga mengalami
perubahan pada perlakuan M
(tanpa pemaparan, pemaparan 5 dan 10 menit). Sadana et al. (1979) melaporkan bahwa irradiasi UV selama 20 menit terhadap S. rolfsii berpengaruh terhadap kerapatan koloni menjadi
lebih rapat dibandingkan dengan tetuanya.
3 dan M6
Irradiasi UV tidak berpengaruh terhadap warna serta bentuk koloni dari
isolat mutan. Hal ini terjadi karena irradiasi UV merusak pada bagian sel-sel tertentu dan tidak semua sel dirusak. Sel yang dirusak akan mengalami perubahan
genetik dari tetuanya. Atlas (1994) menyebutkan bahwa
(pemaparan 15 dan 30 menit). Jenis miselium dari kedua perlakuan ini terbentuk seperti kapas dengan hifa yang
menggumpal dan halus (Gambar 8 A.a). Sementara jenis miselium yang terbentuk pada perlakuan lainnya seperti bulu dengan hifa lurus (Gambar 8 A.b). Penentuan jenis miselium dan hifa yang terbentuk ini sesuai Fichtner (2006) yang
menyebutkan pada dasarnya ada dua jenis hifa yang dihasilkan S. rolfsii yaitu
kasar dan lurus yang didukung dengan Semangun (2004) yang menyatakan bahwa S. rolfsii mempunyai miselium yang terdiri dari benang-benang berwarna putih,
tersusun seperti bulu dan kapas.
menjadi reaktif dan memungkinkan perubahan susunan kimia DNA. Absorbsi maksimal sinar UV di dalam sel terjadi pada asam nukleat, maka diperkirakan
mekanisme utama perusakan sel oleh sinar UV pada ribosom, sehingga mengakibatkan terjadinya mutasi atau kematian sel.
b. Mikroskopis
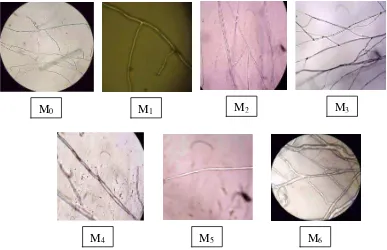
Secara mikroskopis, morfologi semua isolat mutan S. rolfsii tidak berbeda nyata terhadap tipe liarnya atau dengan kata lain irradiasi UV tidak merubah morfologi mikroskopis S. rolfsii (Gambar 9).
Gambar 9. Fotomikrograf isolat mutan S. rolfsii dari kiri ke kanan (isolat tipe liar, pemaparan 5, 10, 15, 20, 25, 30 menit) perbesaran 1000 x
Gambar 9 menunjukkan bahwa isolat mutan S. rolfsii tidak mengalami perubahan morfologi baik hifa maupun miseliumnya. S. rolfsii merupakan jamur
yang dalam perkembangbiakannya tidak membentuk spora, akan tetapi dilakukan secara seksual dengan bantuan miselium dan hifa aktif yang terdapat di bagian
dalam sklerotia. Sehingga sklerotia merupakan bahan pemencaran dan pertahanan diri S. rolfsii untuk tetap dapat bertahan hidup di alam dengan keunggulan sifatnya
M6 M5
M4
M2 M1
yang mampu bertahan dalam tanah selama ± 1 tahun. Miselium tersebut dibagi oleh beberapa dinding melintang (septa) setiap segmen menjadi hifa inti. Pertumbuhan miselium terjadi pada ujung hifa. Sesuai Punja & Rahe (2001)
bahwa untuk menjaga struktur pelindung, sklerotia terdiri dari hifa yang aktif dan menjadi inokulum pertama untuk perkembangan penyakit. Suhu optimum untuk
pertumbuhan sklerotia adalah 27-30° C dan tidak aktif pada suhu dibawah 0° 3. Diameter Koloni Isolat Mutan S. rolfsii
C.
Analisis sidik ragam rataan diameter koloni isolat mutan S. rolfsii dapat dilihat pada Tabel 3 (Lampiran 4-6).
Tabel 3. Beda uji rataan diameter koloni isolat mutan S. rolfsii
Perlakuan Diameter koloni (cm)
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Hsi = Hari setelah inokulasi
Pada 1-2 hsi, diameter koloni isolat mutan relatif tidak stabil dengan pertumbuhan yang bersifat random dan tidak linear. Hal ini disebabkan karena setiap isolat S. rolfsii memiliki ketahanan dan respon yang berbeda dalam
mentoleransi pengaruh yang disebabkan penetrasi sinar UV. Namun, Pada 3 hsi pertumbuhan dari setiap isolat mulai stabil. Perlakuan M6 (pemaparan 30 menit)
mutan. Sebagaimana disebutkan oleh Sadana et al. (1979) bahwa irradiasi UV selama 20 menit terhadap isolat S. rolfsii berpengaruh terhadap kecepatan
pertumbuhan dari isolat mutan menjadi lebih lambat dibandingkan dengan tetuanya.
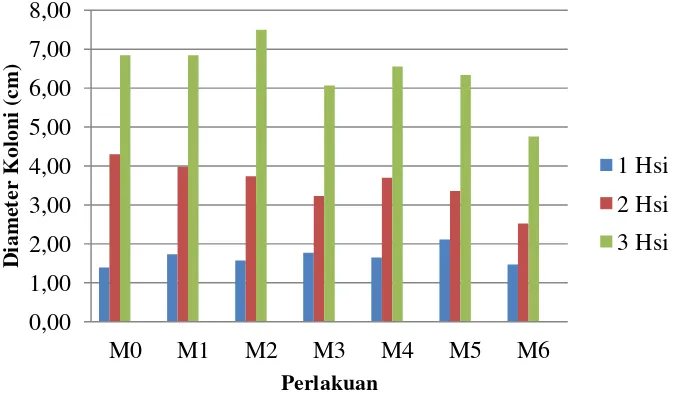
Gambar 10. Histogram beda uji rataan diameter koloni isolat mutan S. rolfsii
Gambar 10 dan Tabel 3 menunjukkan bahwa diameter koloni isolat
mutan S. rolfsii tertinggi terdapat pada perlakuan M2 (pemaparan 10 menit) sebesar 7,50 cm (pada 3 hsi) (Lampiran 38). Rataan diameter koloni isolat mutan S. rolfsii terendah perlakuan terendah terdapat pada perlakuan M6
(pemaparan 30 menit) sebesar 4,76 cm (3 hsi) (Gambar 8 C kanan). Isolat S. rolfsii yang dipapari dengan waktu yang lebih singkat (5 dan 10 menit) menunjukkan pertumbuhan
yang tidak berbeda nyata dengan isolat tipe liar (tanpa pemaparan), sehingga diasumsikan bahwa isolat tersebut mampu mentoleransi adanya pengaruh buruk
yang diakibatkan oleh irradiasi UV.
i i i i 4. Pengaruh Isolat Mutan S. rolfsii Terhadap Diameter Koloni Isolat
Tipe Liar S. rolfsii
Analisis sidik ragam rataan pengaruh isolat mutan S. rolfsii terhadap
diameter koloni isolat tipe liar S. rolfsii dapat dilihat pada Tabel 4 (Lampiran 7-10).
Tabel 4. Beda uji rataan pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat tipe liar S. rolfsii
Perlakuan Diameter Koloni Isolat Liar (cm) 1 Hsi 2 Hsi 3 Hsi 4 Hsi
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Hsi = Hari setelah inokulasi
Pada 1-2 hsi, Tabel 4 menunjukkan bahwa isolat mutan S. rolfsii tidak berpengaruh terhadap isolat tipe liar S. rolfsii dikarenakan belum terjadi
pertemuan miselium antara kedua isolat. Namun kecepatan tumbuh dari setiap
perlakuan menunjukkan perbedaan yang nyata. Pada 3 hsi, perlakuan
M2
Pada 4 Hsi, pertumbuhan koloni kedua isolat telah memenuhi cawan petri. Perlakuan M
(4,33 cm) (pemaparan 10 menit) berbeda sangat nyata dengan semua perlakuan. Miselium antara isolat mutan S. rolfsii dan isolat tipe liar S. rolfsii telah bertemu. Hal ini mengindikasikan bahwa pertumbuhan isolat mutan S. rolfsii
yang dipapari UV selama 10 menit berpengaruh dalam menghambat pertumbuhan isolat liar S. rolfsii dalam hal perebutan ruang dan nutrisi.
0,00 pemaparan). Hal ini mengindikasikan bahwa pertumbuhan dari isolat mutan S. rolfsii dengan pemaparan yang singkat, mempengaruhi diameter koloni isolat tipe liar S. rolfsii. Isolat liar M0
(tanpa pemaparan) diketahui memiliki pertumbuhan yang cepat sehingga mampu bersaing dengan sesamanya. Kompetisi yang terjadi adalah perebutan ruang tumbuh, nutrisi, dan bahan lainnya yang dibutuhkan kedua
isolat. Sesuai Pracaya (1991), menyebutkan bahwa dalam pengendalian hayati pengertian antagonisme adalah gangguan atau hambatan terhadap proses
kehidupan (pertumbuhan, perbanyakan, infeksi, penyebaran, dan lain-lain) dari suatu organisme (patogen) oleh organisme lain (antagonis). Proses ini dapat terjadi antara organisme dalam satu spesies maupun antar genus dan spesies yang
berbeda.
Gambar 11. Histogram beda uji rataan pengaruh isolat mutan S. rolfsii terhadap diameter koloni isolat tipe liar S. rolfsii
Diameter koloni isolat tipe liar S. rolfsii tertinggi terdapat pada perlakuan M6 (pemaparan 30 menit) sebesar 6,39 cm dan terendah terdapat pada perlakuan M2 (pemaparan 10 menit) sebesar 5,39 cm. Isolat S. rolfsii yang dipapari UV selama 30 menit menyebabkan pertumbuhan isolat semakin lambat sehingga
Susanti et al. (2009) menyatakan bahwa tingkat inaktifasi mikroorganisme sangat tergantung pada dosis UV yang digunakan. Sadana et al. (1979) menyebutkan bahwa bahwa irradiasi UV selama 20 menit terhadap isolat S. rolfsii berpengaruh
terhadap kecepatan pertumbuhan dari isolat mutan menjadi lebih lambat dibandingkan dengan tetuanya.
5. Luas Pertumbuhan Koloni Isolat Mutan S. rolfsii
Berdasarkan analisis sidik ragam menunjukkan bahwa rataan luas
pertumbuhan koloni isolat mutan S. rolfsii dapat dilihat pada Tabel 5 (Lampiran 11-13).
Tabel 5. Beda uji rataan luas pertumbuhan koloni isolat mutan S. rolfsii
Perlakuan Luas pertumbuhan koloni (cm 2
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Hsi = Hari setelah inokulasi
Luas pertumbuhan koloni isolat mutan S. rolfsii sejalan dengan
pertumbuhan diameter koloni S. rolfsii. Pada 1 hsi, luas pertumbuhan koloni isolat mutan S. rolfsii pada perlakuan M5 (4,15 cm2) (pemaparan 25 menit) dan M3 (3,42 cm2) berbeda nyata dibandingkan perlakuan lainnya karena
pertumbuhannya yang lebih cepat dan lebar. Pada 2-3 hsi, perlakuan M6 (6,10 cm2) (pemaparan 30 menit) berbeda sangat nyata dengan semua perlakuan
menurunkan kecepatan pertumbuhan dari isolat tersebut sehingga luas pertumbuhannya lebih rendah dibandingkan dengan pemaparan UV dengan waktu
yang lebih singkat.
Luas pertumbuhan koloni isolat mutan S. rolfsii tertinggi terdapat pada perlakuan M2 (pemaparan 10 menit) sebesar 45,12 cm2 (3 hsi) (Lampiran 38).
Luas pertumbuhan koloni isolat mutan S. rolfsii terendah terdapat pada perlakuan M6 (pemaparan 30 menit) sebesar 18,54 cm2
6. Pengaruh Isolat Mutan S. rolfsii Terhadap Luas Pertumbuhan Koloni Isolat Tipe Liar S. rolfsii
(3 hsi).
Berdasarkan analisis sidik ragam menunjukkan bahwa rataan pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii
dapat dilihat pada Tabel 6 (Lampiran 14-17).
Tabel 6. Beda uji rataan pengaruh isolat mutan S. rolfsii terhadap luas pertumbuhan koloni isolat tipe liar S. rolfsii
Perlakuan Luas pertumbuhan koloni (cm 2
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Hsi = Hari setelah inokulasi
Pada 1-2 hsi (Tabel 6), isolat mutan S. rolfsii tidak berpengaruh terhadap isolat tipe liar S. rolfsii dikarenakan belum terjadi pertemuan miselium antara
kedua isolat. Namun luas pertumbuhan dari setiap perlakuan menunjukkan
0,00 perlakuan lainnya tetapi tidak berbeda nyata dengan M0 (tanpa pemaparan). Sementara pada 4 hsi, perlakuan M2 (pemaparan 10 menit) berbeda sangat nyata dengan semua perlakuan. Hal ini menunjukkan bahwa isolat S. rolfsii yang
dipapari UV selama 10 menit memiliki kemampuan dalam menghambat pertumbuhan isolat tipe liar S. rolfsii dalam hal perebutan ruang tumbuh dan
nutrisi. Sementara perlakuan lainnya dengan waktu pemaparan UV lebih lama, pertumbuhannya lebih lambat sehingga kurang mampu bersaing dengan isolat tipe
liar S. rolfsii dalam memperebutkan ruang tumbuh dan nutrisi. Meskipun demikian, isolat mutan S. rolfsii tersebut masih mampu untuk tumbuh di media biakan walaupun terhambat oleh pertumbuhan isolat tipe liarnya. Sebagaimana
dalam penelitian Susanti et al. (2009) menyebutkan bahwa dari jamur F. oxysporum f.sp lycopersici yang telah dimutasi memiliki kemampuan dan
ketahanan untuk mentoleransi pengaruh-pengaruh yang bersifat merugikan menyebabkan beberapa konidia jamur dapat tetap ditumbuhkan pada media biakan.
Isolat S. rolfsii yang dipapari UV selama 10 menit (Gambar 6 B) paling efektif mempengaruhi pertumbuhan koloni dari isolat tipe liar S. rolfsii yang
mengakibatkan luas pertumbuhannya hanya sebesar 31,54 cm2 (4 hsi). Sementara isolat S. rolfsii yang dipapari UV selama 30 menit (Gambar 6 A) kurang efektif mempengaruhi pertumbuhan koloni dari isolat tipe liar S. rolfsii sehingga
pertumbuhan dari liarnya relatif cepat dengan luas pertumbuhan sebesar 53,51 cm2
7. Jumlah Sklerotia dari Isolat Mutan S. rolfsii
(4 hsi). Hal ini disebabkan irradiasi UV terhadap isolat S. rolfsii mengalami perubahan yang bersifat genetis. Hut et al. (2008) menyebutkan bahwa mutasi
dapat berakibat pada kesalahan menyandi protein dan keadaan ini jika tidak bersifat letal, biasanya menimbulkan penampakan fenotip yang berbeda dari
keadaan normalnya. Karena merupakan perubahan pada materi genetik, maka mutasi diwariskan pada keturunannya.
Berdasarkan analisis sidik ragam, beda uji rataan jumlah sklerotia dari isolat mutan S. rolfsii dapat dilihat pada Tabel 7 (Lampiran 18-21).
Tabel 7. Beda uji rataan jumlah sklerotia dari isolat mutan S. rolfsii
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Msi = Minggu setelah inokulasi Perlakuan Jumlah sklerotia
1 Msi 2 Msi 3 Msi 4 Msi
0,00 Tabel 7 menunjukkan bahwa pada 1-4 msi, perlakuan M6 (pemaparan 30 menit) berbeda sangat nyata terhadap perlakuan lainnya sekaligus sebagai rataan
tertinggi dengan rataan jumlah sklerotia dari isolat mutan S. rolfsii sebesar
244 sklerotia. Rataan jumlah sklerotia dari isolat mutan S. rolfsii terendah terdapat pada perlakuan M1 (pemaparan 5 menit)
Grafik histogram jumlah sklerotia dari isolat mutan S. rolfsii dapat dilihat pada Gambar 13.
sebesar 28,33 sklerotia.
Gambar 13. Histogram jumlah sklerotia dari isolat mutan S. rolfsii
Sklerotia merupakan bahan perbanyakan, pemencaran, sekaligus sebagai
pertahanan diri dari S. rolfsii dalam kondisi tertekan atau kurang menguntungkan baggi pertumbuhannya. Namun pemaparan UV selama 30 menit secara signifikan
merangsang pembentukan sklerotia menjadi lebih cepat dan banyak di bandingkan dengan pemaparan yang lebih singkat. Hal ini mungkin disebabkan adanya mekanisme perubahan biokimia yang bersifat genetis, yang menyebabkan
terjadinya perubahan materi genetik yang dikandung oleh S. rolfsii yang berdampak pada pembentukan sklerotia. Radiasi sinar UV ini dilaporkan
0,00 atau bahkan keseluruhan sel dari isolat yang tekena paparan sinar UV. Sesuai dengan Freeman et al. (2002) yang menyatakan bahwa pengaruh radiasi sinar UV ini pada proses mutagenesis disebabkan oleh kemampuan sinar UV dalam menginduksi perubahan secara genetis pada patogen.
8. Pengaruh Isolat Mutan S. rolfsii Terhadap Jumlah Sklerotia Isolat Tipe Liar S. rolfsii
Analisis sidik ragam rataan pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat liar S. rolfsii dapat dilihat pada Tabel 8 (Lampiran 22-25). Tabel 8. Beda uji rataan pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat
liar S. rolfsii
Perlakuan Jumlah sklerotia isolat tipe liar
1 Msi 2 Msi 3 Msi 4 Msi
Keterangan : angka yang diikuti notasi huruf yang berbeda pada kolom yang sama menyatakan berbeda nyata pada uji jarak duncan taraf 5%.
Msi = Minggu setelah inokulasi
Grafik histogram beda uji rataan pengaruh isolat mutan S. rolfsii terhadap jumlah sklerotia isolat tipe liar S. rolfsii dapat dilihat pada Gambar 14.
Tabel 8 dan Gambar 14 diketahui bahwa rataan jumlah sklerotia dari
isolat tipe liar S. rolfsii pada perlakuan M3 (pemaparan 15 menit) dan
M6 (pemaparan 30 menit) berbeda nyata dengan semua perlakuan. Hal ini membuktikan bahwa adanya pengujian antara isolat mutan S. rolfsii terhadap isolat tipe liar S. rolfsii mempengaruhi pembentukan sklerotia yang dilakukan oleh kedua isolat tersebut seperti yang terlihat pada Gambar 15.
Gambar 15. Pembentukan sklerotia pada perlakuan M3 (kiri) dan perlakuan M6 (kanan) pada 4 msi (A) isolat mutan (B) isolat liar
Gambar 15 menunjukkan bahwa akibat adanya pertumbuhan isolat mutan S. rolfsii pada perlakuan M3 (pemaparan 15 menit) dan
M6 (pemaparan 30 menit), berpengaruh terhadap isolat tipe liar S. rolfsii yang tidak mampu membentuk sklerotia (Gambar 14, Gambar 15 dan Tabel 8) menjadi
0,67 sklerotia (M3) dan 0 sklerotia (M6). Sementara pada perlakuan M4 (pemaparan 20 menit) dan M5 (pemaparan 25 menit), pembentukan sklerotia pada isolat mutan tersebut tidak banyak namun kedua isolat mampu
mempengaruhi pembentukan sklerotia tipe liarnya. Hal ini mengindikasikan adanya mekanisme antagonis berupa hiperparasitisme. Isolat mutan S. rolfsii
menjadi memiliki kemampuan untuk merusak lisis miselium atau mendegradasi suatu senyawa dari isolat tipe liar S. rolfsii yang berperan dalam pembentukan
A
sklerotia yang mengakibatkan pembentukan sklerotia pada isolat liar S. rolfsii menjadi sedikit bahkan tidak mampu lagi membentuk sklerotia sebagaimana mestinya. Hut et al. (2008) menyebutkan bahwa mutasi adalah
suatu perubahan pada rangkaian nukleotida dari suatu asam nukleat. Mutasi dapat berakibat pada kesalahan menyandi protein dan keadaan ini jika tidak bersifat
letal, biasanya menimbulkan penampakan fenotip yang berbeda dari keadaan normalnya. Karena merupakan perubahan pada materi genetik, maka mutasi
diwariskan pada keturunannya. Dan dalam keadaan seperti ini diharapkan nantinya isolat mutan dari S. rolfsii yang terbentuk mampu mengendalikan tipe liarnya.
Gambar 16. Pembentukan sklerotia pada perlakuan M1
Gambar 16 menunjukkan bahwa rataan jumlah sklerotia isolat tipe liar S. rolfsii tertinggi terdapat pada perlakuan M1 (pemaparan 5 menit) sebesar 62,00 sklerotia. Isolat mutan S. rolfsii dengan waktu pemaparan UV yang lebih
singkat, hanya mampu bersaing dalam hal perebutan ruang tumbuh dan nutrisi. Namun tidak berpengaruh terhadap pembentukan sklerotia yang dilakukan oleh tipe liarnya yang tidak berbeda nyata terhadap perlakuan M0 (tanpa pemaparan).
Seperti yang dilaporkan Susanti et al. (2009) yakni perubahan pigmen dari strain F. oxysporum f.sp Lycopersici yang telah dipapari UV ada yang bersifat genetis