KARAKTERISASI BAKTERI PENAMBAT NITROGEN DAN
PENGHASIL INDOLE-3-ACETIC ACID SERTA APLIKASINYA
PADA BIBIT KELAPA SAWIT (Elaeis guineensis Jacq.)
ISMI ISTI’ANAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid serta Aplikasinya pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Ismi Isti’anah
RINGKASAN
ISMI ISTI’ANAH. Karakterisasi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid serta Aplikasinya pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh NISA RACHMANIA MUBARIK dan ARIS TJAHJOLEKSONO.
Mikroorganisme tanah memainkan peranan penting dalam menjaga kesuburan tanah sehingga berpotensi untuk dimanfaatkan dalam pertanian yang berkelanjutan. Salah satu mikroorganisme yang dapat dimanfaatkan ialah bakteri penambat nitrogen. Bakteri penambat nitrogen dapat meningkatkan (memperlihatkan efek positif) dalam pertumbuhan tanaman sehingga disebut plant growth promoting rhizobacteria (PGPR). PGPR sering digunakan sebagai inokulan untuk meningkatkan hasil pertanian. Salah satu mekanisme PGPR dalam meningkatkan pertumbuhan tanaman ialah dengan menghasilkan hormon pertumbuhan, yaitu indole-3-acetic acid (IAA). Bakteri penambat nitrogen dan penghasil IAA dapat berasosiasi dengan tanaman sehingga dapat digunakan sebagai pupuk hayati untuk memperbaiki pertumbuhan tanaman. Interaksi antara pupuk hayati dan tanaman bersifat saling menguntungkan, yaitu tanaman mendapatkan tambahan unsur hara yang diperlukan dan mikroorganisme mendapatkan bahan organik untuk aktivitas dan pertumbuhannya.
Aplikasi pupuk hayati pada pembibitan tanaman kelapa sawit (Elaeis guineensis Jacq.) merupakan salah satu upaya untuk membentuk interaksi antara mikroorganisme dan tanaman. Tanaman kelapa sawit merupakan jenis tanaman perkebunan yang memiliki banyak keunggulan. Upaya peningkatan produktivitas tanaman kelapa sawit perlu dilakukan mengingat besarnya prospek kelapa sawit di Indonesia. Penelitian ini bertujuan untuk mengkarakterisasi bakteri penambat nitrogen dan penghasil IAA serta melihat pengaruhnya dalam memacu pertumbuhan bibit kelapa sawit. Metode yang dilakukan meliputi amplifikasi gen 16S rRNA, uji hipersensitivitas pada daun tembakau, analisis IAA meliputi optimasi produksi IAA optimum pada pengukuran pertumbuhan bakteri uji serta pengukuran IAA secara kualitatif dan kuantitatif menggunakan metode kolorimetri dan HPLC, serta aplikasi bakteri penambat nitrogen dan penghasil IAA pada kecambah sawit yang telah pecah masa dormansinya hingga 90 HST.
Amplifikasi gen 16S rRNA pada isolat A13 menghasilkan amplikon berukuran 1300 pb. Analisis 16S rRNA menunjukkan bahwa isolat A13 memiliki kesamaan dengan Pseudochrobactrum asaccharolyticum. Uji hipersensitivitas menunjukkan bahwa isolat A13 dan ITJ7 tidak memperlihatkan gejala hipersensitivitas pada daun tembakau. Selama 48 jam inkubasi, isolat A13 memproduksi IAA maksimum pada jam ke- 24 dan isolat ITJ7 memproduksi IAA maksimum pada jam ke-33. Konsentrasi IAA yang dihasilkan dari metode kolorimetri ialah 93.25 ppm pada isolat A13 dan 76.25 ppm pada isolat ITJ7. Analisis kuantitatif menggunakan metode HPLC menunjukkan bahwa isolat A13 memproduksi IAA sebesar 69.839 ppm dan isolat ITJ7 menghasilkan IAA sebesar 62.720 ppm. Aplikasi isolat A13 dan ITJ7 pada bibit kelapa sawit memberikan pengaruh yang berbeda nyata pada parameter jumlah akar lateral.
SUMMARY
ISMI ISTI’ANAH. Characterization of Nitrogen Fixing and Indole-3-Acetic Acid Producing Bacteria and Its Application on Oil Palm (Elaeis guineensis Jacq.) Seedling. Supervised by NISA RACHMANIA MUBARIK dan ARIS TJAHJOLEKSONO.
Soil microorganisms play an important role in maintaining soil fertility, so they are potential to be used in sustainable agriculture. One of microorganisms that can be used are nitrogen-fixing bacteria. Nitrogen-fixing bacteria can increase (show positive effects) in the growth of the plant, so they are called as plant Interactions between biological fertilizers and plant are mutually beneficial, i.e. plants get extra nutrients and microorganisms required to get organic material to the activity and growth. Bio-fertilizer application on oil palm (Elaeis guineensis Jacq.) seedling is an effort to establish the interaction between microorganisms and plants. Oil palm is one type of plant that has many advantages. Efforts to producing bacteria on oil palm seedling.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KARAKTERISASI BAKTERI PENAMBAT NITROGEN DAN
PENGHASIL INDOLE-3-ACETIC ACID SERTA APLIKASINYA
PADA BIBIT KELAPA SAWIT (Elaeis guineensis Jacq.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2014 ini ialah interaksi mikrob dengan tanaman, dengan judul Karakterisasi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid serta Aplikasinya pada Bibit Kelapa Sawit (Elaeis guineensis Jacq.).
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Racmania Mubarik, MSi dan Bapak Dr Aris Tjahjoleksono, DEA selaku pembimbing atas ilmu, kebaikan, dan kesabaran dalam memberikan bimbingan pada penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini, serta Ibu Dr. Alina Akhdiya, MSi sebagai penguji luar komisi atas saran dan diskusi yang diberikan. Terima kasih atas hibah penelitian unggulan perguruan tinggi (PUPT) tahun 2015 a.n. Dr Nisa Rachmania Mubarik MSi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Tak lupa juga penulis ucapkan terima kasih kepada Mita, Kak Fifiq, Kak Feni, Kak Wahyu, dan Kak Gesty atas do’a dan semangat yang diberikan. Penulis juga mengucapkan terima kasih kepada Kak Meli, teman-teman Biologi 47 dan SPs Mikrobiologi 2013-2014, Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, serta teman-teman Laboratorium Mikrobiologi IPB yang tidak dapat disebutkan satu-persatu. Ungkapan terima kasih juga penulis sampaikan kepada keluarga tercinta, terutama kedua orang tua (Ibu & Bapak), kakak-kakak (Mas Anifuddin, Mas Sofian, Mas Iwan), kakak ipar (Mba Ika, Mba Mardha, Mba Ayu), dan keponakan-keponakan (Yahya, Balqis, Sakhia, Salwa, Syahma, Sauda, Arkaan) yang senantiasa memberikan doa, dukungan, dan limpahan kasih sayang.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
Aplikasi Bakteri Penambat Nitrogen dan Penghasil IAA pada Bibit Kelapa Sawit 10
HASIL DAN PEMBAHASAN 11 Peremajaan Isolat Bakteri Penambat Nitrogen dan Penghasil IAA 11
Identifikasi Molekuler Berdasarkan Gen 16S rRNA 11
Uji Hipersensitivitas pada Daun Tembakau 12
Pengukuran Pertumbuhan Bakteri dan Analisis Kuantitatif IAA Menggunakan Metode Kolorimetri 13
Analisis Kuantitatif IAA Menggunakan Metode HPLC 14
DAFTAR TABEL
1 Karakteristik morfologi isolat terpilih 11
2 Pengaruh kultur bakteri terhadap pertumbuhan akar tanaman kelapa
sawit umur 90 HST 16
3 Pengaruh kultur bakteri terhadap pertumbuhan tajuk tanaman kelapa
sawit umur 90 HST 17
4 Pengaruh kultur bakteri terhadap bobot kering akar dan tajuk tanaman
kelapa sawit umur 90 HST 18
DAFTAR GAMBAR
1 Reduksi N2 menjadi NH3 3
2 Jalur biosintesis indole-3-acetic acid pada bakteri 4
3 Komponen utama dari sistem HPLC 5
4 Diagram alur penelitian 7
5 Hasil visualisasi gen 16S rRNA isolat A13 menggunakan elektroforesis
gel agarosa 1% 11
6 Hasil konstruksi pohon filogeni berdasarkan sekuen gen 16S rRNA 12
7 Uji hipersensitivitas pada daun tembakau 13
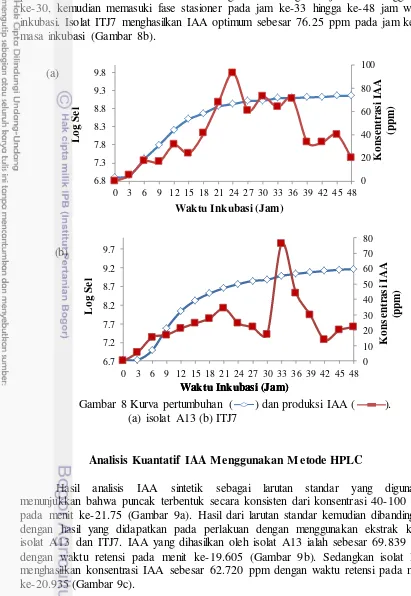
8 Kurva pertumbuhan dan produksi IAA 14
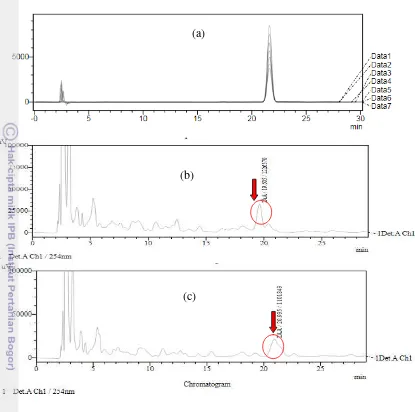
9 Kromatogram IAA 15
10 Hasil pertumbuhan akar dan tajuk tanaman kelapa sawit umur 90 HST 16
DAFTAR LAMPIRAN
1 Prosedur isolasi DNA genom menggunakan PrestoTM Mini gDNA Kit
(Geneaid). 24
2 Kurva standar isolat A13 26
3 Kurva standar isolat ITJ7 27
4 Kurva standar IAA pada metode kolorimetri 28
5 Kurva standar IAA sintetik pada metode HPLC 29
6 Hasil analisis tanah yang digunakan sebagai media tanam bibit kelapa
10 Analisis homologi sekuen 16S rRNA isolat A13 34 11 Total bakteri dari media tanam kelapa sawit umur 45 HST yang
dihitung dengan metode Total Plate Count (TPC) pada media NA (Nutrient Agar) dan NfB (Nitrogen free Bromthymol Blue) 35 12 Total bakteri dari media tanam kelapa sawit umur 90 HST yang
1
PENDAHULUAN
Latar Belakang
Mikroorganisme tanah memainkan peranan penting dalam menjaga kesuburan tanah sehingga berpotensi untuk dimanfaatkan dalam pertanian yang berkelanjutan. Salah satu mikroorganisme yang dapat dimanfaatkan ialah bakteri penambat nitrogen. Bakteri penambat nitrogen ada yang bersimbiosis seperti Rhizobium (Djordjevic et al. 1987) dan yang hidup bebas seperti Azospirillum sp. (Dobereiner et al. 1976), Bacillus sp. (Seldin et al. 1984), dan Paenibacillus sp. (Rosado et al. 1998). Ketika digunakan sebagai inokulan, bakteri penambat nitrogen dapat meningkatkan (memperlihatkan efek positif) dalam pertumbuhan tanaman sehingga disebut plant growth promoting rhizobacteria (PGPR). PGPR sering digunakan sebagai inokulan untuk meningkatkan hasil pertanian (Loper dan Schroth 1986). Salah satu mekanisme PGPR dalam meningkatkan pertumbuhan tanaman ialah dengan menghasilkan hormon pertumbuhan, yaitu indole-3-acetic acid (IAA) (Khalid et al. 2003). IAA berfungsi mengendalikan beberapa mekanisme fisiologi tumbuhan, seperti proses pembelahan sel dan diferensiasi jaringan tumbuhan.
Bakteri penambat nitrogen dan penghasil IAA seperti Azospirillum brasilense, Herbaspirillum seropedicae, serta Acetobacter diazotrophicus dapat berasosiasi dengan tanaman sehingga dapat digunakan sebagai pupuk hayati untuk memperbaiki pertumbuhan tanaman (Baldani et al. 1997). Aplikasi pupuk hayati pada pembibitan tanaman kelapa sawit merupakan salah satu upaya untuk membentuk interaksi antara mikroorganisme dan tanaman. Tanaman kelapa sawit merupakan jenis tanaman perkebunan yang memiliki banyak keunggulan. Upaya peningkatan produktivitas tanaman kelapa sawit perlu dilakukan mengingat besarnya prospek kelapa sawit di Indonesia. Salah satu upaya peningkatan produktivitas dapat dilakukan dengan cara pemupukan secara efisien dan efektif (Mardiana dan Napitupulu 2009).
Pupuk hayati merupakan mikroorganisme hidup yang diberikan ke dalam tanah sebagai inokulan untuk membantu atau menyediakan unsur hara tertentu bagi tanaman. Interaksi antara pupuk hayati dan tanaman bersifat saling menguntungkan, yaitu tanaman mendapatkan tambahan unsur hara yang diperlukan dan mikroorganisme mendapatkan bahan organik untuk aktivitas dan pertumbuhannya. Pupuk hayati berperan dalam mempengaruhi ketersediaan unsur hara makro dan mikro, meningkatkan efisiensi penyerapan hara, kinerja sistem enzim, metabolisme, pertumbuhan, dan hasil tanaman. Selain itu, pupuk hayati juga memiliki prospek lebih baik karena pengaruhnya yang nyata dalam meningkatkan hasil (Cattelan et al. 1999).
2
Perumusan Masalah
Upaya peningkatan produktivitas kelapa sawit (Elaeis guineensis Jacq.) dapat dilakukan dengan penggunaan pupuk N sintetik. Namun, dampak negatif penggunaan pupuk N sintetik yaitu mahal serta dapat mencemari lingkungan jika penggunaannya berlebihan. Penggunaan pupuk hayati berupa bakteri penambat nitrogen dan penghasil indole-3-acetic acid selain dapat membentuk proses interaksi antara mikrob dan tanaman juga dapat digunakan untuk mengurangi ketergantungan terhadap pupuk nitrogen sintetik.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkarakterisasi bakteri penambat nitrogen dan penghasil indole-3-acetic Acid (IAA) serta melihat pengaruhnya dalam memacu pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.).
Manfaat Penelitian
Karakterisasi serta aplikasi bakteri penambat nitrogen dan penghasil indole-3-acetic acid dalam penelitian ini, diharapkan dapat memberikan informasi mengenai potensi isolat bakteri dalam memacu pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.). Hasil penelitian ini juga diharapkan dapat memberikan informasi mengenai alternatif penggunaan pupuk hayati menggunakan isolat bakteri penambat nitrogen dan penghasil indole-3-acetic acid dalam dunia pertanian.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi peremajaan isolat bakteri penambat nitrogen dan penghasil indole-3-acetic acid (IAA), karakterisasi morfologinya, identifikasi molekuler berdasarkkan sekuen gen 16S rRNA, uji hipersensitivitas, analisis kemampuan produksi IAA dengan metode kolorimetri dan HPLC, serta aplikasi isolat terpilih pada bibit kelapa sawit.
TINJAUAN PUSTAKA
Bakteri Penambat Nitrogen
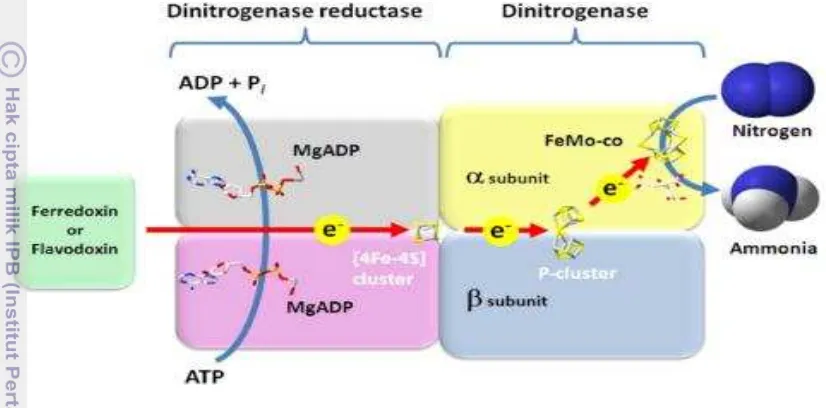
3 Bakteri penambat nitrogen menempati relung ekologi yang sangat diperlukan karena berperan sebagai pemasok nitrogen dan mengubahnya dalam bentuk yang dapat diserap oleh tumbuhan. Tumbuhan dapat menggunakan unsur nitrogen dalam bentuk ammonium atau nitrat. Proses reduksi N2 menjadi NH3 melibatkan enzim nitrogenase. Nitrogenase merupakan salah satu kompleks metaloenzim yang terdiri atas protein Fe dan MoFe (Dixon dan Kahn 2004) (Gambar 1).
Gambar 1 Reduksi N2 menjadi NH3. Reduksi N2 melibatkan protein MoFe dan protein Fe (Howard dan Rees 1994)
Penambatan atau pengikatan N2 dapat terjadi secara simbiotik dan nonsimbiotik. Bakteri penambat nitrogen yang hidup bersimbiosis merupakan bakteri yang mampu membentuk nodul, di antaranya ialah bakteri dari genus Rhizobium atau Bradyrhizobium (Antoun et al. 1998). Penambatan nitrogen juga dapat dilakukan oleh bakteri penambat nitrogen yang hidup bebas yaitu bakteri yang mampu menambat N bebas dari atmosfer tanpa harus membentuk nodul atau bintil akar. Contoh bakteri penambat nitrogen yang hidup bebas ialah Azospirillum, Azotobacter, dan Pseudomonas (Frankenberger dan Arshad 1995). Bakteri yang dapat mengikat atau memfiksasi unsur N di dalam tanah ini juga dikenal dengan istilah diazotrof (James dan Olivares 1997).
Produksi Fitohormon IAA oleh Bakteri
4
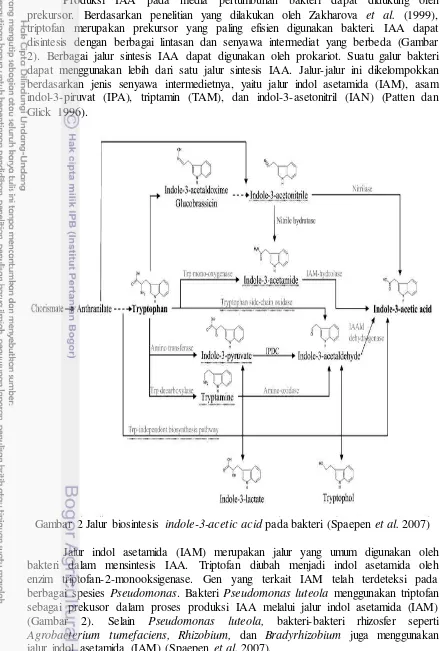
Produksi IAA pada media pertumbuhan bakteri dapat didukung oleh prekursor. Berdasarkan penelitian yang dilakukan oleh Zakharova et al. (1999), triptofan merupakan prekursor yang paling efisien digunakan bakteri. IAA dapat disintesis dengan berbagai lintasan dan senyawa intermediat yang berbeda (Gambar 2). Berbagai jalur sintesis IAA dapat digunakan oleh prokariot. Suatu galur bakteri dapat menggunakan lebih dari satu jalur sintesis IAA. Jalur-jalur ini dikelompokkan berdasarkan jenis senyawa intermedietnya, yaitu jalur indol asetamida (IAM), asam indol-3-piruvat (IPA), triptamin (TAM), dan indol-3-asetonitril (IAN) (Patten dan Glick 1996).
5
Metode Pengukuran IAA
Produksi IAA oleh bakteri dapat dianalisis dengan menggunakan metode kolorimetri maupun dengan metode High Performance Liquid Chromatography (HPLC).
Metode Kolorimetri
Prinsip dari metode kolorimetri ialah melihat adanya warna yang muncul ketika supernatan dari kultur bakteri yang diujikan bereaksi dengan reagen yang digunakan. Reagen yang digunakan dalam metode kolorimetri ialah reagen Salkowski. Adanya reaksi dari larutan asam sulfat (H2SO4) serta FeCl3 yang merupakan komposisi dari reagen Salkowski akan mendeteksi senyawa indol yang terbentuk sehingga warna campuran yang semula kuning berubah menjadi merah. Intensitas warna merah sesuai dengan konsentrasi IAA yang dimiliki oleh supernatan bakteri yang diujikan. Semakin tinggi konsentrasi IAA, warna merah yang terbentuk semakin tinggi intensitasnya (Gordon dan Weber 1951).
Metode HPLC
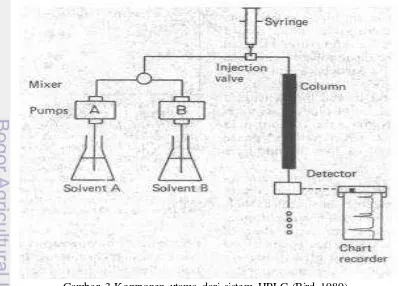
Prinsip kerja metode HPLC ialah pengujian senyawa yang disekresikan oleh bakteri, misalnya senyawa IAA berdasarkan waktu retensi yang dihasilkan pada panjang gelombang yang spesifik. Waktu retensi dari puncak (peak) yang muncul dibandingkan dengan larutan standar yang digunakan. Larutan standar tersebut juga diekstraksi dengan prosedur yang sama dengan kultur bakteri yang diujikan (Tien et al. 1979). Komponen utama dari sistem HPLC ialah pompa (tekanan tetap dan volume tetap), penginjeksi, kolom, detektor, dan rekorder atau sistem data yang terintegrasi (Bird 1989) (Gambar 3).
6
Agens Hayati Pembibitan Tanaman Kelapa Sawit
Tanaman kelapa sawit ialah tanaman perkebunan andalan di Indonesia yang memiliki prospek yang baik dalam pengembangannya. Perkembangan industri perkebunan kelapa sawit di Indonesia mulai meningkat sejak tahun 1968. Komoditas sawit merupakan sumber devisa bagi negara dengan ekspor berupa minyak sawit/crude palm oil (CPO) dan minyak inti sawit/palm kernel oil (PKO) (Obidzinski et al. 2012). Pengembangan kelapa sawit masih dihadapkan pada berbagai kendala. Salah satu kendala tersebut adalah masalah yang terkait dengan kualitas bibit sawit. Salah satu upaya dalam menangani masalah ini ialah melalui perbaikan pertumbuhan bibit tanaman dengan cara pemberian pupuk nitrogen yang dibutuhkan tanaman untuk memacu pertumbuhan vegetatifnya.
Pembibitan kelapa sawit (Elaeis guineensis Jacq.) dapat menggunakan agen alternatif dalam pemupukannya yaitu menggunakan kultur bakteri PGPR. Salah satu alternatif yang dapat digunakan sebagai agen pemupukan ialah bakteri penambat nitrogen dan penghasil IAA. Penelitian Bakhtiar et al. (2012) menyebutkan bahwa inokulasi bakteri PGPR yang bersifat endosimbiotik dengan mikoriza, yaitu Bacillus subtilis B10 dapat mempengaruhi tinggi tanaman serta bobot kering akar pada bibit kelapa sawit. Selain itu, Panjaitan (2014) menyebutkan bahwa pemberian kombinasi kultur bakteri diazotrof endofit dengan 50% dosis N dari standar pemupukan berpengaruh secara signifikan dalam peningkatan pertumbuhan kelapa sawit, yaitu pada diameter bonggol, tinggi tanaman, jumlah pelepah daun, dan bobot kering
7
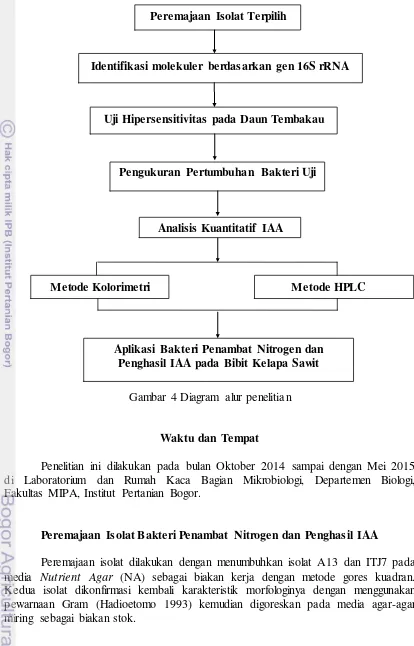
Gambar 4 Diagram alur penelitian
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Oktober 2014 sampai dengan Mei 2015 di Laboratorium dan Rumah Kaca Bagian Mikrobiologi, Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor.
Peremajaan Isolat Bakteri Penambat Nitrogen dan Penghasil IAA
Peremajaan isolat dilakukan dengan menumbuhkan isolat A13 dan ITJ7 pada media Nutrient Agar (NA) sebagai biakan kerja dengan metode gores kuadran. Kedua isolat dikonfirmasi kembali karakteristik morfologinya dengan menggunakan pewarnaan Gram (Hadioetomo 1993) kemudian digoreskan pada media agar-agar miring sebagai biakan stok.
Identifikasi molekuler berdasarkan gen 16S rRNA
Uji Hipersensitivitas pada Daun Tembakau
Pengukuran Pertumbuhan Bakteri Uji
Analisis Kuantitatif IAA
Metode Kolorimetri Metode HPLC
Aplikasi Bakteri Penambat Nitrogen dan Penghasil IAA pada Bibit Kelapa Sawit
8
Identifikasi Molekuler Menggunakan 16S rRNA
Isolat A13 yang akan diidentifikasi berdasarkan sekuen gen 16S rRNA terlebih dahulu ditumbuhkan pada media Nutrient Agar (NA) selama 24 jam. Proses
ekstraksi DNA dilakukan sesuai dengan prosedur PrestoTM Mini gDNA Kit (Geneaid)
(Lampiran 1). DNA hasil ekstraksi diukur konsentrasi dan kemurniannya dengan
menggunakan NanoDrop 2000 spectrophotometer (ThermoScientific, Wilmington,
DE, USA), kemudian digunakan sebagai template pada reaksi Polymerase Chain
Reaction (PCR). Primer yang digunakan ialah 63F (5’-CAG GCC TAA CAC ATG genom sebagai template. PCR yang dilakukan meliputi tahap pre-denaturation (95 OC selama 5 menit), lalu 30 siklus pada tahap denaturation (95 OC selama 1 menit), annealing (55 OC selama 1 menit), dan elongation (72 OC selama 1.5 menit), kemudian tahap terakhir ialah post elongation (72 OC selama 10 menit). Produk hasil PCR divisualisasi dengan menggunakan elektroforesis pada 1 % (w/v) gel agarosa dengan tegangan 80 Volt selama 45 menit. Visualisasi DNA dilakukan di atas UV transiluminator menggunakan Ethidium Bromida (EtBr). DNA hasil amplifikasi kemudian disekuen pada penyedia jasa sekuensing PT Genetika Sains Indonesia. Kromatogram hasil sekuensing kemudian dianalisis dan dilakukan pengeditan menggunakan program ChromasPro jika diperlukan. Sekuen (urutan) basa nukleotida kemudian disejajarkan dengan data yang terdapat pada GeneBank menggunakan program BLAST-N (Basic Aligment Search Tool-Nucleotide) yang terdapat di dalam software NCBI (National Center for Biotechnology Information). Konstruksi pohon filogenetik dilakukan dengan menggunakan program MEGA 6.0 dengan metode Neighbour Joining (NJ) dan nilai bootstrap 1000x.
Uji Hipersensitivitas pada Daun Tembakau
9
Pengukuran Pertumbuhan Bakteri
Kurva pertumbuhan digunakan untuk mengetahui jumlah sel pada fase pertumbuhan bakteri. Pengukuran kurva tumbuh dilakukan menggunakan metode turbidimetri (Hadioetomo 1993). Pengukuran kurva tumbuh dilakukan pada isolat A13 dan ITJ7 selama 48 jam masa inkubasi. Kultur bakteri ditumbuhkan pada media NB sebanyak 100 mL dan diinkubasi pada inkubator bergoyang dengan kecepatan 120 rpm. Sebanyak 1 mL kultur diambil dengan menggunakan pipet mikro dan dimasukkan ke dalam kuvet untuk dilakukan pengukuran menggunakan spektrofotometer Genesys pada panjang gelombang 620 nm setiap 3 jam selama 48 jam masa inkubasi. Nilai absorbansi yang didapatkan dari pengukuran selanjutnya dikonversi menjadi nilai log sel dengan kurva standar yang sudah dibuat sebelumnya (Lampiran 2 dan 3).
Analisis Kuantitatif IAA
Analisis kuantitatif IAA dilakukan menggunakan dua metode, yaitu metode kolorimetri dan metode HPLC. Pengukuran produksi IAA berdasarkan metode kolorimetri dilakukan dengan menggunakan reagen Salkowski (Gordon dan Weber 1951). Pengukuran produksi IAA kultur dilakukan setiap 3 jam sekali selama 48 jam masa inkubasi. Isolat diinokulasi ke dalam 100 mL media NB yang ditambahkan triptofan 1,0 mM dan diinkubasi pada inkubator bergoyang dengan kecepatan 120 rpm. Kemudian sebanyak 1,5 mL kultur disentrifugasi selama 10 menit pada kecepatan 8000 rpm. Supernatan yang terbentuk kemudian direaksikan dengan reagen Salkowski. Lalu larutan diinkubasi selama 15 menit dalam keadaan gelap. Setelah itu dilakukan pengukuran menggunakan spektrofotometer Genesys pada panjang gelombang 520 nm. Metode kolorimetri digunakan untuk mendapatkan konsentrasi IAA berdasarkan persamaan yang didapatkan dari kurva standar IAA (Lampiran 4).
10
Aplikasi Bakteri Penambat Nitrogen dan Penghasil IAA pada Bibit Kelapa Sawit
Persiapan Tanam
Persiapan meliputi penyediaan media tanam dan penyediaan kecambah kelapa sawit. Media tanam berupa tanah, kompos, dan sekam. Media tanam tersebut disterilisasi dengan autoklaf pada suhu 121 0C 1 atm selama 2 jam. Media tanam berupa tanah dari Dramaga, Bogor yang sebelumnya sudah dianalisis di Laboratorium Bioteknologi Tanah (Lampiran 6), kompos, dan sekam. Ketiga media tanam tersebut dicampurkan dengan perbandingan 5:3:2 (1000 g tanah: 600 g kompos: 400 g sekam) kemudian dimasukkan ke dalam polibag. Kecambah sawit varietas DxP Simalungun yang digunakan pada penelitian ini didapatkan dari Pusat Penelitian Kelapa Sawit (PPKS) Medan. Sebelum dilakukan penanaman pada polibag, kecambah kelapa sawit terlebih dahulu disterilisasi menggunakan akuades dan Dithane-45 untuk mengurangi resiko kontaminasi. Kecambah ditanam pada polibag yang sudah berisi media tanam pada kedalaman ±2 cm.
Pemupukan dan Pemberian Kultur Bakteri
Sebanyak 5 g pupuk NPK diberikan ke dalam perlakuan 100% dosis pupuk dan 2.5 g ke dalam perlakuan 50% dosis pupuk. Pupuk NPK diberikan pada saat penanaman awal dengan cara ditabur secara merata di sekitar area penanaman kecambah sawit pada tiap polibag. Sedangkan pemberian kultur bakteri dilakukan setiap dua minggu sekali hingga 45 HST. Inokulan yang dipakai ialah bakteri yang memiliki kepadatan 108 sel/ml dengan penambahan triptofan. Sebanyak 10 mL kultur diinokulasi menggunakan syringe di sekitar area penanaman kecambah sawit.
Pengukuran Pertumbuhan
11
HASIL DAN PEMBAHASAN
Peremajaan Isolat Bakteri Penambat Nitrogen dan Penghasil IAA
Isolat A13 dan ITJ7 tumbuh setelah diinkubasi selama 24 jam pada media NA. Karakteristik isolat A13 dan ITJ7 tercantum pada Tabel 1.
Tabel 1 Karakteristik morfologi isolat terpilih Kode
Isolat
Morfologi Koloni
Bentuk Sel Pewarnaan Gram Bentuk Warna Elevasi
A13 Bulat Putih susu Cembung Batang Negatif ITJ7 Bulat Bening Cembung Batang Negatif
Identifikasi Molekuler Berdasarkan Gen 16S rRNA
Amplifikasi gen 16S rRNA dari isolat A13 menghasilkan amplikon berukuran ~1300 pb (Gambar 5). Amplikon tersebut kemudian disekuen dan didapatkan urutan basa nukleotida dalam bentuk kromatogram yang dapat dianalisis dan diedit menggunakan software ChromasPro.
Gambar 5 Hasil visualisasi gen 16S rRNA isolat A13 menggunakan elektroforesis gel agarosa 1%. M= Marker 1 kb, A13= hasil amplifikasi gen 16S rRNA dari isolat A13.
Analisis sekuen isolat A13 (Lampiran 8) selanjutnya dilakukan menggunakan program BLAST-N (Lampiran 9). Hasil analisis tersebut menunjukkan bahwa isolat A13 memiliki kekerabatan dekat dengan spesies Pseudochrobactrum asaccharolyticum dengan nilai query cover sebesar 100% dan nilai E-value sebesar 0 (Lampiran 10).
12
Sekuen isolat A13 selanjutnya disejajarkan serta dikonstruksi pohon filogeninya bersama beberapa sekuen pembanding menggunakan software MEGA 6.0. Isolat ITJ7 yang sudah teridentifikasi sebelumnya oleh Harca et al. (2014) sebagai Beijerinckia fluminensis juga digunakan sebagai salah satu sekuen pembanding. Pohon filogeni yang terbentuk menunjukkan bahwa isolat A13 memiliki hubungan yang sangat dekat dengan Pseudochrobactrum asaccharolyticum (Gambar 6).
Gambar 6 Hasil konstruksi pohon filogeni berdasarkan sekuen gen 16S rRNA
Uji Hipersensitivitas pada Daun Tembakau
13
(a) (b)
(c) (d)
(e) (f) Gambar 7 Uji hipersensitivitas pada daun tembakau.
(a) kontrol positif pada masa inkubasi 48 jam, (b) kontrol negatif pada masa inkubasi 48 jam, (c) perlakuan isolat A13 pada masa inkubasi 0 jam, (d) perlakuan isolat A13 pada masa inkubasi 48 jam, (e) perlakuan isolat ITJ7 pada masa inkubasi 0 jam, dan (f) perlakuan isolat ITJ7 pada masa inkubasi 48 jam.
Pengukuran Pertumbuhan Bakteri dan Analisis Kuantitatif IAA Menggunakan Metode Kolorimetri
14
Analisis Kuantatif IAA Menggunakan Metode HPLC
15
Gambar 9 Kromatogram IAA.
(a) larutan standar IAA sintetik (b) isolat A13 (c), dan isolat ITJ7.
Aplikasi Bakteri Penambat Nitrogen dan Penghasil IAA pada Bibit Kelapa Sawit
Pemberian kultur A13 dan ITJ7 pada pembibitan tanaman kelapa sawit selama 90 hari memberikan pengaruh pada jumlah akar lateral, diameter batang, tinggi tanaman, jumlah daun, serta bobot kering akar dan tajuk. Pada parameter yang lain juga terdapat perbedaan antara perlakuan kontrol dengan perlakuan yang diberi tambahan kultur bakteri dari kedua isolat, namun pengaruhnya tidak signifikan. Morfologi tanaman kelapa sawit yang berumur 90 HST secara keseluruhan dapat dilihat pada Gambar 10.
(a)
(b)
16
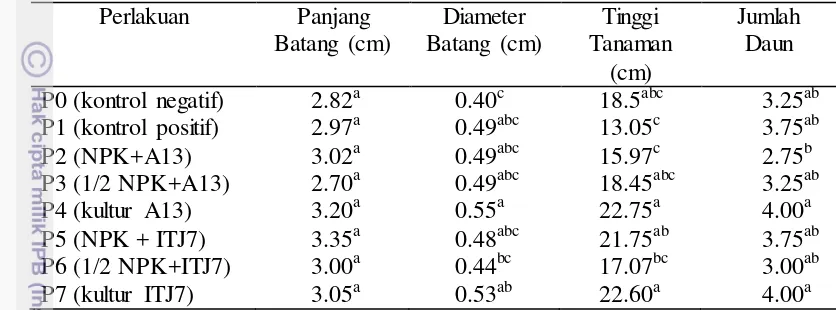
Pengamatan terhadap panjang akar utama menunjukkan bahwa tidak terdapat perbedaan antara kontrol dengan perlakuan kultur. Kemudian pada pengukuran diameter akar juga tidak terlihat adanya pengaruh yang signifikan. Sebaliknya, hasil pengamatan jumlah akar lateral menunjukkan bahwa P0 (kontrol negatif) dan P1 (kontrol positif/ NPK 100%) memiliki jumlah akar lateral yang lebih sedikit dibandingkan dengan keenam perlakuan lain yang menggunakan kultur bakteri (Tabel 2).
Tabel 2 Pengaruh kultur bakteri terhadap pertumbuhan akar tanaman kelapa sawit umur 90 HST
Pemberian pupuk NPK dengan atau tanpa kultur bakteri berpengaruh nyata terhadap diameter batang dan tinggi tanaman, tetapi tidak berpengaruh terhadap panjang batang. Pengamatan parameter diameter batang menunjukkan bahwa diameter yang paling besar dimiliki oleh P4 (kultur bakteri A13), sedangkan P0 memiliki diameter batang yang paling kecil, yaitu sebesar 0.40 cm. Pengukuran tinggi tanaman juga memberikan hasil yang bervariasi. Perlakuan P4 (kultur bakteri A13), P5 (pupuk NPK + ITJ7), dan P7 (kultur bakteri ITJ7) memiliki rata-rata tinggi tanaman yang lebih besar dari 20 cm. Hasil yang serupa diperoleh dari parameter jumlah daun, perlakuan menggunakan kultur A13 (P4), perlakuan menggunakan
17 dosis penuh pupuk NPK dan kultur A13 (P5), perlakuan menggunakan kultur ITJ7 (P7), serta perlakuan kontrol positif (P1) memiliki rata-rata jumlah daun sebanyak 4 helai sedangkan keempat perlakuan lainnya menghasilkan daun rata-rata 3 helai (Tabel 3).
Tabel 3 Pengaruh kultur bakteri terhadap pertumbuhan tajuk tanaman kelapa sawit umur 90 HST
Hasil analisis statistik terhadap data pengamatan pengaruh kultur bakteri terhadap bobot kering akar dan tajuk kelapa sawit disajikan pada Tabel 4. Keenam perlakuan dengan kultur bakteri menunjukkan bobot kering akar lebih besar daripada kontrol negatif dan kontrol positif, yaitu lebih dari 0.05 gram. Perlakuan P3 (50% pupuk NPK dan kultur bakteri A13), P4 (kultur bakteri A13), P5 (pupuk NPK dan kultur bakteri ITJ7), P6 (50% pupuk NPK dan kultur bakteri ITJ7), serta P7 (kultur bakteri ITJ7) berbeda nyata dengan perlakuan P0 (kontrol negatif). Perlakuan P1 (kontrol positif) juga memberikan hasil yang berbeda nyata dengan perlakuan P4, P5, P6, serta P7, namun tidak berbeda nyata dengan perlakuan P0, P2, dan juga P3.
18
P0 (kontrol negatif) 0.0377c 0.2610b P1 (kontrol positif) 0.0437bc 0.2959b
P2 (NPK+A13) 0.0646abc 0.3585b
Isolasi bakteri penambat nitrogen yang dilakukan dari 10 sampel tanah rhizosfer asal perkebunan kelapa sawit dari penelitian sebelumnya menghasilkan 5 isolat bakteri yang tumbuh pada media Nitrogen Free Bromthymol (NfB) (Isti’anah 2014) dan 7 isolat bakteri yang mampu tumbuh pada medium LG (Harca et al. 2014). Penelitian ini menggunakan isolat terpilih, yaitu isolat A13 dan ITJ7 yang merupakan isolat bakteri penambat nitrogen dan penghasil IAA. Kedua isolat memiliki keistimewaan, yaitu mampu menambat nitrogen. Kemampuan menambat nitrogen telah diukur dengan metode Acethylene Reduction Assay (ARA) atau reduksi gas etilen. Isolat A13 mampu mereduksi asetilen sebesar 0.675 ppm/jam, mampu menghasilkan IAA sebesar 33.88 ppm, serta memiliki laju pertumbuhan yang baik (jumlah sel mencapai 109 sel/mL) ketika ditumbuhkan pada media NfB (Isti’anah 2014). Isolat ITJ7 mampu mereduksi etilen sebesar 0.092 ppm/jam dan menghasilkan IAA sebesar 26.032 ppm serta memiliki laju pertumbuhan yang baik (jumlah sel mencapai 108 sel/mL) ketika ditumbuhkan pada media LG yang juga tidak mengandung unsur nitrogen (Harca et al. 2014). Oleh karena itu, isolat A13 dan ITJ7 selanjutnya dipilih untuk diuji pada pembibitan awal kelapa sawit.
19 Pseudochrobactrum asaccharolyticum memiliki kekerabatan dekat dengan genus Ochrobactrum yang sama-sama berperan sebagai penambat nitrogen dan PGPR (Imran et al. 2014). Selain itu, Pseudochrobactrum asaccharolyticum juga dapat digunakan sebagai agen bioremediasi pada lingkungan yang terkena kontaminasi logam berat, seperti krom (Ge et al. 2013) serta mempunyai kemampuan dalam mendegradasi senyawa fenol (Mao et al. 2015). Konstruksi pohon filogeni juga melibatkan sekuen isolat ITJ7 yang sebelumnya telah teridentifikasi sebagai Beijerinckia fluminensis (Harca et al. 2014) sebagai sekuen pembanding. Beijerinckia fluminensis merupakan salah satu mikrob tanah penambat nitrogen (Kumar 2014).
Uji pendahuluan yang dilakukan sebelum mengaplikasikan isolat A13 dan ITJ7 adalah dengan cara menguji hipersensitivitasnya pada daun tembakau. Reaksi positif pada uji tersebut ditunjukkan dengan adanya gejala nekrosis, yaitu terdapat bercak kuning atau coklat pada daun. Gejala tersebut biasanya mengakibatkan kematian sebagian sel inang yang bertujuan untuk menghambat pertumbuhan patogen (Lindsay et al. 1993). Kultur A13 dan ITJ7 yang tidak menyebabkan gejala hipersensitivitas pada daun tembakau menunjukkan bahwa kedua isolat tersebut tidak bersifat patogen pada tanaman (Vanneste et al. 1990) sehingga kedua isolat tersebut dapat diaplikasikan pada uji berikutnya, yaitu aplikasi pada bibit kelapa sawit.
Pengukuran pertumbuhan bakteri uji yang dilakukan menggunakan L-triptofan pada kultur bakteri. L-L-triptofan merupakan prekusor utama terbentuknya senyawa IAA. Hal ini disebabkan oleh adanya kemiripan struktur kimia antara triptofan dengan IAA. Konversi dari triptofan menjadi IAA dapat dilakukan dengan cara degradasi rantai samping, meliputi proses deaminasi, dekarboksilasi, serta oksidasi (Sembner et al. 1980). Penambahan triptofan pada kultur bakteri dapat memicu produksi IAA yang lebih optimal. Produksi IAA pada isolat A13 dan ITJ7 meningkat pada saat bakteri berada dalam fase pertumbuhan bakteri melambat dan mencapai stasioner. Menurut Spaepen et al. (2007), IAA ialah salah satu metabolit sekunder yang dihasilkan pada fase stasioner.
20
Pengujian isolat A13 dan ITJ7 pada bibit sawit umur 90 HST berpengaruh pada parameter jumlah akar lateral secara signifikan dibandingkan dengan perlakuan kontrol. Hal ini karena isolat A13 dan ITJ7 menghasilkan IAA yang tinggi, yaitu sekitar 60-90 ppm (diperoleh dari hasil analisis kuantitatif IAA menggunakan metode kolorimetri dan HPLC) atau sekitar 3.42 x 10-5 M hingga 5.13 x 10-5 M. Hasil yang diperoleh tersebut sesuai dengan pernyataan Patten dan Glick (2002) bahwa konsentrasi IAA yang tinggi dapat memacu pertumbuhan akar lateral. Sedangkan konsentrasi IAA yang rendah, yaitu sekitar 10-9 M hingga 10-12 M hanya memicu pemanjangan akar utama saja. Pada parameter diameter batang serta tinggi tanaman juga terdapat perbedaan antara perlakuan kontrol dengan kultur. Peningkatan pertumbuhan ini berkaitan dengan produksi senyawa berupa IAA yang umum ditemukan pada bakteri tanah (Dobbelaere dan Okon 2007). Peningkatan pertumbuhan pada akar lebih terlihat signifikan dibandingkan dengan bagian tajuk. Hal ini karena pengamatan dilakukan selama 90 HST sehingga bibit kelapa sawit tersebut masih dipengaruhi juga oleh endosperma yang digunakan sebagai cadangan makanannya sebelum proses pecahnya plumula (berdiferensiasi menjadi pelepah daun) (Lubis 2008).
Perbedaan nyata yang dihasilkan dari pengukuran bobot kering tanaman (bagian tajuk dan akar) disebabkan adanya keseimbangan kadar hara dan hormon dalam jaringan tanaman pada perlakuan dengan kultur bakteri dibandingkan dengan perlakuan kontrol. Adanya bakteri diazotrof yang berinteraksi dengan tanaman mampu memberikan asupan nitrogen dalam jumlah yang optimum dan stabil. Kecukupan unsur N juga sangat penting dalam pertumbuhan tanaman karena kedudukannya dalam proses biokimia tanaman sebagai unsur esensial pada pembentukan sel, penyusunan protein, sitoplasma, klorofil, dan komponen sel lainnya (Jackson et al. 2008). Selain itu, fitohormon seperti senyawa IAA yang dihasilkan juga dapat menyebabkan terjadinya perubahan fisiologi pada akar, seperti peningkatan efisiensi penyerapan mineral, air, respirasi akar, penundaan daun dari senesens, dan peningkatan bobot kering (Dobbelaere dan Okon 2007). Hasil yang diperoleh dari pengujian kultur bakteri pada pembibitan tanaman kelapa sawit selama 90 hari juga berbanding lurus dengan pengamatan koloni bakteri pada 45 dan 90 HST (Lampiran 11 dan 12). Viabilitas bakteri yang diinokulasikan pada media tanam pembibitan kelapa sawit menunjukkan bahwa terdapat perbedaan kemampuan bakteri dalam menggunakan nutrisi yang terdapat di dalam media untuk mendukung laju pertumbuhannya (Lestari et al. 2007).
SIMPULAN DAN SARAN
Simpulan
21 daripada perlakuan kontrol. Pemberian kultur bakteri memberikan pengaruh yang lebih baik terhadap parameter jumlah akar lateral.
Saran
Perlu dilakukan pengujian lebih lanjut pada isolat-isolat terpilih tersebut untuk diformulasikan sebagai pupuk hayati dengan pemilihan bahan pembawa yang tepat.
DAFTAR PUSTAKA
palm seedlings inoculated with arbuscular mycorrhizal fungi and mycorrhizal endosymbiotic bacteria Bacillus subtilis B10 towards biotic stress of pathogen Ganoderma boninense Pat. Microbiol Indones. 6(4): 157-164. Baldani JI, Caruso L, Baldani VLD, Goi SR, Dobereiner J. 1997. Recent advances inBNF with non-legume plants. Soil Bio Biochem. 29(5): 911–922.
Bird IM. 1989. High performance liquid chromatography: principals and clinical applications. Br Med J. 299: 783-787.
Cattelan AJ, Hartel PG, Fuhrmann JJ. 1999. Screening for plant growth-promoting legumes. Annu Rev Phytopathol. 25(12): 145–168.
Dobbelaere S, Okon Y. 2007. The Plant Growth Promoting Effect and Plant Response. Berlin (DE): Springer.
Dobereiner J, Marriel IE, Nery M. 1976. Ecological distribution of Spirillum lipoferum Beijerinck. Can J Microbiol. 22(10): 1464–1473.
Frankenberger M, Arshad WT. 1995. Phytohormones in Soils: Microbial Production and Function. New York (US): Marcel Dekker Inc.
Ge S, Dong X, Zhou J, Ge S. 2013. Comparative evaluations on biotreatment of hexavalent chromate by resting cells of Pseudochrobactrum sp. and Proteus sp. in wastewater. J Environ Man. 126: 7-12
Gordon SA, Weber RP. 1951. Colorimetric estimation of indoleacetic acid. Plant Physiol. 26(1): 192-195.
Hadioetomo RS.1993. Mikrobiologi Dasar dalam Praktek. Jakarta (ID): Gramedia. Harca NN, Mubarik NR, Wahyudi AT. 2014. Isolation and identification of nitrogen
22
Howard JB, Rees DC. 1994. Nitrogenase: a nucleotide-dependent molecular switch. Annu Rev Biochem. 63: 235-264.
Imran A, Saadalla MJA, Khan S, Mirza MS, Malik KA, Hafeez FY. 2014.
Ochrobactrum sp. Pv2Z2 exhibits multiple traits of plant growth promotion,
biodegradation and N-acyl-homoserine-lactone quorum sensing. Ann
Microbiol. 64(4): 1797-1806.
Isti’anah I. 2014. Isolasi dan seleksi bakteri penambat nitrogen dan penghasil indole-3-acetic acid asal sampel tanah dari Jambi Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Jackson LE, Burger M, Cavagnaro TR. 2008. Roots, nitrogen transformation, and ecosystem service. Ann Rev. 59(1): 341-363.
James E, FL Olivares. 1997. Infection and colonization of sugarcane and other graminaceous plants by endophytic diazotrophicus. Plant Sci Bioeng. 110(4): 415-418.
Khalid A, Arshad M, Zahir ZA. 2003. Screening plant growth promoting rhizobacteria for improving growth and yield of wheat. J Appl Microbiol. 96: 473-480.
Kumar M. 2014. Bacteria involving in nitrogen fixation and their evolutionary correlation. Int J Curr Microbiol Appl Sci. 3(3):842-830.
Lestari P, Dwi NS, Eny IR. 2007. Pengaruh hormone asam indol asetat yang dihasilkan Azospirillum sp. terhadap perkembangan akar padi. J Agro Biogen. 3: 66-72.
Lindsay WP, Lamb CJ, Dixon RA. 1993. Microbial recognition and activation of plant defence system. Trends Microbiol. 5(1):181-187.
Loper JE, Scroth MN. 1986. Influence of bacterial sources of indole-3-acetic acid on root elongation of sugar beet. Phytopatology 76: 386-389.
Lubis AU. 2008. Kelapa Sawit (Elaeis guineensis Jacq.) di Indonesia Edisi 2. Medan (ID): Pusat Penelitian Kelapa Sawit.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2006. Brock: Biology of Microorganisms. Ed ke-12. San Fransisco (US): Pearson Education Inc. Mao Z, Yu C, Xin L. 2015. Enhancement of phenol biodegradation by
Pseudochrobactrum sp. through ultraviolet induced mutation. Int J Mol Sci. 16:7320-7333.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evolution of useful bacteria specific PCR primers that amplify genes coding for bacteria 16S rRNA. Appl Environ Microbiol. 64(2): 795 – 799.
Mardiana S, Napitupulu ES. 2009. Pengaruh pemberian pupuk saputra nutrient (plant liquid) dan limbah sludge industry kelapa sawit (Elaeis guineensis Jacq.) di pembibitan utama (main-nursery). Agrobio J. 1(1): 13-22.
Marschner H, Kirkby EA, Cakmak I. 1996. Effect of mineral nutritional status on shoot-root partitioning of photoassimilates and cycling of mineral nutrients. J Exp Bot. 47: 1255-1263.
Mehnaz S, Lazarovits G. 2006. Inoculation effects of Pseudomonas putida,
Gluconacetobacter azotocaptans, and Azospirillum lipoferum on corn plant
23 Obidzinski K, Andriani R, Komarudin H, Andrianto A. 2012. Environmental and social impacts of oil palm plantations and their implications for biofuel production in Indonesia. Ecol Soc. 17(1): 25-44.
Omer ZS, Tombolini R, Broberg A, Gerhardson B. 2004. Indole-3-acetic acid production by pink-pigmented facultative methylotrophic bacteria. Plant Growth Regul. 43: 93-96.
Panjaitan A. 2014. Kemampuan bakteri diazotrof endofit untuk meningkatkan pertumbuhan bibit kelapa sawit (Elaeis guineensis Jacq.) [tesis]. Bogor (ID): simultaneously UV, native fluorescence and pre-column fluorescence derivatization. Chromatographia 57: 87-92.
Rao NS. 1994. Mikrobiologi Tanah dan Pertumbuhan Tanaman. Susilo H, penerjemah. Jakarta (ID): UI Press. Terjemahan dari: Soil Microorganisms and Plant Growth. Ed ke-2.
Rosado AS, de Azevedo FS, da Cruz DW, van Elsas JD, Seldin L. 1998. Phenotypic and genetic diversity of Paenibacillus azotofixans strains isolated from the rhizoplane or rhizosphere soil of different grasses. J Appl Microbiol. 84(2): Development Indole-3-Acetic Acid. Berlin (DE): Springer.
Spaepen S, Jos V, Roseline R. 2007. Indole-3-acetic acid in microbial and microorganism plant signaling. FEMS Microbiol Rev. 31(4): 425–448.
Tien TM, Gaskins MH, Hubbell DH. 1979. Plant growth substances produced by Azospirillum brasilense and their effect on the growth of pearl millet (Pennisetum americanum L.). Appl Environ Microbiol. 37(5): 1016-1024. Vanneste JL, Paulin J, Expertd P. 1990. Bacteriophage Mu as genetic tool to study
Erwinia amylovora pathogenicity and hypersensitive reaction on tobacco. J Bacteriol. 172(2): 931-940.
24
LAMPIRAN
Lampiran 1 Prosedur isolasi DNA genom menggunakan PrestoTM Mini gDNA Kit (Geneaid)
Kultur bakteri pada media Nutrient Agar 24 jam masa inkubasi
Ditambahkan 180 L GT bufer (resuspensi)
Pelet + 20 L Proteinase K (resuspensi)
Diinkubasi 60oC selama 10 menit
Ditambah 200 L GB bufer
Dihomogenisasi dengan vortex selama 10 detik
Diinkubasi pada suhu 70 oC selama 10 menit
Ditambahkan 200 L etanol absolut
Campuran dimasukkan ke dalam GD kolom
Sentrifugasi 14.000 rpm selama 1 menit
Setiap 3 menit dibolak-balik secara perlahan Secara perlahan
25 Lampiran 1 Prosedur isolasi DNA genom menggunakan PrestoTM Mini gDNA Kit
(Geneaid) (Lanjutan)
Ditambahkan 400 L W1 bufer
Cairan dibuang
Ditambahkan 600 LWash bufer
Cairan dibuang
Ditambahkan 100 L Preheat bufer
Sentrifugasi 14.000 rpm selama 2 menit
Tabung koleksi dibuang dan diganti dengan yang baru
Sentrifugasi 14.000 rpm selama 2 menit
Sentrifugasi 14.000 rpm selama 2 menit
Sentrifugasi 14.000 rpm selama 2 menit
26
Lampiran 2 Kurva standar isolat A13
Persamaan regresi linear y= 0.637x-4.405
y = 0.637x - 4.4059 R² = 0.9574
0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
7 7.2 7.4 7.6 7.8 8 8.2
27
Lampiran 3 Kurva standar isolat ITJ7
Persamaan regresi linear y= 0.552x-3.715
y = 0.552x - 3.715 R² = 0.957
0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
7.2 7.4 7.6 7.8 8 8.2 8.4 Log sel/mL
28
Lampiran 4 Kurva standar IAA pada metode kolorimetri
Persamaan regresi linear y= 0.001x + 0.044
y = 0.0019x + 0.0449 R² = 0.9743
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18 0.2
0 10 20 30 40 50 60 70 80
OD ( =520 nm)
29 Lampiran 5 Kurva standar IAA sintetik metode HPLC
No Konsentrasi (ppm) Mean Area Area
1 40 705485.7 705486
2 50 884707.1 884707
3 60 1051773.1 1051773
4 70 1222666.3 1222666
5 80 1399846.3 1399846
6 90 1580924.2 1580924
30
Lampiran 6 Hasil analisis tanah yang digunakan sebagai media tanam pada bibit kelapa sawit
Analisis Kadar Satuan Kategori
pH 4.9 - Asam
C-org 2 % Sedang
N-total 0.18 % Rendah
P2O5 Bray (terlarut) 6.10 ppm Rendah
Ca 4.56 (me/100 mg) Rendah
Mg 1.01 (me/100 mg) Rendah
K 0.46 (me/100 mg) Sedang
Na 0.33 (me/100 mg) Rendah
KTK 11.88 (me/100 mg) Rendah
KB (Kejenuhan Basa) 53.54 % Sedang
Fe 3.61 ppm Rendah
Cu 1.93 ppm Tinggi
Zn 7.19 ppm Tinggi
Mn 128.88 ppm Sangat Tinggi
31 Lampiran 7 Rancangan percobaan RAL
*Keterangan : P0 = kontrol negatif, P1 = kontrol positif, P2 = pupuk NPK dan kultur A13, P3= ½ pupuk NPK dan kultur A13, P4= kultur A13, P5= pupuk NPK dan kultur ITJ7, P6= ½ pupuk NPK dan kultur ITJ7, P7= kultur ITJ7, (1) = ulangan 1, (2)= ulangan 2, (3)= ulangan 3, (4)= ulangan 4.
P0 (1) P5 (3) P6 (2) P3(3) P3 (4) P2 (3) P6 (3) P0 (4)
P6 (1) P0 (2) P5 (1) P0 (3) P2 (4) P8 (4) P5 (4) P4 (2)
P2 (1) P5 (2) P3 (2) P1 (4) P1 (3) P3 (1) P4 (4) P1 (1)
32
Lampiran 8 Sekuen gen 16S rRNA dari isolat A13
33 Lampiran 9 Hasil analisis Blast-N sekuen gen 16S rRNA dari isolat A13 pada
34
Lampiran 10 Analisis homologi sekuen gen 16S rRNA isolat A13
Homologi %
Identitas E-value
No akses
Pseudochrobactrum asaccharolyticum galur CCUG 46016 100% 0.0 NR
042474.1
Pseudochrobactrum saccharolyticum galur CCUG 33852 99% 0.0 NR
042473.1
Pseudochrobactrum lubricantis galur KSS 7.8 99% 0.0 NR
104538.1
Pseudochrobactrum k iredjiniae galur CCUG 49584 99% 0.0 NR
042519.1
Paenochrobactrum gallinari galur Sa25 97% 0.0 NR
35 Lampiran 11 Total bakteri dari media tanam kelapa sawit umur 45 HST yang dihitung dengan metode Total Plate Count (TPC) pada media NA (Nutrient Agar) dan NfB (Nitrogen free Bromthymol Blue)
Perlakuan Media NA (sel/mL) Media NFB (sel/mL)
K - 2.13 x 107 3.9 x 107
K + 3.79 x 107 6.1 x 106
P A13 1.31 x 109 3.95 x 108
P ITJ7 4.68 x 107 7.7 x 107
P1/2 A13 3.95 x 107 3.75 x 107
P1/2 ITJ7 8.02 x 107 3.4 x 107
NPK + A13 1.25 x 109 9.15 x 108
NPK + ITJ7 2.15 x 108 9.2 x 107
36
Lampiran 12 Total bakteri dari media tanam kelapa sawit umur 90 HST yang dihitung dengan metode Total Plate Count (TPC) pada media NA (Nutrient Agar) dan NfB (Nitrogen free Bromthymol Blue)
Perlakuan Media NA (sel/mL) Media NFB (sel/mL)
K - 8.95 x 106 1.12 x 106
K + 1.17 x 107 1.59 x 106
P A13 7.28 x 108 5.95 x 108
P ITJ7 1.34 x 108 1.98 x 108
P1/2 A13 1.85 x 107 3.15 x 107
P1/2 ITJ7 3.15 x 107 5.75 x 107
NPK + A13 7.7 x 108 1.25 x 108
37
RIWAYAT HIDUP
Penulis dilahirkan di Purbalingga pada tanggal 17 Mei 1992 dari ayah Abdul Azis dan ibu Tumidjah. Penulis merupakan anak keempat dari empat bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Purwokerto. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan beasiswa Peningkatan Prestasi Akademik (PPA) dari DIKTI pada tahun 2011-2014. Pada tahun 2013 penulis diterima sebagai mahasiswa program sinergi S1-S2 fast-track untuk program studi S2 Mikrobiologi dan mendapatkan beasiswa Fresh Graduate (FG) dari DIKTI.