i
PENENTUAN KETERULANGAN BIOSENSOR
ANTIOKSIDAN DARI EKSTRAK
Deinococcus radiodurans
DAN PERBANDINGAN METODE ELEKTROKIMIA
DENGAN SPEKTROFOTOMETRI
NIKE NURJANAH FERINDA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penentuan Keterulangan Biosensor Antioksidan dari Ekstrak Deinococcus radiodurans dan Perbandingan Metode Elektrokimia dengan Spektrofotometri adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Nike Nurjanah Ferinda
v
ABSTRAK
NIKE NURJANAH FERINDA. Penentuan Keterulangan Biosensor Antioksidan dari Ekstrak Deinococcus radiodurans dan Perbandingan Metode Elektrokimia dengan Spektrofotometri. Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan DEDEN SAPRUDIN.
Metode elektrokimia biosensor antioksidan merupakan metode alternatif dalam pengukuran kapasitas antioksidan. Metode ini memiliki sensitivitas yang lebih tinggi, biaya yang lebih murah, dan instrumentasi lebih sederhana dibandingkan metode spektrofotometri. Penelitian ini bertujuan melakukan optimisasi aktivitas superoksida dismutase (SOD) dari ekstrak Deinococcus radiodurans terimobilisasi zeolit, uji keterulangan, dan perbandingan limit deteksi metode elektrokimia dengan spektrofotometri. Kondisi optimum aktivitas antioksidan SOD dari ekstrak D. radiodurans adalah suhu 31 °C, pH 9, dan zeolit 137.5 mg. Arus optimum yang diperoleh dari keterulangan sebesar 1.749 µA dengan simpangan baku 0.01 dan koefisien keragaman sebesar 0.59%. Nilai limit deteksi untuk biosensor elektrokimia sebesar 1.76 ppm. Nilai tersebut lebih rendah dibandingkan limit deteksi untuk spektrofotometri, yaitu 2.01 ppm. Metode elektrokimia dapat mendeteksi analit dengan konsentrasi yang lebih rendah.
Kata kunci : biosensor antioksidan, D. radiodurans, keterulangan, limit deteksi, superoksida dismutase
ABSTRACT
NIKE NURJANAH FERINDA. Determination of Antioxidant Biosensor Repeatability from Deinococcus radiodurans Extract and The Comparison Methods between Electrochemical and Spectrophotometry. Supervised by DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, and DEDEN SAPRUDIN.
vi
vii
NIKE NURJANAH FERINDA
Skipsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Program Studi Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2014
PENENTUAN KETERULANGAN BIOSENSOR
ANTIOKSIDAN DARI EKSTRAK
Deinococcus radiodurans
ix
Judul Skripsi : Penentuan Keterulangan Biosensor Antioksidan dari Ekstrak Deinococcus radiodurans dan Perbandingan Metode Elektrokimia dengan Spektrofotometri
Nama : Nike Nurjanah Ferinda NIM : G44100012
Disetujui oleh
Dr Novik Nurhidayat Dr Deden Saprudin, MSi
Pembimbing II Pembimbing III
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
x
xii
PRAKATA
Puji syukur saya panjatkan ke hadirat Allah SWT karena berkat izin-Nya saya dapat menyelesaikan proposal penelitian ini. Shalawat serta salam saya curahkan kepada Nabi besar Muhammad SAW, sahabat, dan pengikutya hingga akhir zaman. Ucapan terima kasih yang sebesarnya kepada ayahanda dan ibunda tercinta, Ceprison dan Afrida, kepada uda Rindo Ferindo, uni Fika Ferinda, uni Wulan dari, dan uda Riko Putra yang dengan kesabaran dan keikhlasan telah memberikan dorongan moral, material, dan doa yang tulus.
Penulis mengucapkan rasa terima kasih yang tulus kepada Prof Dr Dyah Iswantini Pradono MSc Agr, Dr Novik Nurhidayat, dan Dr Deden Saprudin MSi selaku komisi pembimbing. Terima kasih saya ucapkan juga untuk Bu Neri, Mbak Ratih, pak Acun di PUSLIT Biologi LIPI Cibinong, Bu Ai, Pak Mail staf laboran Kimia Fisik, Pak Eman dari Kimia Analitik. Ungkapan terima kasih juga disampaikan kepada Kak Aji yang mengarahkan dalam proses penelitian, sahabatku Ana, Uci, dan Dina yang memberikan semangatnya, Mita, Ali, Kinan, Asri, dan teman-teman seperjuangan di Kimia.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
xiv
DAFTAR ISI
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
BAHAN DAN METODE 3
Alat dan Bahan 3
Metode 3
HASIL DAN PEMBAHASAN 6
Penumbuhan Sel Deinococcus radiodurans dan Ekstraksi Enzim SOD 6
Pengukuran Arus Elektrode Pasta Karbon 6
Aktivasi Zeolit 7
Imobilisasi Enzim 7
Pengoptimuman Aktivitas SOD Terimobilisasi 9
Limit Deteksi dan Limit Kuantitatif dengan Metode Elektrokimia dan
Spektrofotometri 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
xv
DAFTAR GAMBAR
1 Voltamogram siklik pada pengukuran larutan K3Fe (CN)6 0.01M 7 2 Voltamogram siklik pada suhu 20 °C, bufer fosfat pH 9, dan zeolit
137.5 mg 8
3 Mekanisme pengukuran biosensor antioksidan 9
4 Alur kontur hubungan antara suhu dan pH (a), suhu dan zeolit (b), dan pH dan zeolit (c) terhadap aktivitas antioksidan D. radiodurans. 10 5 Hubungan penurunan arus terhadap penambahan vitamin C 11 6 Hubungan penurunan arus terhadap penambahan ekstrak daun jambu
biji 11
7 Hubungan absorban terhadap penambahan vitamin C metode DPPH 12 8 Hubungan absorban terhadap penambahan ekstrak daun jambu biji
metode DPPH 12
DAFTAR LAMPIRAN
1 Bagan alir penelitian 16
2 Ekstraksi SOD 16
3 Kombinasi faktor-faktor peubah bebas bakteri D. radiodurans dengan
penambahan zeolit 18
4 Hasil optimasi bakteri D. radiodurans dengan penambahan zeolit 19 5 Keterulangan pengukuran hasil atioksidan D. radiodurans kondisi
optimum 20
6 Penentuan limit deteksi dan limit kuantitatif metode elektrokimia 21 7 Penentuan limit deteksi dan limit kuantitatif metode elektrokimia
menggunakan ekstrak daun jambu biji 23
8 Penentuan limit deteksi dan limit kuantitatif metode DPPH 25 9 Penentuan limit deteksi dan limit kuantitatif metode DPPH
Radikal bebas merupakan molekul yang pada orbit terluarnya mempunyai satu atau lebih elektron tak berpasangan, sifatnya sangat labil, dan sangat reaktif sehingga diperlukan suatu senyawa untuk menangkap radikal bebas tersebut. Antioksidan merupakan zat yang dapat menghambat reaksi oksidasi oleh radikal bebas yang menyebabkan kerusakan. Substansi antioksidan dalam melindungi tubuh dari serangan radikal bebas berfungsi menstabilkan radikal bebas dengan melengkapi kekurangan elektron dari radikal bebas sehingga menghambat terjadinya reaksi berantai (Windono dan Soediatmoko 2001). Oleh karena itu, diperlukan metode atau teknik yang tepat dalam pengukuran sifat antioksidan.
Metode atau teknik yang dapat digunakan dalam menentukan sifat-sifat antioksidan adalah teknik spektrofotometri, fluoresensi, kromatografi gas atau cair, dan sebagainya (Campanella et al. 2000). Metode spektrofotometri telah dikembangkan sebelumnya tetapi memiliki beberapa kelemahan diantaranya biaya yang mahal karena menggunakan bahan kimia yang bermacam-macam dalam jumlah yang banyak, waktu yang lama dalam preparasi sampel, dan kurang sensitif terutama dalam menguji sampel berwarna serta sangat dipengaruhi oleh kekeruhan atau turbiditas.
Metode alternatif yang dikembangkan dalam mengukur sifat-sifat antioksidan adalah biosensor antioksidan. Metode ini memiliki kelebihan yaitu waktu analisis cepat, biaya instrumen yang tidak mahal, dan operasi yang sederhana yang tidak tergantung pada konsentrasi analat. Biosensor antioksidan ada dua jenis yaitu biosensor amperometri untuk menguji kapasitas antioksidan mono dan polifenol berbasis enzim tirosinase, laktase atau peroksidase dan biosensor untuk pengujian kapasitas antioksidan berdasarkan penangkapan radikal bebas. Berdasarkan aktivitas penangkapan radikal bebas tipe biosensor dikembangkan menggunakan sitokrom c, dan enzim superoksida dismutase (SOD) (Prieto-Simon et al. 2008). Biosensor antioksidan berbasis SOD lebih sensitif dan spesifik, telah terbukti dapat mengukur kapasitas antioksidan berbagai jenis bahan alam, produk makanan dan minuman, serta farmasi. Penggunaan SOD murni memiliki kekurangan, yaitu harga yang mahal dan kestabilan enzim yang rendah. Solusi dari kekurangan tersebut adalah penggunaan bakteri yang menghasilkan SOD sebagai sensor. Bakteri yang digunakan adalah Deinococcus radiodurans. Bakteri ini bersifat resisten terhadap radiasi ultraviolet, ionisasi, desikasi, dan adanya ROS atau spesi oksigen reaktif. Bakteri D. radiodurans
menghasilkan enzim yang dapat diinduksi untuk meningkatkan aktivitasnya yaitu Mn-SOD.
2
xantina 0.200-0.275 mM. Kondisi optimum aktivitas SOD murni yang diperoleh pada konsentrasi 10 unit dengan waktu respons 4 detik dan elektrode stabil disimpan dalam larutan bufer pH 11 pada suhu 20 oC selama 72 jam.
Kestabilan enzim perlu dijaga untuk menghasilkan kerja yang maksimum, salah satu caranya dengan melakukan imobilisasi pada nanomaterial. Shumyantseva et al. (2005) menggunakan nanopartikel emas yang menghasilkan sensitivitas yang tinggi dari biosensor kolesterol dengan sitokrom P450scc. Wang
(2009) membuat elektroda karbon dengan nanopartikel platinum untuk menentukan kadar glukosa dan menghasilkan respon arus yang lebih besar dibandingkan elektroda tanpa nanopartikel platinum. Esumi et al. (2003) juga telah membuat biosensor antioksidan dari nanopartikel emas dengan kitosan yang menunjukkan stablitas baik.
Imobilisasi enzim dapat dilakukan dengan menggunakan bahan anorganik seperti tanah liat, alumina berpori, silika (Bhatia et al. 2000), dan zeolit (Balal et al. (2009), Kirdeciler et al. (2011), Goriushkina et al. (2010) juga dapat digunakan sebagai matriks imobilisasi enzim. Zeolit banyak terdapat di Indonesia yang berpotensi sebagai matriks imobilisasi SOD. Zeolit alam merupakan senyawa alumina silikat terhidrasi yang secara fisik dan kimia mempunyai kemampuan sebagai penjerap, penukar kation, dan sebagai katalis. Karakteristik zeolit unik, yaitu memiliki kemampuan katalitik yang dapat membantu mempercepat reaksi, stabil pada suhu tinggi, tahan terhadap pelarut organik, dan sifat yang keras membuat zeolit lebih stabil terhadap tekanan mekanik yang tinggi, sehingga enzim yang terjerap lebih stabil. Rangka dan pori dari struktur zeolit yang seragam menyebabkan selektivitas dan reprodusibilitas yang dihasilkan tinggi (Valdes et al. 2006).
Penggunaan nanopartikel emas pada amina yang terfungsionalisasi pada zeolit Na-Y untuk mengimobilisasi pepsin telah dilakukan Mukhopadhyay et al.
(2003) yang menghasilkan aktivitas katalitik baik, di atas tujuh kali penggunaan kembali. Balal et al. (2009) menggunakan nanopartikel berupa zeolit termodifikasi FeCl3 pada elektroda pasta karbon sebagai biosensor untuk mengukur dopamine dan triptopan yang menghasilkan arus lebih tinggi dibandingkan elektroda pasta karbon dengan mediator FeCl3 tanpa penambahan zeolit. Gia (2012) melakukan imobilisasi enzim pada zeolit yang meningkatkan aktivitas GDH pada biosensor glukosa berdasarkan nilai Imaks-nya. Selain itu, Liyonawati (2012) juga menggunakan zeolit sebagai matriks untuk mengimobilisasi ekstrak E.coli yang menghasilkan hasil lebih baik pada biosensor antioksidan. Penelitian yang dilakukan oleh Iswantini et al. (2013) memaparkan bahwa penggunaan zeolit sebagai matriks imobilisasi ekstrak D. radiodurans
meningkatkan aktivitasnya dalam biosensor antioksidan, tetapi masih perlu ditingkatkan agar penggunaan biosensor dapat digunakan dalam jangka waktu yang lama. Oleh karena itu, pada penelitian ini akan dibuat biosensor antioksidan berbasis SOD dari bakteri D. radiodurans yang diimobilisasi pada zeolit dan dilakukan optimasi campuran zeolit dengan enzim, suhu, dan pH dalam pembuatan elektroda agar aktivitas dan stabilitasnya lebih baik. Penelitian ini bertujuan melakukan optimasi aktivitas SOD ekstrak D. radiodurans
3
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain pipet mikro, pinset, batang gelas, sel elektrokimia, neraca analitik, pH meter, oven, tanur, potensiostat-galvanostat eDAQ yang dilengkapi dengan perangkat lunak Echem v2.1.0 dan Minitab 14, laminar air flow, incubator, High Speed Refrigerated Centrifuge KUBOTA 6500,
Centrifuge 5415 R, autoklaf, Ultrasonic Homogenizer UH-150, spektrofotometer ultraviolet tampak (berkas ganda), dan alat-alat gelas lainnya. Bahan-bahan yang digunakan adalah media LB untuk pertumbuhan Deinococcus radiodurans, sel D.
radiodurans, grafit, ferosena, parafin cair, zeolit alam Bayah, xantina oksidase
(XO), xantina, dimetil sulfoksida (DMSO), bufer fosfat, HCl 3M, asam askorbat, etanol 95%, ekstrak daun jambu biji, DPPH, AgNO3, membran dialisis, jaring nilon, dan parafilm.
Metode
Penelitian ini terdiri atas beberapa tahap percobaan, yaitu penumbuhan sel
Deinococus radiodurans dan ektraksi SOD, aktivasi zeolit, pembuatan elektroda, imobilisasi enzim, optimasi aktivitas antioksidan ekstrak D. radiodurans, pengukuran keterulangan, penentuan limit deteksi (LOD) dan limit kuantisasi (LOQ). Bagan alir penelitian secara umum dilampirkan pada Lampiran 1.
Penumbuhan sel Deinococcus radiodurans dan ekstraksi protein sitoplasma D. radiodurans
Bakteri Deinococcus radiodurans ditumbuhkan pada media LB (Luria Bertani) yang mengandung tripton 1% (b/v) , yeast extract 0.5% (b/v), glukosa 0.2% (b/v), NaCl 0.5% (b/v), dan alcohol. Selanjutnya diinkubasi selama 48 jam pada 300C. Sel dipanen dengan sentrifugasi kecepatan 7000 rpm selama 10 menit untuk memisahkan sel bakteri dengan media. Sel (pelet) dicuci beberapa kali dengan larutan buffer posfat pH 9.0 dan disuspensikan kembali dalam larutan bufer fosfat pH 9.0. Suspensi sel di sonikasi dengan pulsa 50% dan output 5 untuk memecahkan sel bakteri yaitu dengan interval 2 × 10 menit dan interval berhenti 1 menit. Selama sonikasi suspensi sel didinginkan dalam penangas es. Selanjutnya disentrifugasi 10000 rpm selama 30 menit untuk memisahkan supernatan dan pelet. Ekstrak kasar
(crude extract) enzim berada disupernatan. Ekstrak selanjutnya diukur nilai
serapannya pada panjang gelombang 260 nm dan 280 nm untuk mengetahui konsentrasi protein yang dihitung melalui persamaan :
[Enzim]= (1.55 × Absorban 280 nm) - (0.76 × Absorban 260 nm) × 1000 × FP (Wilfinger et al. 1997) Pembuatan Elektroda Pasta Karbon Termodifikasi Ferosena
4
dicampur dengan 35 L parafin cair hingga membentuk pasta. Pasta karbon
dimasukkan ke dalam badan elektroda hingga padat sampai permukaan. Permukaan elektroda dihaluskan dan dibersihkan dengan amplas dan kertas minyak (Trivadila 2011).
Aktivasi Zeolit
Sebanyak 50 gram zeolit Bayah dicuci dengan akuades sampai pH netral, kemudian disaring dengan ayakan ukuran 50 mesh dan dikeringkan dalam oven pada 105 °C selama 3 jam. Zeolit yang telah kering diaktivasi dengan menambahkan 250 mL HCl 3 M ke dalam gelas piala dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring, kemudian dicuci menggunakan akuades sampai pH netral. Larutan hasil saringan diuji kandungan klorida dengan AgNO3 dan dicuci kembali dengan akuades sampai tidak mengandung klorin. Setelah pH netral dan bebas klorin, zeolit dikeringkan pada suhu 300 °C selama 3 jam. Zeolit kemudian dihaluskan dan diayak dengan ayakan 100 mesh (Arif 2011).
Optimasi aktivitas SOD dari Bakteri Deinococcus Radiodurans terimobilisasi
Optimasi yang dilakukan adalah optimasi suhu (20-40 °C), pH (7-11), dan konsentrasi zeolit (25-250 mg). Metode yang digunakan untuk pengoptimuman aktivitas SOD adalah Response Surface Method. Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya.
Imobilisasi Ekstrak Deinococcus radiodurans
Sebanyak 30 mg zeolit Bayah dicampur dengan 10 mL akuades dengan alat
vortex sehingga membentuk suspensi 3 mg/mL. sebanyak 20 L ekstrak
Deinococcus radiodurans dalam bufer fosfat pH 9.0 dicampur dengan 10 L
suspensi zeolit dan didiamkan selama 10 menit lalu diteteskan 10 L pada
permukaan elektroda, didiamkan hingga pelarutnya menguap, dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektroda dapat langsung digunakan untuk pengukuran aktivitas antioksidan ekstrak D. radiodurans dengan metode voltametri siklik. Elektroda direndam dalam bufer fosfat pH 9.0 pada suhu 4 °C ketika tidak digunakan untuk memberikan keadaan yang sama dengan lingkungan sebenarnya (Dai et al. 2004). Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan metode voltametri siklik dengan menggunakan eDAQ potensiostat galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Elektroda yang digunakan adalah elektroda Ag/AgCl sebagai elektroda rujukan, platina sebagai counter dan elektroda pasta karbon dan zeolit sebagai elektroda kerja. Parameter pengukuran dibuat sebagai berikut :
5
Lower E : -500 mV
Range : 5 V
Larutan bufer fosfat sebanyak 1.9 mL ditambahkan kedalam sel pengukuran dan puncak arus anoda yang terbentuk diamati sebagai blanko. Kemudian ditambahkan 100 L larutan XO 0.1 U/mLdan 1 mL larutan xantina 2.1 mM. Selanjutnya diukur kembali perubahan atau kenaikkan puncak arus anoda yang terjadi.
Pengukuran keterulangan elektrode pasta karbonsecara voltametri siklik (A0AC 2002)
Keterulangan pengukuran ditentukan dengan melakukan pengukuran pada enzim SOD pada konsentrasi optimum selama 10 kali, kemudian dihitung simpangan baku (SB) menggunakan persamaan berikut:
SB = �−��
2
�−1
Persen RSD yang menunjukkan kesalahan pengukuran arus dihitung dengan persamaan berikut:
%RSD = ��
� × 100%
Perbandinganlimit deteksi dan limit kuantisasi dengan metode elektrokimia dengan Spektrofotometri.
Pengukuran dilakukan pada kondisi optimum. Elektrode ditempatkan dalam sel pengukuran yang mengandung enzim 100 L xantin oksidase 0.1 Unit/mL, kemudian 1 mL xantinaditambahkan secara bertahap dan setiap penambahan diukur perubahan arus yang dihasilkan. Selanjutnya pengukuran diulang dengan penambahan 0.5 mL vitamin C dengan variasi konsentrasi 1.25; 2.5; 5; 10; dan 20 ppm. Data kemudian diplot dalam kurva dengan sumbu-x adalah konsentrasi vitamin C dan respon arus (mA) pada sumbu-y, sehingga diperoleh persamaan redresi dengan kemiringan tertentu.
Perbandingan metode elektrokimia dengan metode spektrofotometri dilakukan dengan melihat hasil yang diperoleh dari pengukuran menggunakan spektrofotometer dan biosensor antioksidan. Spektrofofotometri dengan metode DPPH dilakukan pengukuran kapasitas antioksidan vitamin C. Vitamin C dibuat dengan konsentrasi 1.25; 2.5; 5; 10; dan 20 ppm. Sebanyak 4 mL DPPH 125 M ditambahkan kedalam 2 mL masing-masing sampel tersebut. Selanjutnya, dilakukan inkubasi selama 30 menit dalam suhu ruang. Diukur pada panjang gelombang 517 nm. Nilai limit deteksi (LOD) dan (LOQ) hasil pengukuran dengan metode elektrokimia dibandingkan dengan hasil yang diperoleh dari spektrofotometri. Penentuan LOD dan LOQ :
LOD = 3 × �� LOQ = 10 × ��
6
HASIL DAN PEMBAHASAN
Penumbuhan sel Deinococcus radiodurans dan ekstraksi enzim SOD
Pertumbuhan bakteri merupakan pertambahan jumlah volume, ukuran sel, volume, dan ukuran sel serta bertambahnya jumlah sel. Pertumbuhan sel bakteri mengikuti suatu pola tertentu berupa kurva pertumbuhan sigmoid yang menunjukkan empat fase pertumbuhan, yaitu fase log (fase lambat), fase eksponensial (fase cepat), fase stasioner (fase statis), dan fase kematian populasi. Pada fase eksponensial komposisi sel dan konsentrasi metabolit relatif konstan. Pertumbuhan bakteri memerlukan media nutrisi untuk memenuhi kebutuhan energi, sebagai bahan pembangun sel, untuk sintesis protoplasma, dan bagian-bagian sel lainnya. Media pertumbuhan yang digunakan pada penelitian adalah media LB (Luria Bertani). Media ini mengandung campuran zat-zat makanan (nutrisi) berupa tripton, NaCl, dan ekstrak khamir yang diperlukan bagi pertumbuhan D. radiodurans. Penambahan tripton sebagai vitamin, NaCl sebagai sumber mineral, dan ekstrak khamir sebagai nutrisi makanan bakteri.
Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48 jam dengan suhu 30 °C. Setelah tumbuh, bakteri dipindahkan ke dalam media LB cair dan diinkubasi. Selanjutnya bakteri dipisahkan dari media tumbuhnya dengan cara di sentrifugasi dan direndam dengan larutan NaCl 0.85% (b/v). Larutan NaCl 0.85% (b/v) berfungsi sebagai pelarut yang disamakan dengan habitat hidup bakteri. Sel bakteri dipecah untuk mengekstrak protein sitoplasma yang mengandung enzim SOD dengan menggunakan ultrasonic homogenizer. Protein yang terkestrak memiliki konsentrasi sebesar 2141.67 g/ml (Lampiran 2).
Pengukuran Arus Elektrode Pasta Karbon
Elektrode pasta karbon yang telah dibuat harus seragam panjang kawat Cu, besar diameter batang elektrode, dan tinggi grafit pasta karbon pada elektrode. Elektrode pasta karbon tersebut dikarakterisasi dengan larutan K3[Fe(CN)6] dengan larutan elektrolit pendukung KCl 0.1 M dengan teknik voltametrik siklik untuk melihat adanya puncak dan arus oksidasi reduksi elektode yang dihasilkan. Kelebihan teknik voltametri siklik adalah sensitifitasnya yang tinggi, limit deteksi yang rendah, dan daerah linier yang lebar (Mulyani et al. 2012). Berikut adalah reaksi redoks yang terjadi :
7 voltamogram yang cukup seragam digunakan untuk pengukuran optimasi, keterulanagn, dan perbandingan aplikasi metode biosensor dengan spektrofotometer.
Gambar 1 Voltamogram siklik pada pengukuran larutan K3Fe (CN)6 0.01M Aktivasi Zeolit
Zeolit alam yang digunakan pada penelitian ini adalah zeolit Bayah yang berasal dari Bayah, Jawa Barat. Zeolit Bayah adalah jenis klinoptilolit dengan rumus molekul Na3K3[Al6Si30O72]24.H2O. Zeolit alam mempunyai bentuk kristal teratur dan pori yang tersebar merata. Zeolit Bayah diaktivasi secara fisika dan kimia untuk mengilangkan pengotor. Aktivasi secara fisika mencuci zeolit dengan akuabides untuk menghilangkan pengotor seperti debu dan tanah yang masih terdapat dalam zeolit. Selanjutnya dikeringkan dalam oven pada suhu 105 °C selama 3 jam membantu mengeluarkan pengotor dan menguapkan kotoran yang masih tertahan di permukaan zeolit. Aktivasi secara kimia dilakukan dengan HCl 3 M untuk menghilangkan pengotor yang bersifat asam yang larut dalam HCl (Dai
et al. 2004). Selanjutnya dicuci sampai pH netral dan diuji AgNO3 untuk menguji kandungan klorida pada zeolit hingga diperoleh zeolit Bayah ukuran 100 mesh.
Karakteristik zeolit yang stabil pada temperatur tinggi, tahan terhadap pelarut organik, dan sifatnya yang keras sehingga lebih stabil terhadap tekanan mekanik yang tinggi menyebabkan enzim yang terjerap akan lebih stabil. Rangka dan pori dari struktur zeolit yang seragam menyebabkan selektivitas dan reprodusibilitasnya yang dihasilkan tinggi (Valdes et al. 2006). Zeolit bersifat hidrofilik dengan adanya gugus –OH disekitar pori sehingga cocok untuk imobilisasi enzim yang menghasilkan arus yang kuat (Valdes et al. 2006). Zeolit selain dapat digunakan sebagai material penyangga juga memiliki kemampuan katalitik yang membantu mempercepat reaksi (Dai et al. 2004).
Imobilisasi Enzim
Imobilisasi enzim dilakukan pada permukaan material penyangga, yaitu zeolit Bayah untuk menjaga fungsi katalitik enzim pada kondisi ekstrem. Enzim
8
dapat terdenaturasi oleh pH dan suhu yang ekstrem, pelarut organik, dan deterjen. Enzim pada kondisi normal memiliki selektivitas dan sensitivitas yang tinggi. Metode imobilisasi dilakukan untuk menghasilkan respon arus yang tinggi. Enzim SOD diimobilisasi dengan zeolit yang diteteskan pada permukaan pasta karbon termodifikasi ferosena.
Ferosena berfungsi meningkatkan arus yang dihasilkan karena bersifat stabil, tidak bereaksi langsung dengan substrat enzim, potensial redoks yang lebih rendah dari potensial oksidasi zat-zat pengganggu, tidak dipengaruhi oleh Ph dan efek kekuatan ion pada media (Trivadila 2011). Penelitian ini, ferosena telah dicampur rata dengan EPK (elektrode pasta karbon). Cara ini kurang efektif karena menghasilkan arus yang lebih kecil daripada diteteskannnya ke dalam wadah pengukuran arus elektrode. Gambar 2 merupakan salah satu contoh voltamogram siklik yang dihasilkan
Gambar 2 Voltamogram siklik pada suhu 20 °C, bufer fosfat pH 9, dan zeolit 137.5 mg
Pada penelitian ini, penambahan substrat xantina akan menghasilkan reaksi enzimatis xantina dengan xantina oksidase (XO) yang menghasilkan radikal superoksida :
xantina + H2O + O2
��
asam urat + 2H++ 2O2•- (iii)
Selanjutnya, radikal tersebut akan didismutasi membentuk O2 dengan katalis SOD
dengan reaksi :
2H+ + 2O2•- ��� O2 + H2O2 (iv)
9
Gambar 3 Mekanisme pengukuran biosensor antioksidan
Pengoptimuman Aktivitas SOD Terimobilisasi
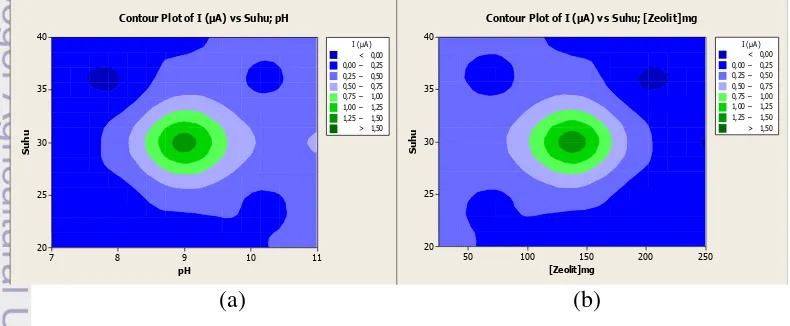
Optimasi aktivitas SOD dari bakteri D. radioduransdilakukan menggunakan metode RSM (response surface method) pada minitab. Faktor kombinasi yang dilakukan optimasi suhu pada rentang (20 ̵ 40 °C), pH (7 ̵ 11), dan zeolit (25 ̵ 250 mg) (Lampiran 3). Hasil analisis RSM menunjukkan plot kontur yang baik dengan bulatan sempurna pada bulatan lebih gelap yang menjelaskan nilai arus tertinggi. Kontur merupakan garis-garis yang menunjukan nilai ekspektasi respon aktivitas berupa arus minimum hingga maksimum. Plot kontur menunjukan hold values
yang akan digunakan sebagai starting value pada response optimizer. Response optimizer berfungsi untuk menganalisis kondisi optimum aktivitas antioksidan dari sel bakteri. Hasil optimum yang diperoleh untuk sel bakteri dengan zeolit, yaitu suhu 30 oC, pH 9, dan zeolit 137.5 mg (Lampiran 4).
Gambar 4 menunjukkan plot kontur hubungan parameter dengan respon berupa arus. Dari kontur dapat terlihat suhu, pH, dan zeolit pada awalnya meningkatkan arus, tetapi arus turun pada kondisi tertentu. Ini disebabkan karena enzim bekerja optimal pada suhu dan pH tertentu. Suhu terlalu tinggi menyebabkan enzim terdenaturasi sehingga rusak dan tidak dapat berfungsi lagi, sedangkan suhu yang rendah menyebabkan enzim tidak dapat bekerja dengan optimal. Ketika pH terlalu tinggi atau terlalu rendah dapat menyebabkan penurunan kinerja enzim yang menyebabkan arus juga turun. Penggunaan zeolit yang banyak menyebabkan sulitnya interaksi antara substrat dengan enzim karena terhalangi oleh partikel-partikel zeolit sehingga arus menjadi turun. Penggunaan zeolit yang terlalu sedikit juga akan memberikan respon arus yang kecil.
(a) (b)
10
(c)
Gambar 4 Alur kontur hubungan antara suhu dan pH (a), suhu dan zeolit (b), dan pH dan zeolit (c) terhadap aktivitas antioksidan D. radiodurans. Hasil ini sedikit berbeda dengan penelitian yang telah dilakukan Trivadila (2011) dimana daerah optimum ekstrak enzim SOD adalah pH 9, suhu 27.50C.
Weniarti (2011) dan Atmadi (2014) melakukan optimasi aktivitas SOD D.
radiodurans terimobilisasi menghasilkan daerah optimum pada pH 9, shu 30 °C, dan
zeolit 156.8 mg. Sedangkan Campanella et al. (2000) mengimobilisasi SOD pada permukaan elektrode oksigen di antara membran dialisis dan membran selulosa triasetat pada pH 7 dan suhu 20 °C. Proses imobilisasi yang berbeda akan mempengaruhi pada suhu dan pH berapa daerah optimumnya.
Hasil uji keterulangan elektrode pasta karbon secara voltametri siklik diperoleh nilai rerata arusnya 1.749 µA dengan standar deviasi 0.01 dan persen RSD 0.59 (Lampiran 5). Hasil ini menunjukkan bahwa hasil yang diperoleh cukup baik .
Limit Deteksi dan Limit Kuantitatif dengan metode elektrokimia dan spektrofotometri
Penentuan limit deteksi (LOD) dan limit kuantitatif (LOQ) menggunakan metode elektrokimia dan spektrofotometri. Limit deteksi dan limit kuantitatif dilakukan dengan mengukur puncak arus yang dihasilkan dengan penambahan vitamin C dengan berbagai konsentrasi. Penentuan limit deteksi dilakukan dengan vitamin C sebagai standar dan sebagai contoh juga dilakukan menggunakan sampel ekstrak daun jambu biji. Pengukuran ini dilakukan pada kondisi optimum yaitu, suhu 30 ᵒC, pH 7 dengan zeolit 137.5 mg. Dibawah ini merupakan kurva hubungan penurunan arus yang dihasilkan dengan penambahan vitamin C. Semakin besar konsentrasi vitamin C yang ditambahkan maka arus yang dihasilkan akan semakin kecil karena sifatnya antioksidan. Hubungan penurunan arus terhadap penambahan vitamin C terlihat pada Gambar 5
[Zeolit]mg
11
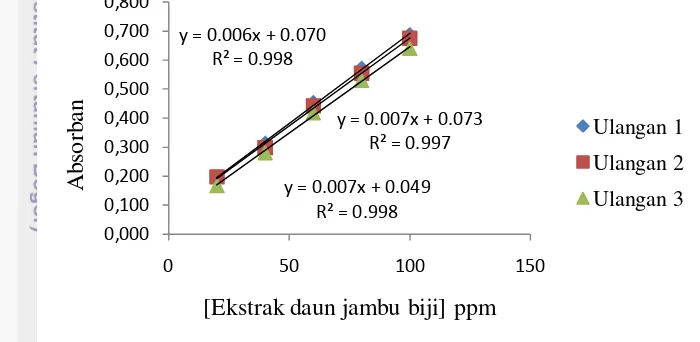
Gambar 5 Hubungan penurunan arus terhadap penambahan vitamin C Nilai LOD dan LOQ rerata yang diperoleh dari pengukuran tersebut sebesar 1.76 ppm dan 5.88 ppm (Lampiran 6). Di bawah ini hubungan arus yang dihasilkan terhadap penambahan ekstrak daun jambu biji dapat dilihat pada Gambar 6
Gambar 6 Hubungan penurunan arus terhadap penambahan ekstrak daun jambu biji
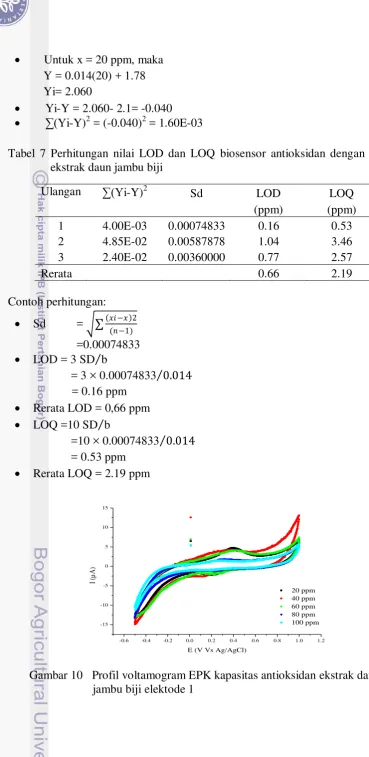
Nilai LOD dan LOQ rerata yang diperoleh dari pengukuran menggunakan sampel ekstrak daun jambu biji sebesar 0.66 ppm dan 2.19 ppm (Lampiran 7).
12
Gambar 7 Hubungan absorban yang dihasilkan dengan penambahan vitamin C Nilai LOD dan LOQ rerata yang diperoleh dari pengukuran menggunakan vitamin C sebesar 2.01 ppm dan 6.70 ppm (Lampiran 8). Di bawah ini merupakan hubungan absorban yang dihasilkan terhadap penambahan ekstrak daun jambu biji dapat dilihat pada Gambar 8
Gambar 8 Hubungan absorban yang dihasilkan dengan penambahan ekstrak daun jambu biji
Nilai LOD dan LOQ rerata yang diperoleh dari pengukuran menggunakan sampel ekstrak daun jambu biji sebesar 1.21 ppm dan 8.35 ppm (Lampiran 9).
Tabel 1 Perbandingan nilai LOD dan LOQ yang diperoleh dengan kedua metode Nilai Metode Elektrokimia Metode Spektrofotometri
Pengukuran kapasitas antioksidan menggunakan kedua metode tersebutterlihat bahwa menggunakan biosensor jauh lebih sensitif dan tepat dibandingkan dengan metode spektrofotometri. Limit deteksi yang dihasilkan
13 metode elektrokimia lebih kecil daripada menggunakan spektrofotometri. Metode spektrofotometeri sangat dipengaruhi oleh kekeruhan larutan. Hal ini berbeda dengan biosensor yang tidak dipengaruhi oleh kekeruhan larutan, sehingga tidak diperlukan pengenceran berkali-kali yang dapat menyebabkan berkurangnya ketelitian. Selain itu, ketika ekstrak daun jambu biji direaksikan dengan DPPH harus diinkubasi selama 30 menit terlebih dahulu agar bereaksi sempurna. Metode pengukuran dengan spektrofotometri memerlukan bahan kimia yang bermacam-macam dan jumlah yang banyak. Menggunakan biosensor tidak diperlukan inkubasi karena radikal adalah senyawa yang tidak stabil yang harus segera diukur. Penggunaan biosensor lebih cepat, akurat dan menghasilkan limit deteksi yang baik dibandingkan dengan spektrofotometri.
SIMPULAN DAN SARAN
Simpulan
Kondisi optimum bagi aktivitas SOD imobilisasi adalah pada pH 9, suhu 30 °
C, dan zeolit 137.5 mg. Hasil keterulangan optimasi pengukuran elektrode pasta karbon diperoleh arus sebesar 1.749 µA dengan standar deviasi 0.01 dan RSD 0.59%. Hasil pengukuran LOD dan LOQ menggunakan metode elektrokimia lebih kecil dibandingkan dengan spektrofotometri, sehingga dengan menggunakan biosensor dapat mendeteksi suatu analit dengan konsentrasi yang lebih kecil. Selain itu dengan menggunakan metode elektrokimia tidak memerlukan waktu yang lama, jumlah bahan kimia yang digunakan juga lebih sedikit dibandingkan metode spektrofotometri.
Saran
Perlu dilakukan penelitian lanjutan untuk meningkatkan untuk melihat parameter sensitivitas, linearitas, stabilitas, dan ketelitian. Perlu dilakukan juga penentuan kapasitas antioksidan dari berbagai sampel seperti kedawung, ekstrak buah, dan sebagainya.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2002. AOAC Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals. [Internet]. [diunduh pada 2013 10 Juli]. Tersedia pada: http://www.aoac.org/Official_Methods/slv_guidelines.pdf. Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media
pendeteksi. [tesis]. Bogor: FMIPA, IPB.
14
biosensor antioksidan. 2014. [skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor.
Balal K, Mohammad H, Bahareh , Ali B.Maryam H, Mozhgan Z. 2009. Zeolite nanoparticle modified carbon paste electrode as a biosensor for simultaneous determination of dopamine and tryptophan. J Chin Chem. 56 : 789-796.
Bhatia R, Gupta AK, Anup KS, Brinker CJ. 2000. Aqueous sol-gel process for protein encapsulation. Chem Mater. 12: 2434-2441.
Campanella L, Favero G,Persi L, Tommaseti M. 2000. New biosensor for superoxide radical used to evidence molecules of biomedical and pharmaceutical interest having radical scavenging properties. J Pharm BiomAn. 23: 69-76.
Coban S. 2008. Development of biosensors for determination of the total antioxidant capacity. [thesis]. Izmir: Department of Chemical Engineering, Izmir Institute of Technology.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytochrome c immobilized on a NaY zeolite matrix and its application in biosensing. Electro Acta. 49 : 2139–2144.
Esumi K, Takei N & Yoshimura T. 2003. Antioxidant-potentiality of gold chitosan nanocomposites. Colloids and Surfaces B: Biointerfaces. 32 (2): 117–125.
Gil DM de Albuquerque. 2011. Biosensor evaluation of the antioxidant activity of wines and teas, interference studies and comparison with other methods. [thesis]. Lisbon: Chemical/Biochemical Department, Lisbon University. Goriushkina TB, Kurç BA, Sacco A, Dzyadevych SV. 2010. Application of
zeolites for glucose oxidase in amperometric biosensors. Sens Elect & Microsys Tech 1: 36-42.
Iswantini D, Nurhidayat N, Trivadila. 2013. Antioxidant biosensor using microbe.
Engineering and Technology 78: 232-246. DOI: 10.5454/mi.5.1.2
Kirdeciler SK, Soy E, Ozturk S, Kucherenko I, Soldatkin O, Dzyadevych S, Akata B. 2011. A novel urea conductometric biosensor based on zeolite immobilized urease. Talanta 85: 1435–1441.
Liyonawati. 2012. Aktivitas dan stabilitas superoksida dismutase dari ekstrak
Escherichia coli diimobilisasi pada zeolit alam sebagai biosensor antioksidan. [skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor. Mukhopadhyay K, Phadtare S, Vinod VP, Kumar A, Rao M, Chaudhari RV, and
Sastry M. 2003. Gold nanoparticles assembled on amine-functionalized
Na−Y zeolite: a biocompatible surface for enzyme immobilization.
Langmuir. 19 (9): 3858-3863.
Mulyani R, Buchari, Noviandri Indra, Ciptati. 2012. Studi voltametri siklikk sodium dedocyl benzen sulfonat dalam berbagai elektroda dan elektrolit pendukung. Journal of Waste Management Technology. 15: 131-144.
Prieto-Simon B, Cortina M, Campas M, Calas-Blanchard C. 2008. Electrochemical biosensor as a tool for antioxidant capacity assessment.
SensActuators B 129: 459–466.
15 Shumyantseva VV, Carrara S, Bavastrello V, Riley DJ, Bulko TV, Skryabin KG,
Archakov AI, & Nicolini C. 2005. Direct electron transfer between cytochrome P450scc and gold nanoparticles on screen-printed rhodium– graphite electrodes. Biosensors and Bioelectronics. 21: 217–22.
Trivadilla. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococcus radiodurans yang diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya [tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor.
Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and zeolite based materials in analytical chemistry. J Trends Anal Chem 25: 24-30. Wang K. 2009. Direct Electrochemistry and Electrocatalysis of Glucose Oxidase
Immobilized on Glassy Carbon Electrode Modified by Nafion and Ordered Mesoporous. Journal of molecularCatalysis B: Enzymatic 58: 194–198 Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase
Deinococcus radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia.[tesis]. Bogor: Program Pacasarjana, Institut Pertanian Bogor. Wilfinger, W.W., Mackey, K. and Chomczynski, P. 1997. Effect of pH and ionic
strength on the spectrophotometric assessment of nucleic acid purity.
Biotechniques 22: 474-481.
16
Lampiran 1 Bagan alir penelitian
Inkubasi 48 jam dan suhu 30 °C
Sentrifugasi 7000 rpm, waktu 10 menit Bakteri D.
Radiodurans
Media LB cair
Ekstrak SOD
Zeolit bayah
Supernatan Pelet
Pelet
Pelet Ekstrak kasar
(crude extract)
Diimobilisasi zeolit
Aktivitas optimum SOD
Keterulangan
LOD dan LOQ metode elektrokimia
LOD dan LOQ metode DPPH
Sentrifugasi 10000 rpm, waktu 10
17 Lampiran 2 Ekstraksi SOD
EkstrakSOD Absorbans 260 nm
Absorban 280 nm
[Enzim]
g/ml
Ulangan 1 0.353 0.240 2074.4
Ulangan 2 0.358 0.248 2246.4
Ulangan 3 0.349 0.239 2104.2
Rerata 2141.667
[Enzim]= (1.55 × Absorban 280 nm) - (0.76 × Absorban 260 nm) × 1000 × FP = (1.55 × 0.240) - (0.76 × 0.353) × 1000 × 20
= 2074.4 g/ml
[Enzim]rerata = �� �� � 1+�� �� � 2+�� �� � 3 3
= 2074 .4 g/ml +2246 .4 g/ml +2104 .2 g/ml 3
18
Lampiran 3 Kombinasi faktor-faktor peubah bebas bakteri D. radiodurans dengan penambahan zeolit
Suhu
(0C) pH
Zeolit (mg)
35.95 10.19 204.39
30.00 9.00 137.50
35.95 7.81 204.39
30.00 9.00 25.00
24.05 10.19 204.39
30.00 9.00 137.50
24.05 7.81 70.61
30.00 9.00 137.50
20.00 9.00 137.50
30.00 11.00 137.50
24.05 10.19 70.61
40.00 9.00 137.50
35.95 7.81 70.61
30.00 7.00 137.50
30.00 9.00 137.50
30.00 9.00 137.50
30.00 9.00 137.50
24.05 7.81 204.39
35.95 10.19 70.61
19 Lampiran 4 Hasil optimasi bakteri D. radiodurans dengan penambahan zeolit
Suhu pH Zeolit (mg)
I (µA) 35.95 10.19 204.39 0.009 30.00 9.00 137.50 1.721 35.95 7.81 204.39 -0.084 30.00 9.00 25.00 0.347 24.05 10.19 204.39 0.047 30.00 9.00 137.50 1.742 24.05 7.81 70.61 0.065 30.00 9.00 137.50 1.739 20.00 9.00 137.50 0.043 30.00 11.00 137.50 0.510 24.05 10.19 70.61 0.369 40.00 9.00 137.50 0.231 35.95 7.81 70.61 -0.009 30.00 7.00 137.50 0.068 30.00 9.00 137.50 1.736 30.00 9.00 137.50 1.728 30.00 9.00 137.50 1.741 24.05 7.81 204.39 0.081 35.95 10.19 70.61 0.421 30.00 9.00 250.00 -0.005
20
Lampiran 5 Keterulangan pengukuran hasil atioksidan D. radiodurans kondisi optimum
Elektrode I (µA)
1 1.738
2 1.751
3 1.734
4 1.740
5 1.749
6 1.745
7 1.761
8 1.748
9 1.767
10 1.755
Irerata (µA) 1.749
Sd 0.01
%RSD 0.59
I rerata (µA) = �(µA)
�
= 1.749 (µA)
Sd = ��−�
(�− ) = 0.0102827 %RSD = ��
�
21 Lampiran 6 Penentuan LOD dan LOQ metode elektrokimia
Tabel 2 Data arus oksidasi terhadap konsentrasi vitamin C Vitamin C
Tabel 3 Perhitungan kuadrat selisih arus elektrode 1, 2, dan 3 vitamin C
Absorban Ulangan Vitamin C (ppm)
22
23 Lampiran 7 Penentuan LOD dan LOQ metode Elektrokimia menggunakan
ekstrak daun jambu biji
Tabel 5 Data arus oksidasi terhadap konsentrasi ekstrak daun jambu biji Vitamin C
Tabel 6 Perhitungan kuadrat selisih arus elektrode 1, 2, dan 3 ekstrak daun jambu biji
Absorban Ulangan Ekstrak daun jambu biji (ppm)
24
25 Lampiran 8 Penentuan LOD dan LOQ metode DPPH
Tabel 8 Data absorban terkoreksi terhadap konsentrasi vitamin C Vitamin C
Tabel 9 Perhitungan kuadrat selisih pengukuran kapasitas antioksidan vitamin C dengan spektrofotometri
Absorban Ulangan Vitamin C (ppm)
26
Y = 0.030 (20) + 0.261 Yi= 0.299
Yi-Y = 0.299- 0.258 = 0.041
∑(Yi-Y)2 = (0.041)2 = 1.64E-03
Tabel 10 Nilai LOD dan LOQ vitamin C dengan spektrofotometri Ulangan ∑(Yi-Y)
2
Sd LOD LOQ
(ppm) (ppm)
1 6.38E-02 0.01856129 1.86 6.19 2 4.58E-02 0.01751949 2.10 7.01 3 8.04E-02 0.02144894 2.08 6.92
Rerata 2.01 6.70
Contoh perhitungan:
Sd = ��−�
(�− ) = 0.01856129
LOD = 3 SD b
= 3 × 0.01856129 0.030
= 1.86 ppm
Rerata LOD = 2,01139ppm
LOQ =10 SD b
=10 × 0.01856129 0.030
= 6.19 ppm
27 Lampiran 9 Penentuan LOD dan LOQ metode DPPH menggunakan ekstrak daun
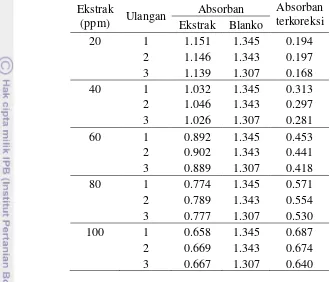
jambu biji
Tabel 11 Data absorban terkoreksi terhadap konsentrasi ekstrak daun jambu biji Ekstrak
Tabel 12 Perhitungan kuadrat selisih pengukuran kapasitas antioksidan ekstrak daun jambu biji dengan spektrofotometri
Absorban Ulangan Ekstrak (ppm)
28
Untuk x = 20 ppm, maka Y = 0.006(20) + 0.070 Yi= 0.190
Yi-Y = 0.190- 0.194= -0.004
∑(Yi-Y)2 = (-0.004)2 = 1.60E-05
Tabel 13 Nilai LOD dan LOQ dengan sampel ekstrak daun jambu biji menggunakan spektrofotometri
Ulangan ∑(Yi-Y)2
Sd LOD LOQ
(ppm) (ppm)
1 2.89E-04 0.00023898 0.12 0.34 2 2.21E-02 0.00368114 1.56 5.26 3 2.35E-02 0.00453395 1.94 1.44
Rerata 1.21 8.35
Contoh perhitungan:
Sd = ��−�
(�− ) = 0.00023898
LOD = 3 SD b
= 3 × 0.00023898 0.006
= 0.12 ppm
Rerata LOD = 1.21 ppm
LOQ =10 SD b
=10 × 0.00023898 0.006
= 0.34 ppm
29
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh, Sumatera Barat pada tanggal 27 Agustus 1992 dari pasangan Ceprison dan Afrida. Penulis merupakan anak ketiga dari tiga bersaudara. Penulis menempuh pendidikan di SMA Negeri 1 Payakumbuh hingga tahun 2010 dan pada tahun yang sama diterima melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Kimia IPB. Selama aktif di perkuliahan penulis bergabung ke dalam berbagai kepanitiaan. Penulis juga aktif sebagai asisten praktikum Kimia Lingkungan (2011-2012) dan asisten mata kuliah PKF (2013-2014).
Selama masa aktif penulis pernah mendapatkan beasiswa Bantuan Belajar Mahasiswa (BBM) (2011-2014). Kegiatan Praktik Lapangan diikuti penulis di Balai Riset dan Standardisasi Industri Padang dan menulis laporan yang berjudul