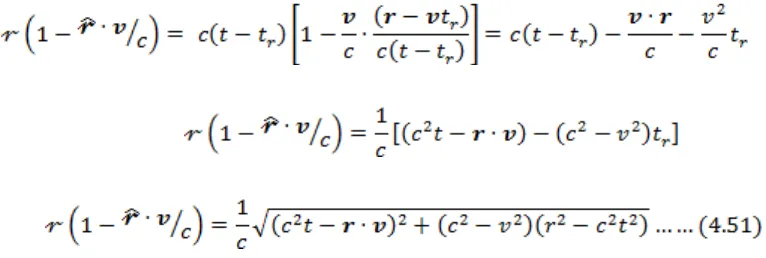31
DAFTAR PUSTAKA
Anugraha, R., 2005, Pengantar Teori Relativitas dan Kosmologi,UGM PRESS :Yogyakarta.
Beiser Arthur, 1999,Konsep Fisika Modern, Edisi keempat,Erlangga :Jakarta. Behera,H.,Effect of relativistic correction to the Coulomb Potensial on the Energy
Levels of Hydrogen Atom.arXiv:1201.1619v2[physics.gen-ph] 10 January 2012:Mumbai.
Goldstein, H.,1980, Classical Mechanics,Second edition,Addison Wesley :Massachusetts.
Pauling, Wilson.1935.Introduction to Quantum Mechanics with Application to Chemistry. McGRAW-HILL BOOK COMPANY:New York.
Purwanto, Agus,2006, Fisika Kuantum, Gava Media : Yogyakarta.
Schiff, Leonard, 1939. Quantum Mechanics, Second edition,McGRAW-HILL BOOK COMPANY : New York.
Sokolov,Loskutov.1966.Quantum Mechanics.Publishing House of Ministry of Education of RSFSR: Moskow.
Zettili, Nouredine, 2009, Quantum Mechanics Concepts and Applications, Second Edition, John Wiley & Sons, Ltd: United Kingdom.
PENGARUH RELATIVISTIK TERHADAP KOREKSI POTENSIAL COULOMB PADA TINGKAT ENERGI ATOM HIDROGEN
ABSTRAK
Telah dilakukan penelitian bahwa potensial Coulomb dipakai untuk mengetahui struktur atom hidrogen. Namun, menurut teori kuantum, hal ini tidak sepenuhnya benar karena pada dasarnya elektron pada atom hidrogen bergerak dengan kecepatan mendekati kecepatan cahaya. Pengaruh kecepatan ini elektron ini tidak diperhitungkan dalam menyusun struktur atom hidrogen secara klasik, sedangkan menurut teori kuantum, pengaruh kecepatan elektron ini berperan dalam efek pengurangan potensial (potensial Li nard-Wiechert). Koreksi terhadap pengurangan potensial Coulomb harus diperhitungkan dalam menyusun tingkat-tingkat energi atom hidrogen, yang secara
ekspektasi mekanika kuantum memiliki nilai . Nilai ini akan
mengubah nilai eigen standard pada energi atom hidrogen. Koreksi ini juga memunculkan degenerasi pada spektrum atom hidrogen.
v
EFFECT OF RELATIVISTIC TO THE COULOMB POTENTIAL CORRECTION ON THE ENERGY LEVEL OF HYDROGEN ATOM
ABSTRACT
Based on expreriments have done, it is argued that Coulomb potential to study of energy levels of hydrogen atom. But, according to quantum theory, it is not correct one because the electron in the hydrogen atom moves with relativistic speed respect to the nucleus. Classically, this relativistic speed is not included in studying structure of hydrogen atom, however this relativistic speed lifts the efect retardation potential (Li nard-Wiechert potential). This correction has to be included in the energy levels of hydrogen atom, whose quantum mechanical expectation value is estimated at
. This value modifies both standard energy eigenvalue in hydrogen
atom, and lifts the -degeneracy in the spectra of hydrogen atom.
BAB 2
TINJAUAN PUSTAKA
2.1 Potensial Coulomb untuk Partikel yang Bergerak
Dalam bab ini, akan dikemukakan teori-teori yang mendukung penyelesaian
pembahasan pengaruh koreksi relativistik potensial Coulomb atom hidrogen,
antara lain: potensial Coulomb untuk partikel bergerak, model atom Bohr,
transormasi Lorentz, dan persamaan Schrodinger.
Secara umum, potensial dari suatu muatan titik q pada posisi tertentu dinyatakan sebagai
Di mana, R adalah jarak titik dari sumber muatan
Melalui prinsip superposisi, potensial dari sekumpulan muatan adalah
Selanjutnya, adalah menghitung pengurangan potensial, dari suatu muatan
titik q yang bergerak membentuk sudut terhadap jarak R dengan kecepatan v
secara relativistik seperti gambar berikut
R
v
6
Maka akan diperoleh persamaan potensial Coulomb
Di manaR r– vt yakni vektor dari posisi mula-mula dari suatu partikel terhadap titik r, adalah sudut antara R dan v, |v| = v, danc adalah kecepatan cahaya dalam ruang vakum dan t adalah waktu mula-mula. Bila keadaan nonrelativistik muncul
,yakni maka persamaan (2.3) akan kembali ke persamaan (2.1). Prinsip
ini disebut prinsip pengurangan potensial dan dikemukakan oleh
Lienard-Wiechert.
2.2 Model Atom Bohr
Gambaran klasik terhadap inti atom didasarkan pada gaya Coulomb antara inti
bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti.
Sederhananya, pada atom hidrogen, dengan satu proton dan satu elektronyang
terjadi pasti orbit melingkar. Elektron dengan massa medan bermuatan –e bergerak melingkar dengan jari-jari rdan kecepatan tangensial v yang tetap. Gaya tarik Coulomb menyebabkan adanya percepatan sentripetal untuk mempertahankan
gerakannya. Gaya netto yang dialami oleh elektron adalah sebesar gaya
elektrostatik ataupun gaya sentripetal, , sehingga
Dimana = 8,85 x 1012F/m yakni permitivitas ruang hampa. Besarnya gaya yang
dialami bertanda positif namun pada arah –r, dimana rmerupakan vektor pointing satuan dari inti atom menuju posisi elektron. Dari persamaan di atas, dapat
ditentukan energi kinetik elektron (dengan mengabaikan efek relativistik)
Energi potensial dalam hal ini bertanda negatif akibat tanda muatan elektron.
Total energi E = K + V menghasilkan
Secara klasik, elektron berada di sekitar inti (pengaruh gaya Coulomb) tidak
sepenuhnya dapat menggambarkan spektrum atom, sehingga konsep tentang inti
atom mengalami perkembangan berikutnya.
Pada tahun 1911, Niels Bohr memodifikasi model atom. Energi elektromagnetik
terkuantisasi, yakni perkalian bilangan bulat terhadap hfdimana f merupakan frekuensi foton. Bohr menyatakan bahwa orbit elektron hanya dapat terjadi pada
keadaan tertentu dalam geraknya yang kemudian disebut sebagai keadaan stasioner, dimana pada keadaan ini tidak ada radiasi elektromagnetik yang dipancarkan. Pada keadaan ini momentum angular elektron, L merupakan perkalian bilangan bulat dengan konstanta Planck h dibagi 2 . Pada keadaan
stasioner ini momentum anguler dapat bernilai dan tidak pernah
bernilai selain bilangan bulat. Keadaan ini disebut dengan kuantisasi momentum
angular, dan merupakan bagian dari hipotesis Bohr. Hipotesis ini berbeda dengan
hipotesis Planck dan berperan dalam membangun hipotesis kuantisasi energi.
Untuk orbit melingkar, vektor posisi elektron r selalu tegak lurus dengan
momentum linear p. Momentum anguler L = r x p bernilai L = r.p= me.v.r.sehingga postulat Bohr terhadap kuantisasi momentum angular adalah
n merupakan bilangan bulat positif. Persamaan ini memberi solusi kecepatan
setelah menggunakan persamaan ini ke persamaan (2.4) diperoleh
8
Dalam hal ini a0= 0,00529 nm yang disebut sebagai jari-jari Bohr. Persamaan (2.11) merupakan jari- jari elektron yang diizinkan dalam mengorbit atom
hidrogen.
Hasil ini lebih signifikan dan tidak dapat diprediksi oleh pernyataan klasik
sebelumnya. Elektron hanya diizinkan mengorbit dengan jari-jari tertentu. Melalui
persamaan (2.11), diperoleh kecepatan, momentum, dan energi total yang
diizinkan dalam hidrogen
Merupakan kuantisasi kecepatan,
Merupakan kuantisasi momentum (momentum nonrelativistik), dan
Merupakan kuantisasi tingkat energi. Di sini = 13,6 eV yang merupakan energi
dasar sistem. Energi elektron terkuantisasi hanya pada nilai-nilai diskrit yang
diizinkan. Tingkat energi yang paling rendah disebut keadaan dasar, energi
elektron bernilai 13,6 eV. Keadaan yang lebih tinggi, n = 2,3,4,... dengan energi
-3,6 eV, -1,5 eV, -0,85 eV,... disebut keadaan tereksitasi. Bilangan bulat n yang
menandai jari-jari dan tingkat energi yang diizinkan dikenal sebagai bilangan
kuantum utama. Bilangan ini menandai tingkat energi dan keberadaan elektron.
Ketika elektron dan inti terpisah pada jarak tak hingga (n ), maka E = 0. Untuk membawa elektron dari jarak tak hingga menuju keadaan tertentu, n, dibebaskan
energi E = -(Ef- Ei) = |En|. Sebaliknya, bila elektron dipindahkan dari keadaan
n menuju tak hingga, pasti dibutuhkan energi minimum |En|. Energi ini dikenal
sebagai energi ikat pada keadaan n. Bila diberikan lebih banyak energi dari |En|
terhadap elektron, maka kelebihan energi ini akan berubah menjadi energi kinetik
2.3 Transformasi Lorentz
Kaitan antara dan yang rasional memenuhi :
dengan menyatakan faktor pembanding yang tak tergantung dari besaran atau
tetapi dapat merupakan fungsi . Pemilihan parsamaan (2.15) sebagai alternatif
transformasi didasarkan pada pertimbangan-pertimbangan sebagai berikut :
a) Persamaan tersebut linear terhadap x dan , sehingga suatu kejadian dalam
kerangka bersesuaian dengan kejadian tunggal dalam kerangka ,
seperti seharusnya.
b) Bentuk persamaan tersebut cukup sederhana, sehingga pemecahannya
mudah dipahami.
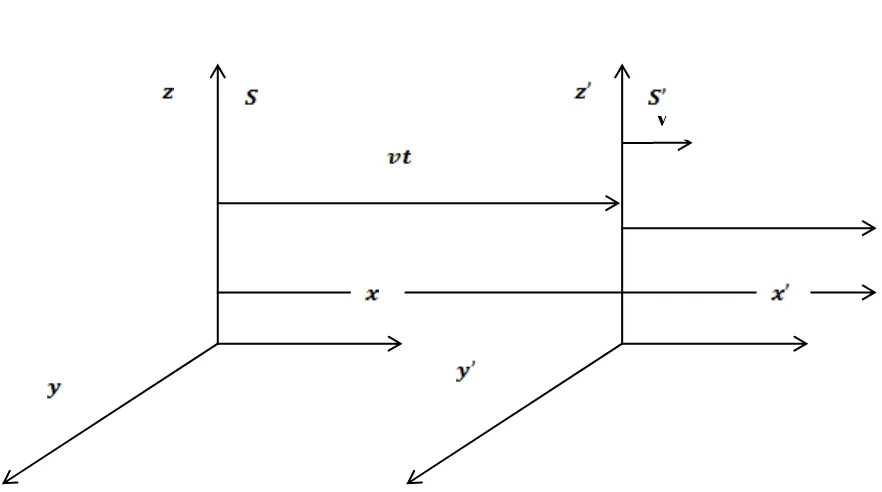
Gambar 2.2. Kerangka acuan S dan Kerangka acuan S’
Menurut postulat pertama relativitas khusus, maka persamaan fisika harus
berbentuk sama dalam kerangka dan , seperti Gambar (2.2), sehingga kaitan
sebagai fungsi dan dapat dinyatakan dalam persamaan berikut:
10
sedangkan pada arah koordinat y’ dan z’ memenuhi persamaan :
Koordinat dan tidak sama, hal ini dapat dilihat dengan mensubstitusi yang
diperoleh dari persamaan (2.15) ke persamaan (2.16) diperoleh :
Dari persamaan ini diperoleh :
Persamaan (2.15), (2.16) hingga persamaan (2.20) merupakan transformasi
koordinat yang memenuhi postulat relativitas khusus.
Pada saat , titik asal kedua kerangka dan berada pada tempat yang sama.
Menurut persamaan awal juga, dan pengamat pada masing-masing
koordinat melakukan pengukuran kelajuan cahaya yang menuju ke titik itu. Kedua
pengamat harus mendapatkan kelajuan yang sama yaitu c. Dalam kerangka S :
sedangkan dalam kerangka :
substitusi dan pada persamaan (2.15) dan (2.20) ke persamaan (2.22),
dihasilkan :
Rumusan di atas sama dengan yang diberikan oleh persamaan (2.21) yaitu
jika kuantitas dalam tanda kurung sama dengan satu, sehingga :
Akhirnya diperoleh nilai :
dengan memasukkan nilai ke persamaan (2.15) diperoleh persamaan
transformasi lengkap dari pengukuran suatu kejadian dalam kerangka terhadap
pengukuran yang sesuai yang dilakukan dalam kerangka :
2.4 Momentum Anguler Orbital
Dalam fisika klasik, momentum anguler partikel dengan momentum p, dan posisi
rdinyatakan dengan
Operator momentum anguler orbital dapat diperoleh dengan menggantikan r
dan pdengan operator yang sesuai untuk posisi dan momentum, dan , dimana
sehingga
12
Namun, momentum anguler bukan pada satu dimensi, sehingga komponen , ,
dan kuadrat dinyatakan sebagai
Karena X, Y dan Z masing-masing komut, begitu juga dengan , dan dan
karena , , diperoleh
Dengan cara yang sama, diperoleh
2.5 Momentum Anguler Spin
Keberadaan spin pertama kali diteliti oleh Stern dan Gerlach tahun 1922 dengan
menggunakan atom perak (Ag). Perak mempunyai 47 elektron, 46 di antaranya
membentuk distribusi muatan simetris yang sferis dan elektron yang ke-47
menempati orbita 5s. Bila atom perak pada keadaan dasar, momentum anguler
orbital totalnya adalah nol, . Pada percobaan Stern-Gerlach, atom perak
melewatimedan magnetik nonhomogen. Bila dalam percobaan, medan meagnetik
dianggap searah sumbu z, secara klasik akan diperoleh pita kontinyu sekitar
. Menurut teori gelombang Schrodinger, bila atom memiliki momentum
anguler orbita , akan terjadi perpecahan menjadi bilangan diskrit (ganjil)
komponen. Andaikan gerakan atom pada keadaan dasar , hanya ada satu titik
yang dapat ditangkap oleh layar, dan apabila awan elektron menepati keadaan 5p
( ) akan terdapat 3 titik pada layar. Secara eksperimen, gerakan atom menurut
prediksitidak seperti fisika klasik maupun teori gelombang Schrodinger.
Mengatasi hal ini. Goudsmith dan Uhlenbeck mengemukakan pendapatnya tahun
intrinsik, yang tidak seperti momentum anguler orbital. Hal ini dinamakan dengan
momentum anguler spin. Tidak seperti momentum anguler orbital, spin tidak
dapat digambarkan dengan operator diferensial. Dari teori klasik elektromegnetik,
momen dipol magnetik orbital diperoleh dari gerak orbital partikel bermuatan q
Di mana L adalah momentum anguler orbital partikel, m adalah massa dan c
adalah kecepatan cahaya. Dengan cara yang sama, diperoleh analisis gerakan spin
elektron sebagai momen dipol magnetik spin
Dengan analogi momentum anguler orbital, partikel yang bercirikan 2 bilangan
kuantum, bilangan kuantum orbital dan bilangan kuantum azimuth
( ). Momentum anguler spin jugan menjadi ciri 2
BAB 2
TINJAUAN PUSTAKA
2.1 Potensial Coulomb untuk Partikel yang Bergerak
Dalam bab ini, akan dikemukakan teori-teori yang mendukung penyelesaian
pembahasan pengaruh koreksi relativistik potensial Coulomb atom hidrogen,
antara lain: potensial Coulomb untuk partikel bergerak, model atom Bohr,
transormasi Lorentz, dan persamaan Schrodinger.
Secara umum, potensial dari suatu muatan titik q pada posisi tertentu dinyatakan sebagai
Di mana, R adalah jarak titik dari sumber muatan
Melalui prinsip superposisi, potensial dari sekumpulan muatan adalah
Selanjutnya, adalah menghitung pengurangan potensial, dari suatu muatan
titik q yang bergerak membentuk sudut terhadap jarak R dengan kecepatan v
secara relativistik seperti gambar berikut
R
v
Maka akan diperoleh persamaan potensial Coulomb
Di manaR r– vt yakni vektor dari posisi mula-mula dari suatu partikel terhadap titik r, adalah sudut antara R dan v, |v| = v, danc adalah kecepatan cahaya dalam ruang vakum dan t adalah waktu mula-mula. Bila keadaan nonrelativistik muncul
,yakni maka persamaan (2.3) akan kembali ke persamaan (2.1). Prinsip
ini disebut prinsip pengurangan potensial dan dikemukakan oleh
Lienard-Wiechert.
2.2 Model Atom Bohr
Gambaran klasik terhadap inti atom didasarkan pada gaya Coulomb antara inti
bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti.
Sederhananya, pada atom hidrogen, dengan satu proton dan satu elektronyang
terjadi pasti orbit melingkar. Elektron dengan massa medan bermuatan –e bergerak melingkar dengan jari-jari rdan kecepatan tangensial v yang tetap. Gaya tarik Coulomb menyebabkan adanya percepatan sentripetal untuk mempertahankan
gerakannya. Gaya netto yang dialami oleh elektron adalah sebesar gaya
elektrostatik ataupun gaya sentripetal, , sehingga
Dimana = 8,85 x 1012F/m yakni permitivitas ruang hampa. Besarnya gaya yang
dialami bertanda positif namun pada arah –r, dimana rmerupakan vektor pointing satuan dari inti atom menuju posisi elektron. Dari persamaan di atas, dapat
ditentukan energi kinetik elektron (dengan mengabaikan efek relativistik)
7
Energi potensial dalam hal ini bertanda negatif akibat tanda muatan elektron.
Total energi E = K + V menghasilkan
Secara klasik, elektron berada di sekitar inti (pengaruh gaya Coulomb) tidak
sepenuhnya dapat menggambarkan spektrum atom, sehingga konsep tentang inti
atom mengalami perkembangan berikutnya.
Pada tahun 1911, Niels Bohr memodifikasi model atom. Energi elektromagnetik
terkuantisasi, yakni perkalian bilangan bulat terhadap hfdimana f merupakan frekuensi foton. Bohr menyatakan bahwa orbit elektron hanya dapat terjadi pada
keadaan tertentu dalam geraknya yang kemudian disebut sebagai keadaan stasioner, dimana pada keadaan ini tidak ada radiasi elektromagnetik yang dipancarkan. Pada keadaan ini momentum angular elektron, L merupakan perkalian bilangan bulat dengan konstanta Planck h dibagi 2 . Pada keadaan
stasioner ini momentum anguler dapat bernilai dan tidak pernah
bernilai selain bilangan bulat. Keadaan ini disebut dengan kuantisasi momentum
angular, dan merupakan bagian dari hipotesis Bohr. Hipotesis ini berbeda dengan
hipotesis Planck dan berperan dalam membangun hipotesis kuantisasi energi.
Untuk orbit melingkar, vektor posisi elektron r selalu tegak lurus dengan
momentum linear p. Momentum anguler L = r x p bernilai L = r.p= me.v.r.sehingga postulat Bohr terhadap kuantisasi momentum angular adalah
n merupakan bilangan bulat positif. Persamaan ini memberi solusi kecepatan
setelah menggunakan persamaan ini ke persamaan (2.4) diperoleh
Dalam hal ini a0= 0,00529 nm yang disebut sebagai jari-jari Bohr. Persamaan (2.11) merupakan jari- jari elektron yang diizinkan dalam mengorbit atom
hidrogen.
Hasil ini lebih signifikan dan tidak dapat diprediksi oleh pernyataan klasik
sebelumnya. Elektron hanya diizinkan mengorbit dengan jari-jari tertentu. Melalui
persamaan (2.11), diperoleh kecepatan, momentum, dan energi total yang
diizinkan dalam hidrogen
Merupakan kuantisasi kecepatan,
Merupakan kuantisasi momentum (momentum nonrelativistik), dan
Merupakan kuantisasi tingkat energi. Di sini = 13,6 eV yang merupakan energi
dasar sistem. Energi elektron terkuantisasi hanya pada nilai-nilai diskrit yang
diizinkan. Tingkat energi yang paling rendah disebut keadaan dasar, energi
elektron bernilai 13,6 eV. Keadaan yang lebih tinggi, n = 2,3,4,... dengan energi
-3,6 eV, -1,5 eV, -0,85 eV,... disebut keadaan tereksitasi. Bilangan bulat n yang
menandai jari-jari dan tingkat energi yang diizinkan dikenal sebagai bilangan
kuantum utama. Bilangan ini menandai tingkat energi dan keberadaan elektron.
Ketika elektron dan inti terpisah pada jarak tak hingga (n ), maka E = 0. Untuk membawa elektron dari jarak tak hingga menuju keadaan tertentu, n, dibebaskan
energi E = -(Ef- Ei) = |En|. Sebaliknya, bila elektron dipindahkan dari keadaan
n menuju tak hingga, pasti dibutuhkan energi minimum |En|. Energi ini dikenal
sebagai energi ikat pada keadaan n. Bila diberikan lebih banyak energi dari |En|
terhadap elektron, maka kelebihan energi ini akan berubah menjadi energi kinetik
9
2.3 Transformasi Lorentz
Kaitan antara dan yang rasional memenuhi :
dengan menyatakan faktor pembanding yang tak tergantung dari besaran atau
tetapi dapat merupakan fungsi . Pemilihan parsamaan (2.15) sebagai alternatif
transformasi didasarkan pada pertimbangan-pertimbangan sebagai berikut :
a) Persamaan tersebut linear terhadap x dan , sehingga suatu kejadian dalam
kerangka bersesuaian dengan kejadian tunggal dalam kerangka ,
seperti seharusnya.
b) Bentuk persamaan tersebut cukup sederhana, sehingga pemecahannya
mudah dipahami.
Gambar 2.2. Kerangka acuan S dan Kerangka acuan S’
Menurut postulat pertama relativitas khusus, maka persamaan fisika harus
berbentuk sama dalam kerangka dan , seperti Gambar (2.2), sehingga kaitan
sebagai fungsi dan dapat dinyatakan dalam persamaan berikut:
sedangkan pada arah koordinat y’ dan z’ memenuhi persamaan :
Koordinat dan tidak sama, hal ini dapat dilihat dengan mensubstitusi yang
diperoleh dari persamaan (2.15) ke persamaan (2.16) diperoleh :
Dari persamaan ini diperoleh :
Persamaan (2.15), (2.16) hingga persamaan (2.20) merupakan transformasi
koordinat yang memenuhi postulat relativitas khusus.
Pada saat , titik asal kedua kerangka dan berada pada tempat yang sama.
Menurut persamaan awal juga, dan pengamat pada masing-masing
koordinat melakukan pengukuran kelajuan cahaya yang menuju ke titik itu. Kedua
pengamat harus mendapatkan kelajuan yang sama yaitu c. Dalam kerangka S :
sedangkan dalam kerangka :
substitusi dan pada persamaan (2.15) dan (2.20) ke persamaan (2.22),
dihasilkan :
11
Rumusan di atas sama dengan yang diberikan oleh persamaan (2.21) yaitu
jika kuantitas dalam tanda kurung sama dengan satu, sehingga :
Akhirnya diperoleh nilai :
dengan memasukkan nilai ke persamaan (2.15) diperoleh persamaan
transformasi lengkap dari pengukuran suatu kejadian dalam kerangka terhadap
pengukuran yang sesuai yang dilakukan dalam kerangka :
2.4 Momentum Anguler Orbital
Dalam fisika klasik, momentum anguler partikel dengan momentum p, dan posisi
rdinyatakan dengan
Operator momentum anguler orbital dapat diperoleh dengan menggantikan r
dan pdengan operator yang sesuai untuk posisi dan momentum, dan , dimana
sehingga
Namun, momentum anguler bukan pada satu dimensi, sehingga komponen , ,
dan kuadrat dinyatakan sebagai
Karena X, Y dan Z masing-masing komut, begitu juga dengan , dan dan
karena , , diperoleh
Dengan cara yang sama, diperoleh
2.5 Momentum Anguler Spin
Keberadaan spin pertama kali diteliti oleh Stern dan Gerlach tahun 1922 dengan
menggunakan atom perak (Ag). Perak mempunyai 47 elektron, 46 di antaranya
membentuk distribusi muatan simetris yang sferis dan elektron yang ke-47
menempati orbita 5s. Bila atom perak pada keadaan dasar, momentum anguler
orbital totalnya adalah nol, . Pada percobaan Stern-Gerlach, atom perak
melewatimedan magnetik nonhomogen. Bila dalam percobaan, medan meagnetik
dianggap searah sumbu z, secara klasik akan diperoleh pita kontinyu sekitar
. Menurut teori gelombang Schrodinger, bila atom memiliki momentum
anguler orbita , akan terjadi perpecahan menjadi bilangan diskrit (ganjil)
komponen. Andaikan gerakan atom pada keadaan dasar , hanya ada satu titik
yang dapat ditangkap oleh layar, dan apabila awan elektron menepati keadaan 5p
( ) akan terdapat 3 titik pada layar. Secara eksperimen, gerakan atom menurut
prediksitidak seperti fisika klasik maupun teori gelombang Schrodinger.
Mengatasi hal ini. Goudsmith dan Uhlenbeck mengemukakan pendapatnya tahun
13
intrinsik, yang tidak seperti momentum anguler orbital. Hal ini dinamakan dengan
momentum anguler spin. Tidak seperti momentum anguler orbital, spin tidak
dapat digambarkan dengan operator diferensial. Dari teori klasik elektromegnetik,
momen dipol magnetik orbital diperoleh dari gerak orbital partikel bermuatan q
Di mana L adalah momentum anguler orbital partikel, m adalah massa dan c
adalah kecepatan cahaya. Dengan cara yang sama, diperoleh analisis gerakan spin
elektron sebagai momen dipol magnetik spin
Dengan analogi momentum anguler orbital, partikel yang bercirikan 2 bilangan
kuantum, bilangan kuantum orbital dan bilangan kuantum azimuth
( ). Momentum anguler spin jugan menjadi ciri 2
BAB 3
METODOLOGI PENELITIAN
3.1 Rancangan Penelitian
Langkah awal yang dilakukan adalah menemukan persamaan potensial Coulomb
nonrelativistik dan kemudian mengembangkannya menurut koreksi relativistik.
Pada akhirnya akan dilakukan perbandingan potensial Coulomb tanpa koreksi
relativistik dengan potensial Coulomb koreksi relativistik.
3.2 Diagram Alir Penelitian
Metodologi yang digunakan dalam penelitian ini dengan menentukan persamaan
potensial Coulomb dan melakukan koreksi relativistik pada tingkatan energi atom
15
Atom Hidrogen
Pendekatan Klasik
v << c
Pendekatan Relativistik
v ≤ c
Potensial Coulomb Potensial Lienard-Whiecert
Penentuan Energi Potensial Penentuan Energi Potensial Relativistik
Penentuan Hamiltonian secara kuantum
Penentuan Hamiltonian secara kuantum
Tingkat-tingkat Energi Atom Hidrogen
Tingkat-tingkat Energi Atom Hidrogen
Koreksi
BAB 4
HASIL DAN PEMBAHASAN
4.1 Persamaan Potensial Coulomb
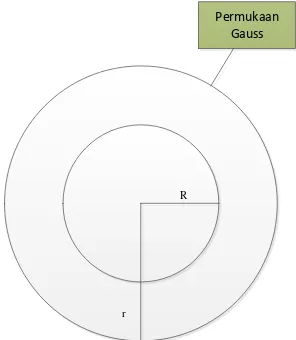
Persamaan potensial Coulomb diturunkan dari Hukum Gauss. Pada gambar 4.1
berikut terdapat permukaan Gauss pada jarak dari suatu pusat bola berjari-jari
dan muatan total sebesar
R
r
Permukaan Gauss
Gambar 4.1.Permukaan Gauss pada Jarak r dari Pusat Bola Berjari-jari R
Dari gambar 4.1 di atas tampak bahwa . Dalam hal ini, hukum Gauss
mengungkapkan
Di mana . Integral tertutup persamaan (4.1) dapat diganti dengan integral
permukaan karena bentuk bola yang simetris, sehingga
17
Sehingga
Atau
Dari persamaan elektrostatik, untuk menghasilkan potensial dari medan listrik
digunakan persamaan
Potensial listrik adalah daerah sekitar muatan listrik yang masih dipengaruhi oleh
medan listrik. Untuk daerah di mana , . Dari persamaan (4.5) dan
(4.6) diperoleh
Bila , dan , yakni pada jarak tak hingga dari muatan , diperoleh
Dari persamaan (4.8) di atas, besar potensial Coulomb dari gambar 4.1 pada jarak
darim muatan pada pusat bola, diperoleh
Bila ada distribusi muatan yang merata pada suatu daerah volume kecil , maka
Atau
Persamaan ini dikenal sebagai Persamaan Poission.
4.2 Atom Hidrogen
Untuk orbit melingkar, vektor posisi elektron, selalu tegak lurus dengan
momentum linear, . Momentum anguler, bernilai ,
sehingga postulat Bohr terhadap kuantisasi momentum anguler adalah
Dimana merupakanbilangan bulat positif. Persamaan ini memberi solusi
kecepatan
Gaya netto yang dialami elektron adalah
Dengan mensubstitusi persamaan (4.12) ke persamaan (4.13), diperoleh jari-jari
atom
Di mana disebut sebagai jari-jari Bohr. Dari persamaan(4.14),
diperoleh kuantitas kecepatan maupun momentum linear atom hidrogen, yaitu
Dan
Energi total merupakan jumlah energi potensial dan energi kinetik yang dialami
19
Dari persamaan (4.14), kuantitas energi atom hidrogen menurut atom Bohr adalah
Jika , nilai energinya disebut energi keadaan dasar, yaitu .
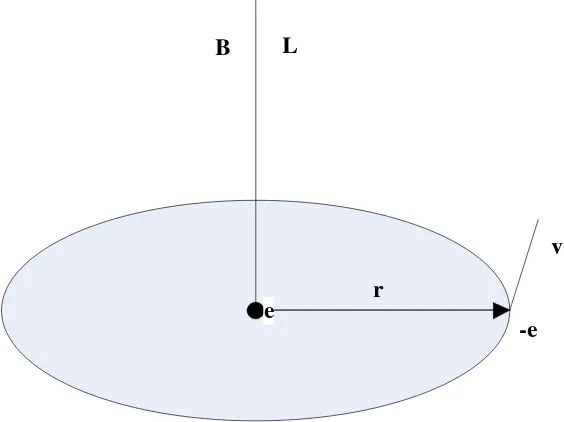
4.3 Pasangan Spin-Orbit
Pasangan spin-orbit pada atom hidrogen berasal dari interaksi antara momen
magnetik spin elektron dan medan magnetik orbital proton,
e
B L
r
-e v
Gambar 4.2
Berdasarkan Gambar 4.2, medan magnetik yang dialami elektron adalah
Di mana merupakan momentum linear elektron dan adalah medan
listrik yang ditimbulkan oleh gaya Coulomb. Secara umum, medan listrik arah
Karena pada interaksi Coulomb berlaku
Di mana adalah potensial Coulomb dan adalah fungsi potensial
terhadap . Dengan mensubstitusikan persamaan (4.20) ke persamaan (4.19),
maka diperoleh persamaan medan magnetik pada elektron
Di mana adalah momentum anguler orbital elektron interaksi antara
momen dipol spin elektron, dengan medan magnetik yang menghasilkan
interaksi energi, yakni
Dengan melakukan transormasi balik pada kerangka acuan diam, persamaan
(4.23) akan mengalami reduksi dengan faktor 2, sehingga
Di mana meerupaka operator yang berkaitan dengan interaksi spin-orbital.
Untuk atom hidrogen dan , sehingga
persamaan (4.24) menjadi
Maka persamaan Hamiltonian berdasarkan teori gangguan interaksi spin-orbit
atom hidrogen adalah
Pada keadaan , keadaan eigen menurut nilai eigen yang bersangkutan
adalah
21
Di mana adalah energi interaksi spin-orbit, yakni
Dengan menggunakan nilai dari (lampiran 2), diperoleh bahwa
sehingga persamaan (4.29) dapat ditulis
Di mana , konstanta tanpa dimensi dan . Persamaan
(4.30) dapat juga ditulis dalam bentuk
Di mana adalah Energi spin-orbit pada orde 1.Persamaan (4.31) merupakan
persamaan tingkat energi atom hidrogen pengaruh spin-orbit dari elektron
terhadap inti atom.
4.4 Koreksi Relativistik terhadap Energi Kinetik
Meskipun efek relativistik pada hidrogen yang disebabkan oleh pergerakan
elektron sangat kecil, namun masih dapat diamati dengan spektroskopi. Energi
kinetik relativistik elektron dirumuskan dengan ,
dimana merupakan energi diam elektron. Dengan melakukan ekspansi
Sehingga Hamiltonian untuk hidrogen menjadi
Di mana merupakan Hamiltonian tanpa gangguan dan
adalah koreksi relativistik yang dapat dianggap sebagai gangguan
orde pertama. Nilai ekspektasi dari koreksi relativistik ini adalah
Nilai (lampiran 3) diberikan
Dengan substitusi persasmaan (4.35) ke persamaan (4.34), diperoleh persamaan
energi pengaruh koreksi relativistik terhadap energi kinetik
Sehingga energi total relativistik Hamiltonian persamaan(4.33) adalah
4.5 Struktur Asli Atom Hidrogen
Struktur asli atom hidrogen diperoleh dengan menggabungkan koreksi spin-orbit
pada persamaan (4.31) dan koreksi relativistik energi kinetik pada persamaan
23
Di mana adalah energi struktur asli atom hidrogen, adalah energi
spin-orbit, adalah energi koreksi relativistik energi kinetik, . Untuk
atau , substitusi ke persamaan (4.38), menghasilkan
Dengan cara yang sama, substitusi atau ke persamaan
(4.38) akan menghasilkan persamaan yang sama dengan persamaan (4.39). Dari
persamaan (4.39) ini akan dihasilkan persamaan umum tingkat energi atom
Di mana . Dari persamaan di atas, tampak bahwa terbagi
menjadi 2 tingkat energi yakni karena memiliki nilai .
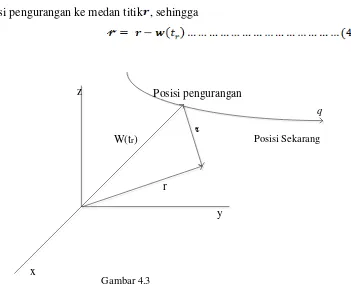
4.6 Potensial Li nard-Wiechert (Pengurangan Potensial)
Pengurangan potensial, dari suatu muatan titik yang bergerak pada suatu
lintasan
Pengurangan waktu ditentukan secara implisit melalui persamaan
Bagian kiri persamaan (4.42) menyatakan jarak yang ditempuh dan
menyatakan waktu untuk melakukan ‘perjalanan’ itu (Gambar 4.3). Parameter
menyatakan posisi pengurangan muatan, dan menyatakan vektor dari
posisi pengurangan ke medan titik , sehingga
z
x
y r W(tr)
r
[image:32.595.135.486.462.746.2]Posisi pengurangan
Gambar 4.3
Posisi Sekarang
25
Dalam hal ini, persamaan (4.10) berubah menjadi
Dan pengurangan potensial dari muatan titik dengan sederhana menjadi .
Pengaruh efek Doppler relativistik (lampiran 1), diperoleh nilai
Maka, persamaan (4.44) berubah menjadi
Bila suatu partikel bergerak dengan kecepatan konstan , maka persamaan (4.41)
berubah menjadi
Dan persamaan (4.42) juga berubah menjadi
Dengan mengkuadratkan kedua ruas persamaan (4.48), diperoleh
Jika diambil nilai dengan rumus peersamaan kuadrat maka
Dengan mengambil limit menuju , diperoleh . Dalam hal ini, muatan
Sekarang, dari persamaan (4.43) dan (4.48) diperoleh dan
, yakni vektor satuan dari jarak ke medan vektor . Dari kedua
persamaan ini maka diperoleh nilai
Melalui substitusi persamaan (4.51) ke persamaan (4.46), diperoleh
Bila suatu muatan bergerak dengan kecepatan konstan , seperti pada
Gambar(2.1), dimana , yakni vektor ‘waktu sekarang’ terhadap medan
titik , dan adalah sudut antara dan , maka dapat dicari
Dari Gambar (2.1), diperoleh
Bila persamaan (4.53) dikali dot vektor dengan , maka diperoleh
atau
Bila persamaan (4.53) dikali dot vektor dengan , maka diperoleh
atau
Bila persamaan (4.53) dikali dot vektor dengan , maka diperoleh
[image:34.595.124.507.167.296.2]27
Bila persamaan (4.54),(4.55),dan(4.56) digabung maka diperoleh persamaan
Sehingga, dengan mensubstitusi persamaan (4.57) ke persamaan (4.52), diperoleh
Ini adalah persamaan pengurangan potensial Coulomb pengaruh relativistik atau
Potensial Li nard-Wiechert.
4.7 Koreksi Relativistik Potensial Coulomb
Berdasarkan persamaan (4.58) energi potensial relativistik atom hidrogen
diperoleh
Pada saat elektron mengelilingi inti atom, besar momentum anguler adalah
, maka persamaan (4.59) dapat ditulis kembali
dengan
Untuk pada orde pertama dalam , dengan melakukan aproksimasi
Yang menghasilkan pengurangan energi potensial sebesar
Menurut teori gangguan orde pertama dan dengan melakukan perkiraan terhadap
variabel dan , maka nilai eigen dari pengurangan energi ini adalah
Ini merupakan persamaan energi pengaruh relativistik terhadap potensial
Coulomb pada tingkat-tingkat energi atom hidrogen. Dengan menggabungkan
peersamaan (4.63) dan persamaan (4.40) diperoleh persamaan tingkat energi atom
hidrogen
Tampak dalam persamaan (4.67) bahwa degenarasi tetap ada, sedangkan dalam
persamaan (4.40) tidak terdapat degenerasi . Perbedaan kedua persamaan inilah
sebagai akibat dari pengaruh koreksi relativistik terhadap potensial Coulomb,
yang memiliki nilai yang sama dengan persamaan (4.63), dimana
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan yang diperoleh dari pembahasan dalam Bab IV adalah:
1. Pengaruh relativistik pada potensial Coulomb yang mengubah persamaan
potensial Coulomb tersebut menjadi persamaan Potensial
Li nard-Wiechert, . Kedua persamaan ini memilik
perbedaan dari pengamatan yang dilakukan. Potesial Coulomb
diasumsikan dengan menganggap bahwa elektron bergerak mengelilingi
inti atom hidrogen dengan kecepatan relatif kecil terhadap kecepatan
cahaya atau bahkan saat elektron tersebut diam, sedangkan potensial
Li nard-Wiechert diasumsikan jika dibandingkan dengan kecepatan
elektron mendekati kecepatan cahaya.
2. Tingkat-tingkat energi atom hidrogen memiliki perbedaan dalam
pengamatan nonrelativistik dan relativistik. Koreksi terhadap potensial
Coulomb menjadi potensial Li nard-Wiechert mengakibatkan tingkat
energi atom hidrogen mengalami pengurangan sebesar .
Pengaruh relativistik pada potensial Coulomb ini menyebabkan adanya
5.2 Saran
Berbicara mengenai atom hidrogen, tidak terlepas dari bilangan kuantum.
Diharapkan untuk para peneliti selanjutnya untuk mampu mengkaji pengaruh
bilangan-bilangan kuantum ini terhadap keadaan (‘state’) atom. Pengkajian ini
tentu membutuhkan aplikasi matematika khusus sehingga diharapkan kepada
31
DAFTAR PUSTAKA
Anugraha, R., 2005, Pengantar Teori Relativitas dan Kosmologi,UGM PRESS :Yogyakarta.
Beiser Arthur, 1999,Konsep Fisika Modern, Edisi keempat,Erlangga :Jakarta. Behera,H.,Effect of relativistic correction to the Coulomb Potensial on the Energy
Levels of Hydrogen Atom.arXiv:1201.1619v2[physics.gen-ph] 10 January 2012:Mumbai.
Goldstein, H.,1980, Classical Mechanics,Second edition,Addison Wesley :Massachusetts.
Pauling, Wilson.1935.Introduction to Quantum Mechanics with Application to Chemistry. McGRAW-HILL BOOK COMPANY:New York.
Purwanto, Agus,2006, Fisika Kuantum, Gava Media : Yogyakarta.
Schiff, Leonard, 1939. Quantum Mechanics, Second edition,McGRAW-HILL BOOK COMPANY : New York.
Sokolov,Loskutov.1966.Quantum Mechanics.Publishing House of Ministry of Education of RSFSR: Moskow.
Zettili, Nouredine, 2009, Quantum Mechanics Concepts and Applications, Second Edition, John Wiley & Sons, Ltd: United Kingdom.
LAMPIRAN
1.Efek Doppler Relativistik
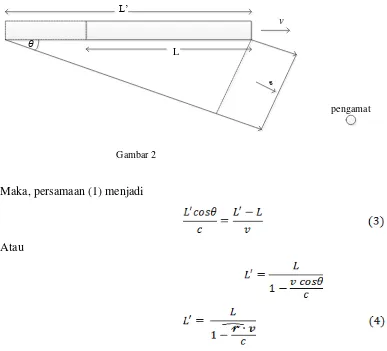
Dari Gambar 1 dapat diamati efek Doppler relativistik. Pengamat sebelah kanan
mengamati benda sepanjang L yang bergerak dengan kecepatan v.
L’
L
v Pengamat
Gambar 1
Saat benda bergerak mendekati pengamat, maka benda tersebut akan terlihat
bertambah panjang. Secara intuisi, hal ini benar karena cahaya yang diterima
pengamat dari bagian depan benda tersebut lebih cepat daripada cahaya yang
diperoleh pengamat dari kedeluruhan benda tersebut. Pada interval tertentu, saat
cahaya bergerak mencapai pengamat pada jarak tertentu, benda tersebut sendiri
telah bergerak sejauh , sehingga berlaku
Atau
Dari persamaan (2) telihat bahwa benda L bertambah panjang dengan faktor
. Sebaliknya, saat benda tersebut menjauhi pengamat, maka benda L
akan mengalami pengurangan dengan faktor . Bila benda L bergerak
33
L’
L
r v
[image:41.595.113.500.84.435.2]pengamat
Gambar 2
Maka, persamaan (1) menjadi
Atau
Bila benda tersebut dalam dimensi volume, maka persamaan (4) manjadi
2.Nilai Rata-rata ,
Dari persamaan rekursi Kramers, yakni
Atau
Jika , maka persamaan (6) menjadi
Dengan mensubstitusi persamaan (8) ke persamaan (9), diperoleh
Jika , maka persamaan (6) menjadi
Atau
Sedangkan nilai
Sehingga
3.Nilai Rata-rata ,
Dari persamaan Hamiltonian
Diperoleh
35