i
UJI EFEK ANTIINFLAMASI EKSTRAK HERBA RUMPUT MUTIARA (Hedyotis corymbosa (L.) Lamk.) DENGAN METODE HEN’S EGG TEST
CHORIOALLANTOIC MEMBRANE
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Edward Wijaya Setiawan
NIM : 088114100
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
UJI EFEK ANTIINFLAMASI EKSTRAK HERBA RUMPUT MUTIARA (Hedyotis corymbosa (L.) Lamk.) DENGAN METODE HEN’S EGG TEST
CHORIOALLANTOIC MEMBRANE
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Edward Wijaya Setiawan
NIM : 088114100
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v
Halaman Persembahan
Kupersembahkan Karya ini untuk: Tuhan Yesus Kristus dan Bunda Maria
Papa - Mama - Saudara-saudaraku Almamaterku
viii
PRAKATA
Puji Syukur dan terima kasih penulis haturkan kepada Tuhan Yang Maha
Esa atas segala berkat, rahmat, karunia dan penyertaan-Nya selama penelitian dan
penyusunan skripsi ini sehingga penulis dapat menyelesaikan skripsi ini dengan
baik. Skripsi dengan judul: “Uji Efek Antiinflamasi Ekstrak Herba Rumput
Mutiara (Hedyotis corymbosa (L.) Lamk.) Dengan Metode Hen’s Egg Test
Chorioallantoic Membrane” ini disusun untuk memenuhi salah satu syarat untuk
memperoleh gelar Sarjana Strata Satu Program Studi Ilmu Farmasi (S.Farm.) di
Universitas Sanata Dharma Yogyakarta.
Dalam menyelesaikan skripsi ini, banyak dihadapi kesulitan. Namun,
dengan adanya bantuan dari berbagai pihak, baik berupa dukungan moril maupun
spirituil, maka pada akhirnya skripsi ini dapat diselesaikan dengan sebaik
mungkin. Dengan penuh kerendahan hati, maka penulis ingin mengucapkan rasa
terima kasih kepada :
1. Ipang Djunarko M. Sc., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Yosef Wijoyo, M. Si. Apt., selaku dosen pembimbing yang dengan sabar
dan bijaksana selalu memberikan bimbingan dan pengarahan kepada
penulis, yang selalu ceria dengan canda tawanya ketika bimbingan.
3. Prof. Dr. C. J. Soegihardjo, Apt., selaku dosen penguji atas pengarahannya
serta kesediaannya meluangkan waktu untuk menjadi penguji.
4. Phebe Hendra, M.Si., Ph. D., Apt., selaku dosen penguji atas kesediaannya
ix
5. Sri Hartati Yulianti M.Si., Apt., atas pengarahannya serta kesediaannya
meluangkan waktu untuk memberikan masukan dan semangat pada saya.
6. Seluruh dosen Fakultas Farmasi USD, atas ilmu yang diberikan dan
kebersamaan selama kuliah di Fakultas Farmasi Universitas Sanata Dharma.
7. Seluruh staf laboratorium, staf kebersihan, dan staf keamanan Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Terutama Mas Agung,
Pak Musrifin, Mas Iswandi, dan Mas Otok yang telah membantu kelancaran
penulis dalam menyelesaikan penelitian.
8. Rosita Secoadi, atas doa, dorongan, semangat, dan perhatiannya.
9. Teman Seperjuangan saya, Yuni Rogan, Elisa Aster, Franky Limawan, dan
Natalia Windari sahabat saya yang telah memberikan doa, dukungan,
bantuan, dan semangat serta pengalaman tak terlupakan selama penelitian
dan penyusunan skripsi. Terima kasih atas saran dan masukkan yang
diberikan.
10.Sahabat-sahabatku dan teman-temanku yang lain atas segala doa dan
dukungannya.
11.Teman-Teman angkatan 2008, khususnya teman-teman FST atas suka duka
dan kebersamaannya.
12.Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu
penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penyusunan dan penyelesaian skripsi ini
masih banyak terdapat kesalahan dan kekurangan mengingat keterbatasan
x
kritik dan saran yang membangun dari semua pihak. Akhir kata, semoga laporan
ini dapat berguna bagi pembaca.
xi INTISARI
Herba rumput mutiara (Hedyotis corymbosa (L.) Lamk.) biasa digunakan untuk pengobatan tradisional. Herba rumput mutiara mengandung zat aktif golongan saponin yaitu steroid yang memiliki daya antiinflamasi. Inflamasi merupakan respon protektif jaringan. Penelitian ini bertujuan untuk mengetahui daya antiinflamasi ekstrak herba rumput mutiara menggunakan metode Hen’s Egg
Test-Chorioallantoic Membrane (HET-CAM) dinyatakan dengan IC50.
Penelitian ini termasuk penelitian eksperimental murni. Penelitian diawali dengan determinasi simplisia, pembuatan serbuk, pembuatan ekstrak herba rumput mutiara dan standarisasi ekstrak. Metode HET-CAM menggunakan kontrol positif inflamasi SDS 1%, kontrol positif antiinflamasi hidrokortison asetat 1%, kontrol negatif aquabidest, konsentrasi ekstrak herba rumput mutiara 150, 300, dan 600 µg/ml. Hasilnya direkam selama 300 detik dicatat dalam satuan detik waktu koagulasi, lisis dan hemoragi pembuluh darah. Data digunakan untuk menentukan iritation score. Hasil irritation score dianalisis dengan uji Kruskal-Wallis, dilanjutkan uji Mann-Whitney dengan tingkat kepecayaan 95% untuk mengetahui beda tiap perlakuan. Daya antiinflamasi dilihat dari nilai IC50 yang
ditetapkan dengan regresi linear.
Hasil penelitian menunjukkan ekstrak herba rumput mutiara memiliki daya antiinflamasi sebanding dengan hidrokortison asetat pada konsentrasi 600 µg/ml. Analisis regresi linear diperoleh IC50 ekstrak herba rumput mutiara 311,65 µg/ml.
xii ABSTRACT
Pearl Grass herb (Hedyotis corymbosa (L.) Lamk.) is used for traditional medicine. It’s contains active substances which fraction steroids that have anti-inflammatory action. Inflammation is a response protectif tissues. This study aims to determine the action of antiinflammatory herb gotu kola extract using Hen's Egg Test-Chorioallantoic Membrane (HET-CAM) method and expressed by IC50.
This research was purely experimental. The research began determination plants, making powder, making extracts and standardized extracts. HET-CAM method uses a positive control inflammation SDS 1%, the positive control anti-inflammatory hydrocortisone acetate 1%, a negative control aquabidest, extract concentration of 150, 300, and 600 µg/ml. The results recorded during 300 seconds, recorded of time of coagulation, lysis and hemorrhage of blood vessels. Data used to determine iritation score (IS). It was analyzed by Kruskal-Wallis test, and then Mann-Whitney test to determine differences for each treatment. Antiinflammatory action is obtained from linear regretion.
Extract has anti-inflammatory action but not statistically significantly different compared with hydrocortisone acetate at concentration of 600 µg/ml. regression analysis of diamond flower herb extract obtained IC50 311,65 µg/ml.
xiii DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... vi
PERNYATAAN KEASLIAN KARYA ... vii
PRAKATA ... viii
INTISARI ... xi
ABSTRACT ... xii
DAFTAR ISI ... xiii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
xiv
B. Rumput Mutiara (Hedyotis corymbosa L.Lamk.) ... 6
C. HETCAM ... 11
BAB III METODOLOGI PENELITIAN... 19
A. Jenis dan Rancangan Penelitian ... 19
B. Variabel dan Definisi Operasional ... 19
1. Variabel penelitian ... 19
2. Definisi operasional ... 19
C. Bahan ... 21
D. Alat ... 21
E. Tata Cara Penelitian ... 21
1. Determinasi simplisia rumput mutiara ... 21
2. Pembuatan serbuk herba rumput mutiara ... 21
xv
4. Uji antiinflamasi ekstrak herba rumput mutiara ... 23
5. Analisis hasil ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
A. Determinasi Simplisia ... 26
B. Pembuatan Serbuk Herba Rumput mutiara ... 26
C. Ekstraksi Serbuk Herba Rumput mutiara ... 28
D. Hasil Uji HET-CAM ... 28
E. Hasil Uji Kruskal Wallis dan Mann Whitney ... 36
F. Penentuan IC50 ... 38
BAB V KESIMPULAN DAN SARAN... 39
A. Kesimpulan ... 39
B. Saran ... 39
DAFTAR PUSTAKA ... 40
LAMPIRAN ... 41
xvi DAFTAR TABEL
Tabel I. Tabel hasil perlakuan ... 33
Tabel II. Hasil skor iritasi... 34
Tabel III. Hasil Uji Mann Whitney ... 36
xvii DAFTAR GAMBAR
Gambar 1. Respon tubuh terhadap antigen dan kerusakan jaringan ... 7
Gambar 2. Biosintesis prostaglandin ... 8
Gambar 3. Rumput mutiara ... 9
Gambar 4. Perkembangan embrio unggas ... 13
Gambar 5. Morfologi telur ... 14
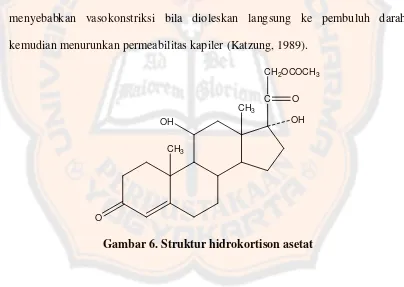
Gambar 6. Struktur hidrokortison asetat ... 15
Gambar 7. Struktur Sodium Dodesil sulfat ... 16
Gambar 8. Pemberian kontrol negatif aquabidest ... 30
Gambar 9. Pemberian kontrol positif inflamasi ... 31
Gambar 10. Kontrol positif antiinflamasi (hidrokortison+SDS1%) ... 31
Gambar 11. Hubungan perlakuan vs irritation score ... 35
xviii DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan simplisia ... 43
Lampiran 2. Penimbangan bahan ... 44
Lampiran 3. Perhitungan Irritation score ... 49
Lampiran 4. Hasil Pengamatan ... 57
1 BAB I PENGANTAR
A. Latar Belakang
Herba rumput mutiara (Hedyotis corymbosa (L.) Lamk.) merupakan
tanaman yang biasa digunakan untuk pengobatan tradisional dan dikenal memilki
efek antiinflamasi, hepatoprotektif dan antikanker (Cardenaz, Quesada, and
Medina, 2004). Rumput mutiara dikembangkan dan diteliti serta dijadikan ramuan
dalam berbagai obat tradisional.
Inflamasi adalah respon jaringan protektif terhadap cedera atau kerusakan
jaringan, yang berfungsi menghancurkan, mengurangi, atau mengurung baik agen
yang menyebabkan cedera maupun jaringan yang cedera itu. Ketika tubuh
mendapatkan stimulus dari luar maka tanda awal yang muncul adalah rubor
(memerah) disertai dengan kalor (panas), dolor (nyeri) dan pada akhirnya terjadi
tumor (bengkak) dan functio laesa (hilangnya fungsi) (Anonim, 1996). Kerusakan
sel akibat stimulus dari luar akan membebaskan mediator seperti histamin,
bradikinin, prostaglandin dan leukotrien dimana mediator-mediator tersebut
berperan dalam proses inflamasi (Mansjoer, 2003).
Dalam rumput mutiara, terdapat asam ursolat bersama asam oleanolat dan
zat-zat lain (Anonim, 2010). Asam ursolat adalah senyawa triterpenoid pentasiklik
yang termasuk dalam famili siklo-skualena, dan terdapat dalam berbagai tanaman
memiliki banyak khasiat seperti sebagai antibakteri, hepatoprotektor,
imunomodulator, antiproliferatif, antitumor, dan antiinflamasi (Anonim, 2010).
Berdasar keterangan diatas maka perlu diteliti mengenai aktivitas
antiinflamasi dari herba rumput mutiara sehingga dapat dikembangkan sebagai
obat herbal yang aman dan efektif dalam mengobati inflamasi. Rumput mutiara
yang kemudian dapat dikembangkan menjadi obat herbal yang diharapkan lebih
aman daripada obat sintetis dalam mengobati inflamasi.
Rumput mutiara ini diekstraksi menggunakan etanol sehingga
menghasilkan ekstrak kental rumput mutiara yang nantinya akan diuji aktivitas
antiinflamasinya. Penggunaan etanol ini dipilih berdasarkan kelarutan dari asam
ursolat yakni sebesar 5,1mg/ml (Schneider, Hosseiny, Szczotka, Jordan, and
Schlitter, 2008).
Uji aktivitas antiinflamasi dapat dilakukan dengan berbagai metode salah
satunya dengan metode HET-CAM (Hen’s Egg Test ChorioAllantoic Membrane).
Metode ini memiliki keuntungan yakni waktu pengamatan yang relatif singkat dan
dengan objek uji telur berembrio ini, dapat teramati secara langsung perubahan
pembuluh darah ketika terjadi inflamasi. Metode ini memiliki kelebihan, yaitu
cepat dan sensitif sehingga dapat juga digunakan untuk screening awal suatu
material yang memiliki aktivitas antiinflamasi.
Uji efek antiinflamasi ekstrak rumput mutiara (Hedyotis corymbosa)
menggunakan metode HET-CAM (Hen’s Egg Test ChorioAllantoic Membrane).
Metode ini menggunakan telur ayam yang telah dibuahi kemudian dipaparkan
terbentuk CAM. CAM ini terdapat pada lapisan mesodermis telur yang terdiri dari
pembuluh darah.
Berdasarkan latar belakang tersebut maka dapat dilakukan uji aktivitas
antiinflamasi untuk ekstrak herba rumput mutiara menggunakan metode
HET-CAM.
B. Perumusan Masalah
Apakah ekstrak etanol herba rumput mutiara (Hedyotis corymbosa
Herba) memiliki aktivitas antiinflamasi berdasarkan metode HET-CAM?
C. Tujuan
Mengetahui aktivitas antiinflamasi ekstrak etanol herba rumput mutiara
(Hedyotis corymbosa Herba) berdasarkan metode HET-CAM.
D. Manfaat
a. Manfaat teoritis
Dari penelitian ini diharapkan dapat memberikan sumbangan
teoritis mengenai aktivitas anti inflamasi ekstrak Hedyotis corymbosa
Herba.
b. Manfaat metodologis
Penelitian ini diharapkan memberikan pengetahuan tentang
metode yang baik untuk uji aktivitas antiinflamasi ekstrak Hedyotis
E. Keaslian Penelitian
Berdasarkan sepengetahuan peneliti uji aktivitas antiinflamasi dari
ekstrak rumput mutiara (Hedyotis corymbosa) dengan metode HET-CAM belum
pernah dilakukan sebelumnya.
Penelitian mengenai rumput mutiara pernah dilakukan berkaitan dengan
aktivitas hepatoprotektif yang dilakukan oleh Alawiyah (2006) dengan hasil
rumput mutiara dapat menurunkan kadar SGPT dan SGOT tikus yang telah
diinduksi parasetamol dengan pemberian ekstrak dengan dosis 400mg/kgBB.
Pengujian terhadap rumput mutiara terhadap pengaruh fagositosis makrofag
pernah dilakukan oleh Azenda (2006). Penelitian mengenai efek antioksidan dan
antikarsinogenik pernah dilakukan oleh Susi Erdini (2011) dengan isolasi sel
kanker payudara MCF-7. Hasil Penelitian tersebut rumput mutiara memiliki
aktivitas antioksidan dan sitotoksik yang sangat tinggi.
Metode HET-CAM yang sama digunakan oleh Alfonsus Rudianto (2010)
untuk menguji aktivitas antiinflamasi dari ekstrak etanol pegagan. Pengujian
BAB II
PENELAAHAN PUSTAKA
A. Inflamasi
Inflamasi adalah respon jaringan protektif terhadap cedera atau
kerusakan jaringan, yang berfungsi menghancurkan, mengurangi, atau mengurung
baik agen yang menyebabkan cedera maupun jaringan yang cedera tersebut.
Tanda klasik radang akut yaitu nyeri (dolor), panas (kalor), kemerahan (rubor),
bengkak (tumor), dan hilangnya fungsi (functio laesa) (Anonim, 1996).
Inflamasi (radang) biasanya dibagi dalam 3 fase : inflamasi akut, repons
imun, dan inflamasi kronis. Inflamasi akut merupakan respon awal terhadap
cedera jaringan; hal tersebut terjadi melalui media rilisnya autacoid serta pada
umumnya didahului oleh pembentukan respon imun. Sejumlah autacoid yang
terlibat seperti histamin, serotonin, bradikinin, prostaglandin, dan leukotrien
(Katzung, 2001).
Respon imun terjadi bila sejumlah sel yang mampu menimbulkan
kekebalan diaktifkan merespon organisme asing atau substansi antigenik yang
terlepas selama respon terhadap inflamasi akut serta kronis. Inflamasi kronis
melibatkan keluarnya sejumlah mediator-mediator yang tidak menonjol dalam
respon akut. Beberapa diantaranya adalah interleukin-1, 2, 3, GM-CSF1, TNF-α,
interferon dan PDGF3 (Katzung, 2001).
Kerusakan jaringan bisa disebabkan oleh senyawa kimia,
agen penyebab rusaknya jaringan, inflamasi juga berfungsi untuk menginduksi
perbaikan jaringan yang rusak dan juga memproteksi adanya kerusakan jaringan
yang bisa menimbulkan efek yang lebih berbahaya. Inflamasi akut dan kronis
dibedakan berdasarkan durasi dan tipe sel inflamasi yang dilepaskan. Inflamasi
akut melibatkan perubahan pembuluh darah dalam detik yaitu adanya vasodilatasi
dan permeabilitas pembuluh darah. Vasodilatasi meningkatkan laju aliran darah
dan peningkatan suhu pada jaringan yang rusak sehingga tanda yang timbul akibat
adanya inflamasi adalah rubor dan kalor. Meningkatnya permeabilitas pembuluh
darah menyebabkan pelepasan protein plasma sehingga timbul tumor pada
jaringan. Selain itu, meningkatnya permeabilitas akan memicu pelepasan leukosit
(neutrofil) dan makrofag yang berfungsi untuk menghancurkan agen-agen
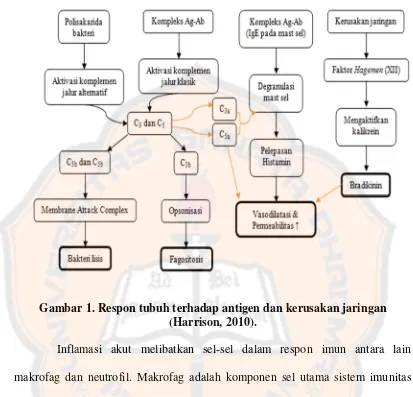
penyebab cedera (Pearson, 2010). Respon tubuh terhadap antigen yang dapat
menyebabkan kerusakan jaringan ditunjukkan pada Gambar 1.
Tubuh merespon adanya antigen yaitu mengaktifkan komplemen yang
menyebabkan vasodilatasi dan meningkatnya permeabilitas pembuluh darah. Efek
serupa juga ditimbulkan pada pelepasan mediator inflamasi yaitu brandikinin
Gambar 1. Respon tubuh terhadap antigen dan kerusakan jaringan (Harrison, 2010).
Inflamasi akut melibatkan sel-sel dalam respon imun antara lain
makrofag dan neutrofil. Makrofag adalah komponen sel utama sistem imunitas
non spesifik yang memproduksi sitokin yaitu Tumour Necrosis Factor-α (TNF-α)
sebagai respon terhadap antigen (bakteri atau fragmen bakteri). TNF-α merupakan
kemoatraktan dimana terlibat dalam meningkatkan migrasi leukosit dan inflamasi
Fenomena inflamasi berkaitan dengan adanya pelepasan mediator nyeri
dapat dilihat pada Gambar 2.
Gambar 2. Biosintesis prostaglandin (Harrison, 2010).
Asam arakidonat merupakan komponen normal yang disimpan pada sel
dalam bentuk fosfolipid. Adanya stimulus menyebabkan asam arakidonat
dilepaskan dari sel penyimpan lipid oleh asil hidrolase sebagai respon inflamasi.
Asam arakidonat kemudian mengalami metabolisme menjadi dua alur. Alur
siklooksigenase yang membebaskan prostaglandin (PGE2, PGF2, PGD2),
prostasiklin, dan tromboksan dan alur lipooksigenase yang membebaskan
leukotrien. Leukotrien dan prostaglandin merupakan mediator nyeri yang
dilepaskan saat terjadi inflamasi (Mansjoer, 2003).
Secara in vitro terbukti bahwa prostaglandin E2 (PGE2) dan prostasiklin
peningkatan aliran darah lokal. Migrasi leukosit ke jaringan radang merupakan
aspek penting dalam proses inflamasi (Anonim, 1995a).
B. Rumput Mutiara (Hedyotis corymbosa L. Lamk.)
Gambar 3. Rumput mutiara
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledoneae Ordo : Rubiales Famili : Rubiaceae Genus : Hedyotis
Spesies : Hedyotis corymbosa L. (Anonim, 2010)
Rumput mutiara (Hedyotis corymbosa L. Lamk.) tumbuh pada tanah
lembap. Rumput mutiara tumbuh setinggi 15 – 30 cm, memiliki batang bersegi,
daun berhadapan bersilang, tangkai daun pendek, panjang daun 2 – 5 cm,
berujung runcing, dan bertulang daun tunggal di tengah. Ujung daun mempunyai
rambut yang pendek. Bunga ke luar dari ketiak daun, bentuknya seperti payung
berwarna putih, berupa bunga majemuk 2-5, tangkai bunga (induk) keras seperti
asam ursolat, asam oleanolat, stigmasterol, beta-sitosterol, dan glikosida flavonoid
(Anonim, 2010).
Rumput rnutiara merupakan tanaman gulma termasuk genus
Rubiaceae-(Oldenlandia) berdaun kecil, bunga berwarna putih, berbatang dua atau lebih
berbentuk panjang, reproduksi dengan biji dan hidup pada tanah yang lembab.
Tanarnan ini dapat rnereduksi tumor, antiinflarnasi dan melindungi hati. Beberapa
hasil penelitian rnenunjukkan bahwa tanaman dari genus Hedyotis banyak
mengandung iridoid (Peng, Feng, and Liang, 1997).
Hedyotis rnengandung 10 senyawa iridoid yaitu asperulosid, skandosid
metil ester, asarn asperulosid, asam diasetil asperulosid, loganin, diasil
asperulosid, asetil skandosid rnetil ester, 6 beta-hldroksigenipin,
6'-asetilasperulosid dan 6'-6'-asetilasperulosid (Peng, Feng, and Liang, 1999).
Asam ursolat adalah golongan triterpenoid pentasiklik yang terdapat
dalam berbagai jenis tanaman. Penelitian tentang asam ursolat menemukan
aktivitas asam ursolat sebagai antikanker, anti mikroba, antiinflamasi,
hepatoprotektif, antihiperlipidemi, dan antiviral (Liu, 1995).
Asam oleanolat adalah golongan triterpenoid pentasiklik yang merupakan
isomer dari asam ursolat. Asam oleanolat memiliki aktivitas antitumor,
antiinflamasi, antihiperlipidemi, dan hepatoprotektif (Liu, 1995).
Iridoid diketahui mempunyai efek biologis yang bervariasi seperti
antimicrobial, antitumor, antihepatoksik, dan ernetik (Konno, Hirayama, Yasui,
Iridoid glikosida kutkoside dan picroside dapat bertindak sebagai
antioksidan dan memperbaiki efek hepatotoksik dari karbontetroklorida,
tioacetamide, galaktosarnin, dan paracetamol (Schuppan, Dong, Brinkhaus, and
Hahn, 1999).
C. HET-CAM
Metode HET-CAM pertaman kali dikemukakan oleh Luepke (1985),
menggunakan membran vaskuler dari fetus yaitu chorioallantoic membran dimana
merupakan gabungan antara Chorion dan allantois (Anonim, 2009).
HET-CAM digunakan untuk meneliti sifat antiiritasi dari ektrak larut air
pada tanaman yang pada akhirnya memiliki tujuan mencari substansi yang
bertanggung jawab terhadap efek antiiritasi tersebut. Metode ini mengukur waktu
onset dari tiga manifestasi iritasi pada membran yaitu hemoragi, lisis dan
koagulasi dan dibandingkan dengan kontrol positif yang sudah ada (Wilson and
Steck, 2000).
Metode pengujian dengan ChorioAllantoicMembrane/CAM merupakan
metode evaluasi subyektif dari perubahan vaskuler(hemoragi dan obstruksi) dan
nekrosis dari CAM, pembuluh vaskular dan membran respirasi yang berada di
bawah lapisan cangkang telur (Hayes, 2001).
ChorioAllantoicMembrane dari ayam merupakan jaringan yang terbentuk
setelah tujuh hari masa inkubasi yang merupakan gabungan dari chorion dan
allantois. Secara struktural lapisan terluar adalah lapisan epitelium yang terbentuk
CAM analogis dengan retina dan pembuluh darahnya. CAM ayam yang sudah
matang dapat dibagi menjadi beberapa lapisan yaitu : stratum primer, saluran
kapiler atau pembuluh darah dan lapisan stratum yang tipis yang tersusun dari sel
epitel yang memungkinkan adanya migrasi termasuk pertukaran gas dan absorbsi
kalsium (Leng, et al., 2004). Keuntungan dari uji CAM adalah biaya rendah,
simpel, dapat dipercaya, dan dapat digunakan untuk skrining dalam skala yang
besar (Ribatti, Vacca, Roncali, and Dammacco, 2000).
CAM merupakan membran vaskular respirasi yang mengelilingi
perkembangan embrio unggas. CAM tersusun atas lapisan ektodermal yang terdiri
atas epitelium yang berupa dua atau tiga inti sel, lapisan mesodermal yang terdiri
dari jaringan penghubung, ground substance, dan pembuluh darah dan juga
terdapat lapisan endodermal. Pembuluh darah berada pada lapisan mesodermal
CAM yang bercabang dari arteri dan vena embrio-allantoic (Anonim, 2003).
Pembuluh ini mengandung eritrosit dan leukosit yang dipercaya terlibat
dalam respon inflamasi oleh karena adanya paparan stimulus dari luar. Hal ini
diasumsikan bahwa efek akut diinduksi oleh zat uji pada pembuluh darah kecil
dan protein pada membran jaringan membran efeknya sama dengan efek yang
diinduksi dengan zat uji yang sama yang dipaparkan pada mata kelinci (Anonim,
Gambar 4. Perkembangan embrio unggas (Anonim, 2003)
Denaturasi (ditunjukkan sebagai koagulasi) digunakan sebagai indikator
efek pada sel dalam CAM. Perubahan pada pembuluh darah CAM dimaksudkan
untuk memprediksi keseluruhan toksisitas dan kerusakan conjuctiva pada mata
(Anonim, 2006).
Telur yang digunakan telah diinkubasi selama 10 hari kemudian dilakukan
peneropongan. Peneropongan bertujuan mengetahui apakah telur tersebut
berembrio dan menandai ruang udara pada telur. Pada saat inkubasi posisi ruang
udara berada di bagian atas. Telur yang digunakan berbobot 50-60 gram dan
Gambar 5. Morfologi telur (D’Arcy and Howard, 1966)
D. Hidrokortison Asetat
Hidrokortison asetat merupakan ester asetat dari hidrokortison.
Hidrokortison asetat merupakan obat kelompok kortikosteroid. Kortikosteroid
adalah kelompok obat yang memiliki aktivitas glukokortikoid dan
mineralokortikoid. Secara umum efeknya dibedakan atas efek retensi Na, efek
terhadap metabolisme karbohidrat (glukoneogenesis), dan efek antiinflamasi.
Umumnya efek antiinflamasi sejalan dengan efek terhadap metabolisme
karbohidrat sehingga pengelompokan kortikosteroid didasarkan atas potensi untuk
menimbulkan retensi Na (efek mineralkortikoid) dan efek antiinflamasi (efek
glukokortikoid). Khasiat antiinflamasi dan glukoneogenesis merupakan ciri
glukokortikoid (Anonim, 2000a).
Terapi menggunakan glukokortikoid menginduksi secara cepat
penyusutan inflamasi pada tikus yang diberi injeksi subkutan berupa karagenin.
lebih tinggi dari 3 mg/kg/hari selama 3 hari menyebabkan penyusutan maksimum
(Hyun, Hideo, and Susumu, 1973).
Pengobatan pasien dengan inflamasi mempunyai 2 tujuan yang utama: 1)
meringankan rasa nyeri, yang seringkali merupakan gejala awal yang terlihat dan
keluhan utama yang terus-menerus dari pasien; 2) memperlambat atau (dalam
teori) membatasi proses perusakan jaringan. Glukokortikoid memiliki efek
antiinflamasi dan ketika pertama kali diperkenalkan dianggap sebagai jawaban
terakhir untuk pengobatan artritis yang beradang (Katzung, 2001). Glukokortikoid
bisa mempengaruhi respon peradangan oleh efek vaskularnya. Glukokortikoid
menyebabkan vasokonstriksi bila dioleskan langsung ke pembuluh darah
kemudian menurunkan permeabilitas kapiler (Katzung, 1989).
O
CH3 OH
CH3
OH
C O
CH2OCOCH3
E. Natrium Lauril Sulfat
Gambar 7. Struktur Natrium Lauril Sulfat
Sodium dodecyl sulphate atau natrium lauril sulfat merupakan surfaktan
anionik yang digunakan secara luas pada formulasi sediaan non parenteral dan
kosmetik. Sodium dodecyl sulphate (SDS) merupakan detergen dan wetting agent
yang efektif dalam kondisi asam atau basa. Digunakan dalam teknik analisis
elektroforesis SDS digunakan untuk analisis protein dan SDS digunakan untuk
meningkatkan selektifitas micellar electrokinetic chromatography (Rowe, 2006).
SDS memiliki kemampuan untuk menginduksi inflamasi pada uji
antiinflamasi menggunakan metode HET-CAM suatu alkaloid dari Adhatoda
vasica Neess. Indikasi terjadi inflamasi adanya pembuluh darah yang membentuk
bintang setelah diamati menggunakan kaca pembesaran (Chakraborty and
Brantner, 2001).
F. Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan hingga memenuhi baku yang telah ditetapkan.
Ekstrak tumbuhan obat yang dibuat dari simplisia nabati dapat dipandang sebagai
bahan awal, bahan antara atau bahan produk jadi. Ekstrak sebagai bahan awal
diproses menjadi produk jadi. Ekstrak sebagai bahan antara berarti masih menjadi
bahan yang dapat diproses lagi menjadi fraksi-fraksi, isolat senyawa tunggal
ataupun tetap sebagai campuran dengan ekstrak lain. Ekstrak sebagai produk jadi
berati ekstrak yang berada dalam sediaan obat jadi siap digunakan oleh penderita
(Anonim, 2000b).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Dirjen POM RI, 1995).
G. Landasan Teori
Inflamasi merupakan respon protektif tubuh terhadap adanya kerusakan
jaringan. Adanya mediator-mediator inflamasi seperti prostaglandin menyebabkan
rasa nyeri pada tubuh yang ditandai dengan adanya dolor, kalor, rubor, tumor dan
functio laesa. Asam arakidonat merupakan komponen normal yang disimpan pada
sel dalam bentuk fosfolipid. Adanya stimulus menyebabkan asam arakidonat
kemudian mengalami metabolisme menjadi dua alur. Alur sikloosigenase yang
membebaskan prostaglandin dan alur lipooksigenase yang membebaskan
leukotrien. Leukotrien dan prostaglandin merupakan mediator nyeri yang
dilepaskan saat terjadi inflamasi (Harrison, 2010)..
Asam ursolat memiliki khasiat seperti sebagai antibakteri,
anti-angiogenik. Dengan adanya efek antiinflamasi maka asam ursolat
dikembangkan sebagai penyembuh luka dan diharapkan dapat mengatasi efek
inflamasi yang muncul ketika luka terjadi (Liu, 1995).
Asam ursolat sendiri berada dalam berbagai tanaman, salah satunya
adalah rumput mutiara. Guna mendapatkan khasiat penyembuhan luka dari asam
ursolat maka dilakukan ekstraksi dari rumput mutiara dengan menggunakan
etanol.
HETCAM merupakan metode untuk meneliti efek iritasi dari suatu
ekstrak dengan menggunakan Chorio Allantoic Membrane dari embrio ayam.
CAM sendiri merupakan jaringan yang terbentuk setelah 7 hari masa inkubasi
yang terdiri dari chorion dan allantois dimana memiliki lapisan epitelium di
bagian terluar yang melapisi allantois (Wilson and Steck, 2000).
Metode pengujian efek iritasi suatu ekstrak dengan metode HET-CAM
memiliki keuntungan biaya yang rendah, simpel, dapat digunakan untuk skrining
dalam skala besar karena waktu yang dibutuhkan untuk sekali skrining relatif
cepat. Data yang didapat di penelitian ini adalah waktu pertama kali terjadinya
hemoragi, lisis, dan koagulasi yang dirumuskan dalam skor iritasi. Pengamatan
dilakukan selama 300 detik atau 5 menit.
H. Hipotesis
Ekstrak etanol herba rumput mutiara (Hedyotis corymbosa) memiliki
BAB III
METODOLOGI PENELITIAN
A. Rancangan Penelitian
Merupakan penelitian eksperimental dengan rancangan acak lengkap
pola searah. Penelitian ini termasuk jenis penelitian eksperimental karena
dilakukan manipulasi terhadap subjek uji yaitu dengan pemberian ekstrak rumput
mutiara pada telur atau CAM dengan pemilihan subjek uji secara random atau
acak.
B. Variabel Penelitian dan Definisi Operasional
a. Variabel bebas
Sebagai variabel bebas dalam penelitian ini adalah: kadar ekstrak
etanol Herba rumput mutiara (Hedyotis Corymbosa).
b. Variabel tergantung
Sebagai variabel tergantung dalam penelitian ini adalah: waktu
hemoragi, waktu hemolisis, waktu koagulasi.
c. Variabel pengacau terkendali
Sebagai variabel pengacau terkendali dalam penelitian ini adalah:
varietas dan pengotor yang berasal dari udara, sterilitas alat, suhu dan
d. Variabel pengacau tak terkendali
Sebagai variabel pengacau tak terkendali dalam penelitian ini adalah
waktu dan lama pengeringan.
e. Definisi operasional variabel
1) Kadar ekstrak etanol rumput mutiara adalah jumlah ekstrak etanol
rumput mutiara yang terlarut dalam volume tertentu yang digunakan
dalam eksperimen.
2) Skor iritasi adalah nilai yang diperoleh dari perhitungan matematis yang
diperoleh dari data waktu koagulasi, waktu lisis dan waktu hemoragi
dalam detik menurut Spielmann (1995).
3) Inflamasi adalah perubahan pembuluh darah berupa hemoragi, hemolisis
dan koagulasi akibat induksi dari agen inflamasi.
4) Waktu hemoragi adalah pendarahan yang terjadi pada CAM, ditandai
dengan adanya bercak darah pada CAM.
5) Waktu hemolisis adalah pecahnya pembuluh darah pada CAM ditandai
dengan adanya aliran darah yang deras maupun terlihat putusnya
pembuluh darah.
6) Waktu koagulasi adalah penggumpalan protein pada telur akibat agen
penginflamasi yang kuat.
7) Perhitungan IC
50 dilakukan dengan cara analisis regresi linear, dimana
diperoleh melalui hubungan regresi konsentrasi vs persen penghambatan.
Nilai persen penghambatan 50% merupakan konsentrasi IC
C. Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi herba rumput
mutiara yang didapat disekitar kampus Universitas Sanata Dharma di Paingan,
etanol, telur ayam bebas antibiotik berumur 8-10 hari dari peternakan unggas di
Wirobrajan, aquabidest, SDS, hidrokortison asetat.
D. Alat
Alat-alat yang digunakan dalam penelitian ini meliputi pinset, pisau
kecil, spuit injeksi 1 ml, alat sokletasi, handycam, membran filter Whatman,
inkubator, rotary vacum evaporator dan seperangkat alat gelas yang lazim
digunakan di laboratorium analisis.
E. Tata Cara Penelitian 1. Deteminasi simplisia rumput mutiara
Determinasi simplisia rumput mutiara dilakukan dengan melihat
tanaman rumput mutiara kemudian dicocokan dengan kunci determinasi yang
ada pada buku Flora of Java volume VI karangan Backer and van den Brink
(1965).
2. Pembuatan serbuk herba rumput mutiara
b. Pembuatan serbuk. Herba rumput mutiara hasil sortasi dikeringkan di bawah sinar matahari secara tidak langsung. Setelah bahan kering,
diserbuk menggunakan alat serbuk (grinder).
3. Ekstraksi rumput mutiara
Sejumlah 20 g serbuk rumput mutiara dibungkus kertas saring
dimasukan ke alat sokhlet ditambah etanol p.a sampai 3 kali sirkulasi (150 ml)
kemudian dipanaskan sampai filtratnya jernih. Filtrat diuapkan menggunakan
rotary vacuum evaporator dengan pemanas waterbath suhu 700C kemudian
didapatkan ekstrak kental dan dituang ke dalam cawan porselin, kemudian
dikeringkan dengan cara dimasukan oven dengan suhu 500C dan didapatkan
ekstrak kental rumput mutiara.
4. Uji antiinflamasi ekstrak herba rumput mutiara a. Penyiapan telur
Telur ayam ayam kampung yang telah dibuahi dimasukkan dalam
inkubator yang telah dibersihkan terlebih dahulu dengan suhu 37 0C. Pastikan
rongga udara telur berada disebelah atas. Pada hari ke sepuluh telur
diteropong, telur yang tidak dibuahi atau tidak mengandung embrio hidup
dibuang. Rongga udara telur ditandai. Telur yang telah berumur sepuluh hari
kemudian ditimbang dan hanya telur dengan berat 50,0 – 60,0 g yang
digunakan.
b. Pengaturan inkubator telur
Inkubator diatur temperatur dan kelembapan suhu yaitu untuk suhu
kelembaban inkubator pada bagian bawah inkubator terdapat tampungan air
yang berfungsi untuk mengatur kelembaban inkubator. Air yang digunakan
untuk mengisi tampungan adalah air steril.
c. Pengujian HET-CAM
1. Kelompok perlakuan. Menggunakan lima telur untuk setiap kelompok perlakuan. Kelompok perlakuan dibagi menjadi:
1. Kontrol positif antiinflamasi (Hidrokortison asetat 1 %). Hidrokortison asetat ditimbang seksama kurang lebih sebanyak 0,01 gram
dimasukkan dalam tabung Eppendorf selanjutnya timbang SDS 0,01 gram
dan dimasukkan ke dalam tabung Eppendorf tersebut ditambah dengan
aquabidest steril hingga 1,0 ml.
2. Kontrol negatif (aquabidest). Aquabidest yang digunakan untuk kontrol negatif adalah aquabidest steril. Kemudian aquabidest
ditambahkan dalam tabung Eppendorf hingga volume 1,0 ml.
3. Kontrol positif inflamasi (SDS 1%). Sodium dodecyl sulphate
(SDS) sebanyak ditimbang seksama kurang lebih 0,01 gram kemudian
dilarutkan dengan 1,0 ml aquabidest steril.
kemudian diencerkan 10 kali lalu ditambah dengan 0,01 g SDS dalam Masing-masing bahan yang telah dibuat kemudian diambil sebanyak 0,2
ml dengan menggunakan spuit. Suntikan pada daerah pada membran yang
dekat dengan pembuluh darah. Amati perubahan pembuluh darah yang
terjadi.
3. Pengamatan. Pengamatan reaksi CAM dilakukan selama 300 detik. Pengamatan dilakukan pada CAM dan dicatat saat timbul
gejala-gejala inflamasi. Gejala-gejala yang diamati adalah hemoragi
(pendarahan), vascular lysis (disintregasi pembuluh darah), koagulasi
(denaturasi protein ekstra dan intra vaskular).
Hemorhage time, yaitu waktu yang dibutuhkan untuk terjadinya
pendarahan pada CAM dihitung dari saat injeksi. Lysis time, yaitu waktu
yang dibutuhkan untuk terjadinya pendarahan dari pembuluh darah pada
CAM dihitung dari saat injeksi. Coagulation time, yaitu waktu yang
dibutuhkan untuk pembentukan koagulan pada CAM dihitung dari saat
5. Analisis Hasil
Data yang didapat adalah waktu pertama kali terjadinya hemoragi,
lisis, dan koagulasi. Pengamatan dilakukan selama 300 detik atau 5 menit.
Skor iritasi dihitung dengan mengikuti rumus:
300[IS] = 5[301-H] + 7[301-L] + 9[301-C]
Dimana : IS = skor iritasi
H = waktu mulainya terjadi reaksi hemoragi pada CAM L = waktu mulainya terjadi lisis pembuluh darah pada CAM C = waktu mulai terjadinya koagulan pada CAM
Kriteria iritasi berdasarkan nilai skor iritasi menurut Luepke (1985)
No Skor iritasi HET-CAM Kategori iritasi
1 ≤ 0,9 Tidak mengiritasi 2 1,0 – 4,9 Iritan lemah 3 5,0 – 8,9 Iritan moderat 4 9,0 – 21 Iritan kuat
Data Iritation Score (IS) untuk semua perlakuan dan replikasi diuji
dengan uji Kruskal Wallis, dilanjutkan Mann Whitney dengan tingkat
kepercayaan 95% untuk mengetahui beda tiap perlakuan. Daya antiinflamasi
dilihat dari nilai IC
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Simplisia
Dalam pelaksanaan penelitian menggunakan suatu simplisia, langkah
awal yang dilakukan adalah determinasi simplisia. Tujuan dari determinasi
simplisia ini adalah untuk menjamin dan memastikan simplisia yang digunakan
benar-benar simplisia yang dimaksud. Simplisia herba rumput mutiara yang
digunakan dalam penelitian ini diperoleh dari sekitar kampus Universitas Sanata
Dharma, Yogyakarta. Simplisia herba merupakan keseluruhan bagian tanaman di
atas tanah dari rumput mutiara. Oleh karena itu, simplisia ini dapat digunakan
sebagai pelengkap untuk determinasi sesuai acuan (Backer dan Bakhuizer van den
Brink, 1965) setelah dibandingkan dengan tanaman rumput mutiara asal simplisia
ini. Dari hasil determinasi, telah dibuktikan bahwa tanaman yang digunakan untuk
penelitian adalah rumput mutiara (Hedyotis corymbosa (L.) Lamk.).
Pembuktian dikuatkan dengan surat determinasi tanaman (Lampiran 1)
yang dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
B. Pembuatan Serbuk Herba Rumput Mutiara
Herba rumput mutiara yang telah dikumpulkan selanjutnya dilakukan
sortasi kering. Tujuan dari sortasi kering ialah memisahkan simplisia dari material
tidak baik seperti simplisia ditumbuhi jamur atau membusuk. Kondisi yang tidak
baik dari simplisia dapat mempengaruhi mutu simplisia itu sendiri.
Herba rumput mutiara yang telah lolos sortasi kering selanjutnya
dikeringkan kembali. Tujuan dari pengeringan adalah untuk mengurangi kadar air
yang terkandung dalam herba rumput mutiara. Adanya kandungan air yang cukup
banyak dapat mengakibatkan herba rumput mutiara cepat membusuk karena
proses enzimatis yang berlangsung jika kandungan air dalam simplisia cukup
tinggi. Pengeringan dilakukan dengan cara dimasukan ke dalam oven dengan suhu
600 C hingga herba rumput mutiara menunjukan kerapuhan yang baik yang dapat
untuk dibuat menjadi serbuk.
Simplisia yang telah kering selanjutnya diserbuk menggunakan alat
penyerbuk (grinder). Tujuan dari pembuatan serbuk ialah untuk memperkecil
ukuran simplisia sehingga saat penyarian akan memperluas area spesifik yang
kontak dengan pelarut sehingga diharapkan proses ekstraksi lebih aktivitastif dan
efisien. Semakin kecil ukuran partikel suatu serbuk maka luas area spesifiknya
akan meningkat. Kesempatan partikel untuk terbasahi sempurna akan tinggi tetapi
dalam proses penyarian ukuran partikel serbuk yang terlalu kecil dapat
menyebabkan kohesifitas partikel serbuk meningkat sehingga partikel akan
tersedimentasi di dasar dan hasil proses penyarian akan kurang optimal.
Serbuk simplisia herba rumput mutiara kemudian disimpan dalam wadah
yang kering dan tertutup rapat dengan diberi silica gel untuk mencegah absorpsi
C. Ekstraksi Serbuk Herba Rumput Mutiara
Serbuk rumput mutiara kemudian diekstraksi dengan metode sokhletasi
dengan suhu 700C dengan penyari etanol 96%. Sokhletasi dipilih karena metode
ini cukup aktivitastif dimana penyarian dilakukan berulang dan dapat menghindari
terjadinya kejenuhan dengan jumlah penyari yang terbatas. Proses ekstraksi ini
dihentikan ketika larutan dalam tabung ekstaksi menjadi bening. Hal ini
menunjukan sudah tidak adanya proses penyarian sehingga sokhletasi dihentikan.
Setelah didapatkan ekstrak rumput mutiara kemudian ekstrak tersebut dikentalkan
dengan rotari vakum evaporator dengan suhu 700C. Rotari vakum evaporator ini
memiliki prinsip kerja menguapkan pelarut dengan menurunkan tekanan dengan
dibantu pompa vakum. Setelah itu kemudian dioven pada suhu 600 C dan didapat
ekstrak rumput mutiara berupa pasta atau berupa ekstrak kental. Tujuan dari
pengentalan ekstrak ini adalah membuang larutan penyari semaksimal mungkin
agar ketika ekstrak diaplikasikan dapat meminimalkan pengaruh dari penyari
terhadap objek uji. Ekstrak yang terbentuk secara organoleptis berwarna hijau
kental dengan aroma khas.
D. Uji HET-CAM
Pada penelitian ini digunakan metode yang disusun oleh Spielmann tanpa
dilakukan modifikasi dimana metode ini memiliki kelebihan:
1. Sederhana, berarti alat dan bahan-bahan yang dibutuhkan tidak
banyak dan perlakuan terhadap telur relatif mudah dilakukan.
2. Cepat, berarti metode ini membutuhkan waktu pengamatan yang
inflamasi dan aktivitas antiinflamasi dari suatu senyawa dapat segera
teramati.
3. Sensitif, berarti adanya rangsangan inflamasi dari luar akan segera
memberikan respon perubahan pembuluh darah.
4. Relatif murah, berarti terkait dengan penggunaan bahan dan alat yang
tidak banyak sehingga secara ekonomis metode ini relatif murah.
Metode HET-CAM ini selain digunakan sebagai metode pengujian
antiinflamasi dapat juga digunakan dalam simulasi bedah optik, pengujian iritasi,
dan uji anti angiogenesis berkaitan dengan obat antikanker. Metode HET-CAM
yang digunakan dalam penelitian ini adalah metode berdasarkan Spielmann
(1996) menggunakan embrio telur dengan umur 10 hari dan hasil yang didapat
berupa skor iritasi. Kontrol positif inflamasi menggunakana natrium lauril sulfat
(Sodium Dodesyl Sulfat) sesuai dengan aturan dari National Institute of
Evironmental Health Sciences yakni sebesar 1%.
Uji yang dilakukan dengan menyuntikan sebanyak 200 µ l larutan uji ke
telur berembrio kemudian diamati waktu hemoragi, hemolisis dan koagulasi.
Kemudian hasilnya dihitung menggunakan rumus:
300[IS] = 5[301-H] + 7[301-L] + 9[301-C]
Dimana : IS = skor iritasi
H = waktu mulainya terjadi reaksi hemoragi pada CAM
L = waktu mulainya terjadi lisis pembuluh darah pada CAM
Dari rumus di atas dapat dilihat perbandingan nilai dari waktu
hemoragi:hemolisis :koagulasi adalah 5:7:9 maka dapat disimpulkan faktor yang
memiliki pengaruh terhadap skor iritasi primer berturut-turut dari yang paling
besar pengaruhnya adalah waktu koagulasi, waktu hemolisis kemudian waktu
hemoragi. Hal ini dapat dirumuskan terjadinya koagulasi dan lisis selalu diawali
dengan hemoragi terlebih dahulu. Begitu pula terjadinya koagulasi juga diawali
hemoragi dan hemolisis baru kemudian terjadi koagulasi.
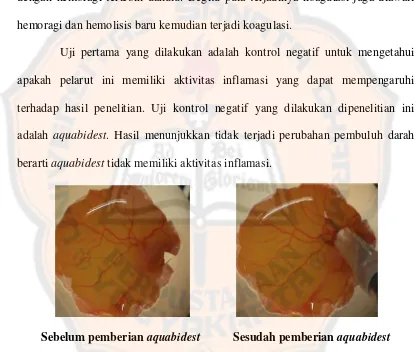
Uji pertama yang dilakukan adalah kontrol negatif untuk mengetahui
apakah pelarut ini memiliki aktivitas inflamasi yang dapat mempengaruhi
terhadap hasil penelitian. Uji kontrol negatif yang dilakukan dipenelitian ini
adalah aquabidest. Hasil menunjukkan tidak terjadi perubahan pembuluh darah
berarti aquabidest tidak memiliki aktivitas inflamasi.
Sebelum pemberian aquabidest Sesudah pemberian aquabidest Gambar 8. Pemberian kontrol negatif aquabidest
Sebagai kontrol positif inflamasi digunakan SDS 1% dimana setelah
pemberian SDS 1% menunjukan terjadinya inflamasi yaitu perubahan pembuluh
darah pada membran allantoic. SDS 1% dipilih sesuai ketentuan pada
Identifying Ocular Corrosives and Severe Irritants : Hen’s Egg Test –
Chrioallantoic Membrane Test Method dimana kontrol positif inflamasi yang
digunakan adalah SDS dengan konsentrasi 0,1-1%.
Sebelum pemberian SDS 1% Setelah pemberian SDS 1% Gambar 9. Pemberian kontrol positif inflamasi
Keterangan : menunjukkan adanya hemoragi dan lisis
Pemberian SDS 1% memberikan aktivitas inflamasi yang ditunjukkan
perubahan pembuluh darah berupa hemoragi dan lisis. Hemoragi ditunjukkan
dengan timbulnya warna merah di dalam membran sedangkan lisis adalah
pecahnya pembuluh darah.
Sebelum pemberian hidrokortison+SDS 1% Sesudah pemberian hidrokortison+SDS 1%
Pengujian kontrol positif antiinflamasi dilakukan dengan pemberian
hidrokortison asetat. Hidorkortison asetat merupakan obat golongan
glukokortikoid yang akan berikatan dengan protein reseptor menghasilkan
perubahan dalam sintesis protein. Protein inilah yang mengubah fungsi seluler
yaitu aktivitas glukogenesis dan aktivitas antiinflamasi (Anonim, 2000a). Setelah
pemberian hidrokortison asetat ditambah dengan SDS 1% ditunjukan tidak ada
perubahan pembuluh darah. Hal ini berarti aktivitas dari hidrokortison asetat
menghambat respon inflamasi yang ditimbulkan oleh SDS 1%.
Setelah dilakukan pengujian kontrol, pengujian dilanjutkan dengan
pengujian larutan uji berbagai tingkat konsentrasi ke CAM. Konsentrasi yang
digunakan 150 µg/ml, 300 µg/ml dan 600 µg/ml. Setelah dipaparkan pada CAM
kemudian dilakukan pengamatan seperti pada kontrol yaitu selama 300 detik dan
dicatat waktu hemoragi, hemolisi dan koagulasi yang kemudian dihitung skor
Berikut ini merupakan hasil dari perlakuan pada berbagai tingkat
konsentrasi:
Tabel I. Tabel Hasil Perlakuan Pemberian Ekstrak Herba Rumput Mutiara Konsentrasi
ekstrak Sebelum Sesudah
150 (µg/ml)
Ket : lisis
300 (µg/ml)
Ket : lisis, hemoragi
600 (µg/ml)
Dapat dilihat pada konsentrasi 150 µg/ml masih terlihat adanya darah
yang keluar cukup besar ditandai dengan adanya lisis pembuluh darah dan bercak
darah yang cukup banyak pada CAM. Kemudian pada konsentrasi 300 µg/ml
menunjukan sudah berkurangnya inflamasi dibanding dengan konsentrasi 150
µg/ml. Pada konsentrasi 600 µg/ml sudah tidak terjadi hemoragi, ini berarti sudah
tidak ada respon inflamasi pada CAM.
Dokumentasi hasil penelitian memberikan gambaran yang kurang jelas,
hal ini disebabkan karena pencahayaan yang kurang selama pengambilan gambar.
Pencahayaan yang baik didapat dengan melakukan pencahayaan dari bawah
cangkang telur sehingga ketika gambar diambil pada bagian atas atau pada bagian
permukaan telur didapat gambar yang bagus.
Pada penelitian ini digunakan 3 peringkat konsentrasi yang
masing-masing dilakukan dengan 5 replikasi. Hasil skor iritasi yang didapat kemudian
dikategorisasi seperti pada tabel 2.
Tabel II. Hasil Skor Iritasi Dari Telur Dengan Pemberian Perlakuan
No. Kelompok perlakuan Irritation score Kategori iritasi
1. Telur+Aquabidest 0 ± 0 Tidak mengiritasi 2. Telur+SDS 1% 10,5 ± 2,3 Iritasi kuat 3. Telur+SDS 1%+Hidrokortison 0 ± 0 Tidak mengiritasi 4. Telur+SDS 1%+Ekstrak 150µg/ml 8,7 ± 0,7 Iritasi sedang 5. Telur+SDS 1%+Ekstrak 300µg/ml 4,9 ± 1,0 Iritasi lemah 6. Telur+SDS 1%+Ekstrak 600µg/ml 0 ± 0 Tidak mengiritasi Keterangan :
Score pada HET-CAM Kategori iritasi
1. 0 – 0,9 Tidak mengiritasi atau praktis tidak mengiritasi 2. 1 – 4,9 Iritasi lemah
3. 5 – 8,9 atau 5 – 9,9 Iritasi sedang 4. 9 – 21 atau 10 – 21 Iritasi kuat
(Cazedey, Carvalho, Fiorentino, Gremião, Salgado, 2009).
Hasil penelitian menunjukkan SDS 1% memberikan aktivitas inflamasi
konsentrasi 600 µg/ml menunjukan penghambatan terhadap inflamasi yang paling
baik terlihat dengan tidak terjadinya inflamasi.
Hasil skor iritasi kemudian dibuat box plot hubungan antara perlakuan
dan hasil iritasi skor yang didapat seperti pada gambar 11.
Gambar 11. Hubungan perlakuan vs irritation score
Dari diagram di atas dapat dilihat skor iritasi menurun seiring dengan
peningkatan dosis ekstrak yang diberikan. Pada perlakuan SDS 1% terlihat box
plot pada 10,5 ± 2,3. Pada konsentrasi 150 µg/ml sudah menunjukan adanya
penghambatan inflamasi akan tetapi sangat kecil ditunjukan adanya penurunan
menghambat terjadinya inflamasi dengan baik dan setara dengan hidrokortison
asetat ditunjukan dengan box plot mendekati 0.
E. Uji Kruskal Wallis Dan Mann Whitney
Data irritation score yang didapat kemudian diolah menggunakan
metode statistik kruskal-wallis untuk mengetahui apakah ada perbedaan irritation
score tiap perlakuan. Dari hasil kruskal wallis didapat nilai α=0,000 dimana nilai
ini α <0,005. Dari hasil tersebut dapat disimpulkan setidaknya ada dua kelompok
memiliki hasil irritation score yang berbeda bermakna. Kemudian setelah uji
Kruskal-wallis dilakukan uji post hoc yaitu uji Mann Whitney untuk mengetahui
perbedaan antar kelompok perlakuan.
Hasil uji Mann Whitney disajikan dalam tabel III.
Tabel III. Hasil Uji Mann Whitney
Perlakuan TA TSDS THDK TE150 TE300 TE600 TSDS : Telur + SDS 1% btb: berbeda tidak bermakna (p>0,05) THDK : Telur + Hidrokortison asetat + SDS 1%
TE150 : Telur + ekstrak herba rumput mutiara 150µg/ml + SDS 1% TE300 : Telur + ekstrak herba rumput mutiara 300µg/ml + SDS 1% TE600 : Telur + ekstrak herba rumput mutiara 600µg/ml + SDS 1%
Nilai skor iritasi pada perlakuan kontrol positif inflamasi (SDS)
p<0,05 yang berarti skor iritasi antara kedua perlakuan berbeda signifikan secara
statistik.
Pada tabel di atas dapat dilihat skor iritasi antara perlakuan SDS dengan
perlakuan konsentrasi 150 µg/ml memiliki nilai p>0,05, yang berarti skor iritasi
yang dihasilkan dari kedua perlakuan tersebut berbeda namun tidak signifikan
secara statistik.
Perbedaan skor iritasi antara perlakuan SDS dengan 300 µg/ml memiliki
nilai p<0,05 yang berarti pada konsentrasi 300 µg/ml menunjukan penurunan skor
iritasi yang signifikan secara statistik dibandingkan dengan kontrol positif
inflamasi.
Pada perlakuan 600 µg/ml menunjukan penurunan skor iritasi secara
signifikan dibandingkan dengan kontrol positif inflamasi SDS. Penurunan skor
iritasi pada perlakuan 600 µg/ml merupakan yang paling baik dari ketiga
konsentrasi lainnya.
Pada perlakuan kontrol positif antiinflamasi yaitu hidrokortison asetat
dibandingkan dengan perlakuan 600 µg/ml memiliki nilai p>0,05. Hal ini berarti
skor iritasi antara kedua perlakuan berbeda tidak bermakna secara statistik. Dapat
dikatakan bahwa konsentrasi ekstrak 600 µg/ml memiliki aktivitas penghambatan
terhadap inflamasi setara dengan hidrokortison 1 %.
Pada konsentrasi 150 µg/ml dan 300 µg/ml nilai dari skor iritasi yang
dihasilkan dibandingkan dengan kontrol positif antiinflamasi memiliki nilai yang
lebih rendah dan menghasilkan p>0,05 yang berarti nilai skor iritasi berbeda
kedua konsentrasi masih lebih rendah dari kontrol positif antiinflamasiyaitu
hidrokortison asetat.
F. Penentuan IC50
PenentuanIC50menggunakanregresilinear yaitu dengan menghubungkan
konsentrasi ekstrak herba rumput mutiara dengan persentase penghambatan
inflamasi. Hubungan konsentrasi vs persentase penghambatan inflamasi sehingga
diperoleh hubungan kurva regresi linear. Persentase penghambatan dihitung
dengan cara:
ℎ = 100%
Keterangan:
ISK: skor iritasi kelompok perlakuan kontrol positif inflamasi
ISP: skor iritasi kelompok perlakuan berbagai konsentrasi ekstrak
Berikut adalah persen penghambatan dari tiap konsentrasi perlakuan:
Tabel IV. Skor Iritasi dan Persen Penghambatan
Perlakuan Skor Iritasi Persen penghambatan
Kontrol positif inflamasi (SDS 1%) 10,5 -
Konsentrasi 150 µg/ml 8,7 17,1%
Konsentrasi 300 µg/ml 4,9 53,3%
Konsentrasi 600 µg/ml 0 100%
Kemudian persen penghambatan yang didapat dibuat regresi linear antara
konsentrasi ekstrak dan persen penghambatan sehingga didapatkan persamaan
y=0,1803x-6,1905 dengan nilai r=0,9872. Persen penghambatan meningkat
seiring meningkatnya konsentrasi ekstrak hingga pada konsentrasi 600 µg/ml
Gambar 12. Kurva persentase penghambatan vs konsentrasi
Menggunakan kurva hubungan konsentrasi vs persentasi penghambatan
dapat ditentukan IC50 dari ekstrak herba rumput mutiara yaitu dengan mencari
nilai penghambatan 50% dari persamaan tersebut. IC50 ekstrak herba rumput
mutiara untuk antiinflamasi adalah 311,65 µg/ml
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Ekstrak herba rumput mutiara memiliki daya antiinflamasi dengan nilai
IC50 sebesar 311,65 µg/ml
B. Saran
4. Perlu dilakukan penataan cahaya yang lebih optimal untuk dokumentasi hasil
sehingga diperoleh data-data dokumentasi yang lebih baik.
5. Perlu dilakukan uji inflamasi pada hewan uji sebagai tindak lanjut dari data
DAFTAR PUSTAKA
Anonim, 1996, Kamus Saku Kedokteran Dorland, 556, Penerbit Buku Kedokteran EGC, Jakarta
Anonim, 2000a, Informatorium Obat Nasional Indonesia, 271-272, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2000b, Parameter Standar Umum Ekstrak Tumbuhan Obat, 5, 13, 17 Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2003, Egg and Embryo Development,http://www.enchantedlearning.com / subjects/birds/info/chicken/egg.shtml diakses tanggal 9 April 2010
Anonim, 2006, Background Review Dokument Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants : Hen’s
Egg Test – Chrioallantoic Membrane Test Method, 6, National Institute of
Evironmental Health Sciences
Anonim, 2009, HerbEx Centella ExtractTM, http://www.biospectrum.com/, diakses tanggal 29 Agustus 2009
Anonim, 2010, Sumber: http://ccrcfarmasiugm. wordpress.com/ ensiklopedia/ ensiklopedia-tanaman-anti-kanker/r/rumput-mutiara/ diakses tanggal 20 Januari 2011
Anonim, 2011, Sumber : http://en.wikipedia.org/wiki/ursolic_acid diakses tanggal 20 Januari 2011
Alawiyah, Lusiana, 2007, Ekstrak Etanol Rumput Mutiara (Hedyotis corymbosa(L.) Lam.) sebagai Antihepatotoksik pada Tikus Putih yang Diinduksi Parasetamol, skripsi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Bogor.
Backer, C. A., and van der Brink Jr, R.C.B., 1965, Flora of Java (Spermatophytes
Only), Vol.VI, N.V.P. Noordhoff-Groningen-The Netherlands,
Netherlands
Bedoui, S., Velkoska, E., Bozinovski, S., Jones, J.E., Anderson, G.P., and Morris, M.J., 2005, Unaltered TNF-α Production by Macrophages and Monocytes in Diet-Induced Obesity in The Rat, Journal of Inflammation
2:2, 1-8
Cardenaz, C., Quesada, A.R., and Medina M.A., 2004, Effects of ursolic acid on
different steps of the angiogenic process, 402, Biochemical and
Chakraborty, A., and Brantner, A.H., 2001, Study of Alkaloids from Adhatoda vasica Nees on their Antiinflammatory Activity, Phytother Res, 15, 532-534
Cazedey, E.C.L., Carvalho, F.C., Fiorentino, F.A.M, Gremião, M.P.D.G., Salgado, H. R.N., 2009, Corrositex®, BCOP and HET-CAM as Alternative Methods to Animal Experimentation, Braz J Pharm Sci, Vol 45, n.4, 759-766
D’Arcy, P.F. and Howard, E.M., 1966, A New Anti-inflammatory Test, Utilizing The Chorio-allantoic Membrane of The Chick Embryo, Br J Pharmacol
Chemother, 29, 378-387
Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995, Farmakope
Indonesia, jilid IV, Departemen Kesehatan Republik Indonesia, Jakarta,
pp 7.
Harrison, J.H., 2010, The Respon to Injury: Acute and Chronic Inflammation, http://www.mcl.tulane.edu/classware/pathology/medical_pathology/inflam mation/inflammation.swf, diakses tanggal 8 April 2010
Hayes, A. Wallace, 2001, Principle and Methods of Toxicology, fourth
edition,878-879, 895-896, Taylor and Francis, USA
Hyun, S.K., Hideo, N., Susumu, T., 1973, Rebound of Rat Carrageenin Granuloma Following Cessation of Anti-inflammatory Strroid Therapy,
Biochem Pharmacol, Vol 23, Issue 2, 381-387
Ikeda, Yasutaka, et al., 2007, Ursolic Acid: An Anti- and Pro-Inflamatory
Triterpenoid, Japan
Liu, J., 1995, Journal of Ethnopharmacology : Pharmacology of Oleanolic acid
and Ursolic acid, pp.49,57-68.
Luepke N. 1985. Hen's egg chorioallantoic membrane test for irritation potential.
Food Chem Toxic 23:287-291.
Katzung, B.G., 1989, Farmakologi Dasar and Klinik edisi III, 539, Buku Kedokteran EGC, Jakarta
Katzung, B.G., 2001, Farmakologi Dasar dan Klinik, 449-450, Salemba Medika, Jakarta
Konno K, Hirayama C, Yasui H, and Nakamura M. 1999. Enzymatic Activation of
Privet Tree. National Institute of Sericultural and Entomological Science. Ibaraki Japan.
Leng, T., Miller, J., M., Bilbao, K., Palanker, D., Huie, P., Blumenkranz, M., 2004, The Chick Chorioallantoic Membrane as a Model Tissue for
Surgical Retinal Research and Simulation, Retina, The Journal of Retinal
and Vitreous Diseases, volume 24, number 3
Mansjoer, S., 2003, Mekanisme Obat Anti Radang, library.usu.ac.id, Diakses pada tanggal 5 Juli 2011
Pearson, N.M., 2010, Acute Inflammation, www.homepage.montana.edu/~awmsg/ Acute%2520 Inflammation.ppt, diakses tanggal 19 April 2011
Peng, J.N., Feng, X.Z., Li, G.Y., and Liang, X.T., 1997, Chemical Investigation of Genus Hedyotis Identification of Iridoids from Hedyotis Chrysotricha.
Yao Xue Xue Bao. 12:908-913.
Peng, I.N., Feng, X.Z. and Liang, X.T., 1999, Two New Iridoids from Hedyotis Chrysotricha. J, Nat Prod 4: 611-612.
Ribatti, D., Vacca, A., Roncali, L., and Dammacco, F., 2000, The Chick Embryo Chorioallantoic Membrane as a Model for in Vivo Research on Anti-Angiogenesis.
Schuppan, D., Dong Jia, I., Brinkhaus, B., and Hahn, E.G., 1999, Herbal Product for Liver Diseases: a Therapeutic Challenge for the New Millennium.
Hepatology. 4: 1099-1104.
Spielmann H, 1995, HET-CAM Test. In: Methods in Molecular Biology Vol 43. In Vitro Toxicity Testing Protocols. (O'Hare S, Atterwill C, eds). Totowa:Hunana Press, 199-204.1996. Results of a validation study in
Germany on two in vitro alternatives to the Draize eye irritation test,
HET-CAM test and the T3 NRU cytotoxicity test. ATLA 24:741-858.
Rowe, R.C., Sheskey, P.J., Owen, S.C., 2006, Handbook of Pharmaceutical Excipients fifth edition, 687, Pharmaceutical Press and American Pharmacists Association, USA
Lampiran 2. Penimbangan bahan
SDS 1 % untuk ekstrak herba rumput mutiara
Gelas arloji 13,8002 14,3021 13,6219 14,1131 Gelas arloji + zat 13,8005 14,4524 13,7719 14,2634 Gelas arloji + sisa 13,6502 14,3022 13,6219 14,1132 Zat 0,1503 0,1502 0,1500 0,1502
SDS 1 % untuk ekstrak herba rumput mutiara
Bobot (g) Konsentrasi Ekstrak Herba Rumput
mutiara
150 μg 300 μg 450 μg 600 μg
Replikasi 3
SDS 1 % untuk ekstrak herba rumput mutiara
Gelas arloji 13,8002 14,3021 13,6219 14,1131 Gelas arloji + zat
13,8002 14,4524 13,7722 14,2633
Gelas arloji + sisa 13,6502 14,3022 13,6219 14,1132 Zat 0,1500 0,1502 0,1503 0,1501
SDS 1 % untuk ekstrak herba rumput mutiara
Replikasi 5
SDS 1 % untuk ekstrak herba rumput mutiara
Gelas arloji 13,8002 14,3021 13,6219 14,1131 Gelas arloji + zat
13,8003 14,4523 13,7722 14,2634
Gelas arloji + sisa
13,6502 14,3022 13,6219 14,1132
Zat 0,1501 0,1501 0,1503 0,1502
Lampiran 3. Penghitungan Irritation Score
= ( ) 5 + ( ) 7 + ( ) 9
Hemorrhage time : waktu terjadi hemoragi dalam satuan detik
Lysis time : waktu terjadi lisis dalam satuan detik
Coagulation time : waktu terjadi koagulasi dalam satuan detik
e. Replikasi 5
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 0
2. Telur + Hidrokortison asetat + SDS 1%
a. Replikasi 1
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 0
b. Replikasi 2
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 0
c. Replikasi 3
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 0
d. Replikasi 4
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
e. Replikasi 5
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 0
3. Telur + SDS 1%
a. Replikasi 1
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 8,89
b. Replikasi 2
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 8,45
c. Replikasi 3
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 10,02
d. Replikasi 4
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
e. Replikasi 5
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
=10,57
4. Telur + ekstrak 150μl + SDS 1%
a. Replikasi 1
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 7,84
b. Replikasi 2
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 8,55
c. Replikasi 3
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 8,76
d. Replikasi 4
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
e. Replikasi 5
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
=9,67
5. Telur + ekstrak 300μl + SDS 1%
a. Replikasi 1
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 4,20
b. Replikasi 2
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 4,45
c. Replikasi 3
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9
= 5,48
d. Replikasi 4
= ( ) 5 + ( ) 7 + ( ) 9
= ( ) 5 + ( ) 7 + ( ) 9