commit to user
UJI SITOTOKSIK ISOLAT AKTIF DARI EKSTRAK KLOROFORM
RUMPUT MUTIARA (Hedyotis corymbosa (L.) Lamk.)
TERHADAP SEL HELA DAN SIHA
Skripsi
Untuk memenuhi sebagian persyaratan guna memperoleh gelar Sarjana Sains
Oeh:
FINA ERNAWATI
NIM M0406028
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
SURAKARTA
commit to user BAB I
PENDAHULUAN
A. Latar Belakang
Kanker merupakan penyakit penyebab kematian terbesar kedua setelah
penyakit kardiovaskuler (Sukardiman et al., 2004). Di Indonesia, penderita kanker mengalami peningkatan yang cukup signifikan dari tahun ke tahun. Menurut Ja’far
dan Santoso (2010) di negara berkembang, kanker serviks merupakan penyebab
utama kematian akibat kanker di kalangan wanita.
Usaha penyembuhan dengan obat sintetik umumnya masih relatif mahal dan
memiliki efek yang besar. Oleh karena itu, sebagian besar penderita penyakit ini
memilih cara lain dengan memanfaatkan bahan alam yaitu dengan menggunakan
tanaman obat sebagai obat tradisional (Sukardiman et al., 2004).
Murdiyono (2008) telah meneliti fraksi 6 ekstrak kloroform rumput mutiara
(Hedyotis corymbosa (L.) Lamk.) dan hasilnya diperoleh LC50-24 jam adalah 281,77 µg/ml. Menurut Meyer et al., (1982) senyawa uji dikatakan toksik jika harga LC50-24
jam kurang dari 1000 µg/ml. Ruwaida (2010) melakukan isolasi terhadap fraksi aktif
rumput mutiara dan diperoleh 6 isolat, dua diantaranya yaitu isolat 4 dan 5
merupakan isolat aktif dengan LC50-24 jam 55,87 µg/ml dan 47,76 µg/ml. Berdasarkan
hasil penelitian tersebut perlu dilakukan penelitian lebih lanjut terhadap isolat 4 dan 5
commit to user
Menurut Febriansah et al. (2008) dan IPTEKnet (2005) rumput mutiara telah lama digunakan dalam pengobatan kanker serviks. Sel HeLa dan SiHa merupakan
turunan dari sel epitel kanker serviks, oleh karena itu pada penelitian ini dilakukan
pengujian sitotoksisitas untuk mengetahui potensi isolat 4 dan 5 dalam penghambatan
pertumbuhan terhadap sel HeLa dan SiHa. Uji sitotoksik digunakan untuk
menentukan parameter nilai IC50-24 jam. Nilai IC50-24 jam dapat menunjukkan potensi
suatu senyawa sebagai sitotoksik.
Haryanti (2008) dalam penelitiannya menyebutkan IC50-24 jam ekstrak etanol
rumput mutiara terhadap sel MCF-7 adalah 77 µg/ml. Sejalan dengan hal tersebut
Suparman (2008) melaporkan IC50-24 jam yang didapat dari uji sitotoksik terhadap
ekstrak etanol rumput mutiara adalah 116 µg/ml pada WiDr. Berdasarkan penelitian
di atas maka perlu dilakukan uji sitotoksik isolat rumput mutiara terhadap sel HeLa
dan SiHa.
Penelitian ini bertujuan untuk mengetahui nilai IC50-24 jam dari isolat 4 dan 5
ekstrak kloroform yang terkandung dalam rumput mutiara yang berpotensi sebagai
antikanker berdasarkan hasil uji toksisitas dengan metode Brine Shrimp Lethality Test
commit to user
B. Rumusan Masalah
1. Berapakah nilai IC50-24 jam isolat 4 dan 5 dari ekstrak kloroform rumput
mutiara terhadap sel HeLa dan SiHa?
2. Bagaimanakah efek sitotoksik pada sel HeLa dan SiHa setelah pemberian
isolat 4 dan 5 dari ekstrak kloroform rumput mutiara?
C. Tujuan Penelitian
1. Mengetahui nilai IC50-24 jam isolat 4 dan 5 dari ekstrak kloroform rumput
mutiara terhadap sel HeLa dan SiHa.
2. Mengetahui efek sitotoksik pada sel HeLa dan SiHa setelah pemberian isolat
4 dan 5 dari ekstrak kloroform rumput mutiara.
D. Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah:
1. Memberikan kontribusi dalam perkembangan ilmu pengobatan mengenai
potensi isolat 4 dan 5 dari ekstrak kloroform rumput mutiara sebagai agen
antikanker.
2. Memberikan informasi mengenai efek sitotoksik isolat 4 dan 5 dari ekstrak
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Rumput mutiara (Hedyotis corymbosa (L.) Lamk.)
Tumbuhan rumput mutiara (Hedyotis corymbosa (L.) Lamk.) merupakan salah satu dari sekian banyak tumbuhan liar yang mungkin terabaikan. Tumbuhan
yang dianggap mengganggu ini seringkali dibabat habis saat membersihkan
kebun atau pekarangan, padahal rumput mutiara merupakan salah satu sumber
obat etnis (Gentry, 1993).
a. Klasifikasi
Division : Spermatophyta
Subdivision : Angiospermae
Class : Dicotyledoneae
Order : Rubiales
Family : Rubiaceae
Genus : Hedyotis
Species : Hedyotis corymbosa (L.) Lamk. (Hutchinson, 1959).
b. Basionim
commit to user
c. Nama Daerah
Nama daerah dari rumput mutiaraadalah rumput siku–siku, bunga telor
belungkas, daun mutiara, katepan, urek–urek polo (Jawa), Pengka (Makasar),
Shui xian cao (China) (IPTEKnet, 2005).
d. Morfologi Tanaman
Gambar 1. Habitus rumput mutiara (Crusson, 2007)
Rumput mutiara tumbuh rimbun berserak, tinggi 15-50 cm, tumbuh
subur pada tanah lembab di sisi jalan dan pinggir selokan, mempunyai banyak
percabangan seperti terlihat pada Gambar 1 di atas. Daun tunggal, berhadapan
atau bersilang berhadapan, helaian relatif kecil, panjang 1-3,5 cm, lebar 1,5-7
mm, ujung dan pangkalnya runcing, berwarna hijau pucat, dengan sisik-sisik
kecil sepanjang tepi daunnya, tangkai daun sangat pendek, atau hampir duduk,
ibu tulang daun satu di tengah. Ujung daun mempunyai rambut yang pendek.
Batang bersegi, bunga ke luar dari ketiak daun, bentuknya seperti payung
commit to user
ungu dengan panjang kira-kira 2 mm, benang sari 4, ibu tangkai bunga
(induk) keras seperti kawat, panjangnya 5-10 mm. Stipula interpetiolaris.
Stamen apipetal seakan-akan di atas tabung mahkota. Ovarium inferior dan
petala berlekatan. Buah berbentuk bulat dengan ujung pecah-pecah. Buah
panjang 1,75-2 mm, lebar 2-2,5 mm, pada permukaan luar di dekat bagian
ujung terdapat sisa kelopak berupa tonjolan kecil runcing (Backer dan Brink,
1965; Febriansah et al., 2008).
e. Kandungan dan Manfaat Rumput Mutiara
Tumbuhan rumput mutiara mempunyai kandungan kimia antara lain
hentriacontane, stigmasterol, ursolic acid, oleanolic acid, β-sitosterol,
sitisterol-D-glucoside, p-coumaric acid, flavonoid glycosides dan
baihuasheshecaosu (CBN Portal, 2007; IPTEKnet, 2005). Asyhar et al.
(2008) telah meneliti dalam ekstrak etanolik rumput mutiara (Hedyotis corymbosa) terdapat kandungan senyawa ursolic acid dan oleanolic acid.
Hsu et al. (1998) meneliti tiga senyawa dari rumput mutiara yaitu
ursolic acid, oleanic acid, dan geniposidic acid. Hasilnya, ursolic acid dan
commit to user
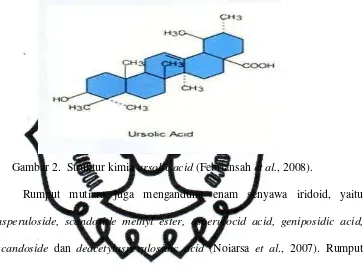
Ursolic acid termasuk dalam golongan senyawa triterpenoid pentasiklik yang secara alami dapat ditemukan pada sebagian besar tanaman herba dan
tanaman berbuah. Struktur kimia ursolic acid dapat dilihat pada Gambar 2.
Gambar 2. Struktur kimia ursolic acid (Febriansah et al., 2008).
Rumput mutiara juga mengandung enam senyawa iridoid, yaitu
asperuloside, scandoside methyl ester, asperulocid acid, geniposidic acid, scandoside dan deacetylasperulosidic acid (Noiarsa et al., 2007). Rumput mutiara telah lama digunakan dalam pengobatan berbagai penyakit,
diantaranya tonsilis, bronkitis, gondongan, pneumonia, radang usus buntu,
hepatitis, radang panggul, infeksi saluran kemih, bisul, borok, kanker limpa,
kanker lambung, kanker serviks, kanker payudara, rektum, fibrosarcoma dan kanker nasopharynx (IPTEKnet, 2005; Febriansah et al., 2008). Penelitian Lin
commit to user
2. Kanker
Kanker adalah segolongan penyakit yang ditandai dengan pembelahan sel
yang tidak terkendali dan kemampuan sel-sel tersebut untuk menyerang jaringan
biologis lainnya, baik dengan pertumbuhan langsung di jaringan yang
bersebelahan (invasi) maupun dengan migrasi sel ke tempat yang jauh (Eka,
2007). Sel kanker timbul dari sel tubuh yang normal, tetapi mengalami
transformasi atau perubahan menjadi ganas oleh bahan-bahan yang bersifat
karsinogen (agen penyebab kanker) ataupun karena mutasi spontan. Transformasi
sejumlah gen menjadi gen mutan disebut neoplasma atau tumor. Neoplasma
merupakan jaringan abnormal yang terbentuk akibat aktivitas proliferasi yang
tidak terkontrol (neoplasia). Sel neoplasma mengalami perubahan morfologi,
fungsi, dan siklus pertumbuhan, yang pada akhirnya menimbulkan disintegrasi
dan hilangnya komunikasi antar sel (Lodish et al., 2004).
Sel kanker memiliki perbedaan yang sangat signifikan dengan sel normal
dalam tubuh. Sifat umum dari kanker ialah sebagai berikut :
1. Sel kanker tidak mengenal program kematian sel yang dikenal dengan nama
apoptosis. Protein p53 mampu mencegah replikasi dari DNA yang rusak pada sel normal dan mendorong penghancuran sendiri dari sel yang mengandung
DNA yang tidak normal. Peristiwa ini disebut apoptosis. Apoptosis sangat
dibutuhkan untuk mengatur berapa jumlah sel yang dibutuhkan dalam tubuh,
commit to user
Bila telah melewati masa hidupnya, sel-sel normal (nonkanker) akan mati
dengan sendirinya tanpa ada efek peradangan (inflamasi), namun sel kanker
berbeda dengan karakteristik tersebut. Sel kanker akan terus hidup meski
seharusnya mati (immortal). Mutasi dari gen p53 menyebabkan proliferasi dan transformasi sel menjadi kehilangan kendali (Hanahan dan Weinberg, 2000;
Sofyan, 2000).
2. Sel kanker tidak mengenal komunikasi ekstraseluler atau asosial. Komunikasi
ekstraseluler diperlukan untuk menjalin koordinasi antar sel sehingga mereka
dapat saling menunjang fungsi masing-masing. Berdasarkan sifatnya yang
asosial, sel kanker bertindak semaunya sendiri tanpa mempedulikan
kebutuhan lingkungannya. Sel kanker dapat memproduksi growth factor
sendiri sehingga tidak bergantung pada rangsangan sinyal pertumbuhan dari
luar untuk melakukan proliferasi. Sel kanker dapat tumbuh menjadi tidak
terkendali (Hanahan dan Weinberg, 2000).
3. Sel kanker mampu menyerang jaringan lain (invasif), merusak jaringan
tersebut dan tumbuh subur di atas jaringan lain membentuk anak sebar
(metastasis). Semakin besar jangkauan metastasis tumor, kanker semakin sulit
untuk disembuhkan. Kanker pada stadium metastasis merupakan penyebab
90% kematian penderita kanker (Hanahan dan Weinberg, 2000).
4. Sel kanker mampu membentuk pembuluh darah baru (neoangiogenesis) untuk
commit to user
mengganggu kestabilan jaringan tempat ia tumbuh (Hanahan dan Weinberg,
2000).
5. Sel kanker memiliki kemampuan yang tidak terbatas dalam memperbanyak
dirinya sendiri (proliferasi), meski seharusnya ia sudah tidak dibutuhkan dan
jumlahnya sudah melebihi kebutuhan yang seharusnya. Berdasarkan
kemampuannya untuk memenuhi kebutuhan sinyal pertumbuhan dan
kemampuan menghindar dari mekanisme apoptosis, sel kanker memiliki
kemampuan tidak terbatas untuk bereplikasi (Hanahan dan Weinberg, 2000).
Sel-sel yang mengalami kerusakan genetik tidak peka lagi terhadap
mekanisme regulasi siklus sel normal sehingga akan terus melakukan
proliferasi tanpa kontrol. Mutasi yang terjadi pada DNA di dalam gen yang
meregulasi siklus sel (pertumbuhan, kematian dan pemeliharaan sel) akan
menyebabkan penyimpangan siklus sel dan salah satu akibatnya adalah
pembentukan kanker atau karsinogenesis (McKelvey dan Evans, 2003;
Gondhowiarjo, 2004).
Serangkaian proses berkembangnya kanker disebut karsinogenesis.
Karsinogenesis adalah suatu proses terjadinya kanker melalui mekanisme multi
tahap yang menunjukkan perubahan genetik dan menyebabkan transformasi
progresif sel normal menjadi sel malignan (ganas) (Hanahan dan Weinberg,
2000). Perubahan basa DNA (mutasi) merupakan perubahan selular mendasar
commit to user
namun dibutuhkan akumulasi dari beberapa mutasi (3 sampai 20 mutasi) dalam
karsinogenesis (Lodish et al., 2000).
Karsinogenesis melibatkan inisiasi, promosi, progresi, dan metastasis. Inisiasi
merupakan perubahan spesifik pada DNA sel target yang menuntun pada
proliferasi abnormal sebuah sel. Sel yang mengalami inisiasi atau prakanker dapat
kembali ke tingkat normal secara spontan, tetapi pada tingkat lebih lanjut menjadi
ganas. Promosi merupakan tingkat lanjutan dari tahap inisiasi. Sel-sel akan
memperoleh beberapa keuntungan untuk tumbuh sehingga pertumbuhannya
menjadi cepat dan berubah menjadi bentuk tumor jinak. Tahap promosi
berlangsung lama, bisa lebih dari sepuluh tahun. Pada tahap perkembangan
(progression), terjadi instabilitas genetik yang menyebabkan
perubahan-perubahan mutagenik. Proses ini akan menghasilkan klon baru sel-sel tumor yang
memiliki aktivitas proliferasi, bersifat invasif (menyerang) dan potensi
metastatiknya meningkat. Metastasis melibatkan beberapa tahap yang berbeda,
termasuk memisahnya sel kanker dari tumor primer, masuk ke dalam sirkulasi,
serta perlekatan pada permukaan jaringan baru (David danShivdasani, 2001).
3. Kanker Serviks
Kanker leher rahim atau disebut juga kanker serviks adalah sejenis kanker
yang menurut data merupakan penyebab kematian nomor 1 pada wanita. Kanker
commit to user
reproduksi wanita yang merupakan pintu masuk ke arah rahim, terletak di antara
rahim dengan liang vagina (Candrakirana et al.,1990).
Kanker serviks umumnya 90% berasal dari sel skuamosa yang melapisi
serviks dan 10% sisanya berasal dari sel kelenjar penghasil lendir pada saluran
servikal yang menuju ke dalam rahim (Gambar 3) (Candrakirana et al.,1990). Salah satu penyebab kanker serviks adalah HPV (Human Papilloma Virus). Virus ini menjangkit perempuan jika pasangannya mengidap virus tersebut. Perempuan
perokok pun sangat rentan terhadap kanker serviks karena nikotin mempengaruhi
selaput lendir (Sanif, 2007).
Gambar 3. Organ reproduksi wanita
Kanker serviks juga dapat dideteksi dengan pendarahan vagina, tetapi
gejala kanker ini tidak terlihat sampai kanker memasuki stadium yang lebih jauh.
HPV 16 dan 18 merupakan penyebab utama pada 70% kasus kanker serviks di
commit to user
waktu yang cukup lama, yaitu sekitar 10 hingga 20 tahun. Namun proses
penginfeksian ini seringkali tidak disadari oleh para penderita, karena proses HPV
kemudian menjadi pra kanker sebagian besar berlangsung tanpa gejala
(Nuryastuti et al., 2002).
4. Human Papilloma Virus (HPV)
Human Papiloma Virus (HPV) adalah suatu virus yang terdiri lebih dari 80 tipe dan terbagi atas dua, yaitu virus berisiko tinggi yang terdiri dari 12 tipe dan
virus berisiko rendah (Lagrange et al., 2005). Perbedaan potensi berbagai tipe HPV terhadap karsinogenesis tergantung afinitas protein E6 dalam mengikat gen
p53 dan protein E7 dalam mengikat gen Rb, yang mempunyai arti penting dalam karsinogenesis kanker serviks (Prayitno et al., 2005).
Ada 2 tipe pengelompokan HPV yaitu tipe yang berisiko rendah terdiri dari
HPV tipe 6,11, 42, 43, dan 44. Tipe yang kedua yaitu HPV berisiko tinggi terdiri
dari tipe 16, 18, 31, 33, 35, 39, 45, 51, 52, 58, 59 dan 68, HPV tipe beresiko
tinggi dapat menyebabkan kanker serviks. HPV tipe 16dan 18dianggap paling
berpotensi sebagai penyebab kanker serviks (Hollema, 1998).
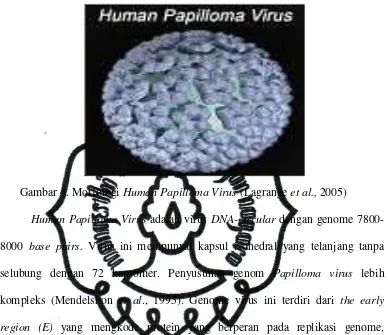
HPV berdiameter sekitar 55 nm dan mengandung genom yang cukup besar
(BM 5 x 106 berbanding 3 x 106). HPV berbentuk bulat seperti terlihat pada
commit to user
Gambar 4. Morfologi Human Papilloma Virus (Lagrange et al., 2005)
Human Papilloma Virus adalah virus DNA-circular dengan genome 7800-8000 base pairs. Virus ini mempunyai kapsul isohedral yang telanjang tanpa selubung dengan 72 kapsomer. Penyusunan genom Papilloma virus lebih kompleks (Mendelshon et al., 1995). Genome virus ini terdiri dari the early region (E) yang mengkode protein yang berperan pada replikasi genome, mengontrol transkripsi dan replikasi serta transformasi sel. The late region (L)
berisi L-genes yang mengkode protein capsid. Protein E6 (onco-protein) high-risk
HPV (tipe 16 dan 18) mempunyai peran dalam proliferasi sel yang dihubungkan
commit to user
pertumbuhan sel, karena tidak terjadinya hambatan aktivasi sel (Mendelshon et al. 1995; Prayitno et al., 2005).
5. Sel HeLa
Sel HeLa merupakan continuous cell line yang tumbuh sebagai sel yang semi melekat. Sel HeLa diturunkan dari sel epitel kanker leher rahim (serviks)
manusia. Sel ini diisolasi tahun 1951 dari seorang wanita penderita kanker leher
rahim bernama Henrietta Lacks, berusia 30 tahun (Syaifuddin, 2007).
Sel HeLa ini cukup aman dan merupakan sel manusia yang umum
digunakan untuk kepentingan kultur sel (LabWork Study Guideand Lecture
Notes, 2000). HeLa bersifat immortal yang tidak dapat mati karena tua dan dapat
membelah secara tidak terbatas selama memenuhi kondisi dasar bagi sel untuk
tetap hidup masih ada. Strain-strain baru dari sel HeLa telah dikembangkan dalam
berbagai macam kultur sel, tapi semua sel HeLa berasal dari keturunan yang
sama. Sel HeLa telah mengalami transformasi akibat infeksi HPV 18 dan berbeda
dengan sel serviks yang normal (Parhardian et al., 2004).
Sel HeLa dapat tumbuh dengan agresif dalam media kultur. Media yang
digunakan adalah media RPMI 1640. Medium RPMI 1640 mengandung nutrisi
yang cukup untuk pertumbuhan, yaitu asam amino, vitamin, garam-garam
anorganik, dan glukosa. Serum yang ditambahkan mengandung hormon-hormon
commit to user
transport, lipid diperlukan untuk pertumbuhan sel, dan mineral berfungsi sebagai
kofaktor enzim (Freshney, 1986).
6. Sel SiHa
Sel SiHa adalah sel kanker serviks akibat infeksi Human Papilloma Virus
(HPV) sehingga mempunyai sifat berbeda dengan sel leher rahim normal. SiHa
cell line mengandung genom HPV 16 (Nuryastuti et al., 2002). HPV 16 merupakan DNA virus yang berukuran kecil dengan untai ganda (Lee et al., 2003).
Sel kanker serviks yang diinfeksi HPV diketahui mengeekspresikan 2
onkogen (gen pemicu tumor), yaitu E6 dan E7. Protein E6 dan E7 terbukti dapat menyebabkan sifat immortal pada kultur primer keratinosit manusia, namun sel
yang imortal ini tidak bersifat tumorigenik hingga suatu proses genetik terjadi.
Jadi, viral onkogen tersebut tidak secara langsung menginduksi pembentukan
tumor, tetapi menginduksi serangkaian proses yang pada akhirnya dapat
menyebabkan sifat kanker (Goodwin dan DiMaio, 2000).
7. Sitotoksik
Sitotoksik adalah sifat toksis atau beracun yang dimiliki oleh suatu
senyawa tertentu terhadap sel hidup. Uji sitotoksik adalah suatu uji secara in vitro
dilakukan menggunakan kultur sel dalam mengevaluasi keamanan suatu obat,
makanan, kosmetika, maupun bahan-bahan kimia lainnya. Pengujiaan ini selain
commit to user
obat-obat terapeutik dan mengamati toksisitas baik akut maupun kronik
(Freshney, 1986).
Dua metode umum yang digunakan untuk uji sitotoksik adalah metode
perhitungan langsung (direct counting) dengan menggunakan biru tripan (trypan blue) dan metode MTT assay. Uji MTT assay merupakan salah satu metode yang digunakan dalam uji sitotoksik (Doyle dan Griffith, 2000).
Studi untuk mempelajari proliferasi, viabilitas, dan mortalitas sel dalam
rangka pencarian senyawa antitumor membutuhkan keakuratan kuantifikasi
jumlah sel hidup dalam kultur. Uji MTT
[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide] merupakan uji yang sensitif, kuantitatif, dan
terpercaya. Metode ini merupakan metode kolorimetrik, dimana pereaksi MTT ini
merupakan garam tetrazolium yang dapat dipecah menjadi kristal formazan oleh
sistem suksinat tetrazolium reduktase yang terdapat dalam jalur respirasi sel pada
mitokondria yang aktif pada sel yang masih hidup. Kristal formazan ini memberi
warna ungu yang dapat dibaca absorbansinya dengan menggunakan ELISA
reader (Doyle dan Griffith, 2000).
Uji sitotoksik digunakan untuk menentukan parameter nilai IC50-24 jam. Nilai
IC50-24 jam menunjukkan nilai konsentrasi yang menghasilkan hambatan proliferasi
sel sebesar 50% dan menunjukkan potensi ketoksikan suatu senyawa terhadap sel.
Nilai ini merupakan patokan untuk melakukan uji pengamatan kinetika proliferasi
commit to user
senyawa sebagai sitotoksik. Sifat sitotoksik memiliki tiga tingkatan, yaitu sangat
aktif bila nilai IC50-24 jam <10 µM, aktif dengan nilai IC50-24 jam 10-20 µM, dan nilai
IC50-24 jam >20 µM dinyatakan tidak aktif (Ito et al., 2003).
Menurut Kamuhabwa et al. (2000), ekstrak uji dengan nilai IC50-24 jam <100 µg/ml tetap dikatakan memiliki potensi antiproliferasi meskipun nilainya kecil.
Nilai IC50-24 jam di bawah 100 µg/mL menunjukkan adanya potensi ekstrak uji
sebagai agen kemoprevensi(Meiyanto et al., 2003). Semakin besar harga IC50-24
jam maka senyawa tersebut semakin tidak toksik. Semakin banyak sel yang hidup,
semakin banyak kristal formazan yang terbentuk, semakin tinggi nilai absorbansi
yang diperoleh dan mengindikasikan mortalitas yang rendah. Akhir dari uji
sitotoksik dapat memberikan informasi persentase (%) sel yang mampu bertahan
hidup, sedangkan pada organ target memberikan informasi langsung tentang
perubahan yang terjadi pada fungsi sel secara spesifik (Doyle dan Griffths, 2000).
8. Siklus sel
Siklus sel adalah proses duplikasi secara akurat untuk menghasilkan jumlah
DNA kromosom yang cukup banyak dan untuk menghasilkan dua sel anakan
yang identik secara genetik. Proses ini berlangsung terus-menerus dan berulang
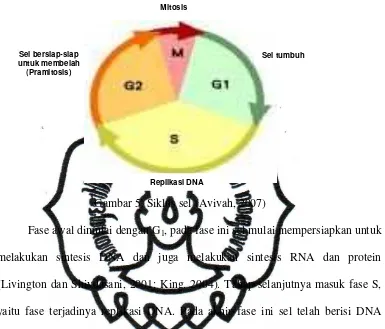
(siklik). Siklus sel secara normal terbagi dalam empat fase, yaitu G1, S, G2, M
commit to user
Gambar 5. Siklus sel (Avivah, 2007)
Fase awal dimulai dengan G1, pada fase ini sel mulai mempersiapkan untuk
melakukan sintesis DNA dan juga melakukan sintesis RNA dan protein
(Livington dan Shivdasani, 2001; King, 2004). Tahap selanjutnya masuk fase S,
yaitu fase terjadinya replikasi DNA. Pada akhir fase ini sel telah berisi DNA
ganda dan kromosom telah mengalami replikasi (De Vita et al., 1997, MacDonald dan Ford, 1997). Fase S berakhir, sel masuk dalam fase pramitosis (G2) dengan
ciri: sel berbentuk tetraploid, mengandung DNA dua kali lebih banyak daripada
sel fase lain, dan masih berlangsungnya sintesis RNA dan protein. Sewaktu
mitosis berlangsung (fase M) sintesis protein dan RNA berkurang secara tiba-tiba,
dan terjadi pembelahan menjadi 2 sel. Tahap selanjutnya sel memasuki fase
istirahat (G0). Sel dalam fase G0 yang masih potensial untuk berproliferasi disebut
sel induk (stem cell) (De Vita et al., 1997).
Sel tumbuh Sel bersiap-siap
untuk membelah (Pramitosis)
commit to user
Perubahan dari satu fase ke fase berikutnya pada siklus sel diatur beberapa
checkpoint. Kontrol checkpoint berfungsi untuk memastikan bahwa kromosom utuh dan tahap-tahap kritis siklus sel telah sempurna sebelum memasuki tahap
selanjutnya (Livingston danShivdasani, 2001).
Pada kanker terjadi perubahan pengaturan siklus sel. Selama
perkembangan sel kanker biasanya mempengaruhi ekspresi protein-protein
pengatur siklus sel. Pada sel kanker juga terjadi ketidakmampuan kontrol
checkpoint, mengakibatkan respon menyimpang terhadap adanya kerusakan seluler. Ketidakmampuan kontrol checkpoint menyebabkan inisiasi fase S atau mitosis tetap berlangsung meskipun ada kerusakan seluler dan ketidakstabilan
genetik yang selanjutnya menimbulkan clone maligna (De Vita et al., 1997, Mac Donald dan Ford, 1997).
9. Apoptosis
Apoptosis merupakan program bunuh diri dari sebuah sel. Program ini
memiliki peran penting untuk menjaga homeostasis perkembangbiakan sel.
Apoptosis merupakan suatu proses aktif yakni kematian sel melalui digesti
enzimatik oleh dirinya sendiri dan mekanisme yang efisien untuk mengeliminasi
sel yang tidak diperlukan dan mungkin berbahaya bagi tubuh sehingga dapat
menyelamatkan organisme (William, 1991). Pada sel-sel kanker program
apoptosis ini telah mengalami gangguan sehingga sel akan mengalami metastasis
commit to user
Secara fisiologis, apoptosis berlangsung melalui 2 jalur utama yakni jalur
ekstrinsik atau jalur DR (Death Reseptor), dan jalur intrinsik atau jalur mitokondria. Pada jalur ekstrinsik, apoptosis dimulai setelah DR pada membran
plasma berikatan dengan protein Fas, suatu glycocylated cell-surface protein dengan berat molekul 42-52 kDa atau dengan TNF-α yang diproduksi oleh
limfosit T atau makrofag yang mengalami sensitisasi. Reaksi ini akan
berlangsung melalui apoptotic pathway dan diikuti oleh aktivitas dari seperangkat enzim (FAAD, TRADD, kaspase 8 dan 10), untuk selanjutnya menstimulasi
efektor apoptosis. Sebagian induksi yang berasal dari TNF-α juga akan
menstimulasi mitokondria (Kromoer et al., 1997). Proses jalur ekstrinsik ini bisa dipicu oleh stimulasi dari luar sel seperti stimulasi hormonal misalnya tiroid yang
tidak bisa diimbangi oleh hormon pertumbuhan (GH) akibat defisiensi dari GH,
juga toksin, stres oksidatif dan masuknya Ca2+ ke dalam sel (Kroemer et al., 1997)
Pada jalur intrinsik, aktivasi apoptosis dapat terjadi di intraseluler, yaitu
inisiasi apoptosis muncul akibat produksi biokimia yang berasal dari stres
intraseluler seperti stres oksidatif, perubahan redoks, ikatan kovalen kimia,
peroksidasi lipid (Reed, 1997). Zat-zat tersebut memberikan signal terhadap
mitokondria sehingga menyebabkan perubahan mitokondria itu sendiri, dimulai
dengan terbukanya membran bagian luar yang diikuti pembengkakan matriks dan
protein-commit to user
protein mitokondria termasuk sitokrom c sebagai aktivator kaspase dalam hal ini
mengaktivasi kaspase 9 untuk menggerakkan efektor apoptosis (Green, 1998).
Apoptosis akan menghasilkan apoptotic bodies yang terdiri dari fragmen sisa-sisa sel, yang akan difagositosis oleh sistem retikuloendotelial di sekitarnya.
Regulasi apoptosis adalah untuk mempertahankan homeostasis normal, menjaga
keseimbangan proliferasi dan kematian sel di dalam organ multiseluler. Salah satu
fungsi apoptosis adalah mencegah kanker dengan cara mengeliminasi sel-sel
kanker. Pada hampir semua proses kematian sel, signal cascade terjadi melalui bantuan senyawa oksigen reaktif sebagai molekul pembawa isyarat (messenger) (Kroemer et al., 1997).
Apoptosis dapat dibagi dalam 3 tahap yaitu :
a. Tahap inisiasi
Selama fase inisiasi yang heterogen, sel menerima stimulus yang
menginduksi kematian, kehilangan faktor -faktor yang menunjang ketahanan
hidup, kekurangan suplai untuk metabolisme dan terjadi pengikatan reseptor
yang meneruskan sinyal kematian, misalnya pengikatan Fas/FasL,
TNF/TNFR dan lain-lain. Reaksi kimia yang berperan dalam fase inisiasi ini
sangat heterogen bergantung pada seberapa lethal stimulus yang diterima. Tahap inisiasi tergantung pada deathinducing signal untuk mengaktifkan
commit to user
b. Tahap efektor
Pada tahap ini, proses inisiasi dilanjutkan dengan reaksi metabolik
dengan pola yang lebih teratur, dan sel mengambil keputusan atau komitmen
untuk “bunuh diri”.
c. Tahap degradasi
Pada fase degradasi atau fase eksekusi, terjadi peningkatan berbagai
aktivitas, termasuk peningkatan aktivasi enzim-enzim katabolik dan produksi
reactive oxygen species (ROS). Pada fase ini perubahan morfologi dan biokimiawi sel, di antaranya fragmentasi DNA, serta degradasi berbagai jenis
protein (Reed, 1997).
Bila sel kehilangan kemampuan untuk melakukan apoptosis (misalnya
karena mutasi), atau bila inisiatif untuk melakukan apoptosis dihambat (oleh virus),
sel yang rusak dapat terus membelah tanpa batas, yang akhirnya menjadi kanker.
Sebagai contoh, salah satu hal yang dilakukan oleh virus papilloma manusia (HPV)
saat melakukan pembajakan sistem genetik sel adalah menggunakan gen onkogen
E6 yang mendegradasi protein p53. Padahal protein p53 berperan sangat penting pada mekanisme apoptosis. Oleh karena itu, infeksi HPV dapat berakibat pada
commit to user
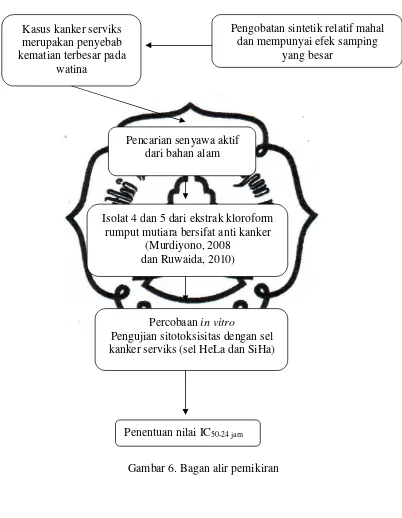
B. Kerangka Pemikiran
Kanker serviks merupakan penyebab kematian terbesar di kalangan wanita.
Usaha penyembuhan dengan obat sintetik umumnya masih relatif mahal dan memiliki
efek samping yang besar. Hal ini menyebabkan orang memilih alternatif untuk
memanfaatkan bahan alam yaitu dengan menggunakan tanaman obat. Salah satu
tumbuhan yang berpotensi untuk komoditas obat ini adalah rumput mutiara (Hedyotis corymbosa (L.) Lamk.).
Murdiyono (2008) telah meneliti fraksi 6 ekstrak kloroform rumput mutiara
dan hasilnya diperoleh LC50-24 jam adalah 281,77 µg/ml. Menurut Meyer et al., (1982), senyawa uji dikatakan toksik jika harga LC50-24 jam lebih kecil dari 1000 µg/ml. Hal ini
menunjukkan bahwa ekstrak kloroform rumput mutiarabersifat toksik dan berpotensi
anti kanker. Penelitian Ruwaida (2010) mengisolasi fraksi aktif dalam ekstrak
kloroform dan diperoleh isolat 4 dan 5 sebanyak senyawa aktif berdasarkan metode
Brine Shrimp Lethality Test (BST) dengan LC50-24 jam masing-masing 55,87 µg/ml dan 47,76 µg/ml, sehingga perlu dilakukan penelitian lebih lanjut potensi rumput mutiara
sebagai anti kanker.
Febriansah et al. (2008) menyebutkan bahwa rumput mutiaratelah digunakan untuk mengobati berbagai macam penyakit salah satu diantaranya adalah kanker
serviks. Penelitian ini bertujuan untuk mengetahui berapa nilai IC50-24 jam isolat 4 dan
commit to user
Uji eksperimental secara in vitro dengan menggunakan human cell line
memiliki keuntungan yaitu memiliki homogenitas sel yang cukup tinggi serta tidak
dijumpai variasi individual. Dalam penelitian ini menggunakan sel kanker serviks (sel
HeLa dan SiHa), kemudian sel kanker akan dikulturkan dalam medium RPMI 1640.
Kemampuan isolat 4 dan 5 dari ekstrak kloroform rumput mutiara dapat diketahui
dengan melakukan pengujian sitotoksisitas untuk mengetahui nilai IC50-24 jam. Nilai
IC50-24 jam di bawah 100 µg/mL menunjukkan adanya potensi ekstrak uji sebagai agen
kemoprevensi(Meiyanto et al., 2008). Semakin kecil nilai IC50-24 jam berarti senyawa uji semakin toksik dan sebaliknya. Bagan pemikiran di atas disajikan dalam Gambar
commit to user
Gambar 6. Bagan alir pemikiran
Pengobatan sintetik relatif mahal dan mempunyai efek samping
yang besar Kasus kanker serviks
merupakan penyebab kematian terbesar pada
watina
Isolat 4 dan 5 dari ekstrak kloroform rumput mutiara bersifat anti kanker
(Murdiyono, 2008 dan Ruwaida, 2010)
Percobaan in vitro
Pengujian sitotoksisitas dengan sel kanker serviks (sel HeLa dan SiHa)
Penentuan nilai IC50-24 jam Pencarian senyawa aktif
commit to user C. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Isolat 4 dan 5 dari ekstrak kloroform rumput mutiara diduga bersifat
sitotoksik sehingga mempunyai nilai IC50-24 jam <100 µg/ ml.
2. Peningkatan konsentrasi isolat aktif dari ekstrak kloroform rumput mutiara
commit to user BAB III
METODE PENELITIAN
A. Waktu Dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Januari-Juli 2010, di LPPT (Laboratorium
Penelitian dan Pengujian Terpadu) Universitas Gadjah Mada, Yogyakarta.
B. Bahan Dan Alat
1. Bahan
Isolat 4 dan 5 rumput mutiara, Cell line HeLa (HPV 18) dan SiHa (HPV
16). Bahan lain adalah MTT {3-(4,5- dimethylthiazol- 2yl) 2,5
diphenyltetrazoliumbromide} (Sigma), Fetal Bovine Serum (FBS) (Sigma), medium Roswell Park Memorial Institute (RPMI) 1640 (Sigma), Fungison, Streptomisin (Sigma)/ Penisilin (Gibco BRL), SDS (Stop Solution), DMSO,
hepes dan tripsin (Sigma Chem. CO. St. Louis. USA).
2. Alat
Microplate 96 sumuran (Nunclone), sentrifuge Sigma 3K12 (B. Braun Biotech International), blue tip dan yellow tip, incubator CO2 Jacketed Incubator
(NuaireTM IR autoflow), ELISA reader, hemocytometer (New Bauer), tabung
conical steril (nunclone), scarper, tissue culture flask (nunclone), laminar airflow
commit to user
(Olympus, Jepang), mikropipet (Soccorex), vorteks (Genie), Timbangan elektrik
(Sartorius).
C. Cara Kerja
a. Pembuatan sampel uji
1. Larutan uji dibuat dengan melarutkan masing-masing isolat 4 dan 5 pada
media RPMI 1640.
2. Larutan induk dibuat serangkaian seri kadar yang dibutuhkan dengan
pengenceran menggunakan media RPMI 1640.
3. Seri kadar yang digunakan untuk uji sitotoksisitas adalah: (200, 100, 50,
25, 6.25, 3.125 1.5625, 0.78125, 0.390625 dan 0.1953125 ml), kontrol
positif doksorubisin, kontrol sel dan kontrol medium.
b. Preparasi sel Hela dan SiHa
1. Sel Hela dan SiHa ditumbuhkan hingga konfluen.
2. Media RPMI 1640 yang digunakan untuk menumbuhkan sel dibuang.
3. Kultur sel dipindahkan ke dalam conical tube berisi 20 ml media RPMI 1640 kemudian disentrifuge 2000 rpm selama 10 menit. Supernatan
dibuang kemudian diresuspensi dengan 10 ml media RPMI 1640.
4. Kerapatan sel dihitung dengan mengambil suspensi sel sebanyak 20 µl
commit to user
kali. Jumlah sel total yang diperoleh dibagi 4 dan dikalikan dengan faktor
pengenceran dan konstanta 104/ml.
c. Uji sitotoksisitas
1. Sebanyak 100 µl medium RPMI 1640 yang mengandung suspensi sel
dengan kerapatan sekitar 2 × 104 sel/ml dimasukkan ke dalam 93 sumuran
Microplate 96 sumuran.
2. Isolat 4 dan 5 diberikan 100 µl pada peringkat konsentrasi yang berbeda
secara triplet, dengan menggunakan mikropipet kemudian masing-masing
konsentrasi isolat sampel uji yang telah disiapkan dalam eppendorf steril dipindahkan ke dalam sumuran.
3. Hal yang sama juga dilakukan pada kontrol positif doksorubisin dan
kontrol sel dalam media RPMI 1640, masing-masing dipindahkan ke
dalam sumuran.
4. Plate diinkubasi selama 24 jam dalam inkubator CO2 37°C dengan kadar CO2 5%.
5. Penambahan MTT 5 mg/ml pada akhir inkubasi sebanyak 100 µl setiap
sumuran.
6. Plate diinkubasi lagi selama 4 jam pada 37oC, CO2 5%.
commit to user
8. Plate diinkubasi semalam pada 37oC, 5% CO2 kemudian diukur absorbansinya menggunakan ELISA reader pada panjang gelombang 550 nm(Meiyanto et al., 2008).
d. Cara Memperoleh Data
Data absorbansi yang diperoleh dikonversi ke dalam persen sel hidup.
Hasil pengamatan sel hidup ditampilkan dalam bentuk persentase sel hidup
dengan rumus:
% sel hidup = x100%
(Meiyanto et al., 2005) Persentase kematian diperoleh dari hasil pengurangan 100% sel-% sel hidup.
D. Analisis data
Tahap selanjutnya dilakukan analisis regresi linier dengan mengubah
commit to user BAB IV
HASIL DAN PEMBAHASAN
A. Uji Sitotoksik
Penelitian ini bertujuan untuk mengetahui efek sitotoksik isolat aktif dari
ekstrak kloroform rumput mutiara (H. corymbosa (L.) Lamk.) terhadap sel HeLa dan SiHa. Dua isolat aktif rumput mutiara, yaitu isolat 4 dan isolat 5, diuji secara lanjut
berdasarkan sitotoksiknya terhadap sel HeLa dan SiHa. Hal ini bertujuan untuk
mengetahui efek sitotoksik masing-masing isolat terhadap sel HeLa dan SiHa
sehingga dapat ditentukan besarnya nilai IC50-24 jam dari masing-masing isolat.
Pada penelitian ini menggunakan metode MTT karena relatif cepat, sensitif,
akurat, dan dapat digunakan untuk mengukur sampel dalam jumlah besar. Namun,
pada penggunaan metode MTT ini senyawa uji yang digunakan tidak boleh senyawa
yang berwarna karena akan menimbulkan bias terhadap nilai absorbansi (Doyle dan
Griffiths, 2000).
Uji sitotoksisitas dimulai dengan menumbuhkan kultur sel HeLa dan SiHa
hingga konfluen dalam medium RPMI 1640 untuk mendapatkan jumlah sel sesuai
dengan kebutuhan uji. Medium RPMI 1640 digunakan karena medium ini merupakan
jenis medium yang umum digunakan pada kultur sel (Freshney, 2000). Medium ini
terkandung nutrisi yang cukup untuk pertumbuhan, yaitu asam amino, vitamin,
hormon-commit to user
hormon yang mampu memacu pertumbuhan sel. Albumin berfungsi sebagai protein
transport, lipid diperlukan dalam pertumbuhan sel, dan mineral berfungsi sebagai
kofaktor enzim.
A.1. Sel HeLa
Sebelum diberi perlakuan, dilakukan persiapan terhadap kultur sel. Sel HeLa
ditumbuhkan hingga konfluen dalam medium RPMI. Jumlah sel yang telah konfluen
terlihat menempel rapat di dasar flask (Gambar 7.a). Morfologi sel HeLa akan terlihat berbentuk lonjong seperti daun. Jumlah sel yang telah konfluen selanjutnya dilakukan
pemanenan sel untuk selanjutnya digunakan dalam uji sitotoksik. Media kultur sel
dibuang untuk memudahkan pemanenan dan perhitungan sel, kemudian ditambahkan
dengan 100 µl tripsin agar sel lepas dari dasar flask. Sel yang lepas dari dasar sel dan sel yang hidup akan berbentuk bulat–bulat serta terlihat mengapung di permukaan
(Gambar 7.b).
Gambar 7. Kenampakan morfologi sel HeLa pada perbesaran 100x sebelum pemberian tripsin (a) dan setelah pemberian tripsin (b).
[image:34.595.110.515.225.687.2]commit to user
Sel sebelum pemberian tripsin terlebih dahulu dilakukan pencucian dengan
PBS yang berfungsi untuk menghilangkan serum dalam media RPMI 1640 yang
tertinggal, karena serum ini dapat menghambat kerja tripsin (Freshney, 2000).
Pemberian tripsin berfungsi sebagai enzim protease yang melepaskan interaksi antara
molekul glikoprotein dan proteoglikan dengan permukaan flask, akibatnya sel akan kehilangan kemampuannya untuk melekat pada permukaan flask dan terlihat mengapung (Doyle dan Griffith, 2000).
Sel yang telah dipanen kemudian dilakukan penambahan medium RPMI
sehingga diperoleh suspensi sel yang dapat langsung dipindahkan kedalam
microplate. Variasi konsentrasi yang digunakan pada isolat 4 dan 5 adalah 200; 100; 50; 25; 12,5; 6,25; 3,125; 1,525; 0,78125; dan 0,390625 µg/ml. Doxorubicin
digunakan sebagai kontrol positif dengan variasi konsentrasi mulai dari 10; 5; 2,5;
1,25; 0,625; 0,3125; 0,15625; 0,078125; 0,0390625; dan 0,1953125 µg/ml. Selain itu
digunakan pula kontrol negatif berupa kontrol sel dan kontrol medium RPMI 1640.
Medium yang berisi sel didistribusikan dalam 96 sumuran masing-masing
100µl, kemudian ditambahkan variasi konsentrasi isolat 4 dan 5 sebanyak 100µl
secara triplet. Tahap berikutnya, microplate yang berisi sel dan sampel uji diinkubasi selama 24 jam dan dilakukan pengamatan selanjutnya.
Pengamatan morfologi sel setelah perlakuan dilakukan di bawah mikroskop.
commit to user
sedikit bila dibandingkan dengan jumlah sel yang mati pada perlakuan isolat 5. Hal
ini terlihat pada Gambar (8.a) sel yang hidup dan berbentuk bulat jernih masih
tampak terlihat lebih banyak. Sel kontrol negatif tampak berbentuk seperti daun,
menempel di dasar flask, sedangkan pada kontrol positif, doxorubisin, terlihat banyak sel yang mati dan berwarna keruh. Gambar lengkap pada tiap perlakuan dapat dilihat
pada Lampiran 1.
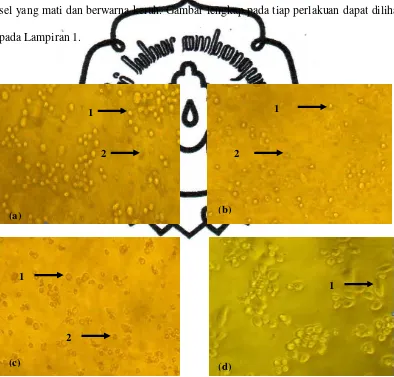
Gambar 8. Kenampakan morfologi sel HeLa pada perbesaran 100x setelah penambahan isolat rumput mutiara pada perlakuan (a) Isolat 4 konsentrasi 200 µg/ml, (b) Isolat 5 konsentrasi 200 µg/ml, (c) doxorubixin konsentrasi 10 µg/ml, (d) kontrol sel.
Keterangan: (1) sel hidup, (2) sel mati
2 1
(d) (c)
(a) (b)
1
2 1
1
[image:36.595.112.506.251.628.2]commit to user
Berdasarkan Gambar 8 terlihat bahwa isolat 5 mampu menghambat
pertumbuhan sel HeLa lebih besar bila dibandingkan dengan isolat 4. Hal ini juga
terlihat pada jumlah persentase kematian sel, pada isolat 5 konsentrasi 200 µg/ml
mampu menyebabkan kematian sel sebesar 84.946%, sedangkan isolat 4 pada
konsentrasi yang sama hanya mampu menyebabkan kematian sel sebesar 14.874%.
[image:37.595.112.513.247.704.2]Persentase kematian sel untuk setiap perlakuan secara lengkap dapat dilihat pada
Tabel 1, sedangkan data absorbansi secara lengkap dapat dilihat pada Lampiran 2.
Tabel 1. Persentase kematian sel HeLa setelah perlakuan dengan isolat 4 dan 5
Konsentrasi (µg/ml) Rata-rata absorbansi % Kematian sel Isolat 4
200 1.627 14.874
100 1.642 13.978
50 1.642 13.978
25 1.666 12.545
12.5 1.677 11.888
6.25 1.683 11.529
3.125 1.687 11.290
1.5625 1.794 4.898
0.78125 1.851 1.493
0.390625 2.036 -9.558
Isolat 5
200 0.454 84.946
100 0.812 63.560
50 1.574 18.041
25 1.576 17.921
12.5 1.64 14.098
6.25 1.645 13.799
3.125 1.655 13.202
1.5625 1.658 13.023
0.78125 1.717 9.498
0.390625 1.779 5.794
Kontrol sel 1.876
commit to user
Berdasarkan hasil pada Tabel 1, isolat 4 pada konsentrasi tertinggi (200
µg/ml) belum menunjukkan kematian 50%, hanya sebesar 14.874%. Oleh karena itu
konsentrasi isolat 4 perlu dinaikkan hingga diperoleh kematian 50% untuk
menentukan nilai IC50-24 jam. Konsentrasi isolat 4 dinaikkan diatas 200 µg/ml hingga
1000 µg/ml. Data selengkapnya tersaji pada Tabel 2, sedangkan nilai absorbansi
[image:38.595.111.511.251.519.2]secara lengkap dapat dilihat pada Lampiran 3.
Tabel 2. Persentase kematian sel HeLa setelah perlakuan dengan isolat 4
Konsentrasi (µg/ml) Rata-rata absorbansi % kematian sel Isolat 4
1000 1.234 39.199
500 1.493 24.158
250 1.519 22.648
125 1.585 18.815
62,5 1.58 19.106
31,25 1.595 18.235
15,625 1.565 19.977
1,9531 1.604 17.712
Kontrol sel 1,909
Kontrol media 0.187
Pada Tabel 2 terlihat bahwa hingga konsentrasi 1000 µg/ml isolat 4 hanya
mampu menyebabkan kematian sebesar 39.199%. Berdasarkan data tersebut maka
isolat 4 tidak toksik terhadap sel HeLa.Namun sebaliknya, isolat 5 pada konsentrasi
100 µg/ml mampu menyebabkan kematian sel HeLa sebesar 63.56%. Oleh karena itu
IC50-24 jam isolat 5 untuk sel HeLa <100 µg/ml.
Berdasarkan hasil pengamatan pada Tabel 1 terlihat bahwa penambahan
commit to user
sel yang hidup pada kontrol sel lebih banyak jika dibandingkan dengan jumlah sel
hidup yang ada pada masing-masing perlakuan. Hal ini sesuai dengan Gambar (8.d)
yaitu terlihat pada kontrol negatif jumlah sel yang hidup lebih banyak bila
dibandingkan dengan perlakuan penambahan isolat 4 dan 5 maupun pada
doxorubisin. Data kematian sel pada perlakuan doxorubisin dapat dilihat pada
Lampiran 5. Berdasarkan data-data tersebut maka dapat dikatakan bahwa pada
penelitian ini isolat 5 lebih toksik dibandingkan isolat 4 pada sel HeLa (Gambar 9).
Gambar 9. Kenampakan morfologi sel HeLa pada perbesaran 100x setelah penambahan isolat rumput mutiara pada perlakuan (a) IC50 isolat 4 (konsentrasi 1000 µg/ml), (b) IC50-24 jam isolat 5 (konsentrasi 100 µg/ml).
Keterangan: (1) sel hidup, (2) sel mati
Gambar (9.a) menunjukkan bahwa hingga konsentrasi 1000 µg/ml masih
terlihat banyak sel yang hidup, sedangkan pada Gambar (9.b) konsentrasi 100 µg/ml
jumlah sel yang mati lebih banyak bila dibandingkan dengan Gambar (9.a) yaitu
sebesar 63.560% (Tabel 1).
a b
1
2 1
[image:39.595.110.513.225.566.2]commit to user
Perhitungan terhadap persentase kematian sel dilakukan untuk menentukan
nilai IC50-24 jam dari masing-masing perlakuaan. IC50-24 jam merupakan konsentrasi yang
menyebabkan penghambatan pertumbuhan sel sebesar 50% dari populasi sel.
Perhitungan IC50-24 jam menggunakan analisa probit dan secara lengkap dapat dilihat
pada Lampiran 5. Hasil analisa probit ini diperoleh dengan mengubah persentase
kematian menjadi angka probit dengan menggunakan tabel probit (Lampiran 4),
[image:40.595.113.519.245.660.2]kemudian dibuat grafik persamaan regresi linier antara probit dan log konsentrasi.
Gambar 10 merupakan kurva persamaan regresi linier antara log konsentrasi dengan
probit isolat 4 terhadap sel HeLa, sedangkan kurva persamaan regresi linier isolat 5
terhadap sel HeLa dapat dilihat pada Gambar 11.
Gambar 10. Persamaan regresi linier antara log konsentrasi dengan probit isolat 4 terhadap sel HeLa.
commit to user
Gambar 11. Persamaan regresi linier antara log konsentrasi dengan probit isolat 5 terhadap sel HeLa.
Kurva persamaan regresi linier antara log konsentrasi dengan probit
doxorubisin terhadap sel HeLa tersaji pada Gambar 12.
Gambar 12. Persamaan regresi linier antara log konsentrasi dengan probit Doxorubisin terhadap sel HeLa.
y = -0.880x + 6.712 r2 = 0.869
[image:41.595.112.516.140.675.2]commit to user
Berdasarkan hasil analisa probit yang dilakukan didapatkan nilai IC50-24 jam
isolat 5 sebesar 88.10 µg/ml dan 2.03 µg/ml untuk doxorubisin, sedangkan isolat 4
tidak dilakukan perhitungan IC50-24 jam karena hingga konsentrasi 1000 µg/ml belum
menunjukkan persentase kematian 50% dan menurut Meyer et al. (1982) nilai IC50-24
jam >1000 µg/ml dinyatakan tidak toksik. Jadi semakin besar nilai IC50-24 jam maka
senyawa tersebut semakin tidak toksik. Suatu ekstrak tanaman berpotensi untuk
dikembangkan sebagai agen antikanker bila memiliki IC50-24 jam <100 µg/ml (Ueda et
al., 2002). Nilai IC50-24 jam <100 µg/ml menunjukkan adanya potensi senyawa uji sebagai agen kemoprevensi(Meiyanto et al., 2008). Berdasarkan hasil tersebut maka isolat 5 mempunyai kemampuan dalam penghambatan pertumbuhan sel HeLa dan
berpotensi sebagai agen kemoprevensi.
A. 2. Sel SiHa
Sebelum diberi perlakuan, dilakukan persiapan terhadap kultur sel. Sel SiHa
ditumbuhkan hingga konfluen dalam medium RPMI 1640. Jumlah sel yang telah
konfluen terlihat menempel rapat di dasar flask (Gambar 13.a). Jumlah sel yang telah konfluen selanjutnya dilakukan pemanenan sel, dalam memudahkan pemanenan dan
perhitungan sel, media kultur sel dibuang kemudian ditambahkan dengan 100 µl
commit to user
Gambar 13. Kenampakan morfologi sel SiHa pada perbesaran 100x sebelum pemberian tripsin (a) dan setelah pemberian tripsin (b).
Sel sebelum pemberian tripsin terlebih dahulu dilakukan pencucian dengan
PBS yang berfungsi untuk menghilangkan serum dalam media RPMI 1640 yang
tertinggal, karena serum ini dapat menghambat kerja tripsin (Freshney, 2000). Tahap
selanjutnya, sel yang telah dipanen kemudian dilakukan penambahan medium RPMI
1640 sehingga diperoleh suspensi sel yang dapat langsung dipindahkan ke dalam
microplate.
Variasi konsentrasi yang digunakan pada isolat 4 dan 5 adalah 1000; 500;
250; 125; 62,5; 31,25; 15,625; 7,8125; 3,90625; dan 1,953125 µg/ml. Doxorubicin
digunakan sebagai kontrol positif dengan variasi konsentrasi mulai dari 10; 5; 2,5;
1,25; 0,625; 0,3125; 0,15625; 0,078125; 0,0390625; dan 0,1953125 µg/ml. Kultur sel
digunakan sebagai kontrol negatif selain itu digunakan kontrol medium RPMI 1640.
Medium yang berisi sel didistribusikan dalam 96 sumuran masing-masing
100µl, kemudian ditambahkan variasi konsentrasi isolat 4 dan 5 sebanyak 100µl
[image:43.595.108.514.155.486.2]commit to user
secara triplet. Tahap berikutnya, microplate yang berisi sel dan sampel uji diinkubasi selama 24 jam dan dilakukan pengamatan selanjutnya.
Setelah dilakukan inkubasi selama 24 jam, sel kemudian diamati di bawah
mikroskop dengan perbesaran 100x maka akan terlihat adanya perubahan morfologi
sel. Seperti halnya pada sel HeLa, sel yang mati akan terlihat adanya perubahan
bentuk, sel berwarna keruh dan mengapung.
Morfologi sel SiHa setiap perlakuan secara lengkap tersaji pada Lampiran 6.
Penetapan jumlah sel yang mati dan hidup pada pengujian sitotoksisitas dapat
dilakukan dengan berbagai cara. Penetapan yang dilakukan berdasarkan pada
parameter kerusakan membran, gangguan sintesis dan degradasi makromolekul,
modifikasi kapasitas metabolisme, serta perubahan morfologi sel. Petunjuk toksisitas
berdasarkan adanya kerusakan membran meliputi perhitungan sel yang mengambil
(up take) atau tidak bahan pewarna seperti biru tripan. Perubahan morfologi dapat diketahui dengan mikroskop electron (Snell dan Mullock, 1987 dalam Rahmawati, 2004).
Berdasarkan metode MTT, sel yang hidup akan membentuk kristal formazan
seperti yang terlihat pada Gambar 14. Formazan merupakan zat berwarna ungu yang
tidak larut dalam air sehingga dilarutkan menggunakan HCl 0,04 N dalam
isopropanol atau 10% SDS. Intensitas warna ungu yang terbentuk dapat ditetapkan
commit to user
melakukan metabolisme, sehingga berkorelasi dengan viabilitas sel. Reaksi
[image:45.595.113.516.198.490.2]pembentukan kristal formazan tersaji pada Gambar 15.
Gambar 14. Kenampakan sel hidup yang membentuk kristal formazan, (1) sel hidup, (2) sel mati.
Gambar 15. Reaksi MTT menjadi formazan (Mosmann, 1983)
Reduksi MTT menjadi garam formazan terjadi jika enzim reduktase dalam
mitokondria dalam keadaan aktif. Reduksi dalam sel melibatkan reaksi enzimatik
dengan NADH atau NADPH yang dihasilkan oleh sel hidup sehingga menghasilkan
endapan yang tidak larut. Pemecahan MTT terjadi pada mitokondria sel yang hidup
oleh enzim suksinat dehidrogenase. Absorbansi yang dihasilkan sebanding dengan
konsentrasi biru formazan yang larut dalam SDS. Reduksi garam tetrazolium
merupakan cara yang dapat dipercaya untuk mendeterminasikan proliferasi sel.
Garam tetrazolium MTT yang berwarna kuning berkurang sebagai akibat dari
1
2
Mitokondria reduktase
commit to user
aktivitas metabolisme sel terutama oleh kerja enzim suksinat dehidrogenase
(Mosmann, 1983).
Konsentrasi yang diujikan pada sel SiHa dimulai dari 1000 µg/ml karena
sebelumnya telah dilakukan uji pendahuluan mulai konsentrasi 200 µg/ml untuk
isolat 4 dan 5, namun hasilnya menunjukkan persentase kematian sel belum mencapai
50%, oleh karena itu konsentrasi dinaikkan hingga memperoleh 50% kematian.
Persentase kematian pada sel SiHa dapat dilihat pada Tabel 3, sedangkan nilai
[image:46.595.115.513.248.690.2]absorbansi secara lengkap dapat dilihat pada Lampiran 7.
Tabel 3. Persentase kematian sel SiHa setelah perlakuan dengan isolat 4 dan 5
Konsentrasi (µg/ml) Rata- rata absorbansi % kematian Isolat 4
1000 1.053 31.904
500 1.123 25.467
250 1.128 24.974
125 1.134 24.451
62.5 1.181 20.078
31.25 1.275 11.423
15.625 1.300 9.085
7.8125 1.324 6.896
3.90625 1.372 2.430
1.953125 1.375 2.137
Isolat 5
1000 1.097 27.869
500 1.126 25.190
250 1.127 25.067
125 1.147 23.281
62.5 1.192 19.046
31.25 1.225 16.012
15.625 1.251 13.597
7.8125 1.305 8.651
3.90625 1.35 4.493
commit to user
Berdasarkan hasil pada Tabel 3 persentase kematian hingga konsentrasi 1000
µg/ml baik isolat 4 dan 5 belum menunjukkan 50% kematian. Padahal konsentrasi
>1000 µg/ml suatu senyawa dapat dikatakan tidak toksik, karena semakin besar nilai
IC50-24 jam maka senyawa tersebut semakin tidak toksik. Jadi dapat dikatakan bahwa
isolat 4 dan 5 tidak toksik pada sel SiHa.
Hal ini juga dapat dilihat pada Gambar 16 terlihat bahwa hingga konsentrasi
1000µg/ml masih banyak sel yang hidup.
Gambar 16. Kenampakan morfologi sel SiHa pada perbesaran 100x setelah penambahan isolat rumput mutiara pada perlakuan (a) isolat 4 (konsentrasi 1000 µg/ml), (b) isolat 5 (konsentrasi 1000 µg/ml), (c) doxorubixin konsentrasi 10 µg/ml, (d) kontrol sel.
Keterangan: (1) sel hidup, (2) sel mati
(a)
2 1
(b) 2
1
(c)
2
(d)
[image:47.595.114.508.246.621.2]commit to user
B. Mekanisme Penghambatan Isolat
Adanya perbedaan ketoksikan isolat 4 dan 5 pada sel HeLa dimungkinkan
karena adanya perbedaan kandungan dalam masing-masing senyawa tersebut.
Ruwaida (2010) melaporkan bahwa isolat 4 belum dapat diketahui golongan
senyawanya, sedangkan isolat 5 diidentifikasi merupakan senyawa golongan
terpenoid.Profil KLT terhadap kandungan isolat 4 dan 5 tersaji pada Gambar 17.
[image:48.595.112.505.228.509.2]
Gambar 17. Profil kromatogram isolat 4 dan 5 rumput mutiara dengan pereaksi deteksi semprot vanillin-asam sulfat, isolat 4 (1), isolat 5 (2).
Ruwaida (2010) melaporkan bahwa dalam isolat 5 terdapat senyawa golongan
terpenoid dengan adanya bercak warna biru pada Rf 0,81 (Gambar 17). Deteksi
dengan pereaksi semprot valinin-asam sulfat akan menunjukkan hasil positif adanya
terpenoid bila terdapat bercak berwarna antara biru sampai ungu. Namun sebaliknya
isolat 4 menunjukkan hasil yang negatif pada pereaksi tersebut. Pengujian lebih lanjut 1
Rf
0.75
0 0.25
0.5
commit to user
terhadap isolat 5 membuktikan bahwa isolat 5 bukan senyawa ursolic acid
berdasarkan metode KLT.
Adanya perbedaan kandungan senyawa tersebut juga akan mempengaruhi
ketoksikan pada sel kanker. Salah satu golongan terpenoid yaitu monoterpen,
dilaporkan mempunyai aktivitas antitumor, salah satu diantaranya yaitu limonen.
Senyawa ini mempunyai kemampuan kemoprevensi pada beberapa tipe kanker.
Mekanisme aksi dari monoterpenoid yaitu dengan cara memblok dan menekan
aktivitas tumor (Crowell, 1999). Contoh lainnya, taxol merupakan senyawa golongan
diterpen dari tanaman Taxus brevifolia yang telah digunakan secara luas untuk pengobatan kanker serviks dan kanker payudara. Mekanisme aksi antikanker taxol
yaitu dengan cara menstabilkan tubulin sehingga mencegah terjadinya pembelahan
sel (Artanti et al., 2005). Taxol diketahui mampu menghambat mitosis dengan cara menyebabkan kerusakan pada mikrotubul, karena menghalangi terbentuknya
mikrotubul sehingga akan terjadi pengeblokan pada proses mitosis (Lesney, 2004).
Hal lain yang dapat menyebabkan adanya perbedaan ketoksikan suatu
senyawa terhadap sel yaitu adanya molekut target yang berbeda pada setiap sel
kanker. Sebagai contoh yaitu fitosterol, senyawa ini merupakan steroid dalam
golongan triterpen dan mempunyai struktur yang mirip dengan kolesterol (Gambar
commit to user
[image:50.595.110.514.177.483.2](a) (b) (Awad dan Carol, 2000)
Gambar 18. Struktur senyawa (a) β-sitosterol dan (b) 3β-hidroksi kolesterol.
Bentuk fitosterol yang umum yaitu β-sitosterol, campesterol dan stigmasterol.
Adanya kemiripan struktur membran molekul target sehingga memudahkan senyawa
tersebut untuk melewati membran sel (Awad dan Fink, 2000). Adanya kemudahan
senyawa dalam melewati struktur membran ini dapat dianalogkan seperti model
gembok-kunci (lock-key), hal ini menyebabkan senyawa tersebut akan lebih mudah masuk dan mempengaruhi aktivitas yang terjadi di dalam sel. Struktur membran sel
tersaji dalam Gambar 19.
Gambar 19. Struktur membran sel (Sheeler, 1983).
Plasma membran glikoprotein
glikolipid
[image:50.595.121.534.546.698.2]commit to user
Faktor lain yang dapat menyebabkan adanya perbedaan kemampuan isolat 4
dan 5 terhadap sel HeLa dan SiHa karena adanya faktor yang berbeda yang
menyebabkan kedua sel kanker tersebut. Sel HeLa merupakan sel kanker serviks
yang disebabkan oleh HPV (Human Papilloma Virus)18 sedangkan SiHa oleh HPV 16. Perbedaan potensi berbagai tipe HPV terhadap karsinogenesis tergantung dari
afinitas protein E6 dalam mengikat gen p53 dan protein E7 dalam mengikat protein
Rb. Protein E6 dari HPV 18 dan HPV 16 akan mengakibatkan inaktivasi gen p53
melalui mekanisme pengikatan yang disebut ubiquitin-dependent proteolytic pathway
(E6AP), sehingga akan terjadi penurunan kadar gen p53. Hal ini menyebabkan gen p53 tidak dapat bekerja secara normal sehingga akan terdegradasi (Gambar 20)
[image:51.595.113.514.249.695.2](Lagrange et al., 2005).
commit to user
[image:52.595.123.501.249.498.2]Disisi lain adanya pengikatan protein E7 terhadap pRb, akan menyebabkan hal yang sama seperti pada gen p53. Ikatan E7 dengan pRb tersebut menyebabkan tidak terikatnya gen E27 (faktor transkripsi) oleh pRb (Gambar 21). Tidak adanya pengikatan gen E2F menyebabkan gen tersebut menjadi aktif dan akan membantu c-myc untuk terjadinya replikasi DNA dan menstimulasi siklus sel (Prayitno et al., 2005).
Gambar 21. Mekanisme pengikatan E7 terhadap protein Rb (Prayitno et al., 2005). Contoh lain yaitu penelitian yang dilakukan oleh Sukardiman et al. (2005) melaporkan bahwa senyawa andrograpolida dari tanaman sambiloto mampu
mematikan atau menginduksi sel HeLa dengan IC50 sebesar 109.90 µg/ml.
Andrograpolida merupakan senyawa diterpen yang mempunyai aktivitas sebagai
inhibitor terhadap aktivitas enzim DNA topoisomerase II. Fungsi enzim DNA
topoisomerase mempunyai peran yang sangat penting dalam proses replikasi,
commit to user
akan menyebabkan proses terjadinya ikatan antara enzim dengan DNA sel kanker
semakin lama, sehingga akan terbentuk Protein Linked DNA Breaks (PLDB), akibatnya terjadi fragmentasi atau kerusakan DNA sel kanker dan selanjutnya
berpengaruh terhadap proses di dalam sel secara apoptosis.
Penelitian yang serupa juga dilakukan oleh Jamora et al. (2001) yaitu dengan melakukan isolasi terhadap senyawa diterpen dari jamur yaitu senyawa clerocidin
yang telah diketahui memiliki aktivitas sebagai inhibitor enzim DNA topoisomerase
II. Hasil penelitian menyatakan bahwa senyawa clerocidin memiliki aktivitas
apoptosis terhadap sel HeLa. Miao et al. (2003) juga melakukan uji induksi senyawa diterpenoid kuinon salvicina yang juga diketahui memiliki aktivitas sebagai inhibitor
enzim DNA topoisomerase II dan hasil penelitiannya menyebutkan bahwa senyawa
salvicina mampu membunuh sel kanker MDR (Multi Drug Resistant) dengan mekanisme apoptosis. Adanya berbagai mekanisme aksi pada masing-masing tipe
terpenoid, maka diperlukan pengujian lebih lanjut untuk mengetahui terpen dari isolat
5. Akan tetapi untuk mengetahui mekanisme penghambatan pertumbuhan pada sel
HeLa maupun SiHa dapat dilakukan dengan pengujian lebih lanjut melalui
mechanism-based assay. Hal ini dapat dilakukan dengan cara pengamatan apoptosis dengan menggunakan metode doublestainning menggunakan etidium bromide-acrydine orange, sel yang hidup akan berflouresensi hijau karena hanya menyerap
commit to user
bromide mampu melewati membran. Hal ini sebagai penanda bahwa sel yang mati telah kehilangan permeabilitas membrannya (Meiyanto et al., 2008)
Salah satu obat antikanker yang banyak terdapat di pasaran adalah
doxorubisin. Doxorubisin merupakan agen kemoterapi golongan antrasiklin yang
memiliki aktivitas antikanker spektrum luas dan telah lama digunakan pada berbagai
jenis kanker. Senyawa ini mempunyai aktivitas antikanker dan spesifik untuk fase S
dalam siklus sel. Rock dan De Michele (2003) menerangkan bahwa mekanisme aksi
doxorubisin kemungkinan melibatkan ikatan dengan DNA melalui interkalasi
diantara pasangan basa serta menghambat sintesis DNA dan RNA melalui
pengacauan template. Kemungkinan mekanisme yang lain adalah dengan melibatkan ikatan dengan lipid membran sel yang akan mengubah berbagai fungsi seluler dan
berinteraksi dengan DNA topoisomerase II membentuk komplek pemotongan DNA.
Namun penggunaan doxorubisin sebagai agen kemoterapi dibatasi oleh efek
toksik terhadap jaringan normal terutama jantung dan mampu menekan sistem imun
(Wattanapiyakul et al., 2005). Oleh karena itu terus dilakukan upaya pencarian senyawa aktif dari bahan alam. Berdasarkan nilai IC50-24 jam isolat 5 pada sel HeLa
yaitu sebesar 88.10 µg/ml, maka isolat 5 dapat diperhitungkan sebagai salah satu
alternatif senyawa antikanker. Penggunaan senyawa antikanker dari bahan alam dapat
dikombinasikan dengan obat antikanker secara sinergis dan diharapkan dapat
meningkatkan sensitifitas sel terhadap doxorubisin. Sebagai contohnya yaitu sel
commit to user
kemoterapi, akan tetapi kombinasi penggunaan doxorubisin dengan fraksi butanolik
kapang endofit buah makasar mampu meningkatkan sensitifitas sel MCF-7 terhadap
doxorubisin sehingga memperkuat pemacuan apoptosis sel MCF-7. Penggunaan
tunggal fraksi butanolik tersebut mempunyai IC50-24 jam 48 µg/ml dan 148 nM pada
doxorubisin, akan tetapi sinergisme fraksi butanolik tersebut dengan doxorubisin
terlihat dari nilai CI (Indeks Combinasi) <0,9 (Kumala et al., 2009). Oleh karena itu penggunaan kombinasi antara senyawa antikanker dari bahan alam dengan obat
commit to user BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Isolat 5 mempunyai nilai IC50-24 jam sebesar 88.10 µg/ml terhadap sel HeLa,
sedangkan isolat 4 mempunyai nilai IC50-24 jam >1000 µg/ml. Akan tetapi pada
sel SiHa baik isolat 4 maupun 5 keduanya mempunyai nilai IC50-24 jam > 1000
µg/ml.
2. Isolat 4 dan 5 mempunyai efek sitotoksik terhadap sel HeLa dan SiHa yaitu
adanya penghambatan pertumbuhan pada kedua sel kanker tersebut, akan
tetapi efek sitotoksik terbesar yaitu isolat 5 terhadap sel HeLa.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut mengenai senyawa yang mempunyai
efek sitotoksik terhadap penghambatan pertumbuhan sel HeLa.
2. Perlu dilakukan penelitian lebih lanjut mengenai penghambatan dan