POTENSI RUMPUT MUTIARA (
Hedyotis corymbosa
(L.)
Lam.) SEBAGAI ANTIOKSIDAN ALAMI
GUSMETA AMELIA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
POTENSI RUMPUT MUTIARA (
Hedyotis corymbosa
(L.)
Lam.) SEBAGAI ANTIOKSIDAN ALAMI
GUSMETA AMELIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
Pada Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Potensi Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam.) Sebagai
Antioksidan Alami
Nama
: Gusmeta Amelia
NIM
: G44102001
Disetujui
Komisi Pembimbing
Dr. Anna P. Roswiem M.S Drs. Edy Djauhari PK, M.Si
Ketua Anggota
Diketahui
Dekan Fakultas Matematika Dan Ilmu Pengetahuan Alam
Dr. Ir. Yonny Koesmaryono, M.S
NIP. 131473999
ABSTRAK
GUSMETA AMELIA. Potensi Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam.)
Sebagai Antioksidan Alami. Dibimbing oleh ANNA P. ROSWIEM dan EDY
DJAUHARI PURWAKUSUMAH.
Rumput mutiara adalah tumbuhan peneduh. Tumbuhan ini diduga
berpotensi sebagai antioks idan alami. Penelitian ini dilakukan untuk
membandingkan aktivitas antioksidasi antara tajuk dan akar rumput mutiara yang
dianalisis secara
in vitro
dan aktivitasnya dibandingkan dengan senyawa
a-tokoferol (V itamin E). Tajuk dan akar rumput mutiara diekstraksi dengan
menggunakan etanol 70% secara refluks. Aktivitas antioksidasinya ditentukan
dengan metode asam tiobarbiturat (TBA). Metode ini didasarkan pada reaksi
spesifik antara TBA dan malondialdehid (MDA) (hasil oksidasi asam linoleat).
ABSTRACT
GUSMETA AMELIA. Potency of Pearl Grass (
Hedyotis corymbosa
(L.) Lam. )
as Natural Antioxidant. Under the direction of ANNA P. ROSWIEM and EDY
DJAUHARI PURWAKUSUMAH.
Pearl grass (
Hedyotis corymbosa
(L.) Lam.) is a shading tree. The plant is
suspected as a natural antioxidant. The aim of this research is to compare
in vitro
antioxidant activities of coronet and root of pearl grass and then to compare them
with a -tocopherol activity. Samples were prepared by solvent extraction with 70%
ethanol. Antioxidant activity was determined by thiobarbituric acid (TBA)
method. This method is based on the specific reaction between TBA and
malondialdehyde (MDA) (the result of linoleic acid oxidation).
DAFTAR ISI
Halaman
DAFTAR TABEL ...
ii
DAFTAR GAMBAR ...
ii
DAFTAR LAMPIRAN ...
iii
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Radikal Bebas ...
1
Definisi Antioksidan ...
2
Fungsi Antioksidan ...
2
Sumber A ntioksidan ...
3
Rumput Mutiara ...
3
Flavonoid ...
4
Vitamin E ...
4
Metode P engukuran Antioksidan ...
5
BAHAN DAN METODE
Bahan dan Alat ...
6
Metode Penelitian ...
6
HASIL DAN PEMBAHASAN
Kadar Air ...
7
Rendemen Ekstrak Rumput Mutiara ...
8
Analisis Hidroperoksida Asam Linoleat ...
8
Analisis MDA dan Potensi Antioksidan Rumput Mutiara ...
9
SIMPULAN DAN SARAN ...
11
DAFTAR PUSTAKA ...
11
DAFTAR TABEL
Halaman
1 Enam perlakuan pada uji potensi antioksidan rumput mutiara ...
7
2 Kadar air rata-rata rumput mutiara ...
8
3 Hasil analisis kadar MDA dengan uji Duncan ...
11
DAFTAR GAMBAR
Halaman
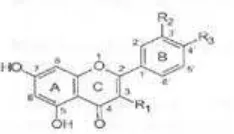
1 Rumput mutiara ...
3
2 Rumus struktur flavonoid ...
4
3 Struktur vitamin E ...
5
4 Reaksi antara MDA dan TBA ...
5
5 Reaksi lipid peroksidasi dari MDA ...
6
6 Reaksi pembentukan hidroperoksida dari asam lemak tidak jenuh ...
9
7 Nilai absorbansi hidroperoksida dari asam linoleat ...
9
8 Kadar MDA (µM) dari ekstrak tajuk dan akar pada beberapa
tingkatan konsentrasi (ppm) ... 10
DAFTAR LAMPIRAN
Halaman
1 Tahapan umum penelitian ...
15
2 Penentuan kadar air tajuk dan akar rumput mutiara ...
16
3 Analisis kadar air tajuk dan akar rumput mutiara ...
16
4 Prosedur ekstraksi tajuk dan akar rumput mutiara ...
17
5 Rendeman hasil ekstraksi rumput mutiara dengan etanol 70% ...
17
6 Analisis hidroperoksida asam linoleat dengan metode tiosianat ...
17
7 Nilai absorbansi hidroperoksida asam linoleat pada ? 492 nm ...
18
8 Analisis potensi antioksidan dengan metode TBA ...
18
9 Hasil analisis aktivitas antioksidan metode TBA ...
19
RIWAYAT HIDUP
Penulis dilahirkan di Jambi pada tanggal 27 Agustus 1984 dari ayah
Nilwandi BE. dan ibu Ermawati. Penulis merupakan anak pertama dari tiga
bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 2 Sungai Penuh (Kerinci) dan
pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi
Masuk IPB (USMI) pada program studi Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allh SWT atas segala karunia
-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tema yang
dipilih dalam penelitian ini adalah khasiat dari tanaman rumput mutiara sebagai
antioksidan, dengan judul Potensi Rumput Mutiara (
Hedyotis corymbosa
(L.)
Lam.) Sebagai Antioksidan Alami. Penelitian ini dilaksanakan mulai bulan Mei
sampai Agustus 2006 di Laboratorium Biokimia, Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam , Institut Pertanian Bogor.
Penulis berterima kasih kepada berbagai pihak yang telah membantu
menyelesaikan karya ilmiah ini terutama kepada Ibu Dr. Anna P. Roswiem M.S
dan Bapak Drs. Edy Djauhari PK. M.Si selaku dosen pembimbing. Terima kasih
juga penulis ucapkan kepada seluruh staf laboratorium Biokimia antara lain, Ibu
Iis, Ibu Mary, Pak Arya dan Mbak Itin atas semua bantuan dan fasilitas yang
diberikan. Terima kasih juga kepada Mbak Wida, Indri, Rita, Andri, Cicing, dan
Peni atas kebersamaan, kerjasama dan dukungannya. Ucapan terima kasih yang
sedalam-dalamnya penulis ucapkan untuk Papa, Mama, adik-adikku serta
keluarga besar atas segala doa, semangat dan kasih sayangnya.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Oktober 2006
1
PENDAHULUAN
Makanan, lingkungan, serta pola hidup suatu masyarakat sangatlah mempengaruhi kesehatan di samping faktor endogen yang ada di dalam tubuh masing-masing individu. Faktor endogen masih bisa dikendalikan, tetapi untuk faktor lingkungan tidaklah mudah. Bahaya lingkungan yang tidak sehat diantaranya adalah radikal bebas, yaitu suatu molekul, atom, atau grup beberapa atom yang memiliki elektron yang tidak berpasangan sehingga menjadi radikal bebas reaktif. Radikal bebas reaktif ini sangat berbahaya sekali karena akan mencuri elektron dari senyawa lain seperti protein, lipid, karbohidrat dan juga DNA di dalam tubuh. DNA adalah senyawa yang ada di dalam inti sel sehingga jika mengalami kerusakan dapat mengakibatkan berbagai macam penyakit seperti katarak, kanker dan berbagai penyakit degeneratif lainnya yang banyak menyerang para manula.
Secara alami tubuh memiliki pelindung yang dapat mencegah serangan berbagai macam penyakit yang disebut antioksidan. Kegunaan utama dari antioksidan adalah untuk menghentikan atau memutuskan reaksi berantai dari radikal bebas yang terdapat secara alami di dalam tubuh. Dengan kata lain, antioksidan dapat menyelamatkan tubuh dari kerusakan akibat adanya radikal bebas. Pada umur 40 tahun, produksi antioksidan dalam tubuh hanya 50% dan pada umur 60-70 tahun akan turun menjadi 5-10%. Untuk itu asupan antioksidan dari luar sangatlah diperlukan oleh tubuh. Disamping itu, antioksidan sintesis seperti BHA (butylatedhydroxyanysole) dan BHT (butylatedhydroxytoluene) bila digunakan dalam jangka waktu panjang dan digunakan dalam jumlah yang berlebihan dapat memberikan efek samping yang cukup berbahaya bagi kesehatan, antara lain adalah dapat menyebabkan kerusakan hati. Oleh sebab itu sekarang banyak peneliti yang berusaha menemukan dan mengembangkan antioksidan dari produk alami seperti dari buah, sayur, rempah dan tanaman obat. Senyawa kimia yang tergolong dalam kelompok antioksidan dan dapat ditemui pada tanaman antara lain berasal dari golongan polifenol, bioflavonoid, vitamin C, vitamin E, betakaroten, katekin, dan lain sebagainya.
Salah satu tumbuhan yang diduga memiliki potensi sebagai antioksidan adalah Rumput M utiara (Hedyotis corymbosa (L.) Lam.). Tumbuhan ini belum terlalu dikenal
oleh masyarakat luas dan belum ada penelitian secara ilmiah yang dilakukan untuk mengetahui potensi antioksidan dari t umbuhan ini. Namun, dalam bidang farmakologi Cina, tumbuhan ini telah lama digunakan untuk menyembuhkan berbagai penyakit. Secara tradisional, ada beberapa sumber yang mengatakan bahwa rumput mutiara dapat digunakan untuk melawan kanker, yaitu dengan cara meminum air rebusan seluruh bagian tumbuhan ini. Dalam penggunaannya, biasanya masyarakat menggunakan rebusan dari keseluruhan bagian dari tumbuhan ini. Namun, dalam penelitian ini akan dibandingkan antara tajuk dan akarnya untuk melihat bagian manakah yang lebih berpotensi sebagai antioksidan.
Penelitian ini bertujuan untuk menguji potensi aktivitas antioksidan ekstrak tajuk dan akar rumput mutiara dengan menggunakan metoda TBA (thiobarbituric acid) serta membandingkan aktivitasnya dengan antioksidan alami yaitu a-tokoferol (Vitamin E).
Hipotesis penelitian ini adalah tumbuhan Rumput mutiara (Hedyotis corymbosa (L.) Lam.) mengandung senyawa bioaktif yang dapat berpotensi sebagai antioksidan. Serta terdapat potensi antioksidan yang berbeda antara bagian tajuk dan akar rumput mutiara. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah kepada masyarakat luas mengenai khasiat rumput mutiara sebagai obat alternatif terutama sebagai antioksidan alami.
TINJAUAN PUSTAKA
Radikal B ebas
2
tubuh melalu i pernafasan, pencernaan, injeksi dan penyerapan kulit (Supari 1995). Menurut Halliwel dan Gutteridge (1989) radikal bebas adalah molekul atau senyawa yang mempunyai satu atau lebih elektron yang tidak berpasangan dan dapat menimbulkan kerusakan pada biomolekul. Produksi radikal bebas yang menyebabkan kerusakan pada materi biologis terjadi selama metabolisme aerob normal. Radikal bebas dapat diproduksi di dalam sel oleh mitokondria, membran plasma, lisosom, peroksisom, retikulum endoplasma, dan inti sel (Langseth 1995). Bentuk nyata dari radikal bebas yang dapat dilihat di alam bebas adalah pembakaran yang tidak sempurna misalnya asap rokok yang tidak menghasilkan CO2 tapi CO, demikian
juga dengan asap dari kendaraan bermotor merupakan radikal bebas yang berbahaya sekali bagi paru-paru. Disamping itu asupan makanan yang mengandung logam-logam berat memungkinkan terbentuknya radikal bebas akibat oksidasi dari luar. Beberapa macam radikal bebas antara lain superoksida (O2-), hidrogen peroksida (H
2O2), radikal
hidroksil (OH), radikal hipoklorit (OCl), dan ozon (O3) (Kumalaningsih 2006).
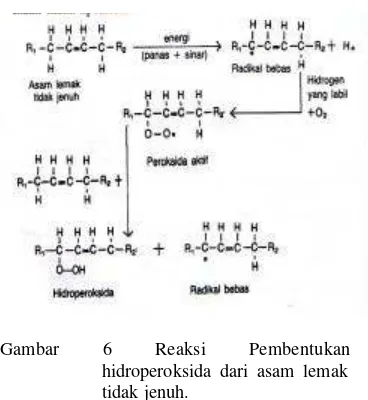
Menurut Halliwell dan Gutteridge (1989) radikal bebas di dalam tubuh dapat terjadi melalui beberapa mekanisme yaitu autooksidasi, aktifitas oksidasi, dan sistem transport elektron. Sedangkan menurut Fardiaz (1996), reaksi autooksidasi di dalam tubuh terjadi antara lipid dan oksigen. Reaksi ini berlangsung melalui tiga tahap, yaitu: Inisiasi, yaitu reaksi dimana radikal bebas terbentuk. Hidroperoksida (ROOH) dapat terbentuk melalui berbagai proses termasuk reaksi antara singlet oksigen dengan lipid tidak jenuh atau oksidasi asam lemak tidak jenuh yang dikatalisis dengan enzim lipoksigenase. Propagasi, merupakan reaksi dimana radikal-radikal bebas diubah menjadi radikal-radikal yang lain. Radikal lipid yang terbentuk pada reaksi inisiasi dapat mengalami reaksi propagasi melalui abstraksi satu atom hidrogen atau melalui reaksi oksigenasi dengan molekul oksigen. Terminasi, reaksi dimana terjadi penggabungan dua radikal dan membentuk produk-produk yang stabil.
Mekanisme reaksinya dapat dijelaskan sebagai berikut:
Inisiasi :
RH + OH• R• + H2O
propagasi :
R• + O2 ROO•
ROO• + RH ROOH + R• Terminasi :
ROO•+ROO• ROOR + O2
ROO• + R • ROOR R• + R• RR
Definisi Antioksidan
Antioksidan merupakan senyawa penting yang berfungsi menangkap radikal bebas dalam tubuh. Secara umum, antioksidan didef inisikan sebagai senyawa yang dapat menunda, memperlambat atau mencegah proses oksidasi lipid (Schuler 1990). Dalam arti khusus, antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi autooksidasi radikal bebas dalam oksidasi lipid (Kochhar dan Rossell 1990). Antioksidan juga merupakan senyaw a yang mempunyai struktur molekul yang dapat memberikan elektronnya dengan cuma-cuma kepada molekul radikal bebas tanpa terganggu sama sekali dan dapat memutuskan reaksi berantai dari radikal bebas (Kumalaningsih 2006). Selain dikonsumsi dalam bentuk makanan antioksidan juga dimanfaatkan untuk penggunaan di bagian luar tubuh, yaitu sebagai kosmetik dalam perawatan kecantikan. Antioksidan telah banyak dikenal, diproduksi, dan digunakan dalam berbagai industri dan kesehatan (Hernani dan Rahardjo 2005).
Sebenarnya, antioksidan juga saling berkompetisi dengan sesamanya sehingga membutuhkan komposisi campuran yang cukup tepat. Antioksidan seperti vitamin C, E dan karotenoid (beta karoten, likopen, dan lutein) memiliki peranan yang cukup penting dalam membantu pencegahan kerusakan sel-sel akibat adanya radikal bebas tersebut (Hernani dan Rahardjo 2005).
Fungsi Antioksidan
3
scavanger, dan chelators (Kumalaningsih 2006 dan Gordon 1990).
Antioksidan primer (antioksidan pemecah rantai), yaitu antioksidan yang dapat bereaksi dengan radikal lipid lalu mengubahnya ke bentuk yang lebih stabil. Antioksidan dapat dikatakan sebagai antioksidan primer (AH) jika dapat mendonorkan atom hidrogennya secara cepat ke radikal lipida (RO*) dan turunan antioksidan disebut (A*) lebih stabil dibanding antioksidan lipid, atau mengubahnya ke bentuk yang lebih stabil. Antioksidan primer yang sangat terkenal adalah enzim superoksida dismutase (SOD) dan glutation peroksidase (GPx). Enzim ini dapat melindungi hancurnya sel-sel dalam tubuh akibat serangat radikal bebas.
Antioksidan sekunder (antioksidan pencegah), didefinisikan sebagai suatu senyawa yang dapat memperlambat laju reaksi autooksidasi lipid. Antioksidan ini bekerja dengan berbagai mekanisme , seperti mengikat ion metal, menangkap oksigen, memecah hidroperoksida ke bentuk-bentuk non radikal menyerap radiasi UV atau mendeaktifkan singlet oksigen. Contoh yang populer dari antioksidan sekunder ini adalah vitamin E, vitamin C, dan betakaroten.
Antioksidan tersier, merupakan s enyawa yang memperbaiki sel-sel dan jaringan yang rusak karena serangan radikal bebas. Biasanya yang termasuk golongan ini adalah enzim metionin sulfoksidan reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut bermanfaat untuk perbaikan DNA pada penderita kanker.
Oxygen scavanger, merupakan antioksidan yang mengikat oksigen sehingga tidak mendukung terjadinya reaksi oksidasi, misalnya vitamin C.
Chelators, berfungsi mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya asam sitrat dan asam amino.
Sumber Antioksidan Antioksidan S intetik.
Ada beberapa antioksidan sintetis yang umum digunakan di seluruh dunia, yaitu butylatedhydroxytoluene (BHT), butylatedhydroxyanysole (BHA), propilgalat, tert-butyl hydroxy quinon (TBHQ), propylgallate (PG), nordihidroquairetic acid (NDGA) dan a-tokoferol. BHT dan BHA adalah yang paling banyak digunakan (Buck 1991). Namun, antioksidan tersebut bersifat karsinogen terhadap sistem reproduksi, dapat menyebabkan pembengkakan organ hati,
mempengaruhi aktivitas enzim dalam hati dan metabolisme, bahkan dalam jangka waktu lama tidak terjamin keamanannya. Berdasarkan uji toksisitas akut dan kronik pada hewan percobaan, pemakaian zat antioksidan maksimal yang diperbolehkan dalam campuran makanan adalah 200 ppm ( Her nani dan Rahardjo 2005).
Antioksidan Alami.
Antioksidan alami dalam makanan dapat berasal dari senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan, senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan dan senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke dalam makanan sebagai tambahan pangan (Pratt 1992). Menurut Pratt dan Hudson (1990), kebanyakan senyawa antioksidan yang diisolasi dari sumber alami berasal dari tumbuhan dan dapat tersebar di berbagai bagian tanaman seperti pada kayu, kulit kayu, akar, daun, buah, bunga, biji, rimpang, dan serbuk sari.
Rumput Mutiara (Hedyotis corymbosa (L.) Lam.)
Sinonim dari Rumput M utiara (Hedyotis corymbosa (L.) Lam. ) adalah Oldenlandia corymbosa, Linn. Rumput mutiara juga memiliki beberapa nama daerah, diantaranya adalah rumput siku-siku, lidah ular, bunga telor belungkas (Indonesia), daun mutiara, rumput mutiara (Jakarta), katepan, urek -urek polo (Jawa), Pengka (Makasar), pucuk pulung (Kalimantan Barat), Shui xian cao (China) (Sudewo 2004 dan IPTEKnet 2005).
Klasifikasi tumbuhan rumput mutiara adalah sebagai berikut (DepKes BPPK 1999): kingdom Plantae, subkingdom Tracheobiont a , superdivisi Spermatophyta, divisi Magnoliophyta, kelas Magnoliopsida, subkelas Asteridae, ordo Rubiales, famili Rubiaceae, genus Oldenlandia L, spesies Oldenlandia corymbosa L. atau Hedyotis corymbosa L.
4
Rumput mutiara merupakan rumput yang tumbuh rindang berserak, berupa semak, batang tegak, berbulu, warna hijau kemerahan, agak lemah, tinggi 15 - 50 cm, tumbuh subur pada tanah lembab di pinggir jalan, pinggir selokan, batang bersegi dan mempunyai banyak percabangan (Gambar 1). Daun tunggal berhadapan bersilang, tangkai daun pendek/hampir duduk, berbentuk lanset, daun berwarna hijau, panjang daun 2 - 5 cm, ujung runcing, tulang daun satu di tengah dan ujung daun mempunyai rambut yang pendek. Bunga tunggal ke luar dari ketiak daun, bentuknya seperti payung berwarna putih (corong), berupa bunga majemuk 2-5, terdapat di ketiak daun, kelopak hijau kemerahan, tangkai bunga (induk) keras seperti kawat, panjangnya 5-10 mm. Buahnya kotak dan warna cokelat sedangkan bijinya bulat dan berwarna cokelat (IPTEKnet 2005).
Bagian yang digunakan sebagai obat adalah seluruh bagian tumbuhan, baik dalam keadaan segar maupun yang dikeringkan (Kusuma FR, Zaky BM 2005). Sifat kimiawi dan efek farmakologis dari rumput mutiara adalah memiliki rasa manis, tawar, sedikit pahit, lembut, netral, agak dingin atau sejuk (Dalimartha 2005 dan Kusuma, Zaky 2005). Menurut Wijaya (2004) dan Soenanto , Kuncoro (2005), kandungan kimia yang terkandung dalam rumput mutiara adalah hentriakontan, stigmasterol, asam ursolat, asam oleanolat, Betasitosterol, sitosterolD -glukosida, p-asam kumarat, flavonoid glikosida, baihuasheshecaosu (kemungkinan analog kumarin), iridoid glikosida, alizarin, krorogenin, dan ikatan antragalol.
Khasiat yang dimilikinya adalah sebagai antiradang (anti-inflamasi), diuretik, menyembuhkan bisul (anti karbunkular), menghilangkan panas (demam), antitoksin, mengaktifkan sirkulasi darah dan memperlancar sumbatan sperma (trubus 2005, Kusuma, Zaky 2005), serta meningkatkan daya fagositosis sel darah putih dan imunitas hormonal (Dalimartha 2005) Dapat mengobati berbagai penyakit seperti radang kandung empedu, hepatitis, kanker (payudara, limpa, usus besar, serviks, rektum, lambung, nasofaring dan fibrosarkoma), tekanan darah tinggi, tonsilis, bronchitis, gondongan, pneumonia, radang usus buntu, radang panggul, infeksi saluran kemih, bisul, dan borok (IPTEKnet 2005, Permadi 2006), untuk batu ginjal, radang ginjal dan infeksi ginjal (Soenanto , Kuncoro 2005). Daunnya yang segar juga dapat dimanfaatkan untuk mengobati luka luar seperti memar, pyodermi,
gigitan ular, tersiram air panas, tulang patah, terkilir, yaitu dengan cara melumatkan herba segar lalu dibubuhkan pada tempat yang sakit (IPTEKnet 2005).
Flavonoid
Senyawa antioksidan alami yang terdapat pada tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavanon, flavonol, isoflavon, katekin, dan kalkon. Sement ara turunan asam sinamat meliputi asam kafeat, asam ferulat, asam klorogenat dan lain-lain. Senyawa antioksidan alami polifenolik ini adalah multifungsional dan dapat bereaksi sebagai pereduksi, penangkap radikal bebas, pengkelat logam, dan peredam terbent uknya singlet oksigen (Kumalaningsih 2006).
Flavonoid merupakan golongan fenolat yang memiliki struktur dasar C6-C3-C6 dan
umumnya mengandung inti ?-benzopiron (Gambar 2). Beberapa flavonoid dilaporkan memiliki aktivitas biologis yang berbeda-beda. Aktivitas biologis tersebut ada yang berguna sebagai antiviral, antifungal, antiinflamatory, dan aktivitas yang bersifat antitoksik (Santos et al 1985). Flavonoid di alam terdapat dalam dua bentuk, yaitu flavonoid aglikon (flavonoid tanpa gula terikat) dan flavonoid glikosida (dengan gula terikat). Flavonoid glikosida umumnya lebih larut dalam air, sebaliknya flavonoid aglikon lebih mudah larut dalam pelarut seperti eter dan kloroform. Seperti senyawa fenolik lainnya, flavonoid tidak stabil terhadap pengaruh cahaya, oksidasi, dan perubahan kimia, sehingga apabila teroksidasi strukturnya akan berubah dan keaktifannya menurun bahkan hilang (Hernani, Rahardjo 2005).
Gambar 2 Rumus struktur flavonoid.
Vitamin E
5
tetapi larut dalam lemak atau minyak. Terdapat delapan bentuk vitain E yaitu empat tokoferol alfa, beta, gamma dan delta serta empat tokotrienol. Dari delapan bentuk tersebut, yang bermanfaat bagi aktivitas biologis dalam tubuh adalah alfa yang ditemukan dalam darah dan jaringan yang berfungsi sebagai mengakhiri rentetan reaksi radikal bebas (Gambar 3). Vitamin E banyak sekali ditemukan dalam minyak tumbuhan seperti minyak bunga matahari, minyak zaitun, kacang-kacangan, biji gandum, dan sayuran berwarna hijau. Pada hewan seperti daging sapi, unggas dan ikan. Vitamin E dapat menstimulasi sistem imun sehingga tubuh dapat menghancurkan sel prekanker sebelum berkembang menjadi ganas. Dapat juga menghambat perkembangan kanker di mulut, kulit, payudara, dan usus (Kumalaningsih 2006). Vitamin E ini digunakan sebagai antioksidan pembanding untuk ekstrak tajuk dan akar rumput mutiara.
Gambar 3 Struktur vitamin E.
Metode Pengukuran Antioksidan
Metode pengukuran antioksidan dapat dilakukan dengan beberapa metode, diantaranya adalah metode bilangan peroksida (metode FTC), metode asam tiobarbiturat (TBA), metode tiosianat, metode Kreis, metode bilangan anisidin dan metode oksigen aktif (Nawar 1996).
Metode bilangan peroksida, peroksida yang merupakan produk reaksi oksidasi diukur berdasarkan kemampuannya menghasilkan iodin dari kalium iodida. Nilai peroksida dinyatakan dalam miliekivalen oksigen per kilogram sampel. Metode asam tiobarbiturat mengukur produk oksidasi asam linoleat (malondialdehida) yang bereaksi dengan asam tiobarbiturat yang menghasilkan produk berwarna merah yang diukur pada ? 532 nm. Metode Kreis mengukur hasil oksidasi lemak yang bereaksi dengan floroglusinol. Metode tiosianat mengukur peroksida melalui kompleks warna Fe[Fe(SCN)6]. Metode bilangan anisidin
mengukur senyawa aldehida hasil oksidasi yang bereaksi dengan p–anisidin.Metode oksigen aktif mengukur nilai peroksida yang
dihasilkan dari oksidasi asam lemak tak jenuh dalam kondisi jenuh udara pada suhu 98oC.
Potensi antioksidan yang digunakan dalam penelitian ini adalah metode TBA. Alasannya adalah metode TBA merupakan cara yang paling lama dan paling sering digunakan untuk mengukur peroksidasi asam lemak pada membran sel dan makanan, reaksi TBA diketahui bersifat sensitif terhadap peroksida lipid dan reaksi antara malodialdehid dengan asam tiobarbiturat akan menghasilkan produk yang sama dengan reaksi yang terjadi antara lipid peroksida dengan asam tiobarbiturat. Kekurangan metode ini adalah berbagai senyawa seperti karbohidrat, protein, dan aldehida dapat bereaksi dengan TBA. Senyawa-senyawa yang bereaksi ini disebut dengan istilah TBARS (Thiobarbituric Acid Reactive Subtances) (Yagi 1994).
Sebelum dilakukan uji potensi antioksidan, dilakukan dulu pengukuran hidroperoksida yang merupakan produk primer dari oksidasi asam linoleat dengan metode tiosianat. Pengukuran hidrop eroksida dilakukan untuk menentukan waktu inkubasi asam linoleat. Menurut Kikuzaki dan Nakatani (1993) pengukuran potensi antioksidan dengan metode TBA sebaiknya dilakukan setelah beberapa hari terjadinya puncak absorbansi asam linoleat karena hidroperoksida akan mengalami dekomposisi membentuk malondialdehida.
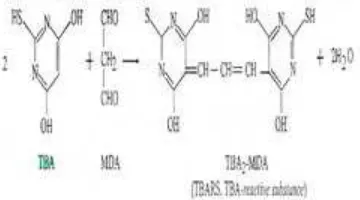
Malondialdehida (MDA) adalah produk akhir dari peroksidasi lipid, yaitu senyawa aldehida berkarbon tiga yang reaktif (Gambar 4). MDA inilah yang nantinya diukur dengan metode TBA, karena MDA dapat bereaksi dengan TBA membentuk produk yang berfluororesesnsi yang memiliki panjang gelombang maksimum pada 532 nm (Gambar 5). Pengukuran MDA telah digunakan sebagai indikator kerusakan oksidatif asam lemak tidak jenuh pada sel hidup yang menyebabkan perubahan struktural dan fungsi (Septiana 2000).
6
Gambar 5 Reaksi lipid peroksidasi dari MDA.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang akan digunakan ialah tajuk dan akar rumput mutiara, etanol 99.8%, etanol 70%, FeCl2 0.02 M dalam HCl 3.5%, stok
1,1,3,3 tetrametoksipropana (TMP) 6 M, TBA 1% (Thiobarbituric Acid) (b/v) dalam asam asetat 50%, TCA (Trichloro Acetate) 20%, asam linoleat 50 mM dalam etanol 99.8%, air bebas ion, buffer fosfat 0.1 M pH 7, a -tokoferol, asam asetat 50% NaOH 1N, asam fosfat 10% dan ammonium tiosianat 30%.
Alat-alat yang digunakan adalah alat-alat gelas, kertas saring, kain kassa, botol gelap berulir, bulp, sudip, gegep, mikropipet, vorteks, termometer, neraca, refluks, rotary evaporator, oven, pHmeter, penangas air, eksikator, spektrofotometer UV vis, freezer dan sentrifus (r = 0.9cm ; RCF= 9.072 x g).
Metode Penelitian
Pengeringan S ampel
Sebanyak 1 Kg tajuk dan akar rumput mutiara segar dibersihkan, lalu dikeringkan di bawah sinar matahari langsung sebelum pukul sepuluh kurang lebih selama 3 hari. Di atas pukul sepuluh, tajuk dan akar dikering anginkan (tidak langsung di bawah sinar matahari, karena dapat merusak senyawa yang terdapat dalam tumbuhan) sampai diperoleh bobot akhir 100 gram atau sepersepuluhnya
Ekstraksi Tajuk dan Akar Rumput Mutiara
Sebanyak 20 gram simplisia tajuk dan akar rumput mutiara masing-masing direfluks dengan 200 ml pelarut etanol 70% selama 2-3
jam pada suhu 70-80oC (Satria 2005). Selanjutnya ekstrak dis aring dengan menggunakan kertas saring dan kain kassa. Ekstrak yang diperoleh diuapkan dengan menggunakan rotavapor pada suhu 50oC (sampai kental) kurang lebih selama 8 jam dan dioven pada suhu 40oC sehingga diperoleh ekstrak kasar (kering). Sebelum ekstrak kasar digunakan untuk uji potensi antioksidan, ekstrak tersebut disimpan dalam freezer (Harbone 1987).
Analisis Kadar Air Tajuk dan Akar Rumput M utiara (Harjadi 1990)
Penentuan kadar air dilakukan dengan cara mengeringkan cawan porselin di dalam oven yang bersuhu 105oC selama 30 menit. Lalu didinginkan dalam eksikator dan ditimbang sampai diperoleh bobot cawan yang konstan. Lalu sebanyak 2 g sampel dimasukkan dalam cawan, dikeringkan dalam oven 105oC selama 3 jam sampai diperoleh bobot yang konstan. Kemudian didinginkan lagi dalam eksikator dan ditimbang. Penentuan kadar air ini dilakukan pada tumbuhan segar dan simplisianya.
Kadar air = A-B x 100% A
Keterangan: A = bobot sampel
B = bobot bahan setelah dikeringkan
Analisis Hidroperoksida Asam Linoleat Dengan Metode Tiosianat (Chen et al 1996)
Sebelum dilakukannya pengukuran potensi antioksidan dari ekstrak tajuk dan akar rumput mutiara, dilakukan pengukuran hidroperoksida sebagai produk primer asam linoleat yang teroksidasi dengan metode tiosianat. Sebanyak 2 ml buffer fosfat 0.1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99.8%, dan 1 ml air bebas ion diletakkan dalam botol gelap berulir, kemudian campuran diinkubasi pada suhu 40oC. Lama
inkubasi yaitu sampai tercapai absorbansi maksimum. Selanjutnya analisis hidroperoksida dilakukan sebagai berikut. Ke dalam 50 µL campuran yang telah diinkubasi ditambahkan 6 ml etanol 75%, 50 µL ammonium tiosianat 30% dan 50 µL FeCl2
7
Analisis Potensi Antioksidan Tajuk dan Akar Rumput Mutiara Dengan Metode TBA (Kikuzaki 1993)
Analisis potensi antioksidan dari ekstrak tajuk dan akar rumput mutiara dilakukan dengan berbagai seri konsentrasi larutan uji yaitu 50, 100, 200 dan 500 ppm. Uji potensi antioksidan dilakukan dengan metode TBA. Nilai aktivitas antioksidan ditentukan berdasarkan kemamp uan ekstrak menahan laju pembentukan MDA. Oleh karena itu aktivitasnya dihitung sebagai % inhibisi dengan rumus:
%inhibisi = {(A -B)/A} x 100%
A adalah MDA kontrol negatif, B adalah MDA tiap perlakuan.
Sampel terdiri atas 2 ml buffer fosfat 0.1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99.8% dan 1 ml larutan uji. Sebagai kontrol negatif dibuat campuran yang sama tetapi 1 ml larutan uji diganti dengan 1 ml air bebas ion. Sedangkan sebagai pembanding (kontrol positif) dibuat campuran yang terdiri atas 2 m l buffer fosfat 0.1 M pH 7, 2 ml asam linoleat 50 mM dalam etanol 99.8% dan 1 ml a -tokoferol. Tajuk dan akar diberi perlakuan yang sama.Masing-masing perlakuan di atas dapat dilihat pada Tabel 1.
Tabel 1 Enam perlakuan pada uji potensi antioksidan rumput mutiara
Komposisi Perlakuan (mL)
I II III I V V VI
Buffer fosfat 1.0 M pH 7
2 2 2 2 2 2
Asam linoleat 50 mM dalam etanol 99.8%
2 2 2 2 2 2
Larutan uji
50 ppm 1
Larutan uji
100 ppm 1
Larutan uji
200 ppm 1
Larutan uji
500 ppm 1
Air bebas
ion 1
a-tokoferol
200 ppm 1
Keterangan:
Perlakuan I : sampel 50 ppm Perlakuan II : sampel 100 ppm Perlakuan III : sampel 200 ppm Perlakuan IV : sampel 500 ppm Perlakuan V : kontrol negatif
Perlakuan VI : kontrol positif (vit.E 200 ppm)
Semua campuran reaksi tersebut diinkubasi dalam penangas air yang bersuhu 40oC dengan lamanya waktu inkubasi disesuaikan dengan hasil pengukuran hidroperoksida dari asam linoleat pada metode tiosianat. Campuran reaksi itu diuji potensi antioksidannya setelah 1 atau beberapa hari dari puncak absorbansi asam linoleat dengan menggunakan metode TBA . Masing-masing campuran reaksi diambil 1 ml, kemudian ditambahkan 2 ml TCA 20%, dan 2 ml larutan TBA 1% (b/v) dalam pelarut asam asetat 50%. Lalu campuran reaksi tersebut ditempatkan pada penangas air bersuhu 100oC selama 10 menit. Setelah dingin disentrifugasi pada 3000 rpm selama 15 menit, selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 532 nm.
Penentuan kurva stand ar dibuat dari larutan pereaksi 1,1,3,3 tetra metoksi propana (TMP). Larutan stok pereaksi TMP 6 M diencerkan menjadi 0.15, 0.3, 0.6, 0.75, 1.5, dan 3.0 µM. Masing-masing konsentrasi dipipet sebanyak 1 ml, selanjutnya ditambahkan 2 ml TCA 20% dan 2 ml TBA 1% dalam pelarut asetat 50%, selanjutnya semua tabung diinkubasi pada suhu 100oC selama 10 menit dan didinginkan dalam suhu kamar. Setelah dingin dilakukan sentrifugasi pada kecepatan 3000 rpm selama 15 menit , kemudian absorbansinya diukur menggunakan spektrofotometer pada panjang gelombang 532 nm.
Analisis Data
Konsentrasi MDA sebagai respon langsung tiap perlakuan diuji dengan analisis varian (ANOVA) untuk melihat adanya perbedaan respon perlakuan terhadap respon tanpa perlakuan (kontrol negatif). Rerata konsentrasi MDA yang berbeda nyata terhadap kontrol negatif menunjukkan adanya potensi sebagai antioksidan. ANOVA dilanjutkan dengan uji Duncan (a = 0.05) untuk melihat perbedaan respon tiap perlakuan. Analisis data dilakukan dengan progam SPSS for Windows (Mattjik 2002).
HASIL DAN
PEMBAHASAN
Kadar Air
8
untuk mengetahui kandungan zat dalam tumbuhan sebagai persentase bahan kering. Selain itu penentuan kadar air juga bertujuan untuk mengetahui ketahanan suatu bahan dalam penyimpanannya (Harjadi 1993). Kadar air yang bagus suatu bahan adalah kurang dari 10%. Pada kadar ini suatu bahan dapat disimpan dalam jangka waktu yang sangat lama karena kemungkinan bahan itu rusak oleh jamur pada saat penyimpanan akan kecil. Umumnya, penentuan kadar air di lakukan dengan mengeringkan bahan pada suhu 105-110oC selama 3 jam sampai diperoleh berat yang konstan (Winarno 1992). Selisih berat bahan sebelum dan sesudah pengeringan adalah banyaknya air yang telah diuapkan atau dihilangkan. Pada penelitian ini diperoleh kadar air untuk tajuk dan akar segar berturut -turut sebesar 86.23% dan 86.62% (Tabel 2). Jadi, jumlah air yang telah diuapkan dari tajuk dan akar segar berturut -turut sebesar 17.77% dan 13.38%. Kemudian, dari simplisia tajuk dan akar diperoleh kadar air akhir berturut -turut sebesar 18.55% dan 12.25% atau jumlah air yang telah berhasil diuapkan dari simplisia tajuk dan akar sebesar 81.45% dan 87.75% . Dari percobaan ternyata jumlah air dari simplisia lebih banyak yang teruapkan dibandingkan jumlah air pada tajuk dan akar segarnya. Hasil ini menunjukkan bahwa simplisia tajuk dan akar dapat disimpan dalam jangka waktu yang lebih lama dibandingkan akar dan tajuk segarnya.
Tabel 2 Kadar air rata-rata rumput mutiara perlakuan Bagian tanaman Kadar air
(%) segar tajuk 86.23
akar 86.62 simp lisia tajuk 18.55 akar 12.25
Rendemen Ekstrak Rumput Mutiara
Senyawa bioaktif yang diperkirakan berperan sebagai antioksidan dari rumput mutiara adalah flavonoid. Flavonoid adalah senyawa yang polar, maka umumnya flavonoid larut dalam pelarut polar sep erti etanol, metanol, butanol, aseton, dimetilsulfoksida, dan lain-lain. Dalam percobaan simplisia tajuk dan akar rumput mutiara diekstraksi dengan menggunakan pelarut etanol 70%.
Pemilihan etanol 70% sebagai pelarut karena etanol 70% sering digunakan untuk ekstraksi dan menghasilkan senyawa bahan aktif yang optimal dan kemungkinan jumlah
pengotor yang ikut dalam larutan pengekstraksi sangat kecil. Ekstraksi simplisia tajuk dan akar dilakukan dengan metode refluks. Sampel dan larutannya (etanol 70%) dipanaskan pada suhu 70 -80oC selama 2 sampai 3 jam. Uap yang dihasilkan akan melewati pipa kondensor yang panjang dan akan jatuh kembali ke dalam larutan sehingga jumlah uap yang keluar dapat diminimumkan. Metode ini dipilih karena pada umumnya masyarakat secara tradisional mengolah rumput mutiara ini dengan cara merebusnya terlebih dahulu (Kusuma, Zaky 2005). Hasil ekstraksi menunjukkan bahwa tajuk menghasilkan rendemen yang lebih besar dibandingkan akar, yaitu sebesar 19.51% sedangkan rendemen akar sebesar 16.06%. Sehingga dapat dikatakan bahwa tajuk lebih banyak mengandung senyawa bioaktif dibanding akar. Ekstrak yang dihasilkan berwarna hitam dengan aroma yang khas.
Analisis Hidroperoksida Asam Linoleat
Hidroperoksida adalah salah satu produk primer hasil oksidasi asam linoleat. Pada percobaan, campuran asam linoleat, buffer fosfat dan air bebas ion dalam botol gelap berulir ditempatkan dalam penangas air 40oC selama 8 hari. Asam linoleat akan dioksidasi oleh oksigen sehingga Fe2+ akan teroksidasi menjadi Fe3+. Reaksi antara Fe3+ hasil oksidasi FeCl2+ oleh hidroperoksida dengan SCN- akan menghasilkan kompleks Fe[Fe(SCN)6
berwarna merah. Absorbansi dari kompleks yang berwarna merah diukur dengan menggunakan spektrofotometer UVvis tiap 24 jam pada panjang gelombang 492 nm (hasil pencarian panjang gelombang maksimum) untuk melihat waktu saat hidroperoksida maksimum yang dihasilkan. Pada tahap awal (inisiasi) oksidasi asam linoleat akan membentuk hidroperoksida (Gambar 6), selanjutnya terjadi tahap propagasi, yaitu kadar hidroperoksida akan terus meningkat sampai terbentuk suatu keadaan maksimum, kemudian pada tahap terminasi hidroperoksida didekomposisi menjadi senyawa molekuler yang lebih kecil seperti malondialdehida.
9
Gambar 6 Reaksi Pembentukan hidroperoksida dari asam lemak tidak jenuh.
Hasil percobaan menunjukkan bahwa hidroperoksida dari hasil oksidasi asam linoleat terbentuk maksimum pada hari ke-5, yaitu pada tahap propagasi (Gambar 7). Maka setelah hari kelima ini (pada tahap terminasi) malondialdehida baru terbentuk bersamaan dengan senyawa-senyawa dengan rantai C lebih pendek lainnya seperti asam-asam lemak, aldehid dan keton yang dapat menimbulkan bau tengik (Winarno 1992). Berdasarkan hasil ini, maka analisis potensi antioksidan dengan metode TBA dilakukan pada hari ke-7, yaitu dua hari setelah hidroperoksida terbentuk maksimum. Hal ini diasumsikan bahwa setelah dua hari, semua hidroperoksida telah terdekompisisi menjadi malondialdehida (jumlah MDA yang terbentuk jauh lebih banyak dibanding jumlah pembentukan hidroperoksida pada saat yang bersamaan).
Gambar 7 Nilai absorbansi hidroperoksida dari asam linoleat.
Analisis MDA dan Potensi Antioksidan Rumput Mutiara
Penambahan ekstrak tajuk dan akar rumput mutiara pada campuran yang berisis asam linoleat dan buffer fosfat dilakukan seawal mungkin (dilakukan pada hari ke-0) untuk menghasilkan efek antioksidasi yang optimum. Antioksidan akan benar -banar bekerja efektif jika ditambahkan seawal mungkin selama periode induksinya, yaitu pada suasana periode awal oksidasi asam linoleat terjadi, dalam hal ini oksidasi masih berjalan secara lambat dengan kecepatan yang seragam.
Malondialdehida yang terbentuk pada tahap terminasi setelah diinkubasi selama 7 hari diukur sebagai TBARS (Thiobarbituric Acid Reactive Subtances). MDA akan bereaksi dengan TBA membentuk kompleks MDA -TBA (gambar 5) dan menghasilkan warna yang merah muda dengan serapan maksimum pada panjang gelombang 532 nm. Pada pengukuran ini pengaruh senyawa-senyawa lain selain MDA dapat diabaikan karena TBA hanya bereaksi spesifik dengan MDA. Sebagai kurva standar, digunakan larutan 1.1.3.3-Tetra metoksi propana (TMP) pada berbagai kisaran konsentrasi.
Vitamin E (alfa tokoferol) digunakan sebagai pembanding pada percobaan ini, karena vitamin E banyak digunakan sebagai antioksidan alami pada makanan. Mengingat batas maksimum antioksidan yang diperbolehkan dalam makanan adalah 200 ppm, maka konsentrasi vitamin E yang digunakan dalam percobaan ini juga sebesar 200 ppm. Sedangkan kontrol negatif pada perlakuan ini adalah air bebas ion.
Selama waktu inkubasi, reaksi oksidasi asam linoleat oleh oksigen dapat dihambat dengan adanya ekstrak tajuk dan akar rumput mutiara di dalam campuran yang berisi asam linoleat . Ada empat konsentrasi ekstrak yang digunakan yaitu 50, 100, 200, dan 500 ppm. Pemilihan keempat konsentrasi ini berdasarkan pada batas maksimum antioksidan dalam makanan yaitu 200 ppm. Jadi ada konsentrasi di bawah 200 ppm dan ada juga konsentrasi di atas 200 ppm. Semakin tinggi konsentrasi ekstrak maka laju pembentukan MDA dapat semakin terhambat. Pada tahap inkubasi ini jumlah hidroperoksida yang terbentuk sebanding dengan jumlah MDA yang dihasilkan. Nilai pengukuran absorbansi pada panjang gelombang 532 nm berbanding lurus dengan jumlah MDA yang terbentuk dan berbanding terbalik dengan
0.0 0.5 1.0 1.5
0 1 2 3 4 5 6 7 8 9
lama inkubasi (hari)
10
potensi antioksidan yang dihasilkan dari masing-masing ekstrak.
Dari hasil percobaan diperoleh bahwa semakin tinggi konsentrasi ekstrak, maka kadar MDAnya semakin menurun. Hal ini ditandai dengan semakin pudarnya warna merah yang terbentuk da ri masing-masing ekstrak. Pada Gambar 8 dapat dilihat bahwa secara umum dari penelitian ini ternyata ekstrak tajuk memiliki daya hambat yang lebih besar dalam menahan laju pembentukan MDA dari asam linoleat dibandingkan dengan ekstrak akar rumput mutiara.. Ekstrak tajuk 500 ppm memiliki kadar MDA sebesar 8.632 µM sedangkan akar pada konsentrasi 500 ppm sebesar 11.046 µM. Begitu juga pada 3 konsentrasi lainnya, ekstrak tajuk lebih mampu menahan laju pembentukan MDA dibandingkan ekstrak akar.
Konsent rasi MDA dari tiap -tiap perlakuan dapat dilihat pada G ambar 8. Kontrol negatif ternyata menghasilkan konsentrasi MDA yang sangat tinggi sekali (30.517µM), ini terjadi karena pada kontrol negatif tidak ada senyawa yang berperan untuk menahan laju pembentukan MDA. Sedangkan kontrol positif (vitamin E) memiliki kadar MDA terendah dibandingkan perlakuan lainnya (6.834µM). Dari gambar tersebut dapat dikatakan bahwa kontrol positif memang berperan lebih baik dalam menahan terbentuknya MDA dibandingkan ekstrak tajuk dan akar rumput mutiara yang digunakan. Hal ini menunjukkan bahwa adanya perlakuan dapat menghambat proses oksidasi sehingga mengurangi konsentrasi MDA yang terbentuk.
Gambar 8 Kadar MDA (µM) dari ekstrak tajuk dan akar pada beberapa tingkatan konsentrasi (ppm).
Aktivitas suatu bahan sebagai antioksidan sangat dipengaruhi oleh konsentrasi dan ketahanannya terhadap berbagai faktor fisik dan kimia. Antioksidan yang ideal memiliki aktivitas yang baik pada konsentrasi yang rendah dan memiliki daya tahan yang baik pula terhadap perubahan kondisi seperti suhu, pH, cahaya dan oksigen (Coppen 1983). Menurut Gordon 1990, ekstrak suatu bahan yang berperan sebagai antioksidan dapat berubah sifatnya menjadi prooksidan jika berada dalam konsent rasi yang terlalu besar. Aktivitas penghambatan (% inhibisi) terhadap pembentukan MDA dari tiap perlakuan juga dapat dihitung dari kadar MDA yang diperoleh (Gambar 9). Persentase inhibisi ini menggambarkan seberapa besarkah potensi dari masing-masing ekstrak dengan berbagai tingkatan konsentrasi dalam berperan sebagai antioksidan.
Persentase inhibisi (penghambatan) dari gambar dapat dilihat bahwa semakin besar konsentrasi ekstrak maka semakin besar pula aktivitas penghambatannya terhadap proses oksidasi asam linoleat. Dari gambar juga dapat dilihat bahwa kontrol negatif sama sekali tidak memiliki aktivitas penghambatan (0%), sedangkan kontrol positif dapat menghambat terjadinya proses ok sidasi yang lebih baik dari ekstrak tajuk dan akar rumput mutiara. Kontrol positif memiliki aktivitas penghambatan sebesar 77.61% Persentase inhibisi meningkat secara kontinu seiring dengan peningkatan konsentrasi ekstrak. Aktivitas inhibisi (penghambatan) ekstrak tajuk pada konsentrasi 50, 100, 200 dan 500 ppm masing-masing adalah 45.21%, 54.96%, 61.78%, dan 71.74%. Selanjutnya untuk
Gambar 9 Persentase ekstrak tajuk dan akar rumput mutiara dalam menahan laju oksidasi. 0 5 10 15 20 25 30 35 kadar MDA (µM)
50 100 200 500 k- k+
perlakuan (ppm) Kontrol negatif Kontrol positif Akar Tajuk 0 10 20 30 40 50 60 70 80 % inhibisi
50 100 200 500 k- k+
perlakuan (ppm)
Kontrol negatif Kontrol positif
11
ekstrak akar berturut-turut dari konsentrasi yang rendah adalah 39.56%, 52.88%, 58.48%, dan 63.81%. Dari hasil yang diperoleh tersebut secara umum ekstrak tajuk memiliki kemampuan menghambat pembentukan MDA yang lebih baik dibandingkan dengan ekstrak akar. Pada gambar dan hasil yang diperoleh terlihat bahwa ekstrak tajuk 500 ppm memiliki % inhibisi yang mendekati % inhibisi dari kontrol positif.
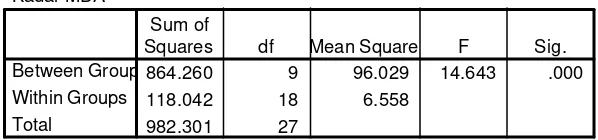
Hasil analisis statistik dengan uji Duncan (a=0.05) pada Tabel 3 diperoleh bahwa potensi antioksidasi dari ekstrak tajuk 500 ppm, tajuk 200 ppm dan akar 500 ppm tidak berbeda nyata dengan kontrol positif (lihat variabel a pada tabel). Berdasarkan hasil tersebut berarti ekstrak tajuk 500 ppm, 200 ppm, dan akar 500 ppm memiliki aktivitas antioksidasi yang sama besar dengan vitamin E. Dan memiliki kemampuan sebagai ant ioksidasi yang lebih baik dibanding ekstrak tajuk dan akar pada konsentrasi yang lebih rendah lagi.
Ekstrak tajuk 500 dan 200 ppm juga tidak berbeda nyata dengan ekstrak akar 500 dan 200 ppm (variabel b) . Ekstrak tajuk 500 ppm memiliki nilai yang berbeda nyata dengan ekstrak tajuk dan akar 100 dan 50 ppm. Sedangkan ekstrak akar 500 ppm berbeda nyata dengan ekstrak tajuk dan akar 50 ppm. Hasil uji Duncan menunjukkan bahwa kontrol negatif berbeda nyata dengan semua perlakuan.
Tabel 3 H asil analisis kadar MDA denga n uji Duncan
perlakuan Kadar MDA (µ M) K + 6.8340a T500 8.6227a,b A500 11.0457a,b,c T200 11.6633a,b,c,d
A200 12.6713b,c,d T100 13.7447c,d,e A100 14.3787c,d,e T50 16.7203d,e A50 18.4440e
K - 30.5170f Keterangan:
perlakuan yang memiliki variabel yang sama berarti tidak berbeda nyata.
SIMPULAN DAN SARAN
Simpulan
Ekstrak tajuk (kadar air 18.55%) dan akar (kadar air 12.55%) rumput mutiara berpotensi
secara in vitro sebagai antioksidan berdasarkan kemampuannya dalam menahan laju pembentukan MDA. Berdasarkan hasil penelitian ini, aktivitas antioksidasi maksimum terdapat pada ekstrak tajuk 500 ppm. Ekstrak tajuk 200 ppm memiliki aktivitas antioksidasi setara dengan kontrol positif 200 ppm.Ekstrak tajuk memiliki kemampuan menahan laju oksidasi lebih baik daripada ekstrak akar rumput mutiara.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui secara pasti senyawa bioaktif yang berperan sebagai antioksidan. Selain itu, perlu dilakukan analisis potensi antioksidasi tajuk dan akar rumput mutiara dengan berbagai metode baik secara in vitro maupun in vivo.
DAFTAR PUSTAKA
Andarwulan N, Fardiaz D.1994. Isolasi dan K arakterisasi A ntioksidan A lami dari Jinten (Cuminum cyminum Linn.). Bogo r: Fakultas Teknologi Pertanian IPB.
Adawiyah DR, Sarastani D, Fardiaz D. 2001. Kajian Aktivitas Antioksidan Biji Buah Atung (Parinarium glaberimum Hassk). Bogor: Fakultas Teknologi Pertanian IPB .
[anonim]. 2005. Rumput mutiara.
http://www.iptek.net.id/ind/pd_tanobat/vie w .php?id=54. [2 Maret 2006].
Chen HM, Koji M, Fumio Y, Kiyoshi N. 1996. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein. J. Agric. Food. Chem. 44: 2619-2623.
Coppen PP. 1983. The use of antioxidant. Di dalam: Allen JC dan Hamilton RJ, editor. Rancidity in Foods. London: Applied Science Publishers.
Dalimartha S. 2005. Ramuan Tradisional untuk Pengobatan Hepatitis. Jakarta: Penebar Swadaya.
12
[DepKes BPPK] Departemen Kesehatan, Badan Penelitian dan Pengembangan Kesehatan. 1999. Inventaris Tanaman Obat Indonesia (V). Jakarta: Bakti Husada.
Fardiaz D. 1996. Antioksidan non gizi bahan pangan penangkal senyawa radikal. Di dalam: Zakaria FR, R dewanti, S Yasni, editor. Prosiding Seminar Senyawa Radikal dan Sistem Pangan: Reaksi Biomolekuler, Dampak Terhadap Kesehatan dan Penangkalan. Jakarta: Kerjasama Pusat Studi Pangan dan Gizi dan Kedutaan Besar Prancis.
Gordon MH. 1990. The mechanism of antioxidant action in vitro. Di dalam: Hudson BJF, editor. Food Antioxidants. New York: Elseviere Applied Science.
Halliwell B, Gutteridge JMC. 1989. Free Radical In Biology and Madicine. Ed ke-2. New York: Oxford University press.
Harbone JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolihin S, editor. Bandung: ITB press. Terjemahan dari: Phytochemical Methode.
Harjadi W. 1990. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hernani, Rahardjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta: Penebar Swadaya.
Irma, Gilang. 2005. Tanaman obat untuk penderita kanker.
http://www.fk.unpad.ac.id/jsp/berita-detil.jsp?id_berita=O020820052. [2 Maret 2006].
Kikuzaki H, Nakatani N. 1993. Antioxidant effect of some ginger constituents. Journal of Food Science 58 (6): 1407-1410.
Kochhar SP, Rossell JB. 1990. Detection, estimation and evaluation of antioxidant in food systems. Di dalam: Hudson BJF, editor. Food Antioxidants. New York: Elseviere Applied Science.
Koessitoresmi A. 2002. Kapasitas antioksidan ekstrak batang dan daun cincau hijau (Cyclea barbata L. Miers.) pada sel limfosit manusia secara in vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Kumalaningsih S. 2006. Antioksidan Alami. Surabaya: Trubus Agrisarana.
Kurtubi M. 2005. Potensi ekstrak bawang dayak (Eleutherine palmifolia (L) Merr) sebagai antioksidan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kusuma FR, Zaky BM. 2005. Tumbuhan Liar Berkhasiat Obat. Jakarta: Agromedia Pustaka.
Langseth L. 2000. Antioxidant and their effect on health. Di dalam: Schmidl MK, P Labuza, editor. Essentials of Functional Food. Maryland: An Aspen Publication.
Mattjik AA. 2002. Rancangan Percobaan. Bogor: IPB press.
Murray RK et al. 2003. Biokimia Harper. Andry Hartono, penerjemah. Jakarta: Penerbit Buku Kedokteran EGC.
Nawar WW. 1996. Lipids. Di dalam: Femena RO, editor. Food Chemistry. New York: Marcel Dekker
Permadi A. 2006. Tanaman Obat Pelancar Air Seni. Jakarta: Penerbar Swadaya.
Pratt DE, Hudson BJF. 1990. Natural antioxidant not exploited commercially. Di dalam: Hudson BJF, editor. Food Antioxidant. London: Elseviere Applied Science.
Pratt DE. 1992. antioxidant from natural plant material. Di dalam: Huang MT, Lee CY, editor. Phenolic Compounds in Food and Their Effect on Health II:Antioxidant and Cancer Prevention. Washington DC: American Chem. Soc.
Sarastani D. 2001. Kajian aktivitas antioksidan dari biji atung (Parinarium glaberrimun Hassk.) [tesis]. Bogor: Progam Pascasarjana, Institut Pertanian Bogor.
13
(Scheff). Boerl) [skripsi]. Bogor: Fakultas Matematika dan Pengetahuan Alam, Institut Pertanian Bogor.
Schuler P. 1990. Natural antioxidants exploited commercially. Di dalam: Hudson BJF, editor. Food Antioxidants. New York: Elseviere Applied Science.
Septiana AT. 2001. Aktivitas ekstrak jahe (Zingiber officinale Roscoe) dalam pencegahan oksidasi lipoprotein densitas rendah (LDL) dan akumulasi koleterol pada makrofag secara in vitro [tesis]. Bogor: Progam Pascasarjana, Institut Pertanian Bogor.
Soenanto H, Kuncoro S. 2005. Hancurkan Batu Ginjal Dengan Tanaman Herbal. Jakarta: Puspa Swara.
Sudewo B. 2004. Tanaman Obat Populer Pengempur Aneka Penyakit. Jakarta: Agromedia pustaka.
Supari F. 1996. Radikal bebas dan patofisiologi beberapa penyakit. Di dalam: Zakaria FR, Dewanti R, Yasni S, editor. Prosiding Seminar Senyawa Radikal dan Sistem Pangan: Reaksi Biomolekuler, Dampak Terhadap Kesehatan dan Penangkalan. Jakarta: Kerjasama Pusat Studi Pangan dan Gizi dan Kedutaan Besar Prancis.
Wijayakusuna H. 2004. Atasi Kanker Dengan Tanaman Obat. Jakarta: Puspa Swara.
Yagi K. 1994. Lipid peroxides and related radicals in clinical medicine. Di dalam: Free Radical in Diagnostic Medicine. New York : Plenum press.
14
15
Lampiran 1 Tahapan umum penelitian
Refluks: etanol 70% 2 jam,
70
oC
Rotavapor 50
oC
Oven 40
oC
Simplisia tajuk dan akar rumput
mutiara
ekstrak
Analisis kadar air
Ekstrak kasar
Larutan uji 50, 100,
200, 500 ppm
Vitamin E
(a-tokoferol) 200 ppm
Kontrol negatif tanpa
antioksidan
Uji TBA
Analisis
16
Lampiran 2 Penentuan kadar air tajuk dan akar rumput mutiara
dikeringkan
didinginkan
Lampiran 3 Analisis kadar air tajuk dan akar rumput mutiara
sampel ulan gan
Bobot wadah awal (g)
Bobot wadah +
sampel (g)
Bobot sampel (g)
Bobot sampel setelah dikeringkan
(g)
Kadar air (%)
Tajuk segar 1 33.7160 35.7469 2.0309 0.2868 85.88 2 36.3084 36.3084 2.0502 0.2753 86.57 Akar segar 1 35.7018 35.7018 2.0141 0.2758 86.31 2 36.2640 36.2640 2.0153 0.2635 86.93 Tajuk simplisia 1 30.5576 32.6217 2.0641 1.6836 18.43 2 32.1058 34.1816 2.0758 1.6882 18.67 Akar simplisia 1 2 32.2837 33.3734 34.2973 35.3778 2.0136 2.0044 1.7657 1.7600 12.31 12.19 Contoh perhitungan:
Kadar air tajuk segar = bobot sampel – bobot sampel setelah dikeringkan x 100% Bobot sampel
= 2.0309 – 0.2868 x 100% = 85.8 8 % 2.0309
Kadar air rata-rata : Tajuk segar = 86.23 % Akar segar = 86.62 % Tajuk semplisia = 18.55 % Akar simplisia = 12.25 % + 2 g tajuk dan akar
segar rumput mutiara
Cawan porselin
+ 2 g simplisia
tajuk
dan akar rumput mutiara Oven T=105oC, t= 30 meniteksikator
Ditimbang sampai diperoleh bobot konstan
eksikator
Ditimbang sampai diperoleh bobot konstan
Oven T=105oC, t= 3 jam Oven T=105oC, t= 3 jam
eksikator
17
Lampiran 4 Prosedur ekstraksi tajuk dan akar rumput mutiara
Refluks etanol 70%, 2 jam, 70oC
Rotavapor 50oC Oven 40oC
Lampiran 5 Rendemen hasil ekstraksi rumput mutiara dengan etanol 70%
Sampel Bobot sampel (g) Bobot ekstrak (g) Rendemen (%) Tajuk 20.0004 3.9021 19.51 Akar 18.2495 2.9315 16.06 Contoh perhitungan:
Rendemen (%) = bobot ekstrak (g) x 100% Bobot sampel (g) = 3.9021 x 100%
20.0004 = 19.51 %
Lampiran 6 Analisis hidroperoksida asam linoleat dengan metode tiosianat
+ 2 mL buffer fosfat 0.1 M pH 7
+ 2 mL asam linoleat 50 mM dalam etanol 99.8% + 1 mL air bebas ion
+ 6 mL etanol 75%
+ 50 µL ammonium tiosianat 30% + 50 µL FeCl2 0.02 M dalam HCl 3.5%
Simplisia tajuk dan rumput
mutiara
filtrat
Ekstrak kasar
Simpan dalam freezer
Botol gelap berulir
Inkubasi 40oC Selama 3 menit
Larutan diatas dipipet sebanyak 50 µL
Diamkan 3 menit
18
Lampiran 7 Nilai absorbansi hidroperosida asam linoleat pada ? 492 nm
Hari ke- Absorbansi rerata
1 2 3
0 0.311 0.419 0.205 0.312 1 0.534 0.783 0.453 0.590 2 0.663 0.976 0.585 0.741 3 0.954 1.029 0.982 0.988 4 1.004 1.119 1.221 1.115
5 1.525 1.477 1.223 1.408
6 0.628 0.660 0.508 0.599 7 0.478 0.510 0.487 0.492 8 0.278 0.473 0.374 0.375
Lampiran 8 Analisis potensi antioksidan dengan metode TBA
Pembuatan kurva standar TMP
pengenceran
+ 2 mL TCA 20%
+ 2 mL TBA 1% dalam asam asetat 50%
Inkubasi 100oC selama 10 menit Didinginkan
Tetrametoksi propana 6M
0.15 µM 0.3 µM 0.6 µM 0.75 µM 1.5 µM 3.0 µM
Tiap larutan dipipet 1 mL
Tabung reaksi
Sentrifugasi 3000 rpm, t= 15 menit
19
Lanjutan
Pengukuran konsentrasi malondialdehida dengan metode TBA
Inkubasi 40oC sampai 2 hari setelah absorbansi maksimum
+ 2 mL TCA 20%
+ 2 mL TBA 1% dalam asam asetat 50%
Inkubasi 100oC selama 10 menit Didinginkan
Lampiran 9 Hasil analisis aktivitas antioksidan metode TBA
Absorbansi larutan standar TMP (1.1.3.3-tetrametoksipropana) konsentrasi TMP (µM) serapan rerata
1 2
0.00 0.000 0.000 0.000 0.15 0.006 0.006 0.006 0.30 0.010 0.008 0.009 0.60 0.014 0.014 0.014 0.75 0.015 0.016 0.016 1.50 0.037 0.035 0.036 3.00 0.063 0.061 0.062
Catat an :
Persamaan kurva standar yang dihasilakn dihasilkan digunakan untuk
menentukan konsentrasi M D A
Gambar 11 kurva standar TMP Larutan uji 50, 100,
200, 500 ppm
Kontrol negatif tanpa antioksidan
Pembanding vitamin E 200 ppm
Tiap larutan dipipet 1 mL
Tabung reaksi
Sentrifugasi 3000 rpm t= 15 menit
Diukur absorbansi pada ? 532 nm
y = 0.0205x + 0.0019
R2 = 0.9921
0.00 0.01 0.02 0.03 0.04 0.05 0.06 0.07
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50
konsentrasi (µM)
20
Lanjutan
Konsentrasi MDA dan aktivitas antioksidasi rumput mutiara
Perlakuan ulangan rerata kadar MDA (µM) aktivitas (% inhibisi)
1 2 3
blanko 0.000 0.000 0.000 0.000 0.000 100.00
k- 0.551 0.704 - 0.628 30.517 0.00
k+ 0.115 0.169 - 0.142 6.834 77.61
A50 0.325 0.307 0.508 0.380 18.444 39.56
A100 0.314 0.294 0.282 0.297 14.379 52.88
A200 0.227 0.283 0.275 0.262 12.672 58.48
A500 0.215 0.221 0.249 0.228 11.046 63.81
T50 0.343 0.376 0.315 0.345 16.720 45.21
T100 0.274 0.263 0.314 0.284 13.745 54.96
T200 0.184 0.255 0.284 0.241 11.663 61.78
T500 0.171 0.183 0.182 0.179 8.623 71.74
Catatan:
k- = Kontrol negatif (tanpa perlakuan) k+ = Kontrol positif (Vitamin E 200 ppm) A50 = Akar 50 ppm
T50 = Tajuk 50 ppm
[image:30.612.138.437.563.633.2]
Gambar 12 Hasil reaksi TBA dan MDA yang dihambat oleh ekstrak.
Lampiran 10 Hasil uji ANOVA dan Duncan untuk rerata konsentrasi MDA tiap
perlakuan dengan selang kepercayaan 95%
ANOVA
Kadar MDA
864.260 9 96.029 14.643 .000
118.042 18 6.558
982.301 27
Between Groups Within Groups Total
Sum of
21
Lanjutan
Uji Duncan untuk rerata kadar MDA tiap perlakuan
perlakuan N Subset for alpha = 0.05
a b c d e f
Kontrol + 2 6.83400
T500 3 8.62267 8.62267
A500 3 11.04567 11.04567 11.04567
T200 3 11.66333 11.66333 11.66333 11.66333 A200 3 12.67133 12.67133 12.67133
T100 3 13.74467 13.74467 13.74467 A100 3 14.37867 14.37867 14.37867
T50 3 16.72033 16.72033
A50 3 18.44400
Kontrol - 2 30.51700
Sig. .057 .106 .187 .051 .063 1.000