EKSTRAK ETANOL RUMPUT MUTIARA (
Hedyotis
corymbosa
(L.) Lam.
)
SEBAGAI ANTIHEPATOTOKSIK
PADA TIKUS PUTIH YANG DIINDUKSI PARASETAMOL
LUSIANA ALAWIYAH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
LUSIANA ALAWIYAH. Ekstrak Etanol Rumput Mutiara (
Hedyotis corymbosa
(L.)
Lam
)
sebagai Antihepatotoksik pada Tikus Putih yang Diinduksi Parasetamol.
Dibimbing oleh ANNA P. ROSWIEM dan EMAN KUSTAMAN.
Rumput mutiara merupakan rumput liar yang digunakan sebagai obat tradisional
dan diduga berpotensi sebagai antihepatotoksik. Penelitian ini dilakukan untuk
membuktikan potensi antihepatotoksik tanaman rumput mutiara. Tanaman rumput
mutiara diekstraksi dengan pelarut etanol 70%. Hasil ekstraksi diperoleh nilai rendemen
sebesar 30.06%. Ekstrak kasar rumput mutiara diidentifikasi dengan uji fitokimia,
mempunyai senyawa metabolit sekunder di antaranya alkaloid, flavonoid, saponin,
tanin, dan steroid.
ABSTRACT
LUSIANA ALAWIYAH. Ethanol Extract of Pearl Grass (
Hedyotis corymbo
sa (L.)
Lam) as Antihepatotoxic on White Rat which is Induced by Paracetamol. Under the
direction of ANNA P. ROSWIEM and EMAN KUSTAMAN.
Pearl grass (
Hedyotis corymbo
sa (L.) Lam) is well-recognized as traditional
medicine and predicted having antihepatotoxic potency. This research is conducted to
prove that pearl grass have antihepatotoxic effect. Pearl grass was extracted with
ethanol solution 70 % and rendemen value is 30.16%. The identification of
phytochemical test of crude extract of pearl grass, it’s has secondary metabolite
compound such as alkaloid, flavonoid, saponin, tannin, and steroid.
EKSTRAK ETANOL RUMPUT MUTIARA (
Hedyotis
corymbosa
(L.) Lam
.)
SEBAGAI ANTIHEPATOTOKSIK
PADA TIKUS PUTIH YANG DIINDUKSI PARASETAMOL
LUSIANA ALAWIYAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains
pada Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul skripsi
: Ekstrak Etanol Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam.)
sebagai Antihepatotoksik pada Tikus Putih yang Diinduksi
Parasetamol
Nama
: Lusiana Alawiyah
NIP
: G44103007
Disetujui
Komisi Pembimbing
Dr. Anna P Roswiem, M.S.
Ir. Eman Kustaman.
Ketua Anggota
Diketahui
.
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan penulisan karya ilmiah ini. Tema
yang dipilih dalam penelitian ini ialah khasiat dari tanaman rumput mutiara sebagai
antihepatotoksik, dengan judul Ekstrak Etanol Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam.) sebagai Antihepatotoksik pada Tikus Putih yang Diinduksi Parasetamol.
Penelitian ini dilaksanakan mulai bulan Mei sampai Agustus 2007 di Laboratorium
Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Anna P Roswiem, M.S selaku
pembimbing utama, Ir. Eman Kustaman selaku pembimbing kedua. Terima kasih juga
penulis ucapkan kepada seluruh staf Laboratorium Biokimia, dan semua teman-teman
di Biokimia. Ungkapan terima kasih yang sedalam-dalamnya penulis sampaikan kepada
keluarga besar dan suamiku yang telah memberikan dukungan moril, materil, doa dan
kasih sayangnya.
Penulis menyadari dalam penulisan usulan penelitian ini masih jauh dari
sempurna. Semoga usulan penelitian ini dapat bermanfaat bagi kita semua. Semoga
karya ilmiah ini dapat bermanfaat.
Bogor, Desember 2007
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 15 Juli 1985 sebagai anak pertama
dari dua bersaudara pasangan Ade Juandi dan Euis Herawati.
Tahun 2003 penulis lulus dari SMU Negeri 2 Sukabumi dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada
Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam
.
) ... 1
Organ Hati dan Fungsinya ... 2
Parasetamol ... 2
SGOT dan SGPT ... 3
BAHAN DAN METODE
Bahan dan Alat ... 4
Ekstraksi Tanaman Rumput Mutiara (
Hedyotis corymbosa
(L.) Lam.) 4
Uji Fitokimia ... 4
Pembuatan Dosis Ekstrak Rumput Mutiara... 4
Hewan Coba dan Rancangan Percobaan ... 5
Penimbangan Berat Badan dan Analisis SGPT, SGOT ... 5
Analisis Data Statistik ... 5
PEMBAHASAN
Ekstraksi ... 5
Uji Fitokimia ... 6
Hepatotoksik Parasetamol ... 6
Uji Antihepatotoksik ... 7
Bobot Badan ... 8
SIMPULAN ... 9
SARAN ... 9
DAFTAR PUSTAKA ... 9
DAFTAR GAMBAR
Halaman
1
Tanaman rumput mutiara (
Hedyotis corymbosa
(L.) Lam.) ... 2
2
Struktur parasetamol ... 3
3
Tikus Percobaan
Spraque-Dawley
... 5
4
Kadar SGPT rata-rata tikus selama perlakuan... 8
5
Kadar SGOT rata-rata tikus selama perlakuan ... 8
6
Rataan bobot badan tikus selama perlakuan ... 9
DAFTAR LAMPIRAN
Halaman
1
Tahapan penelitian ... 12
2
Ekstraksi rumput mutiara ... 13
3
Rendemen hasil ekstraksi rumput mutiara ... 13
4
Dosis parasetamol dan ekstrak rumput mutiara ... 14
5
Contoh perhitungan kadar SGPT dan SGOT ... 14
6
Daftar bobot badan tikus selama perlakuan ... 15
7
Kadar SGPT tikus pada masa perlakuan ... 16
8
Kadar SGOT tikus pada masa perlakuan ... 18
9
Hasil analisis ragam dan annova SGPT program SAS... 19
10 Hasil analisis ragam dan annova SGOT program SAS ... 22
PENDAHULUAN
Seiring dengan berkembangnya penggunaan tanaman obat dalam kesehatan dengan semboyan “back to nature”, keingintahuan masyarakat terhadap khasiat dan manfaat tanaman obatpun semakin berkembang. Saat ini masyarakat mulai menyadari bahwa pemakaian bahan kimia sering menimbulkan efek samping, sehingga lebih memilih menggunakan bahan alami yang berasal dari tumbuhan. Obat tradisional dan tanaman obat banyak digunakan masyarakat menengah ke bawah terutama dalam upaya preventif, promotif dan rehabilitasi.
Senyawa fitokimia sebagai senyawa kimia yang terkandung dalam tanaman mempunyai peranan yang sangat penting bagi kesehatan termasuk fungsinya dalam pencegahan terhadap berbagai penyakit degeneratif dan penyakit infeksi. Beberapa senyawa fitokimia yang diketahui mempunyai fungsi fisiologis adalah karotenoid, fitosterol, saponin, glikosinolat, polifenol, inhibitor protease, monoterpen, fitoestrogen, turunan senyawa flavonoid, sulfida, alkaloid, dan asam fitat.
Penyakit hati atau yang lebih dikenal sebagai hepatitis merupakan suatu proses peradangan pada jaringan hati. Penyebab timbulnya kerusakan fungsi hati ini dapat disebabkan oleh virus, bakteri, aflatoksin, konsumsi alkohol yang berkepanjangan serta obat-obatan. Hati merupakan organ yang sangat penting dan memiliki aneka fungsi dalam proses metabolisme sehingga organ ini sering terpajan zat kimia. Zat kimia tersebut akan mengalami detoksikasi dan inaktivasi sehingga menjadi tidak berbahaya bagi tubuh. Kerusakan hati karena obat dan zat kimia dapat terjadi jika cadangan daya tahan hati berkurang dan kemampuan regenerasi sel hati hilang dan selanjutnya akan mengalami kerusakan permanen sehingga dapat fatal.
Berbagai upaya pengobatan gangguan fungsi hati secara klinis telah dilakukan, namun cara ini membutuhkan pengeluaran biaya yang mahal dan menyebabkan efek samping yang merugikan. Oleh karena itu, penelitian mulai dialihkan pada pengobatan tradisional yang dapat dijangkau masyarakat. Secara tradisional. Banyak jenis tumbuhan yang digunakan karena aktivitas antihepatotoksiknya sebagai obat peradangan hati, salah satunya adalah rumput mutiara (Hedyotis corymbosa (L.). Masyarakat
menggunakan tanaman tersebut dengan cara meminum air rebusannya.
Penggunaan parasetamol sebagai model penelitian karena pemberian parasetamol dosis berlebihan dan dalam jangka waktu yang lama dapat menimbulkan kerusakan sel hati secara konsisten. Hepatotoksisitas adalah istilah yang dipakai untuk menggambarkan kerusakan pada hati akibat penggunaan obat. Hepatotoksik dari parasetamol pada manusia dapat terjadi pada pemberian dosis tunggal 10-15 g (200-250 mg/kgBB). Gejala pada hari pertama keracunan akut parasetamol tidak mencerminkan bahaya yang mengancam. Anoreksia, mual dan muntah serta sakit perut terjadi 24 jam pertama dan dapat berlangsung selama seminggu atau lebih. Gangguan fungsi hati terjadi dalam waktu 24 jam dan mencapai puncak lebih kurang 4 hari setelah pemberian obat tersebut (Boyer & Rouff 1977). Donatus dan Susana (1992) menyatakan bahwa dosis parasetamol 250 mg/kgBB telah memberikan efek hepatotoksik yang nyata (P<0.05) pada mencit percobaan.
Penelitian ini bertujuan untuk menguji efek pemberian ekstrak etanol rumput mutiara sebagai antihepatotoksik terhadap penurunan kadar SGOT dan SGPT tikus putih yang diinduksi parasetamol dosis tinggi. Hasil penelitian ini diharapkan bermanfaat dalam menambah informasi ilmiah mengenai pemanfaatan rumput mutiara dalam mengobati penyakit hati. Hipotesis dari penelitian ini adalah pemberian ekstrak etanol 70% rumput mutiara dapat menurunkan kadar SGOT dan SGPT tikus putih yang diinduksi parasetamol dosis hepatotoksik.
TINJAUAN PUSTAKA
Rumput Mutiara (Hedyotis corymbosa (L.) Lam.)
Rumput mutiara (Hedyotis corymbosa
(L.) Lam. ) mempunyai nama sinonim, yaitu
Oldenlandia corymbosa L. atau Hedyotis corymbosa L. (DepKes BPPK 1999).
Rumput mutiara ini tumbuh rindang berserak, berupa semak, batang tegak, berbulu, agak lemah, tinggi 15-50 cm, tumbuh subur pada tanah lembab di sisi jalan, pinggir selokan dan cukup sinar matahari, 1 batang bersegi dan mempunyai banyak percabangan. Daun berhadapan bersilang, tangkai daun pendek/hampir duduk, berbentuk lanset, dan berwarna hijau panjang daun 2 - 5 cm, ujung runcing, tulang daun satu di tengah dan ujung daun mempunyai rambut yang pendek. Bunga ke luar dari ketiak daun, bentuknya seperti payung berwarna putih, berupa bunga majemuk 2-5, tangkai bunga (induk) keras seperti kawat, panjangnya 5-10 mm. Buahnya bulat, berwarna coklat dan ujungnya pecah-pecah (Anonim 2005) ditunjukan pada Gambar 1.
Menurut Kusuma dan Zazky (2005), bagian tanaman yang digunakan sebagai obat, yaitu seluruh tanaman, segar atau yang dikeringkan. Sifat kimiawi dan efek farmakologisnya diantaranya rasa manis, tawar, sedikit pahit, netral, lembut dan sejuk agak dingin (Dalimarta 2006; Kusuma & Zaky 2005). Kandungan kimia yang terkandung dalam rumput mutiara diantaranya hentriakontan, stigmasterol, asam ursolat, asam oleanolat, Beta-sitosterol, sitosterol-D-glukosida, p-asam kumarat, flavonoid glikosida, baihuasheshecaosu (analog kumarin), iridoid glikosida, alizarin, krorogenin, dan ikatan antragalol (Wijaya 2004; Soenanto & Kuncoro 2005).
Rumput mutiara memiliki khasiat sebagai antiradang (antiinflamasi), diuretik, antipiretik, antitoksin, antikarbunkular (menyembuhkan bisul), memperlancar sumbatan sperma (Kusuma & Zaky 2005 ; trubus 2005), meningkatkan daya fagositosis sel darah putih dan imunitas hormonal (Dalimarta 2005). Rumput ini juga dapat mengobati berbagai penyakit, seperti hepatitis, radang kandung empedu, hipertensi, tonsilis, brochitis, gondongan, pneumonia, radang usus buntu, infeksi saluran kemih, radang panggul, infeksi saluiran kemih, bisul dan borok (Anonim 2005, Permadi 2006).
Gambar 1 Tanaman Rumput Mutiara (Hedyotis Corymbosa (L.) Lam)
Organ Hati dan Fungsinya
Hati merupakan organ tempat proses metabolisme terbesar dan terpenting dalam tubuh. Letaknya di perut bagian kanan, di belakang tulang iga. Sebagai organ terbesar di antara organ dalam lain, hati berbobot sekitar 1/36 berat badan orang dewasa, atau kira-kira 1.200-1.600 gram. Normalnya, hati berukuran selebar telapak tangan pemiliknya atau 7-10 cm. Hati memiliki beberapa fungsi penting, yaitu pembentukan dan ekskresi cairan empedu, fungsi metabolik, pertahanan tubuh, dan tempat detoksifikasi berbagai macam zat toksik.. Empedu dibentuk oleh hati. Sekitar satu liter cairan empedu diekskresikan (dikeluarkan) oleh hati setiap hari. Garam empedu yang dihasilkan penting untuk pencernaan dan penyerapan lemak dalam usus halus. Garam ini sebagian diserap kembali oleh usus halus dan dialirkan ke hati.
Hati terlibat dalam sintesis, penyimpanan dan metabolisme banyak senyawa endogen dan klirens senyawa eksogen, termasuk obat dan toksin yang lain dari tubuh (Kenward & Chik 2003). Sebagian besar racun memasuki tubuh melalui sistem gastrointestinal, dan setelah diserap racun dibawa oleh vena vorta hati ke hati. Hati akan mengubah senyawa racun menjadi kurang toksik dan lebih mudah larut air (Casarett & Doull’s 1989). Senyawa racun dapat menyebabkan berbagai jenis efek toksik pada berbagai organel dalam sel hati sehingga dapat menyebabkan kerusakan hati, seperti steatosis, kolestasis, nekrosis, dan sirosis.
Steatosis (perlemakan hati) adalah hati yang mengandung berat lipid lebih dari 5%. Toksin dari tetrasiklin dapat menyebabkan butiran lemak dalam suatu sel, sedangkan etanol dapat menyebabkan butiran lemak besar yang menggantikan inti, yang paling umum adalah mekanisme rusaknya pelepasan trigliserida hati ke plasma. Nekrosis adalah kematian hepatosit dan merupakan suatu manifestasi akut yang berbahaya tetapi tidak terlalu kritis karena hati mempunyai kapasitas pertumbuhan kembali (Lu 1995). Sirosis adalah suatu kondisi di mana jaringan hati yang sehat digantikan oleh jaringan parut. Akibatnya, aliran darah menuju hati menjadi terhambat, sehingga fungsi hati pun menjadi terganggu.
Parasetamol
antipiretik. Struktur parasetamol ditunjukkan pada Gambar 3. Parasetamol memberikan efek yang sangat baik dan aman jika digunakan dalam dosis pengobatan yang tepat. Clark (1973) menyatakan bahwa penggunaan parasetamol secara terus menerus dalam dosis tinggi dapat menyebabkan kerusakan hati karena terbentuknya ikatan antara makromolekul sel hati dengan metabolit intermediet parasetamol. Toksisitas parasetamol akan berbeda pada setiap spesies. Penurunan jumlah glutation jaringan hati lebih peka terhadap hewan-hewan yang peka terhadap keracunan parasetamol dibandingkan pada binatang yang tidak peka walaupun diberikan dosis parasetamol yang sama (Davis
et al. 1976).
Menurut Goodman dan Gilman’s (1980), parasetamol dimetabolisme terutama oleh enzim mikrosomal hati. Parasetamol mengalami biotranformasi di hati dan sebagian besar dieksekresikan setelah berkonjugasi dengan glukuronat (60%), asam sulfat (3%) dan sistein (3%). Jika mengkonsumsi dalam dosis yang tinggi, maka parasetamol ikut mengalami N-hidroksilasi dengan secara spontan mengalami dehidratasi membentuk metabolit N-asetil-p-benzoquinone yang bersifat hepatotoksik. Masih menurut Goodman dan Gilman’s, hepatotoksis dapat terjadi setelah mengkonsumsi dosis tunggal 10-15 g (200-250 mg/kg) parasetamol. Dosis di atas (200-250 mg/kg secara potensial sangat fatal. Indikasi klinik terhadap manifestasi kerusakan hati terjadi 2-6 hari setelah mengkonsumsi parasetamol dosis toksik.
Hipotesis mekanisme toksisitas parasetamol dibagi menjadi dua yaitu melalui antaraksi kovalen dan antaraksi nirkovalen. Antaraksi kovalen, terjadi karena pemberian parasetamol dosis toksik akan menguras kandungan GSH-sitosol sehingga N-asetil-p-benzokuinonimina (NAPBKI) akan berikatan secara kovalen dengan makromolekul protein sel hati, yang mengakibatkan terjadinya kerusakan sel (Gillette 1981; Tirmenstein & Nelson 1990), sedangkan antaraksi nirkovalen, melibatkan pembentukan radikal bebas N-asetil-p-semikuinonimina (NAPSKI), pembangkitan oksigen reaktif, anion superoksida serta gangguan homeostasis Ca
2+
, yang semuanya akan menyebabkan terjadinya kerusakan sel hati (Chan, Han & Kan 2001). Kematian sel terjadi bersama dengan pecahnya membran plasma, pada nekrosis, terjadi pembengkakan mitokondria, pembengkakan sitoplasma, penghancuran
organel dan inti, dan pecahnya membran plasma.
HN
OH C CH3 O
Gambar 2 Struktur parasetamol
SGPT dan SGOT
Jaringan hati mengandung enzim-enzim transaminase dalam jumlah yang besar seperti Glutamat Piruvat Transaminase (GPT) dan Glutamat Oksaloasetat Transaminase (GOT). Adanya kerusakan sel-sel parenkim hati atau permeabilitas membran akan mengakibatkan enzim GOT dan GPT, arginase, laktat dehidrogenase (LDH) dan gamma-glutamil transaminase (GGT) bebas keluar sel, sehingga enzim masuk ke pembuluh darah melebihi keadaan normal dan kadarnya dalam darah meningkat (Girindra 1986). Indikator yang lebih baik untuk mendeteksi kerusakan jaringan hati adalah SGPT dan SGOT, karena kedua enzim tersebut akan meningkat terlebih dahulu dan peningkatannya lebih nyata bila dibandingkan dengan enzim-enzim lainnya (Calbreath 1982). Kenaikan kadar transaminase dalam serum disebabkan oleh sel–sel yang kaya akan transaminase mengalami nekrosis atau hancur. SGPT adalah ukuran nekrosis hepatoseluler yang paling spesifik dan paling luas digunakan, SGOT bekerja serupa tetapi kurang spesifik (Sujono 2002).
Enzim GPT akan memindahkan gugus amino pada alanin ke gugus keto dari α -ketoglutarat membentuk glutamat dan piruvat. Selanjutnya piruvat diubah menjadi laktat. Reaksi tersebut dikatalisis oleh enzim laktat dehidrogenase (LDH) yang membutuhkan NADH dalam reaksi yang dikatalisisnya. Enzim GPT merupakan enzim yang spesifik ada pada hati. Persamaan reaksi dari aktivitas GPT dan LDH terlihat pada reaksi sebagai berikut:
α-ketoglutarat + L-alanin piruvat + L-glutamat piruvat + NADH +H+ L-laktat + NAD+
Enzim GOT mengkatalisis pemindahan gugus amino pada L-aspartat ke gugus keto dari α-ketoglutarat membentuk glutamat dan oksalat. Selanjutnya oksaloasetat diubah menjadi malat. Reaksi tersebut dikatalisis oleh enzim malat dehidrogenase (MDH) yang
membutuhkan NADH dalam reaksi yang dikatalisisnya. Persamaan reaksi aktivitas GOT sebagai berikut:
α-ketoglutarat + L-aspartat Lglutamat + oksaloasetat
oksaloasetat + NADH +H+ L-malat + NAD+ Enzim GOT tidak spesifik untuk disfungsi hati karena enzim ini juga ditemukan pada otot rangka, ginjal, dan pankreas.
BAHAN DAN METODE
Bahan dan Alat
Hewan uji yang digunakan adalah tikus putih jantan galur Spraque Dawley (bobot ± 150-180 g, umur 6 minggu), tanaman rumput mutiara yang diperoleh dari Balitro, parasetamol yang diproduksi Indo Farma, reagen kit GPT dan GOT merk HUMAN, air destilata, etanol 99.8% dan 70%, pakan standar tikus.
Peralatan yang digunakan dalam penelitian ini adalah kandang, alat-alat gelas,
stop watch, syringe, timbangan analitik, kertas saring, kuvet, vial, mikropipet, bulp, gegep, vorteks, oven, pH meter, eksikator, microfuge, rotavapor, penangas air, freezer, spektrofotometer, dan alat-alat bantu lainnya.
Metode Penelitian
Ekstraksi Tanaman Rumput Mutiara (Hedyotis Corymbosa (L.) Lam)
Keseluruhan bagian tanaman digunakan, sebanyak 5 kg dicuci sampai bersih, kemudian dikeringkan di udara terbuka sampai cukup kering selama kurang lebih 7 hari. Pengeringan selanjutnya dalam oven pada suhu 40-60 ºC lalu dibuat serbuk. Serbuk kering tanaman sebanyak 100 g diekstraksi secara maserasi menggunakan pelarut etanol 70% dengan perbandingan 1:10 selama 24 jam pada suhu ruang, sambil dikocok menggunakan inkubator bergoyang, maserasi ini dilakukan triplo. Setelah 24 jam sampel tersebut disaring untuk memisahkan filtrat dengan ampas. Masing-masing filtrat dievaporasi menggunakan evaporator vakum 40 oC untuk menguapkan ekstrak pekat yang diperoleh kemudian dikeringkan dengan oven pada suhu 40-60 ºC. Ekstrak yang diperoleh digunakan untuk uji fitokimia dan uji antihepatotoksik.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid dan Senyawa Fenolik. Sebanyak 0.1 g ekstrak ditambah metanol sampai terendam lalu dipanaskan. Filtratnya ditambah NaOH 10% atau H2SO4.
Terbentuknya warna merah karena penambahan NaOH 10% menunjukkan adanya senyawa fenolik hidrokuinon sedangkan warna merah yang terbentuk akibat penambahan H2SO4 pekat menunjukkan
adanya senyawa flavonoid.
Uji Alkaloid. Sebanyak 0.1 gram ekstrak etanol rumput mutiara ditambahkan 5 mL kloroform dan 3 tetes amoniak. Fraksi kloroform dipisahkan dan diasamkan dengan 2 tetes H2SO4 2M. Fraksi Asam dibagi
menjadi tiga tabung kemudian masing-masing ditambahkan pereaksi Dragendorf, Meyer dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan putih ada pereaksi Meyer, endapan merah pada perekasi Dragendorf, dan endapan coklat pada pereaksi Wagner.
Uji Tanin. Sebanyak 0.1 gram ekstrak etanol rumput mutiara ditambahkan 5 mL akuades kemudian dididihkan selama 5 menit. Kemudian disaring dan filtratnya ditambahkan dengan 5 tetes FeCl3 1% (b/v). Warna biru tua
atau hitam kehijauan yang terbentuk menunjukkan adanya tanin.
Uji Saponin. Sebanyak 0.1 gram ekstrak etanol rumput mutiara ditambahkan 5 mL akuades lalu dipanaskan selama 5 menit. Kemudian dikocok selama 5 menit. Busa yang terbentuk setinggi kurang lebih 1 cm dan tetep stabil setelah didiamkan selama 10 menit menunjukkan adanya saponin.
Uji Steroid dan Terpenoid. Sebanyak 0.1 gram ekstrak etanol rumput mutiara kotok ditambahkan 5 mL etanol 30% lalu selama 5 menit dipanaskan dan disaring. Filtratnya diuapkan kemudian ditambahkan dengan eter. Lapisan eter ditambahkan dengan pereaksi Liebermen Burchard (3 tetes asetat anhidrida dan 1 tetes H2SO4 pekat). Warna merah atau
ungu yang terbentuk menunjukkan adanya triterprnoid dan warna hijau menunujukkan adanya steroid.
Pembuatan Dosis Ekstrak Rumput Mutiara
Dosis ekstrak rumput mutiara yang digunakan adalah 400 mg/kgBB dan 800 mg/kgBB, hal ini berdasarkan penelitian Ardiningsih (1995) pada penggunaan dosis rumput laut Sargassum sp. Dosis 400 mg/kgBB dan 800 mg/kgBB kemudian dikonversikan dengan rendemen hasil ekstraksi yang diinduksikan ke tikus.
Hewan Coba dan Rancangan Percobaan
Rancangan percobaan yang akan digunakan adalah rancangan acak lengkap (RAL) dengan enam perlakuan dan lima kali ulangan. Hewan uji yang digunakan adalah tikus putih jantan galur Spraque-Dawley
dengan jenis kelamin jantan, sehat, mempunyai aktivitas normal, dengan berat badan ± 150-200 g, dan berumur ± 6 minggu (Gambar 4). Sebelum mendapatkan perlakuan, tikus diadaptasikan selama dua minggu untuk menyesuaikan kondisi fisiologis, menyeragamkan cara hidup dan makanannya, yaitu dengan memberi pakan standar dan air minum ad libitum. Selama perlakuan, tujuh minggu tikus diberi pakan standar dan air minum ad libitum.
Adapun pembagian kelompok perlakuan, yaitu kelompok A sebagai kontrol tikus diinduksi aquades selama 7 minggu; kelompok B sebagai kelompok hepatotoksik, tikus diinduksi parasetamol dosis 250 mg/kgBB selama 7 minggu; kelompok C tikus diinduksi parasetamol 250 mg/kgBB selama 7 minggu, awal minggu ke-5 sampai minggu ke-7 diberi ekstrak rumput mutiara 400 mg/kgBB; kelompok D tikus diinduksi parasetamol selama 7 minggu, awal minggu ke-5 sampai minggu ke-7 diberi ekstrak rumput mutiara 800 mg/kgBB; kelompok E tikus diinduksi parasetamol sampai minggu ke-4, awal minggu ke-5 sampai minggu ke-7 diberi ekstrak rumput mutiara 400 mg/kgBB; kelompok F tikus diinduksi parasetamol sampai minggu ke-4, awal minggu ke-5 sampai minggu ke-7 diberi ekstrak rumput mutiara 800 mg/kgBB.
Gambar 3 Tikus percobaan galur
Spraque-Dawley
Penimbangan Berat Badan dan Analisis Kadar SGPT dan SGOT
Penimbangan berat badan pada masa adaptasi dilakukan pada awal minggu pertama, akhir minggu pertama dan akhir minggu ke-dua. Setelah dilakukan perlakuan, penimbangan bobot badan dilakukan setiap hari untuk menyesuaikan dosis pemberian parasetamol dan ekstrak rumput mutiara. Pengambilan darah tikus dilakukan sebanyak lima kali, yaitu satu kali sebelum perlakuan, dan empat kali setelah perlakuan, yaitu akhir
minggu empat, lima, enam dan ke-tujuh. Darah tikus diambil melalui pembuluh vena ekor, dan ditampung dalam tabung sentrifus kemudian disentrifus pada kecepatan 3000 rpm selama 15 menit untuk mendapatkan serumnya (serum berada di bagian atas), serum berwarna kuning muda bening. Setelah itu dilakukan analisis kadar SGPT dan SGOT.
Prosedur analisis SGPT dan SGOT mengikuti metode dari International Federation of Clinical Chemystry (IFCC). Penentuan kadar GPT dan GOT caranya sama hanya berbeda jenis reagen yang digunakan. Metode analisis GPT dan GOT adalah serum darah tikus diambil sebanyak 100 μL dicampur dengan reagen GPT sebanyak 1000
μL, setelah itu campuran disimpan di penangas air suhu 37 0C kemudian absorbannya dibaca dengan menggunakan fotometer UV pada panjang gelombang 340 nm. Pembacaan dilakukan pada menit ke-1, 2 dan 3. Kadar GPT dicari dengan rumus Δ A/menit x 1745. Kadar GOT dicari dengan cara yang sama seperti GPT tetapi menggunakan reagen GOT.
Analisis Data Statistik
Analisis data terhadap kadar enzim SGPT dan SGOT menggunakan analisis ragam (ANOVA) rancangan acak lengkap (RAL) pada tingkat kepercayaan 95% dan taraf α 0,05 dan kemudian dilanjutkan dengan uji duncan untuk melihat perbedaan pengaruh perlakuan antar kelompok percobaan. Data kadar SGPT dan SGOT dianalisis menggunakan program SAS.
HASIL DAN PEMBAHASAN
Ekstraksi
dengan pelarut selama 3x24 jam dengan mengganti pelarut setiap 24 jam. Hal ini dilakukan untuk memperoleh hasil ekstrak yang maksimal. Perbandingan bahan dan pelarut dapat mempengaruhi hasil ekstraksi.
Menurut Cowley (1973), diacu dalam Melawati (2006) perbandingan yang baik antara bahan dan pelarut adalah 1:10. Oleh karena itu penelitian ini juga menggunakan perbandingan tersebut. Pada penelitian ini, pelarut yang digunakan untuk maserasi rumput mutiara adalah etanol 70%. Pemilihan etanol 70% sebagai pelarut karena etanol 70% sering digunakan untuk ekstraksi dan menghasilkan senyawa bahan aktif yang optimal dan kemungkinan jumlah pengotor yang ikut dalam larutan pengekstrak sangat kecil (Harbone 1997). Rendemen ekstrak rumput mutiara yang telah dirotavapor/dipekatkan adalah sebesar 30.06% dari 3 kali ulangan. Rendemen ekstrak ini kemudian akan digunakan untuk menentukan dosis ekstrak yang akan diberikan ke tikus.
Uji Fitokimia
Sampel yang digunakan adalah ekstrak pekat rumput mutiara Penapisan fitokimia secara kualitatif dilakukan sebagai uji awal untuk mengetahui keberadaan senyawa kimia spesifik, yaitu senyawa metabolit sekunder yang diharapkan dapat berperan sebagai antihepatotoksik. Penapisan fitokimia ini didasarkan pada metode Harborne (1987). Hasil pengujian menunjukkan bahwa ekstrak rumput mutiara mengandung alkaloid, flavonoid, tanin, saponin, dan steroid (Tabel 1). Pada uji alkaloid sampel menunjukkan hasil positif terhadap ketiga pereaksi (Wagner, Mayer, dan Dragendorf). Adanya flavonoid ditunjukkan dengan terbentuknya larutan berwarna merah jingga. Tanin ditunjukkan dengan terbentuknya larutan berwarna hitam kehijauan. Saponin ditunjukkan dengan adanya busa dan tetap stabil setelah didiamkan selama 10 menit. Steroid ditunjukkan dengan terbentuknya larutan berwarna hijau.
Senyawa-senyawa metabolit sekunder yang dapat bersifat sebagai hepatoprotektor adalah flavonoid berdasarkan penelitian Ardiningsih (1995) dan saponin berdasarkan penelitian Kayun (2003). Menurut Robinson (1995), flavonoid sering merupakan senyawa pereduksi yang baik, karena mampu menghambat banyak reaksi oksidasi, baik
secara enzimatis maupun nonenzimatis. Aktivitas antioksidan dari beberapa golongan
flavonoid dapat menjelaskan mengapa flavonoid yang merupakan komponen aktif dari tumbuhan digunakan secara tradisional untuk mengobati gangguan fungsi hati (Robinson 1995). Keberadan saponin dalam tumbuhan dapat juga dimanfaatkan sebagai obat. Menurut Lacaile dan Wagner (1996) aktivitas spesifik saponin termasuk aktivitas yang berhubungan dengan kanker, seperti sitotoksik, antitumor, antiperadangan, antialergenik, antivirus, antihepatotoksik, antidiabetes, dan antifungal.
Tabel 1 Hasil uji fitokimia ekstrak pekat rumput mutiara.
Uji Hasil Alkaloid + Flavonoid + Saponin + Triterpenoid -Steroid + Tanin + Keterangan :
(+) = mengandung senyawa uji, (-) = tidak mengandung senyawa uji
Hepatotoksik Parasetamol
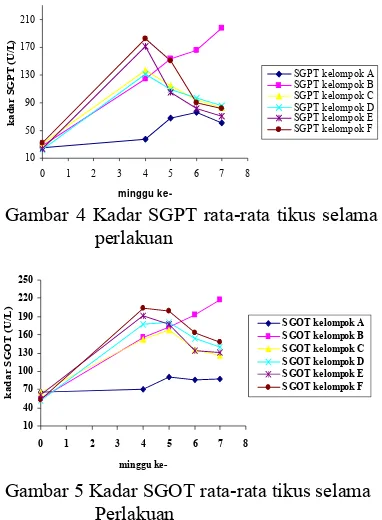
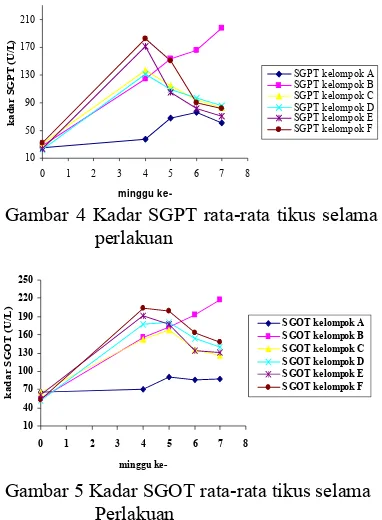
Setelah dilakukan perlakuan pemberian parasetamol dosis 250 mg/kgBB selama 4 minggu terhadap kelompok B, C, D, E dan F telah menaikkan kadar SGPT 4-5 kali dan kadar SGOT tikus 4-6 kali keadaan normalnya, terlihat pada Gambar 4 dan 5. Kadar SGPT kelompok perlakuan yang diberi parasetamol 250 mg/kgBB berdasarkan hasil uji statistik menunjukkan berbeda nyata dengan kelompok A (normal). Kadar SGPT kelompok E dan F tidak saling berbeda nyata, tetapi berbeda nyata dengan kelompok B dan D, sedangkan kelompok C tidak berbeda nyata dengan kelompok B, D dan E. Kadar SGOT tikus setelah diinduksi perasetamol 250 mg/kgBB selama 4 minggu telah menyebabkan kenaikan kadar SGOTnya dan berbeda nyata dengan kelompok normalnya. Kenaikan 4-6 kali kadar SGPT dan SGOT mengindikasikan telah terjadi kerusakan fungsi hati yang bersifat hepatitis kronis.
Menurut Suarsana dan Budiasa (2005) peningkatan kadar SGPT dan SGPT 1-5 kali lebih tinggi dari keadaan normalnya menunjukkan kerusakan hati yang terjadi bersifat hepatotoksis kronis. Kelompok B (kelompok hepatotoksik), yaitu tikus diinduksi perasetamol sampai minggu ke-7 ternyata mengalami kenaikan kadar SGPT dan SGOT yang cukup tajam pada minggu ke-7, Kerusakan fungsi hati yang terjadi dapat bersifat hepatotoksik kronis yang permanen.
Uji Antihepatotoksik
Setelah dilakukan pemberian ekstrak etanol rumput mutiara, pada minggu ke-5 (seminggu setelah pemberian ekstrak etanol rumput mutiara), kadar SGPT kelompok C, D dan E berbeda nyata dengan kelompok B juga berbeda nyata dengan kelompok A. Kelompok F tidak berbeda nyata dengan kelompok B, tetapi berbeda nyata dengan kelompok C, D dan E Kelompok F penurunan kadar SGPTnya sangat kecil sehingga masih tidak berbeda nyata dengan kelompok B, dan berbeda nyata dengan kelompok C, D dan E. Namun semua kelompok yang telah seminggu diberi ekstrak etanol rumput mutiara berdasarkan uji statistik menunjukkan hasil yang berbeda nyata (P<0.05) dengan kelompok A. Kadar SGOT setelah seminggu diberi ekstrak etanol rumput mutiara mengalami penurunan yang sangat kecil dan penurunannya belum begitu terlihat, sehingga kelompok yang telah diberi ekstrak etanol rumput mutiara pada minggu ke-5 memperlihatkan hasil uji statistik yang tidak berbeda nyata dengan kelompok B, dan
berbeda nyata dengan kelompok A. Hal ini disebabkan pemberian ekstrak 400 maupun 800 mg/kgBB yang diberikan belum dapat melawan efek hepatotoksik parasetamol karena waktu pemberian masih relatif singkat.
Penurunan kadar SGPT dan SGOT baru terlihat jelas setelah minggu ketujuh, tetapi pada minggu ketujuh pun belum mencapai keadaan normalnya seperti sebelum diberi perlakuan dan masih berbeda nyata dengan kelompok normal yang dicekok akuades, kemungkinan pemberian ekstrak etanol rumput mutiara perlu diperpanjang lagi waktunya. Kadar SGPT pada minggu ke-7 berdasarkan uji statistik menunjukkan bahwa kelompok C, D, E dan F tidak saling berbeda nyata tetapi berbeda nyata terhadap kelompok B. Kelompok C tidak berbeda nyata dengan kelompok A tetapi kelompok D, E, dan F berbeda nyata dengan kelompok A. Kadar SGOT tikus pada minggu ke-7 berdasarkan uji statistik menujukkan bahwa kelompok C, D, E dan F tidak saling berbeda nyata tetapi berbeda nyata terhadap kelompok B dan juga terhadap kelompok A. Kelompok normal juga mengalami kenaikan kadar SGPT dan SGOT disebabkan tikus mengalami stres akibat pencekokan, dan pemotongan ekor untuk pengambilan darah, seperti terlihat pada Gambar 4 dan 5.
Perlakuan C dan D ingin membuktikan apakah ekstrak etanol rumput mutiara bersifat hepatoprotektor. Pemberian ekstrak rumput mutiara dilakukan memasuki minggu ke-5 sampai minggu ke-7 dengan tidak menghentikan pemberian parasetamol. Hasil analisis memperlihatkan pemberian ekstrak etanol rumput mutiara selama tiga minggu pada kelompok C dengan dosis 400 mg/kgBB dan kelompok D dosis 800 mg/kgBB dapat menurunkan kadar SGPT dan SGOT tikus. Berdasarkan data statistik setelah pemberian ekstrak etanol rumput mutiara selama 3 minggu, pada minggu ke-7 kadar SGPT tikus kelompok C dan D menujukkan hasil yang berbeda nyata (P<0.05) bila dibandingkan dengan perlakuan B juga berbeda nyata dengan kelompok A. Kadar SGOTnya pada minggu ke-7 memperlihatkan hasil uji statistik yang berbeda nyata terhadap kelompok B dan juga kelompok A, namun telah memperlihatkan penurunan yang cukup berarti (Gambar 4 dan 5).
10 40 70 100 130 160 190 220 250
0 1 2 3 4 5 6 7 8 minggu ke-k a d a r S G O T ( U /L )
S GOT kelompok A S GOT kelompok B S GOT kelompok C S GOT kelompok D S GOT kelompok E S GOT kelompok F
10 50 90 130 170 210
0 1 2 3 4 5 6 7 8
m inggu
ke-k a d a r S G P T ( U /L )
SGPT kelompok A SGPT kelompok B SGPT kelompok C SGPT kelompok D SGPT kelompok E SGPT kelompok F
250 mg/kgBB dihentikan pada minggu ke-4. Hasil analisis memperlihatkan pemberian ekstrak etanol rumput mutiara selama tiga minggu pada kelompok E dengan dosis 400 mg/kgBB dan kelompok F dosis 800 mg/kgBB dapat menurunkan kadar SGPT dan SGOT tikus. Hal ini dapat dilihat dari penurunan aktivitas enzim SGPT serta SGOT pada minggu ke-7, berdasarkan uji statistiknya berbeda secara nyata (P<0.05) bila dibandingkan dengan perlakuan B, tetapi kelompok E sudah tidak berbeda nyata dengan kelompok A sedangkan kelompok F masih berbeda nyata dengan kelompok A.
Pemberian ekstrak etanol rumput mutiara dosis 400 dan 800 mg/hari/kgBB selama 3 minggu memperlihatkan efek sebagai hepatoprotektif yaitu mampu menurunkan kadar SGPT dan SGOT tikus yang terus dipapar dengan parasetamol. Ekstrak etanol rumput mutiara juga mempunyai efek antihepatotoksik, menurunkan kadar SGPT dan SGOT tikus akibat pemberian parasetamol selama 4 minggu.
Gambar 4 dan 5 menunjukkan bahwa pemberian ekstrak rumput mutiara dosis 400 dan 800 mg/kgBB selama 3 minggu pada kelompok yang dipapar terus parasetamol, yaitu kelompok C dan D pada minggu ke-7 berdasarkan uji statistiknya menunjukkan tidak saling berbeda nyata. Kelompok E dan F yang dihentikan pemberian parasetamolnya pada minggu keempat dan dilanjutkan dengan pemberian ektrak rumput mutiara dosis 400 dan 800 mg/kgBB selama 3 minggu menunjukkan adanya penurunan kadar SGPT dan SGOT yang tidak saling berbeda nyata. Kelompok E dan F juga tidak berbeda nyata dibandingkan dengan kelompok C dan D yang terus dipapar parasetamol. Artinya dari keempat kelompok tersebut dengan dosis ekstrak rumput mutiara 400 dan 800 mg/kgBB mampu melindungi hati dan mampu mengobati kerusakan fungsi hati. Hal ini menunjukkan bahwa sampai dengan dosis 800 mg/kgBB, pengaruh pemberian ekstrak rumput mutiara antara kedua dosis tersebut tidak berbeda, artinya pengaruh antara kedua dosis tersebut sama saja. Sehingga dosis 400 mg/kgBB sudah cukup efektif untuk menurunkan kadar SGPT maupun SGOT tikus pada tingkat 4-6 kali keadaan normalnya. Dosis 400 mg/kgBB tersebut tidak berbeda dengan hasil penelitian Ardiningsih (1995) yang menyatakan bahwa ekstrak kasar dari rumput laut (Sargassum sp.) dapat berfungsi sebagai antihepatotoksik pada ayam yang dinduksi parasetamol (250 mg/kgBB).
Gambar 4 Kadar SGPT rata-rata tikus selama perlakuan
Gambar 5 Kadar SGOT rata-rata tikus selama Perlakuan
Bobot Badan
130 140 150 160 170 180 190 200 210
0 7 14 21 28 35 42 49 56
hari b o b o t (g ra m ) kelompok A kelompok B kelompok C kelompok D kelompok E kelompok F
Gambar 6 Ratan bobot badan tikus selama perlakuan
SIMPULAN DAN SARAN
SIMPULAN
Rumput mutiara berpotensi menurunkan kadar SGPT dan SGOT tikus yang telah diinduksi parasetamol 250 mg/kgBB. Pemberian parasetamol dosis 250 mg/kgBB selama 4 minggu telah menyebabkan peningkatan kadar SGPT dan SGOT tikus 4-5 kali dari keadaan normalnya. Setelah pemberian ekstrak etanol 70% rumput mutiara dosis 400 dan 800 mg/kgBB selama 3 minggu, terjadi penurunan kadar SGPT dan SGOT yang cukup berarti. Berdasarkan uji fitokimianya ekstrak etanol rumput mutiara mengandung senyawa alkaloid, flavonoid, saponin, tanin, dan steroid.
Pemberian ekstrak etanol rumput mutiara dengan dosis 400 dan 800 mg/kgBB tidak berbeda nyata baik pada kelompok yang dihentikan pemberian parasetamolnya pada minggu keempat maupun yang terus dipapar parasetamol. Dosis 400 mg/kgBB ekstrak etanol 70% rumput mutiara mampu melindungi hati dan mengobati hati dari kerusakan atau peradangan, dosis tersebut sudah cukup efektif untuk menurunkan kadar SGPT dan SGOT tikus setingkat hepatitis kronik pada manusia.
SARAN
Sebaiknya dilakukan uji histopatologi hati dan waktu penelitian perlu diperpanjang untuk melihat penurunan kadar SGPT dan SGOT yang lebih signifikan. Perlu dilakukan penelitian lebih lanjut sehubungan dengan pelarut-pelarut lain sebagai bahan pengekstrak yang spesifik yang berperan sebagai bahan pengekstrak dan identifikasi senyawa aktif yang berperan sebagai antihepatotoksik serta mekanismenya. antihepatotoksik, dan mempelajari mekanismenya dalam tubuh.
DAFTAR PUSTAKA
Adijuwana, Nur MA. 1989. Teknik Spektroskopi dalam Analisis Biologi. Bogor: Pusat Antar Universitas IPB.
Amelia G. 2006. Potensi rumput mutiara (Hedyotis corymbosa (L.) Lam) sebagai antioksidan alami [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[Anonim] 2005. Rumput mutiara. http://www.iptek.net.id/ind/pd tanobat/ view.php?id=54. [2 Februari 2007].
Ardiningsih P. 1995. Efek pemberian rumput laut (Sargassum sp.) terhadap kadar SGOT dan SGPT ayam [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Barry H, Rumack MD. 1983 Acetaminophen Overdose. Am J Med 104-112.
Boyer TD. Rouff SL. 1971. Acetaminophen-induced hepatic necrosis and renal failure. J Am Med Assoc9: 218.
Calbreath DF. 1992. Clinical Chemistry. New York: Saunder Company.
Casarett, Doull’s. 1989. Toxicology: The Basic Science of Poisons. New York: Macmillan Company.
Chan K, Han XD, Kan YW. 2001. An important function of nrf2 in combating oxidative stress: detoxification of acetaminophen. Proc Natl Acad Sci 98 (8): 4611 – 4616.
Clark R. 1973. Hepatic damage and death from overdose of parasetamol. Lancet 1: 66-69.
Dalimartha S. 2005. Ramuan Tradisional untuk Pengobatan Hepatitis. Jakarta: Penebar Swadaya.
Davis M, Simmon CJ, Harisson NG, Williams R. 1976. Paracetamol overdose in man: Relationship between patern of urinary metabolites and severity of liver damage.
[DepKes BPPK] Departemen Kesehatan, Badan Penelitian dan Pengembangan Kesehatan. 1999. Inventaris Tanaman Indonesia (V). Jakarta: Bakti Husada.
Donatus IA. 1982. Toksisitas parasetamol dan usaha pencegahanya. Medika 8 (8): 606-610.
Donatus IA, Susana. 1992. Daya antihepatotoksik seduhan rimpang temulawak (Curcuma xanthoriza Roxb.) pada mencit. Di dalam: Risalah Simposium Penelitian Tanaman Obat III.
Yogyakarta: Universitas Gajah Mada.
Fox JG, Cohen BJ, Loew FM. 1984.
Laboratory Animal Medicine. Orlando: Academic-Pr.
Gan S. 1980 Farmakologi dan Terapi. Ed ke-2. Jakarta: Bagian Farmakologi Fakultas Kedokteran, Universitas Indonesia.
Gillete JR. 1981. An integrated approach to the study of chemically reactive metabolites of acetaminophen. Arch Intern Med 141:375-379.
Girindra A. 1986. Patologi Klinik Veteriner. Bogor: IPB Pr.
Goodman, Gilman’s. 1980. The Pharmecological Basic of Therapeutics. Ed ke-6. New York: MacMilan Publishing Co Inc.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Iwang S, penerjemah; Bandung: ITB. Terjemahan dari: Phytochemical Methods.
Hawkins DW, Rahn DW. 1997.
Pharmacoteraphy: Apathophysiological Approach. London: Black well Scientific Publication.
Hernani, Rahardjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta: Penebar Swadaya.
Katzung BG. 1998. Farmakologi Dasar dan Klinik. Jakarta: Buku Penerbit Kedokteran EGC.
Kenward R, Chik KT. 2003. Farmasi Klinis. Di dalam: Mohammad Aslam, Chik Kaw Tan, Adji Prayitno, editor. Menuju Pengobatan Rasional dan Penghargaan Pilihan Pasien Jakarta: PT Gramedia.
Kayun SP. 2003. Ekstrak saponin dari akar kuning sebagai hepatoprotektor [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kusuma FR, Zaky BM. 2005. Tumbuhan Liar Berkhasiat Obat. Jakarta: Agromedia Pustaka.
Lacaile D, Wagner H. (1996). A revief of the biological and pharmacological aktivities of saponins. Phyto med 2: 363-386.
Lu FC. 1995. Toksikologi Dasar: Asas, Organ, Sasaran, dan Penilaian Risiko. Ed ke-2. Edi Nugroho, penerjemah; Jakarta: UI Pr.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Kosasih Padmawinata, penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Techniques of Flavonoid Identification.
Mattjik AA. 2002. Rancangan Percobaan. Bogor: IPB Pr.
Melawati. 2006. Optimasi proses maserasi panili (Vanilla planifolia A) hasil modifikasi proses kuring [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Mitchell. 1979. Acetaminophen induced hepatic necrosis. J Pharmacol 187 (1): 185-194.
Mutschler E. 1991. Dinamika Obat. Ed ke-5. Mathilda BW dan Ranti AS, penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Arzeneimittelwirkungen, 5 Vollig Neubearbeitee und Erweiterte Auflauge.
Permadi A. 2006. Tanaman Obat Pelancar Air Seni. Jakarta: Penebar Swadaya.
Rustandi MI. 2006. Potensi antioksidasi ekstrak daun sangitan. (Sambucus javanica Reinw ex Blume) sebagai hepatoprotektor pada tikus [skripsi]. Bogor: Fakultas Matematika dan IPA, Institut Pertanian Bogor.
Santoso, Sardjono H. 1992. Perspektif Pengembangan Obat Tradisional di Indonesia. Jakarta: UI Pr.
Sjaifoellah N. 1996. Ilmu Penyakit Dalam. Jilid I. Ed ke-3. Jakarta: UI Pr.
Soenanto H, Kuncoro S. 2005. Hancurkan Batu Ginjal Dengan Tanaman Herbal. Jakarta: Puspa swara.
Suarsana IN, Budiasa IK. 2005. potensi hepatoprotektif ekstrak mengkudu pada keracunan parasetamol.
http://www.jvet/view.htm. Vol 6(3). [2 Februari 2007].
Sujono H. 2002. Gastroenterology. Bandung: Penerbit Alumni.
Tirmenstein MA, Nelson SD. 1990, Acetaminophen-induced oxidation of protein thiols: contribution of impaired thiol-metabolizing enzymes and the breakdown of adenin nucleotides. J Biol Chem 265 (6): 3059 – 3065.
Wijayakusuma H. 2004. Atasi Kanker dengan Tanaman Obat. Jakarta: Puspa swara.
Wijayakusuma H, Dalimartha, Wiria AS. 1996. Tanaman berkhasiat obat di
Indonesia. Jilid IV. Jakarta: Pustaka Kartini.
Windyagiri A. 2006. Potensi hepatoprotektor air rebusan daun sirih merah (Piper crocatum) pada tikus putih hiperglikemia [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lampiran 1 Tahapan umum penelitian
Rumput mutiara (
Hedyotis
corymbosa
(L.) Lam
.) kering
Maserasi dengan alkohol 70%
Rotavapour sampai pekat
Dikeringkan dalam oven 40-60
0C hingga kering
Estrak kasar
Uji fitokimia
uji pada hewan coba
(tikus putih)
uji
uji
uji uji uji steriod
flavonoid alkaloid tanin saponin dan terpenoid
dan
senyawa
fenolik
Lampiran 2 Ekstraksi rumput mutiara
Lampiran 3 Rendemen hasil ekstraksi rumput mutiara
Sampel
Bobot sampel (g)
Bobot ekstrak (g)
Rendemen (%)
100 g
30.16 g
30.16
Rumput mutiara
100 g
29.74 g
29.74
100 g
30.29 g
30.29
Contoh perhitungan:
Rendemen (%) =
x
100
%
simplisia
bobot
ekstrak
Bobot
=
100
%
100
16
.
30
x
= 30.16%
Rata-rata rendemen ekstrak (%) =
30
.
06
%
3
%
29
.
30
%
74
.
29
%
16
.
30
Ekstraksi : etanol 70%
Maserasi
Filtrat
Ekstrak kasar
Rotavapor 50 ºC
Oven 40 ºC
Lampiran 4 Dosis parasetamol dan ekstrak rumput mutiara
Perhitungan dosis parasetamol yang diinduksikan pada tikus
1 tablet 500 mg parasetamol dilarutkan dalam 10 mL akuades sehingga diperoleh konsentrasi 50 mg/mL
Dosis yang diinduksikan pada tikus 250 mg/kgBB
Misalkan robot badan tikus 200 g maka:
mg kg
mg x g g
50 250
1000
200
Larutan stok yang dibuat 50 mg/mL Jadi untuk bobot badan tikus 200 g :
mL mg mg
1 50 50
; mg mL
mL x
mg 1,00
50 1
50
Perhitungan dosis ektrak rumput mutiara yang diinduksikan pada tikus
Dosis yang diinduksikan adalah 400 mg/kgBB dan 800 mg/kgBB
Rendemen ektrak yang diperoleh adalah 30.06% = 0.3
Untuk dosis 400 mg/kgBB: 400 mg/kgBB x 0.3 = 120 mg/kgBBMisalkan untuk bobot badan tikus 200 g: 120 mg/kgBB x 0.2 kg = 24 mg/BB
Larutan stok dibuat untuk dosis 400 mg/kgBB: 240 mg ekstrak dilarutkan dalam 10 mL akuades, sehingga dalam 1 mL mengandung 24 mg ekstrak rumput mutiara
Untuk dosis 800 mg/kgBB: 800 mg/kgBB x 0.3 = 240 mg/kgBB
Misalkan untuk bobot badan tikus 200 g: 240 mg/kgBB x 0.2 kg = 48 mg/BB
Larutan stok dibuat untuk dosis 800 mg/kgBB: 480 mg ekstrak dilarutkan dalam 10 mL akuades, sehingga dalam 1 mL mengandung 48 mg ekstrak rumput mutiara
Jadi untuk bobot tikus badan 200 g dicekok larutan ekstrak dosis 400 maupun 800 mg/kgBB sebanyak 1 mL
Untuk bobot badan yang lain dikonversikan terhadap bobot badan 200 g, misalnya untuk bobot badan 150 g: x mL mL
g g
75 . 0 1 200
150
Lampiran 5 Contoh perhitungan kadar SGPT dan SGOT
Prosedur analisis kadar GPT dan GOT mengikuti metode dari International Federation of Clinical Chemystry (IFCC) dengan rumus Δ A /menit x 1745.
C
CoonnttoohhppeerrhhiittuunnggaannkkaaddaarrSSGGPPTT::
N
Niillaaiiaabbssoorrbbaannssmmeenniittkkee--00==00..997700 m
meenniittkkee--11==00..884499 m
meenniittkkee--22==00..779900 m
meenniittkkee--33==00..773355 Δ
ΔAA//mmeenniitt ==00..223355//33==00..00778833333333 K
KaaddaarrSSGGPPTT==00..007788xx11774455==113366..669911UU//LL
C
CoonnttoohhppeerrhhiittuunnggaannkkaaddaarrSSGGOOTT:: N
Niillaaiiaabbssoorrbbaannssmmeenniittkkee--00==11..229977 m
meenniittkkee--11==11..226611 m
meenniittkkee--22==11..222266 m
meenniittkkee--33==11..119922 Δ
ΔAA//mmeenniitt==00..110055//33==00..003355
K
Lampiran 6 Daftar bobot badan tikus selama perlakuan
Kelompok A kontrol normal
Bobot badan tikus hari ke- (gram) Kelompok
A No Tikus
0 7 14 21 28 35 42 49
A1 152.23 148.64 157.35 163.67 165.16 165.31 192.06 180.51 A2 181.72 182.14 194.95 214.57 221.16 215.17 216.06 220.70 A3 146.11 140.73 150.25 161.78 171.65 168.68 173.85 179.25 A4 155.78 168.99 191.19 203.79 206.02 208.59 212.19 216.02 A5 184.98 187.36 203.17 221.03 225.44 224.15 226.55 227.63 rataan 164.16 165.57 179.38 192.96 197.88 196.38 204.14 204.822
Kelompok B kontrol positif (hepatotoksik);induksi parasetamol 250 mg/kgBB
Bobot badan tikus hari ke- (gram) Kelompok
B No Tikus
0 7 14 21 28 35 42 49
B1 156.07 158.13 169.52 177.96 187.47 187.15 183.50 177.00 B2 170.19 172.09 182.50 191.84 189.92 191.44 189.48 185.58 B3 115.12 118.05 128.34 123.55 mati mati mati mati B4 168.26 170.72 194.49 196.05 192.72 192.25 193.93 191.52 B5 187.57 186.42 207.39 222.11 215.49 212.56 207.31 198.11 rataan 159.44 161.08 176.44 182.30 196.40 195.85 193.55 188.05
Kelompok C perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke
5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Bobot badan tikus hari ke- (gram) Kelompok
C No Tikus
0 7 14 21 28 35 42 49
C1 155.78 158.31 175.71 182.86 160.17 164.38 169.10 182.28 C2 180.43 174.65 188.96 204.12 203.10 204.54 200.26 210.55 C3 146.19 156.21 162.61 162.24 mati mati mati mati C4 145.52 144.84 156.93 160.05 147.80 151.53 157.87 167.96 C5 151.36 148.04 144.39 162.06 168.67 177.26 179.52 188.43 rataan 155.85 156.41 165.72 174.26 169.93 174.43 176.50 187.30
Kelompok D perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke
5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Bobot badan tikus hari ke- (gram) Kelompok
D No Tikus
0 7 14 21 28 35 42 49
Lanjutan Lampiran 6
Kelompok E perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke
5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Bobot badan tikus hari ke- (gram) Kelompok
E No Tikus
0 7 14 21 28 35 42 49
E1 150.57 148.41 158.22 172.01 173.81 178.48 189.64 193.36 E2 161.62 132.18 145.52 158.91 160.70 160.28 163.32 168.07 E3 135.40 mati mati mati mati mati mati mati E4 158.91 154.81 173.15 179.93 177.37 181.71 190.32 199.27 E5 175.77 170.13 183.40 189.49 191.37 195.21 201.75 209.48 rataan 156.45 151.38 165.07 175.08 175.81 178.92 186.26 192.55
Kelompok F perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke
5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Bobot badan tikus hari ke- (gram) Kelompok F
No Tikus 0 7 14 21 28 35 42 49 F1 145.68 130.81 145.53 152.00 153.94 159.69 170.08 171.58 F2 158.49 139.55 156.17 169.09 163.26 167.42 176.52 186.62 F3 172.22 158.85 176.39 187.91 mati mati mati mati F4 147.16 140.30 137.70 149.85 155.78 156.97 167.90 170.96 F5 168.34 156.97 167.51 175.66 177.02 179.06 188.09 200.33 rataan 158.37 145.29 156.66 166.90 162.50 165.78 175.65 182.37
Lampiran 7 Kadar SGPT tikus pada masa perlakuan
Kelompok A kontrol normal
Kadar SGPT tikus minggu ke- ( U/L) Kelompok A
No Tikus 0 4 5 6 7
A1 33.174 40.158 61.075 80.851 64.565 A2 18.031 36.666 65.728 57.585 58.167 A3 29.083 41.904 84.341 82.015 73.290 A4 23.266 34.920 78.525 71.545 60.493 A5 19.776 31.130 49.441 88.413 48.278 Rataan
± SD
24.666 6.359
36.955 4.269
67.822 13.921
76.082 11.966
60.958 9.136
Kelompok B kontrol positif (hepatotoksik);induksi parasetamol 250 mg/kgBB Kadar SGPT tikus minggu ke- ( U/L) Kelompok B
No Tikus 0 4 5 6 7
B1 31.991 141.426 182.640 191.950 209.520 B2 23.266 125.712 148.906 161.121 198.340 B3 24.444 132.696 mati mati mati B4 29.682 112.261 139.696 155.886 193.695 B5 31.428 108.252 136.691 150.070 188.460 Rataan
± SD
28.162 4.004
124.069 13.856
151.983 21.088
164.756 18.682
Lanjutan Lampiran 7
Kelompok C perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Kadar SGPT tikus minggu ke- ( U/L) Kelompok C
No Tikus 0 4 5 6 7
C1 29.682 128.548 111.680 95.975 88.9905 C2 31.428 149.488 121.568 105.863 91.321 C3 34.920 mati mati mati mati C4 33.174 122.150 114.006 87.831 72.708 C5 27.083 144.835 111.098 85.505 76.198 Rataan
± SD
31.257 3.042
136.255 13.001
114.588 4.819
93.793 9.213
82.304 9.226
Kelompok D perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Kadar SGPT tikus minggu ke- ( U/L) Kelompok D
No Tikus 0 4 5 6 7
D1 16.266 104.118 98.883 83.760 79.106 D2 22.103 133.783 112.843 94.811 86.668 D3 24.430 126.803 122.731 118.078 91.321 D4 23.266 mati mati mati mati D5 28.501 114.588 104.118 92.485 86.086 Rataan
± SD
22.913 4.429
119.823 13.135
109.643 10.453
97.283 14.656
85.795 5.037
Kelompok E perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Kadar SGPT tikus minggu ke- ( U/L) Kelompok E
No Tikus 0 4 5 6 7
E1 23.166 115.170 103.536 100.628 93.067 E2 27.649 238.483 102.373 68.055 62.820 E3 22.397 mati mati mati mati E4 18.224 117.496 105.863 86.086 73.290 E5 27.485 214.053 109.353 73.870 50.605 Rataan
± SD
23.784 3.932
171.300 64.256
105.281 3.078
82.159 14.424
69.946 17.987
Kelompok F perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Kadar SGPT tikus minggu ke- ( U/L) Kelompok F
No Tikus 0 4 5 6 7
F1 33.178 190.205 143.090 86.086 70.963 F2 27.936 139.600 116.333 82.015 73.871 F3 36.666 mati mati mati mati F4 34.920 221.033 209.400 93.648 84.341 F5 29.682 175.663 133.783 98.883 94.811 Rataan
± SD
32.476 3.621
181.625 33.804
150.651 40.705
90.158 7.554
Lampiran 8 Kadar SGOT tikus pada masa perlakuan
Kelompok A kontrol normal
Kadar SGOT tikus minggu ke- ( U/L) Kelompok A
No Tikus 0 4 5 6 7
A1 71.586 91.321 91.321 80.316 78.570 A2 66.310 43.679 61.656 73.332 75.078 A3 55.258 62.212 124.476 106.506 103.014 A4 54.095 78.823 104.118 90.792 99.552 A5 77.943 72.281 67.473 76.459 83.808 Rataan
± SD
65.038 10.325
69.663 17.961
89.809 25.982
85.481 13.471
88.004 12.573
Kelompok B kontrol positif (hepatotoksik);induksi parasetamol 250 mg/kgBB Kadar SGOT tikus minggu ke- ( U/L) Kelompok B
No Tikus 0 4 5 6 7
B1 76.780 164.030 173.735 192.531 203.583 B2 47.696 161.121 177.408 193.113 246.626 B3 52.350 159.376 mati mati mati B4 50.605 115.081 152.978 189.041 195.440 B5 48.278 164.101 183.806 195.544 222.778 Rataan
± SD
55.142 12.239
152.741 21.148
171.982 13.335
192.557 2.682
217.107 22.773
Kelompok C perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Kadar SGOT tikus minggu ke- ( U/L) Kelompok C
No Tikus 0 4 5 6 7
C1 52.350 175.081 174.500 148.907 136.188 C2 58.748 130.293 162.285 129.712 120.474 C3 82.597 mati mati mati mati C4 79.683 136.110 165.775 127.967 122.220 C5 57.585 168.101 171.591 133.201 125.712 Rataan
± SD
66.192 13.894
152.396 22.472
168.539 5.525
134.947 9.557
126.148 7.038
Kelompok D perlakuan induksi parasetamol 250 mg/kgBB selama 7 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Kadar SGOT tikus minggu ke- ( U/L) Kelompok D
No Tikus 0 4 5 6 7
D1 50.023 198.930 199.511 169.846 158.886 D2 52.931 130.875 175.081 141.926 137.936 D3 51.187 178.571 182.643 151.815 130.950 D4 45.370 mati mati mati mati D5 62.820 201.838 162.285 152.978 132.696 Rataan
± SD
52.466 4.629
177.553 32.795
179.880 15.552
154.141 11.584
Lanjutan Lampiran 8
Kelompok E perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 400 mg/kgBB
Kadar SGOT tikus minggu ke- ( U/L) Kelompok E
No Tikus 0 4 5 6 7
E1 66.310 240.228 153.560 120.405 117.496 E2 58.166 141.345 169.846 130.875 128.548 E3 41.880 mati mati mati mati E4 66.449 111.098 162.285 148.325 137.273 E5 75.616 270.475 222.778 172.173 136.691 Rataan
± SD
61.684 12.676
190.786 76.571
177.117 31.159
142.944 22.634
130.002 9.239
Kelompok F perlakuan induksi parasetamol 250 mg/kgBB selama 4 minggu, minggu ke 5 diinduksi ekstrak rumput mutiara 800 mg/kgBB
Kadar SGOT tikus minggu ke- ( U/L) Kelompok F
No Tikus 0 4 5 6 7
F1 47.696 230.921 198.493 133.783 122.150 F2 68.636 192.531 190.786 140.763 134.946 F3 55.258 mati mati mati Mati F4 50.605 203.583 231.503 182.061 170.428 F5 48.278 188.460 172.755 194.858 166.356 Rataan
± SD
54.095 8.656
203.874 19.130
198.493 24.572
162.860 30.145
148.470 23.648
Lampiran 9 Hasil analisis ragam dan anova SGPT dengan program SAS
SGPT minggu ke-0Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 30
Source DF Squares Mean Square F Value Pr > F Model 5 408.4681619 81.6936324 4.29 0.0063 Error 24 457.0339588 19.0430816
Corrected Total 29 865.5021207 R-Square Coeff Var Root MSE Respon Mean 0.471944 16.03768 4.363838 27.20990 Duncan's Multiple Range Test for Respon: Alpha 0.05 Error Degrees of Freedom 24 Error Mean Square 19.04308
Number of Means 2 3 4 5 6 Critical Range 5.696 5.983 6.167 6.297 6.394
Means with the same letter are not significantly different.
Duncan grouping
Mean N Perlakuan
A 32.476 5 F
A 31.257 5 C
A B 28.162 5 B
B 24.666 5 A
B 23.784 5 E
Lanjutan Lampiran 9
SGPT minggu ke-4Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 26
Source DF Squares Mean Square F Value Pr > F Model 5 60774.94228 12154.98846 13.75 <.0001 Error 20 17680.71012 884.03551
Corrected Total 25 78455.65240 R-Square Coeff Var Root MSE Respon Mean 0.774641 23.85120 29.73273 124.6593 Duncan's Multiple Range Test for Respon: Alpha 0.05 Error Degrees of Freedom 20 Error Mean Square 884.0355 Harmonic Mean of Cell Sizes 4.285714
Number of Means 2 3 4 5 6 Critical Range 42.37 44.47 45.81 46.74 47.43
Means with the same letter are not significantly different.
Duncan grouping Mean N perlakuan
A 181.63 4 F
A B 171.30 4 E
B C 136.26 4 C
C 124.07 5 B
C 119.82 4 D
D 36.96 5 A
SGPT minggu ke-5
Perlakuan 6 A B C D E F Number of Observations Read 30
Number of Observations Used 26 Source DF Squares Mean Square F Value Pr > F Model 5 23834.36982 4766.87396 12.14 <.0001 Error 20 7854.63430 392.73172
Corrected Total 25 31689.00412
R-Square Coeff Var Root MSE Respon Mean 0.752134 17.03798 19.81746 116.3134 Duncan's Multiple Range Test for Respon: Alpha 0.05 Error Degrees of Freedom 20 Error Mean Square 392.7317 Harmonic Mean of Cell Sizes 4.285714
Number of Means 2 3 4 5 6 Critical Range 28.24 29.64 30.53 31.16 31.62
Means with the same letter are not significantly different.
Duncan grouping Mean N perlakuan
A 152.88 5 B
A 150.65 4 F
B 114.59 4 C
B 109.64 4 D
B 105.28 4 E
Lanjutan Lampiran 9
SGPT minggu ke-6Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 25
Source DF Squares Mean Square F Value Pr > F Model 5 21476.35452 4295.27090 24.62 <.0001 Error 19 3314.27168 174.43535
Corrected Total 24 24790.62620
R-Square Coeff Var Root MSE Respon Mean 0.866309 13.24440 13.20740 99.72060 Duncan's Multiple Range Test for Respon:
Alpha 0.05
Error Degrees of Freedom 19 Error Mean Square 174.4354 Harmonic Mean of Cell Sizes 4.137931
Number of Means 2 3 4 5 6 Critical Range 19.22 20.17 20.77 21.19 21.50
Means with the same letter are not significantly different.
Duncan grouping Mean N Perlakuan
A 164.757 4 B
B 97.284 4 D
B C 93.794 4 C
B C 90.158 4 F
B C 82.160 4 E
C 76.082 5 A
SGPT minggu ke-7
Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 25
Source DF Squares Mean Square F Value Pr > F Model 5 52100.44064 10420.08813 88.75 <.0001 Error 19 2230.85787 117.41357
Corrected Total 24 54331.29851
R-Square Coeff Var Root MSE Respon Mean 0.958940 11.42542 10.83575 94.83898 Duncan's Multiple Range Test for Respon:
Alpha 0.05
Error Degrees of Freedom 19 Error Mean Square 117.4136 Harmonic Mean of Cell Sizes 4.137931
Number of Means 2 3 4 5 6
Critical Range 15.77 16.55 17.04 17.38 17.64
Means with the same letter are not significantly different.
Duncan grouping Mean N Perlakuan
A 197.504 4 B
B 85.795 4 D
B 82.304 4 C
B 80.997 4 F
B C 69.946 4 E
Lampiran 10 Hasil analisis ragam dan anova SGOT dengan program SAS
SGOT Minggu ke-0Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 30
Source DF Squares Mean Square F Value Pr > F Model 5 884.881425 176.976285 1.46 0.2390 Error 24 2905.714054 121.071419
Corrected Total 29 3790.595479
R-Square Coeff Var Root MSE Respon Mean 0.233441 18.61708 11.00325 59.10297 Respon:
Levels of perlakuan
N Mean Std Dev
A 5 65.0384000 10.3251024
B 5 55.1418000 12.2386691
C 5 66.1926000 13.8944742
D 5 52.4662000 6.4299854
E 5 61.6842000 12.6765577
F 5 54.0946000 8.6567609
SGOT minggu ke-4
Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 26
Source DF Squares Mean Square F Value Pr > F Model 5 53161.69455 10632.33891 8.02 0.0003 Error 20 26508.48835 1325.42442
Corrected Total 25 79670.18290
R-Square Coeff Var Root MSE Respon Mean 0.667272 23.60240 36.40638 154.2487 Duncan's Multiple Range Test for Respon
Alpha 0.05
Error Degrees of Freedom 20 Error Mean Square 1325.424 Harmonic Mean of Cell Sizes 4.285714
Number of Means 2 3 4 5 6 Critical Range 51.88 54.46 56.09 57.24 58.08
Means with the same letter are not significantly different.
Duncan grouping
Mean N Perlakuan
Lanjutan Lampiran 10
SGOT minggu ke-5Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 25
Source DF Squares Mean Square F Value Pr > F Model 5 34103.47033 6820.69407 14.77 <.0001 Error 19 8775.19160 461.85219
Corrected Total 24 42878.66193
R-Square Coeff Var Root MSE Respon Mean 0.795348 13.32297 21.49075 161.3059 Duncan's Multiple Range Test for Respon:
Alpha 0.05
Error Degrees of Freedom 19 Error Mean Square 461.8522 Harmonic Mean of Cell Sizes 4.137931
Number of Means 2 3 4 5 6 Critical Range 31.27 32.82 33.80 34.48 34.98
Means with the same letter are not significantly different.
Duncan grouping
Mean N Perlakuan
A 198.38 4 F
A 179.88 4 D
A 177.12 4 E
A 171.98 4 B
A 168.54 4 C
B 89.81 5 A
SGOT minggu ke-6
Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 25
Source DF Squares Mean Square F Value Pr > F Model 5 28700.27520 5740.05504 19.18 <.0001 Error 19 5687.45180 299.33957
Corrected Total 24 34387.72700
R-Square Coeff Var Root MSE Respon Mean 0.834608 12.09136 17.30143 143.0892 Duncan's Multiple Range Test for Respon:
Alpha0.05
Error Degrees of Freedom 19 Error Mean Square 299.3396 Harmonic Mean of Cell Sizes 4.137931
Number of Means 2 3 4 5 6 Critical Range 25.18 26.42 27.21 27.76 28.16
Means with the same letter are not significantly different
Duncan grouping Mean N perlakuan
A 192.56 4 B
B 162.87 4 F
B C 154.14 4 D
B C 142.94 4 E
B C 134.95 4 C
Lanjutan Lampiran 10
SGOT minggu ke-7
Perlakuan 6 A B C D E F Number of Observations Read 30 Number of Observations Used 25
Source DF Squares Mean Square F Value Pr > F Model 5 38747.47885 7749.49577 30.89 <.0001 Error 19 4766.81417 250.88496
Corrected Total 24 43514.29303
R-Square Coeff Var Root MSE Respon Mean 0.890454 11.35470 15.83935 139.4960 Duncan's Multiple Range Test for Respon
Alpha 0.05
Error Degrees of Freedom 19 Error Mean Square 250.885 Harmonic Mean of Cell Sizes 4.137931
Number of Means 2 3 4 5 6 Critical Range 23.05 24.19 24.91 25.41 25.78
Means with the same letter are not significantly different.
Duncan grouping Mean N Perlakuan
A 217.11 4 B B 148.47 4 F B 140.12 4 D B 130.00 4 E B 126.15 4 C C 88.00 5 A
Lampiran 11 Foto hasil uji fitokimia
Flavonoid saponin
Alkaloid
Gambar


Garis besar
Dokumen terkait
Hasil penelitian ini menunjukkan bahwa dengan pemberian ekstrak etanolik rumput mutiara selama 7 hari pada hewan uji, menyebabkan peningkatan ekspresi p53 pada
Hasil uji toksisitas fraksi-fraksi hasil fraksinasi dari fraksi larut etil asetat ekstrak kloroform rumput mutiara terhadap A.. Berdasarkan Tabel 2 dapat diketahui bahwa fraksi
telah dilakukan dapat disimpulkan bahwa tanaman rumput mutiara ( Hedyotis Corymbosa ) dalam bentuk sediaan ekstrak pekat, secara GCMS ( Gas Chromatograph Mass Spectrometry
Hasil penelitian ini menunjukkan bahwa dengan pemberian ekstrak etanolik rumput mutiara selama 7 hari pada hewan uji, menyebabkan peningkatan ekspresi p53 pada
Hasil penelitian menunjukkan bahwa ekstrak etanol herba Rumput Mutiara mempunyai efek toksik menurut metode BST dengan nilai LC50 sebesar 131,5 μ g/ml. Kata Kunci : uji
Penulis skripsi berjudul Uji Efek Antiinflamasi Ekstrak Herba Rumput Mutiara (Hedyotis Corymbosa L. Lamk.) Dengan Metode Hen’s Egg Test Chorioallantoic Membranes
Produksi NO makrofag peritoneal mencit Balb/c yang diberi ekstrak Rumput Mutiara dosis bertingkat selama 14 hari menunjukkan peningkatan yang berbeda dengan
Pada penelitian ini telah dilakukan uji efek analgesik dari bahan alam kombinasi Ekstrak Tapak Liman ( Elephantopus scaber L ) dan Rumput Mutiara ( Hedyotis corymbosa L )