OPTIMASI SUHU DAN WAKTU EKSTRAKSI DALAM PROSES DIGESTI HERBA RUMPUT MUTIARA (Hedyotis corymbosa (L.) Lamk)
DENGAN APLIKASI DESAIN FAKTORIAL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Lilia Cresensia Yuniarty Rogan
NIM : 088114167
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
OPTIMASI SUHU DAN WAKTU EKSTRAKSI DALAM PROSES DIGESTI HERBA RUMPUT MUTIARA (Hedyotis corymbosa (L.) Lamk)
DENGAN APLIKASI DESAIN FAKTORIAL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Ilmu Farmasi
Oleh :
Lilia Cresensia Yuniarty Rogan
NIM : 088114167
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
vii PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas rahmat, berkat, cinta,
ijin, dan penyertaanNya yang begitu besar, sehingga penulis dapat menyelesaikan
penelitian dan penyusunan skripsi berjudul “Optimasi Suhu dan Waktu Ekstraksi
dalam Proses Digesti Herba Rumput Mutiara (Hedyotis corymbosa (L.) Lamk)
Dengan Aplikasi Desain Faktorial”. Skripsi ini disusun untuk memenuhi
persyaratan dalam meraih gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi,
Universitas Sanata Dharma, Yogyakarta.
Dalam menyelesaikan skripsi ini, penulis tidak henti-hentinya
mendapatkan banyak dukungan dan bantuan dari berbagai pihak. Oleh karena itu,
penulis mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Yohanes Dwiatmaka, M.Si. selaku dosen pembimbing atas kesabaran dan
waktunya memberikan koreksi, pengarahan, dan masukan selama persiapan,
penelitian, sampai penyusunan skripsi ini di tengah kesibukan beliau yang
sangat padat.
3. Rini Dwiastuti, M.Sc., Apt. selaku dosen penguji yang telah memberikan
waktu, kesempatan, masukan, dan bimbingan selama penyelesaian skripsi ini.
4. Jeffry Julianus, M.Si. selaku dosen penguji dan dosen pendamping akademik,
atas waktu, masukan, dan semangat selama penyelesaian skripsi ini, dan atas
pendampingan dan perhatiannya terhadap perkembangan saya selama masa
viii
5. Sri Hartati Yuliani, M.Si., Apt. yang telah berkenan memberikan baku asam
ursolat untuk penelitian ini serta memberikan ide, bimbingan, dan bantuan
bagi penelitian ini.
6. Christine Patramurti, M.Si. atas waktu yang diluangkan untuk memberikan
masukan dan semangat selama penyusunan skripsi ini.
7. Bapak, Mama, Yohan, Yuda, Bulik, Dik Jati, dan Dik Dian, atas pengertian,
dukungan, doa, kesabaran, kasih, teguran, canda tawa, serta perhatian yang
selalu mengalir tanpa henti.
8. Seluruh dosen Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta atas
ilmu, pengalaman, semangat, dan persahabatan berharga yang diberikan.
9. Seluruh staf laboratorium, staf kebersihan, dan staf keamanan Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Terutama Mas Bimo, Pak
Musrifin, Pak Parlan, Mas Kunto, Pak Wagiran, Mas Otok, dan Pak Ketul
yang telah membantu kelancaran penulis dalam melakukan penelitian.
10.Elisa Aster Nugroho, sebagai partner selama kuliah dan skripsi. Terima kasih
atas kesabaran, kerja sama, masukan, persahabatan, dan semangat selama ini.
11.Sahabat-sahabat terbaik saya, Melisa Darmawan dan Eka Riusinta Wati.
Terima kasih untuk semua kasih sayang, perhatian, tawa, canda,
kebersamaan, pengalaman baru, bantuan, masukan, dan semangat di kala
sedih.
12.Felicia, Sari Tambunan, Prasilya, Regina Clarissa, Pius, Asti, Dian, dan
ix
13.Teman-teman Grup Antistres: Paul, Hepi, Adi, Velly, Vica, Rosi, Dhimas,
Usie, Sasa, Satya, Elisa, Novie, Ike, sebagai teman seperjuangan mengerjakan
skripsi di Laboratorium Analisis Instrumental. Terima kasih atas diskusi,
semangat, cerita, canda-tawa, masukan, dan kebersamaan selama kita bekerja
bersama.
14.Teman-teman kelompok praktikum C2: Usie, Sasa, Satya, Asti, Dian, Tika,
Seco, atas kekompakkan, kebersamaan, dan kerja sama selama kuliah,
praktikum, dan di luar itu.
15.Teman-teman angkatan 2008 yang bersedia mengisi sebagian cerita hidupku.
Terima kasih atas semua kebersamaan, bantuan selama perkuliahan, dan
pengalaman yang tak terlupakan. Semoga kita bisa berhasil lewat cara kita
masing-masing.
16.Semua pihak yang tidak dapat disebutkan satu per satu, atas segala bantuan,
semangat, dan doa yang menyertai penulis dari awal penelitian sampai akhir
terselesaikannya penulisan skripsi.
Penulis menyadari adanya kekurangan dalam penyusunan skripsi oleh
karena keterbatasan wawasan dan kemampuan. Penulis membuka diri untuk
menerrima saran yang membangun dari semua pihak. Dengan segala kerendahan
hati, penulis mengharapkan skripsi ini memberi manfaat bagi pembaca. Akhir
kata, penulis mempersembahkan skripsi ini bagi majunya ilmu pengetahuan
farmasi.
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 5
C. Keaslian Penelitian ... 5
D. Manfaat Penelitian ... 6
E. Tujuan Penelitian ... 6
1. Tujuan umum ... 6
xii
2. Pembuatan simplisia rumput mutiara ... 32
3. Pembuatan ekstrak rumput mutiara ... 32
4. Penetapan kandungan triterpen total ... 33
5. Analisis hasil ... 37
BAB IV HASIL DAN PEMBAHASAN ... 38
A. Determinasi Tanaman ... 38
B. Pengumpulan Bahan dan Pembuatan Serbuk Simplisia ... 38
1. Pengumpulan bahan ... 38
2. Sortasi basah ... 40
3. Pencucian ... 40
xiii
5. Sortasi kering ... 41
6. Pembuatan serbuk ... 42
C. Defatisasi ... 43
D. Digesti ... 45
E. Pengeringan Ekstrak Rumput Mutiara ... 49
F. Analisis Kualitatif dengan KLT ... 52
1. Pengamatan nilai Retardation Factor (Rf) asam ursolat ... 55
2. Perbandingan pola spektra baku asam ursolat dengan sampel ... 58
G. Analisis Kuantitatif dengan KLT-Densitometri ... 59
1. Penetapan panjang gelombang maksimum (λmaks) ... 59
2. Validasi metode ... 60
3. Kurva baku ... 68
4. Penetapan kandungan triterpen total dalam sampel secara KLT-Densitometri ... 70
H. Analisis Hasil Kadar Triterpen Total ... 72
BAB V KESIMPULAN DAN SARAN ... 78
A. Kesimpulan ... 78
B. Saran ... 78
DAFTAR PUSTAKA ... 79
LAMPIRAN ... 84
xiv
DAFTAR TABEL
Tabel I. Rancangan percobaan desain faktorial dengan dua faktor dan
dua level ... 25
Tabel II. Perbandingan suhu dan waktu digesti ... 33
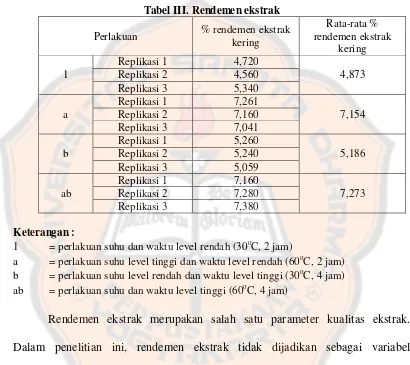
Tabel III. Rendemen ekstrak ... 51
Tabel IV. Harga Rf masing-masing bercak dengan eluen toluen-aseton-asam asetat (90:10:0,07) dan fase diam silika gel 60 F254 ... 56
Tabel V. Data % recovery baku asam ursolat ... 61
Tabel VI. Data % CV baku asam ursolat ... 63
Tabel VII. Nilai r seri baku asam ursolat ... 63
Tabel VIII. Perbandingan nilai Rf baku dan sampel, serta nilai resolusi ... 65
Tabel IX. Data recovery dan CV baku asam ursolat dalam matriks ekstrak ... 68
Tabel X. Data seri konsentrasi baku asam ursolat dengan AUC baku asam ursolat ... 69
Tabel XI. Kadar triterpen total dalam ekstrak pada setiap kondisi dan replikasi ... 71
Tabel XII. Kondisi desain faktorial dan respon yang dihasilkan ... 73
Tabel XIII. Nilai efek dari faktor suhu, waktu, dan interaksinya terhadap respon kadar triterpen total ... 73
xv
DAFTAR GAMBAR
Gambar 1. Rumput mutiara (Hedyotis corymbosa (L.) Lamk) ... 9
Gambar 2. Struktur kimia asam oleanolat dan asam ursolat ... 12
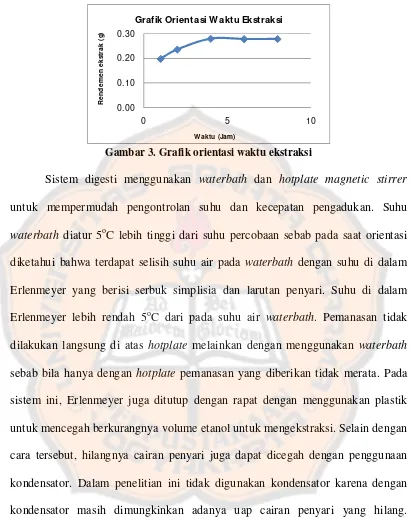
Gambar 3. Grafik orientasi waktu ekstraksi ... 48
Gambar 10. Interaksi asam ursolat dengan fase gerak toluen-aseton-asam asetat (90:10:0,07) ... 57
Gambar 11. Perbandingan pola spektra ekstrak adisi dengan baku asam ursolat ... 58
Gambar 16. Kromatogram ekstrak tanpa adisi baku asam ursolat ... 67
Gambar 17. Kromatogram ekstrak dengan adisi baku asam ursolat ... 67
xvi
Gambar 19. Profil KLT penetapan kadar triterpen total dalam ekstrak
etanolik herba rumput mutiara dilihat secara visual dengan
cahaya biasa ... 71
Gambar 20. Grafik hubungan suhu dan waktu ekstraksi terhadap kadar
xvii
DAFTAR LAMPIRAN
Lampiran 1. Surat Keterangan Determinasi ... 85
Lampiran 2. Certificate of Analysis Baku Asam Ursolat ... 86
Lampiran 3. Data Penimbangan Bahan ... 87
Lampiran 4. Sistem Kromatografi Lapis Tipis Densitometri yang Digunakan ... 88
Lampiran 5. Spektrum Baku Asam Ursolat pada 200-700 nm ... 89
Lampiran 6. Data Orientasi Waktu Ekstraksi ... 90
Lampiran 7. Validasi Metode ... 91
Lampiran 8. Perhitungan Kadar Triterpen Total ... 94
Lampiran 9. Data Rendemen Ekstrak ... 97
Lampiran 10. Notasi Desain Faktorial dan Percobaan Desain Faktorial ... 98
Lampiran 11. Data Desain Faktorial ... 98
Lampiran 12. Optimasi Fase Gerak ... 100
Lampiran 13. Kromatogram Kurva Baku Asam Ursolat Replikasi 3 ... 103
Lampiran 14. Kromatogram Akurasi dan Presisi Metode ... 104
Lampiran 15. Kromatogram Akurasi dan Presisi dalam Matriks Sampel ... 107
Lampiran 16. Kromatogram Penetapan Kadar ... 110
xviii INTISARI
Rumput mutiara (Hedyotis corymbosa (L.) Lamk) merupakan tanaman yang memiliki banyak manfaat untuk pengobatan, dengan kandungan utamanya adalah asam ursolat. Asam ursolat merupakan suatu senyawa triterpenoid yang telah diketahui memiliki banyak fungsi biologis seperti antikanker, antibakteri, hepatoprotektif, imunomodulator, antiproliferatif, inflamasi, dan anti-angiogenik. Salah satu tahapan dalam proses isolasi asam ursolat adalah ekstraksi. Pada penelitian ini dilakukan ekstraksi terhadap serbuk herba rumput mutiara secara digesti dengan perbedaan suhu dan waktu ekstraksi. Penelitian ini bertujuan untuk mengetahui kondisi proses digesti herba rumput mutiara yang dapat memberikan kadar triterpen total yang optimal pada level yang diteliti.
Penetapan kadar triterpen total menggunakan metode KLT-Densitometri dengan fase diam silika gel 60 F254 dan fase gerak toluen – aseton – asam asetat
(90:10:0,07). Analisis hasil dilakukan dengan metode desain faktorial dua faktor dan dua level menggunakan software ubuntu-10.04-DesFaktor-0,9® by ubuntu R OpenOffice.org (www.molmod.org).
Hasil penelitian menunjukkan bahwa suhu digesti merupakan faktor yang diprediksi dominan dan signifikan mempengaruhi perolehan kadar triterpen total, sedangkan waktu ekstraksi diprediksi berpengaruh signifikan terhadap perolehan kadar triterpen total namun bukan merupakan faktor yang diprediksi dominan. Tidak diperoleh area prediksi proses digesti yang optimum untuk memperoleh kadar triterpen total pada level yang diteliti.
xix ABSTRACK
Rumput mutiara (Hedyotis corymbosa (L.) Lamk) is a plant which has many benefit for medicinal treatment, with ursolic acid as its main compound. Ursolic acid is a triterpenoid which has been known has a lot of biological effects including antitumoral, antibacterial, hepatoprotective, immunomodulatory, antiproliferative, anti-inflammatory, and anti-angiogenic activities. One step in the isolation process of ursolic acid is extraction. This research shows an extraction process of rumput mutiara herb powder use digestion with different of temperature and time of extraction. The aim of this research is to know condition of digestion process of rumput mutiara herb which produce optimum concentration of total triterpenoid on the level studied.
Determination of total triterpenoid concentration use TLC-Densitometry method, with silica gel 60 F254 as stationary phase and toluene – acetone – acetic
acid (90:10:0,07) as mobile phase. Analysis of the results use factorial design method with two factors and two levels, use software ubuntu-10.04-DesFaktor-0,9® by ubuntu R OpenOffice.org (www.molmod.org).
The analysis result show that digestion temperature is the predicted dominant factor which influences the achievement of total triterpenoid concentration significantly, while time of extraction is predicted to affect the achievement of total triterpenoid concentration significantly too, but not an predicted dominant factor. There are no providable predicted optimum digestion process area to get total triterpenoid on the level studied.
1 BAB I
PENDAHULUAN
A. Latar Belakang
Kanker merupakan salah satu penyakit tidak menular yang menjadi masalah
kesehatan masyarakat, baik dunia maupun di Indonesia. Di dunia, 12% dari
seluruh kematian disebabkan oleh kanker. Kanker adalah pembunuh nomor 2
setelah penyakit kardiovaskular. WHO dan Bank Dunia, pada tahun 2005,
memperkirakan setiap tahunnya 12 juta orang di seluruh dunia menderita kanker
dan 7,6 juta di antaranya meninggal dunia. Prevalensi kanker di Indonesia adalah
4,3 per 1000 penduduk. Berdasarkan data Sistem Informasi Rumah Sakit (SIRS)
tahun 2007, kanker payudara menempati urutan pertama pada pasien rawat inap di
seluruh rumah sakit di Indonesia (16,85%), disusul kanker leher rahim (11,78%),
sedangkan kasus kanker bronkus dan paru pada pasien rawat inap sebesar 5,8%
dari seluruh jenis kanker (Depkes RI, 2011). Hal ini menyebabkan kebutuhan
akan senyawa antikanker semakin tinggi.
Telah banyak dilakukan penelitian terhadap senyawa-senyawa antikanker,
terutama yang berasal dari alam, salah satunya adalah asam ursolat. Asam ursolat
(3b-hydroxy-urs-12-en-28-oic acid) merupakan suatu senyawa triterpenoid
pentasiklik, anggota famili cyclosqualenoid. Dari hasil penelitian, senyawa ini
telah diketahui memiliki banyak fungsi biologis selain sebagai antikanker, antara
lain aktivitas antibakteri, hepatoprotektif, imunomodulator, antiproliferatif,
anti-inflamasi, dan anti-angiogenik (Cardenas, Quesada, and Medina, 2004). Dalam
hasil bahwa asam ursolat berpotensi untuk dikembangkan menjadi agen
co-kemoterapi. Sedangkan menurut Yamaguchi, Noshita, Kidachi, Umetsu, Hayashi,
dan Komiyama (2008), asam ursolat dapat menjadi suatu agen antitumor yang
menjanjikan, karena bekerja spesifik pada sel tumor dan menyebabkan kerusakan
yang sangat kecil pada sel normal.
Asam ursolat dapat ditemukan pada cukup banyak jenis tanaman obat. Salah
satu tanaman yang mengandung asam ursolat adalah rumput mutiara (Hedyotis
corymbosa (L.) Lamk). Rumput mutiara termasuk ke dalam famili Rubiaceae.
Gentry (1993) menyebutkan bahwa anggota suku Rubiaceae merupakan salah satu
sumber obat etnis. Di Indonesia tumbuhan ini belum dimanfaatkan secara optimal
dalam pengobatan. Rumput mutiara sendiri telah diketahui memiliki banyak
manfaat untuk pengobatan, seperti hepatoprotektif (Sadasivan, Latha, Sasikumar,
Rajashekaran, Shyamal, and Shine, 2006), antitumor (Liang et al., 2008),
menghilangkan panas dan toksik, antiradang, diuretik, menyembuhkan bisul
(anticarbuncular), dan mengaktifkan sirkulasi darah (Hariana, 2006). Rumput
mutiara sangat mudah ditemukan ataupun dibudidayakan di Indonesia,
menyebabkan tanaman ini berpotensi untuk dikembangkan menjadi salah satu
tanaman obat tradisional. Menurut Liang et al. (2008), asam ursolat dan asam
oleanolat merupakan kandungan utama dari rumput mutiara, oleh karenanya
digunakan sebagai marker bagi tanaman tersebut. Kandungan asam ursolat sendiri
lebih banyak dibandingkan asam oleanolat. Kedua senyawa tersebut merupakan
isomer dengan struktur kimia yang sangat mirip, menyebabkan keduanya sangat
Yamaguchi et al. (2008) mengekstraksi asam ursolat dari kulit buah apel
menggunakan pelarut kombinasi n-heksana, kloroform, dan metanol sedangkan
Haryanti et al. (2009) mengekstraksi asam ursolat dari rumput mutiara
menggunakan pelarut etanol 96%. Schneider, Hosseiny, Szczotka, Jordan, dan
Schlitter (2008) menyebutkan bahwa pelarut alkohol, seperti metanol dan etanol
memberikan hasil yang tinggi dalam ekstraksi asam ursolat dari tanaman. Hasil
penelitian Xia, Wang, Xu, Zhu, Song, dan Li (2011) menunjukkan bahwa pelarut
etanol memberikan hasil ekstraksi asam ursolat terbanyak dibandingkan pelarut
metanol dan air dalam ekstraksi dengan metode Microwave-Assisted Extraction.
Dalam penelitian tersebut, disebutkan pula bahwa asam ursolat dapat terdegradasi
dalam waktu tertentu, menyebabkan menurunnya hasil ekstraksi, sehingga perlu
dilakukan optimasi lama waktu ekstraksi. Wang dan Weller (2006) menyebutkan
bahwa secara umum, suhu ekstraksi dapat mempengaruhi perolehan senyawa
aktif. Peningkatan suhu medium ekstraksi dapat meningkatkan kemampuan
berdifusi pelarut ke dalam sel dan akibatnya meningkatkan kelarutan senyawa.
Oleh karena itu, perlu dilakukan optimasi suhu dan lama waktu ekstraksi untuk
mendapatkan hasil yang optimum.
Kandungan asam ursolat yang cukup banyak dalam rumput mutiara dan
sifatnya yang mudah larut dalam larutan penyari (etanol 96%) menyebabkan
ekstraksi dengan metode digesti sangat sesuai. Selain itu, metode ini
menggunakan peralatan yang sederhana dan mudah dilakukan. Pemisahan asam
ursolat dan asam oleanolat sangat sulit untuk dilakukan sehingga dalam penelitian
bahwa asam ursolat merupakan kandungan triterpen terbanyak dalam rumput
mutiara (Liang et al., 2008). Kadar triterpen total yang diperoleh dari setiap
kondisi ekstraksi akan dihitung dengan KLT-Densitometri. Terdapat banyak
keuntungan dari penggunaan Kromatografi Lapis Tipis (KLT), dimana salah satu
keuntungan utamanya adalah mampu memisahkan beberapa sampel secara
bersamaan, yang lebih menguntungkan dibandingkan Kromatografi Cair Kinerja
Tinggi (KCKT) (Watson, 2009). Densitometri merupakan metode analisis
instrumental yang didasarkan pada interaksi radiasi elektromagnetik dengan analit
yang merupakan bercak pada Kromatografi Lapis Tipis (KLT). Densitometri
dimaksudkan untuk analisis kuantitatif analit dengan kadar kecil, yang
sebelumnya dilakukan pemisahan dengan Kromatografi Lapis Tipis (KLT)
(Gandjar and Rohman, 2009).
Penelitian ini dimulai dengan preparasi herba rumput mutiara meliputi
sortasi kering, pencucian, pengeringan, dan penyerbukan. Ekstraksi dilakukan
secara digesti dengan variasi suhu dan waktu ekstraksi. Analisis kuantitatif
kandungan triterpen dilakukan dengan metode KLT-Densitometri. Optimasi
proses digesti dengan variasi suhu dan waktu ekstraksi menggunakan aplikasi
desain faktorial dan dilanjutkan dengan uji ANOVA (taraf kepercayaan 95%).
Pengolahan data dilakukan dengan menggunakan software
ubuntu-10.04-DesFaktor-0,9® by ubuntu R OpenOffice.org (www.molmod.org). Kadar triterpen
total yang diperoleh dari tiap variasi suhu dan waktu ekstraksi akan dihitung dan
dianalisis menggunakan desain faktorial untuk menentukan faktor dominan,
menentukan signifikansi faktor, dan pembuatan contour plot untuk memperoleh
area optimum suhu dan waktu ekstraksi yang menghasilkan kadar triterpen total
paling optimum pada level yang diteliti.
Tujuan penelitian ini adalah mencari area optimum kondisi proses digesti
dengan variasi suhu dan waktu ekstraksi sehingga dapat memberi solusi dalam
pengadaan ekstrak rumput mutiara yang memiliki kandungan triterpen yang
optimum.
B. Perumusan Masalah
Permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut:
1. Apakah perbedaan suhu dan waktu ekstraksi pada proses digesti herba rumput
mutiara berpengaruh terhadap kadar triterpen total yang diperoleh?
2. Manakah faktor antara suhu, waktu ekstraksi, dan interaksi keduanya yang
paling dominan berpengaruh pada proses digesti herba rumput mutiara
sehingga diperoleh kadar triterpen total yang optimum?
3. Apakah diperoleh area suhu dan waktu ekstraksi yang optimum pada digesti
herba rumput mutiara terbatas pada level yang diteliti?
C. Keaslian Penelitian
Sejauh pengetahuan penulis, penelitian tentang optimasi suhu dan waktu
ekstraksi dalam proses digesti herba rumput mutiara terhadap kadar asam ursolat
maupun triterpen dengan aplikasi desain faktorial belum pernah dilakukan oleh
peneliti lain. Sejauh peneliti mengetahui, penetapan kadar asam ursolat pernah
Hedyotis corymbosa (L.) Lamk) dengan metode HPLC (Liang et al., 2009).
Dalam penelitian tersebut juga dilakukan validasi dan optimasi ekstraksi, dimana
pelarut yang digunakan adalah aseton dan metode penetapan kadarnya
menggunakan HPLC-DAD. Selain itu, pernah juga dilakukan isolasi terhadap
asam ursolat dari kulit apel (Yamaguchi et al., 2008), dan Ixora coccinea (Latha
et al., 2001), serta kuantifikasi asam ursolat dalam tanaman Ocimum sanctum
(Anandjiwala et al., 2006).
D. Manfaat Penelitian
Secara teoritis, penelitian ini bermanfaat untuk menambah informasi dalam
ilmu kefarmasian, khususnya mengenai pengaruh perbedaan suhu dan waktu
ekstraksi terhadap kadar triterpen total yang dihasilkan pada proses digesti serbuk
herba rumput mutiara.
Secara praktis, penelitian ini diharapkan dapat memberikan data mengenai
suhu dan waktu ekstraksi yang paling optimal untuk mendapatkan ekstrak herba
rumput mutiara yang paling optimum.
E. Tujuan Penelitian
1. Tujuan umum
Secara umum, penelitian ini bertujuan untuk menambah informasi mengenai
kondisi proses digesti yang optimal untuk memperoleh kadar triterpen total yang
2. Tujuan khusus
a. Mengetahui pengaruh perbedaan suhu dan waktu ekstraksi pada proses
digesti herba rumput mutiara terhadap kadar triterpen total yang
diperoleh.
b. Mengetahui faktor antara suhu, waktu ekstraksi, dan interaksi keduanya
yang paling dominan berpengaruh pada proses digesti herba rumput
mutiara sehingga diperoleh kadar triterpen total yang optimum.
c. Mengetahui area suhu dan waktu ekstraksi yang optimum pada digesti
8 BAB II
PENELAAHAN PUSTAKA
A. Rumput Mutiara
1. Keterangan botani
Rumput mutiara (Hedyotis corymbosa (L.) Lamk) termasuk dalam familia
Rubiaceae. Tanaman ini memiliki sinonim Oldenlandia corymbosa L. dan nama
daerah rumput siku-siku, bunga telor belungkas (Indonesia); daun mutiara,
rumput mutiara (Jakarta); katepan, urek-urek polo (Jawa); dan pengka (Makasar)
(Wijayakesuma, 1992).
2. Morfologi
Rumput mutiara merupakan rumput yang tumbuh rindang berserak, agak
lemah, tinggi 15-35 cm, tumbuh subur pada tanah yang lembab, mempunyai
banyak percabangan. Batang bersegi, daun berhadapan bersilang, tangkai daun
pendek/hampir duduk, panjang daun 2-3,5 cm, ujung runcing, tulang daun di
tengah. Ujung daun mempunyai rambut yang pendek. Bunga keluar dari ketiak
daun, bentuknya seperti payung berwarna putih, berupa bunga majemuk 2-5,
tangkai bunga (induk) keras, panjangnya 5-10 mm. Buah bulat, ujungnya
pecah-pecah (Wijayakesuma, 1992). Buahnya bulat kukuh dan dihiasi oleh 4 helai daun
kelopak (de Voogd, 1950).
3. Kandungan kimia
Herba rumput mutiara memiliki kandungan kimia berupa asam ursolat,
asam oleanolat, stigmasterol, β-sitosterol, dan glikosida flavonoid
Gambar 1. Rumput mutiara (Hedyotis corymbosa (L.) Lamk)
4. Bagian yang dapat digunakan
Bagian tanaman yang dapat digunakan dalam pengobatan adalah seluruh
bagian dari tanaman baik dalam keadaan segar atau yang telah dikeringkan
(Wijayakesuma, 1992).
B. Terpenoid
Terpen merupakan senyawa hasil kondensasi linier asam asetat dengan dua
atom karbon. Asam asetat melalui berbagai cara akan menjadi asam malonat yang
akhirnya menjadi beberapa senyawa terpen. Terpen merupakan senyawa
hidrokarbon jenuh atau tak jenuh dengan jumlah atom C merupakan kelipatan
lima. Selanjutnya senyawa terpen digolongkan atas dasar jumlah atom C
penyusunnya. Istilah terpen diganti dengan terpenoid mengingat senyawa
hidrokarbon tersebut mempunyai gugus fungsional yang mengandung atom O,
dan diketahui bahwa biosintetik terpenoid merupakan polimerisasi senyawa
isoprena. Terpenoid digolongkan menjadi:
a. Monoterpenoid dengan jumlah atom C = 10
c. Diterpenoid dengan jumlah atom C = 20
d. Sesterpenoid dengan jumlah atom C = 25
e. Triterpenoid dengan jumlah atom C = 30
f. Tetraterpenoid dengan jumlah atom C = 40 (Mursyidi, 1990).
Secara kimia, terpenoid umumnya larut dalam lemak dan terdapat di dalam
sitoplasma sel tumbuhan. Biasanya terpenoid diekstraksi dari jaringan tumbuhan
dengan memakai eter minyak bumi, eter, atau kloroform, dan dapat dipisahkan
secara kromatografi pada silika gel atau alumina memakai pelarut di atas. Tetapi,
sering ada kesukaran sewaktu mendeteksi dalam skala mikro karena tidak
berwarna dan tidak ada pereaksi kromogenik semesta yang peka. Sering kali kita
harus mengandalkan cara deteksi yang nisbi tidak khas pada plat KLT, yaitu
penyemprotan dengan asam sulfat pekat, diteruskan dengan pemanasan (Harbone,
1987).
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isopren dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa ini berstruktur siklik yang nisbi rumit, kebanyakan
berupa alkohol, aldehida, atau asam karboksilat. Semua jenis triterpenoid
dipisahkan dengan cara yang serupa, terutama didasarkan kepada KLT dan KGC
(Harbone, 1987).
C. Asam Ursolat dan Asam Oleanolat
Asam ursolat, 3β-hydroxyurs-12-en-28-oic acid; urson; prunol;
micromerol; malol. C30H48O3; berat molekul 456,68 g/mol (C 78,90%, H 10,59%,
(bearberry), Vaccinium macrocarpon Art (cranberry), Rodhodendron
hymenanthas Makino, Ericaceae. Terdapat juga pada lapisan pelindung seperti
minyak pada apel, pir, prem, dan buah-buah lainnya. Larut pada suhu 15oC. 1
bagian larut dalam 88 bagian metanol, 178 bagian alkohol, 140 bagian eter, 388
bagian kloroform, 1675 bagian karbon disulfida. Cukup larut dalam aseton. Larut
dalam asam asetat glasial panas dan dalam NaOH 2% dalam alkohol. Tidak larut
dalam aquadest dan petroleum eter. Titik lebur 285o-288oC (Budavari, O`Neil,
Smith, and Heckelman, 1989).
Asam ursolat merupakan triterpenoid pentasiklik, anggota famili
cyclosqualenoid, ditemukan di banyak tanaman obat. Asam ursolat diketahui
dapat menghambat replikasi DNA, aktivitas tirosin kinase, dan ekspresi
lipoksigenase, siklooksigenase-2, menginduksi sintesis nitrit oksida, dan matriks
metalloproteinase-9. Semua efek molekuler ini dapat menyebabkan efek biologis
pleiotropis, termasuk aktivitas antibakteri, hepatoprotektif, imunomodulator,
antiproliferasi, antitumor, antiinflamasi, dan anti-angiogenik (Cardenas et al.,
2004).
Asam oleanolat, 3-hydroxyolean-12-en-28-oic acid; oleanol; caryophyllin.
C30H48O3; berat molekul 456,71 g/mol (C 78,90%, H 10,59%, O 10,51%). Berupa
serbuk halus, kristal berbentuk jarum.Titik lebur 310oC. K = 3x10-7. Tidak larut
dalam aquadest. Larut dalam 65 bagian eter, 106 bagian alkohol 95%, 35 bagian
alkohol 95% panas, 118 bagian kloroform, 180 bagian aseton, 235 bagian metanol
Asam ursolat dan asam oleanolat adalah isomer dengan struktur kimia
yang mirip, dan akibatnya sulit untuk dipisahkan (Liang et al., 2009).
Perbedaannya hanya pada konfigurasi gugus metil pada cincin E (Du and Chen,
2008).
.
Gambar 2. Struktur kimia asam oleanolat dan asam ursolat (Gbaguidi, Accrombessi, Moudachirou, and Quetin-Leclercq, 2005)
D. Pembuatan Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain simplisia
merupakan bahan yang dikeringkan. Simplisia dapat berupa simplisia nabati,
simplisia hewani, dan simplisia pelikan. Simplisia harus memenuhi persyaratan
minimal untuk menjamin keseragaman senyawa aktif, keamanan maupun
kegunaannya. Faktor yang berpengaruh adalah bahan baku simplisia, proses
pembuatan simplisia termasuk cara penyimpanan bahan baku simplisia dan cara
pengepakan dan penyimpanan simplisia (Depkes RI, 1986).
1. Pengumpulan bahan baku
Kadar senyawa aktif dalam suatu simplisia berbeda-beda, antara lain
tergantung pada :
a. Umur tanaman yang dipanen. Umur tanaman yang dipanen berpengaruh
pada kadar senyawa aktif. Apabila umur tanaman pada saat panen sama,
maka mutu simplisia yang dihasilkan juga akan sama.
b. Lingkungan tempat tumbuh. Lingkungan tempat tumbuh yang berbeda
dapat mengakibatkan perbedaan kadar kandungan senyawa aktif.
Pertumbuhan tanaman dipengaruhi tinggi tempat, keadaan tanah, dan cuaca.
c. Waktu panen. Waktu panen sangat erat hubungannya dengan pembentukan
senyawa aktif di dalam bagian tanaman yang akan dipanen. Waktu panen
yang tepat adalah pada saat bagian tanaman tersebut mengandung senyawa
aktif dalam jumlah yang terbesar. Panen dapat dilakukan dengan tangan,
menggunakan alat atau mesin. Dalam hal ini ketrampilan pemetik
diperlukan, agar diperoleh simplisia yang benar, tidak tercampur dengan
bagian lain dan tidak merusak tanaman induk. Alat atau mesin yang
digunakan untuk memetik perlu dipilih yang sesuai. Alat yang terbuat dari
logam sebaiknya tidak digunakan bila diperkirakan akan merusak senyawa
aktif simplisia seperti fenol, glikosida, dan sebagainya (Depkes RI, 1986).
2. Sortasi basah
Dalam proses pembuatan simplisia, setelah bahan baku dikumpulkan,
kemudian dilakukan sortasi basah terhadap bahan baku tersebut. Sortasi basah
dilakukan untuk memisahkan kotoran-kotoran atau bahan-bahan asing lainnya
dan bahan simplisia. Misalnya pada simplisia yang dibuat dari akar suatu
tanaman obat, bahan-bahan asing seperti tanah, kerikil, rumput, batang daun,
bermacam-macam mikroba dalam jumlah yang tinggi, oleh karena itu
pembersihan simplisia dari tanah yang terikut dapat mengurangi jumlah mikroba
awal (Depkes RI, 1986).
3. Pencucian
Pencucian dilakukan untuk menghilangkan tanah dan pengotor lainnya
yang melekat pada bahan simplisia. Pencucian dilakukan dengan air bersih,
misalnya air dari mata air, air sumur, atau air PAM. Bahan simplisia yang
mengandung zat yang mudah larut dalam air yang mengalir, pencucian agar
dilakukan dalam waktu yang sesingkat mungkin. Pencucian sayur-sayuran 1 kali
dapat menghilangkan 25% dari jumlah mikroba awal. Jika dilakukan pencucian
3 kali, jumlah mikroba yang tertinggal hanya 42% dari jumlah mikroba awal.
Pencucian tidak dapat membersihkan semua mikroba karena air pencucian yang
digunakan biasanya mengandung sejumlah mikroba juga (Depkes RI, 1986).
4. Pengeringan
Tujuan pengeringan ialah untuk mendapatkan simplisia yang tidak mudah
rusak, sehingga dapat disimpan dalam waktu yang lebih lama. Dengan
mengurangi kadar air dan menghentikan reaksi enzimatik maka penurunan mutu
atau perusakan simplisia dapat dicegah. Air yang masih tersisa dalam simplisia
pada kadar tertentu dapat merupakan media pertumbuhan kapang dan jasad renik
lainnya. Pengeringan simplisia dilakukan dengan menggunakan sinar matahari
atau menggunakan suatu alat pengering. Hal-hal yang perlu diperhatikan selama
proses pengeringan adalah suhu pengeringan, kelembaban udara, aliran udara,
Suhu pengeringan tergantung pada bahan simplisia dan cara
pengeringannya. Bahan simplisia dapat dikeringkan pada suhu 30-90oC, tetapi
suhu yang terbaik adalah tidak melebihi 60oC (Depkes RI, 1986).
5. Sortasi kering
Sortasi setelah pengeringan sebenarnya merupakan tahap akhir pembuatan
simplisia. Tujuan sortasi untuk memisahkan benda-benda asing seperti
bagian-bagian tanaman yang tidak diinginkan dan pengotor-pengotor lain yang masih
ada dan tertinggal pada simplisia kering (Depkes RI, 1986).
E. Penyarian
Penyarian (ekstraksi) merupakan kegiatan penarikan zat yang dapat larut
dari bahan yang tidak dapat larut dengan cairan penyari. Pada proses penyarian
terjadi perpindahan masa zat aktif yang semula berada di dalam sel akan ditarik
oleh cairan penyari. Hasil penyarian akan semakin baik apabila ukuran serbuk
semakin halus, karena permukaan serbuk simplisia yang bersentuhan dengan
cairan penyari semakin luas, tetapi dalam pelaksanaannya tidak selalu demikian,
karena penyarian masih tergantung juga pada sifat fisik dan kimia simplisia yang
bersangkutan. Simplisia yang terlalu halus akan memberikan kesulitan pada
proses penyaringan. Serbuk yang terlalu halus akan mempersulit penyaringan,
karena butir-butir halus tadi membentuk suspensi yang sulit dipisahkan dengan
hasil penyarian. Hasil penyarian tidak murni lagi tetapi tercampur dengan
partikel-partikel halus tadi. Penyerbukan yang terlalu halus menyebabkan banyak dinding
sel yang pecah, sehingga zat yang tidak diinginkan pun ikut ke dalam hasil
Pada pengeringan tumbuhan segar maka protoplasma akan mengkerut.
Mengalirnya bahan pelarut ke dalam ruang sel juga menyebabkan protoplasma
membengkak, dan bahan kandungan sel akan terlarut sesuai dengan kelarutannya.
Bahan kandungan sel berpindah, sejauh bahan tersebut terlarut molekuler,
mengikuti difusi melalui ruang antarmiselar. Faktor pendorong yang bekerja
adalah adanya perbedaan konsentrasi antara larutan di dalam sel dengan cairan
penyari yang mula-mula masih tanpa bahan aktif yang mengelilinginya. Bahan
kandungan sel akan mencapai ke dalam cairan di sebelah luar selama difusi
melintasi membran sampai terbentuknya suatu keseimbangan konsentrasi antara
larutan di sebelah dalam dan di sebelah luar sel (Voigt, 1994).
1. Ekstrak
Ekstrak adalah sediaan kering, kental atau cair yang dibuat dengan
menyari simplisia nabati atau hewani menurut cara yang cocok (Depkes RI,
1979). Menurut Voigt (1994), ekstrak dikelompokkan menurut sifat-sifatnya
menjadi:
a. Ekstrak encer (extractum tenue). Sediaan ekstrak encer ini memiliki
konsistensi madu dan mudah dituang.
b. Ekstrak kental (extractum spissum). Sediaan ekstrak kental ini memiliki
konsistensi liat dalam keadaan dingin dan tidak dapat dituang serta
kandungan airnya berjumlah sampai 30%.
c. Ekstrak kering (extractum siccum). Sediaan ekstrak kering ini memiliki
konsistensi kering dan mudah digosokkan dengan kandungan lembab tidak
d. Ekstrak cair (extractum fluidum). Pada ekstrak cair memiliki konsistensi cair
dan mudah dituang.
Ekstrak kering adalah ekstrak dimana semua pelarutnya diuapkan sampai
semua pelarut menguap (Sumaryono, 2004).
2. Cairan penyari
Pelarut yang digunakan dalam proses ekstraksi harus memenuhi syarat
berikut:
a. Memiliki selektivitas tinggi terhadap zat yang akan diekstraksi.
b. Tidak bereaksi dengan zat yang akan diekstraksi dan dengan zat lain yang
ada dalam tanaman.
c. Murah.
d. Tidak berbahaya bagi manusia dan lingkungan.
e. Mudah menguap.
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol, atau
pelarut lainnya. Penyarian pada perusahaan obat tradisional masih terbatas pada
penggunaan cairan penyari air, etanol, atau air-etanol. Etanol dipertimbangkan
sebagai penyari karena lebih selektif, kapang dan kuman sulit tumbuh dalam
etanol 20% ke atas, tidak beracun, netral, absorbsinya baik, etanol dapat
bercampur dengan air pada segala perbandingan, panas yang diperlukan untuk
pemekatan lebih sedikit (Depkes RI, 1986).
Etanol mengandung tidak kurang dari 92,3% b/b dan tidak lebih dari
93,8% b/b, setara dengan tidak kurang dari 94,9% v/v dan tidak lebih dari 96%
tidak berwarna. Bau khas dan menyebabkan rasa terbakar pada lidah. Mudah
menguap walaupun pada suhu rendah dan mendidih pada suhu 78oC. Bercampur
dengan air dan praktis larut dengan semua pelarut organik (Depkes RI, 1995).
3. Digesti
Digesti adalah cara maserasi dengan menggunakan pemanasan lemah,
yaitu pada suhu 40o-50oC. Cara maserasi ini hanya dapat dilakukan untuk
simplisia yang zat aktifnya tahan terhadap pemanasan. Dengan pemanasan akan
diperoleh keuntungan antara lain:
a. Kekentalan pelarut berkurang, yang dapat mengakibatkan berkurangnya
lapisan-lapisan batas.
b. Daya melarutkan cairan penyari akan meningkat, sehingga pemanasan
tersebut mempunyai pengaruh yang sama dengan pengadukan.
c. Koefisien difusi berbanding lurus dengan suhu absolut dan berbanding
terbalik dengan kekentalan, hingga kenaikan suhu akan berpengaruh pada
kecepatan difusi. Umumnya kelarutan zat aktif akan meningkat bila suhu
dinaikkan (Depkes RI, 1986).
Pada proses maserasi, cairan penyari akan menembus dinding sel dan
masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan
karena adanya perbedaan konsentrasi antara larutan zat aktif di luar sel dan di
dalam sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut
berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar dan di
dalam sel. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol
Pengadukan diperlukan untuk meratakan konsentrasi larutan di luar butir
serbuk simplisia, sehingga dengan pengadukan tersebut tetap terjaga adanya
derajat perbedaan konsentrasi yang sekecil-kecilnya antara larutan di dalam sel
dengan larutan di luar sel. Penggunaan mesin pengaduk yang berputar
terus-menerus dapat mempersingkat waktu proses ekstraksi menjadi 6 sampai 24 jam
(Depkes RI, 1986).
4. Penguapan
Penguapan merupakan proses terbentuknya uap dari permukaan cairan.
Kecepatan terbentuknya uap tergantung pada difusi uap melalui lapisan batas di
atas cairan yang diuapkan. Kecepatan penguapan tergantung pada kecepatan
pemindahan panas. Oleh karena itu luas permukaan penguapan harus seluas
mungkin dan lapisan batas dikurangi (Depkes RI, 1986).
F. Kromatografi Lapis Tipis (KLT)
Kromatografi adalah cara pemisahan zat khasiat dan zat lain yang ada
dalam sediaan dengan jalan penyarian berfraksi, penyerapan, atau penukaran ion
pada zat berpori, menggunakan cairan atau gas yang mengalir. Kromatografi lapis
tipis (KLT) digunakan untuk pemisahan senyawa secara cepat, dengan
menggunakan zat penjerap berupa serbuk halus yang dilapiskan rata pada
lempeng kaca (Depkes RI, 1979).
Campuran yang akan dipisahkan, berupa larutan, ditotolkan berupa bercak
atau pita. Setelah plat atau lapisan ditaruh di dalam bejana tertutup rapat yang
berisi fase gerak yang cocok, pemisahan terjadi selama pengembangan.
Fase diam dibuat dari salah satu penjerap yang khusus digunakan untuk
KLT yang dihasilkan oleh berbagai perusahaan. Panjang lapisan tersebut 200 nm
dengan lebar 200 atau 100 mm. Untuk analisis, tebalnya 0,1-0,3 mm, biasanya 0,2
mm. Sebelum digunakan, lapisan disimpan dalam lingkungan yang tidak lembab
atau bebas dari uap laboratorium (Stahl, 1985).
Fase diam yang umum ialah silika gel, aluminium oksida, kieselgur,
selulosa dan turunannya, dan lain-lain. Silika gel paling banyak digunakan (Stahl,
1985). Silika gel GF254 artinya silika tersebut mengandung gypsum (CaSO4½H2O)
yang merupakan pengikat, dengan cara meningkatkan gaya adhesi antara partikel
senyawa dengan silika dan juga meningkatkan gaya adhesi antar partikel silika.
F254 adalah indikator fosforesensi pada panjang gelombang 254 nm yang berarti
silika tersebut dapat berfosforesensi pada panjang gelombang 254 nm (Jork,
1990).
Fase gerak ialah medium angkut dan terdiri atas satu atau beberapa pelarut.
Pelarut bergerak di dalam fase diam, yaitu suatu lapisan berpori, karena ada gaya
kapiler. Pelarut yang digunakan hanyalah bertingkat mutu analitik dan bila
diperlukan, sistem pelarut multikomponen ini harus berupa suatu campuran
sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985).
Bercak ditotolkan pada jarak 15 mm dari tepi lapisan bawah. Jarak suatu
bercak awal, yang berukuran 3-5 mm, ke bercak awal lainnya dan jarak antara
bercak paling pinggir dengan tepi samping sekurang-kurangnya 10 mm. Lapisan
fase diam tidak boleh rusak selama penotolan cuplikan itu. Biasanya ditotolkan
mikropipet berujung runcing, khusus berskala 1 µL dan bervolume 10 µL (Stahl,
1985).
Di samping larutan cuplikan, selalu ada suatu campuran pembanding yang
dikembangkan pada waktu bersamaan. Campuran ini terdiri atas 1-5 senyawa
yang diketahui, dengan konsentrasi yang telah diketahui pula. Bila mungkin,
senyawa pembanding ini sama dengan senyawa yang terdapat dalam larutan
cuplikan (Stahl, 1985).
Bejana harus dapat menampung plat 200 x 200 mm dan harus tertutup
rapat. Untuk kromatografi dalam bejana yang jenuh, secarik kertas saring bersih
yang lebarnya 18-20 cm dan panjangnya 45 cm ditaruh pada dinding sebelah
dalam bejana berbentuk U dan dibasahi dengan pelarut pengembang. Tingkat
kejenuhan bejana mempunyai pengaruh yang nyata pada pemisahan dan letak
bercak (Stahl, 1985).
Proses kerja dengan KLT yaitu dengan menempatkan pada dua sisi bejana
kromatografi, 2 helai kertas saring, tinggi 18 cm, lebar sama dengan panjang
bejana. Larutan fase gerak dimasukkan kurang lebih 100 mL ke dalam bejana
kromatografi hingga tinggi pelarut 0,5 cm sampai 1 cm, kemudian ditutup rapat
dan kertas saring harus basah seluruhnya. Pada dasar bejana, kertas saring harus
tercelup ke dalam pelarut. Tahap selanjutnya yaitu dilakukan penotolan larutan
sampel dan standar, menurut cara yang tertera pada masing-masing monografi
dengan jarak kira-kira 1,5-2 cm dari tepi bawah lempeng, biarkan kering. Bejana
kemudian ditutup rapat dan dibiarkan hingga pelarut merambat 10-15 cm di atas
Terdapat berbagai kemungkinan untuk deteksi senyawa tak berwarna pada
kromatogram. Deteksi paling sederhana adalah jika senyawa menunjukkan
penyerapan di daerah UV 254 nm atau jika senyawa itu dapat dieksitasi ke
fluorosensi radiasi UV 365 nm. Selain itu, senyawa juga dapat dideteksi dengan
pereaksi semprot dan pemanasan (Stahl, 1985).
Identifikasi senyawa pada lempeng KLT dinyatakan dengan harga Rf.
Angka ini diperoleh dengan membagi jarak yang ditempuh oleh totolan cuplikan
dengan jarak yang ditempuh oleh pelarut. Keduanya diukur dari titik awal, dan
harga Rf beragam mulai dari 0 sampai 1 (Gritter, 1985). Penilaian visual
kromatogram diperoleh dengan pengamatan 2 bercak dengan harga Rf dan ukuran
yang hampir sama (Depkes RI, 1979). Selain itu, beberapa sifat, misalnya
fluorosensi atau pemadaman fluorosensi, dan terutama warna hasil reaksi warna
juga dapat dijadikan penilaian visual. Informasi mengenai identitas seringkali
dapat juga diperoleh dengan membandingkan perubahan warna pada pemanasan,
dan selanjutnya pada penyimpanan plat (Stahl, 1985).
Dengan menggunakan KLT, pemisahan senyawa yang amat berbeda
seperti senyawa organik alam dan senyawa organik sintetik, kompleks
anorganik-organik, dan bahkan ion ananorganik-organik, dapat dilakukan dalam beberapa menit dengan
biaya yang tidak terlalu mahal. Kelebihan KLT yang lain ialah pemakaian pelarut
dan cuplikan yang jumlahnya sedikit (Gritter, 1985).
G. Densitometri
Densitometri merupakan salah satu metode analisis KLT kuantitatif.
dipisahkan, dibandingkan dengan kerapatan bercak senyawa standar yang dielusi
bersama-sama. Syarat-syarat senyawa standar adalah murni, inert, dan stabil
(Hardjono, 1983).
Alat densitometri mempunyai sumber sinar yang bergerak di atas bercak
pemisahan pada lempeng kromatografi yang akan ditetapkan kadar komponennya.
Lazimnya lempeng itu digerakkan menyusuri berkas sinar tersebut. Bercak yang
kecil dan intensif akan menghasilkan suatu puncak kurva absorbsi yang sempit
dan tajam, sebaliknya bercak yang lebar akan menghasilkan puncak kurva
absorbsi yang melebar dan tumpul (Sudjadi, 1988).
Banyak sinar yang direfleksikan akan ditangkap oleh suatu alat yang
disebut reflection photomultiplier yang akan diteruskan ke pencatat atau rekorder
untuk diubah menjadi suatu puncak atau kromatogram. Luas puncak atau tinggi
puncak sesuai dengan konsentrasi senyawa pada noda yang dukur kerapatannya
(Mintarsih, 1990).
Penelusuran bercak akan mendapatkan hasil yang baik apabila dilakukan
pada panjang gelombang maksimum, karena perubahan konsentrasi pada bercak
sedikit saja sudah dapat terdeteksi. Pengukuran dilakukan dengan menelusuri
bercak yang akan ditetapkan kadarnya pada kisaran panjang gelombang zat
tersebut (Mintarsih, 1990).
Plat yang digunakan untuk KLT-densitometri sebaiknya digunakan plat
buatan pabrik karena pada plat buatan sendiri fase diamnya kurang kompak,
sehingga akan mempengaruhi hasil penelusuran dengan densitometri yaitu berupa
fase diam sedangkan puncak yang kasar disebabkan permukaan plat yang kurang
rata (Mintarsih, 1990).
Teknik pengukuran dapat didasarkan atas pengukuran intensitas sinar yang
diserap (absorbansi), intensitas sinar yang dipantulkan (reflaktansi), atau intensitas
sinar yang difluorosensikan. Teknik pengukuran berdasarkan refleksi dimana sinar
datang sebagian diserap dan sebagian lagi dipantulkan (Mintarsih, 1990).
Ada dua cara penetapan kadar dengan alat densitometer. Pertama, setiap
kali penetapan ditotolkan sediaan baku dari senyawa yang bersangkutan dan
dielusi bersama dalam satu lempeng, kemudian AUC (luas daerah di bawah
kurva) sampel dibandingkan dengan harga AUC zat baku. Yang kedua, dengan
membuat kurva baku hubungan antara jumlah zat baku dengan AUC. Kurva baku
diperoleh dengan membuat totolan zat baku pada plat KLT dengan
bermacam-macam konsentrasi (minimal 3 bermacam-macam konsentrasi). Bercak yang diperoleh dicari
AUC nya dengan alat densitometer. Dari kurva baku diperoleh persamaan y = bx
+ a, dimana x adalah banyaknya zat yang ditotolkan dan y adalah AUC
(Supardjan, 1987).
H. Desain Faktorial
Metode desain faktorial adalah sistem desain eksperimental dimana
faktor-faktor yang terlibat dalam suatu reaksi atau proses dapat dievaluasi secara
simultan dan mengukur efek dari faktor-faktor tersebut. Teknik ini bisa diterapkan
dalam masalah farmasi, dan menjadi dasar bagi berbagai macam percobaan atau
Desain faktorial sederhana salah satunya adalah dengan dua faktor pada
dua level (rendah dan tinggi). Hal ini berarti ada dua faktor yang masing-masing
faktor diuji pada dua level yang berbeda, yaitu pada level rendah dan tinggi
(Bolton, 1990).
Optimasi campuran dua bahan (berarti ada dua faktor) dengan desain
faktorial (two level factorial design) dilakukan berdasarkan:
Y = bo + b1X1 + b2X2 + b12X1X2
Pada desain faktorial dua level dan dua faktor diperlukan empat percobaan
(2n = 4, dengan 2 menunjukkan level dan n menunjukkan jumlah faktor).
Penamaan formula untuk 4 percobaan adalah formula (1) untuk percobaan I,
formula a untuk percobaan II, formula b untuk percobaan III, dan formula ab
untuk percobaan IV (Bolton, 1990).
Rancangan percobaan desain faktorial sebagai berikut:
Tabel I. Rancangan percobaan desain faktorial dengan dua faktor dan dua level
Percobaan Faktor A Faktor B Interaksi
1 - - +
Percobaan a = faktor A level tinggi, faktor B rendah Percobaan b = faktor A level rendah, faktor B tinggi
Percobaan ab = faktor A level tinggi, faktor B tinggi (Bolton, 1997).
Efek masing-masing faktor dan interaksinya dapat dihitung sebagai
rata-rata selisih antara respon pada level rendah dengan respon pada level tinggi. Efek
dan interaksi faktor yang diteliti dapat dirumuskan menjadi persamaan berikut :
Efek faktor A = ( + )−( + 1)
2
Efek faktor B =( ) ( )
Interaksi = ( 1+ )−( + )
2 (Bolton, 1997).
Desain faktorial memiliki beberapa keuntungan. Metode ini memiliki
efisiensi yang maksimum untuk memperkirakan efek yang dominan dalam
menentukan respon. Keuntungan utama desain faktorial adalah bahwa metode ini
memungkinkan untuk mengidentifikasi efek masing-masing faktor, maupun efek
interaksi antar faktor. Metode ini ekonomis, dapat mengurangi jumlah penelitian
jika dibandingkan dengan meneliti dua efek faktor secara terpisah (Bolton, 1997).
I. Landasan Teori
Rumput mutiara memiliki kandungan kimia utama berupa asam ursolat
dan asam oleanolat (Liang et al., 2008). Asam ursolat memiliki banyak fungsi
antara lain antibakteri, hepatoprotektif, imunomodulator, antiproliferasi,
antitumor, antiinflamasi, dan anti-angiogenik (Cardenas et al., 2004). Satu bagian
asam ursolat larut dalam 178 bagian etanol (Budavari et al., 1989). Dalam
(2008) disebutkan bahwa pelarut alkohol, seperti metanol dan etanol memberikan
hasil yang tinggi dalam ekstraksi asam ursolat dari tanaman.
Asam ursolat dan asam oleanolat adalah isomer dengan struktur kimia
yang mirip, dan akibatnya sulit untuk dipisahkan (Liang et al., 2009). Oleh karena
itu, dalam penelitian ini, kadar triterpen total yang akan dihitung sebagai kadar
asam ursolat.
Optimasi pada penelitian ini dilakukan pada faktor suhu dan waktu
ekstraksi sebab kedua faktor ini merupakan faktor yang berpengaruh dan dapat
dikendalikan dalam proses digesti, untuk mendapatkan kadar triterpen total yang
optimum. Kedua faktor ini penting untuk dioptimasi sebab dalam penelitian yang
dilakukan oleh Xia et al. (2011), disebutkan bahwa asam ursolat dapat
terdegradasi dalam waktu tertentu, menyebabkan menurunnya hasil ekstraksi,
sehingga perlu dilakukan optimasi lama waktu ekstraksi. Selain itu, Wang dan
Weller (2006) menyebutkan bahwa secara umum, suhu ekstraksi dapat
mempengaruhi perolehan senyawa aktif. Peningkatan suhu medium ekstraksi
dapat meningkatkan kemampuan berdifusi pelarut ke dalam sel dan akibatnya
meningkatkan kelarutan senyawa, namun tidak semua senyawa tahan terhadap
suhu yang tinggi.
J. Hipotesis
Hipotesis yang dapat diajukan pada penelitian ini antara lain:
1. Perbedaan suhu dan waktu ekstraksi pada proses digesti herba rumput mutiara
2. Dapat diketahui faktor antara suhu, waktu, atau interaksi keduanya yang
diprediksi paling dominan berpengaruh pada proses digesti herba rumput
mutiara sehingga diperoleh kadar triterpen total yang optimum.
3. Diperoleh area prediksi suhu dan waktu ekstraksi yang optimum pada digesti
29 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental ganda karena ada
intervensi atau perlakuan terhadap subyek uji, dengan dua faktor yaitu suhu dan
waktu ekstraksi, menggunakan aplikasi desain faktorial.
B. Variabel Penelitian
1. Variabel bebas
Suhu dan waktu ekstraksi, masing-masing dengan 2 macam level. Suhu
ekstraksi yang digunakan untuk level rendah adalah 30oC sedangkan untuk level
tinggi adalah 60oC. Waktu ekstraksi untuk level rendah adalah 2 jam sedangkan
untuk level tinggi adalah 4 jam.
2. Variabel tergantung
Kadar triterpen total dalam ekstrak.
3. Variabel pengacau
a.Variabel pengacau terkendali. Varietas tumbuhan, kecepatan pengadukan,
lingkungan tempat tumbuh, waktu panen.
b.Variabel pengacau tidak terkendali. Umur tumbuhan.
C. Definisi Operasional
1. Simplisia adalah bahan tanaman yang belum mengalami pengolahan apapun
2. Simplisia rumput mutiara yang dimaksud ialah serbuk simplisia dari herba
rumput mutiara (Hedyotis corymbosa (L.) Lamk) yang telah mengalami
pencucian, sortasi basah, pengeringan selama 5 hari pada suhu 60oC, sortasi
kering, penyerbukan, dan pengayakan dengan ayakan no. mesh 12 dan 50.
3. Digesti adalah suatu metode ekstraksi dengan cara merendam dan mengaduk
dengan stirrer simplisia rumput mutiara dalam cairan penyari etanol 96% dan
perbandingan simplisia dan cairan penyari (1:10), dengan menggunakan
variasi suhu dan waktu ekstraksi.
4. Ekstrak yang dimaksudkan dalam penelitian ini adalah ekstrak kering yang
diperoleh dari digesti simplisia rumput mutiara yang sebelumnya telah
didefatisasi dengan petroleum eter (40o-60oC), yang telah disaring dengan
kertas saring dan dibantu dengan vacuum, serta diuapkan cairan penyarinya,
pertama-tama dengan waterbath hingga kental lalu dilanjutkan dengan oven
hingga bobot tetap.
5. Cairan penyari yang digunakan dalam penelitian ini adalah etanol 96%.
6. Faktor adalah besaran yang mempengaruhi respon, dalam penelitian ini
digunakan 2 faktor, yaitu suhu dan waktu ekstraksi.
7. Level yang dimaksud adalah nilai dari faktor. Terdiri dari level rendah dan
level tinggi. Level rendah suhu digesti adalah 30oC dan level rendah waktu
digesti adalah 2 jam. Level tinggi suhu digesti adalah 60oC dan level tinggi
8. Respon adalah besaran yang akan diamati perubahan efeknya. Dalam
penelitian ini respon yang diamati adalah kadar triterpen total dalam ekstrak
yang ditentukan secara KLT-Densitometri.
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah herba rumput
mutiara yang dikumpulkan dari lingkungan Kampus III Universitas Sanata
Dharma Yogyakarta pada bulan Juni - Agustus 2011, baku asam ursolat
(Sigma-Aldrich, No. Lot BCBD0299V, kemurnian 99,0 %), etanol 96% teknis (Brataco
Chemica), metanol p.a. (E. Merck), toluen p.a. (E. Merck), aseton p.a. (E. Merck),
asam asetat glasial p.a. (E. Merck), petroleum eter p.a. (E.Merck, b.p. 40-60oC),
asam sulfat p.a. (E. Merck), plat KLT silika gel 60 F254 (E. Merck).
E. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat alat
KLT-Densitometri (Camag TLC Scanner 3 CAT. No. 027.6485 SER. No.
160602), autosampler (Linomat 5 No. 170610), mikropipet Scorex, lemari
pengering, blender, ayakan dengan no. mesh 12 dan 50 (Retsch), neraca analitik
(Mettler Toledo AB204), termometer, waterbath (Gerhardt), hotplate magnetic
stirrer (Cenco Instrumenten b.v.), vacuum, oven (Marius Instrumenten), dan
F. Tata Cara Penelitian
1. Determinasi rumput mutiara
Determinasi tumbuhan rumput mutiara dilakukan dengan mencocokan
ciri-ciri tumbuhan dengan kunci determinasi menurut Backer dan van Der Brink
(1965).
2. Pembuatan simplisia rumput mutiara
a.Pengumpulan bahan. Rumput mutiara dikumpulkan dari lingkungan
sekitar Kampus III Universitas Sanata Dharma Yogyakarta pada bulan Juni –
Agustus 2011.
b.Sortasi Basah. Sortasi basah dilakukan dengan cara dipisahkan dari
benda-benda asing seperti bagian tumbuhan yang tidak diinginkan (akar, ranting kering,
dan daun kering) dan juga dari pengotor lain yang masih tertinggal.
c.Pencucian. Pencucian dilakukan dengan air mengalir hingga bersih.
d.Pengeringan. Pengeringan awal dilakukan dengan mengangin-anginkan
hingga tidak ada lagi air sisa pencucian di permukaan tanaman. Pengeringan
dilanjutkan dalam lemari pengering dengan suhu 60oC selama 5 hari.
e.Pembuatan serbuk. Pembuatan serbuk dilakukan dengan menggunakan
blender lalu diayak dengan ayakan no. mesh 12-50.
3. Pembuatan ekstrak rumput mutiara
a. Defatisasi serbuk simplisia. Serbuk simplisia dipisahkan dari
senyawa-senyawa non polar menggunakan pelarut petroleum eter dengan maserasi selama
1 jam, dengan perbandingan serbuk-penyari 1:10 dan kecepatan pengadukan 250
kemudian dioven pada suhu 60oC untuk menguapkan petroleum eter. Residu
sampel kering siap diekstraksi.
b. Optimasi kondisi pembuatan ekstrak rumput mutiara. Sebanyak 5 gram
serbuk simplisia yang telah didefatisasi dimasukkan masing-masing ke dalam 4
Erlenmeyer bertutup. Etanol 96% dengan volume 50 mL ditambahkan ke dalam
masing-masing Erlenmeyer.
Tabel II. Perbandingan suhu dan waktu digesti Suhu (oC) Waktu (jam)
hingga tanda batas. Sebanyak 5 mL filtrat diuapkan di atas waterbath (suhu 70oC)
hingga didapatkan ekstrak kental. Penguapan dilanjutkan di dalam oven dengan
suhu 80oC hingga bobot tetap.
4. Penetapan kandungan triterpen total
a. Pembuatan fase gerak. Dibuat campuran toluen – aseton – asam asetat
(90:10:0,07 v/v).
b. Pembuatan pelarut. Dibuat campuran metanol dan kloroform dengan
perbandingan 4:1.
d. Pembuatan larutan baku asam ursolat
1) Pembuatan larutan stok asam ursolat 1000 ppm
Sejumlah lebih kurang 10,0 mg baku asam ursolat ditimbang seksama
kemudian dilarutkan dalam pelarut hingga volume tepat 10,0 mL.
2) Pembuatan larutan baku asam ursolat
Sebanyak 0,500 mL; 1,000 mL; 1,500 mL; 2,000 mL; dan 2,500 mL;
larutan stok asam ursolat diambil dan dimasukkan ke dalam labu ukur 5
mL kemudian diencerkan dengan pelarut hingga tanda, sehingga diperoleh
konsentrasi 100 ppm, 200 ppm, 300 ppm, 400 ppm, dan 500 ppm.
e. Penetapan panjang gelombang serapan maksimum. Seri larutan baku
konsentrasi 100 ppm, 300 ppm, dan 500 ppm masing-masing ditotolkan dengan
volume penotolan 2 µL pada plat KLT dengan fase diam silika gel 60 F254 dan
setelah kering dikembangkan dalam bejana kromatografi yang telah dijenuhi
dengan fase gerak. Setelah mencapai jarak rambat 10 cm, plat dikeluarkan dari
bejana dan dikeringkan. Pengembangan dengan cara yang sama dilakukan
sebanyak 3 kali. Selanjutnya, bercak ditampakkan dengan menggunakan reagen
pendeteksi yang dilanjutkan dengan pemanasan dalam oven suhu 110oC selama 3
menit. Plat KLT discanning panjang gelombang serapan maksimumnya dengan
densitometer.
f. Pembuatan kurva baku, pengamatan nilai Retardation Factor (Rf) asam
ursolat, dan penentuan linearitas. Seri larutan baku konsentrasi 100 ppm, 200
ppm, 300 ppm, 400 ppm, dan 500 ppm, diperlakukan seperti poin 4e. Plat KLT
dilakukan sebanyak 3 kali dan pilih persamaan kurva baku yang paling baik.
Selain itu dilihat pula nilai Rf dari masing-masing seri baku asam ursolat dan
linearitas metode (dilihat dari harga r (koefisien korelasi) hasil pengukuran seri
baku asam ursolat).
g. Penentuan recovery, resolusi, Coefficient of Variations (CV), dan range.
Seri larutan baku konsentrasi 100 ppm, 300 ppm, dan 500 ppm diberi perlakuan
seperti pada poin 4.e. Replikasi dilakukan sebanyak 3 kali. Selanjutnya kadar
terukur dihitung dengan menggunakan persamaan kurva baku. Berdasarkan data
ini dapat ditentukan:
4) Penentuan range. Range merupakan interval konsentrasi analit yang
memenuhi persyaratan linearitas, akurasi, dan presisi.
h. Penentuan recovery dan Coefficient of Variations (CV) baku dalam
matriks sampel.
1) Preparasi larutan sampel (LS). Ekstrak kering dilarutkan dengan pelarut
hingga 10 mL. Kemudian 3,5 mL larutan tadi diambil dan dimasukkan ke
2) Pembuatan larutan sampel dengan adisi (LSAU). Sebanyak 3,5 mL larutan
sampel (LS) diambil dan dimasukkan ke dalam labu takar 5 mL. Larutan
tersebut ditambah dengan 0,5 mL larutan stok asam ursolat 1000 ppm dan
diencerkan dengan pelarut hingga tanda sehingga diperoleh kadar ± 375
ppm.
3) Pengembangan dan pengukuran. LS dan LSAU diberi perlakuan seperti pada
poin e.4. Setelah itu dihitung kadar baku asam ursolat dalam sampel. Kadar
baku asam ursolat dalam sampel adalah selisih kadar LSAU dengan kadar LS.
Selanjutnya dihitung recovery dan CVnya.
% recovery = ( + ) − x 100%
i. Analisis kualitatif. Ekstrak kering dilarutkan menggunakan pelarut
kemudian dimasukkan ke dalam labu ukur 10 mL dan ditambahkan pelarut hingga
tanda batas. Larutan ekstrak bersama baku asam ursolat (300 ppm), diperlakukan
seperti poin 4e. Setelah proses derivatisasi tersebut, bercak diamati di bawah
cahaya biasa. Analisis kualitatif juga dilakukan dengan cara menghitung Rf tiap
bercak dibandingkan dengan harga Rf baku asam ursolat serta membandingkan
pola spektra bercak yang memiliki Rf identik dengan baku dengan pola spektra
baku.
j. Analisis Kuantitatif. Ekstrak kering dilarutkan menggunakan pelarut
kemudian dimasukkan ke dalam labu ukur 10 mL dan ditambahkan pelarut hingga
tanda batas. Larutan ekstrak diperlakukan seperti poin 4e. Plat KLT diukur AUC
5. Analisis hasil
Kadar triterpen total (% b/b) dalam sampel dari setiap kondisi dan setiap
replikasi yang didapat, kemudian dianalisis dengan menggunakan aplikasi desain
faktorial menggunakan software Ubuntu-10.04-DesFaktor-0.9® by Ubuntu R
OpenOffice.org (www.molmod.org). Pendekatan desain faktorial yang digunakan
untuk menghitung koefisien a, b, ab, sehingga didapatkan persamaan Y = b0 +
b1(XA) + (b2(XB) + b12(XA)(XB). Dari persamaan ini dapat dibuat suatu profil yang
menggambarkan profil kadar triterpen total (% b/b) dari hasil digesti herba rumput
mutiara dengan adanya perbedaan kondisi perlakuan antara suhu dan waktu
ekstraksi yang digunakan. Hasil profil yang diperoleh berdasarkan rumus
digunakan untuk menentukan kombinasi antara suhu dan waktu ekstraksi yang
menghasilkan kadar triterpen total (% b/b) yang paling optimum. Penentuan
38 BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman dilakukan untuk mendapatkan kepastian kebenaran
tanaman yang diselidiki sesuai dengan yang dimaksud dalam penelitian.
Determinasi dilakukan oleh Laboratorium Farmakognosi Fitokimia, Fakultas
Farmasi, Universitas Sanata Dharma Yogyakarta, dengan mencocokkan ciri-ciri
tanaman dengan kunci determinasi yang ada dalam buku Flora of Java (Backer
and van Der Brink, 1965). Hasil determinasi menunjukkan bahwa tanaman yang
digunakan dalam penelitian ini adalah Hedyotis corymbosa (L.) Lamk (Lampiran
1).
B. Pengumpulan Bahan dan Pembuatan Serbuk Simplisia
1. Pengumpulan bahan
Herba rumput mutiara yang digunakan dalam penelitian ini diambil dari area
Kampus III Universitas Sanata Dharma Yogyakarta pada bulan Juni - Agustus
2011. Tanaman ini belum dibudidayakan sehingga faktor umur tanaman tidak
dapat dikendalikan. Dalam penelitian ini, faktor yang dikendalikan adalah waktu
panen, lingkungan tempat tumbuh dan varietas tanaman.
Waktu panen sangat erat hubungannya dengan pembentukan senyawa aktif
di dalam bagian tanaman yang akan dipanen. Waktu panen yang tepat adalah pada
saat bagian tanaman tersebut mengandung senyawa aktif dalam jumlah yang