188
PERBANYAKAN APEL MELALUI INISIASI KULTUR MERISTEM APEL
IN VITRO
Ahmad Syahrian Siregar* dan Arry Supriyanto Balai Penelitian Tanaman Jeruk dan Buah Subtropika
Jl. Raya Tlekung No.1 Junrejo Batu Jatim 65301 *e-mail: rianlitbang@gmail.com
ABSTRACT
The succesful factor to initiate apple meristem culture in vitro are to handle the major source of surface contaminan, use appropriate planting medium and control the plant grwoth regulator . An effective concentration of particular sterilant should be exposed to the eksplant surface in order to remove the contaminant and should be done quickly. Rapid multiplication is another aim to achieve a large number of clone in short time. The aim of this research was to get an effective and efficient sterillant concentration to initiate apple meristem culture also to get a proper initiate medium of meristem culture in addition of plant growth regulator combinbation. The research was conducted in the Plant Breeding Labarotory at Citrus Research Centre and Subtropical Fruit Indonesia, started from June-Oktober2013. The results showed 50 % of clorox sterillant could effectively remove the surface contaminant about 90% meristem explant free from contaminant and only consumed 3 minute to do this methode. In the mean time the MS medium without plant growth regulator in addition of activatate charcoal 1 mg/l could absorb the phenolic substance about 80 % of meristem explant could survive and growth. The use of MS medium base with the combination of BAP (2 mg/l) and IBA (0,1 mg/l) showed the high number of shoot (7,4)
Keywords : Meristem, In vitro, Clorox, Activated charcoal, MS
ABSTRAK
Dalam memulai kultur meristem apel in vitro yang perlu dilakukan adalah steriliasi dalam menangani kontaminan yang ada dipermukaan esplan dengan waktu yang juga relatif lebih cepat serta penggunaan media tanam dan pemanfatan kombinasi auksin dan sitokinin yang tepat sehingga eksplan yang ditanam dapat diperbanyak secara cepat. Penelitian in bertujuan untuk mengetahui efektifitas dan efisisiensi sterilan klorox dalam menghilangkan kontaminan dengan perlakuan beberapa tingkat konsentrasi klorox serta penggunaan media tanam yang dikombinasikan dengan zpt BAP dan IBA in vitro yang tepat dalam melakukan kultur inisiasi meristem apel in vitro. Penelitian dilaksanakan di Laboratorium Pemuliaan Tanaman, Balai Penelitian Tanaman Jeruk dan Buah Subtropika, pada bulan Juni–Oktober 2013. Hasil penelitian menunjukkan bahwa eksplan meristem yang diberi perlakuan sterilan klorox dengan konsentrasi 50 % dengan waktu yang hanya 3 menit secara efektif dan efisien dapat menghilangkan kontaminan pada permukaan eksplan dengan tingkat keberhasilan 90 %. Sedangkan media inisiasi MS tanpa zat pengatur tumbuh yang ditambahkan arang aktif 1 mg/l secara efektif dapat menyerap zat fenolik yang dikeluarkan oleh eksplan sehingga eksplan dapat tumbuh dengan baik dengan persentasi keberhasilan sebesar 80%. Penggunaan media MS yang dikombinasikan dengan ZPT BAP 2 mg/l dan IBA 0,1 mg/l menunjukkan jumlah tunas yang optimal yaitu sebanyak 7,4 planlet.
Kata Kunci :Meristem, In Vitro, Klorox, Arang Aktif, MS
PENDAHULUAN
Untuk memenuhi kebutuhan akan bibit tanaman apel biasanya petani konvensional memperbanyaknya dengan layering.Akan tetapi cara tersebut masih belum dapat memenuhi permintaan pasar akan benih. Untuk memenuhi permintaan bibit apel dalam jumlah besar dalam waktu yang relatif singkat dan juga bebas dari penyakit , digunakan cara perbanyakan dengan kultur meristem in vitro (kultur jaringan). Perbanyakan tanaman kultur meristemin vitro bertujuan untukmendapatkan bibit secara masal dalam kurun waktu yang relatif cepat dibandingkan dengan perbanyakan secara konvensional dan dapat memperoleh bahan tanaman bebas dari penyakit(Baskaran, et al., 2008).
Tahap inisiasi pada kultur meristem merupakan tahapan paling penting dalam menentukan keberhasilan penelitian terutama apabila eksplan berasal dari lapang (Blazina, 2000). Keberhasilan kultur meristem sangat tergantung pada beberapa hal, antara lain adalah proses sterilisasi dan pengendalian zat fenolik. Diperlukan proses sterilisasi yang tepat untuk menghilangkan mikroorganisme pathogen yang terdapat pada eksplan dan juga tidak mengganggu pertumbuhan eksplan (Ko, et al., 2009). Pada beberapa metode sterilisasi inisiasi kultur meristem yang telah dilakukan oleh beberapa peneliti(Mert et.al,2010 ;Yasmin, et al.,2011; Ali, et al.,2011), dirasakan masih memerlukan waktu yang lama rata-rata 10 menit dan juga tingkat keberhasilan yang masih
189
rendah. Sehingga diperlukan metode yang dapat lebih efektif mengendalikan kontaminan pada permukaan eksplan dan juga efisien dalam penggunaan waktu. Dan untuk mengatasi zat fenolik yang terjadi karena perlukaan pada bagian eksplan, cara untuk mengatasi masalah tersebut diantaranya adalah dengan menggunakan arang aktif (Thomas, 2008: Poudyal, et al., 2008).
Media dasar yang umum digunakan untuk kultur meristem adalah media Murashige dan Skoog (MS)6 yang biasanya ditambah dengan beberapa kombinasi zat pengatur tumbuh (ZPT). Beberapa kombinasi penggunaan zat pengatur tumbuh yang biasa diaplikasikan pada apel diantaranya 1-6-Benzylaminopurine (BAP) dengan Indole Butyric Acid (IBA) (Radman, et.al, 2002.; Chakrabarty et al., 2003) Mikropropagasi dengan menggunakan kombinasi dari dua ZPT tersebut dapat menghasilkan planlet stroberi secara organogenesis.
Penelitian ini bertujuan untuk mendapatkan protokol sterilisasi yang lebih efektif dan efisien untuk mengatasi kontaminan serta penggunaan media yang tepat dan kkombinasi hormon BAP dan IBA..
BAHAN DAN METODE
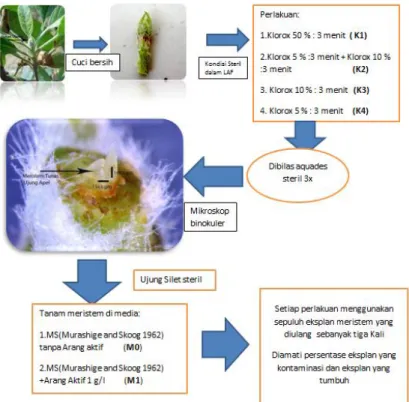
Penelitian dilaksanakan di Laboratorium Pemuliaan Tanaman, Balai Penelitian Tanaman Jeruk dan Buah Subtropika, pada bulan Juni–Oktober 2013. Eksplan diambil di kebun penelitian Tlekung Balitjestro. Bagian yang diambil adalah pucuk batang bawah tanaman apel (Malus sp.). Pengambilan eksplan dilakukan sebelum matahari terlalu tinggi karena sinar matahari akan meningkatkan produksi fenol pada apel (Malus sp.). Bagian yang dipotong kira-kira 10 cm dari tunas pucuk. Kemudian eksplan dibawa ke laboratorium untuk disterilisasi.
Sterilisasi Eksplan
Sterilisasi eksplan terdiri dari dua tahap, yaitu sterilisasi di ruangan biasa dan sterilisasi di dalam ruang laminair air flow. Pada tahap pertama, eksplan yang telah diambil dari lapangan dipotong kecil-kecil (±2 cm). Eksplan yang telah dipotong dimasukkan ke dalam erlenmeyer, ditetesi dengan 3 tetes Sunlight® dan 10 air kran. Eksplan di shaker selama 10 menit.
Sterilisasi tahap selanjutnya dilakukan di dalam laminair air flow kemudian eksplan direndam dalam larutan kloroks. Dalam penelitian ini, eksplan diberi perlakuan, yaitu 1) direndam dalam larutan dengan konsentrasi 50 % selama 3 menit (K1), 2) direndam dalam larutan kloroks dengan konsentrasi 10%, kemudian direndam dalam larutan kloroks 5% , masing-masing 3 menit (K2), 3) direndam dalam larutan dengan konsentrasi 10 % selama 3 menit (K3) dan 4) direndam dalam larutan dengan konsentrasi 5 % selama 3 menit (K4) . Setiap perlakuan dilakukan tiga kali pengulangan. Selanjutnya dibilas dengan dH20 steril sebanyak 3 kali masing-masing 3 menit. Ditiriskan di kertas saring. Eksplan siap ditanam dalam media.
Penanaman Eksplan
Penanaman eksplan dilakukan dalam Laminair Air Flow (LAF). Untuk mendapatkan jaringan meristem, primodial-primodial daun yang ada pada kuncup harus dibuka satu per satu menggunakan pinset dan pisau di bawah mikroskop stereo. Jaringan meristem pada apel berwarna bening dan dilindungi oleh promodial-primodial daun. Setelah didapatkan jaringan meristem, maka dilakukan penanaman pada media MS (Murashige and Skoog 1962) tanpa arang aktif (MO) dan MS (Murashige and Skoog 1962) dengan arang aktif 1 g/l (M1) . Selanjutnya eksplan diamati setiap hari. Variabel yang diamati adalah persentase eksplan yang hidup dan persentase kontaminasi.
190
Perlakuan media dan hormon tumbuh untuk pertumbuhan meristem.
Setelah eksplan meristem tumbuh pada media inisiasi, maka selanjutnya dilakukan perlakuan pada media tanam MS yang dikombinasikan dengan ZPT BAP dan IBA sebagai berikut:
Apel
Media MS tanpa hormon...A0 Media MS + BAP (1 mg/l) + IBA (1 mg/l)...A1 Media MS + BAP (1 mg/l) + IBA (0,5 mg/l) ...A2 Media MS + BAP (1 mg/l) + IBA (0,25mg/l) ...A3 Media MS + BAP (1 mg/l) + IBA (0,1mg/l) ...A4 Media MS + BAP (1,5 mg/l) + IBA (1 mg/l) ...A5 Media MS + BAP (1,5 mg/l) + IBA (0,5 mg/l) ...A6 Media MS + BAP (1,5 mg/l) + IBA (0,25mg/l) ...A7 Media MS + BAP (1,5 mg/l) + IBA (0,1mg/l) ...A8 Media MS + BAP (2 mg/l) + IBA (1 mg/l) ...A9 Media MS + BAP (2 mg/l) + IBA (0,5 mg/l) ...A10 Media MS + BAP (2 mg/l) + IBA (0,25mg/l) ...A11 Media MS + BAP (2 mg/l) + IBA (0,1mg/l) ...A12 Media MS + BAP (1 mg/l) ...A13 Media MS + BAP (1,5 mg/l) ...A14 Media MS + BAP (2 mg/l) ...A15
Setelah planlet berumur 16 minggu dilakukan pengukuran terhadap 90 dihitung jumlah tunas, tinggi tunas (cm), diamater tunas (cm) dan eksplan yang mengalami pertumbuhan kalus (-, +, ++). Data yang diperoleh dirata-ratakan untuk di uji beda nyata dengan menggunakan Duncan’s multiple range test (DMRT) menggunakan program SPSS.
Gambar 1.Skema perlakuan percobaan HASIL DAN PEMBAHASAN
Ekplan yang diberi beberapa perlakuan klorox menunjukkan tingkat efektifitas yang berbeda dalam membersihkan kontaminan yang berada pada permukaan eksplan. Pada Gambar 2 konsentrasi klorox yang paling rendah efektifitasnya dalam membersihkan kontaminan adalah K4 (klorox konsentrasi 5%) dimana hampir 50 % dari total eksplan yang di tanam mengalami kontamniasi baik yang disebabkan oleh jamur ataupun dari bakteri. Sedangkan perlakuan klorox 50 %(K1) efektif dalam menghilangkan kontaminan yang berada pada permukaan eksplan meristem dimana hanya sebesar 10 % saja eksplan meristem yang terkontaminasi baik oleh jamur maupun oleh bakteri.
191
Pada penelitian ini, kloroks digunakan untuk sterilisasi permukaan saja yaitu karena menurut Mert (2010), kloroks mampu membersihkan mikroorganisme yang terikut dalam bahan tanam, menghilangkan pertikel-partikel tanah, debu dan lain-lain. Sebenarnya, jaringan meristem apel merupakan bagian tanaman atau jaringan yang tidak mengandung patogen (steril). Jadi, dalam hal ini kloroks hanya untuk sterilisasi bagian luar dan permukaan pucuk eksplan. Apabila terjadi kontaminasi pada kultur meristem, maka sumber kontaminan bukanlah dari jaringan meristem, tetapi berasal dari bagian luar atau permukaan pucuk apel tersebut. Konsentrasi kloroks yang semakin tinggi juga tidak akan merusak jaringan meristem, tetapi hanya akan merusak bagian luar dan permukaan pucuk apel.
Gambar 2. Persentase Eksplan Meristem yang Kontaminasi 60 Hari Setelah Tanam (HST)
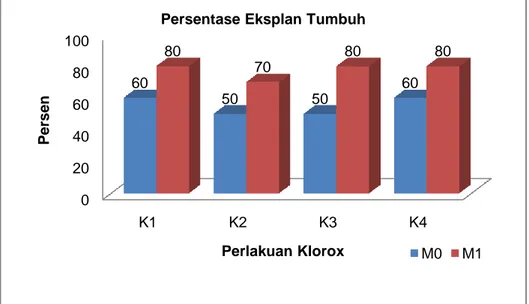
Pada Gambar 3 menunjukkan bahwa penggunaan media MS yang ditambahkan arang aktif sebanyak 1 g/l (M1) dapat secara efektif menyerap zat fenolik yang dikeluarkan oleh eksplan meristem akibat perlukaan sehingga tanaman dapat tumbuh menjadi planlet tanpa adanya ganguan dari zat penghambat fenolik (Gambar 3). Persentase tanaman yang tumbuh pada media M1 adalah sebesar 80 %. Berbeda dari media M1, pada media M0, media tanpa arang aktif pertumbuhan ekplan meristem lebih rendah yaitu 60%. Penggunaan arang aktif dalam kegiatan penelitian ini berfungsi untuk menghambat senyawa fenol yang dihasilkan oleh eksplan akibat pelukaan. Selain itu, menurut Hutami (2006), arang aktif yang ditambahkan ke dalam media, dapat memberikan lingkungan gelap pada media. Lingkungan yang gelap ini juga dapat menghambat proses pencoklatan (browning) pada eksplan karena kerja fenol akan terhambat jika tidak ada cahaya. Hal ini didukung oleh penelitian Tisserat (1979) yang menyatakan bahwa arang aktif menghilangkan pewarnaan dengan menyerap dan mengoksidasi fenol dan menginaktifkan peroksidase. Arang aktif mengurangi pencoklatan pada eksplan palem dan kultur media, sehingga memacu eksplan untuk tumbuh secara organogenesis.
Gambar 3. Persentase Eksplan Meristem Yang Tumbuh Pada 60 Hari Setelah Tanam (HST)
0 10 20 30 40 50 60 70 80 90 100 k1 k2 k3 k4 10 20 20 40 10 30 40 50 Pe rse n Perlakuan Klorox
Persentase Eksplan Kontaminasi
M0 M1 0 20 40 60 80 100 K1 K2 K3 K4 60 50 50 60 80 70 80 80 P er se n Perlakuan Klorox Persentase Eksplan Tumbuh
192
Gambar 4. a). Kultur meristem apel 30 HST pada media M1 b). Hasil Kultur meristem apel 90 HST pada media M1
Pada Tabel 1, media perlakuan yang menunjukkan jumlah tunas yang paling baik adalah A12 ( Media MS + BAP (2 mg/l) + IBA (0,25mg/l)), A11 (Media MS + BAP (2 mg/l) + IBA (0,25mg/l)) dan A15 (Media MS + BAP (2 mg/l) ) dengan jumlah tunas masing-masing adalah 7,4 ;6,8 dan 6,8. sedangkan yang terendah didapat pada media perlakuan A0 (Media MS tanpa Zat pengatur tumbuh) dan A1 (Media MS + BAP (1 mg/l) + IBA (1 mg/l)) dengan jumlah tunas sebanyak 1.
Untuk tinggi tunas yang tertinggi di dapat pada media perlakuan A12( Media MS + BAP (2 mg/l) + IBA (0,25mg/l)) dengan tinggi 2 cm, sedangkan yang terendah didapat pada media perlakuan A0(Media MS tanpa Zat pengatur tumbuh) dan A2 Media MS + BAP (1 mg/l) + IBA (0,5 mg/l) dengan tinggi tunas 0,75 cm dan 0,85 cm . Diameter tunas yang terbaik didapat pada media perlakuan A11 ( Media MS + BAP (2 mg/l) + IBA (0,25mg/l) dengan diameter tunas sebesar 0,42 cm , sedangakn yang terendah didapat pada media perlakuan A15 (Media MS + BAP (2 mg/l)) dengan diameter tunas sebesar 0,14. Pada tabel 1 teramati adanya pertumbuhan kalus pada media perlakuan A1 (Media MS + BAP (1 mg/l) + IBA (1 mg/l)), A2 Media MS + BAP (1 mg/l) + IBA (0,5 mg/l), A5 (Media MS + BAP (1,5 mg/l) + IBA (1 mg/l)), A6 (Media MS + BAP (1,5 mg/l) + IBA (0,5 mg/l)), A9 (Media MS + BAP (2 mg/l) + IBA (1 mg/l)) dan A10 (Media MS + BAP (2 mg/l) + IBA (0,5 mg/l)).
Tabel 1. Perlakuan media tumbuh meristem tanaman apel jumlah tunas, tinggi tunas, diamater tunas dan klaus
N0 Media Perlakuan
Jumlah Tunas Tinggi Tunas (cm) Diameter Tunas (cm) Kalus 1 A0 1 f 0,75 e 0,26 dce - 2 A1 1 f 1 ed 0,26 dce ++ 3 A2 1,6 ef 0,85 e 0,26 dce + 4 A3 1,8 ef 1,4 bcd 0,24 def - 5 A4 2,4 e 1,5 abcd 0,3 bcde - 6 A5 2,2 e 1,05 cde 0,26 dce ++ 7 A6 3,4 cd 1,5 abcd 0,34 abcd + 8 A7 4,2 bc 1,6 abc 0,34 abcd - 9 A8 5,2 b 1,9 ab 0,36 abc - 10 A9 2,4 de 1,6 abc 0,28 dce ++ 11 A10 4,2 bc 1,7 ab 0,36 abc + 12 A11 6,8 a 1,7 ab 0,42 a - 13 A12 7,4 a 2 a 0,4 ab -
14 A13 3,4 cd 1,6 abc 0,24 def -
15 A14 4,4 bc 1,8 ab 0,22 ef -
16 A15 6,8 a 1,7 ab 0,14 f -
Keterangan: Huruf yang berbeda pada kolom yang sama menunjukkan perbedaan nyata pada uji DMRT dengan taraf 0.05
193
Gambar 5. Kultur meristem apel, a. Meristem apel dibawah mikroskop pembesaran b. Meristem apel pada media MS + Arang aktif 0,5 mg/l c. Meristem apel yang dirumbuhkan pada media perlakuan tunas d.
Pertumbuhan meristem apel kiri ke kanan
Dari hasil penelitian kultur meristem apel dengan penggunaan zat pengatur tumbuh BAP 2 mg/l dan IBA antara 0,1-0,25 mg/l menunjukkan pertumbuhan eksplan meristem apel yang optimal. Sedangkan penggunaan zat pengatur tumbuh auksin dengan konsentrasi yang tinggi ≥0,5 mg/l dapat menyebabkan pertumbuhan kalus sehingga pertumbuhan tunas terhambat. Konsentrasi auksin yang tinggi pada beberapa spesies tanaman dapat menyebabkan pertumbuhan kalus Kalus yang tumbuh disekitar jaringan eksplan meristem dapat menghalangi terjadinya proses penyerapan nutrisi pada media sehingga pertumbuhan tunas-tunas adventif dapat terganggu (George et al, 2008). Pada perbanyakan in vitro tanaman apel diharapkan bahwa tunas dapat diinduksi secara langsung pada eksplan tanpa ada pertumbuhan kalus.
KESIMPULAN
Penggunaan Sterilan klorox 50% dengan waktu 3 menit dapat secara efektif menghilangkan kontaminan pada permukaan eksplan dan sangat efisien dalam penggunaan waktu. Media inisiasi meristem pada apel menggunakan arang aktif 1 g/l efektif dalam menyerap zat fenolik sehingga eksplan dapat tumbuh dengan baik.
Media pertumbuhan yang terbaik untuk apel yaitu dengan menggunakan media dasar MS yang ditambahkan BAP 2mg/l dan IBA 0,1 mg/l dengan jumlah tunas sebanyak 7,4 dan juga pertumbuhan kalus pada media tersebut juga tidak teramati.
UCAPAN TERIMA KASIH
Penulis mengucapkan terimakasih kepada Kementerian Pertanian yang telah mendanai penelitian ini, serta tidak lupa kepada teknisi Laboratorium Pemuliaan Tanaman dan Somatik Embriogenesis Balitjestro yang telah sangat membantu dalam penyelesaian penelitian ini.
REFERENSI
Ali,A., Sajid A, Naveed, N.H, Majid A, Saleem A, Khan, U.A, Jafery, F.I and Naz, S. 2011. Initiation, proliferation and development of micropropagation system for mass scale production of banana through meristem culture. Afr. Jour.biotech. Vol 10(70) 15731-15738.
Baskaran P, Jayabalan N (2008) Effect of growth regulators on rapid micropropagation and psoralen production in Psoralea corylifoliaL. Acta Physiol Plant 30:345–351.
Blazina, F. (2000). Meristem shoot tip and bud culture. In: Handbook of Plant Cell Culture. (Evans, D., W. Sharp, D. Ammirato and Y. Yamada. eds). New York:Macmillan Co. pp.177 – 227
Chakrabarty, D., E.J. Hahn, Y.J. Yoon and K.Y. Paek. 2003. Micropropagation of apple rootstock M.9 EMLA using bioreactor. Journal of Horticultural Science & Biotechnology,78: 605-609
Geoge, E.F., M..A. Hall and G.J. De Klerk 2008. Plant propagation by tissue culture 3rd Edition, Vol.1: The back ground.Springer.
Hutami, Sri. 2006. Penggunaan Arang Aktif dalam Kultur In Vitro. Berita Biologi, Volume 8, Nomor 1, April 2006.
194
Ko, C.Y, Al-Abdulkarim, A.M, Al-Jowid, S.M, dan Al-Baiz, A. 2009. An effective disinfection protocol for plant regeneration from shoot tip cultures of strawberry. Afr.Jou.Of.Biotech.Vo.8(11)pp .2611-2615
Mert, C.,and Soylu A. 2010. Shoot location and collection time effects on meristem tip culture of some apple rootstocks. Pak.J.Bot, 42(1): 549-557
Murashige, T and F.Skoog.1962. A revised medium for rapid growth and bioassays with tobbaco tissue culture. Physiol.Plant.15:473-497
Poudyal, B.K., DU, G., Zhang Y., Liu, J. And SHI, Q. (2008). Studies on browning problem and phenols content on shoots of Yali, Aikansui and Abbe Fetel pears for in vitro culture. Front. Agric.China 2008, 2(3): 321–330.
Radmann, E.B., J.C. Fachınello and J.A. Peters. 2002. Effect of auxin and cultivation conditions in In vitro rooting of root-stoock of apple 'M-9'. Revista Brasileira Fruticultura, 24: 624-628.
Thomas, T.D. (2008). The role of activated charcoal in plant tissue culture. Biotechnology Advances. 26,618–631.
Tisserat, B. 1979. Propagation of Date Palm (Phoenix dactylifera L.) in vitro. J. Exp. Bot. 30:1275-1283
Yasmin. A, Jalbani. A, and Raza S. 2011. Effect of growth regulators on meristem tip culture of local potato cvs desiree and patrones. Pak. J. Agri. Agril. Engg, Vet Sci, 27(2): 143-149