LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT BINTANG TOEDJOE
JALAN JENDERAL AHMAD YANI NO 2 PULOMAS
JAKARTA TIMUR
PERIODE 1 APRIL – 31 MEI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
RATU RALNA ISMUHA, S.Farm.
1206198024
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT BINTANG TOEDJOE
JALAN JENDERAL AHMAD YANI NO 2 PULOMAS
JAKARTA TIMUR
PERIODE 1 APRIL – 31 MEI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
RATU RALNA ISMUHA, S.Farm.
1206198024
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT. atas rahmat-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker (PKPA) Angkatan LXXVI Universitas Indonesia, yang diselenggarakan pada tanggal 1 April – 31 Mei 2013 di Di PT. Bintang Toedjoe Jalan Jenderal Ahmad Yani No 2 Pulomas Jakarta Timur
Kegiatan PKPA dan penyusunan laporan PKPA merupakan bagian dari kegiatan perkuliahan program pendidikan profesi apoteker dengan tujuan untuk meningkatkan pemahaman, pengetahuan dan keterampilan mahasiswa. Setelah mengikuti kegiatan PKPA, diharapkan apoteker yang lulus nantinya dapat mengaplikasikan pengetahuan dan keterampilan yang dimiliki kepada masyarakat pada saat memasuki dunia kerja.
Kegiatan PKPA dapat terlaksana dengan baik berkat bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan terima kasih kepada :
1. Bapak JB. Apik Ibrahim selaku Presiden Direktur PT. Bintang Toedjoe yang telah memberi izin kepada penulis untuk melaksanakan Praktek Kerja Profesi Apoteker di PT. Bintang Toedjoe.
2. Ibu Jacqueline selaku Head Manager QA-QC PT. Bintang Toedjoe yang telah memberikan kesempatan kepada penulis untuk melaksanakan Praktek Kerja Profesi Apoteker di Divisi QA-QC.
3. Bapak Budi Raharja S.Si Apt. selaku Manager QC PT. Bintang Toedjoe Plant Pulomas dan sekaligus pembimbing Praktek Kerja Profesi Apoteker yang telah memberikan bimbingan dan pengarahannya.
4. Bapak Eko Supriyatno S. Si Apt dan Mba Heppy Ristaina S. Si Apt selaku Supervisor QC PT. Bintang Toedjoe Plant Pulomas yang telah meluangkan waktu kepada penulis dalam memberikan bimbingan dan pengarahan selama melaksanakan Praktek Kerja Profesi Apoteker.
7. Bapak Sutriyo S.Si., M.Si., Apt selaku Pembimbing penulis atas bantuan, bimbingan dan waktu yang telah diberikan kepada penulis selama PKPA.
8. Seluruh staf pengajar dan tata usaha Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia atas bantuan yang telah diberikan kepada penulis.
9. Seluruh keluarga (Ayah, Ibu, kakak, dan lainnya) yang telah memberikan bantuan dukungan material dan moral.
10.Teman- Teman seperjuangan selama melaksanakan PKPA Ifa, Rahma, Adis, Roni, Asti, Dian, Rahmi, Aini, Novi, Nanda, dan Dika atas segala keramahan, bantuan dan semangat yang diberikan kepada penulis selama melaksanakan PKPA di PT. Bintang Toedjoe
11.Seluruh teman-teman apoteker angkatan 76 yang telah memberikan banyak sekali bantuan dan dukungan kepada penulis.
12.Serta pihak-pihak lain yang tidak dapat disebutkan satu per satu, yang telah memberikan dukungan dalam penyusunan laporan ini.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat banyak kekurangan dan kesalahan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun. Akhir kata, penulis berharap semoga pengetahuan dan pengalaman yang penulis peroleh selama menjalani Praktek Kerja Profesi Apoteker ini dapat memberikan manfaat bagi rekan – rekan sejawat dan semua pihak yang membutuhkan.
Jakarta, Juni 2013
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Ratu Ralna Ismuha, S.Farm
NPM : 1206198024
Program Studi : Apoteker Fakultas : Farmasi
Jenis Karya : Laporan Praktek Kerja Profesi Apoteker
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royati Non-ekslusif (Non-exclusive Roylty-Free Right) atas karya ilmiah saya yang berjudul:
Laporan Praktek Kerja Profesi Apoteker di PT Bintang Toedjoe Indonesia Periode 1 April – 31 Mei 2013
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Non-ekslusif ini Universitas Indonesia berhak menyimpan, mengalih media/ formatkan, mengelola dalam bentuk pangkalan data (database), merawat, dan mempublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/ pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada tanggal: 30 Juli 2013 Yang menyatakan,
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... v
DAFTAR ISI ... vi
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2 TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.1.1 Pengertian Industri Farmasi ... 3
2.1.2 Persyaratan Industri Farmasi ... 3
2.1.3 Izin Industri Farmasi ... 4
2.1.4 Pencabutan Izin Usaha Industri Farmasi ... 4
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 5
2.2.1 Manajemen Mutu ... 5
2.2.2 Personalia ... 6
2.2.3 Bangunan dan Fasilitas ... 7
2.2.4 Peralatan ... 8
2.2.5 Sanitasi dan Higiene ... 9
2.2.6 Produksi ... 10
2.2.7 Pengawasan Mutu ... 11
2.2.8 Inspeksi Diri dan Audit Mutu ... 12
2.2.9 Penanganan Keluhan terhadap Produk, Penarikan kembali Produk dan Produk Kembalian ... 13
2.2.10 Dokumentasi ... 14
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 15
2.2.12 Kualifikasi dan Validasi ... 16
BAB 3 TINJAUAN KHUSUS PT. BINTANG TOEDJOE ... 18
3.1 Sejarah Berdirinya PT. Bintang Toedjoe ... 18
3.2 Visi dan Misi PT. Bintang Toedjoe ... 19
3.3. Lokasi dan Tata Letak Bangunan ... 19
3.4. Pembagian Divisi PT. Bintang Toedjoe ... 20
3.4.1 Bussines Development ... 21
3.4.2 Production Planning and Inventory Control (PPIC) .... 22
3.4.3 Divisi Plant ... 24
3.4.4 Divisi Research and Development (R&D) ... 36
3.4.4.1 Formulation Development ... 36
3.4.4.2 Analytical Development ... 38
3.4.4.3 Packaging Development ... 41
3.4.5 Divisi Quality Assurance and Quality Control (QA-QC) 42 3.4.5.1 Quality Assurance ... 42
3.4.5.2 Quality Control ... 45
3.4.6 Divisi Quality System ... 48
3.4.7 Divisi Purchasing ... 50
BAB 4 PEMBAHASAN ... 52
4.1 Manajemen Mutu ... 52
4.2 Personalia ... 54
4.3 Bangunan dan Fasilitas ... 55
4.4 Peralatan ... 57
4.5 Sanitasi dan Higiene ... 58
4.6 Produksi ... 59
4.7 Pengawasan Mutu ... 60
4.8 Inspeksi Diri dan Audit Mutu ... 62
4.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk kembalian ... 63
4.10 Dokumentasi ... 64
4.11 Pembuatan dan Analisis berdasarkan Kontrak ... 65
4.12 Kualifikasi dan Validasi ... 65
BAB 5 KESIMPULAN DAN SARAN ... 67
5.1. Kesimpulan ... 67
5.2. Saran ... 67
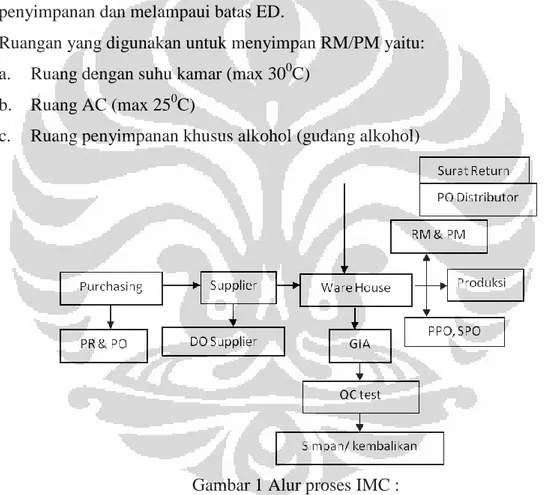
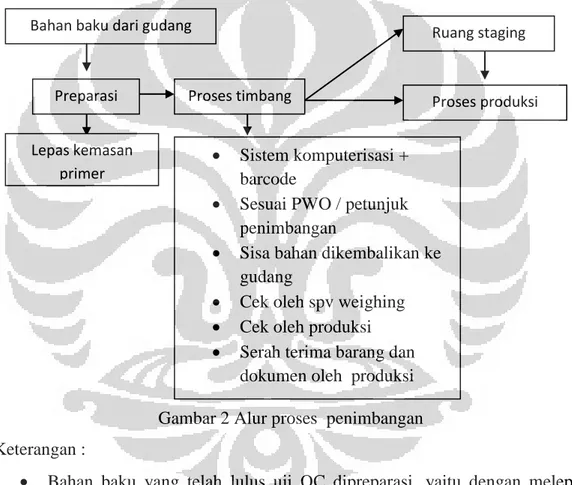
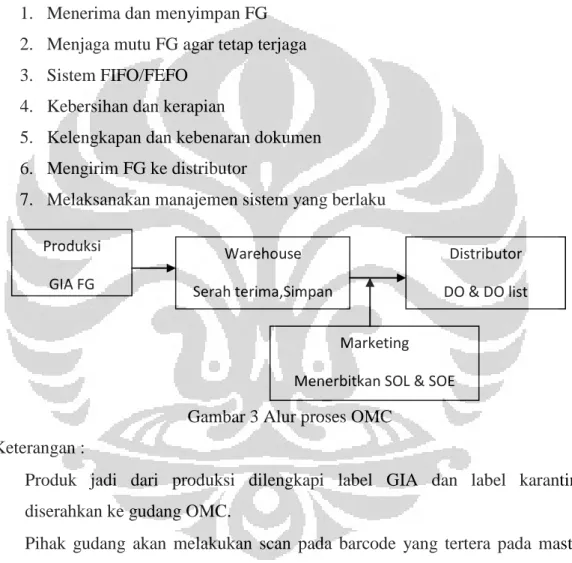
Gambar 1 Alur proses IMC ... 32 Gambar 2 Alur proses penimbangan ... 34 Gambar 3 Alur proses OMC ... 35
Halaman Lampiran 1: Struktur Organisasi PT Bintang Toedjo ... 70 Lampiran 2: Struktur Organisasi Manufacturing Division PT Bintang
Toedjoe ... 71 6 Lampiran 3: Struktur Organisasi Departemen Research and Development
PT Bintang Toedjoe ... 72 Lampiran 4: Struktur Organisasi Departemen Quality Assurance - Quality
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Pembangunan kesehatan merupakan hal yang penting dalam upaya peningkatan derajat kesehatan. Untuk itu diperlukan upaya untuk peningkatan derajat kesehatan dan peningkatan penyelenggaraan kesehatan secara menyeluruh dan terpadu. Pembangunan kesehatan tidak terlepas dari pembangunan di bidang farmasi khususnya dalam hal obat-obatan karena obat merupakan salah satu faktor pendukung peningkatan derajat kesehatan. Pembangunan dibidang obat-obatan mempunyai tujuan menjamin tersedianya obat dalam jumlah dan jenis yang cukup, penyebaran obat secara merata dan teratur serta menjamin kemanjuran obat secara farmakologis dengan efek samping seminimal mungkin dan bentuk sediaan yang dapat diterima.
Sesuai dengan kebijaksanaan pemerintah dalam bidang kesehatan yaitu peningkatan kesehatan masyarakat Indonesia melalui peningkatan sarana kesehatan dan kebutuhan akan alat kesehatan serta obat-obatan, maka pemerintah mengupayakan berdirinya industri untuk memenuhi kebutuhan tersebut. Industri farmasi sebagai produsen obat-obatan, diharapkan dapat menghasilkan produk yang berkualitas dan dapat memenuhi permintaan konsumen. Dunia kesehatan yang berkembang pesat, menyebabkan suatu industri farmasi terus melakukan inovasi dalam hal produk atau teknologi pembuatan, dengan selalu mengutamakan mutu, khasiat, dan keamanan produk.
Untuk meningkatkan kualitas obat, maka pemerintah mengeluarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 43/Menkes/SK/1998 tentang Cara Pembuatan Obat yang Baik (CPOB). Cara Pembuatan Obat Yang Baik (CPOB) adalah pedoman pembuatan obat bagi industri farmasi di Indonesia yang bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB menyangkut keseluruhan aspek produksi dan pengendalian mutu. Selain itu, dalam melaksanakan semua kegiatan di
pihak yang berperan maupun alat yang mendukung kegiatan tersebut. Apoteker sebagai salah satu pihak yang terjun langsung dalam kegiatan kefarmasian diharapkan dapat memberikan kontribusi pikiran dan tenaga yang maksimal untuk peningkatan kualitas dan kuantitas dari produk farmasi.
Praktek Kerja Profesi Apoteker (PKPA) merupakan salah satu sarana bagi calon apoteker untuk mendapatkan pengalaman praktis dan pemahaman yang lebih dalam tentang tugas dan fungsi apoteker di industri farmasi. Oleh karena itu dalam rangka memberikan pemahaman bagi para calon apoteker tentang perannya tersebut maka program profesi apoteker Universitas Indonesia menjalin kerjasama dengan PT. Bintang Toedjoe untuk melaksanakan PKPA di PT Bintang Toedjoe yang dilaksanakan mulai tanggal 1 April- 31 Mei 2013.
1.2 Tujuan
1. Mengetahui peran dan fungsi apoteker di industri farmasi serta meningkatkan wawasan dan pengalaman tentang administrasi, operasional dan pengelolaan kegiatan di industri farmasi.
2. Mempelajari ruang lingkup profesi secara teori dan praktek sehingga memperoleh gambaran yang jelas dan nyata mengenai tanggung jawab profesi apoteker di setiap unit industri farmasi.
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No. 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi, industri farmasi adalah industri obat jadi dan industri bahan baku obat. Bahan baku obat adalah bahan baik yang berkhasiat maupun yang tidak berkhasiat yang digunakan dalam pengolahan obat dengan standar, mutu sebagai bahan farmasi. Sedangkan yang dimaksud obat jadi adalah sediaan atau paduan bahan-bahan yang siap digunakan untutk mempengaruhi sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi.
Industri obat jadi adalah industri yang menghasilkan suatu produk yang telah melalui seluruh tahap proses pembuatan. Proses pembuatan adalah seluruh rangkaian kegiatan yang menghasilkan suatu obat yang meliputi produksi dan pengawasan mutu mulai dari pengadaan bahan awal, proses pengolahan, pengemasan sampai obat jadi dan siap untuk didistribusikan. Industri bahan baku adalah bahan baku yang diproduksi oleh suatu industri, dimana bahan baku tersebut adalah semua bahan baik yang berkhasiat maupun yang tidak berkhasiat, yang digunakan dalam proses pengolahan atau pembuatan obat.
2.1.2 Persyaratan Industri Farmasi
Persyaratan yang harus dipenuhi agar suatu industri farmasi memperoleh izin usaha seperti yang dijelaskan dalam 1799/Menkes/Per/XII/2010 tentang industri Farmasi adalah sebagai berikut
c. Memiliki Nomor Pokok Wajib Pajak;
d. Memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi, dan pengawasan mutu; dan
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
2.1.3 Izin Usaha Industri Farmasi
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut berproduksi dengan perperpanjangan izin setiap 5 tahun, sedangkan untuk industri farmasi Penanaman Modal Asing (PMA) masa berlakunya sesuai dengan ketentuan dalam Undang-Undang No.1 Tahun 1967 tentang Penanaman Modal Asing dan pelaksanaannya.
2.1.4 Pencabutan Izin Usaha Industri Farmasi
Izin usaha industri farmasi dapat dicabut dalam hal (Keputusan Menteri Kesehatan Republik Indonesia No. 245, 1990) :
a. Melakukan pemindah tanganan hak milik izin usaha industri farmasi dan perluasan tanpa izin.
b. Tidak menyampaikan laporan mengenai perkembangan industri farmasi selama tiga kali berturut-turut atau dengan sengaja menyampaikan informasi yang tidak benar.
c. Melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari Menteri Kesehatan RI.
d. Dengan sengaja memproduksi obat jadi atau bahan baku obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku, termasuk obat palsu. e. Tidak dipenuhinya ketentuan dalam izin usaha industri farmasi.
2.2 Cara Pembuatan Obat yang Baik (CPOB) 2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan bagi pengguna karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu” yang memerlukan partisipasi dan komitmen dari semua jajaran pada seluruh departemen dalam suatu perusahaan, para pemasok dan para distributor. Manajemen mutu didesain secara menyeluruh dan diterapkan secara benar dalam rangka mencapai tujuan mutu secara konsisten dan dapat diandalkan. Unsur dasar manajemen mutu adalah sebagai berikut:
a. Infrastruktur atau sistem mutu yang tepat. Unsur ini mencakup struktur organisasi, prosedur, proses dan sumber daya.
b. Tindakan sistematis, unsur ini diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang ditetapkan.
CPOB adalah seluruh aspek dalam praktek yang ditetapkan yang secara kolektif menghasllkan produk akhir atau layanan yang secara konsisten memenuhi spesifikasi yang sesuai serta mengikuti peraturan nasional dan internasional. CPOB bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi pemyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB mencakup seluruh aspek poduksi dan pengendalian mutu. Obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk. Pengawasan mutu adalah bagian dari CPOB yang berhubungan dengan pengambilan sampel, spesifikasi dan pengujian serta dengan organisasi, dokumentasi dan prosedur pelulusan yang memastikan bahwa bahan yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan dinyatakan memenuhi syarat. Setiap industri farmasi hendaklah mempunyai fungsi pengawasan mutu.
yang memadai hendaklah terseedia untuk memastikan bahwa semua fungsi pengawasan mutu dapat dilaksanakan secara efektif dan dapat diandalkan.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan. lndustri farmasi hendaklah memiliki personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personil tidak dibebani tanggung jawab yang berlebihan untuk menghindari risiko terhadap mutu obat.
Industri farmasi harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personil pada posisi penanggung jawab hendaklah dicantumkan dalam uraian tugas tertulis. Tugas mereka boleh didelegasikan kepada wakil yang ditunjuk serta mempunyai tingkat kualifikasi yang memadai. Aspek CPOB harus benar-benar diterapkan, tidak ada yang terlewatkan maupun tumpang tindih dalam tanggung jawab yang tercantum pada uraian tugas.
Personil kunci mencakup Kepala Bagian Produksi, Kepala Bagian Pengawasan Mutu dan Kepala Bagian Manajemen Mutu (Pemastian Mutu). Posisi utama tersebut dijabat oleh personil purna waktu. Kepala Bagian Produksi dan Kepala Bagian Manajemen Mutu (Pemastian Mutu) atau Kepala Bagian Pengawasan Mutu, harus terpisah (independent) satu terhadap yang lain. Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, manajemen mutu (pemsastian 'mutu)/ pengawasan mutu dipimpin oleh orang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadai yang dlperlukan untuk dapat melaksanakan tugasnya secara
organisasi yang dapat menghambat atau membatass kewajibannya dalam melaksanakan tanggung jawab atau yang dapat menimbulkan konflik kepentingan pribadi atau finansial.
lndustri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya dapat berdampak pada mutu produk. Di samping'pelatihan dasar dalam teori dan praktik CPOB, personil baru hendaklah mendapat pelatihan sesuai dengan tugas yang diberikan. Pelatihan berkesinambungan hendaklah juga diberikan, dan efektifitas penerapannya hendaklah dinilai secara berkala. Selain itu hendaklah tersedia program pelatihan yang disetujui kepala bagian masing- masing.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi, dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan hendaknya sedemikian rupa untuk menghindari pencemaran dan lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, air, serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut. Bangunan dan fasilitas hendaknya dirawat dengan cermat, dibersihkan dan perlu didesinfeksi sesuai prosedur tertulis yang rinci. Catatan pembersihan dan desinfeksi hendaklah disimpan. Seluruh bangunan dan fasilitas termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling bangunan hendaklah dirawat dalam kondisi
diperbaiki bila perlu. Perbaikan dan perawatan bangunan dan fasilitas hendaklah dilakukan hati-hati agar kegiatan tersebut tidak mempengaruhi mutu obat pasokan.
Tenaga listrik, lampu penerangan, suhu. kelembaban dan ventilasi hendaklah tepat agar tidak mengakibatkan dampak yang merugikan baik secara langsung maupun tidak langsung terhadap produk selama proses pembuatan dan penyimpanan, atau terhadap ketepatan/ ketelitian fungsi dari peralatan. Selain itu desain dari tala letak ruang hendaklah memastikan kompatibilitas dengan kegiatan produksi lain yang mungkin dilakukan di dalam sarana yang sama atau sarana yang berdampingan. Disamping itu dilakukan pencegahan agar area produksi tidak dimanfaatkan sebagai jalur lalu lintas umum bagi persornil dan bahan atau produk, atau sebagai tempat penyimpanan bahan atau produk selain yang sedang diproses.
2.2.4 Peralatan
Peralatan untuk membuat obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai, serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan. Peralatan hendaklah didesain dan dikonstruksi sesuai dengan tujuannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi atau absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan.
Bahan yang diperlukan untuk pengoperasian alat khusus misalnya pelumas atau pendingin tidak boleh bersentuhan dengan bahan yang sedang diolah sehingga tidak mempengaruhi identitas, mutu atau kemurnian bahan awal, produk antara ataupun produk jadi. Peralatan tidak boleh merusak produk akibat katup bocor tetesan pelumas dan hal sejenis atau karena perbaikan, perawatan, modifikasi dan adaptasi yang tidak tepat. Peralatan hendaklah didesain sedemikian rupa agar mudah dibersihkan. Pembersihan
dalam keadaan bersih dan kering. Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu atau kemurnian produk.
Selain itu hendaklah tesedia alat timbang dan alat ukur dengan rentang dan ketelitian yang tepat untuk proses produksi dan pengawasan. Peralatan yang digunakan untuk menimbang, mengukur, memeriksa dan mencatat hendaklah diperiksa ketepatannya dan dikalibras sesuai program dan prosedur yang ditetapkan. Hasil pemeriksaan dan kalibrasi hendaklah dicatat dan disimpan dengan baik. Selain itu peralatan hendaklah ditempatkan sedemikian rupa untuk memperkecil kemungkinan tejadinya pencemaran silang antar bahan dl area yang sama. Peralatan hendaklah dlpasang sedemikian rupa untuk menghindari resiko kekeliruan atau pencemaran. Peralatan satu sama lain, hendaklah ditempatkan pada jarak yang cukup untuk menghindari kesesakan serta memastikan tidak terjadi kekeliruan dan campur-baur produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu. Sanitasi dan higiene yang mulai diatur dalam pedoman CPOB 2006 terbaru adalah terhadap personalia, bangunan dan fasilitas, serta peralatan. Prosedur sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk cukup efektif dan selalu memenuhi persyaratan.
Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan personil, hendaklah personil menggenakan pakaian pelindung yang bersih dan sesuai degan tugasnya termasuk penutup rambut. Pakaian kerja kotor dan lap pembersih kotor (yang dapat dipakai ulang) hendaklah disimpan dalam wadah tertutup hingga pencucian. Disamping itu semua personil hendaklah
penerapan higiene perorangan. Semua personil yang berhubungan dengan proses pembuatan hendaklah menerapkan tingkat hiegene yang tinggi. Merokok, makan, minum, mengunyah, memelihara tanaman, menyimpan makanan, minuman, bahan untuk merokok atau obat pribadi hanya diperbolehkan di area tertentu dan dilarang dalam area produksi, laboratorium, area gudang dan area lain yang mungkin berdampak terhadap mutu produk.
Prosedur tertulis tersebut hendaklah disusun dan dipatuhi untuk mencegah pencemaran terhadap peralatan. bahan awal, wadah obat, tutup wadah, bahan pengemas dan label atau produk jadi. Rodentisida, insektisida, agen fumigasi dan bahan sanitasi tidak boleh mencemari peralatan, bahan awai, bahan pengemas. bahan yang sedang diproses atau produk jadi. Hendaklah ada prosedur tertulis untuk pemakaian rodentisida, insektisida, fungisida, agens fumigasi, pembersih dan sanitasi yang tepat. Selain itu rodentislda, insektisida dan fungisida hendaklah tidak digunakan kecuali yang sudah terdaftar dan digunakan sesuai peraturan terkait.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin produk yang dihasilkan memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir, melainkan mutu harus dibangun selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan kebersihan, dan higiene sampai dengan pengemasan.
Mutu suatu obat ditentukan oleh proses produksi. Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang telah ditentukan. Prosedur kerja standar hendaklah tertulis, mudah dipahami, dan dipatuhi oleh karyawan produksi. Dokumentasi setiap langkah dilakukan dengan cermat, tepat dan ditangani oleh karyawan yang melaksanakan tugas. Bila
terjadi penyimpangan maka hendaklah ada persetujuan tertulis dari kepala bagian Pemastian mutu dan bila perlu melibatkan bagian Pengawasan Mutu.
Pengolahan produk yang berbeda hendaklah tidak dilakukan secara bersamaan atau bergantian dahm ruang kerja yang sama kecuali tidak ada risiko terjadinya campur baur ataupun kontaminasi silang. Bila bekerja dengan bahan atau produk kering, hendaklah dilakukan tindakan khusus untuk mencegah debu timbul serta penyebarannya. Hal ini terutama dilakukan pada penanganan bahan yang sangat aktif atau menyebabkan sensitisasi. Penyimpangan terhadap instruksi atau prosedur sedapat mungkin dihindarkan. Pada umumnya pembuatan produk non-obat hendaklah dihindarkan dibuat di area dan dengan peratatan yang khusus untuk produk obat.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari CPOB untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi obat jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Kemandirian pengawasan mutu dari produksi dianggap sebagai hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan dengan memuaskan. Tiap pemegang izin pembuatan harus mempunyai bagian pengawasan mutu. Bagian ini harus terpisah dari bagian lain dan dibawah tanggung jawab dan wewenang seorang dengan kualifikasi dan pengalaman yang sesuai, yang membawahi satu atau beberapa laboratorium. Sarana yang memadai harus tersedia untuk memastikan bahwa segala kegiatan pengawasan mutu dilaksanakan dengan efektif dan dapat diandalkan.
Pengawasan mutu hendaklah mencakup semua kegiatan analisis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini
yang dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya. Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk pengambilan sampel dan penyelidikan yang diperlukan.
2.2.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Auditor luar yang independen dapat memberikan manfaat ketika dilakukan inspeksi diri dan audit mutu. Inspeksi diri hendaklah dilakukan secara rutin maupun dalam keadaan khusus, misalnya terjadi penarikan kembali obat jadi atau penolakan yang berulang. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif. Inspeksi diri dilakukan dengan membuat daftar periksa inspeksi diri yang menyajikan standar persyaratan minimal dan seragam. Daftar periksa mengandung pertanyaan mengenai ketentuan CPOB yang meliputi personalia, bangunan termasuk fasilitas untuk personil, perawatan bangunan dan peralatan, penyimpanan bahan awal, bahan pengemas dan obat jadi, peralatan, pengolahan dan pengawasan selama proses, pengawasan mutu, dokumentasi, sanitasi dan higiene, program validasi dan revalidasi, kalibrasi alat atau sistem pengukuran, prosedur penarikan kembali obat jadi, penanganan keluhan, pengawasan label dan hasil inspeksi diri sebelumnya dan tindakan perbaikan.
dari dalam atau luar perusahaan. Tiap anggota hendaklah independen dalam melakukan inspeksi dan evaluasi. Inspeksi diri dapat dilakukan oleh tiap bagian sesuai kebutuhan pabrik, namun inspeksi diri yang dilaksanakan secara menyeluruh hendaklah dilaksanakan minimal satu kali dalam setahun. Frekuensi inspeksi diri hendaklah tertulis dalam prosedur tetap inspeksi diri. Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk, dan Produk Kembalian
Keluhan terhadap obat dan laporan keluhan dapat menyangkut mutu, efek samping yang merugikan atau masalah efek terapetik. Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi dengan cermat, kemudian diambil tindak lanjut yang sesuai dan dibuatkan laporan. Penarikan kembali obat jadi adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Penarikan kembali dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Penarikan obat jadi dari peredaran dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut. Obat kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, kadaluarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan.
Industri farmasi hendaklah menyiapkan prosedur untuk penanganan, penyelidikan dan pengujian obat kembalian serta pengambilan keputusan apakah produk kembalian dapat diproses ulang atau harus dimusnahkan setelah dilakukan evaluasi secara kritis. Obat kembalian yang tidak dapat
pemusnahan produk harus disiapkan dan mencakup tindakan pencegahan terhadap pencemaran lingkungan dan penyalahgunaan bahan atau produk oleh orang yang tidak mempunyai wewenang.
2.2.10 Dokumentasi
Dokumentasi merupakan bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi dokumen produksi induk/formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu. Dokumen produksi induk, prosedur pengolahan induk dan prosedur pengemasan induk (formula pembuatan, intruksi pengolahan dan intruksi pengemasan) menyatakan seluruh bahan awal dan bahan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan. Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian, dan pengoperasian peralatan.
Catatan menyajikan riwayat tiap bets produk, termasuk distribusinya dan semua keadaan yang relevan yang berpengaruh pada mutu produk akhir,
1. Dokumen hendaklah didesain, disiapkan, dikaji dan didistribusikan dengan cermat. Bagian dokumen pembuatan dan dokumen registrasi (dossier) yang relevan hendaklah sesuai.
2. Dokumen hendaklah disetujui, ditandatangani dan diberi tanggal oleh personil yang sesuai dan diberi wewenang.
rapi dan mudah dicek. Dokumen hasil reproduksi hendaklah jelas dan terbaca. Reproduksi dokumen kerja dari dokumen induk tidak boleh menimbulkan kekeliruan yang disebabkan proses reproduksi.
4. Dokumen hendaklah dikaji ulang secara berkala dan dijaga agar selalu up-to-date. Bila suatu dokumen direvisi, hendaklah dijalankan suatu sistem untuk menghindarkan penggunaan dokumen yang sudah tidak berlaku secara tidak sengaja.
5. Dokumen hendaklah tidak ditulis-tangan; namun, bila dokumen memerlukan pencatatan data, maka pencatatan ini hendaklah ditulis-tangan dengan jelas, terbaca, dan tidak dapat dihapus. Hendaklah disediakan ruang yang cukup untuk mencatat data.
6. Semua perubahan yang dilakukan terhadap pencatatan pada dokumen hendaklah ditandatangani dan diberi tanggal; perubahan hendaklah memungkinkan pembacaan informasi semula. Di mana perlu, alasan perubahan hendaklah dicatat. Pencatatan hendaklah dibuat atau dilengkapi pada tiap langkah yang dilakukan dan sedemikian rupa sehingga semua aktivitas yang signifikan mengenai pembuatan obat dapat ditelusuri. Catatan pembuatan hendaklah disimpan selama paling sedikit satu tahun setelah tanggal daluwarsa produk jadi.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui, dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
Pemberi kontrak bertanggung jawab untuk menilai kompetensi penerima kontrak dalam pelaksanaan pekerjaan atau pengujian yang diperlukan dan
kontrak hendaklah menyediakan semua informasi yang diperlukan kepada penerima kontrak untuk melaksanakan pekerjaan kontrak secara benar sesuai izin edar dan persyaratan legal lain. Pemberi kontrak hendaklah memastikan bahwa penerima kontrak memahami sepenuhnya masalah yang berkaitan dengan produk atau pekerjaan atau pengujian yang dapat membahayakan gedung, peralatan, personil, bahan atau produk lain. Disamping itu pemberi kontrak hendaklah memastikan bahwa semua produk yang diproses dan bahan yang dikirimkan oleh penerima kontrak memenuhi spesifikasi yang ditetapkan atau produk telah diluluskan oleh kepala bagian manajemen mutu (pemastian mutu).
Penerima kontrak harus mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman, dan personil yang kompeten untuk melakukan pekerjaan yang diberikan oleh pemberi kontrak dengan memuaskan. Pembuatan obat berdasarkan kontrak hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat CPOB yang diterbitkan oleh otoritas pengawasan obat (OPO). Penerima kontrak hendaklah memastikan bahwa semua produk dan bahan yang diterima sesuai dengan tujuan penggunaannya. Selain itu penerima kontrak hendaklah tidak mengalihkan pekerjaan atau pengujian apapun yang dipercayakan kepadanya sesuai kontrak kepada pihak ketiga tanpa terlebih dahulu dievaluasi dan disetujui oleh pemberi kontrak. Pengaturan antara penerima kontrak dan pihak ketiga manapun hendaklah memastikan bahwa informasi pembuatan dan analisis disediakan kepada pihak ketiga dengan cara yang sama seperti yang dilakukan pada awalnya antara pemberi kontrak dan penerima kontrak.
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian resiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi. Kegiatan validasi meliputi kualifikasi (personil, peralatan, dan sistem), kalibrasi (instrumen dan alat ukur) dan validasi (prosedur dan proses).
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasi di dalam Rencana Induk Validasi (RIV) atau dokumen setara. Pada umumnya validasi proses dilakukan sebelum produk dipasarkan (validasi prospektif). Dalam keadaan tertentu, jika hal di atas tidak memungkinkan, validasi dapat juga dilakukan selama proses produksi rutin dilakukan (validasi konkuren). Proses yang sudah berjalan hendaklah juga divalidasi (validasi retrospektif). Selain validasi proses terdapat pula validasi pembersihan untuk mengkonfirmasi efektivitas prosedur pembersihan dan validasi metode analisis untuk menunjukkan bahwa metode analisis sesuai tujuan penggunaannya.
Kualifikasi adalah suatu tindakan pembuktian yang terdokumentasi dengan tujuan untuk memastikan bahwa instrumen atau sistem yang digunakan sesuai dengan yang telah ditetapkan. Kualifikasi mencakup :
a. Kualifikasi desain (Design Qualification) yaitu suatu tindakan yang terdokumentasi untuk memastikan bahwa desain dari fasilitas, sistem dan peralatan sesuai dengan tujuan yang diinginkan
b. Kualifikasi instalasi (Installation Qualification) yaitu suatu tindakan yang terdokumentasi untuk memastikan bahwa alat atau instrument telah dipasang sesuai dengan desain dari spesifikasi instalasi alat tersebut.
c. Kualifikasi Operasional (Operational Qualification) adalah suatu tindakan yang terdokumentasi untuk memastikan bahwa alat atau instrument tersebut telah dapat beroperasi sesuai spesifikasinya.
d. Kualifikasi Kinerja (Performance Qualification) yaitu suatu tindakan yang terdokumentasi untuk memastikan kinerja dari alat tersebut telah menghasilkan produk atau keluaran (output) lain secara konsisten sesuai dengan spesifikasi yang telah ditentukan.
e. Kualifikasi fasilitas, peralatan dan sistem terpasang yang telah operasional yaitu suatu tindakan yang terdokumentasi untuk memastikan parameter operasional dan batas variabel kritis pengoperasian alat, kalibrasi, pembersihan, perawatan preventif serta prosedur dan catatan pelatihan operator (BPOM, 2006; BPOM 2009, BPOM 2012)
TINJAUAN KHUSUS PT. BINTANG TOEDJOE
3.1 Sejarah Berdirinya PT. Bintang Toedjoe
Bintang Toedjoe pertama kali didirikan di Garut, Jawa Barat, pada tanggal 29 April 1946 oleh Tan Jun She (seorang sinshe), Tjia Pu Tjien dan Hioe On Tjan. Nama Bintang Toedjoe dipilih sesuai dengan jumlah anak perempuan Tan Jun She yaitu 7 orang. Pada saat itu, PT. Bintang Toedjoe berhasil memproduksi obat-obatan yang dijual bebas guna memenuhi kebutuhan masyarakat akan obat dengan alat-alat yang sederhana dan hanya mempekerjakan beberapa karyawan. Salah satu obat yang diproduksi adalah puyer no.16 (obat sakit kepala no.16) yang sampai saat ini masih banyak dikonsumsi oleh masyarakat Indonesia dan diekspor ke beberapa negara.
Empat tahun sejak didirikan, PT. Bintang Toedjoe pindah ke kawasan Krekot, Jakarta. Pada tahun 1974, PT. Bintang Toedjoe pindah ke kawasan Cempaka Putih, Jakarta. Pada tahun 1970-an, PT. Bintang Toedjoe mulai memproduksi obat resep dokter.
Pada tahun 1985, PT. Bintang Toedjoe diakuisisi oleh Kalbe Group dan berkembang dengan pesat. Seiring dengan perjalanan waktu PT. Bintang Toedjoe terus berkembang dan menunjukkan reputasinya sebagai salah satu pabrik farmasi yang sangat aktif pada segmen pasar Nutraceuitical Product (food supplements
dan herbal medicine) dan produk Over The Counter (OTC), baik di dalam negeri maupun di pasar ekspor.
Sejalan dengan peningkatan produksinya, lokasi kawasan Cempaka Putih sudah tidak memadai lagi. Maka pada tahun 1993 PT. Bintang Toedjoe pindah ke Kawasan Industri Pulogadung. Pada bulan September 2002 Head Office pindah ke Pulomas. Jumlah karyawan secara keseluruhan berkisar sekitar 1300 orang. PT. Bintang Toedjoe merupakan salah satu perusahaan farmasi terbesar di Indonesia yang tidak hanya memproduksi obat-obatan, melainkan juga memproduksi suplemen makanan.
Pada tanggal 12 Mei 1997 PT. Bintang Toedjoe memperoleh sertifikat standar mutu ISO 9001 (International Organization for Standarization), yang merupakan pengakuan terhadap kualitas manajemen perusahaan. Hal ini merupakan bukti bahwa perusahaan ini selalu memperhatikan kualitas produk obat yang dibuat dan setiap aspek kegiatan yang terlibat di dalamnya. PT. Bintang Toedjoe juga menerapkan sistem CPOB, SMK3 (Sistem Manajemen Kesehatan dan Keselamatan Kerja), HACCP (Hazard Analysis Critical Control Point), ISO 9001, ISO 14001, OHSAS (Occupational Health and Safety Asessment Series), dan 5R (Ringkas, Rapi, Resik, Rawat, Rajin).
3.2 Visi dan Misi PT. Bintang Toedjoe
PT. Bintang Toedjoe mempunyai visi yaitu menjadi perusahaan healthcare
yang dikagumi dan disegani di Asia Tenggara.
Untuk mewujudkan visi tersebut PT. Bintang Toedjoe mempunyai misi yaitu menghasilkan produk yang inovatif dan berkualitas yang terjangkau masyarakat umum untuk kehidupan yang lebih produktif dan bermakna.
Panca Sradha PT. Bintang Toedjoe adalah:
1. Trust is the glue of life. Saling percaya adalah perekat di antara kami. 2. Mindfulness is the foundation of our action. Kesadaran penuh adalah dasar
setiap tindakan kami.
3. Innovation is the key to our success. Inovasi adalah kunci keberhasilan kami.
4. Strive to be the best. Bertekad untuk menjadi yang terbaik.
5. Interconnectedness is a universal way of life. Saling keterkaitan adalah panduan hidup kami.
3.3 Lokasi dan Tata Letak Bangunan
PT. Bintang Toedjoe berlokasi di Jakarta Timur dan memiliki dua plant yang terletak di dua lokasi yang berbeda yaitu di Pulomas dan kawasan industri Pulogadung. PT. Bintang Toedjoe plant Pulomas terletak di Jl. Jend. Ahmad Yani No.2, yang terdiri dari Head Office dan Plant yang bertanggung jawab terhadap
produksi produk-produk effervescent (seperti Extra Joss dan Ejuss) dan obat tradisional (seperti Bintang Toedjoe Masuk Angin dan Promag Gazero). PT. Bintang Toedjoe plant Pulogadung berlokasi di Kawasan Industri Pulogadung Jl. Rawa Sumur Barat II/K-9, bertanggung jawab terhadap produksi produk-produk liquid (seperti Nitros, Komix, Sakatonik Liver, Promag Suspensi), produk-produk puyer (seperti Puyer 16, Puyer 14, Waisan), produk tablet (seperti Sakatonik ABC), serta produk-produk tablet effervescent (seperti Promuno, Flavettes, Caxon).
PT Bintang Toedjoe baik plant Pulomas maupun Pulogadung memiliki 3 kelas pembagian ruang yaitu blackarea (pada area ini jumlah partikel, suhu dan kelembaban udara tidak diatur namun tetap dipantau secara berkala meliputi ruang
packaging sekunder, gudang Raw Material atau Packaging Material atau finished goods dan ruang office), grey area (pada area ini jumlah partikel, suhu, kelembaban dan aliran udaranya diatur dan dipantau meliputi ruang compounding, ruang filling atau kemas primer, ruang sampling, ruang penimbangan atau
weighing dan white area (meliputi ruang laboratorium analisis mikrobiologi di dalam ruang Quality Anssurance – Quality Control), sebelum masuk white area tersebut diharuskan memakai baju dan sepatu khusus bebas serat dan harus melewati ruang buffer khusus yang memiliki air blower untuk menghilangkan partikel yang menempel pada baju.
3.4 Pembagian Divisi PT. Bintang Toedjoe
PT. Bintang Toedjoe memiliki beberapa pembagian divisi yaitu :
1. Marketing & Sales, divisi ini bertanggung jawab terhadap seluruh kegiatan pemasaran dan penjualan produk-produk PT. Bintang Toedjoe.
2. Manufacturing, divisi ini bertanggung jawab atas produksi produk-produk PT. Bintang Toedjoe termasuk pengembangannya.
3. Business Development, divisi ini bertanggung jawab terhadap ide pengembangan produk baru, registrasi produk, survey konsumen berkaitan dengan produk dan medical.
4. Finance, Accounting, Information, Technology, Legal (FAITL), divisi ini bertanggung jawab atas semua aktivitas finance dan accounting di PT. Bintang Toedjoe serta hal-hal yang berhubungan dengan hukum dan
Information Technology support.
5. Industrial Relation and General Affair atau IRGA, divisi ini bertanggung jawab atas hubungan sosial seperti hubungan kerja antar karyawan dalam perusahaan atau menyelesaikan apabila ada sengketa antar karyawan.
6. Human Resources, divisi ini bertanggung jawab dalam menetapkan strategi pengembangan sumber daya manusia yang kompeten dengan didukung budaya perusahaan yang harmonis serta melaksanakan proses rekruitmen, penempatan pegawai, Individual Development Program atau IDP dan menciptakan sistem yang dapat mendukung terciptanya sumber daya manusia yang diharapkan.
Manufacturing
Divisi manufacturing terdiri dari Plant (Production, Engineering dan
Warehouse & Penimbangan), Research & Development, Quality Assurance-Quality Control, Assurance-Quality System dan Purchasing. Setiap bagian dari divisi
manufacturing bekerja sama dalam menghasilkan produk yang bermutu, aman dan acceptable serta sesuai dengan ketentuan Cara Pembuatan Obat yang Baik.
3.4.1 Bussiness Development
Bagian Bussines Development PT. Bintang Toedjoe dibagi menjadi empat divisi, yaitu: CI (Consumer Insight), PI (Product Inovation), RA (Regulatory Affair) dan Medical.
1. Consumer Insight (CI)
Tujuan CI adalah mencari produk apa yang diinginkan konsumen berdasarkan hasil insight ke pasar. Fungsi dan tugas dari CI yaitu melakukan survey terhadap konsumen, dimana hasil survey tersebut berkaitan dengan pengembangan produk PT. Bintang Toedjoe sehingga produk yang dikembangkan sesuai dengan kebutuhan dan keinginan konsumen.
2. Product Inovation (PI)
Berfungsi dalam pengembangan konsep produk baru, dimana PI akan menentukan komposisi serta varian rasa dari suatu produk yang akan dikembangkan oleh PT. Bintang Toedjoe.
3. Regulatory Affair (RA)
Tugas dan tanggung jawab regulatory affair adalah memperoleh nomor izin edar (nomor registrasi) produk baru (untuk meregistrasikan suatu produk), melakukan registrasi variasi terhadap produk yang mengalami perubahan-perubahan yang tidak terkait mutu dan kualitas, serta memperoleh persetujuan izin iklan. Registrasi obat dilakukan di Badan Pengawasan Obat dan Makanan (BPOM).
4. Medical
Tugas dan tanggung jawab medical berkaitan dengan penentuan indikasi produk-produk yang diproduksi PT. Bintang Toedjoe
3.4.2 Production Planning and Inventory Control (PPIC)
Production Planning & Inventory Control (PPIC) merupakan bagian yang banyak bekerjasama dengan manufacturing terutama bagian produksi. PPIC PT. Bintang Toedjoe saat ini dikelola oleh SCM (Supply Chain Management) Kalbe Group. PPIC dibagi menjadi 2 bagian, yaitu PPIC plant Pulomas dan PPIC plant Pulogadung. PPIC bertanggung jawab terhadap perencanaan jadwal produksi dan pengelolaan inventori baik raw material, packaging material, finished goods. PPIC dalam fungsi dan tugasnya bekerja sama dengan bagian produksi, purchasing, RnD dan QC.
Ruang lingkup kerja Production Planning & Inventory Control dapat dibagi menjadi dua bagian yaitu bagian PPC (Production Planning Control) dan IPC (Inventory Planning Control). IPC memiliki 2 subbagian yang ditangani, yaitu inventori IMC (Incoming Material Control) dan OMC (Outgoing Material Control). Monitoring (report) IMC dan OMC diinfokan ke SCM. Tugas dan tanggung jawab Production Planning Control yaitu menerima perkiraan pemesanan distributor dari pihak sales, merencanakan pengadaan raw material
atau packaging material, memenuhi permintaan finished goods. Inventory Planning Control bertanggung jawab terhadap perhitungan jumlah bahan baku maupun bahan kemas yang ada maupun yang sedang dipesan agar dapat memenuhi kebutuhan produksi. Hal ini dilakukan berdasarkan rencana produksi triwulan dari bagian Production Planning Control. Bagian Inventory Planning Control juga berperan dalam memantau persediaan obat jadi agar tidak terjadi
overstock atau stock out sehingga mampu memenuhi permintaan konsumen. Pihak PPIC harus mempertimbangkan kapasitas produksi dalam menentukan jumlah atau perencanaan barang yang akan diproduksi agar produk yang dihasilkan sesuai yang diharapkan dan dihasilkan tepat waktu. Hal-hal lain yang perlu dipertimbangkan dalam PPIC antara lain : stock on hand, lead time dan
safety stock. Sistem pemesanan barang dengan supplier oleh PPIC PT Bintang Toedjoe sebagian sudah menggunakan sistem kanban.
Secara umum, alur PPIC adalah sebagai berikut :
a. Penyampaian RoFo (Rolling Forecast) dari bagian marketing ke demand planning. RoFo merupakan suatu rencana penjualan selama rencana waktu yang ditentukan/direncanakan.
b. PPIC selanjutnya menindaklanjuti RoFo tersebut dengan membuat perencanan produksi/RPP (Rolling Production Plan) untuk memenuhi target yang diminta. RPP disusun untuk satu tahun, 6 bulan, bulanan dan mingguan.
Forecast 6 bulan ke depan disusun berdasarkan review meeting bulanan secara berkala dengan marketing. Kemudian rencana produksi satu tahun dituangkan menjadi rencana produksi bulanan dari forecast bulanan dan disampaikan ke produksi dalam bentuk rencana produksi mingguan.
c. PPIC akan menghitung kebutuhan bahan raw material (RM), packaging material (PM) yang diperlukan berdasarkan rencana produksi yang dibuat. d. PPIC membuat pemesanan bahan dengan membuat PR (Purchase Request)
ke bagian purchasing. Bagian purchasing membuat PO (Purchase Order) ke supplier yang dituju.
e. Bahan yang dipesan, dikirim oleh supplier dan diterima oleh bagian IMC
Pada tahap perencanaan produksi dibutuhkan perencanaan terhadap material yang akan dibutuhkan dalam kegiatan produksi, yang biasa disebut MRP (Material Requirement Planning). Alur proses MRP adalah :
1. Proses konversi dari produk yang diminta menjadi material-material pembentuk yang dibutuhkan
2. Netting, yaitu menghitung kebutuhan masing-masing material, inventory yang tersedia, dan penjadwalan untuk pemesanan material.
3. Lot sizing, yaitu menentukan jumlah material yang akan dipesan dimana jumlah yang dipesan harus disesuaikan dengan jumlah standar pembelian. 4. Lead time offsetting, yaitu menentukan kapan material diperlukan dan kapan
material akan siap digunakan untuk produksi.
3.4.3 Divisi Plant 3.4.3.1 Produksi
Departemen produksi bertanggung jawab atas semua kegiatan pembuatan produk yaitu mulai dari penerimaan bahan awal dari bagian pengolahan (compounding), pengisian (filling), pengemasan (packaging), hingga menghasilkan produk jadi (finished goods). Pelaksanaan proses produksi dilakukan berdasarkan rencana produksi mingguan dari bagian PPIC (Production Planning & Inventory Control) yang diturunkan lagi menjadi rencana produksi harian. Proses produksi juga harus sesuai dengan prosedur tetap seperti yang tertulis pada WI (work instruction) sehingga dapat menjamin mutu produk sesuai spesifikasi yang ditetapkan.
Departemen produksi di PT Bintang Toedjoe dibagi dalam dua plant, yakni plant Pulogadung dan plant Pulomas. Plant pulogadung terbagi dalam 3 line produksi, yaitu line puyer, tablet effervescent, dan liquid, sedangkan plant
Pulomas terbagi menjadi 2 line, yaitu line effervescent dan obat tradisional. 1) Area produksi
Area produksi di plant Pulomas dibagi menjadi 2 area yaitu black area dan
grey area. Yang membedakan 2 area tersebut adalah aliran udara, tekanan udara, suhu, RH, dan jumlah partikel.
a) Black area
Jumlah partikel pada daerah black area > 100.000. Sedangkan untuk RH, suhu, tekanan udara tidak diatur namun tetap dipantau secara berkala. Yang termasuk daerah black area pada ruang produksi adalah ruang packaging sekunder. Pakaian yang digunakan di ruang black area berupa baju black area all in
bewarna biru dan menggunakan sepatu khusus. b) Grey area
Grey area dikenal dengan kawasan bersih. Pada ruang grey area syarat jumlah partikelnya maksimal 100.000 partikel. Ruang-ruang grey area dijaga suhunya antara 20-27°C dan RH ≤70%. Namun khusus untuk ruang produksi
effervescent dengan dehumidifier dijaga suhunya ≤25°C dan RH ≤30%. Yang
termasuk grey area pada ruang produksiadalah ruang compounding dan ruang
filling (kemas primer). Untuk pakaian yang digunakan di ruang grey area
berupa terusan baju grey area all in, APD meliputi masker, sarung tangan, dan penutup telinga khusus (untuk area tertentu) serta sepatu khusus berwarna putih.
Line effervescent
Alur proses produksi secara keseluruhan adalah sebagai berikut:
a. Bahan baku ditimbang oleh warehouse bagian penimbangan (weighing). Bahan baku yang telah ditimbang diberi label penimbangan yang diparaf oleh penimbangan dan saksi. Hasil penimbangan disimpan di ruang staging
sebelum dipakai untuk proses compounding.
b. Pihak produksi mengambil bahan baku yang telah ditimbang di ruang staging, kemudian melakukan proses produksi (compounding) sesuai dengan WI yang telah ditetapkan. Secara berkala dilakukan sampling dan pengawasan dalam proses (In Process Control).
c. Bulk hasil akhir compounding dikarantina untuk dilakukan proses sampling
dan analisis oleh pihak QC. Pihak QC akan mengeluarkan label “ditolak” atau “diluluskan”. Bulk yang dinyatakan lulus oleh pihak QC akan diserahkan ke bagian pengemasan primer.
d. Selama proses pengemasan tersebut dilakukan IPC oleh Produksi dan inspeksi oleh QA. IPC yang dilakukan oleh produksi adalah uji keseragaman bobot, uji kebocoran dan uji kerekatan sealing. Uji keseragaman dilakukan per 10 menit. Uji ini bertujuan untuk menjamin kesamaan bobot produk dalam range yang dipersyaratkan, sehingga keseragaman rasa dan kadar zat aktif di dalam produk tersebut tetap terjaga. Uji kebocoran, yaitu uji dengan larutan rodamin, alat vakum dan alat sealing strength yang bertujuan untuk mengecek kemungkinan terjadinya kebocoran pada kemasan. Kemasan harus dapat melindungi produk dari risiko kehilangan bobot, kerusakan dan kontaminasi sehingga kemasan tersebut harus tertutup rapat. Uji selanjutnya adalah uji kerekatan sealing yang bertujuan untuk mengetahui seberapa besar kerekatan
sealing yang dihasilkan, sehingga kemasan tidak mudah terbuka.
e. Produk ruahan yang telah dikemas primer secara otomatis akan diteruskan ke pihak packaging untuk dikemas sekunder. Pengemasan sekunder terdiri dari empat tahap yaitu, tahap Cartoning, merupakan tahap pengemasan sachet ke dalam pack karton. Pada bagian ini operator akan mengelompokkan 6 sachet
untuk diletakkan di bagian mesin pengemas sekunder. Sachet yang sudah terkelompok tersebut kemudian akan terdorong ke dalam pack kemasan sekunder, lalu kemasan akan dilem secara otomatis. Pada proses ini dilakukan
In Process Control setiap 30 menit yaitu melihat secara visual kemasan sachet
sebelum dimasukkan ke pack karton. Hal yang perlu diperhatikan adalah nomor batch, tanggal pembuatan, tanggal kadaluarsa dan penampilan sachet
secara visual. Selain itu, alat pengemasan memiliki sensor berat untuk memastikan jumlah sachet yang ada di karton sesuai dengan yang diinginkan. Bila jumlahnya kurang atau lebih, maka mesin akan secara otomatis membuangnya dari line proses pengemasan.
f. Tahap selanjutnya yaitu wrapping yaitu tahap pengemasan 10 pack
menggunakan plastik Oriented Polypropylene (OPP). Setelah proses cartoning
perjalanan pack ini berlanjut ke proses wrapping pembungkusan 10 pack
menjadi satu menggunakan plastik Oriented Polypropylene. Dari proses ini dihasilkan satu unit Oriented Polypropylene. Pada alat ini terdapat pengontrol
untuk memastikan bahwa jumlah pack yang terbungkus dalam Oriented Polypropylene adalah sesuai. Jika jumlahnya tidak sesuai mesin akan secara otomatis tidak bekerja sampai jumlahnya sesuai.
g. Proses berikutnya adalah packing Oriented Polypropylene ke dalam Master Box (dus) yang dilakukan secara manual oleh operator. Sejumlah 24 Oriented Polypropylene dimasukkan ke dalam suatu dus, kemudian dus akan berjalan melewati sensor pengecekkan berat untuk memastikan bahwa jumlah Oriented Polypropylene dalam dus tersebut sesuai. Apabila telah sesuai maka akan keluar label berisi keterangan nomor batch, tanggal pembuatan, tanggal kadaluarsa, operator penimbangan dan keterangan-keterangan pelengkap lain. Label ini kemudian ditempel di dus sebagai identitas dari dus tersebut. Setelah itu proses dilanjutkan ke penyegelan dus dengan perekat.
h. Proses selanjutnya yaitu pengiriman produk jadi ke gudang. Hasil pengemasan dari mesin perekat tersambung langsung ke lantai 1, yaitu ruang tempat produk jadi yang telah selesai dikemas. Pada proses ini operator akan mengecek kelengkapan dus, setelah lengkap kemudian produk jadi siap diserahkan ke gudang produk jadi dengan dilengkapi dokumen GIA (Good Inward Advice) yang berisi informasi nomor batch, nama produk dan jumlah produk. Setelah proses serah terima ini, maka bagian produksi sudah menyerahkan tanggung jawab terhadap produk jadi ke bagian gudang. Nomor GIA ini kemudian akan ditempelkan di dus produk
i. Kemudian pihak gudang akan melakukan scan pada barcode di kemasan sekunder dan melakukan penyimpanan.
Line Liquida (Obat Tradisional)
Produk obat tradisional PT Bintang Toedjoe adalah bintang toedjoe masuk angin dan promag gazero. Secara umumproses produksinya terbagi menjadi :
a. Compounding
Raw material yang telah ditimbang oleh bagian ware house dilarutkan dalam alat mixing tank yang dilengkapi dengan agitator untuk dilakukan
mesin, dan jumlah cemaran mikroba. Testing point dalam proses ini meliputi karakter fisik bulk final mixing, analisis cemaran mikrobiologi dan homogenitas kadar zat aktif. Setelah homogen, produk ruahan tersebut dikarantina sambil menunggu hasil analisa dari QC untuk release/reject. Bagian QC akan memeriksa kadar bahan aktif, fisik, dan organoleptis.
b. Filling
Produk ruahan yang sudah mendapat status release dari QC akan dilanjutkan ke tahap filling liquid. Produk ruahan yang sudah berada di dalam storage dialirkan melalui pipa-pipa ke mesin filling dengan bantuan
compressor. Produk liquid tersebut akan difilling ke pengemasan primer berupa sachet. Parameter kritis dalam pada tahap ini meliputi keseragaman volume, keseragaman bobot, uji kebocoran. Fisik produk hasil filling diuji meliputi hasil inkjet no. Batch, manufacturing date, expired date, hasil
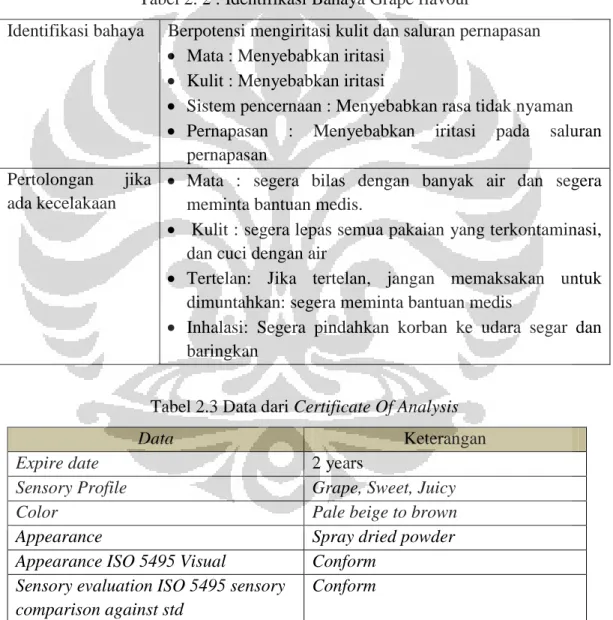
sealing, potongan, i-cut dan redaksi sachet. Pada proses ini juga diambil sampel atas, tengah dan bawah untuk pengujian mikrobiologi. Uji cemaran mikrobilogi meliputi Total Plate Count (TPC) dan kapang khamir.
c. Packaging
Tahap terakhir adalah tahap packaging yaitu bulk yang telah dikemas dalam sachet dikemas kembali dengan kemasan pack kemudian dikemas dengan kemasan yang lebih besar, yaitu karton. Testing point pada tahap ini adalah hasil inkjet no. batch, manufacturing date, expired date, etiket, jumlah sachet dalam pack, dan jumlah pack dalam karton.
3.4.3.2 Teknik (Engineering)
Departemen teknik merupakan departemen yang bertanggung jawab memberikan bantuan teknik kepada semua departemen yang membutuhkan bantuan terkait alat, mesin, sistem penunjang dan lain-lain. Departemen teknik dibagi menjadi beberapa bagian sesuai fungsinya antara lain maintenance, utility, sparepart, workshop, building maintenance dan environtment (IPAL).
a. Maintenance
Tugas dan tanggung jawab bagian maintenance yaitu memastikan penanganan, perawatan dan perbaikan mesin-mesin yang digunakan pada proses produksi (mesin compounding, mesin filling dan mesin kemas).
b. Utility
Tugas dan tanggung jawab utility yaitu memastikan penanganan, perawatan dan perbaikan sistem sistem penunjang produksi berjalan lancar dan efektif. Sistem penunjang produksi yang menjadi bagian dari tanggung jawab utility
adalah:
Pengolahan air (RO dan Demineralisasi)
Boiler Compressor Genset
Chiller
HVAC (Heating Ventilating and Air Conditioner)
c. Sparepart
Tugas dan tanggung jawab sparepart, yaitu menjamin ketersediaan sparepart ke bagian maintenance, utility, workshop dan produksi pada saat yang dibutuhkan sehingga seluruh mesin dapat berjalan sesuai dengan rencana.
d. Workshop
Tugas dan tanggung jawab workshop, yaitu membuat dan mendesain part mesin sehingga umur pakai menjadi optimal dan membantu dalam memperbaiki semua alat-alat yang rusak.
e. Building maintenance
Bagian building memiliki tanggung jawab dalam pengelolaan bangunan baik manufacturing maupun office sehingga tetap dalam kondisi yang optimal sesuai dengan standar manajemen mutu yang telah ditetapkan.
f. Environment / Instalasi Pengolahan Air limbah (IPAL)
Instalasi Pengolahan Air Limbah (IPAL) memiliki tanggung jawab dalam menangani limbah yang dihasilkan oleh pabrik. Limbah yang dihasilkan terdiri dari limbah padat dan limbah cair. Limbah padat non B3 yang masih memiliki