HASIL DAN PEMBAHASAN
Hasil dari perancangan teknologi proses produksi probiotik penghasil omega-6 dan penurun kolesterol dikembangkan dengan melakukan modifikasi perancangan proses Seider
et al., (1999) dan skema perancangan proses oleh Douglas (1988) dengan hasil seperti yang
disajikan dalam Gambar 6 di bawah ini.
ANAL ISIS PELUA NG DAN PERMASA L AHAN Analisis Peluang
(Aspek Kebijakan Pemerintah dan Potensi Pasar)
Analisis Permasalahan
Pemanfaatan isolat lokal.
Karakterisasi dan identifikasi isolat potensial.
Aspek penggunaan bahan baku standar dan bahan baku subsitusi. Pemilihan jalur proses produksi.
R ANC AN GAN PR OSES KREASI PROSES
Penyiapan Bahan Baku
Glukosa (Perbanyakan Sel) Starter
Fermentasi Batch pada Substrat Glukosa Skala Laboratorium
20 g/l 30 g/l 40 g/l
Konsentrasi Glukosa
Konsentrasi Substrat Glukosa Terpilih ( 20 g/l)
Apakah ada keuntungan kasar?
Tidak Tolak
Ya
Tidak PENGE M BA NG AN PR OS ES
Pembuatan Diagram Alir (Fermentasi & Formulasi Produk)
Integrasi Proses
(Process Engineering Flow Diagram)
Pengujian Fermentasi Batch Skala Pilot Plant
Substrat Glukosa 20 g/l Substrat Komplek
Karakterisasi Produk (Uji In Vivo)
Kreasi Formulasi Produk
Konsentrasi Sel Konsentrasi Sel + Kaldu
Apakah Proses Menjanjikan
Tidak Tolak Lanjutan Ya KELAYAKAN PER ANC ANGAN PROSES
Perhitungan Neraca Massa
Disain Peralatan
Terpenuhi
Penentuan Kapasitas Produksi
Perhitungan :
• Biaya investasi • Biaya modal kerja • IRR, NPV, Net B/C, PBP • Cash flow
Kelayakan Finansial Proses
Ya Rancangan Lanjutan Gambar 6. Perancangan proses produksi probiotik penghasil
4.1. Analisis Peluang
Kebijakan pemerintah dalam rangka pembangunan dan perbaikan gizi masyarakat disusun dengan mengacu pada Undang-Undang No. 17 tahun 2007 tentang Rencana Pembangunan Jangka Panjang Nasional tahun 2005-2025. Program pemerintah yang tertuang dalam dokumen perencanaan BAPPENAS menegaskan bahwa “Pembangunan dan perbaikan gizi dilaksanakan secara lintas sektor meliputi produksi, pengolahan, distribusi, hingga konsumsi pangan dengan kandungan gizi yang cukup, seimbang, serta terjamin keamanannya”. Ketahananan pangan merupakan salah satu prioritas dalam Rencana Pembangunan Nasional Jangka Menengah Tahun 2010-2014 yang ditetapkan melalui Peraturan Presiden Republik Indonesia No. 5 Tahun 2010. Instruksi Presiden No. 3 Tahun 2010 menginstruksikan perlunya disusun rencana aksi pangan dan gizi nasional dan rencana aksi pangan dan gizi di tingkat provinsi yang dalam proses penyusunannya melibatkan kabupaten dan kota (Anonim, 2011). Rencana aksi pangan dan gizi disusun dalam program berorientasi aksi yang terstruktur dan terintegratif dalam lima pilar rencana aksi yaitu perbaikan gizi masyarakat, peningkatan aksesibilitas pangan, peningkatan pengawasan mutu dan keamanan pangan, peningkatan perilaku hidup bersih dan sehat, serta penguatan kelembagaan pangan dan gizi. Kebijakan pemerintah yang memprioritaskan program peningkatan gizi masyarakat telah memberikan peluang pengembangan industri probiotik penghasil omega-6 dan penurun kolesterol karena produk yang dikembangan memiliki kandungan nutrisi yang cukup dan makanan yang mampu memberikan efek kesehatan. Hal ini selaras dengan program pemerintah tentang formulasi peningkatan kandungan nutrisi pada produk pangan (scaling-up nutrition-SUN). SUN Movement merupakan upaya global dari berbagai negara dalam rangka memperkuat komitmen dan rencana aksi percepatan perbaikan gizi masyarakat. Efek kesehatan dari probiotik penghasil omega-6 dan penurun kolesterol dapat memberikan kontribusi terhadap penurunan penyebab kematian akibat penyakit tidak menular seperti hipertensi yang mencapai 31,9 % dan prevalensi akibat jantung koroner 7,2 %. Kedua penyakit tersebut dapat dipicu dari pola konsumsi pangan yang banyak mengandung kolesterol (Anonim, 2007).
Pergeseran pola hidup sehat masyarakat dan meningkatnya kesadaran gizi masyarakat juga dapat mendorong laju konsumsi hasil pengolahan susu per tahun sebesar 6,1%. Laju konsumsi ternyata jauh lebih besar dari laju produksinya yang baru mencapai 3,1%. Untuk meningkatkan produksi pengolahan susu nasional, saat ini telah banyak beredar merek (susu dan yoghurt) yang sudah mulai berbasis kedelai, walaupun
penjualannya masih belum signifikan. Belum ada indikasi jelas apakah pasar akan merespon positif atau tidak. Namun melihat berkembangnya gaya hidup sehat, produk ini bisa memperoleh pangsa pasar untuk kelas menengah ke atas. Biodrinking yoghurt relatif masih kalah populer dengan minuman kesehatan yang lebih dulu muncul, karena dianggap belum perlu untuk kesehatan dan terlalu mahal serta menyusahkan karena harus disimpan di dalam kulkas. Rencana pengembangan teknologi probiotik penghasil omega-6 dan penurun kolesterol berbahan baku dari ekstrak jagung dan ekstrak mengkudu diharapkan mampu memberikan kontribusi pada pemenuhan pangan yang memiliki kandungan nutrisi cukup.
Peluang pasar industri probiotik sangat besar. Data konsumsi probiotik nasional tidak dapat ditemukan secara pasti berapa besar nilai perdagangan dan volume pasar probiotik nasional. Namun jika didasarkan pada beberapa industri yang saat ini telah berjalan konsumsi pangan probiotik cukup besar. Data yang dirilis oleh PT. Yakult Indonesia untuk pabrik di Sukabumi mampu memproduksi 1,8 juta botol Yakult bervolume 65 ml atau setara 117 ton probiotik/ hari. Produksi tersebut belum memasukkan produksi pabrik di lokasi lain dan rencana pengembangannya. Demikian juga untuk pesaing dari
Vitacharm untuk volume packing yang sama kapasitas produksinya sekitar 2 juta botol/hari.
Kapasitas tersebut baru untuk botol berukuran kecil, karena Vitacharm juga memproduksi minuman yang dikemas ukuran curah. Sedangkan untuk industri yoghurt seperti Yummi Indonesia juga memiliki kapasitas produksi yang cukup besar. Dari contoh industri yang sudah berjalan tersebut dapat memberikan gambaran begitu besarnya peluang industri probiotik nasional.
Isolat Lactobacillus sp. yang berasal dari tuak mengkudu memiliki potensi untuk dijadikan agensia probiotik karena kondisi mikrobiologis badeg pace dengan derajat keasaman yang tinggi memungkinkan bakteri hasil isolasi tersebut bersifat probiotik. Tuak mengkudu yaitu sejenis minuman tradisional sari buah mengkudu (Morinda citrifolia) yang difermentasi secara spontan dan memiliki khasiat kesehatan. Tuak mengkudu yang dikenal
badeg pace oleh masyarakat Ponorogo secara tradisional telah menjadi minuman secara
turun temurun yang diyakini dapat memberikan efek kesehatan. Keberhasilan dalam mengembangkan isolat lokal yang berasal dari Ponorogo memiliki peluang yang cukup besar dalam mendorong kemandirian pemenuhan kebutuhan pangan yang berbasis pada potensi wilayah, sehingga dapat mengurangi ketergantungan pemenuhan dari wilayah lain.
4.2. Analisa Permasalahan
Permasalahan dalam perancangan teknologi produksi berhubungan erat dengan kegiatan sintesis yang merupakan kegiatan yang berurutan dan terpadu. Dalam sintesis dilakukan pemilihan proses dengan mengikuti kaidah umum seperti mempertimbangkan biaya rendah, aman, memenuhi persyaratan lingkungan dan mudah mengoperasikannya. Inti dari perancangan proses yang ditulis Mangunwidjaja dan Suryani (1994) adalah menemukan pilihan-pilihan proses yang layak dikembangkan sehingga pemilihan proses merupakan titik awal yang cukup menentukan. Perancangan proses dilakukan karena adanya peluang untuk menghasilkan produk yang menguntungkan dan memuaskan serta adanya permasalahan langsung dari masyarakat (Seider et al. 1999). Permasalahan dirumuskan secara spesifik berdasarkan informasi dari kajian pustaka. Informasi yang dimaksud berkaitan dengan ketersedian bahan baku, skala proses produksi, permintaaan pasar, harga jual produk dan lain-lain. Invensi dalam perancangan proses dimulai dengan membuat pernyataan masalah sederhana kemudian dilanjutkan pembentukan tim perancang, pengumpulan informasi, inovasi proses untuk menyelesaikan masalah spesifik.
Untuk menentukan teknologi proses produksi probiotik penghasil omega-6 dan penurun kolesterol yang terbaik dilakukan penelitian dari skala laboratorium 250 ml dengan peubah konsentrasi glukosa awal fermentasi 20 g/l dan 30 g/l serta 40 g/l. Isolat yang digunakan berasal dari hasil isolasi badeg pace dan buah mengkudu matang. Untuk melihat peluang dan potensi isolat yang dapat digunakan sebagai agensia probiotik maka terlebih dahulu dilakukan pengujian isolat secara in vitro yang meliputi uji daya antagonistik terhadap bakteri patogen dan uji ketahanan terhadap bile sile serta uji kemampuan tumbuh pada pH rendah yang dilanjutkan dengan mengidentifikasi secara molekuler.
Hasil yang terbaik dan diperkirakan dapat memberikan keuntungan kasar penelitian dilanjutkan pada percobaan skala pilot plant 75 liter dengan menggunakan bahan baku yang sama. Pada tahap pengembangan teknologi proses produksi skala pilot plant 75 liter juga dilakukan dengan mensubsitusi bahan baku standar dengan bahan baku yang berasal dari produk pertanian dengan harapan subsitusi tersebut dapat mengurangi harga bahan baku, sehingga dengan produktivitas yang sama akan meningkatkan keuntungan.
4.2.1. Pemanfatan Isolat Lokal
Potensi sumber daya alam Indonesia yang cukup besar memberikan peluang untuk dilakukan eksplorasi secara maksimal. Dalam upaya pemanfatan sumberdaya hayati lokal maka telah dilakukan isolasi galur Lactobacillus sp. yang bersumber dari badeg pace dan buah mengkudu matang yang diambil dari daerah Ponorogo. Dari hasil isolasi diperoleh enam isolat bakteri. Berdasarkan Bergey’s Manual of Systematic Bacteriology, kelompok bakteri asam laktat yang berbentuk batang yang mempunyai katalase negatif dan hasil pewarnaan gramnya positif merupakan bakteri asam laktat genus Lactobacillus sp. Dari keenam isolat yang merupakan bakteri gram positif, katalase negatif dan berbentuk batang sebanyak lima isolat. Hasil isolasi menunjukkan bahwa Lactobacillus sp. terdapat pada buah mengkudu matang dan tuak mengkudu. Pada Tabel 7 ditunjukkan bahwa dari buah mengkudu matang didapatkan dua isolat Lactobacillus sp. JR17 dan Lactobacillus sp. JR10, dari tuak mengkudu didapatkan tiga buah isolat Lactobacillus sp. JR19, Lactobacillus sp. JR64 dan Lactobacillus sp. JR92 dan satu isolat JR03 bukan Lactobacillus sp. Kelima isolat tersebut kemudian diuji kemampuan antibakterinya dan kemampuan tumbuh pada kondisi pencernaan (pH rendah dan adanya garam empedu).
Tabel 7. Data hasil isolasi dan uji bakteri asam laktat.
No Sumber Jumlah isolat Kode isolat Bentuk isolat Katalase Gram 1 Buah mengkudu matang 2 JR17 JR10 batang batang negatif negatif positif positif 2 Tuak mengkudu 4 JR64 JR19 JR92 JR03 batang batang batang bulat negatif negatif negatif positif positif positif positif negatif 4.2.2. Karakterisasi Potensi Isolat Lokal
Uji Aktivitas Antagonistik Bakteri Asam Laktat terhadap Bakteri Patogen
Salah satu kriteria yang diharapkan dari bakteri asam laktat yang digunakan untuk probiotik adalah kemampuannya untuk menghambat bakteri patogen sehingga mampu berkompetisi untuk menjaga keseimbangan mikroflora normal dalam saluran pencernaan (Fuller 1986). Dalam penelitian ini digunakan dua bakteri patogen yaitu Escherichia coli ATCC 25922 yang merupakan bakteri gram negatif, sedangkan Staphylococcus aureus
ATCC 25923 bakteri gram positif yang tidak membentuk spora. Hasil pengujian aktivitas antagonistik bakteri asam laktat terhadap bakteri patogen ternyata isolat yang berasal dari
badeg pace memiliki daya hambat yang tinggi dibandingkan dengan isolate dari buah
mengkudu matang. Dalam penelitian ini tidak dilakukan identifikasi jenis senyawa antimikroba yang dihasilkan, akan tetapi dari beberapa penelitian telah membuktikan bahwa bakteri asam laktat dapat menghasilkan beberapa senyawa yang dapat menghambat pertumbuhan mikroba, misalnya, asam laktat, asam asetat, asam-asam organik, hidrogen peroksida, dan senyawa komplek protein spesifik yang disebut bakterosin adalah senyawa-senyawa antimikroba yang dihasilkan oleh bakteri asam laktat.
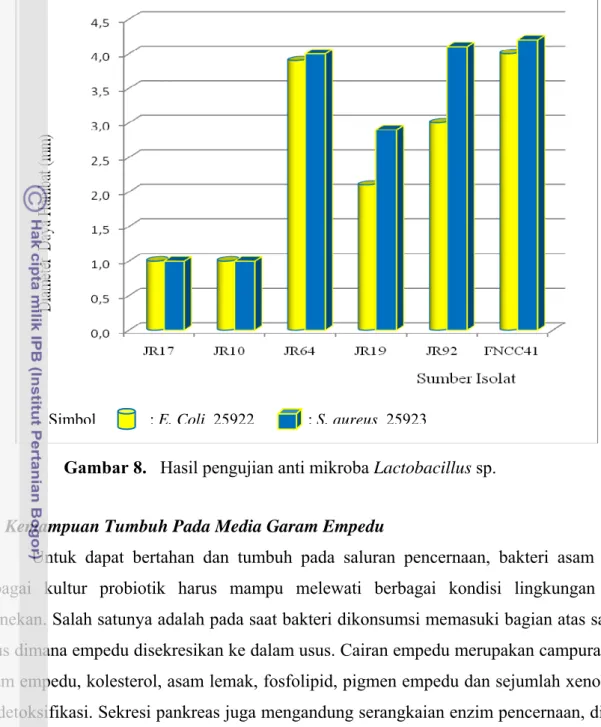
Kelima isolat yang terpilih diseleksi kemampuannya menghambat bakteri patogen. Kemampuan penghambatan isolat Lactobacillus sp. JR64 dapat dilihat dari terbentuknya areal bening (zone penghambatan) di sekitar sumuran yang berisi isolat Lactobacillus sp. seperti pada Gambar 7.
Gambar 7. Hasil Pengujian Anti Mikroba Lactobacillus sp.
Pada Gambar 8. dapat dilihat bahwa Lactobacillus sp. JR17 dan Lactobacillus sp. JR10 memiliki aktifitas antibakteri yang sangat kecil yaitu 1,0 mm. Lactobacillus sp. JR64 memiliki aktivitas antibakteri yang paling besar 3,9 mm terhadap Escherichia coli ATCC 25922 dan 4,0 mm Staphylococcus aureus ATCC 25923, hampir sama dengan bakteri pembanding (kontrol) 4,0 mm terhadap Escherichia coli ATCC 25922 dan 4,2 mm terhadap
Staphylococcus aureus ATCC 25923. Sedangkan kedua isolat yang lainnya Lactobacillus
sp. JR19 dan Lactobacillus sp. JR92 memiliki aktifitas penghambatan 2,1 mm dan 3,0 mm terhadap Escherichia coli ATCC 25922, terhadap Staphylococcus aureus ATCC 25923 seluas 2,9 mm dan 4,1 mm.
Diameter hambat terhadap
Staphylococcus aureus ATCC 25923
Diameter hambat terhadap
Uji Kemampuan Tumbuh Pada Media Garam Empedu
Untuk dapat bertahan dan tumbuh pada saluran pencernaan, bakteri asam laktat sebagai kultur probiotik harus mampu melewati berbagai kondisi lingkungan yang menekan. Salah satunya adalah pada saat bakteri dikonsumsi memasuki bagian atas saluran usus dimana empedu disekresikan ke dalam usus. Cairan empedu merupakan campuran dari asam empedu, kolesterol, asam lemak, fosfolipid, pigmen empedu dan sejumlah xenobiotik terdetoksifikasi. Sekresi pankreas juga mengandung serangkaian enzim pencernaan, dimana enzim yang bersifat lipolitik diaktifkan oleh karakteristik aktif permukaan empedu. Kombinasi tersebut bersifat bakterisidal bagi mikroorganisme komersial dalam tubuh manusia kecuali bagi beberapa genus penghuni usus yang tahan terhadap empedu.
Garam empedu berpengaruh terhadap permeabilitas sel bakteri. Pada sel bakteri asam laktat yang diinkubasi pada larutan penyangga yang mengandung garam empedu masih mengalami pertumbuhan dan tidak mengalami lisis, tetapi mengalami peningkatan kebocoran materi intraseluler yang terabsorbsi pada panjang gelombang 260 nm, yang berarti terjadi perubahan sifat permeabilitas pada membran sel bakteri. Pada bakteri yang tidak tahan terhadap garam empedu diduga bahwa perubahan permeabilitas seluler dan kebocoran materi intraseluler yang dialami lebih besar sehingga menyebabkan lisisnya sel,
Gambar 8. Hasil pengujian anti mikroba Lactobacillus sp.
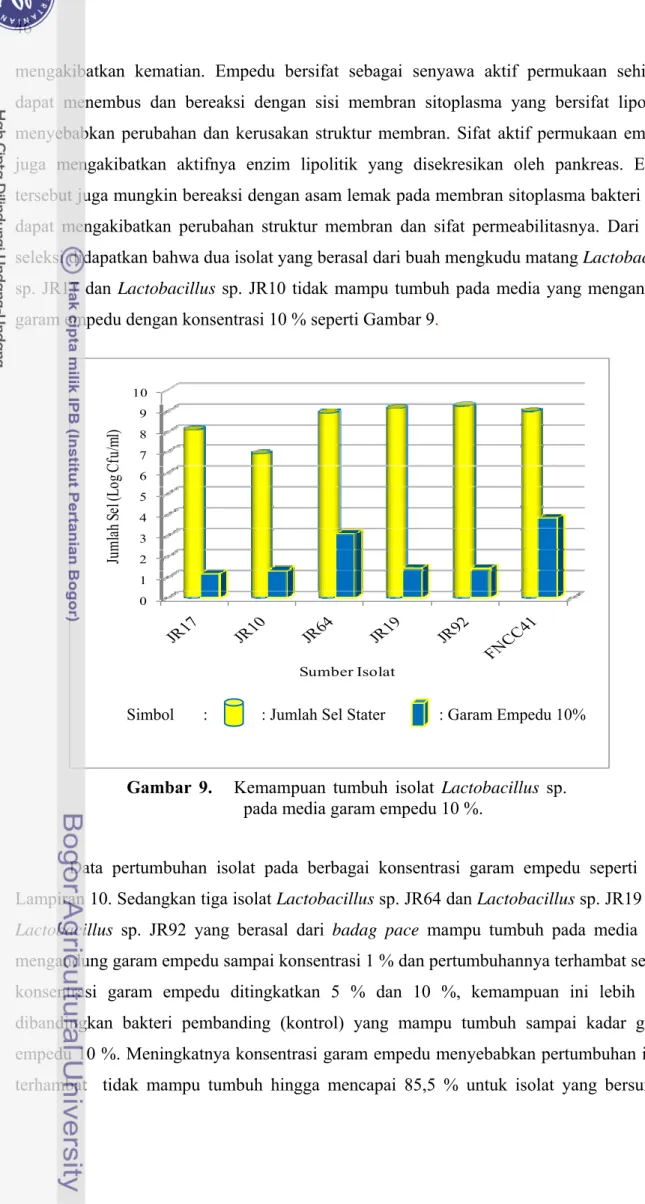
mengakibatkan kematian. Empedu bersifat sebagai senyawa aktif permukaan sehingga dapat menembus dan bereaksi dengan sisi membran sitoplasma yang bersifat lipofilik, menyebabkan perubahan dan kerusakan struktur membran. Sifat aktif permukaan empedu juga mengakibatkan aktifnya enzim lipolitik yang disekresikan oleh pankreas. Enzim tersebut juga mungkin bereaksi dengan asam lemak pada membran sitoplasma bakteri yang dapat mengakibatkan perubahan struktur membran dan sifat permeabilitasnya. Dari hasil seleksi didapatkan bahwa dua isolat yang berasal dari buah mengkudu matang Lactobacillus sp. JR17 dan Lactobacillus sp. JR10 tidak mampu tumbuh pada media yang mengandung garam empedu dengan konsentrasi 10 % seperti Gambar 9.
Data pertumbuhan isolat pada berbagai konsentrasi garam empedu seperti pada Lampiran 10. Sedangkan tiga isolat Lactobacillus sp. JR64 dan Lactobacillus sp. JR19 serta
Lactobacillus sp. JR92 yang berasal dari badag pace mampu tumbuh pada media yang
mengandung garam empedu sampai konsentrasi 1 % dan pertumbuhannya terhambat setelah konsentrasi garam empedu ditingkatkan 5 % dan 10 %, kemampuan ini lebih kecil dibandingkan bakteri pembanding (kontrol) yang mampu tumbuh sampai kadar garam empedu 10 %. Meningkatnya konsentrasi garam empedu menyebabkan pertumbuhan isolat terhambat tidak mampu tumbuh hingga mencapai 85,5 % untuk isolat yang bersumber
Gambar 9. Kemampuan tumbuh isolat Lactobacillus sp. pada media garam empedu 10 %.
0 1 2 3 4 5 6 7 8 9 10 Jum la h S el (L og C fu/ m l) Sumber Isolat
Stater
10%
mengkudu matang Lactobacillus sp. JR17. Sedangkan untuk isolat Lactobacillus sp. JR64 jumlah isolat yang tidak dapat bertahan relatif lebih kecil sebesar 65,4 % dan mikroba kontrol sebesar 57,4%.
Kemampuan tumbuh pada pH rendah
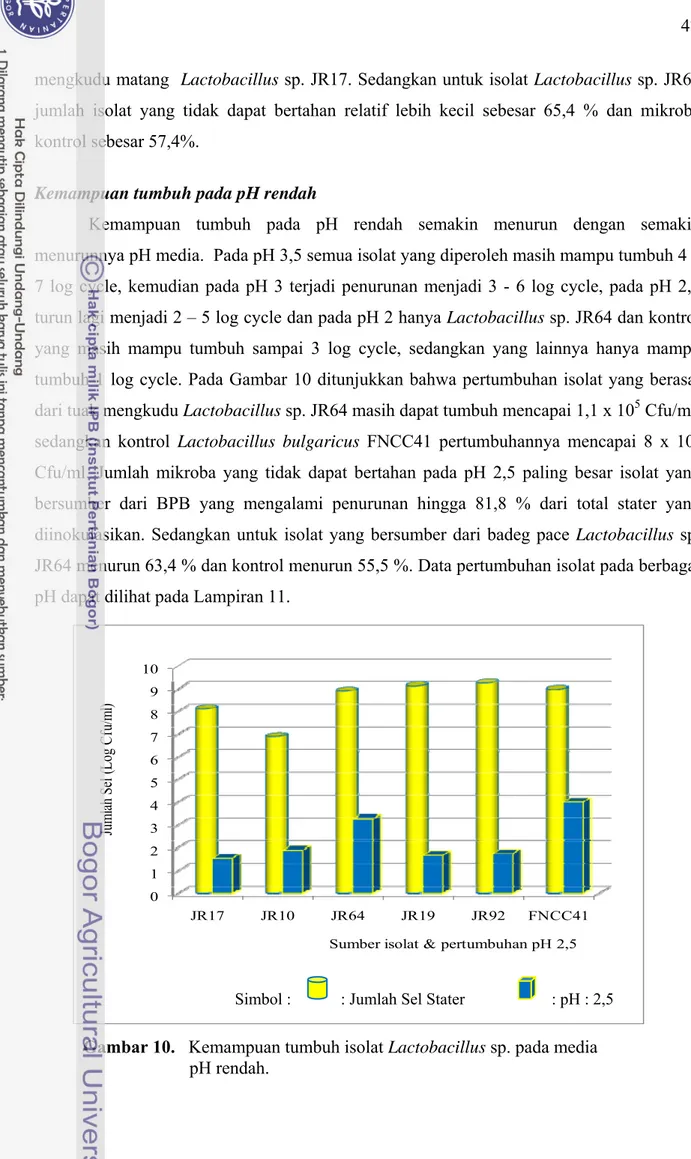
Kemampuan tumbuh pada pH rendah semakin menurun dengan semakin menurunnya pH media. Pada pH 3,5 semua isolat yang diperoleh masih mampu tumbuh 4 – 7 log cycle, kemudian pada pH 3 terjadi penurunan menjadi 3 - 6 log cycle, pada pH 2,5 turun lagi menjadi 2 – 5 log cycle dan pada pH 2 hanya Lactobacillus sp. JR64 dan kontrol yang masih mampu tumbuh sampai 3 log cycle, sedangkan yang lainnya hanya mampu tumbuh 1 log cycle. Pada Gambar 10 ditunjukkan bahwa pertumbuhan isolat yang berasal dari tuak mengkudu Lactobacillus sp. JR64 masih dapat tumbuh mencapai 1,1 x 105 Cfu/ml, sedangkan kontrol Lactobacillus bulgaricus FNCC41 pertumbuhannya mencapai 8 x 105 Cfu/ml. Jumlah mikroba yang tidak dapat bertahan pada pH 2,5 paling besar isolat yang bersumber dari BPB yang mengalami penurunan hingga 81,8 % dari total stater yang diinokulasikan. Sedangkan untuk isolat yang bersumber dari badeg pace Lactobacillus sp. JR64 menurun 63,4 % dan kontrol menurun 55,5 %. Data pertumbuhan isolat pada berbagai pH dapat dilihat pada Lampiran 11.
0 1 2 3 4 5 6 7 8 9 10 JR17 JR10 JR64 JR19 JR92 FNCC41 Jum lah Sel (L og C fu/ m l)
Sumber isolat & pertumbuhan pH 2,5
Starter pH 2,0
Simbol : : Jumlah Sel Stater : pH : 2,5
Gambar 10. Kemampuan tumbuh isolat Lactobacillus sp. pada media pH rendah.
Kebanyakan bakteri asam laktat tidak hanya mengalami pertumbuhan pada kondisi pH rendah, tetapi mungkin juga mengalami kerusakan asam dan hilangnya viabilitas sel. Pengaturan pH rendah dengan menggunakan HCl dalam media pertumbuhan, untuk mendekati kondisi lambung yang juga mengandung HCl. HCl adalah asam kuat yang mudah terdisosiasi menghasilkan proton menyebabkan penurunan pH medium di luar sel atau pH ekstraseluler. Paparan pada kondisi yang sangat asam dapat mengakibatkan kerusakan membran dan lepasnya komponen intraseluler yang dapat menyebabkan kematian. Bakteri asam laktat pada umumnya memiliki ketahanan yang lebih baik terhadap kerusakan membran akibat terjadinya penurunan pH ekstraseluler dibandingkan dengan bakteri yang tidak tahan terhadap asam. Perbedaan kerentanan terhadap kerusakan membran akibat turunnya pH telah diteliti oleh Bender et al., (1986), dimana kerusakan membran diukur berdasarkan pada keluarnya ion Mg dari sel. Pada galur yang kurang tahan terhadap asam, ion Mg akan keluar dari dalam sel ketika pH mencapai 4, sedangkan pada
Lactobacillus casei mulai terjadi kerusakan membran pada pH eksternal kurang dari 3. Ada
beberapa kemungkinan mekanisme bagaimana bakteri mengatur pH internalnya tetapi mekanisme yang paling penting adalah translokasi protron oleh enzim ATP-ase (Hutkins dan Nannen 1993). Enzim yang terikat pada membran tersebut melakukan reaksi reversible bertindak sebagai pompa yang memindahkan ion. Enzim tersebut mengkatalisa gerakan proton melewati membran sel sebagai akibat dari hidrolisis atau sintesa ATP. Pada bakteri yang tahan asam, pH optimal enzim tersebut lebih rendah dibandingkan dengan yang kurang tahan terhadap asam. Parameter lain yang terlibat dalam pengaturan pH internal adalah permeabilitas membran plasma terhadap proton.
4.2.3. Identifikasi Lactobacillus sp. dengan Molekuler
Identifikasi molekuler Lactobacillus sp. dipilih dari hasil karakterisasi potensi isolat lokal terbaik yaitu Lactobacillus sp. JR64 dari badeg pace. Bakteri Lactobacillus sp. JR64 dilakukan identifikasi dengan menggunakan PCR yang diperkirakan akan berada pada daerah 16S rRNA.
Isolasi Genom DNA
Proses ekstrasi genom DNA dari isolat bakteri genus Lactobacillus sp. JR64 dilakukan secara enzimatis dengan menggunakan Instagene matrix, yaitu suatu kit yang dapat digunakan untuk ekstraksi genom DNA. Kit ini mengandung komponen yang
dibutuhkan dalam proses ekstraksi genom seperti lisozim, RNAse, dan EDTA. RNAse berfungsi untuk menguraikan RNA, karena keberadaan RNA dapat mengkontaminasi isolat DNA. Keberadaan protein dalam isolat DNA juga dapat mengganggu proses amplifikasi PCR, terutama jika protein tersebut adalah suatu DNAse yang dapat menguraikan DNA. Dari proses isolasi ini diperoleh DNA sebesar 1.360 ng dengan kemurnian (260/280) 2,5. Hasil isolasi ini mencukupi sebagai DNA templat, karena untuk proses amplifikasi PCR hanya diperlukan DNA sebesar 50-200 ng/µl.
Amplifikasi PCR pada daerah 16S rRNA
Amplifikasi gen 16S rRNA menggunakan primer 8F dan 1492R. Visualisasi hasil amplifikasi dilakukan dengan elektroforesis gel agarosa dengan konsentrasi 1%.
Gambar 11. Hasil amplifikasi Gen 16S rRNA
Hasil visualisasi seperti pada Gambar 11 menunjukkan panjang fragmen amplikon yang
diperoleh dari hasil PCR 16S rRNA diperkirakan sekitar 1.500 pb berdasarkan ukuran pita
pada GeneRuler™ 1Kb DNA Ladder. Hasil ini menunjukkan bahwa panjang amplikon gen
l6S rRNA mendekati dengan prediksi : 1484 pb jika menggunakan primer 8F dan 1492R.
1500bp
1 2
Gen16S rRNA
Keterangan :
1. GeneRuler™ 1Kb DNA Ladder 2. Amplikon gen 16S rRNA Isolat
Lactobacillus sp. JR64
1.500 pb
Skala GeneRuler™ 1Kb DNA Ladder
Penentuan Urutan Basa DNA (Sekuensing) daerah 16S rRNA
Penentuan urutan basa (sekuensing) hasil PCR dilakukan dengan menggunakan primer 765R dan 1141R. Hasil pembacaan urutan basa fragmen DNA sampel Lactobacillus sp. JR64 menggunakan ABI 3130 Genetic Analyzer diperoleh sebanyak 945 bp, dapat dilihat pada Lampiran 12. Data hasil amplikon selanjutnya dibandingkan tingkat homologinya dengan data hasil sekuensing gen bakteri yang terdapat pada data Genebank, menggunakan program BLAST-N. Hasil BLAST urutan nukleotida tersebut terhadap data
base 16S rDNA yang terdapat dalam situs www.ncbi.com dapat dilihat pada Lampiran 13.
Berdasarkan analisis penjajaran dengan program Clustal X, maka diperoleh pohon kekerabatan filogenetik seperti Gambar 12. Analisis menunjukkan bahwa isolat
Lactobacillus sp. JR64 mempunyai kemiripan yang paling tinggi dengan Lactobacillus plantarum strain UK-3 dengan nilai kesamaan pasangan basa (max score) 854, nilai total
pasangan basa (total score) 854, presentase analisis keseluruhan (query coverage) 100%, persentase kesalahan dalam proses (E value) 0,0 dan presentase keakuratan identifikasi (max identify) 99 %. Dari hasil pembacaan pohon filogenetik diperoleh hasil bahwa isolat yang berasal dari badeg pace merupakan jenis bakteri Lactobacillus plantarum JR64.
Berdasarkan data pohon filogenetik isolat Lactobacillus sp. JR64 memiliki kesamaan dengan isolat Lactobacillus plantarum UK-3 yang ditemukan oleh Oh,K.H. and Um,S.J., 2011, Lactobacillus plantarum strain UK-3 16S ribosomal RNA gene, www.ncbi..nlm.nih.gov/nucleotide. Data secara detail Lactobacillus plantarum UK-3 ditunjukkan pada Lampiran 14.
4.2.4. Pemilihan bahan baku
Bahan baku yang digunakan untuk produksi probiotik penghasil omega-6 dan penurun kolesterol digunakan bahan baku ekstrak jagung dan ekstrak mengkudu. Harga bahan baku untuk media fermentasi dari ekstrak jagung dan ekstrak mengkudu merupakan produk pertanian yang memiliki harga lebih murah dibandingkan dengan harga bahan baku substrat yang berasal dari medium glukosa sehingga bahan baku dari produk pertanian direkomendasikan untuk digunakan sebagai bahan baku fermentasi produksi probiotik penghasil omega-6 dan penurun kolesterol. Selisih harga bahan baku tersebut dapat memberikan keuntungan yang lebih besar.
Komposisi medium fermentasi yang digunakan dapat berupa medium sederhana atau medium komplek karena keduanya dapat diperoleh secara sintetis. Medium sintetis sangat menguntungkan dimana untuk setiap komponen dapat dikurangi dihilangkan atau ditambahkan dan pada umumnya tidak membentuk busa karena tidak mengandung protein dan peptida. Pada fermentasi skala industri sumber-sumber nutrien harus mampu membentuk produk atau biomassa dengan hasil maksimum untuk setiap gram substrat yang digunakan. Manipulasi metabolik juga diharapkan dapat memacu pembentukan produk fermentasi dengan laju yang maksimum dan dapat menghambat pembentukan produk yang tidak diinginkan. Aspek lain adalah medium fermentasi harus memiliki mutu yang konsisten, murah dan cukup tersedia sepanjang tahun serta tidak menimbulkan masalah aerasi, agitasi dan pemurnian hasilnya (Rachman, 1992).
Manipulasi metabolik merupakan salah satu cara dalam teknik fermentasi untuk memperoleh hasil yang optimum. Manipulasi metabolik dapat dilakukan dengan pemberian substrat media yang bervariasi baik jenis maupun konsentrasi. Pada lintasan primer metabolik dapat ditemui beberapa senyawa antara yang membentuk lintasan samping. Dalam hal ini modifikasi metabolisme mikroorganisme dengan menggunakan peubah variasi konsentrasi substrat diharapkan terjadi pembelokan lintasan metabolisme tersebut kearah pembentukan senyawa asam linoleat (omega-6).
4.2.5. Pemilihan jalur proses
Masalah yang dihadapi dalam produksi probiotik dengan isolat lokal Lactobacillus
plantarum JR64 adalah besarnya efisiensi dari setiap tahapan proses karena akan berkorelasi
dengan biaya produksi. Oleh sebab itu pemilihan jalur proses perlu dikaji secara detail sehingga hasil perancangan dapat memberikan keuntungan secara maksimal. Dalam perancangan proses perlu dipertimbangkan efisiensi dan kesesuaian peralatan proses sehingga pabrik memiliki umur yang panjang.
Proses yang efisien sangat dipengaruhi oleh besarnya konversi bahan baku menjadi produk yang diharapkan dengan konsumsi energi. Jika proses yang dipilih sangat efisien maka akan mampu memberikan keuntungan yang besar sehingga pengembalian modal investasi bisa dilakukan lebih cepat. Sedangkan proses yang efektif sangat terkait dengan pemilihan peralatan yang tepat sehingga waktu proses lebih cepat, kondisi proses yang aman dan mudah dalam pengoperasiannya. Faktor lain yang perlu diperhatikan dalam perancangan proses yaitu pemilihan jalur proses dengan tahapan yang singkat dimungkinkan dapat memberikan keuntungan yang lebih besar karena semakin panjang tahapan proses akan menambah biaya pembelian peralatan dan membutuhkan tenaga pengoperasi yang lebih banyak.
Produksi probiotik penghasil omega-6 (ω-6) dan penurun kolesterol dapat dilakukan dengan cara fermentasi menggunakan bahan baku glukosa maupun bahan baku subsitusi dari ekstrak jagung dan ekstrak buah mengkudu. Sistem fermentasi dipilih fermentasi batch karena memiliki kelebihan seperti harga instrumentasi relatif lebih murah dan penggunaannya fleksibel artinya dapat dihentikan secara mudah dan cepat setiap saat serta dapat digunakan secara multifungsi. Pemilihan sistem batch telah mempertimbangkan selama proses fermentasi diharapkan Lactobacillus plantarum JR64 tidak menghasilkan zat toksin karena tidak dapat dikeluarkan yang dapat mengganggu metabolisme sehingga produktivitas akan menurun. Fermentasi batch setelah dilakukan inokulasi tidak dilakukan lagi penambahan media ke dalam fermentor, sehingga semakin lama waktu fermentasi, laju pertumbuhan spesifik (μ) mikroba semakin menurun sampai akhirnya berhenti. Penurunan dan berhentinya pertumbuhan disebabkan nutrien berkurang dan terjadi akumulasi metabolit yang mempengaruhi laju pertumbuhannya, sehingga pada fermentasi curah jumlah sel pada fase stasioner merupakan jumlah sel maksimum dan faktor pembatas utama dari luar terhadap pertumbuhan mikroba adalah konsentrasi nutrien dan konsentrasi metabolit-metabolit dapat menghambat pertumbuhan mikroba.
4.3. Kreasi Teknologi Proses Produksi
Perancangan proses merupakan proses kreatif dan berdisiplin untuk memecahkan masalah yang mencakup pendefinisian dan penyelesaian masalah dengan menggunakan prinsip metode ilmiah dan seni, informasi teknis dan imajinasi menentukan struktur, mesin, proses atau sistem baru yang memenuhi fungsi yang diinginkan dengan nilai ekonomis dan efisiensi tinggi. Kreasi proses dilaksanakan melalui pengumpulan data percobaan laboratorium dan diakhiri dengan analisis keuntungan secara garis besar. Hasil analisa sangat menentukan proses dinilai layak atau tidak. Proses dianggap layak ketika harga produk lebih tinggi dari nilai harga bahan baku dan proses ditolak ketika tidak dapat memberikan keuntungan.
Kreasi proses produksi probiotik dari isolat lokal Lactobacillus plantarum JR64 penghasil omega-6 dan penurun kolesterol dilakukan dengan percobaan fermentasi skala laboratorium 250 ml dengan menggunakan substrat standar glukosa pada konsentrasi substrat glukosa awal 20 g/l dan 30 g/l serta 40 g/l. Hasil percobaan dari ketiga konsentrasi tersebut selanjutnya dipilih yang terbaik ditentukan berdasarkan nilai efisiensi fermentasi yaitu Y p/s dan Y x/s.
4.3.1. Profil Fermentasi Batch Skala Laboratorium.
Hasil fermentasi produksi probiotik dengan menggunakan isolat lokal Lactobacillus
plantarum JR64 skala laboratorium dengan konsentrasi glukosa awal fermentasi 20 g/l
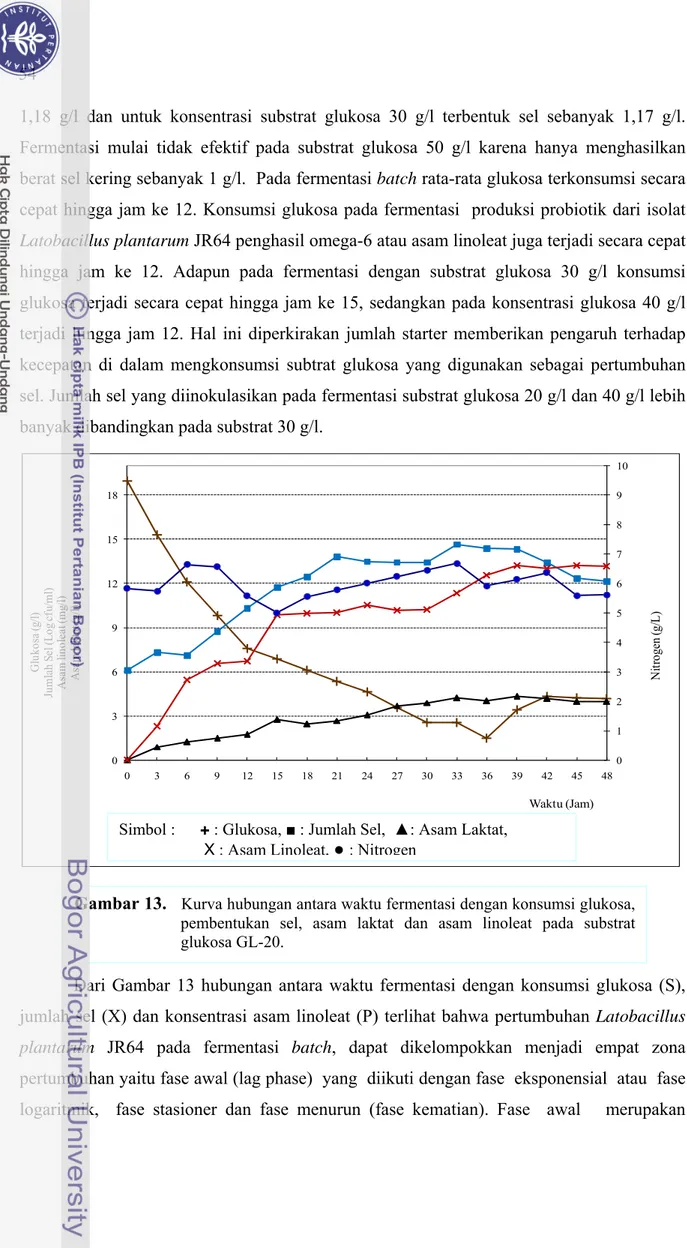
yang diberi notasi (GL-20) dapat dilihat pada Gambar 13. Untuk mengetahui pola interaksi antara penggunaan substrat dengan pertumbuhan Lactobacillus plantarum JR64 dan pembentukan produk maka dilakukan analisa glukosa (RS) dan penimbangan bobot sel (X) serta kadar omega-6 (P). Untuk menentukan bobot sel dapat dihitung dengan menggunakan kurva hubungan berat sel kering dengan jumlah sel (log cfu/ml) pada fermentasi skala laboratorium seperti pada Lampiran 15.
Pada Gambar 13, ditunjukkan bahwa waktu lag terjadi selama 6 jam kemudian mengalami perubahan secara eksponensial hingga jam ke 21 dan sekaligus menjadi permulaan dari fase stasioner. Pertumbuhan tetap ini mulai berakhir saat fermentasi berjalan selama 42 jam dan terus menurun hingga akhir fermentasi. Hasil dari penelitian Hwang et
al. (2011) yang menggunakan glukosa sebagai substrat fermentasi isolat Lactobacillus plantarum LP02 ternyata terjadi peningkatan produksi sel ketika konsentrasi glukosa
1,18 g/l dan untuk konsentrasi substrat glukosa 30 g/l terbentuk sel sebanyak 1,17 g/l. Fermentasi mulai tidak efektif pada substrat glukosa 50 g/l karena hanya menghasilkan berat sel kering sebanyak 1 g/l. Pada fermentasi batch rata-rata glukosa terkonsumsi secara cepat hingga jam ke 12. Konsumsi glukosa pada fermentasi produksi probiotik dari isolat
Latobacillus plantarum JR64 penghasil omega-6 atau asam linoleat juga terjadi secara cepat
hingga jam ke 12. Adapun pada fermentasi dengan substrat glukosa 30 g/l konsumsi glukosa terjadi secara cepat hingga jam ke 15, sedangkan pada konsentrasi glukosa 40 g/l terjadi hingga jam 12. Hal ini diperkirakan jumlah starter memberikan pengaruh terhadap kecepatan di dalam mengkonsumsi subtrat glukosa yang digunakan sebagai pertumbuhan sel. Jumlah sel yang diinokulasikan pada fermentasi substrat glukosa 20 g/l dan 40 g/l lebih banyak dibandingkan pada substrat 30 g/l.
Dari Gambar 13 hubungan antara waktu fermentasi dengan konsumsi glukosa (S), jumlah sel (X) dan konsentrasi asam linoleat (P) terlihat bahwa pertumbuhan Latobacillus
plantarum JR64 pada fermentasi batch, dapat dikelompokkan menjadi empat zona
pertumbuhan yaitu fase awal (lag phase) yang diikuti dengan fase eksponensial atau fase logaritmik, fase stasioner dan fase menurun (fase kematian). Fase awal merupakan
Gambar 13. Kurva hubungan antara waktu fermentasi dengan konsumsi glukosa, pembentukan sel, asam laktat dan asam linoleat pada substrat glukosa GL-20. 0 1 2 3 4 5 6 7 8 9 10 0 3 6 9 12 15 18 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 Ni tr og en (g /L ) G luk os a ( g/ l) Ju ml ah S el (L og cf u/ ml ) A sa m lin ole at (m g/ l) A sa m la kta t ( g/l) Waktu (Jam)
Simbol : + : Glukosa, ■ : Jumlah Sel, ▲: Asam Laktat, X : Asam Linoleat,●: Nitrogen
periode adaptasi mikroorganisme terhadap lingkungannya. Pada fase ini terjadi sintesis enzim oleh mikroorganisme yang diperlukan dalam proses metabolisme dan selama periode ini tidak terjadi perbanyakan sel. Oleh karena itu pada fase lag, jumlah biomassa X= Xo bernilai konstan dan laju pertumbuhan sel pada fase ini (dx/dt) = 0, demikian pula dengan laju pertumbuhan spasifik μ = 0.
Profil fermentasi dengan menggunakan substrat glukosa dengan konsentrasi awal 30 g/l seperti ditunjukkan pada Gambar 14. Profil pembentukan produk asam linoleat (omega-6) dan asam laktat berasosiasi dengan konsumsi substrat. Di dalam penelitian Hwang et al., (2011) dinyatakan bahwa asam laktat terbentuk secara maksimal ketika fermentasi berjalan selama 8 jam dan produksi asam laktat berjalan secara konstan hingga fermentasi jam ke 16. Fermentasi dihentikan pada jam ke 28 karena konsentrasi asam laktat yang terbentuk semakin menurun yang kemungkinan terkonsumsi oleh isolat Lactobacillus
plantarum LP02. Pada fermentasi dengan isolat Lactobacillus plantarum JR64
pembentukan produk terbaik antara jam ke 21 hingga jam ke 24. Pada konsentrasi glukosa 20 g/l pembentukan asam linoleat dianggap lebih efisien pada fermentasi jam ke 21.
Gambar 14. Kurva hubungan antara waktu fermentasi dengan konsumsi glukosa, pembentukan sel, asam laktat dan asam linoleat pada substrat glukosa GL-30. 0 1 2 3 4 5 6 7 8 9 10 0 3 6 9 12 15 18 21 24 27 30 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 N itr og en (g /l) G luk os a ( g/ l) Ju m lah S el (L og cf u/ ml ) A sa m li no le at ( m g/l) A sa m la kta t ( g/l ) Waktu (Jam) Simbol : + : Glukosa, ■ : Jumlah Sel, ▲: Asam Laktat,
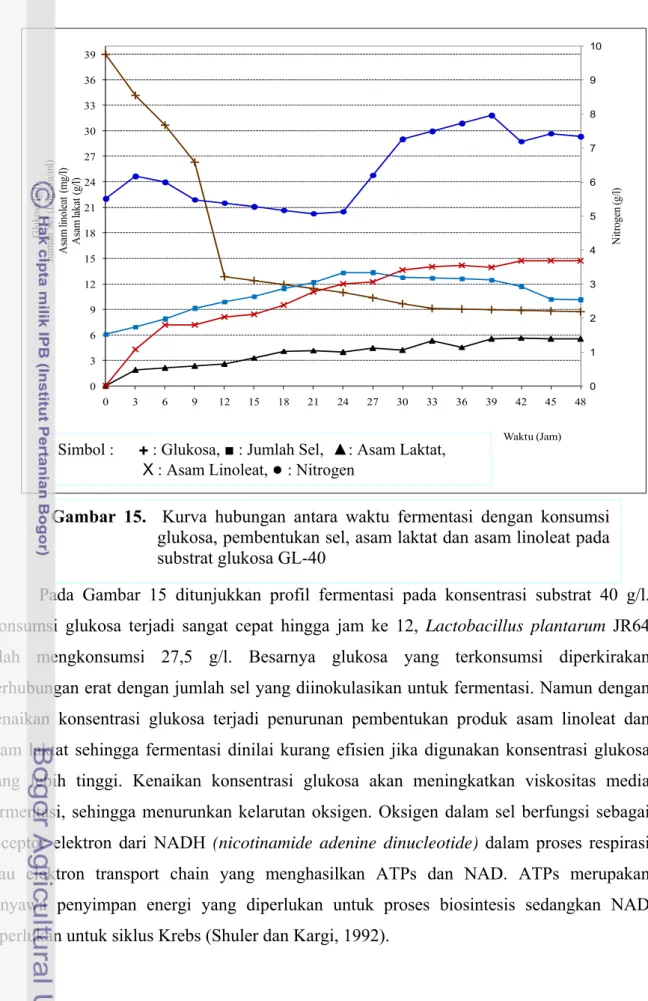
Pada Gambar 15 ditunjukkan profil fermentasi pada konsentrasi substrat 40 g/l. Konsumsi glukosa terjadi sangat cepat hingga jam ke 12, Lactobacillus plantarum JR64 telah mengkonsumsi 27,5 g/l. Besarnya glukosa yang terkonsumsi diperkirakan berhubungan erat dengan jumlah sel yang diinokulasikan untuk fermentasi. Namun dengan kenaikan konsentrasi glukosa terjadi penurunan pembentukan produk asam linoleat dan asam laktat sehingga fermentasi dinilai kurang efisien jika digunakan konsentrasi glukosa yang lebih tinggi. Kenaikan konsentrasi glukosa akan meningkatkan viskositas media fermentasi, sehingga menurunkan kelarutan oksigen. Oksigen dalam sel berfungsi sebagai acceptor elektron dari NADH (nicotinamide adenine dinucleotide) dalam proses respirasi atau elektron transport chain yang menghasilkan ATPs dan NAD. ATPs merupakan senyawa penyimpan energi yang diperlukan untuk proses biosintesis sedangkan NAD diperlukan untuk siklus Krebs (Shuler dan Kargi, 1992).
Gambar 15. Kurva hubungan antara waktu fermentasi dengan konsumsi glukosa, pembentukan sel, asam laktat dan asam linoleat pada substrat glukosa GL-40 0 1 2 3 4 5 6 7 8 9 10 0 3 6 9 12 15 18 21 24 27 30 33 36 39 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 N itr ogen ( g/ l) G lukos a (g /l) Ju m la h Sel ( L og c fu/ m l) A sam li nol ea t (m g/ l) As am la ka t ( g/ l) Waktu (Jam) Simbol : + : Glukosa, ■ : Jumlah Sel, ▲: Asam Laktat,
4.3.2. Laju pertumbuhan Spesifik maksimum (µ) Skala Laboratorium
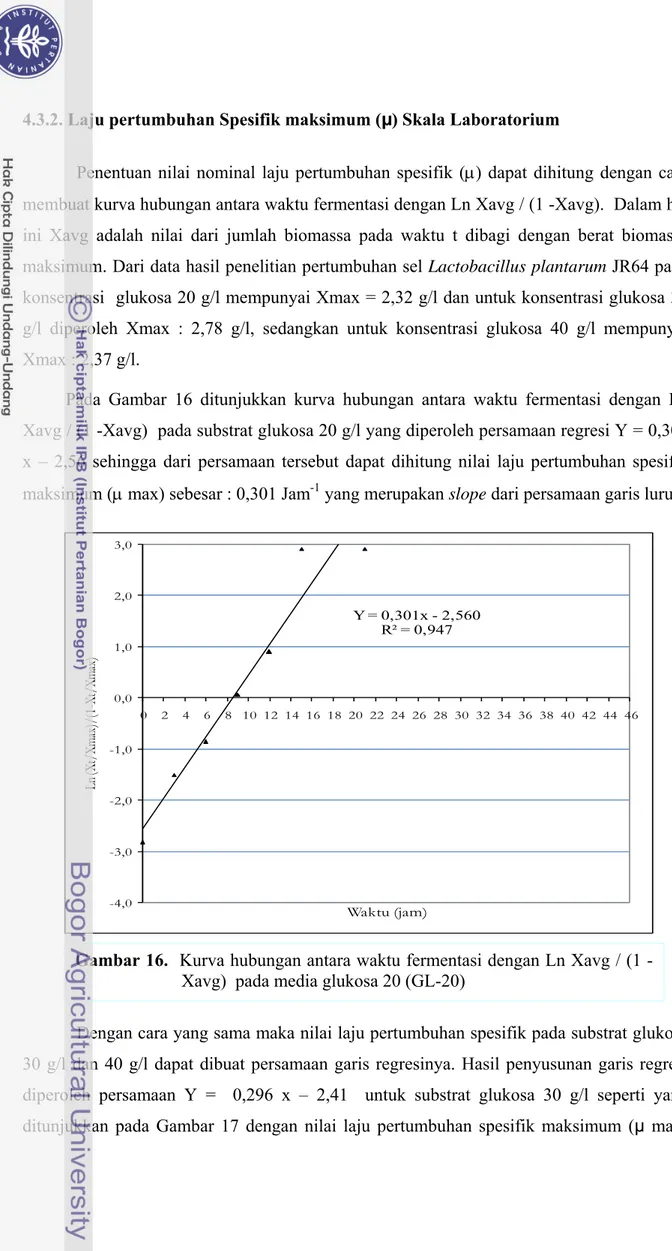
Penentuan nilai nominal laju pertumbuhan spesifik (μ) dapat dihitung dengan cara membuat kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg). Dalam hal ini Xavg adalah nilai dari jumlah biomassa pada waktu t dibagi dengan berat biomassa maksimum. Dari data hasil penelitian pertumbuhan sel Lactobacillus plantarum JR64 pada konsentrasi glukosa 20 g/l mempunyai Xmax = 2,32 g/l dan untuk konsentrasi glukosa 30 g/l diperoleh Xmax : 2,78 g/l, sedangkan untuk konsentrasi glukosa 40 g/l mempunyai Xmax : 2,37 g/l.
Pada Gambar 16 ditunjukkan kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada substrat glukosa 20 g/l yang diperoleh persamaan regresi Y = 0,301 x – 2,56 sehingga dari persamaan tersebut dapat dihitung nilai laju pertumbuhan spesifik maksimum (μ max) sebesar : 0,301 Jam-1 yang merupakan slope dari persamaan garis lurus.
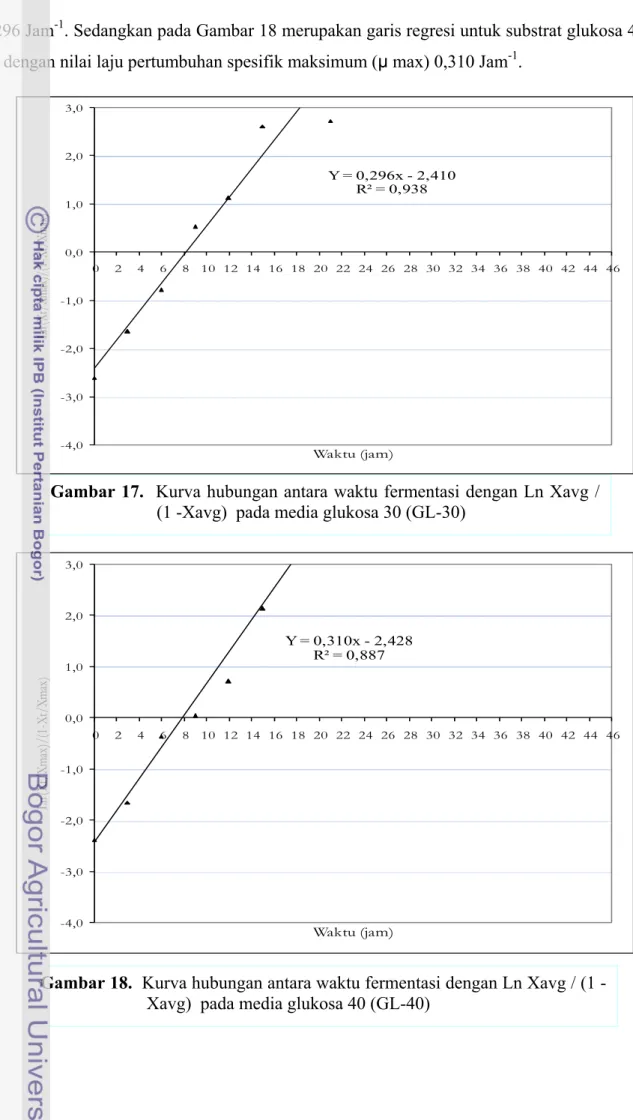
Dengan cara yang sama maka nilai laju pertumbuhan spesifik pada substrat glukosa 30 g/l dan 40 g/l dapat dibuat persamaan garis regresinya. Hasil penyusunan garis regresi diperoleh persamaan Y = 0,296 x – 2,41 untuk substrat glukosa 30 g/l seperti yang ditunjukkan pada Gambar 17 dengan nilai laju pertumbuhan spesifik maksimum (µ max)
Gambar 16. Kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media glukosa 20 (GL-20)
Y = 0,301x - 2,560 R² = 0,947 -4,0 -3,0 -2,0 -1,0 0,0 1,0 2,0 3,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 Ln (X t/ Xm ax )/ (1 -X t/ Xm ax ) Waktu (jam)
0,296 Jam-1. Sedangkan pada Gambar 18 merupakan garis regresi untuk substrat glukosa 40 g/l dengan nilai laju pertumbuhan spesifik maksimum (µ max) 0,310 Jam-1.
Gambar 17. Kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media glukosa 30 (GL-30)
Y = 0,296x - 2,410 R² = 0,938 -4,0 -3,0 -2,0 -1,0 0,0 1,0 2,0 3,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 Ln (X t/ Xm ax)/ (1-Xt/ Xm ax) Waktu (jam) Y = 0,310x - 2,428 R² = 0,887 -4,0 -3,0 -2,0 -1,0 0,0 1,0 2,0 3,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 Ln (X t/ Xm ax )/ (1 -X t/ Xm ax ) Waktu (jam)
Gambar 18. Kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media glukosa 40 (GL-40)
4.3.3. Efisensi Fermentasi (Yp/s dan Yx/s) Skala Laboratorium
Pertumbuhan sel dan pembentukan produk oleh mikroorganisme merupakan proses biokonversi dengan unsur makro dan mikro sebagai sumber nutrien yang digunakan selama kultivasi sehingga akan terjadi biokonversi menjadi biomassa dan metabolit. Setiap tahap biokonversi tersebut dapat dikuantitatifkan dengan suatu koefisien hasil (yield) yang dinyatakan sebagai biomassa yang terbentuk per unit substrat dan produk yang terbentuk per unit substrat yang dinotasikan sebagai Yx/s dan Yp/s. Cara yang biasa digunakan dalam menghitung hasil adalah dengan mengukur biomassa atau produk yang dihasilkan dan substrat yang dikonsumsi selama periode waktu tertentu.
Penentuan nilai Yp/s dapat dihitung dengan metoda linierisasi persamaan dengan cara membuat garis regresi antara jumlah penggunaan substrat (So-S) dengan jumlah produk yang dihasilkan (P-Po) pada tiap satuan waktu. Menurut Wang et al., (1979) nilai rendemen konsumsi substrat untuk pembentukan produk dihitung dengan rumus empiris (Pt–Po)=Yp/s (So–St). Kemiringan garis regresi dari persamaan garis (P–Po)=Yp/s (So–S) merupakan nilai Yp/s.
Pada Gambar 19 ditunjukkan kurva hubungan penggunaan substrat (So-St) dan pembentukan produk (Pt-Po) dengan persamaan regresi Y = 0,688 x + 0,207. Nilai kemiringan garis regresi (slope) dari persamaan tersebut sebesar 0,688 g produk/ g substrat sebagai nilai perbandingan antara produk yang dihasilkan dari tiap satuan substrat atau dikenal harga product yield Yp/s : 0,688 g produk/ g substrat. Hal ini berarti bahwa setiap gram glukosa akan terkonversi menjadi 0,688 g asam linoleat (omega-6). Jadi efisiensi pembentukan produk pada substrat glukosa sebesar 68,8 %.
Hasil penelitian Berry et al., (1999) menggunakan isolat Lactobacillus rhamnosus dengan konsentrasi glukosa 80 g/l diperoleh data pembentukan asam lakat (+) sebesar Yp/s : 0,84 hingga fermentasi jam ke 14. Pada fermentasi dengan substrat glukosa 20 g/l diperoleh yield fermentasi 68,8 % yang dihitung terhadap produksi asam linoleat dan diperkirakan hasil Yp/s yang diperoleh tidak jauh berbeda jika Yp/s dihitung terhadap jumlah asam laktat yang terbentuk.
Dengan cara yang sama maka diperoleh persamaan garis untuk konsentrasi awal glukosa 30 g/l dengan persamaan Y = 0,51 x + 1,567 dan substrat glukosa 40 g/l dengan persamaan regresi Y = 0,345 x + 1,977. Dari masing-masing persamaan tersebut maka diperoleh konversi substrat menjadi asam linoleat sebesar 51 % dan 34, 5 %. Kedua nilai tersebut lebih rendah jika dibandingkan dengan konversi substrat pada media glukosa 20 g/l. Berdasarkan hasil perhitungan ternyata nilai Yp/s secara keseluruhan bahwa meningkatnya kadar gula yang tinggi tidak selalu memberikan nilai Yp/s yang tinggi pula. Hal ini disebabkan penggunaan substrat dengan konsentrasi yang tinggi dapat menyulitkan mikroorganisme untuk mengkonsumsi secara baik sehingga pertumbuhan dapat terhambat. Faktor lain adalah karena mikroorganisme mengalami perubahan permeabilitas sel terhadap substrat dan produk yang mengakibatkan hanya pada konsentrasi tertentu yang dapat dimanfaatkan dengan baik selama fermentasi.
Gambar 19. Kurva hubungan antara jumlah penggunaan substrat (So-S) dan jumlah asam linoleat yang terbentuk (Pt-Po) pada media GL-20 tiap satuan waktu.
y = 0,688x + 0,207 R² = 0,955 0 2 4 6 8 10 12 14 0 5 10 15 20 Pt -Po So - S
Rendemen penggunaan substrat untuk penggandaan biomassa Yx/s merupakan rasio antara perbedaan jumlah biomassa pada saat t dengan jumlah biomassa pada saat t=0 dengan selisih antara jumlah substrat pada awal fermentasi dengan sisa substrat pada waktu t. Nilai Yx/s dapat ditentukan dengan cara menghubungkan antara selisih penggunaan substrat (So-S) dan jumlah biomassa yang terbentuk (X-Xo). Kemiringan garis regresi (slope) persamaan garis (X–Xo) = Yx/s (So–S) merupakan nilai Yx/s. Pada Gambar 20 ditunjukkan kurva hubungan antara jumlah penggunaan substrat (So-S) dan jumlah sel yang terbentuk (Xt-Xo) pada substrat GL-20 tiap satuan waktu yaitu Y = 0,142 x – 0,088.
Dengan cara yang sama maka diperoleh persamaan regresi pada konsentrasi glukosa 30 g/ l dan 40 g/l yaitu masing-masing Y = 0,123 x – 0,163 dan Y = 0,07 x + 0,019. Data kemiringan regresi dari ketiga persamaan tersebut diperoleh nilai masing-masing 14,2 % untuk substrat 20 g/l dan 12,3% untuk substrat 30 g/l serta substrat 40 g/l sebesar 7 %. Jika dibandingkan dari masing-masing nilai maka produktivitas sel paling tinggi terjadi pada fermentasi dengan menggunakan glukosa 20 g/l.
Gambar 20. Kurva hubungan antara jumlah penggunaan substrat (So-S) dan jumlah sel yang terbentuk (Xt-Xo) pada media GL-20 tiap satuan waktu. y = 0,142x - 0,088 R² = 0,896 -1 0 1 2 3 4 5 0 5 10 15 20 Xt -Xo So - S
4.4. Pengembangan proses produksi probiotik skala pilot plant
Alternatif 1. Jalur proses diagram alir dan integrasi proses dengan bahan baku glukosa
Input Tahapan Kondisi Output
Pasteurisasi 80 0C, 5 Menit
Inkubasi 37 0C, 18 -24 Jam
Mendapatkan Jumlah Sel Yang
Banyak Glukosa : 20% Media Unsur Mikro Inkubasi 37 0C, 24 Jam Starter (Vegetatif 2,5 l) 50 ml Susu Segar + 1,5 g Laktosa monohidrat Bioreaktor 75 liter (Volume Kerja 50 liter Probiotik) Sterilisasi 121 0C, 15 Menit Inkubasi 37 0C, 48 Jam Formulasi 50 g Butter + 20 g Gula Halus + 15 g Probiotik. Packing Produk Inokulasi 5 v/v dari Volume Kerja Produktivitas Sel dan Omega-6 Tinggi Produk Probiotik & Omega-6 Inokulasi 3 v/v dari Volume Kerja MRS Agar • 2,61 g MRSA + 50 g Air. • Media 6 ml/ Slant Sterilisasi 121 0C, 15 Menit Inkubasi / Kulkas 37 0C, 48 Jam
Koloni Terbaik & Tunggal MRS Broth (Pre Vegetatif lt) Sterilisasi 121 0C, 15 Menit • 2,61 g MRS Broth + 50 g Air. • Media 6 ml/ Slant Mendapatkan Isolat Segar Mendapatkan Isolat Koloni Terbaik & Tunggal
Gambar 21. Alternatif perancangan teknologi proses produksi dengan bahan baku glukosa
Alternatif 2. Jalur proses perancangan teknologi proses produksi dengan bahan baku ekstrak jagung dan ekstrak mengkudu
Input Tahapan Kondisi Output
Pasteurisasi 80 0C, 5 Menit
Inkubasi 37 0C, 18 -24 Jam
Mendapatkan Jumlah Sel Yang
Banyak • Yield Susu Jagung : 35% • Yield Ekstrak Mengkudu : 55 % 640 ml Susu Jagung + 160 ml Ekstrak Mengkudu + 200 ml Susu Segar Inkubasi 37 0C, 24 Jam Starter (Vegetatif 2,5 l) 50 ml Susu Segar + 1,5 g Laktosa monohidrat Bioreaktor 75 liter (Volume Kerja 50 liter Probiotik) Sterilisasi 121 0C, 15 Menit Inkubasi 37 0C, 48 Jam Formulasi 50 g Butter + 20 g Gula Halus + 15 g Probiotik. Packing Produk Inokulasi 5 v/v dari Volume Kerja Produktivitas Sel dan Omega-6 Tinggi Produk Probiotik & Omega-6 Inokulasi 3 v/v dari Volume Kerja MRS Agar • 2,61 g MRSA + 50 g Air. • Media 6 ml/ Slant Sterilisasi 121 0C, 15 Menit Inkubasi / Kulkas 37 0C, 48 Jam Koloni Terbaik &
Tunggal MRS Broth (Pre Vegetatif lt) Sterilisasi 121 0C, 15 Menit • 2,61 g MRS Broth + 50 g Air. • Media 6 ml/ Slant Mendapatkan Isolat Segar Mendapatkan Isolat Koloni Terbaik & Tunggal
Gambar 22. Alternatif perancangan teknologi proses produksi dengan bahan baku ekstrak jagung dan ekstrak mengkudu
Pemilihan jalur proses ini bertujuan untuk merancang proses produksi probiotik dari isolat lokal Lactobacillus plantarum JR64 dengan menggunakan bahan baku fermentasi dari glukosa atau bahan baku alternatif dari campuran pati atau ekstrak jagung dengan ekstrak mengkudu. Hasil terbaik dari kreasi percobaan skala laboratorium dengan membandingkan nilai Yp/s dan Yx/s, maka diperoleh hasil terbaik pada fermentasi substrat glukosa 20 g/l. Data terbaik skala laboratorium selanjutnya akan digunakan sebagai dasar untuk pengujian skala pilot plant. Hasil pengujian skala pilot plant dengan substrat glukosa dan campuran ekstrak jagung dan ekstrak mengkudu kemudian dipilih sebagai dasar perancangan dan perhitungan finansial untuk mengevaluasi kelayakan secara ekonomi ditinjau dari aspek biaya bahan baku, biaya peralatan, biaya pabrik secara umum serta biaya variable lainnya. 4.4.1. Pengujian Sistem Fermentasi Bacth Pada Skala Pilot Plant.
Profil teknologi proses produksi probiotik dengan menggunakan media glukosa
Hasil pengujian tahapan proses alternatif 1 seperti Gambar 21 pada skala pilot plant dengan menggunakan substrat glukosa 20 g/l diperoleh profil fermentasi seperti yang ditunjukkan pada Gambar 23. Pada Gambar 23 ditunjukkan bahwa fase eksponensial berlangsung selama 21 jam. Meningkatnya produksi metabolit primer diikuti oleh penurunan glukosa yang signifikan. Setelah fermentasi berjalan selama 20 jam sisa glukosa tinggal 4 g/l atau terjadi penurunan kurang lebih 16 g/l. Hal ini tidak memungkinkan untuk terjadinya proses metabolisme sehingga jumlah sel dan pembentukan produk berjalan secara stationer.
Glukosa dalam kondisi aerob akan terkatabolisme mengikuti EMP (Embden-Meyerhof-Parnas) pathway, menjadi pyruvate dan energi dalam bentuk ATP. Pyruvate dalam kondisi aerob akan terkonversi menjadi CO2 dan NADH melalui siklus Krebs/
trycarboxylic acid (TCA). Pyruvate dalam kondisi anaerob dapat terkonversi menjadi asam laktat, etanol, aseton, butanol atau asam asetat. Jumlah oksigen yang terbatas akan menghambat pembentukan ATPs sehingga akan menurunkan proses biosintesis. Penurunan konsentrasi oksigen dalam sel memacu pembentukan asam laktat, sehingga glukosa yang terbentuk tidak digunakan untuk pembentukan biomassa tetapi untuk pembentukan asam laktat. Pada konsentrasi substrat karbon , viskositas media fermentasi sangat tinggi sehingga membatasi ketersediaan oksigen dalam media fermentasi dan dapat menghambat proses metabolisme secara menyeluruh.
Teknologi proses produksi probiotik dengan menggunakan media komplek
Hasil pengujian tahapan proses alternatif 2 seperti Gambar 22 pada skala pilot plant dengan menggunakan media dari ekstrak jagung diperoleh profil fermentasi seperti yang ditunjukkan pada Gambar 24. Penggunaan media dari ekstrak jagung diharapkan dapat menggantikan substrat glukosa dan menghasilkan konsentrasi produk omega-6 yang lebih tinggi. Kandungan omega-6 pada kaldu fermentasi diharapkan mampu meningkatkan efektivitas sebagai penurun kolesterol. Omega 6 merupakan salah satu makanan yang telah terbukti dapat menurunkan kadar kolestrol dalam darah. Pada Gambar 24 ditunjukkan kurva hubungan waktu fermentasi dengan konsumsi substrat sumber karbon dan nitrogen, pembentukan sel dan pembentukan produk. Produktivitas Lactobacillus plantarum JR64 dalam menghasilkan omega-6 selama fermentasi relatif rendah dan cenderung konstan. Hasil tertinggi omega-6 terjadi pada jam ke-18 dengan konsentrasi 1,03 g/l. Kandungan asam lemak di dalam ekstrak jagung sebesar 4 % ternyata tidak dapat berfungsi sebagai substrat induser yang dapat meningkatkan pembentukan omega-6.
Gambar 23. Kurva hubungan antara waktu fermentasi dengan konsumsi glukosa, jumlah sel, asam laktat dan asam linoleat pada media glukosa 20 g/l pada skala 75 L.
0 1 2 3 4 5 6 7 8 9 10 0 3 6 9 12 15 18 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 Ni tro ge n ( g/ L) G luk os a (g /l) As am L ak at (g /l) B er at S el ( g/ l), A sam L in ol eat (m g/ l) Waktu (Jam) Simbol : + : Glukosa, ■ : Jumlah Sel, ▲: Asam Laktat,
Kadar nitrogen pada media ekstrak jagung ternyata mengalami perubahan secara fluktuatif. Perubahan peningkatan terjadi dari jam ke-0 sampai jam ke-9 tetapi setelah itu mengalami penurunan sampai jam ke-15 dan meningkat kembali hingga jam ke-33. Hal ini disebabkan pada awal pertumbuhan, bakteri masih memanfaatkan kandungan nutrisi lain yang ada pada media ekstrak jagung, kemudian setelah kandungan nutrisi itu habis, bakteri mulai menggunakan protein untuk pembentukan komponen-komponen selnya sehingga kadar berkurang dan sejalan dengan peningkatan jumlah sel, kadar protein kembali mengalami peningkatan. Buckle et al., (1987) bahwa berdasarkan berat keringnya mikroba mengandung protein yang cukup tinggi yaitu sekitar 49-80% dan menurut Botazzi (1983) bahwa mikroba menyumbangkan 7% dari total protein dalam fermentasi susu.
Gambar 24. Kurva hubungan antara waktu fermentasi dengan konsumsi ekstrak jagung, jumlah sel, asam laktat dan asam linoleat pada media komplek skala 75 L.
0 1 2 3 4 5 6 7 8 9 10 0 3 6 9 12 15 18 21 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 N it rogen ( g/ L ) E ks tr ak J ag ung ( g/ l) Ju ml ah S el ( L o g cf u/ ml ) A sa m la k ta t ( g/l ) A sa m lin o le at ( g/l ) Waktu (Jam) Simbol : + : Glukosa, ■ : Jumlah Sel, ▲: Asam Laktat,
4.4.2. Laju Pertumbuhan Spesifik Maksimum (µ max) Percobaan Skala Pilot Plant
Pertumbuhan sel selalu berhubungan dengan konsumsi substrat. Pertumbuhan sel sangat erat kaitannya dengan waktu yang diperlukan untuk perbanyakan sel dalam jumlah maupun masanya. Hal ini menunjukkan bahwa pertumbuhan mikroorganisme dan aktifitas-ahifitas fisiologis lainnya merupakan kemampuan sel dalam memberikan respon terhadap lingkungannya. Untuk menentukan bobot sel dapat dihitung dengan menggunakan kurva hubungan berat sel kering dengan jumlah sel (log cfu/ml) pada fermentasi skala laboratorium seperti pada Lampiran 15.
Pada Gambar 25 ditunjukkan hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media glukosa-20 skala pilot plant dengan nilai persamaan regresi sebesar 0,148 Jam-1 yang merupakan nilai dari laju pertumbuhan spesifik maksimum (µ max). Sedangkan pada Gambar 26 ditunjukkan persamaan regresi Y = 0,143 x – 2,62 yang diperoleh dari kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media komplek campuran ekstrak jagung dengan ekstrak mengkudu.
Y = 0,148x - 1,588 R² = 0,688 -4,0 -3,0 -2,0 -1,0 0,0 1,0 2,0 3,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 Ln (X t/ Xm ax )/ (1 -X t/ Xm ax ) Waktu (jam)
Gambar 25. Kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media glukosa-20 skala pilot plant
4.4.3. Efisensi Fermentasi (Yp/s dan Yx/s) Skala Pilot Plant
Penentuan nilai Yp/s dapat dihitung dengan metoda linierisasi persamaan dengan cara membuat garis regresi antara jumlah penggunaan substrat (So-S) dengan jumlah produk yang dihasilkan (P-Po) pada tiap satuan waktu. Kemiringan garis regresi dari persamaan garis (P–Po)=Yp/s (So–S) merupakan nilai Yp/s. Demikian juga untuk menghitung Yx/s dapat dilakukan dengan cara membuat persamaan regresi hubungan antara selisih penggunaan substrat (So-S) dan jumlah biomassa yang terbentuk (X-Xo). Kemiringan garis regresi (slope) persamaan garis (X–Xo) = Yx/s (So–S) merupakan nilai Yx/s.
Hasil perhitungan efisiensi fermentasi skala pilot plant seperti yang ditunjukkan pada Tabel 8. Fermentasi dengan menggunakan konsentrasi glukosa awal 20 g/l diperoleh Yp/s : 51,6%, sedangkan pada fermentasi dengan medium komplek diperoleh Yp/s : 22,2 %. Pada fermentasi dengan medium standar diperoleh Yx/s : 40,1 % dan dengan menggunakan medium komplek diperoleh Yx/s : 62,1%.
Y = 0,143x - 2,620 R² = 0,984 -4,0 -3,0 -2,0 -1,0 0,0 1,0 2,0 3,0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 Ln (X t/ Xm ax )/ (1-Xt /X m ax ) Waktu (jam)
Gambar 26. Kurva hubungan antara waktu fermentasi dengan Ln Xavg / (1 -Xavg) pada media komplek skala pilot plant
Tabel 8. Data efisiensi fermentasi media glukosa dan media komplek skala pilot plant
Pada Tabel 8 ditunjukkan bahwa medium kombinasi ekstrak jagung dan ekstrak mengkudu setiap gram substrat akan menghasilkan 0,621 gram sel Lactobacillus palntarum JR64, sedangkan efisiensi pembentukan produk relatif rendah dimana setiap gram substrat akan menghasilkan 0,22 gram asam linoleat (omega-6).
Hasil penelitian Berry et al., (1999) yang menggunakan Lactobcaillus rhamnosus untuk menghasilkan asam laktat diperoleh Y p/s : 0,84 pada medium glukosa, sedangkan pada fermentasi dengan medium komplek diperoleh Yp/s : 0,8. Hal ini berarti bahwa nilai produktivitas pada medium komplek lebih rendah dibandingkan dengan penggunaan medium standar. Hasil penelitian ini tidak jauh berbeda dengan percobaan yang menggunakan isolat Lactobacillus plantarum JR64 untuk menghasilkan omega-6. Produktivitas Lactobacillus plantarum JR64 dalam memproduksi asam laktat tertinggi pada jam ke 24 dengan konsentrasi 14,1 g/l.
Penggunaan media fermentasi diharapkan selama fermentasi tidak terbentuk produk yang tidak diinginkan. Disamping itu harga bahan baku bisa lebih murah dan memiliki kualitas yang berkesinambungan serta tersedia sepanjang tahun. Pertimbangan penggunaan bahan baku jagung juga mudah dalam penanganan selama proses, terutama untuk pengadukan, aerasi, purifikasi dan penanganan limbah.
No Parameter Satuan Substrat
Glukosa 20 g/l Komplek
1 µ max Jam-1 0,149 0,148
2 Xm g/l 0,059 8,88
3 Xo g/l 0,601 0,602
4 Yp/s Efisiensi penggunaan substrat
terhadap pembentukan produk (%) 51,6 22,2
5 Yx/s Efisiensi penggunaan substrat
4.5. Desain dan Formulasi Produk Krem Probiotik
Desain produk yang menjadi target dari formulasi ini dibuat dalam bentuk krem untuk mendapatkan viabilitas sel yang cukup panjang dan dapat diaplikasikan pada berbagai bentuk makanan. Pada Gambar 27 ditunjukkan hasil formulasi dalam bentuk krem.
Gambar 27. Hasil formulasi krem probiotik
Pengujian viabilitas sel dilakukan selama 28 hari pada penyimpanan suhu refrigeran. Jumlah bakteri rata-rata dari kelima formulasi hingga hari ke 14 mengalami peningkatan, namun mulai terjadi penurunan pada hari ke 21 dan cenderung terus menurun pada hari ke 28. Menurut Tamime et al., (1992), daya simpan produk pada suhu refrigeran lebih panjang dari pada daya simpan produk dalam suhu kamar, sebagai akibat rendahnya aktivitas BAL dalam penyimpanan suhu rendah. Pada Gambar 28 ditunjukkan bahwa jumlah sel
Lactobacillus plantarum JR64 dari kelima formulasi, ternyata untuk formula ke 5 memiliki
viabilitas sel yang cukup baik dibandingkan keempat formula lainnya. Formula ke lima (E) yang berisi 50 gram butter dan 20 gram icing sugar serta 15 gram probiotik memiliki kesesuaian sebagai media probiotik untuk tetap bertahan hidup.
Jumlah Lactobacillus plantarum JR64 rata-rata awal formulasi berkisar 107 Cfu/ml dan setelah disimpan selama 28 hari jumlah Lactobacillus plantarum JR64 yang masih memenuhi persyaratan probiotik yaitu formula ke 3, 4 dan 5. Namun yang memiliki jumlah sel tertinggi yaitu formula ke-5 sebanyak log 8,95 Cfu/ml atau setara 8,92 x 108 Cfu/ml.
Hasil formulasi ini juga menunjukkan bahwa desain produk dalam bentuk krem juga lebih baik dan tahan lama dibandingkan dengan formulasi bentuk cair. Bahkan aplikasinya memiliki spektrum yang cukup luas. Helferich dan Westhoof, (1980) telah melakukan penelitian tentang lama penyimpanan terhadap toleransi pH rendah dan akan semakin bertahan dalam penyimpanan kondisi dingin. Pada penyimpanan suhu kamar probiotik tetap memperlihatkan aktivitasnya sehingga terus membutuhkan sumber karbon dan sumber energi untuk berkembang, namun sebaliknya aktivitas itu menurun jika disimpan pada suhu 10-15 ºC. Pada Gambar 29 ditunjukkan perubahan pH selama penyimpanan terlihat cukup stabil untuk semua formulasi, tidak ada perbedaan yang signifikan antara hari ke-0 dengan setelah disimpan selama 28 hari.
Gambar 28. Jumlah L. plantarum JR64 formula krem selama penyimpanan.
0 2 4 6 8 10 12 Kontrol A B C D E 8,48 8,00 10,28 10,30 10,42 10,39 6,67 7,23 7,76 8,76 8,77 8,95 Jum lah Sel L og ( Cf u / m l)
Formulasi Hari Ke 21 & 28
Pada Tabel 9 ditunjukkan memiliki kandungan asam laktat selama penyimpanan selama 28 hari sebesar 0,897 %. Kandungan asam laktat tersebut memenuhi persyaratan sebagai probiotik yaitu minimal kandungan asam laktat 0,85 %.
Tabel 9. Hasil analisa asam laktat, asam linoleat, gula reduksi dan protein.
Waktu Asam Laktat Asam Linoleat Gula Reduksi Protein
(hari) (%) (mg/L) (g/L) (%) 0 0,719 18,54 8,61 1,061 7 0,753 19,75 7,31 1,193 14 0,797 20,97 5,38 1,111 21 0,842 22,19 4,53 1,092 28 0,897 20,22 3,67 1,104
Terjadi penurunan kadar gula reduksi namun tidak terlalu besar, sesuai dengan jumlah pertumbuhan bakteri yang melambat karena proses penyimpanan pada suhu refrigerator sehingga jumlah gula reduksi yang digunakan bakteri untuk proses pertumbuhannya sedikit. Kadar gula reduksi awal dari formulasi hampir sama dengan kadar gula reduksi pada jam ke-33. Gula reduksi lalu digunakan oleh bakteri untuk pertumbuhannya sehingga setelah 28 hari kadar gula reduksi sangat kecil.
0 2 4 6 Kontrol A B C D E 4,28 4,55 4,39 4,34 4,30 4,25 4,25 4,46 4,32 4,27 4,25 4,26 pH F or m ul a K re m
Formulasi Hari Ke 0 & 28 Simbol : : Hari ke 0, : Hari ke 35
Kadar protein pada formulasi ke-5 mengalami perubahan secara fluktuatif karena perubahan suhu penyimpanan mempengaruhi fase pertumbuhan sehingga mempengaruhi kemampuan bakteri untuk memecah protein menjadi komponen-komponen yang lebih sederhana, sedangkan kadar asam linoleat mengalami peningkatan, hal ini terjadi karena kemungkinan butter juga mempunyai kandungan asam linoleat sehingga mempengaruhi jumlah kadar asam linoleat pada sediaan krem.
Produk formulasi dalam bentuk krem dapat diaplikasikan untuk penurunan kolesterol karena selain dari kemampuan Lactobacillus plantarum JR64 yang diduga untuk menurunkan kolesterol, jumlah kadar asam linoleat dari produk krem relatif lebih besar. 4.6. Karakterisasi Produk Dengan Uji In Vivo
4.6.1. Aktivitas Asimilasi Kolesterol
Hasil pengujian asimilasi kolesterol Lactobacillus plantarum JR64 memiliki kemampuan mengasimilasi kolesterol 34,6 μg/ml. Besarnya aktivitas asimilasi kolesterol dihitung berdasarkan selisih antara kolesterol yang terdeteksi pada kontrol dengan jumlah kolesterol yang terdeteksi pada media uji dengan kaldu Lactobacillus plantarum JR64.
Pada asimilasi kolesterol oleh Lactobacillus plantarum JR64, diduga bahwa koleterol yang diambil oleh sel bakteri bergabung dengan membran seluler bakteri tersebut, sebab sel bakteri yang ditumbuhkan dengan adanya misel kolesterol lebih tahan terhadap lisis karena sonikasi.
4.6.2. Uji In- Vivo Media Tikus
4.6.2.1. Perkembangan Hewan Coba dan Konsumsi Pakan
Penelitian ini menggunakan tikus putih galur Wistar jantan dengan bobot badan berkisar 200 gr sampai dengan 250 gr. Sebelum perlakukan tikus putih dipelihara dengan pemberian pakan standar dan minum secara ad libitum selama 7 hari dengan maksud untuk beradaptasi dengan lingkungan seperti yang ditunjukkan pada Gambar 30.
Pada Gambar 31. ditunjukkan bahwa perkembangan bobot badan tikus selama perlakuan ternyata terjadi penurunan. Berdasarkan data perhitungan rata-rata penurunan bobot badan tikus paling tinggi terjadi pada kelompok D yaitu 0,53 gr / hari atau sebesar 52,96 % diikuti kelompok C yang mencapai 0,462 gr / hari setara 46,16 %, sedangkan untuk kontrol positif dan negatif masing-masing mengalami penurunan bobot badan sebesar 0,4 gr / hari atau 39,96 % dan 0,215 gr/ hari (21,48%). Data bobot badan tikus secara lengkap dapat di lihat pada Lampiran 17.
Menurut Murray et al., (2003) pemberian propil tiourasil dapat mempengaruhi korteks adrenal yang dapat mengubah kolesterol menjadi kortisol yang memicu terjadinya penurunan bobot badan. Bobot badan hewan yang normal akan mengalami peningkatan sejalan dengan pertambahan umur, sedangkan diet dengan kadar lemak dan kolesterol tinggi menyebabkan peningkatan bobot badan lebih cepat dibandingkan diet dengan kadar lemak rendah. Namun, dalam penelitian ini ditemukan bahwa bobot badan tikus cenderung menurun yang disebabkan oleh faktor stres yang dipengaruhi oleh hormon kortisol dan adrenalin. Hormon kortisol dapat meningkatkan suplai glukosa untuk pembakaran dan pembentukan energi, sedangkan hormon adrenalin dapat menyebabkan terjadinya pembakaran lemak.
Gambar 30. Berat pakan dan tempat pakan tikus serta cara minum ad libitum Berat Pakan : 20 g/hari 1 Ekor tikus/ Kandang Minum Ad libitum
Penurunan bobot badan tikus juga dipengaruhi oleh jumlah pakan yang dikonsumsi. Pada Gambar 32 ditunjukkan bahwa kelompok kontrol negatif mengkonsumsi pakan rata-rata 91,08 % dari total pakan yang diberikan 20 gr/hari, sedangkan kelompok kontrol positif lebih rendah dalam mengkonsumsi pakan yang hanya 52,76 %. Pada kelompok C dan D selama perlakukan 35 hari masing-masing mengkonsumsi pakan jauh lebih rendah hanya 49,48 % dan 61,70 % dari total pakan yang di berikan sebanyak 700 gr. Kelompok B, C, D, E dan F memperoleh pakan dengan kandungan lemak berkalori tinggi yang dapat menyebabkan interval waktu makan menjadi lebih lama sehingga jumlah pakan yang dikonsumsi menjadi lebih sedikit. Rendahnya jumlah pakan yang dikonsumsi kelompok B dan C ternyata dapat menimbulkan penurunan bobot badan tikus paling besar. Data konsumsi pakan secara rinci dapat dilihat pada Lampiran 18.
Gambar 31. Perubahan bobot badan tikus selama perlakuan.
0 50 100 150 200 250 300 A B C D E F Be ra t Ba da n , gr
Kelompok Perlakuan, Hari Ke 0 & 35
4.6.2.2. Pengaruh kondidat probiotik terhadap perubahan kadar kolesterol total
Kadar kolesterol total selama perlakuan ditunjukkan pada Gambar 33. Hasil uji ANOVA menunjukkan perubahan kadar kolesterol total dipengaruhi oleh perlakuan pakan yang digunakan (F hitung =16,20 > F tabel 0,01=3,51). Hasil uji lanjut menggunakan BNT 0,05 = 13,702 menunjukkan bahwa kadar kolesterol total dari tiap-tiap kelompok pada akhir adaptasi (hari ke- 0) yaitu kelompok A 0,695 mg/ml dan kelompok B 0,768 mg/ml, sedangkan kelompok C : 0,809 mg/ml dan kelompok D : 0,835 mg/ml. Adapun kondisi awal kadar kolesterol total pada kelompok E sebesar 0,839 mg/ml dan kelompok F 0,746 mg/ml. Perubahan kadar kolesterol total pada hari ke 35 untuk kelompok D mengalami penurunan sebesar 0,101 mg/ml dengan perlakuan penambahan kaldu probiotik, sedangkan untuk kontrol negatif mengalami peningkatan 7,33 %. Peningkatan kolesterol total paling tinggi terjadi pada kontrol positif sebesar 27,31 % diikuti kelompok F 23 %. Adapun untuk kelompok C meningkat 4,27 % dan kelompok E 4,12 %. Data pengaruh kondidat probiotik terhadap perubahan kadar kolesterol total secara rinci dapat dilihat pada Lampiran 19.
Gambar 32. Rata-rata jumlah konsumsi pakan selama perlakuan.
0 5 10 15 20 STD A B C D E F K ons um si Pa ka n, g/ ha ri Kelompok Perlakuan
4.6.2.3. Pengaruh kondidat probiotik terhadap perubahan kadar Trigliserida
Pada Gambar 34 ditunjukkan perubahan trigliserida selama perlakuan. Hasil uji ANOVA menunjukkan perubahan kadar kolesterol total dipengaruhi oleh perlakuan pakan yang digunakan (F hitung =18,47 > F tabel 0,01=3,51). Hasil uji lanjut menggunakan BNT 0,05 = 19,234 menunjukkan bahwa kadar trigliserida darah tikus hari ke-0 sebelum perlakuan semua kelompok berkisar antara 0,499 – 0,862 mg/ml dan mengalami penurunan rata-rata perhari 0,06 – 0,49 mg/ml. Perlakuan dengan pemberian pakan yang berbeda, induksi propil tiourasil kemungkinan dapat memperlambat pelepasan asam lemak bebas dari jaringan adiposa dan menurunkan kadar asam lemak bebas plasma dengan menurunkan laju lipolisis pada simpanan trigliserida, (Murray et al., 1996). Data pengaruh kondidat probiotik terhadap perubahan kadar trigliserida secara rinci dapat dilihat pada Lampiran 20.
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 A B C D E F 0,69 0,77 0,81 0,83 0,84 0,75 0,74 0,97 0,79 0,73 0,87 0,92 K ole ste rol T ot al , m g/m l
Kelompok perlakuan, Hari ke 0 & 35
Simbol : : Hari ke 0, : Hari ke 35 Gambar 33. Perubahan kadar kolesterol total darah hari ke 0 dan 35 hari.
4.6.2.4. Pengaruh kondidat probiotik terhadap perubahan kadar HDL kolesterol Pada Gambar 35 ditunjukkan perubahan kadar HDL kolesterol selama perlakuan. Hasil uji ANOVA menunjukkan perubahan kadar HDL kolesterol dipengaruhi oleh perlakuan pakan yang digunakan (F hitung =8,40 > F tabel 0,01=3,51). Hasil uji lanjut menggunakan BNT 0,05 = 7,749 menunjukkan bawa kadar HDL Kolesterol hari ke-0 sebelum perlakuan berkisar antara 0,454 - 0,60 mg/ml. Pada kelompok kontrol negatif terjadi peningkatan HDL sebesar 23,10 % dan kelompok E dengan perlakuan penambahan suplemen kondidat sel probiotik Lactobacillus plantarum JR64 terjadi peningkatan kadar HDL sebesar 35,78 %. Untuk perlakuan pemberian kaldu Lactobacillus plantarum meningkat 9,9 %. Adapun untuk kelompok D yang mendapat perlakuan penambahan suplemen kaldu Lactobacillus bulgaricus FNCC41 mengalami penurunan 1,36 % dan kelompok F dengan perlakuan sel Lactobacillus bulgaricus meningkat 30,74 %. Pengaruh probiotik Lactobacillus plantarum JR64 terhadap peningkatan kadar HDL kolesterol berbeda secara nyata. Hal ini terjadi karena Lactobacillus plantarum JR 64 mampu mencegah kolesterol endogen yang disintesis dalam tubuh selama 35 hari yang dibawa oleh lipoprotein ke dalam darah dan menyerap langsung kolesterol eksogen dalam usus dan mengekskresikannya melalui feses. High Density Lipoprotein (HDL) kolesterol merupakan
0,00 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00 A B C D E F 0,75 0,79 0,50 0,70 0,86 0,58 0,42 0,67 0,46 0,63 0,38 0,42 Tr ig lis erid a, m g/m l
Kelompok Perlakuan, Hari ke 0 & 35
Simbol : : Hari ke 0, : Hari ke 35
carier (lipoprotein) yang berfungsi untuk mentransfer kelebihan kolesterol dan jaringan periferal menuju ke hati dan sangat bermanfaat dalam menurunkan resiko aterosklerosis. Data pengaruh kondidat probiotik terhadap perubahan kadar HDL kolesterol secara rinci dapat dilihat pada Lampiran 21.
4.6.2.5. Pengaruh kondidat probiotik terhadap perubahan kadar LDL kolesterol
Pada Gambar 36 ditunjukkan perubahan kadar LDL kolesterol selama perlakuan. Hasil uji ANOVA menunjukkan perubahan kadar LDL kolesterol dipengaruhi oleh perlakuan pakan yang digunakan (F hitung =6,80 > F tabel 0,01=3,51). Hasil uji lanjut menggunakan BNT 0,05 = 27,783. Kadar Low Density Lipoprotein (LDL) kolesterol dalam darah tikus uji sebelum diberikan perlakukan berkisar antara 0,105 mg/ml – 0,159 mg/ml. Setelah perlakuan selama 35 hari terjadi penurunan LDL kolesterol sebesar 19,5 % untuk kelompok C dengan penambahan kondidat probiotik kaldu Lactobacillus plantarum JR64, sedangkan untuk kelompok pembanding dengan pemberian suplemen kaldu
Lactobacillus bulgaricus FNCC41 mampu mengendalikan peningkatan LDL kolesterol
karena hanya meningkat yang bertambah 11,12 %. Penurunan kolesterol selain dipengaruhi
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 A B C D E F 0,45 0,50 0,60 0,50 0,51 0,52 0,56 0,49 0,62 0,49 0,66 0,65 Ko n sen tr as i HD L , m g/m l
Kelompok Perlakuan, Hari Ke 0 & 35
Simbol : : Hari ke 0, : Hari ke 35
oleh kandungan asam linoleat tetapi dipengaruhi juga oleh kemampuan bakteri untuk mengasimilasi kolesterol dan mendekonjugasi garam empedu (Ngatirah, 2000). Data pengaruh kondidat probiotik terhadap perubahan kadar LDL kolesterol secara rinci dapat dilihat pada Lampiran 22.
Kadar kolesterol dalam darah yang tinggi merupakan pemicu utama terjadinya jantung koroner dan stroke, hal tersebut terutama disebabkan oleh pola hidup yang kurang sehat. Berbagai cara telah diusulkan untuk dapat menurunkan kolesterol dalam darah secara nyata. Omega 6 merupakan salah satu makanan yang telah terbukti dapat menurunkan kadar kolestrol. Dari hasil penelitian ditemukan bahwa penggantian diet asam lemak jenuh dengan asam lemak tidak jenuh dapat menurunkan kolesterol, tetapi asam lemak tak jenuh tunggal tidak berpengaruh secara aktif terhadap penurunan kadar kolesterol. Dari percobaan klinis LDL naik 1,74 mg/dl setiap kenaikan 1% asam lemak jenuh pada diet, sedangkan omega 6 justru menurunkan sebesar 0,74 mg/dl setiap 1% energi yang diwakilinya.
Makanan yang mengandung lipid mengalami proses sedemikian rupa sebelum diserap oleh usus, Proses itu adalah ester kolesterol dalam makanan dihidrolisis menjadi kolesterol yang bercampur dengan kolesterol yang teresterifikasi dan kolesterol empedu
0,0 0,1 0,2 0,3 0,4 A B C D E F 0,13 0,11 0,13 0,11 0,16 0,15 0,14 0,34 0,10 0,12 0,16 0,23 K on se n tr as i LDL, m g/ m l
Kelompok Perlakuan, Hari Ke 0 & 35
Simbol : : Hari ke 0, : Hari