BAB II KAJIAN TEORI 2.1 Jagung
Jagung (Zea mays L.) merupakan salah satu tanaman pangan dunia yang terpenting selain gandum dan padi. Menurut Aryaningrum (2011) jagung memiliki kadar karbohidrat yang cukup tinggi yakni 63,6% dalam 100 gr jagung. Tanaman jagung merupakan salah satu tanaman serelia yang tumbuh hampir di seluruh dunia dan tergolong spesies dengan variabilitas genetik tebesar. Di Indonesia jagung merupakan bahan makanan pokok kedua setelah padi.
Salah satu provinsi penghasil jagung yaitu Provinsi Gorontalo. Di Gorontalo tanaman ini dikenal dengan nama Binthe. Menurut BPIJ Provinsi Gorontalo (2010), Pemerintah Daerah Provinsi Gorontalo menjadikan jagung sebagai komoditi unggulan disamping komoditi yang lainnya. Sebab prospek pengembangan jagung di daerah ini sangat potensial yang tersebar pada beberapa kabupaten/kota, seperti kabupaten Gorontalo, Kabupaten Boalemo dan Kabupaten Pohuwato. Di Provinsi Gorontalo jagung merupakan komoditi tanaman pangan yang memegang peranan penting dengan tingkat produksi yang tinggi.
Keunggulan jagung dibandingkan dengan komoditas pangan yang lain adalah kandungan gizinya lebih tinggi dari beras, sumber budidaya alam ini juga sangat mendukung untuk pembudidayaannya, harga relatif murah dan tersedianya teknologi budidaya hingga pengolahan. Selain sebagai bahan makan pokok, jagung juga dapat digunakan sebagai bahan pakan ternak dan bahan industri serta komoditas eksport (Suprapto dan Rasyid dalam Soeprijanto, 2012).
2.1.1 Sistematika tumbuhan jagung
Menurut Iriani (2011) dalam taksonomi tumbuhan, tanaman jagung diklasifikasikan sebagai berikut:
Kingdom : Plantae (tumbuh-tumbuhan) Divisio : Spermatophyta (tumbuhan berbiji) Subdivisio : Angiospermae (berbiji tertutup) Kelas : monocotyledoneae (berkeping satu) Ordo : Graminae (rumput-rumputan) Famili : Poaceae (graminaceae) Spesies : Zea mays L
2.1.2 Komposisi kimia tongkol jagung
Tongkol jagung tersusun atas senyawa kompleks lignin, hemiselulosa dan selulosa. Masing-masing merupakan senyawa-senyawa yang potensial dapat dikonversi menjadi senyawa lain secara biologi. Selulosa merupakan sumber karbon yang dapat digunakan mikroorganisme sebagai substrat dalam proses fermentasi untuk menghasilkan produk yang mempunyai nilai ekonomi tinggi (Suprapto dan Rasyid dalam Soeprijanto, 2008). Komposisi kimia limbah tongkol jagung menurut Meryandani dkk (2009) dapat dilihat pada Tabel 1 dibawah ini. Tabel 1. Komposisi kimia tongkol jagung
No. Komposisi Jumlah (%)
1. 2. 3. Selulosa Hemiselulosa Lignin 65,96 10,82 23,74
Selulosa adalah polimer β-glukosa dengan ikatan β-1,4 diantara satuan glukosanya. Selulosa berfungsi sebagai bahan struktur dalam jaringan tumbuhan dalam bentuk campuran polimer homolog dan biasanya disertai polisakarida lain dan lignin dalam jumlah yang beragam. Molekul selulosa memanjang dan kaku, meskipun dalam larutan. Gugus hidroksil yang menonjol dari rantai dapat
O CH2OH OH OH O CH2OH OH OH O O CH2OH OH OH O CH2OH OH OH O O O
membentuk ikatan hidrogen dengan mudah, mengakibatkan kekristalan dalam batas tertentu (John dalam Sari, 2009). Struktur selulosa dapat dilihat pada gambar 1.
Gambar 1. Struktur selulosa
Selulosa hampir tidak pernah ditemui dalam keadaan murni di alam, melainkan selalu berikatan dengan bahan lain yaitu lignin dan hemiselulosa. Serat selulosa alami terdapat di dalam dinding sel tanaman dan material vegetatif lainnya. Selulosa murni mengandung 44,4% C; 6,2% H dan 49,3% O. Rumus empiris selulosa adalah (C6H10O5)n. Pada proses hidrolisis yang sempurna akan
mengahasilkan glukosa, sedangkan proses hidrolisis sebagian akan menghasilkan disakarida selobiosa (Sjostrom dalam Soeprijanto, 2008).
2.2 Alkohol
Alkohol dapat diproduksi dengan cara fermentasi gula menggunakan
Saccharomyces cerevisiae. Alkohol dapat dibuat dari pati tongkol jagung yang
telah diproses menjadi glukosa (Richana, 2007).
Secara teoritis, hidrolisis glukosa akan menghasilkan alkohol dan karbondioksida. Perbandingan mol antara glukosa dan alkohol dapat dilihat pada reaksi berikut ini:
C6H12O6 2 C2H5OH + 2 CO2
Satu mol glukosa menghasilkan 2 mol alkohol dan 2 mol karbondioksida, atau dengan perbandingan bobot tiap 180 g glukosa akan menghasilkan 90 g
alkohol. Dengan melihat kondisi tersebut, perlu diupayakan penggunaan substrat yang murah untuk dapat menekan biaya produksi alkohol sehingga harganya bisa lebih mudah (Richana, 2007).
Alkohol (etanol) adalah cairan transparan, tidak berwarna, cairan yang mudah bergerak, mudah menguap, dapat bercampur dengan air, eter, dan kloroform, diperoleh melalui fermentasi karbohidrat dari ragi. Alkohol biasanya diartikan sebagai etil alkohol (C2H5OH), mempunyai densitas 0,78506 g/mL pada
25 °C, titik didih yaitu 78,4 °C, tidak berwarna, dan mempunyai bau serta rasa yang spesifik. Etanol disebut juga etil alkohol, alkohol absolut, atau alkohol saja adalah sejenis cairan yang mudah menguap, mudah terbakar, tak berwarna, dan merupakan alkohol yang paling sering digunakan dalam kehidupan sehari-hari. Senyawa ini merupakan obat psikoaktif dan dapat ditemukan pada minuman beralkohol dan termometer modern.
Alkohol yang dipakai untuk minuman dan gasohol masih dibuat secara fermentasi. Alkohol yang dipakai sebagai pelarut dibuat dengan hidrasi dari etilen, suatu zat petrokimia yang didapat dari reaksi pemecahan minyak bumi (Fessenden & Fessenden, 1997).
2.2.1 Sifat kimia alkohol
Menurut Fessenden (1997), beberapa sifat alkohol adalah sebagai berikut. 1) Berbobot molekul rendah sehingga larut dalam air.
2) Diperoleh dari fermentasi gula Pembentukan alkohol
3) Pembakaran alkohol menghasilkan CO2 dan H2O
Pembakaran alkohol
CH3CH2OH + 3O2 2CO2 + 3H2O + energi
2.3 Hidrolisis Asam
Hidrolisis adalah proses peruraian suatu senyawa oleh air. Proses tersebut dapat terjadi dalam suasana asam, basa, atau netral tergantung pada senyawa yang bereaksi serta karena enzim. Hidrolisis selulosa merupakan suatu proses yang dilakukan untuk menghasilkan glukosa. Ada dua cara yang digunakan untuk hidrolisis selulosa yaitu dalam suasana asam dan secara enzimatis. (Soeprijanto, 2008).
Menurut Soebijanto dalam Sari (2009), hidrolisis asam adalah hidrolisis dengan menggunakan asam yang dapat mengubah polisakarida (pati, selulosa) menjadi gula. Dalam hidrolisis asam biasanya digunakan asam chlorida (HCl) atau asam sulfat (H2SO4) dengan kadar tertentu. Penggunaan asam H2SO4 dan
HCl sebagai katalis dalam hidrolisis asam menghasilkan gula sederhana yang berbeda, dimana pada konsentrasi dan waktu hidrolisis yang sama H2SO4
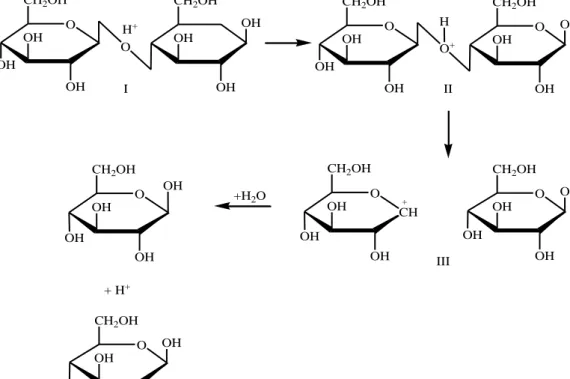
memberikan hasil lebih tinggi dibandingkan dengan HCl. Menurut Aranie dan Idiawati (2011) Proses Hidrolisis terjadi seperti pada reaksi dibawah ini:
CH O OH CH2OH OH OH O OH CH2OH OH OH OH I II III +H2O + H+ + O CH2OH OH OH OH CH2OH OH OH O OH H+ O CH2OH OH OH OH O CH2OH OH OH O+ OH H O CH2OH OH OH OH OH O CH2OH OH OH OH OH
Gambar 2. Proses Hidrolisis Selulosa (Arianie dan Idiawati, 2011) 2.4 Metode Luff Schoorl
Banyak cara yang bisa dilakukan untuk menguji atau mengukur kadar glukosa. Dalam penelitian ini cara yang digunakan yaitu dengan menggunakan metode luff schoorl. Pengukuran karbohidrat yang merupakan gula pereduksi dengan metode Luff Schoorl ini didasarkan pada reaksi sebagai berikut :
R-CHO + 2 Cu2 R-COOH + Cu2O
1 Cu2 + 4 I Cu2I2 + I2
2 S2O32- + I2 S4O62- + 2 I
-Monosakarida akan mereduksikan CuO dalam larutan Luff menjadi Cu2O.
Kelebihan CuO akan direduksikan dengan KI berlebih, sehingga dilepaskan I2. I2
metode analisa yang digunakan adalah Iodometri karena kita akan menganalisa I2
yang bebas untuk dijadikan dasar penetapan kadar. Dimana proses iodometri adalah proses titrasi terhadap iodium (I2) bebas dalam larutan. Apabila terdapat
zat oksidator kuat (misal H2SO4) dalam larutannya yang bersifat netral atau
sedikit asam penambahan ion iodida berlebih akan membuat zat oksidator tersebut tereduksi dan membebaskan I2 yang setara jumlahnya dengan dengan banyaknya
oksidator. I2 bebas ini selanjutnya akan dititrasi dengan larutan standar Na2S2O3
sehinga I2 akan membentuk kompleks iod-amilum yang tidak larut dalam air.
Oleh karena itu, jika dalam suatu titrasi membutuhkan indikator amilum, maka penambahan amilum sebelum titik ekivalen (Underwood, 1996).
Sudarmaji (1989), Metode luff schoorl merupakan suatu metode atau cara penentuan monosakrida dengan cara kimiawi. Pada penentuan dengan metode ini yang ditentukan bukannya kuprooksida yang mengendap tapi dengan menentukan kuprioksida dalam larutan sebelum direaksikan dengan gula reduksi (titrasi blanko) dan sesudah direaksikan dengan sampel reduksi (titrasi sampel). Penentuannya dengan titrasi menggunakan Na-thiosulfat. Selisih titrasi blanko dengan titrasi sampel ekuivalen dengan kuprooksida yang terbentuk dan juga ekuivalen dengan jumlah gula reduksi yang ada dalam bahan atau larutan. Reaksi yang terjadi selama pembentukan karbohidrat cara ini mula-mula kuprioksida yang ada dalam reagen akan membebaskan iod dari garam K-iodida. Banyaknya iod yang dibebaskan ekuivalen dengan banyaknya kuprioksida. Banyaknya iod dapat diketahui dengan titrasi menggunakan Na-thiosulfat. Untuk mengetahui bahwa titrasi sudah cukup maka diperlukan indikator amilum. Apabila larutan
berubah warnanya dari biru menjadi putih berarti titrasi sudah selesai. Agar supaya perubahan watna biru menjadi putih dapat tepat maka penambahan amilum diberikan pada saat titrasi hampir selesai. Setelah diketahui selisih banyaknya titrasi blanko dan titrasi sampel kemudian dikonsultasikan dengan tabel yang tersedia yang menggambarkan hubungan antara banyaknya Na-thiosulfat dengan banyaknya gula reduksi.
Menurut Dewati (2008) kadar glukosa dapat dihitung dengan menggunakan rumus dibawah ini:
Kadar glukosa = mg glukosa x faktor pengenceran
Berat sampel x 1000 x 100%
Dengan melihat tabel 2 kita dapat mengetahui jumlah gula reduksi (mg glukosa) yang ada dalam larutan.
Tabel 2. Penentuan glukosa, fruktosa dan gula invert dalam suatu bahan **) mL 0,1 N
Thio. *)
Glukosa, fruktosa, gula invert mg C6H12O6
mL 0,1 N Thio. *)
Glukosa, fruktosa, gula invert mg C6H12O6 ∆ ∆ 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 2,4 4,8 7,2 9,7 12,2 14,7 17,2 19,8 22,4 25,0 27,0 30,3 2,4 2,4 2,5 2,5 2,5 2,5 2,6 2,6 2,6 2,6 2,7 2,7 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 33,0 25,7 38,5 38,5 44,2 47,1 50,0 53,0 56,0 59,1 62,0 - 2,7 2,8 2,8 2,9 2,9 2,9 3,0 3,0 3,1 3,1 - - *) mL 0,1 N Thio = titrasi blanko – titrasi sampel
**) Analisis dengan metode Luff Schoorl
2.5 Fermentasi
Prinsip dasar fermentasi adalah mengaktifkan kegiatan mikroba tertentu untuk tujuan mengubah sifat bahan, agar dapat dihasilkan sesuatu yang bermanfaat seperti alkohol. Menurut Idral dkk (2012), Fermentasi alkohol atau alkoholisasi adalah proses perubahan gula menjadi alkohol dan CO2 oleh mikroba,
terutama oleh khamir Saccharomyces cerevisiae. Karbohidrat akan dipecah dahulu menjadi gula sederhana yaitu dengan hidrolisis selulosa menjadi unit-unit glukosa.
Ciri-ciri spesies Saccharomyces cerevisiae 1. Mikroorganisme bersel satu.
2. Tidak berklorofil.
3. Tumbuh baik pada suhu 30 °C dan pH 4-4,5.
4. Mempunyai sifat stabil dan cepat mengadakan adaptasi. 2.6 Cara Perhitungan Jumlah Mikroba/Koloni
Menurut Nugraheni dkk, 2012 perhitungan jumlah mikroba yang tumbuh berdasarkan jumlah koloni yang terhitung dengan colony counter merupakan cara yang paling umum digunakan untuk perhitungan jumlah mikroba. Dasarnya adalah membuat suatu seri pengenceran sampel dengan kelipatan 10 dari masing-masing pengenceran diambil 1 mL dan dibuat taburan dalam petridis (cawan petri) dengan medium agar yang macam dan caranya tergantung pada macamnya mikroba. Setelah diinkubusikan dihitung jumlah koloni tiap petridis dari masing-masing pengenceran. Dari jumlah koloni tiap petridis dapat ditentukan jumlah
bakteri tiap mL sampel yaitu dengan mengalikan jumlah koloninya dengan junlah pengenceran yang dipakai. Jumlah koloni bakteri yang didapat x pengenceran.
Untuk membantu menghitung jumlah mikroba dalam petridis dapat digunakan “colony counter”. Menurut (Thayib, 1989) Pada perhitungan dengan cara ini diperlukan beberapa syarat yang harus dipenuhi, antara lain:
a) Cawan yang dipilih dan dihitung adalah yang mengandung jumlah koloni antara 30 sampai 300.
b) Beberapa koloni yang bergabung menjadi satu merupakan suatu kumpulan koloni yang besar dimana jumlah koloninya diragukan, dapat dihitung sebagai satu koloni.
c) Suatu deretan atau (lantai) koloni yang terlihat sebagai suatu garis tebal dihitung sebagai satu koloni.
d) Hasil yang dilaporkan hanya terdiri dari dua angka yaitu angka pertama dan kedua. Jika angka yang kedua sama dengan atau lebih besar dari 5, harus dibulatkan satu angka lebih tinggi pada angka yang kedua.
Banyaknya jumlah Saccharomyces cerevisiae dari dapat dihitung dengan menggunakan rumus dibawah ini:
Jumlah koloni = Jumlah koloni percawan x 1
faktor pengenceran 2.7 Destilasi
Destilasi merupakan teknik pemisahan yang didasari atas perbedaan perbedaan titik didih atau titik cair dari masing-masing zat penyusun dari campuran homogen. Dalam proses destilasi terdapat dua tahap proses yaitu tahap penguapan dan dilanjutkan dengan tahap pengembangan kembali uap menjadi cair
atau padatan. Atas dasar ini maka perangkat peralatan destilasi menggunakan alat pemanas dan alat pendingin (Zulfikar, 2010).
Pemisahan dengan cara destilasi yang didasarkan pada perbedaan titik didih cairan pada tekanan tertentu. Pemisahan dengan destilasi melibatkan penguapan diferensial dari suatu campuran cairan diikuti dengan penampungan material yang menguap dengan cara pendinginan dan pengembunan. Beberapa tekhnik destilasi lebih cocok untuk pekerjaan preparatif di laboratorium dan industri. Sebagai contoh adalah pemurnian alkohol, pemisahan minyak bumi menjadi fraksi-fraksinya, pembuatan minyak atsiri dan sebagainya (Soebagio,2003).
Pemisahan dengan destilasi berbeda dengan pemisahan cara penguapan. Pada destilasi semua komponen yang terdapat di dalam campuran bersifat mudah menguap (volatil). Tingkat penguapan (volatilitas) masing-masing komponen berbeda-beda pada suhu yang sama. Hal ini akan berakibat bahwa pada suhu tertentu uap yang dihasilkan dari suatu campuran cairan akan selalu mengandung lebih banyak komponen yang lebih volatil. Sifat yang demikian ini akan terjadi sebaliknya, yakni pada suhu tertentu fasa cairan akan lebih banyak mengandung komponen yang kurang volatil. Jadi cairan yang setimbang dengan uapnya pada suhu tertentu memiliki komposisi yang berebeda. Pada pemisahan dengan cara penguapan, komponen volatil dipisahkan dari komponen yang non volatil, karena proses pemanasan (Soebagio,2003).
2.8 Alkoholmeter
Hidrometer yang sering dikenal dengan alkoholmeter merupakan alat untuk mengukur kadar alkohol yang cara pemakaiannya lebih mudah dan harganya
relatif lebih murah. Prinsip kerja alat ini berdasarkan berat jenis campuran antara alkohol dengan air (Isroi, 2008).
Alkohol yang dihasilkan dari proses destilasi diukur dengan menggunakan alkoholmeter. Namun sebelumnya dilakukan pengukuran alkohol standar terlebih dahulu. Kadar alkohol dapat dihitung dengan menggunakan rumus :
Kadar alkohol = % kadar alkohol (sampel)
faktor koreksi x 100%
Menurut Ikmawati (2011) faktor koreksi pada rumus di atas dapat dihitung dengan menggunakan rumus seperti dibawah ini:
Faktor koreksi = % alkohol standar terbaca dengan alkohol meter% alkohol standar x 100% 2.9 Spektrometri Infra Merah
Spektrofotometer IR dapat digunakan untuk mengidentifikasi suatu senyawa. Parameter kualitatif pada spektrofotometer IR adalah bilangan gelombang dimana muncul akibat adanya serapan oleh gugus fungsi yang khas dari suatu senyawa. Namun jika hanya daerah gugus fungsi saja tidak digunakan untuk menganalisis identitas senyawa (Aprilia, 2012).
Spektrofotometri Infra Red atau Infra Merah merupakan suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah gelombang 0,75-1.000 µm atau pada bilangan gelombang 13.000-10 cm-1 dengan menggunakan suatu alat yaitu spektrofotometer inframerah (Anonim, 2007).
Febriyanto (2012) menyatakan bahwa dalam menginterpretasi suatu spektrum IR senyawa hasil isolasi/sintesis, fokus perhatian dipusatkan kepada
gugus fungsional utama seperti karbonil (C=O), hidroksil (O-H), nitril (C-N) dan lain-lain.
Berikut panduan dalam menganalisis spektrum IR suatu senyawa organik:
1. Diperhatikan, apakah ada gugus karbonil (C=O) pada daerah 1820-1600 cm-1 yang puncaknya tajam dan sangat karakteristik.
2. Bila ada gugus karbonil, maka perhatikan kemungkinan gugus fungsional berikut, jika tidak ada maka dilanjutkan pada langkah 3.
a. Asam karboksilat akan memunculkan serapan OH pada daerah 3500-3300 cm-1.
b. Amida akan memberikan serapan N-H yang tajam pada daerah sekitar 3500 cm-1.
c. Ester akan memunculkan serapan C-O tajam dan kuat pada 1300-1000 cm-1. d. Anhirida akan memunculkan serapan C=O kembar pada 1810 dan 1760 cm-1. e. Aldehida akan memunculkan C-H aldehida intensitas lemah tajam pada
2850-2750 cm-1 baik yang simetri maupun anti-simetri. f. Keton, bila semua yang di atas tidak muncul. 3. Bila serapan karbonil tidak ada maka:
a. Ujilah alkohol (-OH), dengan memperhatikan adanya serapan yang melebar (khas sekali) pada 3500-3300 cm-1 (dikonfirmasi dengan asam karboksilat) dan diperkuat dengan serapan C-O pada sekitar 1300-1000 cm-1.
b. Ujilah amina (N-H), dengan memperhatikan adanya serapan medium pada sekitar 3500 cm-1 (dikonfirmasi dengan amida).
c. Ujilah eter (C-O), dengan memperhatikan serapan pada 1300-1000 cm-1 (dikonformasi dengan alkohol dan ester).
4. Ikatan C=C alkena dan aromatis. Untuk alkena serapan akan muncul pada 1650 cm-1, sedangkan untuk aromatis sekitar 1650-1450 cm-1. Serapan C-H alifatik alkena akan muncul di bawah 3000 cm-1, sedangkan C-H vinilik benzena akan muncul di atas 3000 cm-1.
5. Ikatan C≡C alkuna akan muncul lemah tajam pada 2150 cm-1, sedangkan C≡N nitril medium dan tajam akan muncul pada 2250 cm-1.
6. Gugus nitro NO2, memberikan serapan kuat sekitar 1600-1500 cm-1 dari
anti-simetris dan juga pada 1390-1300 cm-1 untuk simetris.
7. Bila informasi 1 sampai 6 di atas tidak ada maka dugaan kuat spektrum IR adalah dari senyawa hidrokarbon.
Senyawa karbonil
Salah satu pita dalam spektrum inframerah yang paling berbeda ialah pita yang disebabkan oleh modus vibrasi regang karbonil (C=O). Pita ini merupakan pita yang kuat dijumpai pada daerah 1640-1820 cm-1 (5,5-6,1 µm). Gugus karbonil merupakan bagian dari sejumlah gugus fungsional (Supratman, 2008).
Asam karboksilat menunjukkan serapan C=O yang khas dan juga menunjukkan serapan pita O-H yang sangat khas, yaitu pada sekitar 3330 cm-1 dan miring ke dalam pita absorpsi C-H alifatik. O-H karboksil memiliki spektrum yang nampak berbeda dari spektrum O-H alkohol karena asam karboksilat membentuk dimer berdasarkan ikatan hidrogen (Supratman, 2008).