METODE ELEKTRODA SELEKTIF ION NITRAT UNTUK
PENGUJIAN NITRAT DALAM AIR
Purwanto A, dan Samin P
Pusat Teknologi Akselerator dan Proses Bahan – BATAN, Yogyakarta
ABSTRAK
METODE ELEKTRODA SELEKTIF ION NITRAT UNTUK PENGUJIAN NITRAT DALAM AIR. Telah dilakukan penelitian pengujian nitrat-nitrogen (NO3--N) dengan metode potensiometri elektroda selektif ion
(ESI) menggunakan potensiometer Metrohm dengan elektroda selektif ion nitrat dan pembanding Ag/AgCl. Kurva standar dibuat dengan kisaran konsentrasi 1-50 ppm dalam larutan pengatur kuat ion (NH4)2SO4,
asam borat, asam sulfamat. Dari kurva standar diperoleh hubungan linier antara Log [NO3
--N] terhadap potensial (mV) pada kisaran konsentrasi 2-50 ppm, faktor Nernst antara 49 – 52 mV perdekade, waktu tanggap elektroda 5 menit. Validasi metode dilakukan dengan menentukan akurasi, presisi dan batas deteksi. Presisi ditentukan dari koefisien variansi terhadap larutan NO3--N konsentrasi 2, 3, 4 dan 5 ppm
dengan 7 pengulangan, diperoleh koefisien variansi antara 0,37% - 1,6%. Uji perolehan kembali (recovery) terhadap 2, 4, 6 dan 8 ppm standar nitrat yang ditambahkan ke dalam cuplikan diperoleh antara 99,88 – 106,89%. Batas deteksi ditentukan dari kurva standar diperoleh 0,60 ppm. Metode ini diterapkan untuk menganalisis nitrogen-nitrat dalam air limbah industri mineral A/KL-P2 diperoleh konsentrasi rerata 48,259 + 1,030 ppm, dalam air sungai TBB/H-2 diperoleh 1,972 + 0,045 ppm.
Kata Kunci : elektroda selektif ion nitrat
ABSTRACT
NITRATE ION SELECTIVE ELECTRODE METHOD FOR THE DETER-MINATION OF NITRATE ION IN WATERS SAMPLE. The determination of nitrate ion in industrial water and river water with nitrate ion selective electrode Metrohm and reference electrode Ag/AgCl double jounction has been carried out. Calibration curve was made from the concentration range of nitrate ion is 1.0 and 50 ppm in ionic strength adjustment (ISA) solution of 0.04 M (NH4)2SO4, boric acid and sulfamic acid. From standard calibration
curve between potential (mV) versus nitrate concentration, it was found that the NO3- electrode calibration
gave Nernst factor of 49 – 52 mV at NO3- ion concentration ranges of 2 to 50 ppm, response time of 5
minutes. The accuracy determined with recovery test by addition of 2, 4, 6 and 8 ppm nitrate standard to the sample solution, gave values between 99.88 – 106.89%., precision from coeficient of variation (CV) is 0.37% - 1.6%, and detection limit is 0.6 ppm respectively. The application of this methode for the determination of nitrogen-nitrate in industrial water and river water. The NO3--N concentration results in mineral industries
water A/KL-P2 is 48.259 + 1.030 ppm, and river water TBB/H-2 is 1.972 + 0.045 ppm.
Keyword : nitrate ion selective electrode
PENDAHULUAN
alidasi merupakan konfirmasi melalui pengujian dan pengadaan bukti yang obyektif bahwa persyaratan tertentu untuk tujuan khusus dipenuhi. Menurut SNI 19-17025-2008, salah satu klausulnya menyebutkan bahwa laboratorium harus memvalidasi metode tidak baku, metode yang dikembangkan, dan metode baku yang digunakan di luar lingkup yang dimaksudkan(1).
Hasil uji yang absah apabila hasil validasinya diperoleh akurasi (ketepatan) dan presisi (kecermatan) yang baik. Akurasi dinyatakan dengan nilai recovery yang dihitung dari kadar terukur dibagi dengan kadar diketahui dikalikan 100
%, jika nilainya berada pada rentang 90-110% maka metode ini dikatakan baik. Presisi metode analisis dihitung berdasarkan Coefficient of Variation (CV) yang dihitung dari simpangan baku dibagi nilai rata-rata dikalikan 100%, jika nilainya kurang dari 2 % maka metode ini presisinya baik.(2) Metode uji
memegang peranan yang sangat penting dalam memperoleh hasil uji dengan akurasi dan presisi tinggi. Salah satu alat uji yang mendukung laboratorium penguji di PTAPB BATAN adalah Potensiometer dengan Elektroda SelektifIon (ESI) nitrat buatan Metrohm Switzerland dan ruang lingkup pengujian antara lain contoh uji air, air limbah dan cuplikan lingkungan. Sehingga tujuan penelilian ini adalah melakukan validasi metode
124
elektroda selektif ion (ESI) nitrat untuk pengujian nitrogen-nitrat dalam air.
Telah diketahui bahwa ion NO3-merupakan
bahan kimia kontaminan akut yang dilepaskan ke penyedia air melalui limbah manusia dan ternak dan pupuk.. Air hujan atau irigasidapat membawa nitrat turun melalui tanah ke air tanah sehingga air minum dapat terkontaminasi nitrat bila diambil dari sumber ini. Ion nitrat ditemukan dalam air alam berasal dari berbagai sumber alami dan buatan manusia. Nitrat merupakan sumber utama nitrogen yang dibutuhkan oleh tumbuh-tumbuhan dan binatang untuk sintesis asam amino dan protein. Kebanyakan nitrogen di bumi terdapat di atmosfer dalam bentuk gas nitrogen, N2. Melalui proses yang disebut siklus
nitrogen(3), gas nitrogen dirubah ke dalam bentuk
yang siap pakai oleh tumbuh-tumbuhan dan binatang. Konversi ini meliputi produk industri dari pupuk, proses alam seperti fiksasi nitrogen tumbuhan, peruraian tanaman dan binatang dan berbagai limbah.
Dalam air alam konsentrasi nitrat biasanya kurang dari 1 mg/L, sumber buatan manusia menjadi naik di atas 3 mg/L. Sumber ini bisa berasal dari kotoran binatang, runoff dari pemberian pupuk, atau perlakuan dari berbagai air limbah. Dalam air minum dengan tingkat konsentrasi diatas 10 mg/L potensial menyebabkan penyakit fatal bagi bayi yang disebut methemoglobinemia, atau Blue-Baby Syndrome.(3) Dalam penyakit ini haemoglobin dikonversi oleh nitrat kedalam bentuk senyawa yang menghambat transport oksigen. Pencemaran nitrat dalam air permukaan dan air alam menjadi masalah besar ekologi dalam beberapa area pertanian. Suplai air minum perlu diuji kadar nitrogen-nitrat pada setiap kurang dari 2-3 tahun untuk mengetahui ada tidaknya kenaikan senyawa nitrogen nitrat, nitrit dan amonia(8).
Metoda elektroda selektif ion nitrat merupakan salah satu metode analisis elektrokimia yang dapat digunakan untuk analisis kuantitatif, penentuan kandungan nitrat dalam air. Penggunaan elektroda selektif ion (ESI) dalam analisis kimia sangat luas karena selektivitasnya tinggi, relatif murah, cepat, tidak memerlukan perlakuan awal yang rumit dan dapat digunakan untuk pengujian anion maupun kation. Dalam beberapa aplikasinya metode ESI menjadi alternatif pengganti metode analisis yang telah ada dengan nilai kelebihan dalam hal efisiensi dan kesederhanaan dalam pengukurannya, akan tetapi kelemahan metode ESI ini kestabilannya rendah.(4)
Elektroda selektif ion berdasarkan jenis ion sensitif membran yang digunakan dalam konstruksinya digolongkan menjadi 3, yaitu : elektroda membran padat (solid-state) membran cair
(liquid) dan membran gelas. Elektroda ion selektip nitrat termasuk dalam elektroda membran cair (liquid) ion-exchange berisi plastik inert porous substrat yang dijenuhkan dengan air tidak bercampur (immisible) dengan pelarut organik yang mengandung garam anorganik dari ion yang diukur.
DASAR TEORI
Respon dari suatu elektroda selektif ion adalah potensial sebagai fungsi dari aktivitas ion atau konsentrasi dalam larutan. Bila aktivitas naik maka potensial elektroda menjadi lebih positip bila elektrodanya adalah sensor kation, menjadi lebih negatif jika elektroda sensor untuk anion. Bila potensial elektroda dari suatu elektroda diukur terhadap elektroda pembanding, diperoleh harga potensial sebanding dengan logaritma aktivitas atau konsentrasi ion. Hubungan antara potensial elektroda dengan aktivitas ion ditunjukkan dengan persamaan Nernst sebagai berikut :
a
log
nF
RT
303
,
2
E
E
=
a+
Dimana :E : adalah total potensial dari sistem yang diukur
Ea : adalah bagian dari total potensial terhadap
elektroda pembanding dalam larutan R : adalah konstante gas umum (8,314 J.K
-1.mol-1)
T : adalah derajat Kelvin, n muatan ion F : adalah bilangan Faraday (96,485 C.mol-1)
a : adalah aktivitas ion dalam larutan cuplikan Untuk sepuluh kali perubahan dalam aktivitas ion, potensial elektroda (pada 25 0C) berubah dengan
59,2 mV jika ion yang diukur adalah monovalen dan 29,6 mV jika yang diukur adalah divalen. Akan tetapi dalam prakteknya sering diperoleh slope elektroda yang lebih kecil atau kurang dari teori dan hal ini menyebabkan kesalahan pengukuran jika kompensasi tidak dipenuhi.(4).
BAHAN DAN TATAKERJA
BahanLarutan standar ion NO3- dari KNO3 , larutan
ISA (Ionic Strength Adjustor) campuran dari (NH4)2
SO4 0,04M, asam sulfamat H2NSO3H, asam borat
H3BO3, perak asetat AgCH3COO, kloroform
CHCl3, asam sulfat H2SO4, semua bahan buatan
Peralatan
Alat uji yang digunakan adalah Potensio-meter 654 pH buatan Metrohm dilengkapi dengan elektroda selektif ion NO3-, elektroda pembanding
Ag/AgCl double junction, motor pengaduk magnet. Alat–alat pendukung adalah neraca analitik Sartorius, oven, eksikator, mikro pipet, labu takar, beker polietilen, stop watch, serta alat–alat laboratorium lainnya.
Tata kerja :
1. Pembuatan larutan
− Larutan standar NO3- -N, konsentrasi 100
ppm
KNO3 dikeringkan dalam oven pada suhu
105 0C selama 24 jam, kemudian ditimbang
0,7218 g KNO3 dilarutkan dalam akuabides
hingga volume 1 L dengan adanya 2 mL kloroform (CHCl3) sebagai pengawet,
larutan ini stabil untuk 6 bulan.(5)
− Larutan pengatur kuat ion (ionic strength adjuster, ISA)
Ditimbang kristal ammonium sulfat, (NH4)2SO4 13,2140 gram, asam sulfamat,
H2NSO3H 3,1554 gram, asam borat, H3BO3
1,5458 gram, dilarutkan dalam akuabides hingga volume 100 mL, pH ditepatkan 3,0 dengan H2SO4 encer.
− Larutan AgCH3COO 0,06 M
Ditimbang 1,0015 gram AgCH3COO
dilarutkan dalam akuabides sambil diaduk dan dipanaskan, setelah dingin volume ditepatkan 100 mL.
2. Pengkondisian elektroda
− Sebelum sel elektrokimia digunakan untuk pengujian ion nitrat perlu dilakukan pengkondisian dengan cara elektroda dicelupkan sambil diaduk ke dalam larutan KNO3 0,01 M atau dengan larutan standar
NO3- -N, konsentrasi terendah dalam kisaran
konsentrasi kurva standar yaitu 1 atau 2 ppm, selama 1 hingga 2 jam, laman perendaman tergantung elektroda itu baru digunakan atau periode lama tidak digunakan. Kemudian sel dicuci dengan akuabides berulangkali, potensial akuabides diukur potensialnya demikian pula untuk larutan blanko. Untuk pengukuran berikutnya diusahakan agar potensial larutan blanko mirip dengan potensial blanko pada pengukuran-pengukuran sebelumnya.
3. Verifikasi elektroda selektif ion NO3
-− Uji verifikasi ditentukan berdasarkan harga potensial elektroda selektif ion relatif terhadap elektroda pembanding Ag/AgCl. Penentuan linieritas kurva, nilai faktor Nernst, waktu tanggap elektroda, sehingga dalam pelaksanaannya disiapkan larutan mengandung nitrat sebagai berikut :
− Dibuat satu deret larutan standar NO3--N
dalam larutan ISA : (NH4)2SO4 0,04 M,
asam borat, asam sulfamat, pH 3,0. dengan variasi konsentrasi adalah : 1,0 ;2,0 ; 3,0 ; 4,0 ; 5,0 ; 10,0 ; 20,0 dan 50,0 ppm. Larutan dituangkan ke dalam beker plastik (polipropylen) 50 mL, diaduk dengan motor pengaduk magnit dan dilakukan pengamatan potensial masing–masing larutan untuk selang waktu 1 hingga 10 menit. Dibuat kurva kalibrasi antara potensial (mV) terhadap logaritma konsentrasi ion NO3--N
(ppm) dan harga slope dari persamaan garis kurva kalibrasi merupakan harga faktor Nernst (2,303 RT/nF). Harga faktor Nernst memenuhi persyaratan apabila pada suhu 25
0C berada dalam kisaran 54 + 5 mV atau 57,1
+ 5 mV perdekade.(6,7)
4. Penentuan akurasi, uji perolehan kembali (recovery)
− Untuk menentukan uji recovery dilakukan pembuatan kurva kalibrasi standar ion nitrat (NO3- ) konsentrasi 1,0 – 20 ppm dalam
larutan ISA (ionic strength adjustor) amonium sulfat 0,04 M pH 3,0. Kurva kalibrasi ini digunakan untuk menentukan kadar ion NO3- dalam contoh air limbah
A/KL-P2 Tailing. Selanjutnya ke dalam larutan contoh tersebut di spike dengan larutan standar ion nitrat (NO3- ) konsentrasi
2, 4, 6, dan 8 ppm dan dihitung harga konsentrasi ion NO3- nya. Prosen recovery
dihitung dari selisih konsentrasi ion NO3
-standar hasil analisis dan harga sesungguhnya dikalikan 100. Sedangkan presisi ditentukan dengan menghitung simpangan baku (Sd) dari tujuh pengujian
larutan, dan koefisien variasi (CV) dihitung sebagai berikut : 100 % x X S CV = d
5. Penentuan batas deteksi metode
− Dilakukan dengan cara uji statistika terhadap kurva kalibrasi standar antara potensial (mV) terhadap log konsentrasi ion NO3- (ppm)
126
dengan menghitung harga limit of detection (Lod) dengan rumus :
( ) 2 n y y S i 2 i B − − =
∑
)simpangan baku blanko dihitung dari kurva kalibrasi standar, kemudian ditentukan harga Y, Y = YB + 3SB, YB adalah harga ordinat
kurva kalibrasi yang tidak melalui titik nol (potensial blanko). Setelah harga Y diperoleh kemudian diplotkan ke dalam kurva kalibrasi akan diperoleh harga X yaitu limit/batas deteksi metode
6. Penentuan konsentrasi ion NO3--N dalam contoh uji
a. Dengan cara kurva standar (langsung)
Larutan contoh masing–masing dipipet sejumlah 25 mL dimasukkan ke dalam beker gelas, pH diatur antara 3-4 dengan ditambah asam sulfat encer bertetes-tetes, kemudian ditambah 5 mL larutan AgCH3COO, bila
terjadi endapan disaring. Filtrat ditampung dalam labu takar 50 mL ditambah 2 mL larutan ISA (NH4)2SO4 0,2 M. Larutan
diencerkan hingga batas sehingga larutan ISA mempunyai konsentrasi 0,04M. Larutan yang terjadi diukur potensialnya pada waktu tanggap 5 menit. Konsentrasi ion NO3
-ditentukan menggunakan kurva kalibrasi standar dikalikan dengan faktor pengenceran. b. Dengan cara standar adisi (metode selisih
kenaikan standar )
Larutan contoh masing–masing dipipet sejumlah 25 mL dimasukkan ke dalam beker gelas, pH diatur antara 3-4 dengan ditambah asam sulfat encer bertetes-tetes, kemudian ditambah 5 mL larutan Ag-CH3COO, bila
terjadi endapan disaring. Filtrat ditampung dalam labu takar 50 mL ditambah 2 mL larutan ISA NH4- sulfat 0,2M. Larutan yang
terjadi diukur potensialnya pada waktu tanggap 5 menit. Selanjutnya ke dalam larutan contoh tersebut di adisi dengan larutan standar ion nitrat (NO3- ) 1000 ppm,
volume tertentu (µL) sehingga konsentrasi nitrat yang ditambahkan (∆C) : 2, 4, 6, dan 8 ppm, setiap penambahan standar diukur potensialnya, konsentrasi ion NO3- dalam
contoh uji (Cs) dihitung dengan persamaan(4): ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − ∆ = ∆ 1 10 1 C Cs E/S
Cs : konsentrasi spesies yang diukur
∆C : perubahan konsentrasi disebabkan kenaikan atau penurunan konsentrasi disebabkan ion analit
S : faktor Nernst atau slope elektroda ∆E : perubahan potensial olek karena
perubah-an konsentrasi
HASIL DAN PEMBAHASAN
Metode elektroda selektif ion telah banyak digunakan dalam berbagai analisis kuantitatif untuk menentukan kandungan kation maupun anion. Elektroda selektif ion merupakan sensor elektrokimia potensiometri yang berfungsi sebagai indikator keberadaan dan kuantitas analit. Elektroda selektif ion nitrat dalam konstruksinya sebagai sensor menggunakan jenis membran cair (liquid) ion-exchange berisi plastik inert porous. Sebelum digunakan untuk pengujian, dilakukan uji verifikasi dengan penentuan linieritas kurva, kisaran konsentrasi yang memenuhi pers. Nernst, waktu tanggap elektroda dan faktor Nernst. Kurva standar ion NO3--N dibuat dengan kisaran konsentrasi 1,0
ppm hingga 50 ppm dalam larutan pengatur kuat ion terdiri dari campuran ammonium sulfat, asam borat, asam sulfamat pH 3,0. Diperoleh hubungan linier antara Log [NO3- -N] terhadap potensial, pada
kisaran konsentrasi 2-50 ppm dengan koef, korelasi (r) = 0,995, sedangkan waktu tanggap adalah 5 menit. Salah satu contoh data pengamatan potensial (mV) terhadap konsentrasi NO3- -N, yang diamati
dari menit pertama hingga 10 menit ditunjukkan pada Tabel 1. Dari beberapa kali pembuatan kurva kalibrasi standar dengan rentang konsentrasi 2,0 – 50 ppm, diperoleh harga faktor Nernst berkisar antara 52 mV–49 mV, sedangkan untuk kisaran konsentrasi 1,0 – 50 ppm diperoleh harga yang lebih rendah (Tabel 1) di bawah. Disamping itu turunnya harga faktor Nernst disebabkan oleh faktor usia pemakaian elektroda, dalam instruction manual Metrohm (5) disebutkan bahwa rata-rata durasi pada
pemakaian ½ tahun, hal ini disebabkan oleh sifat kimia bahan sensor membran polimer dibatasi oleh lamanya penyimpanan. Usia pemakaian elektroda selektif ion nitrat ditentukan oleh bahan aktif dan plasticizer yang digunakan. Dengan bertambahnya waktu, sensitivitas respon elektroda menunjukkan penurunan.
Kurva standar antara logaritma konsentrasi NO3- -N terhadap potensial (mV) ditunjukkan pada
Gambar 1di bawah.
Batas deteksi ditentukan secara perhitungan statistik dari persamaan regresi kurva standar ditunjukkan pada Tabel 2 di bawah.
Tabel 1. Potensial (mV) yang diamati dari menit ke 1 hingga 10 menit untuk konsentrasi ion NO3 - -N : 1 – 50 ppm
Konsentrasi Potensial Elektroda (mV) diamati pada menit ke
(ppm) Log C 1' 1' 3' 4' 5' 5' 10' 10' 1 0,000 209,4 - - - 208,4 - 208,0 - 2 0,301 196,2 196,2 196,5 196,6 196,8 196,8 197,4 197,4 5 0,699 179,5 179,5 179,9 180,0 180,2 180,2 180,8 180,8 10 1,000 165,1 165,1 164,9 165,0 165,0 165,0 165,3 165,3 20 1,301 148,9 148,9 149,0 149,2 149,3 149,3 149,8 149,8 50 1,699 125,0 125,0 123,0 123,8 123,7 123,7 123,2 123,2 F.Nernst (B) -50,915 -49,051 -52,381 -51,933 -49,320 -52,140 -49,428 -52,830 Intercpt (A) 213,855 211,559 215,041 214,853 211,667 215,140 211,940 216,130 Korelasi (R) 0,9969 0,9970 0,9955 0,9960 0,9951 0,9960 0,9936 0,9953 50,0 75,0 100,0 125,0 150,0 175,0 200,0 225,0 0,000 0,500 1,000 1,500 2,000 Log [nitrat], ppm Potensial (mV)
Gambar 1. Kurva log konsentrasi NO3-N, 2–50 ppm
terhadap potensial (mV) yang diamati menit ke 5
Standar deviasi blanko,
3 37 , 61 2 n ) Y Y ( S S 2 ^ i X / Y b − = − = =
∑
= 3,9170 Y = Yb + 3 Sb = 215,4816Batas deteksi (LOD) dihitung dengan memasukkan harga Y ke persamaan regresi, dan diperoleh log X = - 0,2237 sehingga X = 0,597 ppm Jadi pada kisaran konsentrasi : 2-50 ppm, batas penentuan terendah adalah 0,6 ppm.
Penentuan konsentrasi ion NO3--N dalam contoh uji
a. Dengan cara kurva standar (langsung)
Dengan menggunakan kurva kalibrasi standar untuk rentang konsentrasi NO3- -N 2,0 -20 ppm
untuk menghitungan konsentrasi NO3- -N dalam
contoh air limbah industri mineral ditunjukkan tabel 3 di bawah.
Tabel 2. Batas deteksi dihitung dari persamaan kurva standar
Kons.NO3--N (ppm) Log [NO3--N] (Xi) Potensial (Yi) ∧
Y
∧ − 2 i Y) Y ( 2 0,301 187,0 187,92 0,84 5 0,699 171,9 167,01 23,90 10 1,000 148,6 151,20 6,76 20 1,301 130,9 135,39 20,14 50 1,699 117,6 114,48 9,73 Σ ∧ − 2 i Y) Y ( = 61,37128
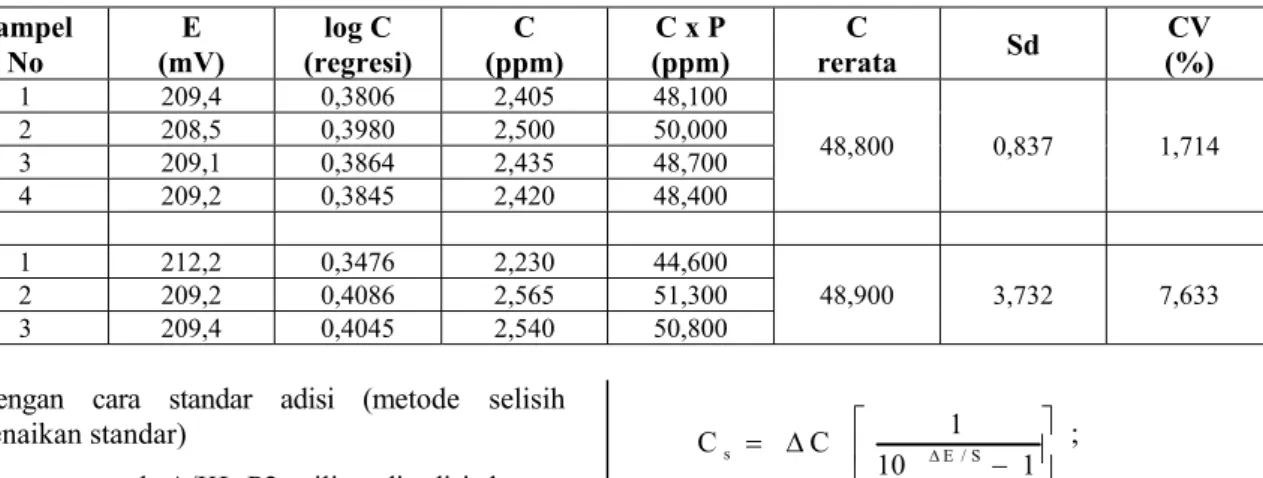
Tabel 3. Kadar NO3- -N dalam cuplikan air limbah industri mineral/ A/KLP2 Tailing, ditentukan dengan cara
kurva standar (langsung)
Sampel
No (mV) E (regresi) log C (ppm) C (ppm) C x P rerata C Sd (%) CV
1 209,4 0,3806 2,405 48,100 48,800 0,837 1,714 2 208,5 0,3980 2,500 50,000 3 209,1 0,3864 2,435 48,700 4 209,2 0,3845 2,420 48,400 1 212,2 0,3476 2,230 44,600 48,900 3,732 7,633 2 209,2 0,4086 2,565 51,300 3 209,4 0,4045 2,540 50,800
b. Dengan cara standar adisi (metode selisih kenaikan standar)
Larutan contoh A/KL-P2 tailing di adisi dengan larutan standar ion nitrat (NO3- ) 1000 ppm,
volume tertentu (mL) sehingga konsentrasi nitrat yang ditambahkan (∆C) : 2, 4, 6, dan 8 ppm, setiap penambahan standar diukur potensialnya, konsentrasi ion NO3- dalam contoh uji (Cs)
dihitung dengan persamaan (4):
⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − ∆ = ∆ 1 10 1 C Cs E/S ;
data percobaan dan perhitungan ditunjukkan pada Tabel 4.
Contoh uji yang ditentukan dengan cara kurva standar langsung (Tabel 3.) dan yang ditentukan dengan cara standar adisi (Tabel 4.) diperoleh konsentrasi, standar deviasi dan koefisien korelasi yang hampir sama. Tabel 4. Kadar NO3--N dalam cuplikan air limbah industri A/KL-P2 Tailing, ditentukan dengan cara adisi
standar. NO3- -N 1000 ppm (mL) ∆C (ppb) E (mV) ∆E (mV) 10∆E/S-1 Cs (ppm) Cs x P P=20 CsRerata (ppm) Sd (ppm) 0,000 0,00 209,4 0,050 2,00 194,9 -14,5 0,9043 2,212 44,323 46,807 1,767 0,100 4,00 186,9 -22,5 1,7168 2,330 46,784 0,150 6,00 181,1 -28,3 2,5152 2,385 47,900 0,200 8,00 176,4 -33 3,3313 2,401 48,221 0,000 0,00 208,5 0,050 2,00 194,5 -14 0,8624 2,319 46,473 48,422 1,385 0,100 4,00 186,5 -22 1,6571 2,414 48,469 0,150 6,00 180,6 -27,9 2,4533 2,446 49,109 0,200 8,00 176 -32,5 3,2362 2,472 49,638 0,000 0,00 209,1 0,050 2,00 195,2 -13,9 0,8542 2,341 46,922 49,235 1,682 0,100 4,00 187,3 -21,8 1,6336 2,449 49,166 0,150 6,00 181,5 -27,6 2,4076 2,492 50,042 0,200 8,00 177 -32,1 3,1616 2,530 50,810 0,000 0,00 209,2 0,050 2,00 195,2 -14 0,8624 2,319 46,473 48,572 1,524 0,100 4,00 187,2 -22 1,6571 2,414 48,469 0,150 6,00 181,4 -27,8 2,4380 2,461 49,417 0,200 8,00 176,8 -32,4 3,2174 2,486 49,928
Uji validitas metode dengan menentukan presisi berdasarkan perhitungan koefisien variansi terhadap larutan NO3- -N konsentrasi 2, 3, 4 dan 5
ppm masing-masing 7 pengulangan, diperoleh
antara 0,37 % - 1,6 % sedangkan menurut acuan < 2% (2). Uji perolehan kembali (recovery) terhadap 2,
4, 6, 8 ppm larutan standar nitrat yang ditambahkan ke dalam cuplikan diperoleh recovery berkisar
rentang 90-110 %(2), sehingga dapat dikatakan bahwa
alat dan metode uji mempunyai presisi dan akurasi yang baik.
Larutan pengatur kuat ion, ISA pH 3 yang dibuat dari ammonium sulfat 0,04 M, asam sulfamat dan asam borat masing-masing 0,01 M berfungsi sebagai pengatur kuat ion sekaligus sebagai bufer dan untuk mengurangi gangguan matriks larutan cuplikan yang diuji. Ammonium sulfat sebagai pengatur kuat ion, asam sulfamat untuk mencegah gangguan dari ion nitrit, asam borat untuk mengatur pH 3 mengurangi gangguan dari bikarbonat(5).
KESIMPULAN
1. Dari hasil percobaan yang dilakukan diperoleh kesimpulan bahwa unjuk kerja elektroda selektif ion NO3- linier pada kisaran konsentrasi 2-50
ppm, dengan waktu tanggap 5 menit, diperoleh harga faktor Nernst di bawah acuan yaitu antara 49–52 mV perdekade konsentrasi.
2. Presisi yang ditentukan dari koef. variasi terhadap larutan NO3- -N konsentrasi 2, 3, 4 dan
5 ppm masing-masing 7 pengulangan, diperoleh presisi yang baik dengan koefisien variasi antara 0,37 % - 1,6 %, nilai ini memenuhi acuan < 2%
(2). Uji perolehan kembali (recovery) terhadap 2,
4, 6, 8 ppm larutan standar nitrat yang ditambahkan ke dalam cuplikan diperoleh recovery berkisar antara 99,88 – 106,89 %, sehingga dapat dikatakan alat dan metode uji mempunyai presisi dan akurasi yang baik. Batas deteksi metode ESI nitrat yang ditentukan dari kurva standar diperoleh sebesar 0,6 ppm. Hasil uji kadar ion NO3- dalam air limbah industri mineral
A/KL-P2 diperoleh konsentrasi rerata 48,259 + 1,030 ppm, dalam air sungai TBB/H-2 diperoleh 1,972 + 0,045 ppm.
DAFTAR PUSTAKA
1. ANONIM., Persyaratan Umum Kompetensi Laboratorium Pengujian dan Laboratorium Kalibrasi, SNI 19-17025-2005, Badan Standardisasi Nasional, Jakarta (2005)
2. MULJA, M., dan HANWAR, D., Prinsip-Prinsip Cara Berlaboratorium yang Baik (Good Laboratory Practice), Majalah Farmasi Airlangga, Vol. III, No.2, 2003.
3. ANONIM., Determining The Amount of Nitrate in Water, Westminster College-SIM 4. ANONIM., Determination of Nitrate Ion Levels
in Water Samples by Use Of Ion Selective Electrode, Department of Chemistry The
University of Adelaide, Australia, http://www.chemistry.adelaide.edu.au
5. ANONIM., Standard Methods For The Examination of Water and Wastewater, 18 th Edition, American Public Health Association, Washington, 1992, (4500-NO3- D. Nitrate Electrode Method).
6. ANONIM., Ion Selective Electrodes (ISE)., Metrohm Ion Analysis, Instruction for Use CH-9100 Herisau (Switzerland)
7. RUNDLE CHRIS C., Operating Instructions for ELIT Ion-Selective Electrodes, http://www.nico2000.net/analytical/nitrate.htm 8. ANONIM., Nitrate Nitrite Nitrogen in Drinking
Water, http://www.water research. net/nitrate. 9. SAWYER DONALD T., Chemistry
Experiments for Instrumental Methods, John Wiley & Sons Inc., Canada 1984.
10. ATIKAH., Fenomena Transport Ion Nitrat Pada Elektroda Selektif Ion Tipe Kawat Terlapis Membran Polivinilklorida Dengan Aliquat 336-Nitrat., Kumpulan Abstrak Tesis A-Disertasi Doktor 2005, ITB Central Library A’s CD Collection.
11. YOKY EDY SAPUTRA., ”Verifikasi dan Validasi Metoda di Laboratorium”, Juli 2009, http//en, wikipedia.org/wiki/accuracy and precision.
TANYA JAWAB
Wisjachudin Faisal− Pengaruh unsur-unsur apa saja yang mengganggu jalannya analisis dengan ion selektif nitrat ?
Purwanto
• Unsur-unsur pengganggu adalah ion klorida dengan bikarbonat bila konsentrasinya 5-10 kalinya NO3--N. Ion-ion lainnya yang
mengganggu, tetapi biasanya dalam air konsentrasinya kecil, yaitu NO2-, CN-, S2-, Br-,
I-.
• Untuk meminimalkan gangguan-gangguan ini dengan cara menggunakan larutan buffer mengandung Ag2SO4, untuk menghilangkan
Cl-,Br-, I
-, S2- dan CN-, asam sulfamat, untuk
menghilangkan NO2-, dan larutan buffer pH
3 untuk mencegah gangguan HCO3- dan
![Tabel 2. Batas deteksi dihitung dari persamaan kurva standar Kons.NO 3 - -N (ppm) Log [NO 3 - -N] (X i ) Potensial (Yi) Y∧ − ∧ 2iY)Y( 2 0,301 187,0 187,92 0,84 5 0,699 171,9 167,01 23,90 10 1,000 148,6 151,20 6,76 20 1,301 130,9 135,39](https://thumb-ap.123doks.com/thumbv2/123dok/2112535.3536460/5.892.188.740.885.1080/tabel-batas-deteksi-dihitung-persamaan-kurva-standar-potensial.webp)