TEH DENGAN METODE 2,2-diphenyl-1-picrylhidrazil (DPPH)
Dionisius Laffyanto 128114100
INTISARI
Pemakaian bahan alam semakin luas karena memiliki aktivitas antioksidan. Antioksidan menghambat suatu radikal bebas dengan cara bereaksi dengan radikal bebas reaktif menjadi radikal bebas relatif stabil. Penelitian ini dilakukan untuk mengetahui karakter dan aktivitas antioksidan tumbuhan sisik naga (Pyrrosia piloselloides (L) M.G Price pohon inang tanaman teh. Tumbuhan ini merupakan salah satu tumbuhan yang memiliki aktivitas antioksidan
Pengujian dilakukan dengan karakterisasi simplisia dan ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga mengikuti parameter standar umum yang terdapat pada Materia Medika Indonesia Jilid V. Pengujian aktivitas antioksidan dilakukan secara kualitatif menggunakan KLT dan secara kuantitatif menggunakan metode 2,2-diphenyl-1-picrylhidrazil (DPPH) yang dinyatakan dengan nilai Inhibition Concentration 50 (IC50). Keberadaan senyawa beraktivitas antioksidan akan mengubah
warna larutan dari ungu menjadi kuning. Kontrol positif yang digunakan adalah rutin. Hasil uji karakterisasi menunjukkan bahwa tumbuhan simplisia dan ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga inang tanaman teh telah memenuhi standar umum pada MMI. Hasil kuantitatif aktivitas antioksidan menunjukkan terdapat aktivitas antioksidan lemah dengan nilai IC50 (2.003,666 ±
31,0215) µg/mL pada ekstrak diklorometan, (582,166 ± 6,6275) µg/mL pada ekstrak etil asetat, dan (160,8 ± 3,84317) µg/mL pada ekstrak metanol.
The used of natural materials more extensive because it has antioxidant activity. Antioxidant inhibit a free radical with the reaction of reactive free radical into a relatevely stable free radical. The study was conducted to determine the character and antioxidant activity of sisik naga plant (Pyrrosia piloselloides (L) M.G Price of host tree tea. It is one of the plant that have antioxidant activity.
The testing conducted with the characterization of simplicia and dichloromethane extract, ethyl acetate extract, and methanol extract of sisik naga plant of host tree tea following by a common parameters standard of Materia Media Indonesia 5th Volume. The antioxidant activity testing was conducted qualitatively by TLC and quantitatively with 2,2-diphenyl-1-picrylhidrazil (DPPH) method which expressed as the value Inhibition Concentration 50 (IC50). The existence of active antioxidant compounds would
change DPPH color from purple to yellow. Rutin was a control positive at this study.
The result showed that the characterization of simplicia and methanol extract of sisik naga plant of host tree tea to qualified by a common parameters standard of Materia Media Indonesia 5th Volume. The IC50 were (003.666 ± 31.021) µg/mL of
dichloromethane extract, (582.166 ± 6.627) µg/mL of ethyl acetate extract, and (160.800 ± 3.8431) µg/mL of methanol extract. The quantitatively result of antioxidant activity was weak.
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KARAKTER EKSTRAK TUMBUHAN SISIK NAGA (Pyrrosia piloselloides (L.) M.G
Price) POHON INANG TEH (Camellia sinensis (L.) O.K) DENGAN METODE 2,2-diphenyl-1-picrylhidrazil (DPPH)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh:
Dionisius Laffyanto
NIM : 128114100
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KARAKTER EKSTRAK TUMBUHAN SISIK NAGA (Pyrrosia piloselloides (L.) M.G
Price) POHON INANG TEH (Camellia sinensis (L.) O.K) DENGAN METODE 2,2-diphenyl-1-picrylhidrazil (DPPH)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh:
Dionisius Laffyanto
NIM : 128114100
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Nothing can stop God’s plan for your life
-Isaiah 14 : 27-
I can do all things through Christ who strengthens me
-Philippians 4 : 13-
God always gives his best to those who leave the choice with him
-Jim Elliot-
Be strong. Be brave. Be fearless. You’re not alone.
-Joshua 1 : 9-
Dengan mengucap syukur, Kupersembahkan karya kecil ini untuk :
Yesus Kristus dan Bunda Maria yang selalu memberikan perlindungan, kekuatan dan pertolongan saat aku terjatuh
Papa, Mama, Mas Ogyk dan Mbak Tisa yang selalu memberikan doa dan dukungan dalam
setiap langkahku dan kehidupanku
Orang tersayang dan sahabat-sahabatku yang selalu setia menemaniku dan memberiku semangat
vii
PRAKATA
Puji syukur Kepada Tuhan Yang Maha Esa karena berkat dan
penyertaanNya yang selalu menyertai penulis, sehingga penulis dapat
menyelesaikan skripsi dengan judul “Uji Aktivitas Antioksidan Dan Penetapan Karakter Ekstrak Tumbuhan Sisik Naga (Pyrrosia piloselloides (L.) M.G Price) Pohon Inang Teh (Camellia sinensis (L.) O.K) dengan Metode 2,2-Diphenyl-1-Picrylhidrazil (DPPH)”. Skripsi ini dibuat untuk memenuhi salah satu syarat memperoleh gelar sarjana farmasi (S.Farm) program studi Farmasi di
Universitas Sanata Dharma, Yogyakarta.
Penelitian menyadari bahwa selama penelitian dan penyusunan skripsi ini
tidak lepas dari bantuan dan dukungan dari berbagai pihak. Oleh karena itu,
penulsi sangat mengucapkan terima kasih kepada:
1. Ibu Aris Widayanti, M.Si., Ph.D., Apt. Selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma yang telah mengijinkan penulis menjalankan
pembelajaran selama masa studi.
2. Ibu Dr. Erna Tri Wulandari, M.Si., Apt., selaku dosen pembimbing yang telah
memberikan bantuan dan bimbingan selama rancangan, pengusulan skripsi,
pelaksanaan penelitian, dan penulisan skripsi.
3. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen penguji yang menguji serta
memberi arahan, kritik, dan saran yang bersifat membangun bagi penulis.
4. Bapak Florentinus Dika Octa Riswanto, M.Sc., selaku dosen penguji yang
menguji serta memberi arahan, kritik, dan saran yang bersifat membangun
viii
5. Segenap dosen Fakultas Farmasi yang tidak bisa disebutkan satu per satu
selaku dosen pembimbing akademik yang telah mendidik, mengarahkan, dan
memberi nasihat-nasihat positif.
6. Bapak Wagiran selaku laboran Laboratorium Farmakognosi-Fitokimia, Mas
Bimo slaku laboran Laboratorium Kimia Analisis Instrumental, dan segenap
laboran Laboratorium Fakultas Farmasi atas segala bantuan untuk penulis
selama pelaksanaan penelitian
7. Keluarga (Papa, Mama, Mas Ogyk, dan Mbak Tisa) yang selalu memberikan
dukungan kepada penulis, baik secara moral maupun materil.
8. Eugenius Yogia dan Gama Nindya, sahabat dan teman seperjuangan dalam
penyelesaian skripsi atas segala dukungan, masukan, kritik, saran, keluh
kesah, canda, tawa kepada penulis selama proses dari awal hingga akhirnya
lulus bersama.
9. Dewita Cici Ernia, teman, sahabat, pacar yang tidak pernah berhenti untuk
selalu mengingatkan dan memberi dukungan kepada penulis dalam
menyelesaikan skripsi.
10. Natasha Queen Ferdinand, teman, sahabat, yang telah menemani penulis
ketika mengambil sampel dan membantu baik dalam hal moral dan selalu
memberikan dukungannya agar penulis segera menyelesaikan skripsi.
11. Seluruh teman-teman Farmasi angkatan 2012 dan teman-teman Mas Boy
2012 yang tidak bisa disebutkan satu per satu yang telah berdinamika
ix
dilalui bersama dari awal Titrasi hingga sekarang ini, tidak lupa juga atas
dukungan doanya selalu kepada penulis.
12. Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat
disebutkan satu per satu.
Penulis menyadari masih banyak kesalahan dan kekurangan pada
penulisan skripsi ini. Oleh karena itu, dengan kerendahan hati penulis
mengharapkan kritik dan saran yang bersifat membangun bagi semua pihak.
Akhir kata, penulsi berharap agar skripsi ini dapt berguna bagi pembaca dan
pengemban ilmu pengetahuan khususnya di bidang farmasi.
Yogyakarta, 15 Januari 2016
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN PENELITIAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xviii
ABSTRACT ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
B. Permasalahan ... 4
C. Keaslian Penelitian ... 4
D. Manfaat Penelitian ... 5
E. Tujuan Penelitian ... 5
BAB II PENELAAHAN PUSTAKA ... 7
xi
1. Klasifikasi Tumbuhan ... 7
2. Morfologi Tumbuhan ... 7
3. Kandungan Kimia ... 8
B. Kandungan Kimia Metabolit Sekunder ... 9
C. Radikal Bebas ... 11
D. Antioksidan ... 13
E. Metode Uji Aktivitas Antioksidan ... 16
F. Tahap Pembuatan Simplisia ... 18
G. Ekstraksi ... 20
H. Kromatografi ... 22
I. Spektrofotometri ... 24
J. Landasan Teori ... 27
K. Hipotesis ... 28
BAB III METODE PENELITIAN ... 29
A. Jenis dan Rancangan Penelitian ... 29
B. Variabel ... 29
C. Definisi Operasional ... 30
D. Bahan dan Alat Penelitian ... 31
1. Bahan Penelitian ... 31
2. Alat Penelitian ... 31
E. Tata Cara Penelitian ... 32
1. Determinasi Tumbuhan ... 32
xii
3. Pembuatan Simplisia Tumbuhan Sisik Naga ... 32
4. Ekstraksi Tumbuhan Sisik Naga ... 33
5. Karakterisasi Ekstrak ... 33
a. Pemeriksaan Mikroskopik ... 33
b. Penetapan Kadar Abu Total ... 34
c. Penetapan Kadar Abut Tidak Larut Asam ... 34
d. Penetapan Kadar Sari Larut Air ... 34
e. Penetapan Kadar Sari Larut Etanol ... 35
f. Uji Kandungan Kimia Ekstrak ... 35
6. Uji Aktivitas Antioksidan ... 36
a. Uji Pendahuluan (Optimasi Panjang Gelombang DPPH) ... 36
b. Uji Pendahuluan (Penentuan Reaction Time) ... 36
c. Pembuatan Larutan ... 37
1) Pembuatan Larutan DPPH ... 37
2) Pembuatan Larutan Uji Ekstrak ... 37
3) Pembuatan Larutan Blanko ... 38
4) Pembuatan Larutan Standar Rutin ... 38
d. Pengujian Aktivitas Antioksidan ... 39
e. Perhitungan Nilai IC50 ... 39
BAB IV HASIL DAN PEMBAHASAN ... 40
A. Determinasi Tumbuhan Sisik Naga ... 40
B. Pengumpulan Tumbuhan Sisik Naga ... 40
xiii
D. Penyerbukan Tumbuhan Sisik Naga ... 42
E. Ekstraksi Tumbuhan Sisik Naga ... 43
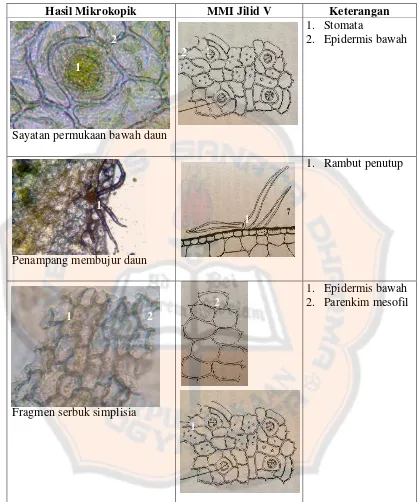
F. Pemeriksaan Mikroskopik ... 44
G. Karakterisasi Tumbuhan Sisik Naga ... 46
H. Kandungan Kimia Ekstrak ... 47
1. Pengujian Senyawa Minyak Atsiri ... 49
2. Pengujian Senyawa Flavonoid ... 52
3. Pengujian Senyawa Tanin ... 54
4. Pengujian Senyawa Steroid ... 56
F. Uji Aktivitas Antioksidan Tumbuhan Sisik Naga ... 57
1. Penentuan Panjang Gelombang Maksimum ... 57
2. Penentuan Reaction Time / Operating Time (OT) ... 58
3. Uji Aktivitas Antioksidan ... 59
BAB V KESIMPULAN DAN SARAN ... 63
A. Kesimpulan ... 63
B. Saran ... 63
DAFTAR PUSTAKA ... 64
LAMPIRAN ... 69
xiv
DAFTAR TABEL
Halaman
Tabel I. Macam ROS dan Antioksidan yang Menetralisir ... 14
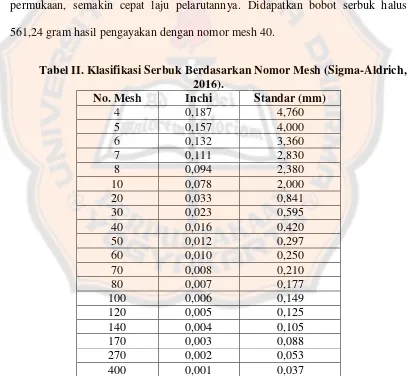
Tabel II. Klasifikasi Serbuk Berdasarkan Nomor Mesh ... 42
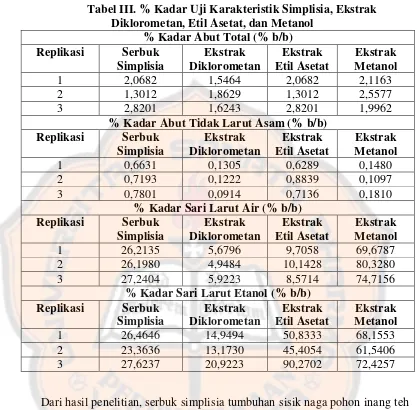
Tabel III. % Kadar Uji Karakteristik Simplisia, Ekstrak Diklorometan, Etil Asetat, dan Metanol ... 47
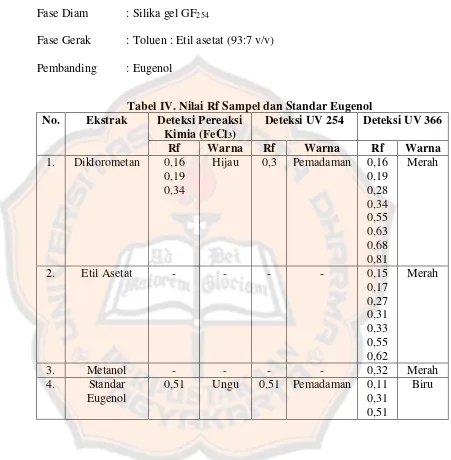
Tabel IV. Nilai Rf Sampel dan Standar Eugenol ... 49
Tabel V. Nilai Rf Sampel dan Standar Rutin ... 51
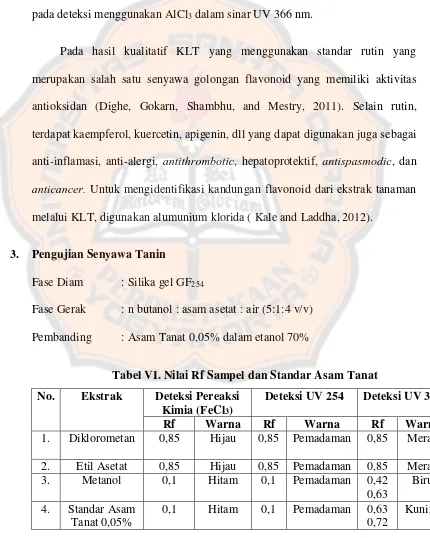
Tabel VI. Nilai Rf Sampel dan Standar Asam Tanat ... 52
Tabel VII. Nilai Rf Sampel dan Standar β-sitosterol ... 54
Tabel VIII. Nilai IC50 Rutin dan Ekstrak Diklorometan, Etil Asetat, Metanol Tumbuhan Sisik Naga Pohon Inang Teh ... 59
xv
DAFTAR GAMBAR
Halaman
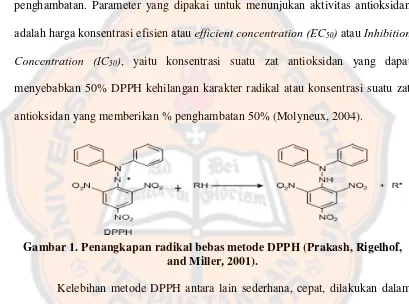
Gambar 1. Penangkapan radikal bebas metode DPPH ... 17
Gambar 2. Hasil uji mikroskopik dengan pembanding MMI Jilid V ... 45
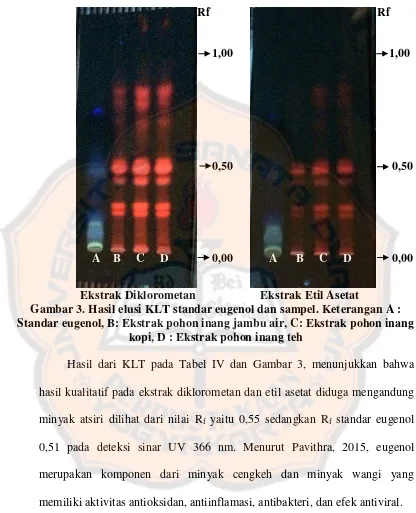
Gambar 3. Hasil elusi KLT standar eugenol dan sampel ... 50
Gambar 4. Hasil elusi KLT standar rutin dan sampel ... 51
Gambar 5 hasil elusi KLT standar asam tanat dan sampel ... 53
Gambar 6. Hasil elusi KLT standar β-sitosterol dan sampel ... 55
Gambar 7. Grafik kurva Operating Time DPPH dan rutin ... 57
Gambar 8. Mekanisme reaksi radikal DPPH dengan senyawa antioksidan ... 58
Gambar 9. Mekanisme reaksi rutin dengan DPPH ... 58
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Tumbuhan Sisik Naga ... 70
Lampiran 2. Surat Determinasi Tumbuhan Sisik Naga ... 71
Lampiran 3. Penimbangan Serbuk Simplisia Tumbuhan Sisik Pohon
Inang Teh ... 72
Lampiran 4. Volume Maserasi Menggunakan Pelarut Diklorometan,
Etil Asetat, dan Metanol ... 72
Lampiran 5. Bobot Tetap dan % Rendemen Ekstrak Diklorometan,
Etil Asetat, dan Metanol Tumbuhan Sisik Naga Pohon
Inang Teh ... 73
Lampiran 6. Penimbangan dan % Rendemen Karakterisasi Simplisia
Dan Ekstrak Diklorometan, Etil Asetat, dan Metanol
Tumbuhan Sisik Naga Pohon Inang Teh ... 74
Lampiran 7. Penimbangan dan Perhitungan Konsentrasi DPPH untuk
Panjang Gelombang Maksimum ... 79
Lampiran 8. Hasil Panjang Gelombang Maksimum Metode DPPH ... 80
Lampiran 9. Penimbangan Dan Perhitungan Konsentrasi Rutin untuk
Penentuan Operating Time ... 80
Lampiran 10. Hasil Operating Time metode DPPH ... 81
Lampiran 11. Penimbangan dan Perhitungan Konsentrasi DPPH dan
Rutin Sebagai Kurva Pembanding ... 83
xvii
Antioksidan Rutin ... 86
Lampiran 13. Penimbangan dan Perhitungan Konsentrasi DPPH dan
Sampel Larutan Uji Untuk Kurva Sampel Uji ... 88
Lampiran 14. Hasil Pengukuran Absorbansi dan Perhitungan Aktivitas
Antioksidan Sampel Uji ... 94
Lampiran 15. Hasil Statistika Uji Normalitas dan uji t tidak
xviii
INTISARI
Pemakaian bahan alam semakin luas karena memiliki aktivitas antioksidan. Antioksidan menghambat suatu radikal bebas dengan cara bereaksi dengan radikal bebas reaktif menjadi radikal bebas relatif stabil. Penelitian ini dilakukan untuk mengetahui karakter dan aktivitas antioksidan tumbuhan sisik naga (Pyrrosia piloselloides (L.) M.G Price) pohon inang Teh (Camellia sinensis (L.) O.K). Tumbuhan ini merupakan salah satu tumbuhan yang memiliki aktivitas antioksidan.
Pengujian dilakukan dengan karakterisasi simplisia dan ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga mengikuti parameter standar umum yang terdapat pada Materia Medika Indonesia Jilid V. Pengujian aktivitas antioksidan dilakukan secara kualitatif menggunakan KLT dan secara kuantitatif menggunakan metode 2,2-diphenyl-1-picrylhidrazil (DPPH) yang dinyatakan dengan nilai Inhibition Concentration 50 (IC50). Keberadaan senyawa
beraktivitas antioksidan akan mengubah warna larutan dari ungu menjadi kuning. Kontrol positif yang digunakan adalah rutin.
Hasil uji karakterisasi menunjukkan bahwa tumbuhan simplisia dan ekstrak metanol tumbuhan sisik naga pohon inang Teh telah memenuhi standar umum pada MMI. Hasil kuantitatif aktivitas antioksidan menunjukkan terdapat aktivitas antioksidan lemah dengan nilai IC50 (2.003,666 ± 31,021) µg/mL pada
ekstrak diklorometan, (582,166 ± 6,627) µg/mL pada ekstrak etil asetat, dan (160,800 ± 3,843) µg/mL pada ekstrak metanol.
xix
ABSTRACT
The used of natural materials more extensive because it has antioxidant activity. Antioxidant inhibit a free radical with the reaction of reactive free radical into a relatevely stable free radical. The study was conducted to determine the character and antioxidant activity of sisik naga plant (Pyrrosia piloselloides (L) M.G Price of host tree tea. It is one of the plant that have antioxidant activity.
The testing conducted with the characterization of simplicia and dichloromethane extract, ethyl acetate extract, and methanol extract of sisik naga plant of host tree tea following by a common parameters standard of Materia Media Indonesia 5th Volume. The antioxidant activity testing was conducted qualitatively by TLC and quantitatively with 2,2-diphenyl-1-picrylhidrazil (DPPH) method which expressed as the value Inhibition Concentration 50 (IC50).
The existence of active antioxidant compounds would change DPPH color from purple to yellow. Rutin was a control positive at this study.
The result showed that the characterization of simplicia and methanol extract of sisik naga plant of host tree tea to qualified by a common parameters standard of Materia Media Indonesia 5th Volume. The IC50 were (003.666 ±
31.021) µg/mL of dichloromethane extract, (582.166 ± 6.627) µg/mL of ethyl acetate extract, and (160.800 ± 3.8431) µg/mL of methanol extract. The quantitatively result of antioxidant activity was weak.
1
BAB I PENGANTAR
A. Latar Belakang
Pemakaian bahan alam saat ini semakin meluas seiring dengan besarnya
pemahaman masyarakat tentang peranannya dalam menghambat penyakit
degeneratif seperti penyakit jantung, kanker, serta gejala penuaan dini.
Masalah-masalah ini berkaitan dengan kemampuan antioksidan untuk bekerja sebagai
inhibitor reaksi oksidasi oleh radikal bebas reaktif yang menjadi salah satu
pencetus penyakit-penyakit di atas (Tahir, Wijaya, Widianingsih, 2003).
Tanpa disadari, dalam tubuh manusia terbentuk radikal bebas secara terus
menerus, baik melalui proses metabolisme sel normal maupun akibat respon
terhadap pengaruh dari luar tubuh, seperti paparan polusi lingkungan, ultraviolet,
dan asap rokok. Radikal bebas adalah atom atau molekul yang memiliki elektron
tidak berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan
menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara
menyerang dan mengikat elektron molekul sekitarnya misalnya protein, asam
lemak tak jenuh, dan lipoprotein, serta unsur DNA termasuk karbohidrat. Dari
molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal
bebas adalah asam lemak tak jenuh. Radikal bebas terbentuk melalui suatu reaksi
oksidasi, dimana radikal bebas yang terbentuk memiliki tingkat kereaktifan yang
tinggi sehingga dapat menyebabkan kerusakan sel. Kerusakan oksidatif yang
beragam penyakit seperti arterosklerosis, diabetes, sirosis, dan kanker
(Aruldoss and Thangavel, 2011).
Kerusakan yang disebabkan oleh radikal bebas dapat dihambat oleh
antioksidan. Antioksidan merupakan senyawa pemberi elektron atau reduktan,
dimana senyawa tersebut mampu menginaktivasi berkembangnya reaksi oksidasi.
Antioksidan menghambat suatu radikal bebas dengan cara bereaksi dengan radikal
bebas reaktif membentuk radikal bebas tak reaktif dan relatif stabil (Fessenden
dan Fessenden, 1982). Tubuh secara alami memiliki antioksidan untuk membatasi
kerusakan yang disebabkan oleh radikal bebas. Salah satu contoh antioksidan
alami yang terdapat pada tubuh adalah enzim SOD (superoxyde dismutase).
Secara alamiah tubuh memiliki antioksidan di dalamnya, namun jumlahnya cukup
terbatas, oleh karena itu dibutuhkan asupan antioksidan tambahan dari luar tubuh.
Sumber antioksidan dapat berasal dari alam maupun sintetik. Antioksidan
sintetik menunjukkan adanya potensi sebagai agen penyebab kanker
(karsinogenik). Beberapa antioksidan sintetik menunjukkan dampak yang
merugikan pada kesehatan, meskipun tidak beracun pada tingkat yang biasa
digunakan, tetapi antioksidan sintetik terlibat dalam menimbulkan beberapa
penyakit, misalnya kanker. Oleh karena itu antioksidan yang berasal dari alam
lebih aman untuk dikonsumsi.
Tumbuhan paku-pakuan mempunyai peranan yang sangat penting dalam
ekosistem hutan dan manusia. Ekosistem hutan, tumbuhan paku-pakuan berperan
dalam pembentukan humus dan melindungi tanah dari erosi, sedangkan dalam
kerajinan tangan, tanaman hias maupun sebagai obat-obatan tradisional
(Purnawati, Turnip, dan Lovadi, 2014).
Tumbuhan sisik naga (Pyrrosia piloselloides (L) M.G Price merupakan
salah satu contoh dari tumbuhan paku-pakuan dengan familia Polypodiaceae
berupa tumbuhan herba yang hidup epifit pada pohon inang. Tumbuhan sisik naga
dapat hidup epifit pada tanaman teh, kopi, jambu, palem dan lain-lain. Tanaman
teh bersifat antioksidan dengan kandungan kimia utama senyawa fenol seperti
katekin dan epigallokatekin gallat (EGCG). Pada penelitian sebelumnya diperoleh
hasil ekstrak diklorometan tumbuhan sisik naga berefek antioksidan dengan nilai
IC50 12,82 ug/mL (Wulandari, Elya, Hanani, and Pawitan, 2013). Terdapat
perbedaan aktivitas antioksidan ekstrak tumbuhan benalu dengan inang tanaman
kepel, kedondong, srikaya dan teh. Perbedaan pohon inang menyebabkan
perbedaan kandungan kimia dalam tanaman sehingga menyebabkan efek
antioksidannya juga berbeda.
Tumbuhan sisik naga mengandung senyawa flavonoid, tanin, steroid atau
triterpenoid, minyak atsiri dan glikosida yang diduga berpotensi sebagai
antikanker. Kanker merupakan penyakit mematikan yang sulit diobati dan
penyebab utama kematian seluruh dunia (Sahid, Pandiangan, Siahaan, dan
Rumondor, 2013). Pemilihan pelarut yang sesuai merupakan faktor penting dalam
proses ekstraksi. Pelarut yang digunakan adalah pelarut yang dapat menyari
sebagian besar metabolit sekunder dalam simplisia (Astarina, Astuti, dan
Penentuan karakter dilakukan dengan pemeriksaan mikroskopik
simplisia, penetapan kadar abu total, penetapan kadar abu tidak larut asam,
penetapan kadar sari larut air, penetapan kadar sari larut etanol, dan uji kandungan
kimia ekstrak menggunakan KLT.
Salah satu uji untuk menentukan aktivitas antioksidan adalah metode
DPPH (2,2-diphenyl-1-picrylhidrazyl). Pada metode ini penangkap radikal bebas
menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan
penghilangan warna. Nilai aktivitas antioksidan diketahui melalui nilai IC50 yang
merupakan konsentrasi yang menyebabkan penurunan 50% dari konsentrasi
DPPH awal (Sunarni, 2005). Digunakan metode DPPH pada penelitian ini karena
metode ini sederhana, cepat, dilakukan dalam suhu ruangan dan mudah untuk
skrining aktivitas penangkap radikal beberapa senyawa, selain itu metode ini
terbukti akurat dan praktis (Prakash, Rigelhof, and Miller, 2001).
B. Permasalahan
1. Bagaimana karakter simplisia dan ekstrak diklorometan, etil asetat, dan
metanol tumbuhan sisik naga pohon inang teh?
2. Bagaimana aktivitas antioksidan dengan metode DPPH pada ekstrak
diklorometan, etil asetat, dan metanol tumbuhan sisik naga pohon inang teh?
C. Keaslian Penelitian
Sejauh pengetahuan penulis, penelitian mengenai uji aktivitas
antioksidan menggunakan metode DPPH ekstrak diklorometan, etil asetat, dan
metanol tumbuhan sisik naga pohon inang tanaman teh belum ada. Penelitian lain
Wulandari, Elya, Hanani, dan Pawitan, 2013 yang menguji aktivitas antioksidan
tumbuhan sisik naga menggunakan metode DPPH tetapi tidak meneliti karakter
dari simplisia dan ekstrak tumbuhan sisik naga.
D. Manfaat Penelitian
1. Manfaat teoritis : penelitian ini diharapkan dapat memberikan informasi
mengenai karakter dan aktivitas antioksidan pada ekstrak diklorometan, etil
asetat, dan metanol tumbuhan sisik naga pohon inang teh yang diukur dengan
metode DPPH.
2. Manfaat praktis : penelitian ini diharapkan dapat memberikan informasi
tentang efek antioksidan yang terdapat pada tumbuhan sisik naga pohon inang
tanaman teh sehingga dapat dimanfaatkan untuk meningkatkan pertahanan
tubuh manusia dari radikal bebas.
E. Tujuan Penelitian
1. Tujuan umum : mengetahui karakter simplisia dan ekstrak diklorometan, etil
asetat, metanol tumbuhan sisik naga pohon inang tanaman teh dan aktivitas
antioksidan ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga
pohon inang tanaman teh menggunakan metode DPPH.
2. Tujuan khusus :
a. Mengetahui karakter simplisia dan ekstrak diklorometan, etil asetat, dan
b. Mengetahui nilai aktivitas antioksidan yang dinyatakan dengan nilai IC50
pada ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga
7
BAB II
PENELAAHAN PUSTAKA
A. Sisik Naga a. Klasifikasi Tumbuhan
Famili : Polypodiaceae
Genus : Drymoglossum
Spesies : Drymoglossum piloselloides (L.) C. Presl
Sinonim : Pyrrosia piloselloides (L.) M.G. Price
(United States Department of Agriculture, 2015).
Nama Daerah : Sumatra: picisan, sisik naga, sakat riburibu (Melayu).
Jawa: paku duduwitan (Sunda), pakis duwitan (Jawa)
(Anonim, 1989).
b. Morfologi Tumbuhan
Tumbuhan sisik naga merupakan tumbuh-tumbuhan epifit kecil
dengan akar rimpang tipis, merayap jauh. Daun satu sama lain tumbuh
pada jarak yang pendek, tangkai pendek, tidak terbagi, pinggir utuh,
berdaging atau seperti kulit, permukaan buah tidak berbulu sama sekali
atau sedikit (Heyne, 1987).
Daun tumbuhan paku ini bulat dan kecil yang menyerupai sisik
naga. Daunnya ada 2, yaitu tropofil dan sporofil. Pada jenis yang tropofil,
daun berbentuk bulat dan kecil, sedangkan jenis sporofil daunnya lebih
Sporangium terdapat pada daun fertil (Purnawati, Turnip, dan Lovadi
2014).
Tumbuh-tumbuhan ini tersebar di seluruh Asia Tropik, di daerah
dengan musim kering yang banyak hujan, dari daerah datar hingga ± 1000
m di atas permukaan laut, tumbuh secara umum pada batang, dahan pohon
dan perdu yang daunnya tidak begitu lebat (Heyne, 1987). Tumbuhan paku
ini ditemukan di hutan kerangas, rawa dan gambut, menempel pada batang
pohon atau hidupnya epifit. Akarnya menjulur dan melekat kuat pada
inangnya (Purnawati, Turnip, dan Lovadi, 2014).
Tumbuhan sisik naga (Pyrrosia piloselloides (L) M.G Price
merupakan salah satu familia Polypodiaceae berupa tanaman herba yang
hidup epifit pada pohon inang. Sisik naga dapat hidup epifit pada pohon
mangga, angsana, mahoni, flamboyan, ketapang, palma, nangka, kerai
payung, dan lain sebagainya (Sahid, Pandiangan, Siahaan, dan Rumondor,
2013).
c. Kandungan Kimia
Tumbuhan sisik naga mengandung senyawa flavonoid, tanin,
steroid atau triterpenoid, minyak atsiri dan glikosida falvonoid (Sahid,
Pandiangan, Siahaan, dan Rumondor, 2013). Metanol dapat melarutkan
flavonoid, glikosida flavonoid, tanin, steroid, senyawa fenolik, saponin,
dan alkaloid karena metanol merupakan pelarut universal yang memiliki
gugus polar (-OH) dan gugus non polar (CH3) sehingga dapat menarik
steroid dapat larut dalam senyawa non polar karena tersusun atas senyawa
triterpenoid. Triterpenoid tersusun dari rantai panjang hidrokarbon C30
yang menyebabkan sifatnya non polar sehingga dapat mudah terekstrak
dalam pelarut yang bersifat non polar. Senyawa triterpenoid juga dapat
terikat dengan gugus gula sehingga akan dapat tertarik oleh pelarut yang
bersifat semi polar bahkan pelarut polar (Astarina, Astuti, dan Warditiani,
2013). Digunakan 3 pelarut untuk ekstraksi yaitu diklorometan (non
polar), etil asetat (semi polar), dan metanol (polar) untuk menyari senyawa
metabolit sekunder. (Yuhernita dan Juniarti, 2011).
B. Kandungan Kimia Metabolit Sekunder
Metabolit diklasifikasikan menjadi 2, yaitu metabolit primer dan
metabolit sekunder. Metabolit primer dibentuk dalam jumlah terbatas dan
digunakan untuk pertumbuhan dan kehidupan organisme. Metabolit sekunder
adalah senyawa kimia yang dibentuk pada biosintesis metabolit sekunder yang
terjadi setelah berlangsungnya biosintesis metabolit primer (Nofiani, 2008).
Kandungan utama dalam metabolit sekunder antara lain, saponins,
cardiac, dan cyanogenic glycosides, terpenoids, sterols, phenols,
phenilpropanoids, alkaloids, flavonoids, and tannins. Untuk saponins, cardiac /
cyanogenic glycosides yang terbentuk dari glukosa selama proses fotosintesis,
bisa juga terbentuk melalui respirasi dari asam amino dan metabolisme terpenoid.
Beberapa tanaman memiliki kemampuan untuk memproduksi sianida dan
glikosida sianogenik yang merupakan sitotoksin kuat dan inhibitor kompetitif
polisiklik aglikon baik dari steroid kolin maupun terpenoid (Bianchi and Canuel,
2011).
Terpenoid dan steroid termasuk dalam derivative isoprena polimer.
Ketika 2 isoprena tersebut bergabung akan membentuk monoterpenoid,
sesquiterpenoid terbentuk dari 3 unit isoprena, dan diterpenoid terbentuk dari 4
unit isoprena. Terpenoid termasuk di dalam triterpenoid, yang terbentuk dari
polimerisasi 6 unit isoprena. Steroid terdapat pada hampir semua jenis tanaman
(gymnoesperm dan angiosperm), dan juga pada jamur dan hewan. Pada tumbuhan,
steroid dibiosintesis dari cycloartenol (Bianchi and Canuel, 2011).
Fenol dibiosintesis oleh beberapa rute yang berbeda, dan demikian
merupakan kelompok heterogen. Walaupun sering dibilang memiliki kesamaan
dengan alkohol karena adanya gugus hidroksil (-OH), fenol tetap diklasifikasikan
secara terpisah karena –OH tidak terikat pada atom karbon jenuh. Fenol juga
mudah teroksidasi dan dapat membentuk polimer, umumnya adalah shikimate. 2
jalur dasar yang terlibat adalah asam shikimat dan asam malonat. Turunan lain
dari fenol antara lain, phenylpropanolol, kumarin, asam sinamat, asam sinapinic
dan coniferyl alkohol, fenol dan turunannya ini termasuk intermediet dalam
biosintesis lignin (Bianchi and Canuel, 2011).
Alkaloid dihasilkan oleh dekarboksilasi asam amino atau transaminasi
dari aldehida. Biosintesis alkaloid yang berbeda membutuhkan enzim yang
berbeda. Pada biosintesis opiate, enzimnya adalah tirosin / dopa dekarboksilase
Flavonoid adalah senyawa polifenol pada tumbuhan yang melindungi
dari ultraviolet dan sebagai media interaksi antara tumbuhan dan mikroba.
Beberapa golongan flavonoid, antara lain, flavonones, anthocyanes yang memberi
pigmentasi pada bunga (merah, kuning, dll) serta jaringan tumbuhan lainnya.
Flavonoid berbeda dari senyawa fenolik yang lain dilihat dari tingkat oksidasi
pada pusat cincin pyran dan sifat biologisnya (Bianchi and Canuel, 2011).
Flavonoid akan menunjukkan pemadaman bercak pada UV 254 nm
sedangkan pada UV 366 nm bercak akan berfluorosensi kuning gelap, hijau, atau
biru. Digunakan deteksi kimia semprot AlCl3 akan mengeluarkan warna kuning
pada flavonoid (Sari, Djannah, dan Nurani, 2010).
Tanin adalah senyawa polifenol yang mengikat dan mengendapkan
protein, biasanya dibagi menjadi tanin terhidrolisis dan tanin terkondensasi. Tanin
terhidrolisis terdiri dari polyol-carbohydrate, dimana gugus -OH dari karbohidrat
sebagian atau seluruhnya diesterifikasi dengan golongan fenolik seperti asam
gallic dan asam ellagic. Tanin tersebut dihidrolisis oleh asam lemah untuk
produksi karbohidrat dan asam fenolat (Bianchi and Canuel, 2011).
C. Radikal Bebas
Dalam struktur atom dan molekul, elektron biasanya saling berpasangan
satu sama lainnya, setiap pasangan bergerak dalam orbitnya. Namun suatu kali
terdapat suatu spesies elektron yang keberadaanya mampu bergerak dalam orbital
namun dalam keadaan tanpa pasangan elektron. Spesies yang mampu bergerak
dalam orbitnya tanpa pasangan biasa masuk dalam istilah “free”. Atom tanpa
sehingga akan bersifat radikal dan akan mudah dalam berinteraksi dengan
senyawa-senyawa lain. Senyawa dengan elektron bebas tersebut disebut dengan
radikal bebas (Nonhebel and Walton, 1974).
Reaktivitas radikal bebas merupakan upaya untuk mencari pasangan
elektron. Sebagai dampak kerja radikal bebas tersebut, akan terbentuk radikal
bebas baru yang berasal dari atom atau molekul yang elektronnya diambil untuk
berpasangan dengan radikal sebelumnya. Namun, bila 2 senyawa radikal bertemu,
elektron-elektron yang tidak berpasangan dari kedua senyawa tersebut akan
bergabung dan membentuk ikatan kovalen yang stabil. Sebaliknya, bila senyawa
radikal bebas bertemu dengan senyawa bukan radikal bebas, akan terjai 3
kemungkinan :
1. Radikal bebas akan memberikan elektron yang tidak berpasangan (reduktor)
kepada senyawa bukan radikal bebas.
2. Radikal bebas menerima elektron (oksidator) dari senyawa bukan radikal
bebas.
3. Radikal bebas bergabung dengan senyawa bukan bebas (Winarsi, 2007).
Target utama radikal bebas adalah protein, asam lemak tak jenuh, dan
lipoprotein, serta unsur DNA termasuk karbohidrat. Dari ketiga molekul tersebut,
yang paling rentan terhadap radikal bebas adalah asam lemak tak jenuh, akibatnya
dinding sel menjadi rapuh karena membran sel yang rusak akibat radikal bebas.
Senyawa oksigen reaktif ini juga mampu merusak bagian dalam pembuluh darah
sehingga meningkatkan pengendapan kolesterol dan menimbulkan aterosklerosis.
mengacaukan sistem info genetika, dan berlanjut pada pembentukan sel kanker
(Winarsi, 2007).
D. Antioksidan
Radikal bebas dari berbagai bentuk selalu dihasilkan dalam metabolisme
spesifik dalam tubuh dan dicegah dengan antioksidan yang dapat menangkal
radikal bebas tersebut. Ketika tingkat radikal bebas lebih tinggi daripada
antioksidan yang ada, hal ini dapat mengakibatkan kerusakan oksidatif pada
jaringan dan bimolekul, sehingga dapat menyebabkan penyakit, seperti penyakit
kanker (Rajesh and Natvar, 2011).
Reactive Oxygen Species (ROS) adalah molekul oksigen yang sangat
reaktif dan di dalamnya pula mengandung radikal bebas. Jenis ROS termasuk
dalam radikal hidroksil, radikal anion superoksida, hidrogen peroksida, singlet
oksigen, radikal oksida nitrat, radikal hipoklorit, dan berbagai peroksida lipid.
Semuanya mampu bereaksi dengan membran lipid, asam nukleat, protein, dan
enzim, serta molekul kecil lainnya yang dapat menyebabkan kerusakan sel
(Pervical, 1998).
Untuk melindungi sel-sel dan sistem organ tubuh dari ROS, terdapat
beberapa komponen dalam tubuh manusia sebagai antioksidan baik endogen
maupun eksogen yang dapat menetralisir radikal bebas, antara lain:
1. Nutrient-derived antioxidant, seperti asam askorbat (vitamin C), tocopherols
dan tocotrienols (vitamin E), karotenoid, dan senyawa dengan bobot molekul
2. Antioxidant enzymes, seperti superokside dismutase, glutathione peroxidase,
dan glutathione reductase
3. Metal binding proteins, seperti ferritin lactoferrin, albumin, dan
caruloplasmin (Pervical, 1998).
Tabel. I Macam ROS dan Antioksidan Yang Menetralisir (Pervical, 1998).
ROS SENYAWA ANTIOKSIDAN
Radikal Hidroksil Vitamin C, glutation, flavonoid, asam lipoic
Radikal Superoksida Vitamin C, glutation, flavonoid, SOD Hidrogen Peroksida Vitamin C, glutation, betakaroten,
vitamin E, CoQ10, flavonoid, asam lipoic
Lemak Peroksida Betakaroten, vitamin E, ubiquinone, flavonoid, glutation peroksidase
Sistem antioksidan secara alami telah tersedia di dalam tubuh seperti
superoksida dismutase (SOD) dan glutation-s-transferase (GST) serta antioksidan
yang berasal dari makanan seperti senyawa fenolik dan flavonoid. Kekurangan
antioksidan di dalam tubuh dapat berakibat perlindungan tubuh terhadap serangan
radikal bebas lemah (Pujimulyani, Raharjo, Marsono, dan Santoso, 2010).
Efek antioksidan mengacu pada senyawa fenolik seperti, flavonoid, asam
fenolat, dan diterpen fenolik. Senyawa tersebut dapat menghambat autooksidasi
melalui mekanisme penangkapan radikal bebas dengan cara menyumbangkan satu
elektron yang tidak berpasangan dalam radikal. Setelah bereaksi dengan radikal
bebas dan menyumbangkan satu elektronnya antioksidan akan membentuk radikal
antioksidan namun radikal antioksidan bersifat tidak reaktif karena distabilkan
Aktivitas senyawa polifenol sebagai antioksidan meliputi 3 mekanisme,
antara lain:
1. Aktivitas penangkapan radikal bebas dengan proses transfer elektron
2. Mencegah spesies senyawa reaktif memproduksi katalisis melalui reaksi
logam
3. Interaksi dengan antioksidan lain untuk meningkatkan aktivitasnya
Antioksidan adalah suatu senyawa yang ketika dalam konsentrasi rendah
berada bersama substrat yang mudah teroksidasi secara signifikan mampu untuk
menunda atau menghambat reaksi oksidasi dari substrat tersebut (Cadenas and
Packer, 2002).
Secara umum antioksidan dibedakan menjadi dua yaitu antioksidan
enzimatis dan antioksidan non-enzimatis. Antioksidan enzimatis disebut juga
sebagai antioksidan primer atau antioksidan endogenus. Suatu senyawa dapat
dikatakan sebagai antioksidan primer apabila dapat memberikan atom hidrogen
secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang
terbentuk segera menjadi senyawa yang lebih stabil. Contoh antioksidan enzimatis
adalah superoksida dismutase (SOD), katalase, dan glutation peroksidase.
Antioksidan non enzimatis disebut juga sebagai antioksidan sekunder atau
antioksidan eksogenus. Kerja sistem antioksidan non enzimatis yaitu dengan cara
memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara
menangkap radikal bebas sehingga radikal bebas tidak akan bereaksi dengan
E. Metode Uji Aktivitas Antioksidan
Ada beberapa metode uji aktivitas antioksidan antara lain, metode
deoksiribosa, ABTS, DPPH, dll. Metode deoksiribosa atau hydroxyl radical
scavenging assay merupakan suatu metode pengukuran aktivitas antioksidan
untuk menghambat radikal bebas. Prinsipnya adalah radikal hidroksil yang
dihasilkan oleh reakis kompleks Re-EDTA akan menyerang deoksiribosa
sehingga menghasilkan malonaldehida (MDA), setelah pemanasan dengan
penambahan asam tiobarbiturat menghasilkan kromogen warna merah. Senyawa
yang memiliki aktivitas antioksidan akan memudarkan kromogen warna merah
(Halliwell, Gutteridge, and Auroma, 1987).
Metode ABTS (asam 2,2-azinobis(3-etilbenzatiazolin)-6-sulfonat)
merupakan senyawa radikal kation yang lebih reaktif dibandingkan dengan
metode DPPH. ABTS merupakan senyawa yang larut air dan stabil secara kimia.
Kemampuan relatif antioksidan untuk mereduksi ABTS dapat diukur dengan
spektrofotometri pada panjang gelombang 734 nm. perbandingan antara uji
sampel dengan baku diekspresikan sebagai TEAC (Trolox Equivalent Antioxidant
Activity) (Pokorny, Yanishlieva, and Gordon, 2001).
Metode DPPH memberikan informasi reaktivitas senyawa yang diuji
dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang
gelombang 517 nm dengan warna ungu. Penangkap radikal bebas menyebabkan
elektron menjadi berpasangan dengan adanya donor hidrogen yang kemudian
sebanding dengan jumlah elektron yang diambil, dan sebagai konsekuensinya
absorbansi dari DPPH juga menurun (Shekar and Anju, 2014).
Aktivitas antioksidan merupakan kemampuan suatu senyawa atau ekstrak
untuk menghambat reaksi oksidasi yang dapat dinyatakan dengan persen
penghambatan. Parameter yang dipakai untuk menunjukan aktivitas antioksidan
adalah harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition
Concentration (IC50), yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50% (Molyneux, 2004).
Gambar 1. Penangkapan radikal bebas metode DPPH (Prakash, Rigelhof, and Miller, 2001).
Kelebihan metode DPPH antara lain sederhana, cepat, dilakukan dalam
suhu ruangan dan mudah untuk skrining aktivitas penangkap radikal beberapa
senyawa, selain itu metode ini terbukti akurat dan praktis. Kelemahannya hanya
dapat larut dalam media organic (terutama alkohol), tidak pada media aqueous
sehingga membatasi kemampuannya dalam penentuan peran antioksidan
F. Tahap Pembuatan Simplisia
Tahap pembuatan simplisia antara lain, sortasi basah, pencucian,
perajangan, pengeringan, sortasi kering, pengepakan, dan penyimpanan, serta
pemeriksaan mutu (Prasetyo dan Inoriah, 2013).
Tumbuhan yang didapatkan disortasi basah terlebih dahulu untuk
memisahkan kotoran-kotoran atau bahan-bahan asing selain bahan simplisia,
misalnya, tanah, kerikil, rumput, batang, daun, akar yang telah rusak, serta
kotoran lain harus dibuang. Tanah mengandung bermacam-macam mikroba dalam
jumlah yang tinggi. Oleh karena itu pembersihan simplisia dari tanah yang terikut
dapat mengurangi jumlah mikroba awal. Kemudian dilakukan pencucian untuk
menghilangkan tanah dan kotoran lain yang melekat pada bahan simplisia
(Prasetyo dan Inoriah, 2013).
Pencucian dilakukan dengan menggunakan air bersih mengalir pada
simplisia. Cara ini sangat mempengaruhi jenis dan jumlah mikroba awal simplisia.
Misalnya jika air yang digunakan untuk pencucian kotor, maka jumlah mikroba
pada permukaan bahan simplisia dapat bertambah dan air yang terdapat pada
permukaan bahan tersebut dapat mempercepat pertumbuhan mikroba (Prasetyo
dan Inoriah, 2013).
Setelah pencucian, dilakukan pengeringan dengan tujuan untuk
mendapatkan simplisia yang tidak mudah rusak, sehingga dapat disimpan dalam
waktu yang lebih lama. Dengan mengurangi kadar air dan menghentikan reaksi
tersisa dalam simplisia pada kadar tertentu merupakan media pertumbuhan
kapang jasad renik lainnya. Enzim dalam sel, masih dapat bekerja menguraikan
senyawa aktif sesaat setelah sel mati dan selama bahan simplisia tersebut masih
mengandung kadar air tertentu. Pada tumbuhan yang masih hidup pertumbuhan
kapang dan reaksi enzimatik yang merusak itu tidak terjadi karena adanya
keseimbangan antara proses-proses metabolisme, yakni proses sintesis,
transformasi, dan penggunaan isi sel. Reaksi enzimatik tidak berlangsung bila
kadar air dalam simplisia kurang dari 10% (Prasetyo dan Inoriah, 2013).
Pengeringan dilakukan di bawah sinar matahari dengan cara simplisia
diletakkan 1 lapis dalam tempat bersih kemudian ditutup dengan kain hitam
kemudian dimasukkan di dalam oven. Hal-hal yang perlu diperhatikan selama
proses pengeringan adalah suhu udara, kelembaban udara, aliran udara, waktu
pengeringan, dan luas permukaan bahan (Prasetyo dan Inoriah, 2013).
Pembuatan simplisia dengan cara menjemur di bawah sinar matahari
langsung memiliki banyak kelemahan yaitu sangat tergantung dengan cuaca, suhu
yang tidak terkontrol dan rawan terhadap kontaminasi. Suhu yang tidak terkontrol
dapat menyebabkan kerusakan pada bahan diantaranya, terpenoid hidrokarbon,
minyak atsiri, seskuiterpen lakton, dan senyawa-senyawa yang memiliki ikatan
rangkap (Ma’mun et al, 2006).
Sortasi setelah pengeringan sebenarnya merupakan tahap akhir
pembuatan simplisia. Tujuan untuk memisahkan benda-benda asing seperti
bagian-bagian tanaman yang tidak diinginkan dan pengotor-pengotor lain yang
penyimpanan menggunakan wadah yang bersifat tidak beracun dan tidak bereaksi
dengan isinya sehingga tidak menyebabkan terjadinya reaksi serta penyimpangan
warna, bau, rasa, dan sebagainya. Selain itu wadah harus melindungi simplisia
dari cemaran mikroba, kotoran dan serangga, serta mempertahankan senyawa
aktif yang mudah menguap atau terhindar dari sinar matahari (Prasetyo dan
Inoriah, 2013).
G. Ekstraksi
Ekstraksi merupakan pemisahan zat aktif jaringan tanaman atau hewan
dari komponen inaktif atau inert dengan menggunakan pelarut yang selektif sesuai
dengan prosedur standar. Tujuan dari prosedur standar untuk ekstraksi simplisia
adalah mendapatkan zat aktif yang diinginkan. Ekstrak yang diperoleh mungkin
siap untuk digunakan sebagai agen obat dalam bentuk tincture dan ekstrak cair,
atau dapat diproses lebih lanjut untuk dimasukkan dalam bentuk sediaan seperti
tablet atau kapsul. Ekstrak yang diperoleh juga dapat difraksinasi untuk
mengisolasi suatu senyawa kimia yang lebih spesifik. Beberapa teknik ekstraksi
yang sering digunakan adalah maserasi, perkolasi, digesti, dan sokletasi (Handa,
Khanuja, Longo, and Rakesh, 2008). Terdapat 2 cara ekstraksi menggunakan
pelarut, yaitu cara dingin dan cara panas. Untuk yang cara dingin antara lain:
1. Maserasi
Proses ekstraksi simplisia menggunakan pelarut beberapa kali
pengocokan atau pengadukan pada temperatur ruangan. Secara teknologi,
maserasi termasuk ekstraksi dengan prinsip metode pencapaian
pengadukan secara kontinu. Remaserasi berarti dilakukan pengulangan
ekstraksi dengan penambahan pelarut setelah dilakukan penyarian maserat
pertama dan seterusnya. Metode ini merupakan pilihan terbaik untuk
ekstraksi simplisia yang mengandung senyawa-senyawa yang termolabil
(Depkes RI, 2000).
2. Perkolasi
Ekstraksi dengan pelarut yang selalu baru sampai sempurna yang
umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus-menerus sampai diperoleh ekstrak
yang jumlahnya 1-5 kali bahan (Depkes RI, 2000).
Untuk ekstraksi cara panas, antara lain:
1. Digesti
Maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang
lebih tinggi daripada temperatur ruangan, yaitu umumnya dilakukan pada
temperatur 40º-50º C (Depkes RI, 2000).
2. Sokletasi
Ekstraksi menggunakan pelarut yang selalu baru yang umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
jumlah pelarut relatif konstran dengan adanya pendingin balik. Metode ini
tidak dapat digunakan untuk senyawa-senyawa yang termolabil karena
pemanasan yang dapat menyebabkan degradasi senyawa tersebut (Depkes
3. Refluks
Ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu
tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya
pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampa 3-5 kali sehinggan dapat diperoleh proses ekstraksi
sempurna (Depkes RI, 2000).
4. Infus
Ekstraksi dengan pelarut air pada temperatur penangas air (bejana
infus tercelup dalam penangas air mendidih, temperatur 96º-98º C selama
15-20 menit (Depkes RI, 2000).
5. Dekok
Infus pada waktu yang lebih lama (≥ 30 menit) dan temperatur sampai
titik didih air. Ekstraksi ini digunakan untuk simplisia yang mengandung
senyawa larut air dan stabil terhadap pemanasan (Depkes RI, 2000).
H. Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh
suatu proses migrasi diferensial dinamis dalam sistem yang terdiri dari 2 fase,
salah satu diantaranya bergerak secara berkesinambungan dengan arah tertentu
dan di dalamnya zat-zat itu menunjukkan perbedaan mobilitas disebabkan adanya
perbedaan dalam absorbsi, partisi, kelarutan, tekanan uap, ukuran molekul atau
kerapatan muatan ion (Kemenkes RI, 2013).
Teknik kromatograafi umum membutuhkan zat terlarut terdistribusi di
melalui media, hingga terpisah dari zat terlarut lainnya. Umumnya zat terlarut
dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau
gas yang disebut eluen. Fase diam dapat bertindak sebagai zat penjerap seperti
halnya penjerap alumina yang diaktifkan, silika gel, dan resin penukar ion, atau
dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam
dan fase gerak (Kemenkes RI, 2013).
Jenis-jenis kromatografi dalam analisis kualitatif dan kuantitatif yang
digunakan dalam penetapan kadar dan pengujian FHI adalah Kromatografi Lapis
Tipis (KLT), Kromatografi Gas (KG), dan Kromatografi Cair Kinerja Tinggi
(KCKT). KLT umumnya lebih banyak digunakan untuk tujuan identifikasi,
karena mudah dan sederhana serta memberikan pilihan fase diam yang lebih luas
dan berguna untuk pemisahan masing-masing senyawa secara kuantitatif dari
suatu campuran (Kemenkes RI, 2013).
Dalam KLT, zat penjerap merupakan lapisan tipis serbuk halus yang
dilapiskan pada lempeng kaca, plastik, atau logam secara merata, umumnya
digunakan lempeng kaca. KLT dapat memisahkan senyawa berdasarkan tigkat
kepolarannya. Perbandingan jarak rambat suatu senyawa tertentu terhadap jarak
rambat fase gerak, diukur dari titik penotolan sampai titik yang memberikan
intensitas maksimum pada bercak, dinyatakan sebagai harga Rf (Kemenkes RI,
2013). Petunjuk dalam memilih dan mengoptimasi fase gerak pada KLT, antara
1. Fase gerak harus memiliki kemurnian yang sangat tinggi karena KLT
merupakan teknik yang sensitif.
2. Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf antara
0,2-0,8 untuk memaksimalkan pemisahan.
3. Untuk pemisihan dengan menggunakan fase diam polar seperti silika gel,
polaritas fase gerak akan meentukan kecepatan migrasi solut yang berarti juga
menentukan nilai Rf.
4. Solut-solut ionik dan solut-solut polar lebih baik digunakan campuran pelarut
sebagai fase geraknya, seperti campuran air dan metanol dengan
perbandingan tertentu (Gandjar dan Rohman, 2007).
I. Spektrofotometri
Spektrofotometri UV/Visibel memiliki prinsip yaitu radiasi pada rentang
panjang gelombang 200–700 nm dilewatkan melalui suatu larutan senyawa.
Elektron pada ikatan dalam molekul menjadi tereksitasi sehingga berada pada
keadaan energi yang lebih tinggi dalam proses menyerap sejumlah energi yang
melewati larutan tersebut. Semakin longgar elektron tersebut ditahan di dalam
ikatan molekul, panjang gelombang radiasi yang diserap semakin panjang
(Watson, 2010).
Absorpsi cahaya ultraviolet atau cahaya tampak mengakibatkan adanya
transisi elektronik, yaitu perpindahan elektron dari orbital dasar yang energinya
rendah menuju keadaan tereksitasi yang energinya lebih tinggi. Panjang
gelombang cahaya uv atau cahaya tampak bergantung pada mudahnya
untuk memindahkan elektron, akan menyerap pada panjang gelombang yang lebih
pendek dan begitu sebaliknya (Fessenden dan Fessenden, 1982).
Hal-hal yang harus diperhatikan dalam analisis spektrofotometri UV-Vis:
a. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal yang perlu dilakukan jika senyawa yang dianalisis tidak menyerap
pada daerah tersebut. Cara yang digunakan adalah dengan merubah menjadi
senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang
digunakan harus memenuhi beberapa persyaratan yaitu:
Reaksinya selektif dan sensitif
Reaksinya cepat, kuantitatif, dan reprodusibel
Hasil reaksi stabil dalam dalam jangka waktu yang lama
Keselektifan dapat dinaikkan dengan mengatur pH, pemakaian masking agent
atau penggunaan teknik ekstraksi (Gandjar dan Rohman, 2007).
b. Waktu Operasional (Operating Time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau
pembentukan warna. Tujuannya adalah untuk mengetahui waktu pengukuran
yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara
waktu pengukuran dengan absorbansi larutan (Gandjar dan Rohman, 2007).
Pada saat awal terjadi reaksi, absorbansi senyawa yang berwarna ini
meningkat sampai waktu tertentu hingga diperoleh absorbansi yang stabil.
tersebut menjadi rusak atau terurai sehingga intensitas warnanya turun
akibatnya absorbansinya juga turun (Gandjar dan Rohman, 2007).
c. Pemilihan Panjang Gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah
panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih
panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan
antara absorbansi dengan panjang gelombang dari suatu larutan baku pada
konsentrasi tertentu (Gandjar dan Rohman, 2007).
Ada beberapa alasan mengapa harus menggunakan panjang gelombang
maksimal, yaitu:
Pada panjang gelombang maksimal, bentuk kurva kepekaannya juga
maksimal karena pada panjang gelombang maksimal tersebut, perubahan
absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
Di sekitar panjang gelombang maksimal, bentuk kurva absorbansi datar
dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh
pemasangan ulang panjang gelombang akan kecil sekali, ketika
digunakan panjang gelombang maksimal (Gandjar dan Rohman, 2007).
d. Pembuatan Kurva Baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai
konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi
diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi
disebabkan oleh kekuatan ion yang tinggi, perubahan suhu, dan reaksi ikutan
yang terjadi (Gandjar dan Rohman, 2007).
e. Pembacaan Absorbansi Sampel atau Cuplikan
Absorban yang terbaca hendaknya antara 0,2 - 0,8 atau 15% - 70% jika
dibaca sebagai transmitans. Anjuran ini ini berdasarkan anggapan bahwa
kesalahan dalam pembacaan T adalah 0,005 atau 0,5% (Gandjar dan Rohman,
2007).
J. Landasan Teori
Sisik naga merupakan tumbuh-tumbuhan epifit kecil dengan akar
rimpang tipis, merayap jauh. Daun satu sama lain tumbuh pada jarak yang
pendek, tangkai pendek, tidak terbagi, pinggir utuh, berdaging atau seperti kulit,
permukaan buah tidak berbulu sama sekali atau sedikit. Tumbuhan sisik naga
mengandung minyak atsiri, terpenoid, fenol, tanin, flavonoid, saponin, steroid.
Penentuan karakter simplisia dan ekstrak diklorometan, etil asetat, dan
metanol tumbuhan sisik naga dilakukan dengan uji pemeriksaan mikroskopik
simplisia berupa serbuk simplisia, akar, batang dan daun, kemudian penetapan
kadar abu total, penetapan kadar abu tidak larut air, penetapan kadar sari tidak
larut asam, penetapan kadar sari larut air, penetapan kadar sari larut etanol, dan uji
kandungan kimia ekstrak menggunakan KLT.
Tumbuhan sisik naga mengandung senyawa flavonoid, tanin, steroid atau
triterpenoid, minyak atsiri dan glikosida falvonoid (Sahid, et al, 2013). Metanol
dapat melarutkan flavonoid, glikosida flavonoid, tanin, steroid, senyawa fenolik,
gugus polar (-OH) dan gugus non polar (CH3) sehingga dapat menarik
analit-analit yang bersifat polar maupun non polar. Minyak atsiri dan steroid dapat larut
dalam senyawa non polar karena tersusun atas senyawa triterpenoid. Triterpenoid
tersusun dari rantai panjang hidrokarbon C30 yang menyebabkan sifatnya non
polar sehingga dapat mudah terekstrak dalam pelarut yang bersifat non polar.
Metode DPPH memberikan informasi reaktivitas senyawa yang diuji dengan
suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang
517 nm dengan warna ungu. Penangkap radikal bebas menyebabkan elektron
menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang
sebanding dengan jumlah elektron yang diambil.
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition
Concentration (IC50), yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50%.
K. Hipotesis
1. Karakter simplisia dan ekstrak diklorometan, etil asetat, dan metanol tumbuhan
sisik naga pohon inang tanaman teh sudah memenuhi standar.
2. Ekstrak diklorometan, etil asetat, dan metanol tumbuhan sisik naga pohon
29
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental dengan rancangan
acak lengkap pola searah. Merupakan jenis penelitian eksperimental karena
penelitian ini mencari hubungan sebab akibat dari ekstrak diklorometan, etil
asetat, dan metanol tumbuhan sisik naga yang menempel pada pohon inang teh
yang digunakan dengan nilai IC50 yang dihasilkan. Rancangan acak karena
pengambilan sampel tumbuhan sisik naga yang menempel pada pohon inang teh
dilakukan secara acak, tidak ada pemilihan secara khusus. Rancangan lengkap
karena terdapat kontrol positif, kontrol negatif dan kelompok perlakuan.
B. Variabel
1. Variabel bebas dalam penelitian ini adalah konsentrasi ekstrak diklorometan,
etil asetat, dan metanol tumbuhan sisik naga pohon inang teh.
2. Variabel tergantung dalam penelitian ini adalah aktivitas antioksidan
tumbuhan sisik naga pohon inang teh (%IC).
3. Variabel pengacau terkendali dalam penelitian ini adalah waktu pemanenan,
waktu inkubasi, suhu pada saat inkubasi.
4. Variabel pengacau tak terkendali dalam penelitian ini adalah kondisi cuaca
pada tempat tumbuh tumbuhan, umur tumbuhan yang dipanen, dan
C. Definisi Operasional
1. Ekstrak diklorometan tumbuhan sisik naga pohon inang teh adalah hasil dari
proses maserasi simplisia kering tumbuhan sisik naga pohon inang teh yang
menggunakan menggunakan pelarut dikloromethan sampai filtrat jernih.
2. Ekstrak etil asetat tumbuhan sisik naga pohon inang teh adalah hasil dari
proses maserasi simplisia kering tumbuhan sisik naga pohon inang teh yang
menggunakan menggunakan pelarut asetat sampai filtrat jernih.
3. Ekstrak metanol tumbuhan sisik naga pohon inang teh adalah hasil dari
proses maserasi simplisia kering tumbuhan sisik naga pohon inang teh yang
menggunakan menggunakan pelarut metanol sampai filtrat jernih.
4. Penetapan karakter tumbuhan sisik naga pohon inang teh meliputi
pemeriksaan mikroskopik, penetapan kadar abu total, penetapan kadar abu
tidak larut asam, penetapan kadar sari larut air, penetapan kadar sari larut
etanol, dan uji kandungan kimia ekstrak sisik naga.
5. Persen inhibition concentration (%IC) adalah nilai yang diperoleh dari selisih
absorbansi larutan kontrol (tanpa sampel sisik naga) dan larutan dengan
sampel sisik naga dibagi larutan kontrol dikalikan 100%.
6. Inhibition Concentrations 50 (IC50) merupakan nilai konsentrasi ekstrak
tanaman sisik naga yang menghasilkan penangkapan 50% radikal bebas
D. Bahan dan Alat Penelitian 1. Bahan Penelitian
Tumbuhan
Tumbuhan yang diteliti adalah tumbuhan sisik naga yang tumbuh
pada pohon inang teh diperoleh dari perkebunan teh di daerah
Ngargoyoso, Karanganyar, Jawa Tengah dan telah diidentifikasi di
Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata
Dharma.
Bahan Kimia
Air suling, bahan kualitas teknis Brataco Chemica, yaitu
dikorometan, etil asetat, metanol, bahan berkualitas pro analitik (E.Merck)
yaitu, toluen, asam asetat, metanol, n-butanol, lempeng silika, eugenol,
alumunium klorida, besi 3 klorida, dan bahan kualitas pro analitik Sigma
Chem Co., USA meliputi, DPPH, Rutin, Asam tanat, β sitosterol.
2. Alat penelitian
Alat penggiling, bejana maserasi, peralatan kromatografi lapis tipis,
pH meter (Eutech Instrumen pH 510) penguap putar (rotary evaporator)
(Buchi R-205, Jerman), spektrofotometer UV-Vis (Hitachi U 2000, Jepang),
E. Tata Cara Penelitian 1. Determinasi Tumbuhan
Determinasi tumbuhan sisik naga pohon inang teh dilakukan di
Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta menggunakan bahan acuan United States Department of
Agriculture.
2. Pengumpulan Tumbuhan Sisik Naga
Tumbuhan sisik naga pohon inang tanaman teh diambil dari
perkebunan Teh Ngargoyoso, Karanganyar, Jawa Tengah tanggal 16 Mei 2015
pukul 06.00 WIB.
3. Pembuatan Simplisia Tumbuhan Sisik Naga
Tumbuhan sisik naga pohon inang teh yang didapat dilakukan sortasi
basah untuk menghilangkan pengotor serta tumbuhan lain. Setelah itu
pencucian dilakukan untuk menghilangkan kotoran yang menempel seperti
debu dan serangga. Bagian daun dipisahkan dari bagian tumbuhan lain yang
terikut saat pengumpulan. Kemudian dicuci dengan air mengalir untuk
menghilangkan kotoran yang melekat lalu ditiriskan sampai sisa air
menghilang. Tumbuhan sisik naga dikeringkan dalam oven pada suhu 40º C.
Dikatakan kering jika daun dapat hancur ketika diremas dengan tangan.
Setelah kering, tumbuhan sisik naga pohon inang teh disortasi kering untuk
menghilangkan pengotor-pengotornya. Tumbuhan sisik naga pohon inang teh
yang telah disortasi kering kemudian diserbuk menggunakan blender, lalu
4. Ekstraksi Tumbuhan Sisik Naga
Serbuk kering tumbuhan sisik naga pohon inang teh ditimbang kurang
lebih 100 g dimaserasi dengan pelarut diklorometan. Kemudian dilakukan
remaserasi dengan pelarut sama sampai filtrat hasil maserasi jernih. Hasil
maserasi disaring dan filtrat yang diperoleh dipekatkan menggunakan vacuum
rotary evaporator pada suhu lebih kurang 500 C sehingga diperoleh ekstrak
kental diklorometan. Ampas dikeringkan kemudian dimaserasi kembali
dengan pelarut etil asetat dan diremaserasi hingga hasil maserasi jernih. Hasil
maserasi disaring dan filtrat yang diperoleh dipekatkan menggunakan vacuum
rotary evaporator pada suhu lebih kurang 500 C sehingga diperoleh ekstrak
kental diklorometan. Ampas dikeringkan kemudian dimaserasi kembali
dengan pelarut metanol dan diremasirasi hingga hasil maserasi jernih kemudian
hasil maserasi disaring dan filtrat yang diperoleh dipekatkan dengan vacuum
rotary evaporator pada suhu lebih kurang 500 C sehingga diperoleh ekstrak
kental etil asetat dan ekstrak kental metanol. Masing-masing ekstrak ditimbang
dan dihitung rendemen ekstrak.
5. Karakterisasi Ekstrak
a. Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik tumbuhan sisik naga pohon inang teh
dilakukan dengan menggunakan bagian dari penampang melintang dan
penampang membujur daun serta batang tumbuhan sisik naga dan serbuk
pemotong khusus dengan bantuan kloralhidrat yang kemudian dipanaskan
untuk melihat fragmen pengenal pada tumbuhan.
b. Penetapan Kadar Abu Total
Timbang seksama 2 sampai 3 g bahan uji yang telah dihaluskan
dan masukkan ke dalam krus silikat yang telah dipijar dan ditara, pijarkan
perlahan-lahan hingga arang habis, dinginkan dan timbang. Jika dengan cara
ini arang tidak dapat dihilangkan, tambahkan air panas, aduk, saring melalui
kertas saring bebas abu. Pijarkan kertas saring beserta sisa penyaringan
dalam krus yang sama. Masukkan filtrat ke dalam krus, uapkan dan pijarkan
hingga bobot tetap.kadar abu total dihitung terhadap berat bahan uji,
dinyatakan dalam % b/b.
c. Penetapan Kadar Abu Tidak Larut Asam
Didihkan abu yang diperoleh pada penetapan kadar abu total
dengan 25 mL asam klorida ence LP selama 5 menit. Kumpulkan bagian
yang tidak larut dalam asam, saring melalui kertas saring bebas abu, cuci
dengan air panas, pijarkan dalam krus hingga bobot tetap. Kadar abu yang
tidak larut dalam asam dihitung terhadap berat bahan uji, dinyatakan dalam
% b/b.
d. Penetapan Kadar Sari Larut Air
Timbang seksama lebih kurang 5 g serbuk (4/18) yang telah
dikeringkan di udara. Masukkan ke dalam labu bersumbat, tambahkan 100
mL air jenuh kloroform, kocok berkali-kali selama 6 jam pertama, biarkan