PENJABARAN PERSAMAAN KEADAAN GAS IDEAL DAN GAS REAL DENGAN MENGGUNAKAN KONSEP MEKANIKA KUANTUM
ABSTRAK
Telah dilakukan penjabaran persamaan keadaan gas ideal dan gas real dengan menggunakan konsep mekanika kuantum. Persamaan keadaan gas ideal dapat diperoleh dengan menganggap potensial gas berbentuk potensial osilator harmonik, sedangkan persamaan keadaan gas real dapat diperoleh dengan menggunakan potensial osilator harmonik terganggu.
DERIVATION OF THE STATE EQUATIONS OF IDEAL AND REAL GASES USING QUANTUM MECHANICAL CONCEPTS
ABSTRACT
The equations of state for both ideal and real gases have been performed using quantum mechanical concepts. The equation of state for an ideal gas can be obtained by assuming that the gas potential has an oscillator harmonic potential, meanwhile the equation of state for a real gas can be obtained using the perturbed oscillator harmonic potential.
Skripsi
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Sains
Program Studi Fisika
Oleh:
Ratna Listiyani
NIM : 023214017
PROGRAM STUDI FISIKA JURUSAN FISIKA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
DERIVATION OF THE STATE EQUATIONS OF IDEAL AND REAL
GASES USING QUANTUM MECHANICAL CONCEPTS
SKRIPSI
Presented as Partial Fulfillment of the Requirements to obtain the Sarjana Sains Degree In Physics
By: Ratna Listiyani NIM : 023214017
PHYSICS STUDY PROGRAM PHYSICS DEPARTEMENT
SCIENCE AND TECHNOLOGY FACULTY SANATA DHARMA UNIVERSITY
MOTTO DAN PERSEMBAHAN
“ Live is a great big canvas and you
should throw all the paint on it you
can “ (Dany Kave)
PERSEMBAHAN :
“Skripsi ini aku persembahkan untuk ayah dan ibuku,
adik-adikku yudha, icha, dan surya yang selalu menyayangiku”
PENJABARAN PERSAMAAN KEADAAN GAS IDEAL DAN GAS REAL DENGAN MENGGUNAKAN KONSEP MEKANIKA KUANTUM
ABSTRAK
Telah dilakukan penjabaran persamaan keadaan gas ideal dan gas real dengan menggunakan konsep mekanika kuantum. Persamaan keadaan gas ideal dapat diperoleh dengan menganggap potensial gas berbentuk potensial osilator harmonik, sedangkan persamaan keadaan gas real dapat diperoleh dengan menggunakan potensial osilator harmonik terganggu.
DERIVATION OF THE STATE EQUATIONS OF IDEAL AND REAL GASES USING QUANTUM MECHANICAL CONCEPTS
ABSTRACT
The equations of state for both ideal and real gases have been performed using quantum mechanical concepts. The equation of state for an ideal gas can be obtained by assuming that the gas potential has an oscillator harmonic potential, meanwhile the equation of state for a real gas can be obtained using the perturbed oscillator harmonic potential.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala kasih dan
karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi
ini berjudul : ”PENJABARAN PERSAMAAN KEADAAN GAS IDEAL DAN
GAS REAL DENGAN MENGGUNAKAN KONSEP MEKANIKA KUANTUM”, yang diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada Program Studi Fisika Universitas Sanata Dharma Yogyakarta.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu
penulis baik berupa waktu, tenaga, bimbingan, dorongan, dan sumbang saran yang
penulis butuhkan dalam penyelesaian skripsi ini. Pada kesempatan ini penulis ingin
mengucapkan terima kasih kepada:
1. Drs. Drs. Vet. Asan Damanik, M.Si. selaku dosen pembimbing yang
telah banyak meluangkan waktu untuk membimbing, mendampingi,
memberikan dorongan dan semangat dalam pengerjaan tugas akhir ini.
2. Dr. Ign. Edi Santosa, M.S. selaku dosen pendamping akademik yang
sudah banyak memberikan pendampingan selama menjadi mahasiswa.
3. Ir. Sri Agustini Sulandari, M.Si. selaku kaprodi Fisika dan dosen yang
senantiasa memberikan kemudahan dalam memberikan materi kuliah.
4. Dwi Nugraheni Rositawati, S.Si., M.Si. selaku dosen penguji yang
telah meluangkan waktu untuk membaca dan mengkoreksi skripsi ini.
5. A. Prasetyadi, S.Si., M.Si. sebagai dosen yang telah memberikan
pengajaran saat penulis menempuh masa perkuliahan.
6. Ayah dan Ibuku serta adik-adikku tercinta yang tanpa henti
memberikan dukungan, dorongan, dan doanya sehingga penulis dapat
menyelesaikan tugas akhir ini.
7. Ken yang selalu berusaha memberikan perhatian, semangat, dan
seluruh kasih sayangnya pada waktu penulis mengerjakan skripsi ini.
8. Manggar, Frida, mbak Ayuk, Sisca dan mbak Yuni yang telah menjadi
sahabat yang sangat baik dan selalu menyayangiku dengan tulus.
9. Mbak Yamidah dan mbak Tatik yang selalu sabar mengajariku ketika
menemui kesulitan dalam mengerjakan skripsi ini.
10.Mas Toro, mbak Lia, mas Yanto, mbak Prapti, mas Edi, mbak Sasti,
dan seluruh keluarga besar yang tidak pernah lelah memberikan
dukungannya.
11.Teman-teman fisika diantaranya Adet, Danang, Inke, Bambang, Iman,
Adit, Lius, Hari, Enzo, Minto, Ismeth, Mamat, Ridwan, Ade, Siska,
Sujad dan Dian yang telah memberikan kenangan manis saat
bersama-sama menempuh masa perkuliahan.
12.Seluruh Staff Pengajar Jurusan Fisika yang telah memberikan
pengajaran dan pendampingan.
Penulis menyadari bahwa dalam penulisan ini masih banyak kekurangan, oleh
karena itu penulis sangat mengharapkan saran dan kritik yang sangat membangun
dari berbagai pihak.
Akhirnya penulis berharap semoga skripsi ini dapat bermanfaat bagi dunia
pendidikan dan khususnya pembaca.
Yogyakarta, September 2008
Penulis
DAFTAR ISI
HALAMAN JUDUL ……… i
HALAMAN PERSETUJUAN PEMBIMBING……… ii
HALAMAN PENGESAHAN .….……… iii
HALAMAN MOTO PERSEMBAHAN ………...………… iv
ABSTRAK ……… v
ABSTRACT ….……… vi
KATA PENGANTAR …..……… vii
PERNYATAAN KEASLIAN KARYA……… x
DAFTAR ISI ………. xi
BAB I. PENDAHULUAN………. 1
1.1. Latar Belakang ……… 1
1.2. Perumusan Masalah ………. 3
1.3. Batasan Masalah ……...………. 4
1.4. Tujuan dan Manfaat Penelitian ……… 4
1.4.1. Tujuan Penelitian …..……… 4
1.4.2. Manfaat Penelitian .…...……… 4
1.5. Sistematika Penulisan …...………....………… 5
BAB II. DASAR TEORI …...……… 6
2.1. Teori kinetik Gas ….….………...……… 6
2.2. Osilator Harmonik …...……… 16
2.3. Osilator Harmonik yang Terganggu …...……..………… 22
Bab III. Metodologi Penelitian …...……… 28
3.1. Jenis Penelitian …...……… 28
3.2. Sarana Penelitian …...……… 28
3.3. Langkah-Langkah Penelitian …...……… 28
Bab IV. Hasil dan Pembahasan …...……… 29
4.1. Hasil Perhitungan ……….. 29
4.1.1. Persamaan Keadaan Gas Ideal…………...……….. 29
4.1.2. Persamaan Keadaan Gas Real ……….……… 31
4.2. Pembahasan ……… 33
BAB V. PENUTUP ……… 35
5.1. Kesimpulan …...……… 35
5.2. Saran …...……….… 35
DAFTAR PUSTAKA ……… 36
LAMPIRAN
BAB I
PENDAHULUAN
1.1.Latar Belakang
Secara fenomenologis dikenal tiga macam wujud zat, yaitu padat, cair, dan
gas. Masing-masing wujud zat tersebut memiliki sifat makroskopik yang berbeda.
Wujud zat padat memiliki kerapatan tinggi dan bentuk ruang yang tetap. Wujud
zat cair memiliki kerapatan yang lebih rendah dibanding zat padat dan bentuk
ruang mengikuti wadahnya. Wujud gas memiliki kerapatan paling rendah dan
bentuk ruang mengikuti wadahnya (Rahayu, 2001).
Sifat gas yang ditinjau dari pandangan makroskopik ditekankan pada
kuantitas makroskopik yang berkaitan dengan keadaan internal sistem. Oleh sebab
itu, diperlukan penelitian untuk menentukan kuantitas makroskopik yang cukup
untuk mendeskripsikan keadaan internal tersebut. Kuantitas makroskopik yang
berkaitan dengan keadaan internal suatu sistem disebut koordinat termodinamik
(Zemansky dan Dittman, 1986). Koordinat termodinamik suatu gas ditentukan
oleh tekanan
( )
p , volume( )
V , dan suhu( )
T . Hubungan koordinat termodinamikdengan massa
( )
m disebut persamaan keadaan(
p,V,T,m)
=0f (1.1)
Jika didefinisikan sebagai volume jenis zat v ⎟
⎠ ⎞ ⎜
⎝ ⎛ =
m V
v , maka persamaan
(1.1) dapat dituliskan menjadi
(
p,v,T)
=0f (1.2)
2
Jika koordinat termodinamik pada suatu gas diukur nilainya serta dibuat
grafik hubungan antara nilai rasio
T v P
dan tekanan pada tiga temperatur
, maka akan diperoleh grafik seperti terlihat pada Gambar 1.1 (Sears
dan Salinger, 1975)
(
T1,T2,T3)
Gambar 1.1 Grafik hubungan rasio
T v P
dan tekanan
Dari Gambar 1.1 terlihat bahwa suatu gas yang mempunyai tekanan
mendekati nol akan memenuhi persamaan
R T
v P
=
atau
T R v
P = (1.3)
yang merupakan persamaan keadaan gas ideal. Jika relasi
m V
v= disubstitusikan
ke persamaan (1.3), maka persamaannya menjadi
T R m V
Massa m sebanding dengan jumlah mol gas (n), sehingga persamaan (1.4) dapat
dituliskan
T R n V
P = (1.5)
Gas ideal adalah gas yang tenaga ikat molekul-molekulnya dapat
diabaikan (Nainggolan, 1978). Jika tenaga ikat molekul-molekul gas tidak dapat
diabaikan maka persamaan keadaannya menjadi persamaan keadaan gas real
(
v b)
RT va
p ⎟ − =
⎠ ⎞ ⎜
⎝
⎛ + 2 (1.6)
Pengaruh dari tenaga ikat molekul-molekul gas yang tidak dapat diabaikan
menyebabkan timbulnya faktor koreksi tekanan 2
v a
. Konstanta b merupakan
faktor koreksi volume yang besarnya sebanding dengan volume yang ditempati
molekul-molekul gas (Nainggolan, 1978). Jika volume gas sangat besar, maka 2
v a
dan dapat diabaikan, sehingga persamaan kembali menjadi persamaan keadaan
gas ideal. b
1.2.Perumusan masalah
Pada persamaan (1.5) telah diketahui persamaan keadaan gas ideal untuk
gas yang mempunyai tekanan mendekati nol. Pada persamaan (1.6) telah
diketahui persamaan keadaan gas real. Yang menjadi permasalahan adalah apakah
4
1.3.Batasan Masalah
Masalah pada penelitian ini dibatasi oleh
1. Persamaan keadaan gas ideal dan gas real dijabarkan dengan konsep
mekanika kuantum.
2. Persamaan keadaan gas ideal dijabarkan dengan menganggap potensial
molekul gas mengikuti potensial osilator harmonik.
3. Persamaan keadaan gas real dijabarkan dengan menganggap potensial
molekul gas mengikuti potensial osilator harmonik yang terganggu.
1.4.Tujuan dan Manfaat Penelitian 1.4.1 Tujuan Penelitian
Tujuan penelitian ini adalah
1. Menjabarkan persamaan keadaan gas ideal dan gas real dengan konsep
mekanika kuantum.
2. Persamaan keadaan gas ideal dijabarkan dengan menganggap potensial
molekul gas mengikuti potensial osilator harmonik.
3. Persamaan keadaan gas real dijabarkan dengan menganggap potensial
molekul gas mengikuti potensial osilator harmonik yang terganggu.
1.4.2 Manfaat Penelitian
Penelitian ini bermanfaat untuk perkembangan ilmu pengetahuan
khususnya pengetahuan tentang persamaan keadaan, bahwa persamaan keadaan
1.5.Sistematika Penulisan
Sistematika penulisan penelitian ini adalah sebagai berikut :
BAB I. PENDAHULUAN
Pada Bab I dijelaskan mengenai latar belakang masalah, rumusan masalah,
batasan masalah, tujuan dan manfaat penelitian, dan sistematika penulisan.
BAB II. DASAR TEORI
Pada Bab II dijabarkan teori kinetik gas, potensial osilator harmonik, dan
potensial osilator harmonik yang terganggu.
BAB III. METODOLOGI PENELITIAN
Pada Bab III akan dijelaskan tentang jenis penelitian, sarana penelitian,
dan langkah-langkah penelitian.
BAB IV. HASIL DAN PEMBAHASAN
Pada Bab IV akan ditampilkan hasil penelitian dan pembahasannya.
BAB V. KESIMPULAN DAN SARAN
BAB II
DASAR TEORI
2.1 Teori Kinetik Gas
Gas adalah kumpulan molekul-molekul yang bergerak di dalam suatu
ruang dan saling bertumbukan antara satu dengan yang lain. Tumbukan antar
molekul ini mengakibatkan terjadinya perubahan besaran fisis pada
molekul-molekul yang saling bertumbukan. Jika ada sejumlah molekul dalam suatu
ruang dengan volume V , maka rapat molekul tiap satu satuan volume
(
adalah N)
n
V N
n = . (2.1)
Kerapatan molekul dianggap sama sehingga dalam setiap sebarang bagian kecil
volume ΔV terdapat ΔN molekul dengan
V n N = Δ
Δ (2.2)
Jika molekul dianggap terletak dalam ruang berbentuk bola dengan radius
r dan berada pada koordinat polar , r θ, φ, maka molekul akan bergerak dari
pusat bola menuju permukaan kulit bola kemudian menumbuk luasan ΔA seperti terlihat pada Gambar 2.1
Gambar 2.1 Pergerakan molekul dalam koordinat polar
Jumlah vektor kecepatan sama dengan jumlah molekul yang ada (N), jadi
rapat arah kecepatan terhadap luasan kulit bola (A) dapat diberikan
A N
q = (2.3)
Rapat arah kecepatan molekul adalah jumlah arah kecepatan molekul tiap satu
satuan luas yang tegak lurus terhadap arah tersebut. Luasan A adalah luas seluruh
permukaan kulit bola sehingga persamaan (2.3) menjadi
q
2
4 r
N q
π
= (2.4)
r
A
Δ
Luas permukaan pada permukaan bola dengan radius dapat dituliskan
φ θ θΔ Δ =
ΔA r2sin (2.5)
Molekul yang mempunyai arah kecepatan antara θ dan θ+Δθ serta φ
dan φ+Δφ, menurut persamaan (2.3) mempunyai jumlah molekul
A q N = Δ
Δ θφ (2.6)
atau dengan menggabungkan persamaan (2.5) dan (2.6) diperoleh
φ θ θ
θφ = Δ Δ
ΔN qr2sin (2.7) substitusi (2.4) ke (2.7) didapatkan
φ θ θ π
θφ = Δ Δ
Δ sin
4 N
N (2.8)
kedua ruas persamaan (2.8) dibagi dengan volume V sehingga didapat
φ θ θ π
θφ
θφ = Δ Δ
Δ =
Δ sin
4 n V
N
8
dengan adalah jumlah molekul tiap satu satuan volume dengan kecepatan
yang mempunyai arah antara
θφ
N
Δ
θ dan θ+Δθ serta φ dan φ+Δφ. Jika molekul
mempunyai kecepatan antara U dan U +ΔU, maka persamaan (2.9) dapat
dituliskan kembali menjadi
φ θ θ π
θφ = Δ Δ Δ
Δ sin
4 1
U
U n
n (2.10)
Banyaknya molekul yang menumbuk elemen ΔA pada saat sama dengan jumlah molekul dalam silinder yang bergerak pada arah
t
Δ
θ dan φ dengan
kecepatan U. Seperti terlihat pada Gambar 2.2
A
Δ
Gambar 2.2 Banyaknya molekul yang menumbuk elemen
( )
UΔtSisi silinder pada arah θ dan φ, panjang silinder menyatakan jarak yang
ditempuh molekul dengan kecepatan U pada saat Δt. Volume silinder pada
Gambar 2.2 diberikan
( ) (
A U t cosθ)
V = Δ Δ
sehingga jumlah molekul dalam silinder didapat
(
)
⎟⎠ ⎞ ⎜
⎝
⎛ Δ Δ Δ
Δ Δ = Δ
Δ θ θ θ φ
π
θφ sin cos
4 U U
n U t A V
n
t A n
U
N U = Δ U Δ Δ Δ Δ
Δ θ θ θ φ
π
θφ sin cos
4 1
(2.12)
Flux molekul pada permukaan didefinisikan sebagai jumlah total
molekul yang sampai ke permukaan tiap satu satuan luas setiap satu satuan waktu
Φ
t A
N
Δ Δ
Δ =
Φ (2.13)
Sehingga dengan substitusi persamaan (2.13) ke (2.12) dihasilkan
φ θ θ θ π
θφ
θφ Δ Δ = Δ Δ Δ
Δ =
ΔΦ sin cos
4 1
U U
U U n
t A N
(2.14)
φ
d
φ
Δ
Flux ΔΦθU didapat dengan mengganti pada persamaan (2.14) dengan
kemudian mengintegralkannya terhadap φ dengan batas sampai 0 2 , yang π
akhirnya diperoleh
θ θ θ
θ = Δ Δ
ΔΦ sin cos
2 1
U
U U n (2.15)
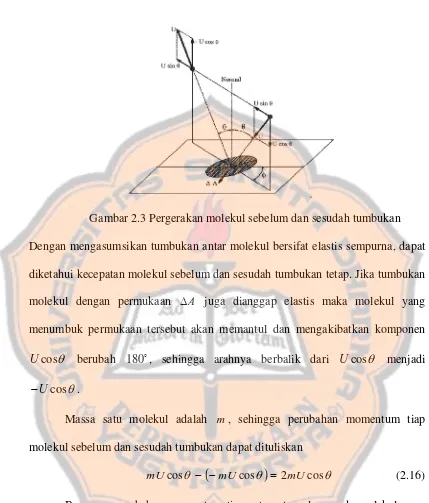
Pergerakan molekul sebelum dan sesudah tumbukan dengan permukaan
A
10
Gambar 2.3 Pergerakan molekul sebelum dan sesudah tumbukan
Dengan mengasumsikan tumbukan antar molekul bersifat elastis sempurna, dapat
diketahui kecepatan molekul sebelum dan sesudah tumbukan tetap. Jika tumbukan
molekul dengan permukaan ΔA juga dianggap elastis maka molekul yang menumbuk permukaan tersebut akan memantul dan mengakibatkan komponen
θ
cos
U berubah 180o, sehingga arahnya berbalik dari Ucosθ menjadi
θ
cos U
− .
Massa satu molekul adalah , sehingga perubahan momentum tiap
molekul sebelum dan sesudah tumbukan dapat dituliskan
m
(
θ)
θθ cos 2 cos
cos mU mU
U
m − − = (2.16)
Besarnya perubahan momentum tiap satu satuan luas pada molekul yang
bertumbukan dengan arah sudut θ dan mempunyai kecepatan U , atau tekanan
diberikan oleh (Sears dan Salinger, 1975) U
Pθ
Δ
(
)
⎟⎠ ⎞ ⎜
⎝
⎛ Δ Δ
=
Δ θ θ sinθcosθ θ
2 1 cos
2 U
U mU U n
= mU2ΔnUsinθcos2θΔθ (2.17)
Tekanan molekul yang bergerak dengan kecepatan U, untuk semua
nilai U P Δ θ Δ
θ dapat ditentukan dengan mengganti pada persamaan (2.17) dengan
2
π θ
d kemudian diintegralkan terhadap θ dengan batas dari sampai 0
∫
Δ = Δ 2 0 2 2 cos sin πθ mU n θ θdθ
PU U
(
)
∫
Δ − = 2 0 2 2 cos cos π θ θd n mU U 2 0 3 2 cos 31 θ π
U n mU Δ − =
(
° − °)
Δ −= cos 90 cos 0
3
1 3 3
2
U n mU
(
3 3)
2 1 0 3 1 − Δ −= mU nU
U
U mU n
P = Δ
Δ 2
3 1
(2.18)
Dengan menjumlahkan semua nilai U didapatkan tekanan total
U
U m U n
P = Σ Δ
Δ 2
3 1
(2.19)
Molekul mempunyai kecepatan rata-rata yang didefinisikan sebagai nilai
rata-rata dari jumlah seluruh kecepatan molekul. Jika terdapat sejumlah molekul
yang memiliki kecepatan
{
N1,N2,...,NN}
{
U1,U2,...,UN}
maka kecepatan12
N N U
N N U U
N
i
i i
N
i i N
i
i
i
∑
∑
∑
= =
= =
= 1
1
1 (2.20)
Kecepatan rata-rata molekul gas tidak memperhitungkan arah. Jika
ditinjau suatu arah tertentu sebagai arah positif, maka arah kecepatan yang
berlawanan dengan arah tersebut bertanda negatif. Nilai rata-rata dari kecepatan
kuadrat diberikan oleh
N U U
N
i i
∑
== 1
2 2
(2.21)
Jika terdapat sejumlah molekul gas yang mempunyai kecepatan U , maka
nilai rata-rata kecepatan kuadrat diberikan oleh N
Δ
N N U U = Σ Δ U
2 2
(2.22)
V N n =
mengingat , persamaan (2.22) dapat dituliskan menjadi
n n U U = Σ Δ U
2 2
atau
2 2
U n n U Δ U =
Σ (2.23)
m 3 1
Jika persamaan (2.23) dikalikan , maka didapat
2 2
3 1 3
1
U nm n
U
mΣ Δ U = (2.24)
2
3 1
U nm PU =
Δ (2.25)
2
3 1
U nm
Kuantitas adalah dua pertiga dari seluruh tenaga kinetik molekul, yakni
) 2
1 ( 3
2 2
U
nm . Sehingga persamaannya dapat dituliskan (Halliday dan Resnick,
1987)
⎟ ⎠ ⎞ ⎜
⎝ ⎛
= 2
2
2 1 3 2 3
1
U nm U
nm
) 2
1 ( 3
2 2
U nm PU =
Δ (2.26)
Jika ΔPU = nRT, maka dari persamaan (2.26) didapat energi kinetik gas
kT N v
m A
2 3 2
1 2 =
(2.27)
sebab R = NAk.
Jika molekul mempunyai x komponen kecepatan antara sampai
, maka perubahan momentumnya diberikan dari persamaan (2.18) yang
dituliskan kembali menjadi
x U
x
x U
U +Δ
(
x xx mU nU
P = Δ
Δ 2
3
1
) (2.29)
dengan adalah jumlah molekul tiap satu satuan volume sebagai fungsi
. Perubahan momentum tersebut terjadi pada interval waktu )
(Ux n
Δ
x U
x
U x t=
Δ (2.30)
14
( )
t U n mU t pdF x x x
x Δ Δ = Δ Δ = 2 3 1 (2.31) sehingga
(
∫
∞ Δ Δ = 0 2 3 1 x xx n U
t U m
F
)
(2.32)2
x
U diberikan oleh (Bradbury, 1984) Nilai
( )
( )
( )
V N U n U U n U n U U x x x x x x / 2 0 2 2 2∫
∫
∫
∞ ∞ + ∞ − +∞ ∞ − Δ = Δ Δ= (2.33)
Persamaan (2.32) dan (2.33) digabungkan, dan diperoleh
V t U N m F x x Δ = 6 2 (2.34)
sehingga tekanan P adalah
V t A U N m A F
P x x
Δ = = 6 2 (2.35)
Selain memiliki energi kinetik, molekul-molekul gas tersebut juga
memiliki energi potensial. Dengan substitusi persamaan (2.30) ke (2.31) diperoleh
relasi
x p U
dFx x x
Δ =
atau
x x
x U p
dF
x = Δ
( )
x xx
x dn U
( )
xx dn U
t x m dF t 2 2 3 1 Δ = Δ sehingga
( )
x x U dn m t dF x 3 1 32 = Δ
(2.36)
2
x
Mengingat nilai adalah
∫
∫
∞ + ∞ − +∞ ∞ − = ) ( ) ( 2 2 x dn x dn x x (2.37)Dengan menggabungkan persamaan (2.36) dan (2.37) diperoleh
V N dF t m V N x dn x x x
∫
∫
∞ ∞ Δ = = 0 3 0 2 2 6 ) ( 2 (2.38)Mengacu pada persamaan (2.35) didapatkan
A dF
dP= x (2.39)
Kedua ruas persamaan (2.39) dikalikan dan dihasilkan x
x dF dP x
A = x
x
x tU
dF dP x
A = Δ
atau
x
x t dF
U dP
V =
∫
Δ (2.40) Persamaan (2.40) diintegralkan dan diperoleh∫
∞ Δ = 0 xx t dF
U V
16
Persamaan (2.41) disubstitusikan ke persamaan (2.38) menjadi
V N t dF t m x x 2 0 2 6 Δ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ Δ =
∫
∞ 2 / / 6 t V N U PV m x Δ = 2 26 t V x U N m PV x Δ = 2 2
6 t V x U N m kT
N x
A = Δ
2 2
6 t N V x U N m kT A x Δ = atau 2 2 6 2 1 2 1 x V N t U N m T k A x Δ
= (2.42)
c V N t U N m A x = Δ 2 6
Jika , maka persamaan (2.42) menjadi
2 2 1 2 1 x c T
k = (2.43)
sehingga besarnya energi potensial sama dengan energi termal, yaitu kT 2 1
.
2.2 Osilator Harmonik
Energi potensial molekul gas dianggap mengikuti potensial osilator
( )
22 1
kx x
V = (2.44)
dengan k adalah konstanta dan m adalah massa partikel osilasi yang memiliki
frekuensi anguler 2
1 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = m k c
ω , sehingga persamaan Schrödinger pada Lampiran
persamaan (13) menjadi
Eu u x m x u
m∂ + c =
∂
− 2 2
2 2 2 2 1 2 ω h (2.45)
Untuk memudahkan perhitungan, semua variabel x diubah ke dengan y
x m y c 2 1 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = h ω (2.46)
dan didefinisikan suatu konstanta
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ = c E ω α h 2 (2.47)
sehingga persamaan (2.45) menjadi
(
y)
u Euy
u + − =
∂
∂ 2
2 2
α (2.48)
Jika nilai sangat besar dibandingkan y α maka persamaan (2.48) dapat didekati
dengan bentuk 0 2 2 2 ≈ − ∂ ∂ u y y u (2.49)
Kemudian persamaan (2.49) diselesaikan dengan fungsi
⎟ ⎠ ⎞ ⎜ ⎝ ⎛− = 2 exp 2 y y
u n (2.50)
18
(
)
(
)
[
]
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + + − − = ∂ ∂ − + 2 exp 1 2 1 2 2 2 2 2 y y y n y n n yu n n n
⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ≈ + 2 exp 2 2 y yn ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− = 2 exp 2 2 y y y n u y2
= (2.51)
Pada persamaan (2.51) terlihat bahwa persamaan (2.50) memenuhi (2.49),
sehingga persamaan (2.50) dapat dituliskan kembali menjadi
( ) ( ) ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− = 2 exp 2 y H
u y y (2.52)
dengan adalah fungsi yang telah ditentukan. Substitusi persamaan (2.52) ke
(2.48) menghasilkan
( )y H
(
1)
02 ′+ − =
−
′′ yH H
H α (2.53)
H dapat dituliskan dalam deret pangkat
∑
∞ = = 0 n n n y aH (2.54)
∑
∞ = − = ′ 0 1 n n n ny aH (2.55)
(
)
∑
∞ = − − = ′′ 0 2 1 n nnn n y
a H
(
)
∑
∞ = − − = 2 2 1 n nnn n y
a (2.56)
(
)(
)
∑
∞ = + + + = ′′ 02 2 1
n
n
n n n y
a
H (2.57)
Dengan menggabungkan persamaan (2.54), (2.55), (2.57) dan (2.53) diperoleh
(
)(
)
(
)
[
1 2 2 1 00
2− + − =
+ +
∑
∞ = + n n nn n a y
a n
n α
]
(2.58)Jika koefisien seluruh pangkat dari sama dengan nol, maka deret (2.58) dapat
dituliskan
y
(
)
(
1)(
2)
1 2 2 + + − + = + n n n a a n n α (2.59)( )
2exp y Untuk nilai n sangat besar, deret (2.54) identik dengan deret
menghasilkan
( )
( )
∑
∑
∑
∞ = = = ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ = 0 2 2 ! 2 1 ! exp n n n n genap n n n y a y n n yy . Jika
mendekati tak berhingga dengan seperti deret
( )y H
( )
2exp y
y maka akan
konvergen. Gejala tersebut dapat dihindari dengan memotong penderetan. Dengan
kata lain merupakan polinom.
( )y u
( )y H
n n a a +2
Berdasarkan persamaan (2.59), jika limit mendekati tak berhingga,
maka didapatkan syarat untuk menyelesaikan persamaan Schrödinger pada
partikel yang bergerak dengan potensial osilator harmonik
1 2 +
= n
α dengan n=0,1,2,...
1
0 =
a jika n ganjil dan a0 =0 jika genap n (2.60)
Dengan substitusi persamaan pertama (2.60) ke persamaan (2.47) diperoleh energi
20 ω h ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + = 2 1 0 n
E n (2.61)
π
2 h
=
h
dengan ω frekuensi osilator harmonik, .
Polinom dikenal sebagai polinom Hermit. Mengacu kepada
persamaan (2.59) didapatkan 4 tingkat energi terendah
( )y H
1
0 =
H
y H1 = 2
2 4 2
2 = y −
H
y y
H3 =8 3 −12 (2.62)
(
2)
2 1
exp − y
Fungsi gelombang un( )x didapat dari perkalian Hn( )y dengan faktor
dan disubstitusikan ke persamaan (2.46) kemudian dinormalisasi 1
2 =
∫
∞ ∞ − dx u , sehingga diperoleh ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛= 4 2
1
0
2
exp m x
m
u c c
n h h ω π ω ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
= 4 2
3 4 1 1 2 exp 4 x m m
u c c
h h ω ω π ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
= 4 2 2
1 2 2 exp 1 2 4 x m x m m
u c c c
h h h ω ω π ω ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
= 4 2 2
3 4 1 3 2 exp 3 2 9 1 x m x m m
u c c c
h h h ω ω ω π (2.63)
∑
∑
∞ = − ∞ = − = 0 / 0 / n kT E n kT E n n n e e E E (2.64) kT 1 =β , maka persamaan (2.64) dapat dituliskan Jika diberikan
∑
∑
∞ = − ∞ = − = 0 0 n E n E n n n e e E E β β (2.65)Untuk memudahkan perhitungan persamaan (2.65) digunakan substitusi
∑
∞ = − = 0 n En eZ β (2.66)
yang dikenal sebagai fungsi partisi (Mandl, 1988). Dengan demikian, tenaga
rata-rata pada persamaan (2.65) menjadi
(
Z ZZ
E 1 ln
β β ∂
)
∂ − = ∂ ∂ − = (2.67)Persamaan (2.61) disubstitusikan ke dalam persamaan (2.66) dan dihasilkan
∑
∞ = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + − = 0 2 1 n n e Z ωβ h∑
∞ = − − = 0 2 / n n e e hωβ hωβ(
1 2 3 ...)
2/ + + + +
= −hωβ −hωβ − hωβ − hωβ
e e
e
e (2.68)
Jika hωβ>0, maka , sehingga bentuk deret pada persamaan (2.67)
dapat dituliskan menjadi
1
<<
−hωβ
22 ωβ ωβ ωβ ωβ h h h h − − − − − = + + + + e e e e 1 1 ...
1 2 3
dan fungsi partisi dapat dituliskan
ωβ ωβ h h − − − = e e Z 1 2 / (2.69)
Dengan substitusi persamaan (2.69) ke dalam persamaan (2.67)
diperoleh tenaga rata-rata osilator harmonik satu dimensi sebesar
(
Z)
E ln β ∂ ∂ − =
(
)
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − − − ∂ ∂ − = ωβ ωβ β h h ln 1 e 2 1 ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − + = 1 1 2 1 ωβ ω h h e (2.70)2.3 Osilator Harmonik yang Terganggu
Potensial osilator harmonik dengan massa yang mengalami gangguan
dapat dituliskan m 4 x δ 4 2 2 2 1 x x m
V = ω +δ (2.71)
sehingga persamaan Schrödingernya menjadi
Eu x u x m x u
m∂ + c + =
∂
− 2 2 4
2 2 2
2 1
2 ω δ
h
(2.72)
δ
dengan adalah tetapan yang bernilai sangat kecil sehingga dapat digunakan
teori gangguan untuk menentukan tingkat energi dasar dari potensial harmonik
Hˆ Teori gangguan dapat digunakan ketika operator Hamiltonian
menunjukan energi total potensial osilator harmonik yang terganggu dan
dituliskan sebagai
H H
Hˆ = ˆ0 + ˆ′ (2.73)
2 2 2
0
2 1 2
ˆ m x
m p
H = + ω
dengan adalah hamiltonian tak terganggu dan
sebagai gangguan. Dalam kasus ini nilai eigen dan fungsi eigen dari
diketahui mengacu pada persamaan (2.61) dan (2.63).
4
ˆ x H′ =δ
0
ˆ H
n
E0 u0n
Nilai eigen dan fungsi eigen diasumsikan berbentuk deret orde
0,1,2,… dalam gangguan n
E0 u0n
Hˆ . Sehingga persamaan (2.73) dapat dituliskan ′
kembali menjadi
H H
Hˆ = ˆ0 + β ˆ′ (2.74) dengan β adalah konstanta, sehingga nilai eigen dan fungsi eigen dapat
dituliskan sebagai
n
E0 u0n
...
2 2 1
0 + + +
= n n n
n E E E
E β β (2.75)
...
2 2 1
0 + + +
= n n n
n u u u
u β β (2.76)
Pada persamaan (2.75) dan (2.76) dapat dilihat bahwa pada saat orde nol nilai
eigen E0n dan fungsi eigen u0n tidak tergantung pada β. Persamaan energi nilai
eigen diberikan (Rae, 1985)
n n
n E u
u
Hˆ = (2.77)
24
(
Hˆ0 +βHˆ′)
(
u0n +βu1n +β2u2n +...)
=(
E0n +βE1n +β2E2n +...)(
u0n +βu1n +β2u2n +...)
(
...)
ˆ
2 2 1 0
0 u n + un + u n +
H β β + βH′
(
u0n +βu1n +β2u2n +...)
=(
0 1 2 2 ...)
0n u n + un + u n +
E β β + βE1n
(
u0n +βu1n +β2u2n +...)
(
0 1 2 2 ...)
...2
2 + + + +
+ β E n u n βun β u n
(
H u n +H un +H u n +)
(
H′u n + H′ un + H′ u2n)
= 2 10 2
2 0 1 0 0
0 ˆ ˆ ...
ˆ β β β β β β β
(
E0nu0n +E0nβu1n +E0nβ2u2n +...)
(
2 2 ...)
1 1
1 0
1 + + +
+ βEnu n βEnβun βEnβ u n
(
2 2 0 + 2 2 1 + 2 2 2 2 +...)
+...+ β E nu n β E nβun β E nβ u n (2.78)
Persamaan (2.78) dapat dituliskan menjadi
Hˆ0u0n = E0nu0n (2.79)
n n n n n
n H u E u E u
u
Hˆ′ 0 + ˆ0 1 = 0 1 + 1 0 (2.80)
Hˆ′u1n +Hˆ0u2n = E0nu2n +E1nu1n +E2nu0n (2.81) Orde pertama dan orde kedua pada persamaan (2.79), (2.80), dan (2.81) adalah
faktor koreksi tingkat-tingkat energi dan fungsi eigen. Jika persamaan (2.79)
Faktor koreksi orde pertama persamaan (2.80) didapat dengan menunjukkan
(2.82) k
nk k
n a u
u1 = Σ 0
substitusi persamaan (2.82) ke (2.80) menghasilkan
k n k nk k n k nk k
n H a u E a u E u
u
Hˆ′ 0 + ˆ0Σ 0 = 0 Σ 0 + 1 0 (2.83)
dengan menggunakan relasi (2.79) persamaan (2.83) menjadi
(
)
nk(
n k)
nk n
n u a E E u
E
Hˆ′− 1 0 =Σ 0 − 0 0 (2.84)
Persamaan (2.84) dikalikan dengan dan diintegralkan dengan diketahui
bahwa adalah orthonormal, sehingga dihasilkan n
u∗0
k u0
nn
n H
E1 = ˆ′ (2.85) dengan τ d u H u H n n
nn 0 ˆ 0
ˆ′ =
∫
∗(2.86)
Substitusi persamaan (2.61) dan (2.63) ke (2.86) dihasilkan tingkat energi
dasar dari potensial harmonik yang terganggu
dx x m m H x m m E ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
=
∫
4 21 2 4 1 10 2 exp ˆ 2 exp h h h h ω π ω ω π ω dx x m H x m m ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
= 2
∫
2 21 2 exp ˆ 2 exp h h h ω ω π ω (2.87) Hˆ
dengan operator hamiltonian pada osilator harmonik yang terganggu adalah
4 2 2 2 2 2 2 1 2
ˆ m x x
x m
H + ω +δ
∂ ∂ −
= h . (2.88)
Substitusi persamaan (2.88) ke (2.87) menghasilkan
26
Persamaan (2.89) dapat dituliskan menjadi
dx x m x m E ⎟ ⎠ ⎞ ⎜ ⎝ ⎛− ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
=
∫
∞ 20 4 2 1
10 2 exp
h h ω δ π ω
. (2.90)
2
α ω = h
m
dengan y2=α2x2, maka persamaan (2.90) menjadi Jika dituliskan
( )
y dx x m E 2 0 4 2 110 2 ⎟ exp−
⎠ ⎞ ⎜ ⎝ ⎛ = δ
∫
∞ π ωh (2.91)
( )
24 4 h ω m y x =
Untuk memudahkan perhitungan, didefinisikan dan
( )
dym
dx 1 12
h ω
= kemudian disubstitusikan ke persamaan (2.91) sehingga
menghasilkan
( )
( ) ( )
dym m
y y m
E 2 12
4 0 2 2 1 10 1 exp 2 h h
h δ ω ω
π ω
∫
∞ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ =( )
y y dy m 4 0 2 2 2 2 2 1 exp 1 2∫
∞ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = δ ω π h (2.92) P dP dy 2 =Jika y4=P2 dan maka persamaan (2.92) menjadi
( )
p dP P P m E 2 exp 1 2 2 0 2 2 2 2 1 10∫
∞ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = δ ω π h( )
P P dP m 2 3 0 2 2 2 2 1 exp 1∫
∞ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = δ ω π h (2.93)Bagian integral persamaan (2.93) didefinisikan sebagai fungsi Gamma, dengan
π 4 3 2 3 = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛
Γ sehingga didapat persamaan tingkat energi dasar untuk osilator
harmonik yang terganggu
δ ω2 2 2 10 4 3 m
E = h (2.94)
Persamaan (2.61) dan (2.94) dijumlahkan, sehingga didapatkan energi total
δ ω ω 22 2
4 3 2 1 m n
En ⎟h + h
⎠ ⎞ ⎜ ⎝ ⎛ +
= (2.95)
Substitusi persamaan (2.95) ke persamaan (2.64) menghasilkan
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − + + = −− 1 4 3 2 1 2 2 ωβ ωβ ω δ
ω h h h
h
e e m
BAB III
METODOLOGI PENELITIAN
3.1. Jenis Penelitian
Jenis penelitian yang dilakukan dalam penulisan skripsi ini adalah
penelitian studi pustaka.
3.2. Sarana Penelitian
Sarana yang dibutuhkan dalam peyelesaian skripsi ini adalah buku-buku
yang berhubungan dengan termodinamika, mekanika kuantum, dan teori kinetik
gas yang terdapat di UPT Perpustakaan Sanata Dharma Yogyakarta.
3.3. Langkah-langkah penelitian
Langkah-langkah yang dilakukan dalam penelitian ini adalah sebagai
berikut:
1. Menelusuri bahan-bahan mengenai persamaan keadaan gas ideal,
persamaan keadaan gas real dan mekanika kuantum.
2. Menentukan energi rata-rata molekul gas yang dianggap
mengikuti potensial osilator harmonik dan potensial osilator
harmonik yang terganggu.
3. Menjabarkan persamaan keadaan gas ideal dan gas real.
4. Menarik kesimpulan dan saran dari penelitian yang telah
dilakukan.
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Perhitungan
4.1.1 Persamaan Keadaan Gas Ideal
Sebagaimana dituliskan pada persamaan (2.70) bahwa energi rata-rata
osilator harmonik telah diketahui. Jika dituliskan
kT 1
=
β maka persamaan (2.70)
menjadi
⎟ ⎟ ⎠ ⎞ ⎜
⎜ ⎝ ⎛
− +
=
1 1 2
1
kT
e
E hω hω (4.1)
Deret ehωkT pada persamaan (4.1) diekspansikan menjadi
... 2
1 1
2 2
2 2
+ +
+ =
T k kT
ehωkT hω h ω (4.2)
Pada suhu tinggi
(
kT >> hω)
deret ehωkT pada persamaan (4.1) dapat didekatidengan
kT ehωkT ≈1+hω
sehingga persamaan (4.1) dapat dituliskan menjadi
⎟ ⎟ ⎟ ⎟
⎠ ⎞
⎜ ⎜ ⎜ ⎜
⎝ ⎛
− ⎟ ⎠ ⎞ ⎜
⎝ ⎛ + + =
1 1
1 2
1
kT E
ω ω
h h
30 ⎟ ⎟ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎜ ⎝ ⎛ − + + = 1 1 2 1 kT kT ω ω h h ⎟⎟ ⎟ ⎠ ⎞ ⎜⎜ ⎜ ⎝ ⎛ + = kT ω ω h h 1 2 1 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + = ω ω h h kT 2 1
= + kT 2
ω h
(4.3)
Persamaan (4.3) dikalikan NA dan didapat
kT N N
E
NA = A + A
2 ω h atau 2 ω h A
A E N
N T
R = −
A N E ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = 2 ω h (4.4)
sebab NAk = R.
Bilangan Avogadro
(
NA)
sebanding dengan volume( )
V , atauV K V K m
NA ≈ = =
ρ ρ
ρ , sehingga persamaan (4.4) dapat dituliskan
V K E T R ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = 2 ω h (4.5)
Jika didefinisikan E ⎟K = P
⎠ ⎞ ⎜ ⎝ ⎛ − 2 ω h
T R V
P = (4.6)
yang merupakan persamaan gas ideal.
4.1.2 Persamaan Keadaan Gas Real
Energi rata-rata dari potensial osilator harmonik yang terganggu telah
diperoleh dan dituliskan pada persamaan (2.96). Pada suhu tinggi
(
kT >>hω)
,deret 1 − − − ωβ ωβ h h e e
pada persamaan tersebut menjadi
... 2 1 ... 2 1 1
1 2 2 2
2 2 2 + + − + + − = − − − β ω ωβ β ω ωβ ωβ ωβ h h h h h h e e
≈ − 1 +1
ωβ h ω h kT −
≈1 (4.7)
Substitusi persamaan (4.7) ke (2.96) menghasilkan
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + + − = ω ω δ ω h h h kT m E 1 4 3 2 1 2 2 ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + − = ω ω δ ω h h h kT
m2 2 4 3 2 3 kT m − + = ω δ
ω 22
4 3 2
3 h
h (4.8)
persamaan (4.8) dikalikan NA dan diperoleh
kT N N m N E
NA = A + A− A
ω δ
ω 22
32
N RT
m N
E
NA = A + ω A−
δ
ω 22
4 3 2 3 h h A A N m N E RT ω δ ω 2 2 4 3 2 3 h
h ⎟ +
⎠ ⎞ ⎜
⎝
⎛ −
= (4.9)
Diketahui
v m
=
ρ dan 12 21 2
v
m = ρ sehingga persamaan (4.9) dapat dituliskan
A A A N v N E N RT ω ρ δ
ω 222
4 3 2
3 h
h − +
= V K v E ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + −
= 2 22 2
4 3 2 3 ω ρ δ ω h
h (4.10)
Untuk memudahkan perhitungan, dituliskan hω−E = x 2
3
dan 2 2 = y
2 4 3 ω ρ δ h ,
sehingga persamaan (4.10) menjadi
V K v y x RT ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + = 2 V v Ky Kx ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ +
= 2 (4.11)
Jika Kx = p dan Ky = a, maka diperoleh
V v a p RT ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + = 2 atau v v a p RT n ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ +
= 2 (4.12)
sebab
Untuk n=1 persamaan (4.12) menjadi persamaan gas real pada saat b =0
v v
a p
RT ⎟
⎠ ⎞ ⎜
⎝ ⎛ +
= 2 (4.13)
4.2 Pembahasan
Sebagaimana yang telah dituliskan dalam buku-buku teks (Halliday dan
Resnick,1987 ; Sears dan Salinger, 1975 ; Nainggolan, 1978) persamaan keadaan
gas ideal adalah . Dengan menggunakan pendekatan teori kinetik gas
dan menganggap potensial atom mengikuti potensial osilator harmonik dapat
dihasilkan persamaan gas ideal.
nRT PV =
Persamaan keadaan gas real dapat diperoleh dengan menganggap potensial
atom gas mengikuti potensial osilator harmonik yang terganggu. Dari persamaan
(4.13) terlihat bahwa persamaan tersebut merupakan persamaan gas van der waals
untuk keadaan . Nilai tetapan a dan b untuk beberapa gas real disajikan
pada Tabel 4.1.
0
=
b
Tabel 4.1 Nilai tetapan a dan b untuk beberapa gas
real (Sears dan Salinger, 1975)
Gas
a
(J m3 kilomol-2)
b
(m3 kilomol-1)
He 3
10 44 .
3 × 0.0234
H2 24.8×103 0.0266
34
CO2 366×103 0.0429
H2O 580×103 0.0319
Hg 3
10
292× 0.0055
Persamaan (4.13) berlaku untuk gas real pada saat p dan v sangat besar dengan b
BAB V
PENUTUP
5.1. Kesimpulan
Berdasarkan keseluruhan proses yang telah dilakukan dalam penelitian
ini dapat diperoleh kesimpulan bahwa
1. Persamaan keadaan gas ideal dan gas real dapat diperoleh dengan
menggunakan konsep mekanika kuantum.
2. Persamaan gas ideal diperoleh dengan menganggap potensial molekul gas
mengikuti potensial osilator harmonik.
3. Persamaan keadaan gas real dapat diperoleh dengan menganggap potensial
molekul gas mengikuti potensial osilator harmonik yang terganggu.
5.2 Saran
Persamaan gas real yang dihasilkan pada penelitian ini menggunakan
anggapan bahwa potensial molekul gas berbentuk potensial osilator harmonik
terganggu dengan menambah faktor pada potensial molekul gas. Perlu
dilakukan penelitian lebih lanjut pada faktor gangguan potensial yang ordenya
lebih tinggi untuk mengetahui pengaruhnya terhadap persamaaan gas real.
4
x δ
DAFTAR PUSTAKA
Bradbury, T. C., 1984, Mathematical Methods with Applications to Problem in
the Physical Sciences, Canada: Addison–Wesley Publishing
Company.
Halliday, D., dan Resnick, R., 1987, Fisika Edisi ketiga Jilid I, Jakarta : Erlangga.
Mandl, F., 1988, Statistical Physics, Manchester : John Wiley & Sons.
Nainggolan, W.S., 1978, Thermodinamika, Bandung: Penerbit Armico.
Omar, M. A., 1975, Elementary Solid State Physics, Massachussets : Addison–
Wesley Publishing Company.
Rae, I. M. A., 1985, Quantum Mechanics, British : ELBS.
Rahayu, S. I., 2001, Teori Kinetik Gas, Jakarta : Departemen Pendidikan
Nasional.
Sears, F. W., dan Salinger, G. L., 1975, Thermodynamics, Kinetic Theory, and
Statistical Thermodynamics, Massachusetts : Addison-Wesley
Publishing Company.
Zemansky, M. W., dan Dittman, R. H., 1981, Heat and Thermodynamics, New
York : McGraw-Hill Book Company.
LAMPIRAN Persamaan Schrödinger L.1 Persamaan Schrödinger Bergantung Waktu
De Broglie mengatakan, partikel bermassa yang bergerak dengan laju
akan mempunyai panjang gelombang
m
v
p h
=
λ (1)
dengan adalah konstanta Planck dan h p adalah momentum linier partikel.
Pada kasus partikel bebas non relativistik, hubungan antara energi dan
momentumnya diberikan oleh
m p E
2
2
= (2)
Untuk partikel yang bergerak dan memiliki potensial V
( )
x, , energi totalnya sama tdengan jumlah dari energi kinetik dan energi potensial. Secara umum persamaan
(2) menjadi
V m p E = +
2
2
(3)
Energi sistem fisis menurut mekenika kuantum diberikan oleh
Ψ =
Ψ H
E ˆ (4)
dengan E adalah nilai eigen,Hˆ adalah operator hamiltonian, dan adalah
fungsi eigen. Jika operator energi, momentum, dan posisi diberikan oleh
Ψ
t i E
∂ ∂ ≡ h
x i px ∂ ∂ −
≡ h (5)
sehingga persamaan (3) dapat dituliskan
Ψ + ∂ Ψ ∂ − = ∂ Ψ ∂ V x m t i 2 2 2 2 h
h (6)
yang disebut persamaan Schrödinger bergantung waktu
L.2 Persamaan Schrödinger Tak Bergantung Waktu
Operator hamiltonian Hˆ merupakan jumlah dari energi kinetik dan energi
potensial
V K
Hˆ = ˆ + ˆ (7) dengan Kˆ adalah operator energi kinetik dan V adalah operator energi potensial.
Jadi persamaan (3) dapat dituliskan menjadi ˆ V m p H ˆ 2 ˆ
ˆ = 2 + (8)
Substitusi persamaan (8) ke (5) yang telah dikenakan pada fungsi gelombang
menghasilkan Ψ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + = ∂ Ψ ∂ V m p t i 2 2
h (9)
Kedua ruas persamaan (9) merupakan energi sehingga untuk menentukan
persamaan Schrödinger dilakukan teknik pemisahan variabel
( ) ( ) ( )
x t = u x T tΨ , (10)
Dengan substitusi persamaan (6) ke (10) dan dibagi dengan Ψdihasilkan
V x u m u t T T i + ∂ ∂ − = ∂ ∂ 2 2 2 2 1 1 h
Ruas kanan persamaan (11) hanya bergantung pada posisi, sedangkan ruas kirinya
hanya bergantung waktu. Dengan demikian kedua ruas dapat dikatakan sebagai
tetapan. Jika tetapan ini disebutE, maka akan didapatkan persamaan yang saling
bebas
ET t T
i =
∂ ∂
h (12)
dan
( )
xu Eu Vx u
m ∂ + =
∂ − 2 22
2
h