Tempat dan waktu
Penelitian dimulai dari bulan Juli 2003 sampai dengan Juni 2005, dan dilaksanakan di empat laboratorium, yaitu Laboratorium Mikrobiologi Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian (Fateta), Institut Pertanian Bogor (IPB); Laboratorium Mikrobiologi Pangan dan Laboratorium Kimia Pangan, South East Asian Food and Agricultural Science and Technology Center (SEAFAST CENTER) IPB; serta Laboratorium Naval Medicine Research Unit (NAMRU) di Jakarta.
Bahan dan alat Bahan
Buah andaliman segar varietas simanuk, yang berasal dari Medan dan diperoleh dari Pusat Pasar Senen Jakarta. Bahan kimia untuk ekstraksi terdiri dari: heksana, etilasetat, metanol, etano l 70%. Selain itu digunakan pula beberapa bahan kimia lainnya, antara lain: buffer cocodilat, glutaraldehid, osmium, etanol, argon, antibiotik (streptomisin, polimiksin B, penisilin G diperoleh dari PT Meiji), Selain itu digunakan pula beberapa bahan kimia lainnya, antara lain: n-oktana, phosphat buffer saline (PBS), gas nitrogen, dan air bebas ion.
Kultur bakteri yang digunakan untuk pengujian aktivitas antibakteri terdiri dari 3 jenis bakteri, yaitu: bakteri Gram positif (Staphylococcus aureus FNCC 057), bakteri Gram negatif (Salmonella Typhimurium FNCC 034) dan bakteri pembentuk spora (Bacillus cereus FNCC 134) yang diperoleh dari koleksi kultur Pusat Antar Universitas (PAU) Pangan dan Gizi, Universitas Gadjah Mada (UGM) Yogyakarta. Media yang digunakan adalah nutrient agar (NA) dan nutrient broth (NB).
Alat
Peralatan yang digunakan dalam penelitian ini meliputi: (1) Peralatan ekstraksi dan kultur uji terdiri dari freezer, pengering beku (Neocool 110 V), penyaring vakum, pemanas berjaket, kondensor, labu didih, oven, rotavapor
(Buchi Waterbath R-124) dan vacuum aspirator (Model B-169), sentrifuse (Biofuge A Sepatech), inkubator bergoyang, tabung gas nitrogen, neraca analitik (Chyo JP-160), pipet mikro 100 µl dan 1000 µl (eppendorf), tabung berulir, (2) Peralatan pengujian aktivitas antibakteri seperti: inkubator, autoklaf, refrigerator, vorteks (Geniie-2), penangas air (GLF), botol sampel (5 ml), pH meter, cawan petri, aluminium foil, pelubang sumur dengan diameter 6 milimeter, kertas saring, oven vakum, (3) Peralatan pengujian mekanisme antibakteri seperti spektrofotometer (Shimadzu), mikroskop (Nikon YS2-T dan Olympus BH-2),
Coating (P elco SC 6), Scanning Electron Microscope (JEOL JSM 5310 LV) dan alat-alat gelas penunjang lainnya.
Metodologi Penelitian
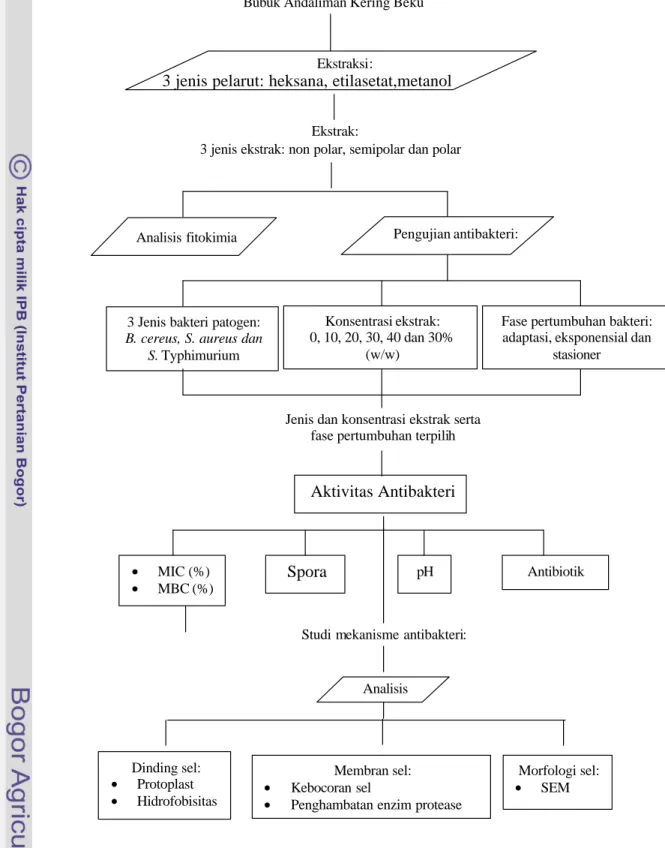
Penelitian ini dibagi menjadi beberapa tahap, yaitu: (1) ekstraksi buah andaliman, (2) analisis komponen aktif ekstrak andaliman, (3) pengujian aktivitas antibakteri berdasarkan fase pertumbuhan dan polaritas pelarut (4) penentuan nilai minimum inhibitory concentration (MIC ) dan minimum bactericidal concentration (MBC), pengaruh pH terhadap aktivitas antibakteri dan pengaruh ekstrak terhadap spora dan sel veg etatif serta (5) pengujian mekanisme antibakteri ekstrak andaliman meliputi kerusakan dinding sel, gangguan permeabilitas membran sel, aktivitas enzim protease dan kerusakan morfologi sel. Secara garis besar proto kol penelitian dapat dilihat pada Gambar 3.1
Pembuatan Bubuk Andaliman Kering Beku
Bubuk andaliman kering beku disiapkan untuk memperoleh ekstrak andaliman (ekstrak nonpolar, semipolar dan polar) yang akan digunakan dalam pengujian aktivitas antib akteri terhadap bakteri patogen, menghitung rendemen bubuk dan ekstrak serta analisis komponen aktif ekstrak andaliman. Buah andaliman dipersiapkan secara berurutan, yaitu sortasi, pencucian, penirisan, pembekuan dan pengeringan beku. Selanjutnya dihaluskan dan diayak dengan ukuran 30 mesh. Bubuk yang dip eroleh disimpan dalam wadah plastik yang kedap udara pada suhu refrigerator (± 50C).
Gambar 3.1 Diagram Alir Pelaksanaan Penelitian
Bubuk Andaliman Kering Beku
Dinding sel:
• Protoplast
• Hidrofobisitas
Fase pertumbuhan bakteri: adaptasi, eksponensial dan
stasioner
Jenis dan konsentrasi ekstrak serta fase pertumbuhan terpilih
• MIC (%)
• MBC (%)
Ekstrak:
3 jenis ekstrak: non polar, semipolar dan polar
Studi mekanisme antibakteri: 3 Jenis bakteri patogen:
B. cereus, S. aureus dan S. Typhimurium
Antibiotik
Spora pH
Ekstraksi:
3 jenis pelarut: heksana, etilasetat,metanol
Analisis fitokimia Konsentrasi ekstrak: 0, 10, 20, 30, 40 dan 30% (w/w) Pengujian antibakteri: Analisis Aktivitas Antibakteri Membran sel: • Kebocoran sel
• Penghambatan enzim protease
Morfologi sel:
Rendemen Pengeringan Beku
Rendemen bubuk pengeringan beku dinyatakan dalam persen dan dihitung dengan menggunakan persamaan: berat bahan setelah pengeringan beku (g) per berat bahan sebelum pengeringan beku (g). Penentuan kadar air dengan menggunakan persamaan selisih berat awal dengan berat akhir per berat awal.
Penentuan Minyak Atsiri Andaliman (Farrel 1990)
Sampel ditimbang sebanyak 50 gram, dimasukkan kedalam labu 500 ml, ditambahkan 250 ml air dan diaduk dengan pengaduk magnetik. Kemudian di refluks selama 6 jam atau sampai dipastikan tidak ada minyak yang menetes lagi. Minyak yang tertampung didinginkan, dan gelembung air yang menempel pada lapisan minyak dipisahkan dengan menggunakan kawat halus. Volume minyak yang tertampung dibaca dan dihitung persentase minyak atsiri yang diperoleh. Kandungan minyak atsiri terhitung dalam persen dengan menggunakan persamaan: jumlah minyak yang tertampung (ml) per jumlah sampel (g).
Analisis Proksimat (Apriyantono et al. 1989)
Tahap ini bertujuan untuk mendapatkan informasi awal mengenai komposisi andaliman segar dengan menggunakan metode proksimat. Pengujian dilakukan adalah kadar air (metode oven), kadar protein (metode Kjeldhal-mikro), kadar lemak (metode soxhlet), kadar abu total, kadar karbohidrat (by difference).
Ekstraksi Andaliman
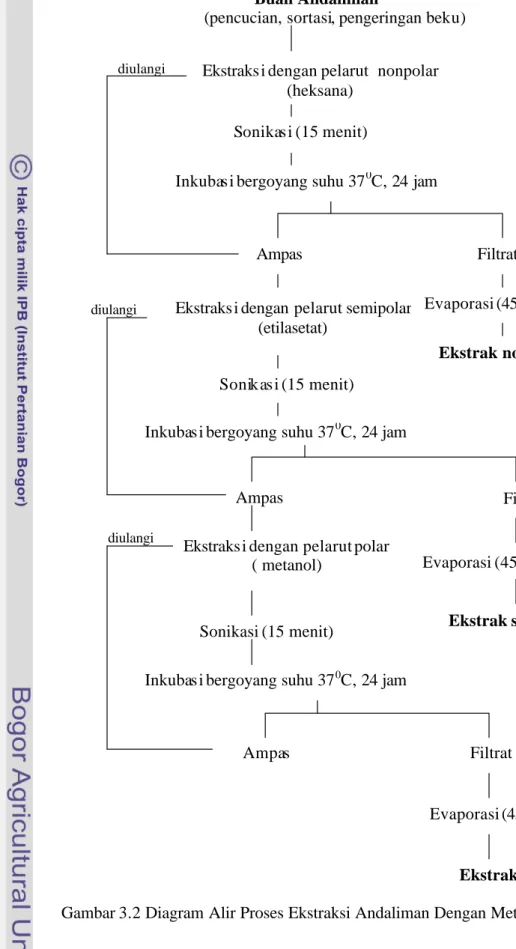
Tahap ini bertujuan untuk mendapatkan stok ekstrak andaliman menggunakan metode ekstraksi maserasi dengan polaritas pelarut yang berbeda, yaitu pelarut heksana (nonpolar), etilasetat (semipolar) dan metanol (polar). Proses ekstraksi seperti disajikan pada diagram alir (Gambar 3.2) dengan pelarut didasarkan pada kekuatan polaritasnya, seperti yang disajikan p ada Tabel 3.1. Tabel 3.1 Penggunaan Pelarut Organik Berdasarkan Kekuatan Polaritasnya
(Houghton dan Raman 1998)
Polaritas Pelarut Kekuatan Pelarut
Nonpolar Semipolar Polar Heksana Etilasetat Metanol 0 4.4 5.1
Sebanyak 100 gram bubuk andaliman dimaserasi dengan 400 ml pelarut nonpolar (heksana), kemudian disonikator selama 15 menit dan dimasukkan dalam inkubator bergoyang dengan kecepatan 150 rpm pada suhu 370C selama 24 jam. Campuran ini kemudian disaring menggunakan penyaring vakum, dan selanjutnya ampas bubuk andaliman tersebut dimaserasi kembali sebanyak 2 kali dengan perlakuan sama seperti di atas, sedangkan filtrat yang diperoleh dipekatkan dengan menggunakan evaporator pada suhu 450C dengan kecepatan 75 rpm selama 45 menit. Tahap ini dilakukan untuk menghilangkan lipid dari ampas dan mendapatkan ekstrak nonpolar yang terkandung dalam andaliman. Ampas andaliman hasil penyaringan terakhir kemudian dikeringkan dalam oven vakum pada suhu 400C selama 24 jam.
Ampas yang telah kering dimaserasi kembali dengan 400 ml pelarut semipolar (etilasetat), kemudian disonikator selama 15 menit, selanjutnya dimasukkan ke dalam inkubator bergoyang dengan kecepatan 150 rpm pada suhu 370C selama 24 jam. Campuran tersebut kemudian disaring dengan menggunakan penyaring vakum, sehingga diperoleh ampas serta filtrat. Setelah ampas kering, kemudian di ekstraksi ulang sebanyak 2 kali dengan perlakuan yang sama seperti di atas, sedangkan filtrat yang dipero leh dipekatkan dengan menggunakan evaporator pada suhu 450C dengan kecepatan 75 rpm selama 1.5 jam. Ekstrak yang diperoleh disebut ekstrak semipolar. Ampas hasil penyaringan terakhir kemudian dikeringkan di dalam oven vakum pada suhu 400C selama 24 jam.
Ampas yang telah kering dimaserasi kembali dengan 400 ml pelarut polar (metanol), kemudian disonikator selama 15 menit, selanjutnya dimasukkan ke dalam inkubator bergoyang dengan kecepatan 150 rpm pada suhu 370C selama 24 jam. Campuran tersebut kemudian disaring dengan menggunakan penyaring vakum, diperoleh ampas dan filtrat. Ampas di ekstraksi ulang sebanyak 2 kali dengan perlakuan sama seperti di atas, sedangkan filtrat yang diperoleh diuapkan dengan menggunakan evaporator pada suhu 450C dengan kecepatan 75 rpm selama 2 jam. Ekstrak yang diperoleh disebut ekstrak polar.
Untuk menyempurnakan hilangnya sisa pelarut, ekstrak d ihembuskan dengan gas nitrogen sampai berat konstan. Selanjutnya ekstrak disimpan dalam botol berwarna coklat (gelap) dan disimpan dalam refrigerator.
Buah Andaliman
(pencucian, sortasi, pengeringan beku)
Gambar 3.2 Diagram Alir Proses Ekstraksi Andaliman Dengan Metode Maserasi Ekstraks i dengan pelarut nonpolar
(heksana) Sonikas i (15 menit)
Ampas
Inkubas i bergoyang suhu 370C, 24 jam
Filtrat
Ekstraks i dengan pelarut semipolar (etilasetat)
Evaporasi (450C), 45 menit
Sonikas i (15 menit)
Inkubas i bergoyang suhu 370C, 24 jam
Ekstrak nonpolar
Filtrat
Evaporasi (450C), 1.5 jam Ekstraks i dengan pelarut polar
( metanol)
Sonikasi (15 menit)
Inkubas i bergoyang suhu 370C, 24 jam
Ampas Filtrat Evaporasi (450C), 2 jam Ampas Ekstrak polar Ekstrak semipolar diulangi diulangi diulangi
Rende men Ekstrak
Rendemen ekstrak dinyatakan dalam persen dan dihitung dengan menggunakan persamaan: berat ekstrak yang diperoleh (g) per berat bahan yang diekstraksi (g).
Persiapan Konsentrasi Ekstrak
Tahap ini bertujuan untuk mengencerkan ekstrak pada konsentrasi tertentu. Ekstrak diencerkan dengan menggunakan pelarut masing-masing dengan konsentrasi 10, 20, 30, 40 dan 50% (w/w). Sebagai kontrol negatif digunakan pelarut heksana (nonpolar), etilasetat (semipolar) dan metanol (polar). Pada setiap kali dilakukan pengujian aktivitas antibakteri, disiapkan ekstrak yang baru.
Persiapan Bakteri Uji
Tahap ini bertujuan untuk menjamin keseragaman kultur yang akan digunakan dalam pengujian daya hambat masing-masing ekstrak andaliman. Persiapan Bakteri B. cereus, S. aureus dan S. Typhimurium (Appendini dan Hotchkiss 2000)
Bakteri uji dalam bentuk liofilisasi terlebih dahulu diaktifkan sebelum digunakan. Tabung dibuka secara aseptis dan pelet liofil dipindahkan secara aseptis menggunakan pinset ke dalam tabung yang berisi medium cair steril NB. Selanjutnya tabung di inkubasi pada suhu 370C selama 24 jam. Untuk penggunaan jangka pendek (3 minggu) dibuat stok bakteri dalam medium agar miring NA. Sebelum digunakan, kultur disegarkan kembali pada medium cair NB pada suhu 370C selama 24 jam. Setelah adanya pertumbuhan, kultur digores dengan menggunakan ose pada NA dan dilakukan pewarnaan Gram untuk melihat homogenitas kultur uji.
Selanjutnya kultur disimpan dalam NB yang mengandung 10% gliserol pada suhu -400C atau untuk penggunaaan jangka pendek (3 minggu) dibuat stok bakteri pada agar miring dengan suhu 60C. Satu ose dari biakan agar miring diinokulasi dalam NB 10 ml dan di inkubasi selama 24 jam pada suhu 370C. Kultur ini digunakan sebagai kultur kerja pada setiap pengujian.
Penentuan Fase Pertumbuhan Bakteri Uji (Harrigan 1998; Lin et al. 2000) Tahap ini bertujuan untuk menentukan fase adaptasi, fase eksponensial, dan fase stasioner masing-masing bakteri uji. Satu ose biakan murni dari agar miring NA diinokulasikan dalam 10 ml NB dan di inkubasi selama 24 jam pada suhu 370C. Selanjutnya sebanyak 10 µl diinokulasi kembali ke dalam 10 ml NB di inkubasi pada suhu 370C selama 0, 1, 2, 3, 4, 5, 6, 8, 10, 12, 16, 20, 25 jam (Lin et al. 2000). Pada setiap waktu inkubasi dilakukan penghitungan jumlah sel dengan menggunakan metode pour plate. Suspensi bakteri dengan beberapa seri pengenceran dituang pada permukaan NA dan di inkubasi pada suhu 370C. Setelah itu dihitung jumlah koloni yang tumbuh (Harrigan 1998).
Pengujian Aktivitas Antibakteri Ekstrak Andaliman Menggunakan Metode Difusi Sumur (Garriga et al. 1993)
Tahap ini bertujuan untuk mendapatkan ekstrak andaliman yang mempunyai aktivitas tertinggi terhadap bakteri uji. Ekstrak yang diuji adalah ekstrak nonpo lar (heksana), ekstrak semipolar (etilasetat) dan ekstrak polar (metanol). Pengujian dilakukan berdasarkan atas kemampuan menghasilkan zona bening berupa diameter penghambatan ekstrak andaliman terhadap bakteri uji (B. cereus, S. aureus dan S. Typhimurium) yang ditumbuhkan pada media agar.
Sebanyak 20 ml NA steril diinokulasikan dengan 0.2% kultur segar berumur 24 jam dalam media NB dengan jumlah sel 107-108 cfu/ml. Selanjutnya media yang telah diinokulasi tersebut dituang kedalam cawan petri hingga ketebalan 4 mm. Setelah agar membeku, dibuat sumur dengan diameter 6 mm. Pada masing-masing sumur-sumur tersebut dimasukkan 60 µl ekstrak andaliman dengan konsentrasi 0, 10, 20, 30, 40, dan 50% (w/w). Masing-masing agar cawan tersebut di inkubasi selama 24 jam pada suhu 370C. Setelah itu dilakukan pengukuran zona penghambatan pertumbuhan bakteri uji yang ditandai dengan adanya areal bening. Areal bening menunjukkan tidak adanya pertumbuhan bakteri uji.
Pengujian Kualitatif Komponen Aktif Ekstrak Andaliman
Tahap ini bertujuan untuk mengetahui golongan senyawa yang terdapat dalam minyak atsiri dan ekstrak andaliman.
Pengujian Golongan Terpenoid dan Steroid (Harbone 1996)
Uji Lie-Bermann-Burchard. Sebanyak 1 mg sampel yang telah kering dilarutkan dalam 2 ml kloroform, kemudian ditambahkan 10 tetes anhidrida asam asetat dan 3 tetes asam sulfat pekat. Larutan dikocok perlahan dan dibiarkan beberapa menit. Hasil uji positif untuk steroid bila terbentuknya warna merah kemudian menjadi biru dan hijau. Hasil uji positif untuk terpenoid bila terbentuk warna merah atau ungu.
Uji Salkowski. Sebanyak 1 mg sampel kering dilarutkan dalam 3 ml kloroform anhidrat, selanjutnya ditambahkan asam sulfat pekat dengan volume sama. Larutan dikocok perlakuann dan dibiarkan sampai lapisan cairan terpisah. Hasil uji positif untuk terpenoid bila terbentuk warna biru yang kemudian berubah menjadi merah pada bagian kloroform, dan hasil uji positif untuk steroid bila terbentuk warna kuning berfluoresensi hijau pada bagian asam.
Pengujian Golongan Saponin (Harbone 1996)
Sebanyak 1 ml sampel pekat dimasukkan ke dalam tabung reaksi, dan ditambahkan 10 ml air panas lalu didinginkan. Selanjutnya dikocok dengan vorteks selama kurang lebih 10 detik. Bila terdapat senyawa saponin dalam ekstrak maka akan terbentuk buih mantap selama sekitar 10 menit. Buih dikatakan mantap bila tingginya 1-10 cm, dan buih tidak hilang bila ditambah HCl 2 N.
Pengujian Golongan Alkaloid (Harbone 1996)
Sampel yang telah dipekatkan dimasukkan dalam spot plate kemudian ditambahkan 3 tetes pereaksi Dragendorf. Hasil uji positif bila terdapat endapan berwarna merah jingga.
Golongan Flavonoid (Harbone 1996)
a. Sebanyak 1 ml sampel ditetesi dengan Pb asetat.
* Hasil uji positif untuk khalkon bila terbentuk warna jingga tua.
* Hasil uji positif untuk auron bila terbentuk warn a merah. b. Sebanyak 1 ml sampel ditambah beberapa tetes NaOH 0.1 N.
* Hasil uji positif untuk flavon dan flavonol bila terbentuk warna kuning
* Hasil uji positif untuk khalkon dan auron bila terbentuk warna merah, atau ungu
c. Sebanyak 1 ml sampel ditambah beberapa tetes H2SO4 pekat, uji positif bila:
* Hasil uji positif untuk flavon dan flavonol bila terbentuk warna kuning * Hasil uji positif untuk flavonoid bila terbentuk warna jingga, atau krem * Hasil uji positif untuk khalkon bila terbentuk warna krem, atau merah tua
Penentuan Nilai MIC dan MBC
Tahap ini bertujuan untuk mengetahui aktivitas penghambatan antibakteri ekstrak andaliman pada bakteri uji dengan menentukan nilai MIC dan MBC.
Nilai Minimum Inhibitory Concentration/ MIC (Kubo et al. 1995)
Nilai MIC adalah konsentrasi minimum ekstrak untuk dapat menghambat pertumbuhan bakteri uji. Penentuan nilai MIC dilakukan dengan menggunakan metode Bloomfield (1991) yaitu dengan memplotkan antara ln Mo (ln konsentrasi ekstrak) pada sumbu X terhadap nilai kuadrat zona penghambatan (Z2) pada sumbu Y. Perpotongan dari regresi linier Y = a + bX dengan sumbu X merupakan nilai Mt. Nilai MIC adalah 0.25 x Mt (Gambar 3.3).
Y
MIC = 0.25 x Mt Y = a + bX
Z2 Mt
Ln Mo X
Hasil perhitungan nilai MIC tersebut diterapkan langsung pada metode Kubo et al. (1995) sebagai berikut, dibuat seri pengujian sebanyak 14 tabung kecil, masing -masing berisi ekstrak dengan konsentrasi 0.0, 0.2, 0.4, 0.8, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 5.0, dan 6.0% (w/w). Total media cair uji setiap tabung adalah 3 ml. Selanjutnya dipersiapkan bakteri uji yang telah disegarkan dan di inkubasi selama 24 jam pada suhu 370C lalu diencerkan 10 kali.
Selanjutnya ke dalam 14 tabung tersebut diinokulasikan dengan 30 µl bakteri uji, di vorteks selama 1-2 menit kemudian di inkubasi pada suhu 370C selama 24 dan 48 jam. Setelah itu dilakukan pengamatan jumlah bakteri dilakukan dengan metode pour plate (Harrigan 1998) setelah inkubasi selama 24 dan 48 jam. Nilai MIC (%) diperoleh dengan menentukan konsentrasi ekstrak terendah yang menunjukk an tidak adanya pertumbuhan dari bak teri uji setelah 24 jam.
Nilai Minimum Bactericidal Concentration/ MBC (Kubo et al. 1995)
Nilai MBC diperoleh dengan menentukan konsentrasi terendah dari 14 seri tabung uji yang menunjukkan penurunan pertumbuhan bakteri uji secara drastis (> 99.9 %) setelah di inkubasi 48 jam dibandingkan dengan jumlah bakteri uji awal (nol jam).
Pengujian Aktivitas Antiba kteri Ekstrak Andaliman terhadap Spora (Garriga et al. 1993)
Bakteri uji (B. cereus, S. aureus dan S. Typhimurium) ditumbuhkan pada suhu 37OC dan diamati pembentukan sporan ya setelah inkubasi selama 12, 24, 48, dan 72 jam dengan cara melakukan pewarnaan dan pengamatan di bawah mikroskop. Sel vegetatif akan diambil dari kultur yang belum membentuk spora berd asarkan hasil pewarnaan . Sebelum dilakukan pengujian pada spora, kultur dipanaskan pada suhu 80OC selama lima menit. Sebanyak 0.2% (w/w) suspensi spora atau sel vegetatif diuji dengan metode difusi sumur.
Pengujian Aktivitas Ekstrak Andaliman pada Beberapa pH (Modifikasi Carson dan Riley 1995)
Tahap ini bertujuan untuk mengetahui pengaruh pH ekstrak etilaseat dan metanol andaliman dalam menghambat pertumbuhan beberapa bakteri patogen.
Konsentrasi ekstrak yang digunakan adalah 10% (w/w). Larutan buffer fosfat dengan pH awal 7.2 diturunkan menjadi pH 4, 5, 6, dan 7 dengan menggunakan HCl 0.1 N. Larutan tersebut digunakan untuk melarutkan ekstrak etilasetat dan ekstrak metanol andaliman.
Pembandingan Aktivitas Ekstrak Andaliman Dengan Streptomisin, Polimiksin B dan Penisilin G (Lin et al. 2000)
Pengujian dilakukan dengan menggunakan metode difusi sumur. Konsentrasi ekstrak andaliman yang digunakan adalah 4000 µg/l, sedangkan konsentrasi antibiotik polimiksin B, streptomisin atau penisilin G berturut-turut adalah 10, 100, 1000 µg/l (Lin et al. 1999 dan Lewis et al. 2004) pada suspensi sel bakteri B. cereus, S. aureus dan S. Typhimurium.
Mekanisme Perusakan Dinding Se l
Tahap ini bertujuan untuk mempelajari mekanisme perusakan sel bakteri yang meliputi: dinding sel (protoplast, hidrofobisitas), mengganggu permeabilitas membran sel (kebocoran sel, penghambatan aktivitas enzim), dan mengamati kerusakan morfologi sel dengan scanning electron microscope (SEM).
Pengujian Aktivitas Antibakteri Ekstrak Andaliman terhadap Protoplast (Nuraida et al. 1999)
S. aureus dan B. cereus diinokulasi ke dalam media NA, kemudian dinkubasi selama 48 jam. Koloni yang terbentuk diambil dengan ose (loop) dan disuspensikan dalam buffer tris HCI steril 10 mmol yang berisi MgCI2 0.01mol/l,
sukrosa 0.5 mol/l, dan enzim lisozim 50 µg/ml sampai mencapai absorbansi 1.0 pada panjang gelombang 650 nm. Suspensi selanjutnya d i inkubasi selama 30 menit hingga hampir seluruh sel membentuk protoplast, yang diamati menggunakan mikroskop. Selanjutnya protoplast dipanen dengan cara di sentrifugasi pada 6000 rpm selama 15 menit, pada suhu ruang dan diresuspensikan dalam 1 ml buffer tris HCI steril 10 mmol tanpa lisozim. Sel utuh sebagai kontrol disuspensikan dalam buffer tris HCI steril 10 mmol. Pengujian aktivitas antibakteri dilakukan dengan metode difusi sumur (Garriga et al. 1993).
Pengujian Hidrofobisitas Bakteri (Jones et al. 1991)
Penentuan hidrofobisitas bakteri dilakukan dengan modifikasi BATH (Bacterial Adherence to Hydrocarbons) pada hidrokarbon n-oktana dengan cara
sebagai berikut: sebanyak 4.8 ml suspensi bakteri uji yang mengan dung 106 cfu/ml disentrifus pada 1900 g selama 15 menit. Supernatan dibuang dan pelet
bakteri ditambah 4.8 ml NB yang mengandung ekstrak andaliman dengan konsentrasi 2, 4 dan 6% (w/w). Sebagai kontrol hidrofobisitas digunakan 1.07 ml buffer fosfat dan 3.73 ml media NB, sehingga volume akhir menjadi 4.8 ml. Selanjutnya masing-masing suspensi bakteri tersebut di inkubasi pada suhu 370C selama 30 menit. Selanjutnya kultur bakteri dipisahkan dengan cara disentrifus 1900 rpm selama 15 menit. Pelet yang terbentuk dicuci satu kali dengan PBS (Phosphat Buffer Saline) steril dan diresuspensikan dalam PBS menjadi 4.8 ml.
Pada setiap 4.8 ml suspensi bakteri yang mengandung 106 cfu/ml ditambahkan masing-masing 0.3, 0.6, 0.9, 1.2 dan 1.5 ml n-oktana dalam tabung yang tahan asam. Selanjutnya divorteks dengan kecepatan konstan selama satu menit, dan diekuilibrasi pada suhu kamar selama 15 menit, sehin gga terjadi pemisahan. Supernatan diambil secara perlahan -lahan menggunakan pipet pasteur, kemudian absorbansi diukur pada ? 600 nm. Hidrofobisitas ditentukan
berdasarkan persentase OD (optical density) (Tabel 3.2).
Persen Hidrofobisitas = 100 - (A x 100/A0)
Keterangan :
A adalah OD dari suspensi bakteri pada fase cair setelah kontak dengan n-oktana. A0 adalah OD suspensi tanpa penambahan n-oktana yang mempunyai nilai
hidrofobisitas setara dengan 0 persen.
Mekanisme Perusakan Membran Sel
Tahap ini bertujuan untuk mempelajari bagaimana mekanisme ekstrak mengganggu permeabilitas membran sel dengan cara mengamati kebocoran sel dan penghambatan aktivitas enzim.
Tabel 3.2 Kriteria Hidrofobisitas Bakteri
Jenis Uji Nilai Kriteria Hidrofobisitas Presipitasi Garam 0.0-1.0 mol/lt Kuat
1.0-2.0 mol/lt Moderat 2.0-4.0 mol/lt Lemah
>4.0 mol/It Negatif Filter Nitro Selulosa >75% Kuat 50-75% Moderat
<50% Negatif
BATH >50% Kuat
20-50% Moderat <20% Negatif Sumber: Santos et al. 1990
Pengujian Kebocoran Sel (Bunduki et al. 1995)
Analisis kebocoran sel dilakukan dengan menggunakan alat Double Beam Spectrophotometer (Model U-2000 Hitachi Instruments, Inc., Westone, MA) pada panjang gelombang 280 nm dan 260 nm. Panjang gelombang 280 nm digunakan untuk mengukur kadar nitrogen dari protein sel, sedangkan panjang gelombang 260 nm untuk mengukur kadar nitrogen asam nukleat sel.
Sebanyak 10 ml kultur murni pada fase eksponensial dan fase stasioner disentrifus pada 10.000 rpm selama 10 menit (Eppendorf Centrifuge 5403) Filtrat dibuang lalu ditambahkan 5 ml larutan garam fisiologis (0.85% NaCl) dalam endapan sel pada tabung reaksi, kemudian di vorteks agar sel homogen dalam larutan fisiologis. Selanjutnya ditambahkan ekstrak etilasetat dan ekstrak metanol dengan konsentrasi 0.0, 0.5, 1.0, 1.5, 2.0, 2.5 MIC dan dibiarkan pada suhu kamar selama 24 jam. Selanjutnya suspensi disentrifus pada 10.000 rpm selama 10 menit dan supernatan disaring dengan kertas saring untuk memisahkan selnya. Analisis dilakukan dengan mengamati optical density (OD) dari cairan supernatan dilakukan yang dimonitor dengan recording spectrophotometer (Model UV-160 Shimadzu UV Visible) pada panjang gelombang 280 dan 260 nm.
Pengujian Aktivitas Enzim Protease (Bergmeyer et al. 1983)
Pengujian ini menggunakan metode kontak dimana bakteri uji dimasukkan dalam medium yang mengandung susu skim 1.5% (v/v) dan ekstrak andaliman 5% (w/w), kemudian d i inkubasi dalam inkubator bergoyang dengan kecepatan 150 rpm selama 24 jam. Suspensi yang mengandung ekstrak tersebut selanjutnya dipisahkan dengan cara disentrifus 3500 rpm. Protein yang tidak terhidrolisis diendapkan dengan 0.1 M asam trikloroasetat (TCA), kemudian dipisahkan dengan sentrifugasi. Penambahan TCA ini sekaligus untuk menginaktifkan protease. Asam amino hasil pemecahan substrat oleh enzim protease terdapat dalam supernatan. Asam amino tersebut direaksikan dengan reagen Folin Ciocalteau (1:2) membentuk larutan berwarna kuning muda sehingga dapat dilakukan pembacaan pada daerah sinar tampak yang diukur pada panjang gelombang 580 nm dengan menggunakan spektrofotometer. Satu unit aktivitas enzim setara dengan jumlah enzim yang dapat menghasilkan satu mikromol tirosin per menit. Unit aktivitas enzim dapat dihitung sebagai berikut:
Asp - Abl
U = ___________ x FP x 1/T Ast - Abl
Keterangan:
U = unit aktivitas protease (unit/ml) Asp = nilai absorbansi sampel
Ast = nilai absorbansi standar
Abl = nilai absorbansi blanko
FP = faktor pengenceran T = waktu inkubasi (menit)
Analisis Kerusakan Morfologi Sel (JEOL 1995 ; Noor 2001)
Sel bakteri untuk pengamatan dengan SEM dipersiapkan dalam bentuk pelet dengan cara sebagai berikut: 4 ml kultur bakteri uji dengan jumlah 106-107 cfu/ml dimasukkan ke 76 ml media NB dalam erlenmeyer 150 ml. Selanjutnya ditambahkan ekstrak etilasetat dan ekstrak metanol masing-masing sebanyak 4% (w/w), dikontakkan selama 4 jam pada inkubator bergoyang dengan kecepatan 150 rpm pada suhu 370C. Setelah itu sel dipisahkan dengan cara
disentrifus 12000 rpm selama 10 menit. Pelet yang diperoleh dicuci dengan buffer fosfat 0.1 M sebanyak 3 kali untuk membuang sisa ekstrak.
Selanjutnya pelet difiksasi pada stub aluminium dengan glutaraldehida 2.5% (dalam 0.1 M buffer fosfat pH 7.2) selama 1.5 jam, lalu dicuci dua kali dengan buffer fosfat 0.05 M pH 7.2 masing-masing selama 20 menit. Setelah itu difiksasi kembali dengan osmium tetraoksida 1% (v/v) (dalam 0.05 M buffer fosfat) selama 2 jam dan dicuci dengan air destilasi yang disuling dua kali (dd H2O) selama 1-2 menit, dikeringkan dengan etanol pada konsentrasi
bertingkat (25, 50, 75, dan 100%) sebanyak 3 kali masing-masing selama 10 menit. Spesimen yang telah kering lalu dilapisi dengan argon dengan ketebalan 20-30 mm selama 5 detik. Sampel siap untuk diamati dibawah scanning electron microscope tipe JEOL JSM-5310 LV.
Analisis Data
Analisis data yang dilakukan untuk mengetahui pengaruh jenis ekstrak andaliman, pengaruh konsentrasi ekstrak, pengaruh fase pertumbuhan bakteri, serta antibiotik , hidrofobisitas dan kebocoran sel menggunakan metode rancangan acak lengkap (RAL) faktorial dilanjutkan dengan uji duncan dengan sistem SPSS (Statistical Product and Service Solutions) versi 11. Data lain seperti, inaktivasi enzim protease bakteri, sel vegetatif, protoplast B. cereus, pH, spora dan SEM diolah secara tabulasi dalam bentuk tabel, grafik atau gambar (Santoso 2002).