RENCANA PELAKSANAAN PEMBELAJARAN(RPP)
Sekolah : SMA Negeri 1 Batujajar Mata Pelajaran : Kimia Kelas/Semester : XI/Ganjil Materi Pokok : Hidrokarbon
Alokasi Waktu : 8 JP ( 2 x Pertemuan) Silabus : KI 3/KI 4/KD.3.1 dan 4.1
INDIKATOR PEMCAPAIAN KOMPETENSI
1. Menjelaskan struktur senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon. 2. Menjelaskan struktur senyawa hidrokarbon berdasarkan pemahaman penggolongan senyawanya. 3. Menjelaskan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon.
4. Mengelompokkan Senyawa Hidrokarbon berdasarkan rantai Karbon terbuka dan tertutup (alifatik, alisiklik dan aromatik) dengan tepat.
5. Mengelompokkan Senyawa Hidrokarbon berdasarkan deret homolog (HidroKarbon Jenuh yaitu Alkana dan HidroKarbon Tidak Jenuh yaitu Alkena dan Alkuna) dengan tepat.
6. Menganalisis stuktur senyawa hidrokarbon berdasarkan tata nama senyawa dan/atau sebaliknya.
TUJUAN PEMBELAJARAN
Melalui model pembelajaran inkuiri terbimbing, peserta didik mampu mencari dan menyelidiki serta menganalisis senyawa hidrokarbon, secara sistematis, kritis, dan logis. Peserta didik mampu menganalisis hasil penelusuran informasi mengenai senyawa hidrokarbon.
KEGIATAN PEMBELAJARAN : pertemuan ke – 1 dan k – 2 ( 180 menit) No Tahap/Sintak Model Kegiatan Nilai-Nilai Karakter Waktu 1 Kegiatan Pendahuluan PPK
a).Peserta didik memberi salam, berdoa, absensi, mengecek kebersihan kelas bersama-sama dengan guru.
b).Peserta didik menerima motivasi dari guru sebelum pelajaran dimulai
(Jika dilakukan di rumah, maka peserta didik menyesuaikan kegiatan sesuai kondisi masing-masing)
Relegius Gotong Royong
15’
2 Kegiatan Inti Tahapan
Reading Litersasi
-Literasi -4C -HOTS
a).Tahap 1: persiapan + Tahap 2: mengamati +Tahap 3 :
hipotesis
Peserta didik membaca perintah yang diberikan oleh guru.. Serta membaca dari modul. Informasi tujuan pembelajaran, metoda pembelajaran dan teknik penilaian yang akan digunakan
b).Sintak tahap 3: mengumpulkan data + tahap 4:
pengolahan data.
Peserta didik mengindentifikasi dari modul dan sumber belajar lainnya (buku paket dan internet)
c).Sintak tahap 4: memverifikasi data + tahap 5:
menyimpulkan.
Peserta didik menyelesaikan pekerjaan dalam modul serta
menyimpulkan hasil pembelajarannnya.
Kemandirian (berfikir kritis, kreatif)
135’
3 Kegitan Penutup a).Peserta didik mereview pembelajaran yang telah dilaksanakan.
b).Peserta didik mengucapkan salam saat guru keluar ruangan , dan mengakhiri prembelajaran
Kemandirian (berfikir kritis, kreatif)
30’
Total Alokasi waktu 1 x Pertemuan 180’
SUMBER BELAJAR
Modul Hidrokarbon
Buku Paket Erlangga Kelas XI
PENILAIAN
Penilaian Sikap : Observasi / Pengamatan/ Jurnal Penilaian Kognitif : Latihan soal dalam modul Penilaian Ketrampilan : Unjuk Kerja
MODUL
HIDROKARBON
Gambar 01. Berbagai senyawa hidrokarbon yang sering kita temukan dalam kehidupan sehari-hari.
Karbon dapat membentuk berjuta-juta macam senyawa hanya dengan beberapa atom lain, misalnya hydrogen, oksigen, dan nitrogen. Beberapa molekul besar dengan struktur sangat kompleks yang yang membentuk tubuh manusia dan berbagai makhluk hidup di dunia, berbasis pada senyawa karbon. Senyawa lain yang banyak digunakan dalam kehidupan sehari-hari, mulai dari plastik, serat kain dan berbagai jenis obat-obatan, semuanya merupakan senyawa karbon. Bahkan minyak bumi yang mempunyai peranan penting secara ekonomis juga termasuk senyawa karbon. Lalu apa yang dimaksud dengan senyawa karbon? Mengapa senyawa karbon jumlahnya sangat banyak, bahkan mencapai jutaan ?
PERTEMUAN KE – 1
A. Senyawa Organik dan Senyawa Anorganik serta kegunaanya
Senyawa karbon mempunyai jenis, sifat, dan kegunaan yang bermacam-macam. Oleh karena itu, senyawa karbon dibahas khusus dalam cabang ilmu kimia yang disebut kimia organik. Nama kimia organic didasarkan pada awal perkembangan ilmu kimia karbon. Dahulu, orang berpendapat bahwa senyawa karbon hanya dapat diperoleh dari makhluk hidup. Pada waktu itu, senyawa karbon dianggap hanya dapat disintesis (dibuat) oleh tubuh makhluk hidup (organisme). Oleh karena itu, senyawa karbon juga dikenal sebagai senyawa organik, misalnya karbohidrat, protein, lemak, dan vitamin.
Pada awalnya, senyawa karbon yang dapat disintesis di luar tubuh makhluk hidup disebut sebagai senyawa karbon anorganik, misalnya garam karbonat (CO32-), gas
karbon dioksida (CO2), dan karbon monoksida (CO). Pendapat ini bertahan lama sampai
akhirnya pada tahun 1828 Friedrich Wohler dapat mensintesis urea di luar tubuh makhluk hidup, yaitu dengan cara memanaskan ammonium sianat menjadi urea. Urea yang dikenal sebagai senyawa organic, secara alami merupakan hasil metabolisme tubuh yang biasa dikeluarkan bersama dengan urine manusia.
NH4+NCO- → CO(NH2)2
Atas dasar pemuan Friedrich Wohler tesebut, penggolongan senyawa karbon organic dan senyawa karbon anorganik tidak didasarkan lagi kepada asalnya (disintesis oleh organisme hidup atau di luar tubh makhluk hidup), tetapi lebih didasarkan kepada
sifat dan strukturnya.
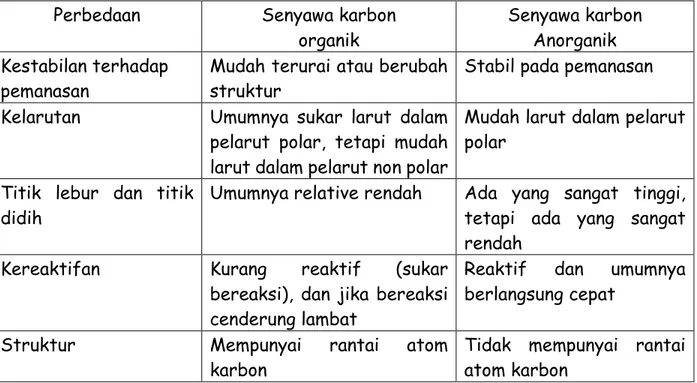
Senyawa karbon organic mempunyai ciri khas bahwa di dalam strukturnya terdapat rantai atom karbon, sedangkan pada senyawa anorganik umumnya tidak mempunyai rantai atom karbon. Beberapa perbedaan yang umum dapat dilihat pada tabel 1.1.
Tabel 1.1. Perbedaan senyawa karbon organic dan senyawa karbon anorganik.
Perbedaan Senyawa karbon
organik
Senyawa karbon Anorganik Kestabilan terhadap
pemanasan
Mudah terurai atau berubah struktur
Stabil pada pemanasan Kelarutan Umumnya sukar larut dalam
pelarut polar, tetapi mudah larut dalam pelarut non polar
Mudah larut dalam pelarut polar
Titik lebur dan titik didih
Umumnya relative rendah Ada yang sangat tinggi, tetapi ada yang sangat rendah
Kereaktifan Kurang reaktif (sukar
bereaksi), dan jika bereaksi cenderung lambat
Reaktif dan umumnya berlangsung cepat
Struktur Mempunyai rantai atom
karbon
Tidak mempunyai rantai atom karbon
B. Identifikasi dan Sumber Senyawa Hidrokarbon
1. Identifikasi Senyawa Karbon
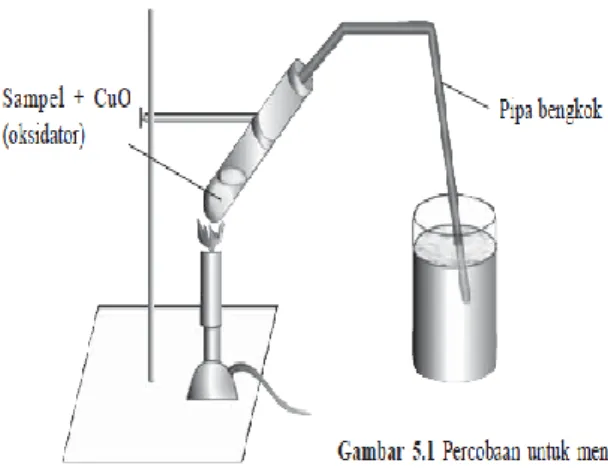
Identifikasi apakah suatu bahan (zat) merupakan senyawa karbon atau tidak, dapat dilakukan dengan membakar bahan tersebut. Pembakaran tidak sempurna dari senyawa karbon akan menghasilkan zat sisa berupa arang (jelaga) atau karbon. Sedangkan bila pembakarannya berlangsung sempurna, akan menghasilkan gas CO2.
Keberadaan gas CO2 ini dapat diketahui dengan cara mengalirkan air kapur (larutan
Ca(OH)2 atau air barit (larutan Ba(OH)2). Apabila senyawa yang dibakar sempurna merupakan senyawa karbon (menghasilkan CO2), air kapur atau air barit akan menjadi keruh. Reaksi yang terjadi antara gas CO2 dengan kapur.
Gambar 1.2. Identifikasi senyawa karbon Bahan + CuO (oksidator) →CO2(g) + H2O(l)
Uji adanya CO2:
CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l) Air kapur
Uji adanya H2O:
H2O(l) + kertas kobalt biru →kertas kobalt merah muda
2. Sumber Senyawa Karbon a. Tumbuhan dan Hewan
Tumbuhan dan hewan merupakan “mesin” pembuatan senyawa karbon, misalnya protein, karbohidrat, lemak, dan berbagai senyawa yang tidak mungkin diperoleh dan ditemukan di luar tubuh hewan. Penelitian menganai senyawa karbon yang terdaoat dalam tumbuhan telah menghasilkan jenis obat-obatan baru yang sebelumnya tidak dikenal.
b. Batu bara
Batu bara merupakan hasil pelapukan tumbuhan yang berlangsung jutaan tahun yang lalu dengan tekanan dan temperature yang sangat tinggi. Pengolahan batu bara dengan cara distilasi pemecahan (cracking) menghasilkan gas batu bara, ter batu bara, dan kokas.
Kokas merupakan bahan bakar yang sangat baik dan digunakan berbagai industry, sedangkan gas batu bara dan ter batu bara dapat diproses dengan berbagai reaksi kimia menjasi bermacam-macam senyawa karbon yang lebih bermanfaat.
c. Gas alam dan minyak bumi
Gas alam dan minyak bumi mengandung banyak senyawa karbon yang berperan penting dalam berbagai industry. Komponen utama dalam gas alam dan minyak bumi adalah senyawa hidrokarbon.
C. Kekhasan Atom Karbon
Sesuai dengan nomor golongannya, karbon mempunyai 4 elektron valensi. Hal itu meguntungkan karena untuk mencapai kestabilan, karbon dapat membentuk 4 ikatan kovalen. Unsur dari golongan lain tidak dapat membentuk ikatan kovalen sebanyak itu kecuali jika melebihi konfigurasi octet. Boron (golongan III A) dan Nitrogen (golongan VA) sebagai contoh hanya dapat membentuk 3 ikatan kovalen. Karbon dapat membentuk ikatan dengan berbagai unsur nonlogam, terutama dengan Hidrogen (H), oksigen(O), nitrogen (N), dan golongan halogen(F,Cl, Br, I) bahkan dengan beberapa unsur logam, seperti magnesium. Perhatikan beberapa contoh berikut: C H H H H C H O H H H C Cl Cl Cl H C H N H H H H
Metana (CH4) methanol (CH3OH) kloroform (CHCl3) metilamina (
CH3NH2)
Selain dapat berikatan dengan atom-atom lain, atom karbon dapat juga berikatan kovalen dengan atom karbon lain, baik ikatan ikatan kovalen tunggal, maupun ikatan rangkap dua dan tiga, seperti etana, etena, etuna (ingat pelajaran tata nama senyawa organik). Ikatan kovalen yang terbentuk pada atom karbon relatif kuat karena atom karbon memiliki jari-jari atom yang relatife kecil.
C H C H H H H H C C H H H H H C C H Etana etena etuna Kecendrungan atom karbon dapat berikatan dengan atom karbon lain memungkinkan terbentuknya senyawa karbon dengan berbagai struktur ( membentuk rantai panjang atau siklik). Rantai karbon yang terbentuk dapat berupa rantai karbon lurus atau rantai bercabang.
C H C H H H C H H C H H C H H C H H H H C H C H H H C H H C H H C H H C H H H C H H C H H H Heksana (C6H14) Oktana(C8H18) C H C H H H C H H C H H C H H C H H H C H H C H H C H H C H H H Dekana (C10H22)
Jika satu atom hydrogen pada metana (CH4) diganti oleh gugus -CH3 maka akan
terbentuk etana ( CH3 – CH3 ). Jika satu hidrogen pada etana diganti oleh gugus –CH3
maka akan terbentuk propana ( CH3 – CH2 – CH3) dan seterusnya hingga terbentuk
senyawa karbon berantai atau siklik.
Berdasarkan jumlah atom karbon yang diikatnya, atom karbon dengan empat ikatan kovalen tunggal dibedakan atas atom karbon primer, sekunder, tertier, dan kuartener. Atom karbon primer adalah atom karbon yang terikat langsung pada 1 atom karbon yang lainnya. Atom karbon sekunder adalah atom karbon yang terikat langsung pada 2 atom karbon yang lainnya. Atom karbon tertier adalah atom karbon yang terikat langsung pada 3 atom karbon yang lainnya. Atom karbon kuartener adalah atom karbon yang terikat langsung pada 4 atom karbon yang lainnya.
Atom C primer : atom C nomor 1, 6, 7, 8, 9 Atom C sekunder : atom C nomor 2, 4
Atom C tertier : atom C nomor 3 Atom C kuartener : atom C nomor 5 PERTEMUAN KE - 2
D. Hidrokarbon
1. Penggolongan Hidrokarbon
Penggolongan hidrokarbon didasarkan pada dua hal, yaitu bentuk rantai karbon dan jenis ikatan.
a. Berdasarkan Bentuk Rantai Karbon
1) Rantai karbon alifatis, yaitu rantai karbon terbuka. Rantai karbon alifatis ini bisa lurus dan bisa juga bercabang.
Contoh:
C
H H HC
C
H H HC
H H 1 2 8 3 3 4 3 5 3 6 7 9C
C
H HC
H H HC
H H HC
H H H H2) Rantai karbon siklis, yaitu rantai karbon tertutup. Dibedakan atas karbosiklik dan heterosiklik.
a) Karbosiklik adalah senyawa karbon siklik yang rantai lingkarnya hanya terdiri dari
atom C saja. Yang termasuk karbosiklik adalah senyawa aromatis dan alisiklik.
1.1. Senyawa aromatis adalah senyawa karbosiklik yang terdiri atas 6 atom karbon
atau lebih yang memiliki ikatan rangkap 2 terkonjugasi Contoh:
1.2. Senyawa alisiklik adalah senyawa karbosiklik yang hanya
mempunyai ikatan tunggal.
Contoh:
b) Heterosiklik adalah senyawa karbosiklik yang di dalam rantai lingkarnya terdapat atom lain selain atom karbon.
Contoh:
b. Berdasarkan jenis ikatan
1). Ikatan jenuh, jika semua ikatan karbonnya merupakan ikatan tunggal (– C – C –).
Contoh:
2). Ikatan tak jenuh, jika mengandung ikatan rangkap 2 (– C = C –) maupun rangkap 3
pada ikatan karbon-karbon.
Dikatakan tak jenuh karena ikatan rangkap, baik rangkap 2 maupunrangkap 3 ini masih
Dapat mengalami pemutusan ikatan. Contoh:
2. Tatanama Senyawa Hidrokarbon a. Alkana
1.) Rumus Umum Alkana
Alkana merupakan senyawa hidrokarbon alifatik jenuh, yaitu
hidrokarbon dengan rantai terbuka dan semua ikatan karbonnya merupakan ikatan tunggal. Senyawa alkana mempunyai rumus (JamesE. Brady):
Nama-nama sepuluh alkana dengan jumlah atom karbon 1 sampai 10 terdapat pada tabel di bawah ini. Hal ini merupakan dasar nama-nama seluruh senyawa organik.
2.) Gugus Alkil
Gugus alkil adalah alkana yang telah kehilangan satu atom H. Gugus alkil ini
dapat dituliskan dengan menggunakan rumus:
Dengan menggantikan satu atom H, maka namanya juga akan berubah dari metana menjadi metil. Berikut ini beberapa gugus alkil yang biasa digunakan.
Sedangkan gugus butyl ada empat jenis, yaitu :
3). Tata Nama Alkana
Dalam pemberian nama alkana ini akan sangat sulit jika hanya menggunakan tata nama alkana biasa (metana s.d. dekana, untuk C1 – C10). Hal ini disebabkan adanya isomer-isomer dalam alkana, sehinggaperlu adanya nama-nama khusus. Misalnya, awalan normal digunakan untuk rantai lurus, sedangkan awalan iso untuk isomer yang mempunyaisatu cabang CH3 yang terikat pada atom karbon nomor dua. Padahalsangat sulit bagi kita untuk memberikan nama pada rantai
karbon yang mempunyai banyak sekali isomer. Oleh karena itu, perhimpunan kimiawan
internasional pada pertemuan di Jenewa pada tahun 1892 telah merumuskan aturan penamaan senyawa kimia. Tata nama yang mereka rumuskan itu terkenal dengan tata nama IUPAC (International Unionof Pure and Applied Chemistry). Nama yang diturunkan dengan aturan
ini disebut nama sistematik atau nama IUPAC, sedangkan nama yangsudah biasa digunakan sebelum tata nama IUPAC tetap digunakan dandisebut dengan nama
biasa atau nama trivial.
Aturan IUPAC untuk penamaan alkana bercabang sebagai berikut. a) Nama alkana bercabang terdiri dari dua bagian, yaitu:
1) Bagian pertama, di bagian depan, yaitu nama cabang (cabangcabang). 2) Bagian kedua, di bagian belakang, yaitu nama rantai induk.
(John Mc. Murry Fay, 4th ed.)
Contoh:
b) Rantai induk adalah rantai terpanjang dalam molekul. Bila ter-dapat dua atau lebih rantai terpanjang, maka harus dipilih yang mempunyai cabang terbanyak. Induk diberi nama alkana tergantung pada panjang rantai. Contoh:
c). Cabang diberi nama alkil, yaitu nama alkana yang sesuai dengan mengganti akhiran ana menjadi il. Gugus alkil mempunyai rumus umum CnH2n + 1 dan dinyatakan dengan lambang R (lihat tentang alkil).
d). Posisi cabang dinyatakan dengan awalan angka. Untuk itu rantai induk perlu dinomori. Penomoran dimulai dari salah satu ujung rantai induk sedemikian hingga posisi cabang mendapat nomor terkecil.
Contoh:
e.) Jika terdapat dua atau lebih cabang yang sama, hal ini dinyatakan dengan awalan di, tri, tetra, penta, dan seterusnya pada nama cabang.
f) . Cabang-cabang yang berbeda disusun sesuai urutan abjad dari nama cabang itu.
Misalnya:
• Etil ditulis terlebih dahulu daripada metil. • Isopropil ditulis terlebih dahulu daripada metil.
Berdasarkan aturan tersebut, penamaan alkana dapat dilakukan dengan langkah-langkah sebagai berikut.
1) Memilih rantai induk, yaitu rantai terpanjang yang mempunyai cabang terbanyak.
2) Memberi penomoran dimulai dari salah satu ujung, sehingga cabang mendapat nomor terkecil.
3). Menuliskan nama dimulai dengan nama cabang yang disusun menurut abjad,
Kemudian diakhiri dengan nama rantai induk. Posisi cabang dinyatakan dengan awalan angka.
Antara angka dengan angka dipisahkan dengan tanda koma (,), sedangkan antara angka dengan huruf dipisahkan tanda jeda (–). Berikut ini contoh pemberian nama pada alkana.
4). Isomerisasi pada Alkana
Sebagaimana telah kita pelajari di depan bahwa pada senyawa hidrokarbon dikenal istilah isomer. Isomer yang terjadi pada alkana adalah isomer rangka. Sebagai contoh C5H12 mempunyai isomer:
Artinya, senyawa dengan rumus molekul C5H12 memiliki 3 isomer. 5). Sifat Alkana
a). Semua hidrokarbon merupakan senyawa nonpolar sehingga tidak larut dalam air. Jika suatu hidrokarbon bercampur dengan air, maka lapisan hidrokarbon selalu di atas sebab massa jenisnya lebih kecildaripada 1.Pelarut yang baik untuk hidrokarbon adalah pelarut nonpolar, seperti CCl4
atau eter.
b) Makin banyak atom C, titik didih makin tinggi. Untuk hidrokarbonyang berisomer (jumlah atom C sama banyak), titik didih makintinggi apabila rantai C makin panjang (bercabang sedikit).
c) Pada suhu dan tekanan biasa, empat alkana yang pertama (CH4 sampai C4H10)
berwujud gas. Pentana (C5H12) sampai heptadekana (C17H36) berwujud cair,
d) Jika direaksikan dengan unsur-unsur halogen (F2, Cl2, Br2, dan I2), maka
atom-atom H pada alkana mudah mengalami substitusi(penukaran) oleh atom-atom halogen.
e) Alkana dapat mengalami oksidasi dengan gas oksigen, dan reaksi pembakaran ini selalu menghasilkan energi. Itulah sebabnya alkana digunakan sebagai bahan bakar. Secara rata-rata, oksidasi 1 gram alkana menghasilkan energi sebesar 50.000 joule.
b. Alkena
1). Rumus Umum Alkena
Alkena adalah hidrokarbon alifatik tak jenuh yang memiliki satu ikatan
rangkap (C = C). Senyawa yang mempunyai dua ikatan rangkap disebut alkadiena, yang mempunyai tiga ikatan rangkap disebut alkatriena, dan seterusnya.
Bagaimana rumus umum alkena? Perhatikan senyawa-senyawa di bawah ini kemudian bandingkan!
Apa kesimpulan yang Anda ambil? Ya benar, alkena ternyata mengikat lebih sedikit dua atom hidrogen dibandingkan alkana. Karena rumus umum alkana CnH2n + 2, maka rumus umum alkena adalah (James E. Brady, 1990):
2). Tata Nama Alkena
a.) Alkena rantai lurus
Nama alkena rantai lurus sesuai dengan nama–nama alkana, tetapi dengan mengganti akhiran –ana menjadi –ena.
Contoh: • C2H4 etena
• C3H6 propena
• C4H8 butena
b) Alkena rantai bercabang Urutan penamaan adalah:
1.) Memilih rantai induk, yaitu rantai karbon terpanjang yang mengandung ikatan
rangkap. Contoh:
2). Memberi nomor, dengan aturan penomoran dimulai dari salah satu ujung rantai induk, sehingga ikatan rangkap mendapat nomor terkecil (bukan berdasarkan posisi cabang).
Contoh:
3) Penamaan, dengan urutan:
- nomor atom C yang mengikat cabang - nama cabang
- nomor atom C ikatan rangkap - nama rantai induk (alkena)
3). Keisomeran Alkena
Alkena mempunyai dua keisomeran sebagai berikut. 1) Keisomeran Struktur
Keisomeran struktur, yaitu keisomeran yang terjadi jika rumus molekul
sama
tetapi rumus struktur berbeda. Keisomeran pada alkena mulai ditemukan pada C4H8 terus ke suku yang lebih tinggi. Perhatikan contoh di bawah ini!
a) C4H8 mempunyai tiga macam isomer, yaitu:
b). C5H10 mempunyai lima macam isomer, yaitu:
2). Keisomeran Geometri
Keisomeran geometri, yaitu keisomeran yang terjadi karena perbedaan
orientasi
gugus-gugus di sekitar C ikatan rangkap.
Contoh:
2–butena mempunyai dua isomer geometri, yaitu cis–2–butena dan trans–2–butena.
Syarat terjadinya isomer geometri adalah apabila masing-masing atom karbon yang berikatan rangkap mengikat 2 atom atau 2 gugus yang berbeda, sehingga jika atom atau gugus yang diikat tersebut bertukar tempat, maka strukturnya akan menjadi berbeda.
4). Sifat-sifat Alkena
a). Sifat Fisis
Titik leleh dan titik didih alkena hampir sama dengan alkana yang sesuai. Pada suhu kamar, suku-suku rendah berwujud gas, suku suku sedang berwujud cair, dan suku-suku tinggi berwujud padat.
b) Reaksi-reaksi Alkena
Alkena jauh lebih reaktif daripada alkana karena adanya ikatan rangkap. Reaksi alkena terutama terjadi pada ikatan rangkap tersebut. Reaksi-reaksi alkena sebagai berikut.
1). Reaksi Adisi (penambahan atau penjenuhan)
Reaksi adisi, yaitu pengubahan ikatan rangkap menjadi ikatan tunggal
dengan cara
mengikat atom lain.
Zat-zat yang dapat mengadisi alkena adalah:
2) Reaksi Pembakaran (oksidasi dengan oksigen)
Pembakaran sempurna alkena menghasilkan CO2 dan H2O.
C2H4 + 3 O2 → 2 CO2 + 2 H2O
Pembakaran tidak sempurna alkena menghasilkan CO dan H2O.
C2H4 + 2 O2 → 2 CO + 2 H2O
3) Reaksi Polimerisasi
Reaksi polimerisasi adalah reaksi penggabungan molekul-molekul sederhana
(monomer) menjadi molekul besar (polimer). Contoh:
c. Alkuna
1) Rumus Umum
Alkuna adalah senyawa hidrokarbon alifatik tak jenuh yang mengandung
ikatan rangkap tiga.
Perhatikan contoh berikut. :
Bagaimana rumus umum alkuna? Masih ingatkah Anda dengan senyawa alkadiena? Perhatikan rumus struktur senyawa-senyawa di bawah ini!
Bagaimana rumus umum alkuna? Masih ingatkah Anda dengan senyawa alkadiena? Perhatikan rumus struktur senyawa-senyawa di bawah ini!
2). Tata Nama Alkuna
a) Alkuna rantai lurus namanya sama dengan alkana, hanya akhi “ana” diganti dengan “una”. Contoh: C3H4: propuna C5H8: pentuna C4H6: butuna
b) Alkuna rantai bercabang Urutan penamaan adalah:
1) Memilih rantai induk, yaitu rantai karbon terpanjang yang mengandung ikatan rangkap tiga. Contoh:
2). Penomoran alkuna dimulai dari salah satu ujung rantai induk,sehingga atom C yang berikatan rangkap tiga mendapat nomor terkecil. Contoh:
3). Penamaan, dengan urutan: • nomor C yang mengikat cabang • nama cabang
• nomor C yang berikatan rangkap tiga • nama rantai induk (alkuna)
Contoh:
3). Keisomeran Alkuna
Alkuna hanya mempunyai keisomeran struktur, tidak mempunyai keisomeran geometri (mengapa?). Keisomeran alkuna dimulai dari C4H6.
Contoh:
4). Sifat-sifat Alkuna a) Sifat Fisis
Sifat fisis alkuna sama dengan sifat fisis alkana maupun alkena. b) Sifat Kimia (Reaksi Alkuna)
Reaksi- reaksi pada alkuna mirip dengan alkena, hanya berbeda pada kebutuhan jumlah pereaksi untuk penjenuhan ikatan rangkap.
Alkuna membutuhkan jumlah pereaksi dua kali kebutuhan pereaksi pada alkena untuk jumlah ikatan rangkap yang sama.
Contoh:
Reaksi penjenuhan etena oleh gas hidrogen CH2 = CH2 + H2 → CH3 –CH3
etena etana
LATIHAN SOAL
Diskusikanlah pertanyaan-pertanyaan berikut ini dan jawablah dengan tepat! A. Simaklah tabel titik didih alkana rantai lurus berikut:
Nama Senyawa
Rumus
Molekul Wujud Zat
Massa Molekul Titik Didih (°C) Etana Propana Butana Pentana Heksana Heptana C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 Gas Gas Gas Cair Cair Cair 30 44 58 72 86 100 – 88,6 – 42,1 0,5 36,1 68,9 98,4 1. Jelaskan hubungan antara massa molekul alkana dengan titik didihnya?
2. Jelaskan hubungan wujud zat dengan rumus molekul dan massa molekul alkana?
3. Buatlah grafik titik didih alkana terhadap peningkatan jumlah atom C! 4. Gambarkan struktur molekul dari senyawa berikut:
a. 2,2-dimetil-5-isopropilnonana b. 2,4-dimetil-5-propildekana
5. Tuliskan semua struktur yang mungkin dari senyawa C6H14 (heksana). Berapa
jumlah isomernya? Beri namamasing-masing isomer tersebut menurut aturan IUPAC.
B. Jawablah pertanyaan-pertanyaan seputar senyawa hidrokarbon alkena berikut!
1. Minyak goreng dari kelapa (minyak curah) membentuk padatan jika pagi hari dan dapat mencair jika dipanaskan, sedangkan minyak goreng instan tidak
mencair. Semua minyak goreng mengandung ikatan rangkap dua. Bagaimana fakta ini dapat dijelaskan kaitannya dengan struktur alkena?
2. Perhatikan tabel titik didih beberapa senyawa alkena berikut:
Nama Senyawa Titik Didih
(°C) 1-butena 2-butena 2-metil-2-propena 5 2,5 –6
Ketiga senyawa tersebut memiliki rumus molekul yang sama dan berisomer satu sama lainnya. Jelaskan mengapa dengan jumlah C yang sama ketiga senyawa tersebut memiliki perbedaan titik didih?
3. Tuliskan nama senyawa berikut berdasarkan aturan IUPAC.
4. Gambarkan isomer posisi yang mungkin dari senyawa alkena dengan rumus molekul C7H14. Beri nama masing-masing isomer tersebut menurut aturan
IUPAC.
5. Gambarkan isomer geometri yang dimiliki oleh senyawa alkena
untukCH3CH=CHCH2CH3
C. Jawablah pertanyaan-pertanyaan seputar senyawa hidrokarbon alkuna berikut!
Perhatikan tabel titik didih alkuna rantai lurus berikut: Nama
Senyawa Masa Molekul
Titik didih (°C) Wujud Zat Etuna 26 -75 Gas Propuna 40 -23 Gas Butuna 54 8,1 Gas Pentuna 68 39,4 Cair Heksuna 82 72 Cair a. b.
1. Jelaskan hubungan antara massa molekul alkuna dengan titik didihnya?
2. Jelaskan hubungan wujud zat dengan rumus molekul dan massa molekul alkuna?
3. Buatlah grafik titik didih alkuna terhadap peningkatan jumlah atom C! 4. Tuliskan nama senyawa berikut:
a. CH3CH2CH2–C≡C–CH3
b. CH3CH2CH2CH–C≡CH
│
CH2CH2CH3
Gambarkan rumus struktur untuk 4,4-dimetil-2-isopropil-1-pentuna. PERTEMUAN KE – 3
E. Minyak Bumi
Minyak bumi merupakan salah satu hasil alam yang banyak digunakan dalam kehidupan sehari-hari. Hasil pengolahan dari minyak bumi sangat membantu manusia dalam kehidupan. Contoh pemanfaatan bahan bakar bensin yang biasa digunakan kendaraan yang berlalu lalang di jalanan.
Proses terjadinya minyak bumi tidak berlangsung dalam waktu singkat. Maka penggunaan hasil pengolahan minyak bumi sebaiknya digunakan seefektif dan sebijak mungkin.
TUGAS !
Kemukakan narasi sertakan gambarkan pengolahan minyak bumi hingga diperoleh fraksi minyak bumi!
(Narasi dapat berupa tulisan tangan di kertas polio bergaris atau HVS, untuk gambar gunakan kreatifitas kalian dalam menggambar sertakan pula sumber belajar yang kalian gunakan, dapat diperoleh dari buku atau internet)
Hasil pekerjaan dapat dikumpulkan pada saat pertemuan tatap muka di sekolah.
PERTEMUAN KE - 4
F. Dampak Pembakaran Bahan Bakar
Penggunaan bahan bakar tidak terlepas dari dampak yang dihasilkan dari pembakaran bahan bakar. Ketika pembakaran yang terjadi tidak sempurna maka akan menghasilkan partikel beracun.
TUGAS!
Kemukakan dampak pembakaran minyak bumi terhadap lingkungan, serta berikan pendapat kalian apa langkah yang dapat dilakukan untuk mengurangi dampak pembakaran minyak bumi!
(Paparan dapat ditulis di kertas polio bergaris atau HVS, sertakan sumber belajar yang digunakan, dapat diperoleh dari buku atau internet)
Hasil pekerjaan dapat dikumpulkan pada saat pertemuan tatap muka di sekolah. Sumber :