HIDRO – ELEKRO METALURGI
ARDI TRI LAKSONO
3334100485
UNIVERSITAS SULTAN AGENG TIRTAYASA
CILEGON – BANTEN
DAFTAR ISI Halaman HALAMAN JUDUL ... ... 1 DAFTAR ISI ... 2 BAB I PENDAHULUAN 1.1 Latar Belakang ... 3 1.2 Tujuan Percobaan ... 5 1.3 Batasan Masalah ... 5 1.4 Sistematika Penulisan ... 6
BAB II PRINSIP PROSES 2.1 Teori Dasar ... 7
2.2 Leaching ... 8
2.3 Solvent Extraction ... 8
2.4 Electrowinning Cu ... 9
2.5 Aplikasi Industri ... 11
BAB III ASPEK TEMODINAMIKA DAN KINETIKA METALURGI 3.1 Aspek Termodinamika Metalurgi ... 13
3.2 Aspek Kinetika Metalurgi ... 13
BAB IV KESIMPULAN 4.1 Kesimpulan ... 15
BAB I
LATAR BELAKANG
1.1 Pendahuluan
Pada proses industri hulu metalurgi umumnya akan didapat berbagai macam bijih yang bervariasi untuk proses industrinya tersebut. Seperti bentuk ukuran dan kadarnya. Untuk yang berukuran besar akan direduksi ukurannya agar didapat ukuran yg sesuai dengan prosesnya. Sementara itu pada tahap selanjutnya pengolahan bijih akan tergantung pada kadar yang terdapat pada bijih itu sendiri. Pada bijih kadar tinggi proses akan dilakukan menggunakan pirometalurgi, sementara yang memiliki kadar rendah akan masuk ke jalur proses hidrometalurgi ataupun elektrometalurgi.
Elektrometalurgi adalah proses ekstraksi suatu bijih logam memanfaatkan arus listrik untuk menjalankan. Dan permasalahan yang muncul adalah ketika industri mendapatkan bijih–bijih dengan kadar rendah. Maka akan dilakukan suatu teknik recovery agar pemasalahan teratasi. Salah satu teknik yang dapat dipakai adalah teknik electrowinning sebagai cara agar didapatkan produk logam dengan kadar tinggi meskipun dari bijih kadar rendah.
Electrowinning adalah proses recovery logam berharga dengan kadar rendah menggunakan prinsip elektrolisis dimana menggunakan arus listrik dari anoda ke katoda untuk mendapatkan logam dari larutan kaya hasil
leaching yang nantinya logam berharga akan menempel dikatoda berbentuk pelat mengikuti bentuk pelat yang dipasang dikatoda. Dipresentasikan pertama kali pada tahun 1847 oleh Maximilian Leuchtenberg secara eksperimental.
Gambar 1. Maximilian Luechtenberg
Setelahnya pabrik pertama dibuat oleh James Elkington dimana mematenkan proses secara komersial pada tahun 1865 dan membuka pabrik pertama di Pembrey, Wales pada tahun 1870. Dan berikut adalah gambaran pabrik di Pembrey.
Secara komersial pabrik Electrowinning pertama dibuat ada di
Amerika Serikat yaitu Balbach and Sons Refining and Smelting Company di Newark, New Jersey pada tahun 1883.
Gambar 3. Balbach and Sons Refining and Smelting Company
1.2 Tujuan Penulisan
Adapun tujuan dari penulisan makalah ini adalah untuk memenuhi tugas mata kuliah Hidro-Elektro Metalurgi. Selain itu juga agar penulis serta mahasiswa lainnya memahami proses electrowinnung tembaga.
1.3 Batasan Masalah
Dalam makalah ini penulis membahas mengenai electrowinning tembaga yaitu mengenai sejarah, prinsip, alur proses, serta aspek termodinamika dan kinetika metalurginya. Aplikasi dari pemakaian electrowinning diindustri pun termasuk kedalam batasan masalah sebagai bukti manfaat adanya teknologi dari proses electrowinning ini bagi industri.
1.4 Sistematika Penulisan
Sistematika penulisan pada laporan ini terdiri dari lima bab. Bab I menjelaskan mengenai latar belakang, tujuan penulisan, batasan masalah, dan sistematika penulisan. Bab II menjelaskan mengenai prinsip proses yang berisi mengenai teori dasar yang mendukung dan menjelaskan bagaimana teknik ini dapat berjalan serta aplikasinya dalam industri. Bab III menjelaskan mengenai aspek termodinamika metalurgi dan kinetika metalurgi yang berhubungan dengan proses pada makalah ini. Serta Bab IV menjelaskan mengenai kesimpulan dari makalah ini.
BAB II PRINSIP PROSES
2.1 Teori Dasar
Prinsip dasar pada teknik recovery pada ekstraksi tembaga (Cu) kadar rendah ini memanfaatkan pregnant solution hasil leaching menggunakan proses electrolysis. Electrolysis adalah proses mengubah energi listrik menjadi reaksi kimia. Dimana proses electrolysis ini membutuhkan energi listrik untuk reaksinya berlangsung serta anoda (sebagai kutub positif) dan katoda (sebagai kutub negatif) serta elektrolit sebagai tempat berpindahnya ion-ion selama reaksi dari proses elektrolisis ini berlangsung. Dapat dilihat skema prosesnya seperti gambar berikut:
Gambar 4. Skema electrolysis
Sementara pada proses electrowinning yang menjadi anoda adalah paduan Pb lalu yang menjadi katoda adalah stainless steel polos. Elektrolit yang dipakai adalah pregnant solution hasil leaching tembaga.
2.2 Leaching
Leaching adalah proses melarutkan logam berharga menggunakan pelarut selektif yang disebut leaching agent. Proses leaching sendiri umumnya dilakukan untuk logam-logam oksida dengan pelarut yang umum dipakai adalah h2so4 dan hcl. Maka dari itu untuk dapat melakukan leaching terhadap logam sulfida harus mendapatkan keadaan- keadaan tertentu, karna sulitnya melarutkan logam sulfida maka jarang sekali logam sulfida melalui tahap hidromet biasanya logam sulfida diberikan proses praolahan dipirometalurgi seperti kalsinasi roasting dan aglomerasi. Setelah menjadi logam oksida barulah masuk ke tahap hidromet bila dibutuhkan. Tembaga sendiri di alam sebanyak 80% berikatan dengan sulfur membentuk tembaga sulfida dengan berbagai jenis macamnya. Namun pada makalah ini penulis berasumsi bila proses leaching dilakukan didalam aqueous solution secara bacterial leaching menggunakan bantuan bacteria enzym catalyst sehingga akan didapatkan ion Cu++ dalam pregnant solution. Dengan reaksi seperti berikut:
Cu2S + 2,5O2 + H2SO4 → 2Cu++ + 2SO4-- + H2O (1)
2.3 Solvent Extraction
Dalam proses elektrowinning sangat direkomendasikan untuk melakukan proses bila kadar dari tembaga pada elektrolit diatas 35 kg/m3. Tujuannya agar kandungan tembaga terjamin selalu tersedia untuk dapat melapisi permukaan katoda, selain itu juga agar didapatkan kehalusan,
kepadatan, kemurnian yang tinggi, dan layak jual pada tembaga dikatoda. Maka dari itulah dilakukan solvent extraction. Karna solvent extraction mampu untuk menyediakannya.
Cara melakukan proses solvent extraction yaitu :
1. mencampurkan larutan hasil pelindian dengan ektrak larutan organik khusus tembaga
2. memisahkan secara gravitasi larutan leaching yang tembaganya sudah dikosongkan (raffinate) dari tembaga yang menyimpan ekstrak organik. 3. mengirim kembali raffinate yang memiliki Cu rendah ke proses
leaching.
4. mengirim tembaga yang menyimpan ekstraktan organik untuk kontak dengan H2SO4 kuat elektrolit electrowinning (170-200 kg H2SO4/m3),
menyebabkan Cu menjadi dilucuti dari organik dan menjadi elektrolit. 5. memisahkan dengan gravitasi ekstraktan organik Cu yang akan
dipisahkan dari larutan elektrolit yang diperkaya Cu++
6. selanjutnya ekstraktan organik yang dipisahkan digabung dengan pregnant leach solution.
7. mengirim elektrolit yang diperkaya Cu++ ke elektrowinning dimana Cu++ sendiri dalam elektrodeposit adalah sebagai logam tembaga murni
2.4 Electrowinning Cu
Prinsip dasar dari kerja electrowinning Cu sesuai dengan prinsip elektrolisis dimana anoda oksidasi (+) dan katoda reduksi (-), konduktor
listrik untuk membawa arus, dan elektrolit sebagai konduktor ion. Menggunakan larutan kaya hasil leaching (CuSO4). Cu dalam elektrolit disebut elektrowon sebagai logam tembaga murni. Anoda yang dipakai lembaran paduan Pb-Sn-Ca hasil roll dan katodanya lembaran Stainless Steel polos. Waktu produksinya sekitar 1 minggu pengerjaan dengan kandungan tembaga pada elektrolit umumnya sekitar 45 kg/m3.
Produk electrowinning adalah: 1. Logam tembaga murni di katoda 2. Gas oksigen di anoda
3. Regenerasi asam sulfat dalam larutan.
Laju pelapisan umumnya berkisar 0,25 - 0,5 Kg Cu/ jam pada katoda. Electrowinning berlangsung dengan merendam katoda logam dan anoda inert (tapi konduktif) di elektrolit CuS04-H2S04-H20 untuk dapat menjalankan prosesnya, memberikan potensial listrik antara anoda dan katoda, pelapisan logam tembaga murni dari elektrolit ke katoda, kebutuhan energi untuk electrowining ±2000 kWh/ ton tembaga dan tahanan listrik ±300 A/m2, serta dilakukan pada temperatur sekitar 65oC. Keberhasilan dari proses electrowinning ditentukan dengan efisiensi arus diatas 95%.
Reaksi pada katoda :
Cu++ + 2e- → Cu0 ε0 = + 0,34 V (2) Reaksi pada anoda :
Reaksi keseluruhan :
Cu++ + SO4-- + H2O → Cu0 + ½ O2 + 2H++ SO4-- ε0 = -0,89 V (4)
2.5 Aplikasi Industri
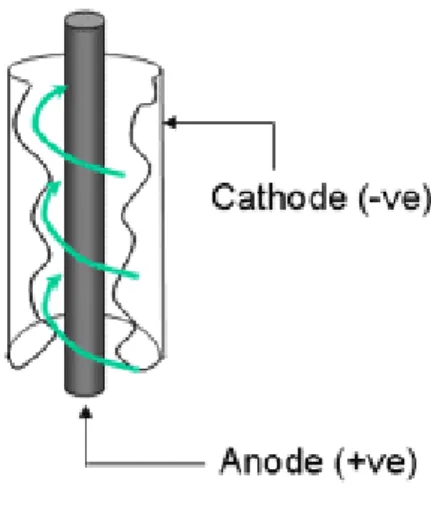
Aplikasi electrowinning Cu merupakan metoda recovery yang dipakai di PT. FREEPORT. Dimana PT. FREEPORT menggunakan proses Electrometal-Electrowinning (EMEW). EMEW adalah suatu proses Electrowinning yang dimodifikasi mengikuti bentuk dari pelat logam. Pertama kali dikembangkan tahun 1994 oleh electrometal mining limited di australia. Tampilan fisik dari EMEW berbentuk tabung tidak seperti electrolysis pada umumnya yang berupa bak besar yang didalamnya disusun elektroda. Sel EMEW dibentuk dengan anoda yang berada ditengah dan katoda sebagai batas bagian dalam tabungnya. Berikut ini adalah gambar skema kinerja EMEW.
Sistem kerja pada EMEW yaitu dengan larutan yang dipompakan memasuki tabung dengan kecepatan tinggi, mengalir secara melingkar didalam tabung sehingga terjadi kontak antara ion-ion tembaga dengan permukaan dalam katoda secara kontinu diperbarui dan keseimbangan antara pasokan (distribusi dan jumlah ion logam dalam larutan ) dengan permintaan (jumlah arus yang diberikan pada elektroda) lebih bersifat langsung dan lebih efektif daripada yang terjadi pada sel konvensional.
Sumber energinya yaitu tiga pembangkit listrik tenaga uap di lokasi tambangnya dengan kapasitas masing-masing 65 megawatt. Serta memiliki tambahan pembangkit bertenaga diesel untuk membantu pengoperasian tambang.
BAB III
ASPEK TERMO-KINETIKA METALURGI
3.1 ASPEK TERMODINAMIKA METALURGI
Untuk mengetahui suatu proses electrowinning dapat berjalan atau tidak kita dapat menghitungnya dengan rumus energi potensial. Seperti dijelaskan sebagai berikut.
ε = ε 0
- (RT/nF) ln K Dengan:
ε = Energi potensial elektroda (v) ε0
= Energi potensial standar elektroda(v) R = 0,082 (L atm/ mol K)
T = Temperatur (K) n = Jumlah ion bereaksi F = Bilangan Faraday
K = konstanta kesetimbangan
3.2 ASPEK KINETIKA METALURGI
Untuk mengetahui bagaimana laju kinetika proses elektrowinning berjalan kita dapat menghitungnya menggunakan hukum I Faraday. Sebagai berikut :
W= Eit/96500 Dengan:
W = berat dalam gram
E = berat ekuivalen, (berat atom/ valensi) i = arus, Ampere
t = waktu, detik
BAB IV KESIMPULAN
Dari pembahasan yang tertulis dalam makalah ini maka dapat ditarik kesimpulan bila electrowinning termasuk kedalam bidang ilmu hidro-elektro metalurgi. Electrowinning bertujuan untuk mendapatkan tembaga murni. Electrowinning menggunakan prinsip elektrolisis dengan anoda inert dan katoda yang akan terlapisi yang terendam dalam larutan kaya (elektrolit) hasil leaching tembaga.
DAFTAR PUSTAKA
Davenport, W.G. 2002. Extractive Metallurgy of Copper Fourth Edition. Elsevier : Oxford, United Kingdom.
UNIT PROCESSES OF EXTRACTIVE
METALLURGY-HIDROMETALLURGY
http://www.alpensteel.com/article/50-104-energi-sungai-pltmh--micro- hydro-power/3749--pt-pln-akan-membangun-pembangkit-listrik-yang-bersumber-dari-sungai-urumuka-timika.html
Hersubeno, J.B. 2010. INSTALASI PENGOLAHAN AIR ASAM DAN TAMBANG PT. FREEPORT INDONESIA. ENERGI.