LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI BAGIAN PENGEMBANGAN VAKSIN KOMBINASI (PVK)
PT. BIOFARMA
JL.PASTEUR NO. 28, BANDUNG
PERIODE 2 – 27 APRIL 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
AMELIA ISYANA WARDHANI, S.Farm.
1106124624
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK JUNI 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI BAGIAN PENGEMBANGAN VAKSIN KOMBINASI (PVK)
PT. BIOFARMA
JL.PASTEUR NO. 28, BANDUNG
PERIODE 2 – 27 APRIL 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
AMELIA ISYANA WARDHANI, S.Farm.
1106124624
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM PROGRAM PROFESI APOTEKER – DEPARTEMEN FARMASI
DEPOK JUNI 2012
Puji dan syukur kami panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Tugas Khusus Praktek Kerja Profesi Apoteker di Unit Pengembangan Vaksin Kombinasi, PT. Biofarma, Bandung. Pada kesempatan ini penulis mengucapkan rasa terima kasih yang sebesar-besarnya kepada Ibu Dr. Neni Nurainy, Apt. selaku kepala Unit Pengembangan Vaksin Kombinasi PT. Biofarma, Bandung dan selaku pembimbing PKPA yang telah banyak memberikan bimbingan dan pengarahan dalam pelaksanaan dan penyusunan laporan ini. Ucapan terima kasih juga tak lupa kami haturkan kepada:
1. Segenap Direksi PT. Biofarma yang telah memberikan kesempatan untuk melaksanakan Praktek Kerja Profesi Apoteker.
2. Dr. Hasan Rachmat M. selaku pembimbing dari Program Profesi Apoteker-Departemen Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia, yang telah memberikan pengarahan dan bimbingan dalam penyusunan laporan.
2. Prof.Dr.Yahdiana Harahap, MS, Apt. selaku pimpinan Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia. 3. Dr. Harmita, Apt. selaku Ketua Program Profesi Apoteker-Departemen
Farmasi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
4. Seluruh staf dan karyawan Unit Pengembangan Vaksin Kombinasi, PT. Biofarma atas segala keramahan, pengarahan, bimbingan, dan kerjasamanya selama PKPA.
5. Seluruh staf dan pengajar Departemen Farmasi.
6. Keluarga yang telah memberikan bantuan moril dan materil sehingga pelaksanaan PKPA dan penyelesaian laporan dapat berjalan lancar.
7. Rekan-rekan program profesi Apoteker Fakultas Farmasi Universitas Indonesia angkatan LXXIV, atas segala bantuan dan motivasinya.
persatu.
Penulis menyadari masih banyak kekurangan dalam penulisan laporan ini. Oleh karena itu, penulis mengharapkan adanya saran dan kritik untuk menyempurnakan laporan ini. Kami berharap semoga laporan ini dapat memberikan manfaat bagi semua pihak terutama dalam bidang profesi apoteker.
Depok, Juni 2012
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... viii
BAB 1. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2. TINJAUAN UMUM PT. BIOFARMA 2.1 Sejarah PT. Biofarma ... 4
2.2 Visi dan Misi PT. Biofarma ... 6
2.3 Kebijakan PT. Biofarma ... 6
2.4 Budaya Perusahaan ... 7
2.5 Struktur Organisasi PT. Biofarma ... 8
2.6 Produk PT. Biofarma ... 17 2.6.1 Produk Vaksin ... 17 2.6.2 Produk Sera ... 18 2.6.3 Produk Diagnostik ... 18 2.6.4 Layanan Pengujian ... 19 2.7 Kerjasama PT. Biofarma ... 19
BAB 3. TINJAUAN KHUSUS UNIT PENGEMBANGAN VAKSIN KOMBINASI PT. BIOFARMA 3.1 Divisi Penelitian dan Pengembangan PT. Biofarma ... 20
3.2 Divisi Teknik ... 29
3.2.1 Bangunan ... 30
3.2.2 Heating, Ventilation and Air Conditioning System (HVAC System) ... 31
3.2.3 Water Treatment Plant (WTP) ... 34
3.2.4 Sistem Pengolahan Limbah ... 38
3.3 Klasifikasi Ruangan ... 42
3.4 Inspeksi Diri ... 44
BAB 4. KESIMPULAN DAN SARAN 4.1 Kesimpulan ... 46
4.2 Saran ... 46
Gambar 2.1 Struktur organisasi PT. Biofarma ... 8
Gambar 3.5 Arah aliran dan tekanan TFF ... 25
Gambar 3.6 Skema sistem TFF ... 25
Gambar 3.7 Aliran dan tekanan dalam jalur TFF ... 26
Gambar 3.8 Profil tekanan dalam jalur TFF ... 26
Gambar 3.9 Komponen sistem HVAC ... 31
Gambar 3.10 Proses pengolahan Pretreatment Water ... 34
Gambar 3.11 Proses pengolahan Water Softener ... 34
Gambar 3.12 Proses pengolahan Purified Water ... 35
Gambar 3.13 Skema pengolahan limbah cair PT. Biofarma ... 39
Tabel 3.1 Pengujian air limbah industri ... 37 Tabel 3.2 Jumlah partikel di udara untuk ruang kelas
PENDAHULUAN 1.1 Latar Belakang
PT Bio Farma (Persero) adalah Badan Usaha Milik Negara (BUMN) dibawah kementerian BUMN yang sahamnya dimiliki sepenuhnya oleh pemerintah Indonesia. PT Bio Farma memproduksi vaksin dan sera untuk mendukung program Imunisasi di Indonesia maupun di negara-negara lainnya. (Biofarma, 2011) PT Bio Farma menyediakan vaksin, sera dan produk biologi lainnya dengan kualitas Internasional untuk melayani kebutuhan Indonesia dan dunia, hal ini dibuktikan dengan telah masuknya Biofarma ke dalam daftar prakualifikasi Badan Kesehatan Dunia (WHO).
Undang-Undang Nomor 23 tahun 1992 tentang kesehatan menyatakan bahwa program imunisasi merupakan salah satu upaya pemberantasan penyakit menular. Pemberian vaksin melalui program imunisasi merupakan salah satu strategi pembangunan kesehatan nasional dalam rangka mewujudkan Indonesia sehat. Program imunisasi mengacu kepada konsep Paradigma Sehat, dimana prioritas utama dalam pembangunan kesehatan yaitu upaya pelayanan peningkatan kesehatan (promotif) dan pencegahan penyakit (preventif) secara menyeluruh, terpadu dan berkesinambungan. Upaya imunisasi telah diselenggarakan di Indonesia sejak tahun 1956 dan upaya ini terbukti paling cost effective. Mulai tahun 1977, upaya imunisasi dikembangkan menjadi Program Pengembangan Imunisasi dalam rangka pencegahan penularan terhadap Penyakit yang Dapat Dicegah Dengan Imunisasi (PD3I), yaitu tuberculosis, difteri, pertusis, campak, polio, tetanus dan hepatitis B. Pemerintah melalui Kementerian Kesehatan Republik Indonesia sejak tahun sejak tahun 1984 juga mulai melaksanakan program imunisasi pada anak sekolah. Keputusan Menteri Kesehatan RI nomor 1059/Menkes/SK/IX/2004 yang mengacu pada himbauan UNICEF, WHO dan UNFPA tahun 1999 mendukung pelaksanaan BIAS (Bulan Imunisasi Anak Sekolah) untuk mencapai target Eliminasi Tetanus Maternal dan Neonatal (MNTE) pada tahun 2005 di negara berkembang (insiden dibawah 1 per 1.000 kelahiran hidup dalam satu tahun). (Sundoro,2011) Adanya berbagai program dan regulasi pemerintah tersebut mendukung berkembanganya industri farmasi yang memproduksi sediaan biologis seperti vaksin. Saat ini, PT Biofarma yang merupakan produsen vaksin yang menyediakan kebutuhan seluruh vaksin
menyatakan bahwa sediaan farmasi dan alat kesehatan harus aman, berkhasiat atau bermanfaat dan terjangkau. Penyelengaraan pengamanan sediaan farmasi dan alat kesehatan ini bertujuan untuk melindungi masyarakat dari bahaya yang disebabkan oleh penggunaan sediaan farmasi dan alat kesehatan yang tidak memenuhi persyaratan mutu dan atau keamanan dan atau kemanfaatan (UU RI No. 36 Th. 2009 Pasal 104 ayat 1). Oleh karena itu, Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM RI) mewajibkan industri farmasi menerapkan Cara Pembuatan Obat yang Baik (CPOB). CPOB adalah pedoman bagi setiap industri farmasi, yang mencakup seluruh aspek produksi dan pengendalian mutu, untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. (BPOM RI, 2006)
Produksi produk biologi memerlukan pertimbangan khusus yang berkaitan dengan sifat produk dan proses. Cara yang digunakan untuk pembuatan, pengendalian serta penggunaan produk biologi memerlukan perhatian khusus. Hal ini disebabkan, pembuatan produk biologi melibatkan bahan dan proses biologi, seperti kultivasi sel atau ekstraksi material dari mikroorganisme hidup. Proses biologis ini dapat menimbulkan variabilitas yang nyata, sehingga sifat dan jenis produk sampingannya juga bervariasi. Terlebih lagi bahan yang digunakan untuk proses kultivasi juga merupakan media pertumbuhan yang baik bagi mikroba pencemar. (BPOM, 2006) Oleh karena itu, distribusi dari produk biologis terregistrasi harus melalui kontol persyaratan tertentu yang spesifik. Proses registrasi tersebut termasuk persetujuan mengenai tahapan proses produksi, uji in process control dan spesifikasi produk akhir sehingga produk biologi tersebut terjamin keamanan, kemurnian, potensi dan efikasinya. (USP32–NF27, 2009) Produk biologi yang dicakup dalam CPOB (Cara Pembuatan Obat yang Baik) adalah vaksin, imunosera, antigen, hormon, enzim, dan produk lain hasil fermentasi (termasuk antibodi monoklonal dan produk yang diperoleh dari r-DNA) yang dibuat dengan metode pembuatan biakan mikroba, biakan sel dan mikroba, ekstraksi dari jaringan biologi hewan dan manusia serta propagasi substrat hidup pada embrio atau hewan.
Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan secara terpadu dan berkesinambungan di industri farmasi yang memproduksi produk biologi bisa digunakan untuk meningkatkan kemampuan, pengetahuan, keterampilan dan pengenalan mengenai
penting mahasiswa untuk mengetahui perkembangan teknologi sediaan biologi tersebut. Untuk mendukung tercapainya hal tersebut, Fakultas Farmasi Universitas Indonesia mengadakan kerjasama dengan PT. Biofarma melalui program Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan dari tanggal 2 April 2012 hingga 27 April 2012 untuk menambah wawasan dalam bidang industri farmasi yang bergerak dalam bidang produksi sediaan biologi.
1.2 Tujuan Praktek Kerja Profesi
1. Mengetahui peran dan fungsi apoteker di industri farmasi serta meningkatkan pengetahuan dan keterampilan di bidang industri farmasi.
2. Mengetahui penerapan CPOB / cGMP di PT. Bio Farma (Persero).
2.1 Sejarah PT. Biofarma
Surat Keputusan Gubernur Hindia Belanda Nomor 14 tahun 1890 membuka lembar baru sejarah industri vaksin dan sera di Indonesia. SK tersebut mendasari didirikannya lembaga vaksin bernama “Parc Vaccinogene” pada tanggal 6 Agustus 1890. Lembaga ini didirikan di Rumah Sakit Militer Weltevreden, Batavia yang saat ini telah berubah fungsi menjadi Rumah Sakit Pusat Angkatan Darat Gatot Soebroto (RSPAD Gatot Soebroto), Jakarta. (Biofarma, 2011) Tanggal berdirinya lembaga tersebut hingga saat ini diperingati sebagai hari ulang tahun Bio Farma.
Pada tahun 1895, nama “Parc Vaccinogene” diganti dengan "Parc Vaccinogene en Instituut Pasteur”. Nama ini bertahan hingga tahun 1901. Pada tahun 1902 perusahaan mengalami pergantian nama menjadi "Landskoepoek Inrichting en Instituut Pasteur", nama ini pun hanya bertahan hingga tahun 1941. Pada tahun 1923, Bio Farma berpindah dari Batavia dan mulai menempati lokasi di Jalan Pasteur No. 28 Bandung. Perusahaan ini yang dipimpin oleh L. Otten (1924-1942), seorang berkewarganegaraan Belanda. (Biofarma, 2011)
Pada tahun 1925, penelitian dalam bidang Bio Kimia klinik dimulai. Pengembangan vaksin terus berlanjut, Otten memperkenalkan Vaksin Cacar Kering (room dried smallpox vaccine). Pada tahun 1930, Maria Van Stockum berhasil membuat vaksin rabies yang berasal dari otak kera dan diinaktifasi dengan formalin. Pada tahun 1934, Otten berhasil membuat vaksin sampar (Pes) hidup yang avirulen (natural attenuated).
Pada masa penjajahan Jepang, tahun 1942, lembaga ini berganti nama menjadi “Bandung Boeki Kenkyushoo” dan dipimpin oleh Kikuo Kurauchi. Pada tahun 1945 perusahaan kembali berganti nama menjadi "Gedung Cacar dan Lembaga Pasteur". Perusahaan ini dipimpin oleh R. M. Sardjito (1945 – 1946) yang merupakan Pemimpin Indonesia pertama yang memimpin perusahaan ini. Pada saat kepemimpinan R. M. Sardjito, lokasi sempat dipindahkan ke daerah
Klaten. Namun, karena terjadi Agresi Militer Belanda II pada tahun 1946 dan Belanda kembali menduduki Bandung, perusahaan kembali berganti nama menjadi "Landskoepoek Inrichting en Instituut Pasteur". (Biofarma, 2011)
Setelah Agresi Militer Belanda II berakhir dan Jepang kalah dalam Perang Dunia II (tahun 1946) karena hancurnya kota Hiroshima dan Nagasaki akibat bom atom yang dijatuhkan oleh Amerika, lembaga ini dapat dimiliki oleh pemerintah Indonesia dan kembali melakukan kegiatan produksi vaksin dan sera pada tahun 1950. Pada tahun 1950-1954 perusahaan bernama "Gedung Cacar dan Lembaga Pasteur" yang merupakan salah satu jawatan dalam lingkungan Departemen Kesehatan Republik Indonesia. Seiring dengan terjadinya proses nasionalisasi, berbagai perusahaan milik Belanda berganti nama. Pemerintah Indonesia pada tahun 1955 mengubah nama perusahaan menjadi Perusahaan Negara Pasteur, yang lebih dikenal dengan nama PN. Pasteur. (Biofarma, 2011) Pada tahun 1957, Labotarium Virus dan Kultur Jaringan didirikan sebagai fasilitas diagnosa cacar negara- negara di wilayah Asia Tenggara. Laboratorium ini mulai digunakan oleh WHO pada tahun 1969. Produksi vaksin terus berkembang, seperti produksi vaksin BCG yang dimulai dengan menggunakan primary seed lot dari Pasteur
Instituut Paris, vaksin cacar beku kering diperkenalkan tahun 1968.
Pada tahun 1961, berdasarkan Peraturan Pemerintah No. 80 tahun 1961 (Lembaran Negara Tahun 1961 No. 101) perusahaan kembali berganti nama menjadi "Perusahaan Negara Bio Farma" atau lebih dikenal dengan nama PN. Bio Farma. (Biofarma, 2011) Tahun 1971, didirikan Bagian Pengawasan Mutu dan Labotarium Mycology. Pada tahun 1978, berdasarkan Peraturan Pemerintah No. 26 tahun 1978, perusahaan kembali berganti nama dari PN. Bio Farma menjadi Perusahaan Umum Bio Farma yang lebih dikenal dengan nama Perum Bio Farma. Pada tahun 1997, berdasarkan Peraturan Pemerintah No. 1 tahun 1997, Perum Bio Farma kembali berganti nama menjadi Perusahaan Perseroan (Persero) atau lebih dikenal dengan nama PT Bio Farma (Persero) sampai dengan saat ini. (Biofarma, 2011)
Pada tahun 1982, produksi vaksin tetanus meningkat dengan digunakannya fermentor (Shinko Pflauder) dengan kapasitas 1000 1iter. Fermentor ini diperoleh dari Commonwealth Serum Labotary (CSL).
Pembangunan Sarana Produksi dan Pengawasan Mutu Vaksin Polio dan Campak yang diresmikan menteri kesehatan saat itu (1990), Bapak Dr. Adhityatma MPH, selesai pada akhir 1991. Pada periode ini, terjadi transfer teknologi produksi Vaksin Polio dan Campak oleh Prof. Dr. Konosuke Fukai. (Biofarma, 2011)
Saat ini, PT. Biofarma (Persero) tumbuh dan berkembang menjadi produsen vaksin dan serum dengan reputasi Internasional. Hal ini ditunjukkan dengan dengan telah diterimanya prakualifikasi dari WHO. Semua jenis vaksin EPI (Expanded Program of Imunization) yang diproduksi oleh PT. Bio Farma sesuai dengan standar TRS (Technical Report Series) yang dikeluarkan oleh WHO.
2.2 Visi dan Misi PT. Biofarma
Visi PT. Bio Farma (Persero) adalah untuk menjadi produsen vaksin dan antisera yang berdaya saing global. (Biofarma, 2011)
Misi yang dicanangkan untuk mencapai visi tersebut adalah:
a. Memproduksi, memasarkan dan mendistribusikan vaksin dan antisera yang berkualitas international untuk kebutuhan pemerintahan, swasta nasional dan internasional
b. Mengembangkan inovasi vaksin dan antisera sesuai dengan kebutuhan pasar
c. Mengelola perusahaan agar tumbuh berkembang dengan menerapkan
good corporate governance
d. Meningkatkan kesejahteraan karyawan dan pemegang saham, dengan tetap memperhatikan kepentingan stakeholder lainnya.
2.3 Kebijakan PT. Biofarma
Dalam menyelenggarakan perusahaan PT. Biofarma (Persero) memiliki kebijakan antara lain:
1. Berdaya saing global 2. Kepuasan pelanggan 3. Produk bermutu
4. Produk ramah lingkungan 5. Perbaikan berkesinambungan 6. Pengendalian pencemaran
7. Keselamatan dan kesehatan kerja karyawan 8. Penghematan energi dan sumberdaya alam 9. Patuh peraturan perundangan
2.4 Budaya Perusahaan
Setiap bagian dari perusahaan berperilaku dan berfikir secaara profesional, memiliki integritas yang tinggi, serta bekerja secara transparan dan akuntabel. (Biofarma, 2011)
Profesionalitas ditunjukkan dengan bekerja sesuai sistem dan prosedur yang berlaku, terbuka dalam mengemukakan dan menghargai perbedaan pendapat, senantiasa memiliki tekad untuk meningkatkan kemampuan dan pengetahuan, penuh percaya diri dan tegar dalam menghadapi setiap tantangan dan rintangan, serta menjadi pribadi yang bertanggung jawab. (Biofarma, 2011)
Karyawan harus memiliki integritas terhadap perusahaan. Integritas tersebut ditunjukkan dengan memiliki visi ke depan, berdisiplin tinggi, dapat dipercaya, bertindak jujur dan memiliki kompetensi, mendarmabaktikan seluruh potensi yang dimiliki untuk kemakmuran Perusahaan, dan beriman dan bertakwa kepada Tuhan Yang Maha Esa. (Biofarma, 2011)
Transparansi diterapkan dengan cara berpegang teguh pada prinsip keterbukaan, senantiasa adil dan bijaksana dalam melaksanakan wewenang, tugas dan tanggung jawab yang diamanatkan, serta menyajikan dan menyampaikan informasi / data secara benar dan lengkap. (Biofarma, 2011)
Sifat akuntabilitas ditunjukkan dengan senantiasa berusaha mendapatkan, memelihara dan menggunakan aset - aset dan pendapatan Perusahaan dengan benar sesuai wewenang, tugas dan tanggung jawab dalam Perusahaan serta berusaha terus menerus untuk menerapkan dan meningkatkan sistem pengendalian manajemen yang baik dan dapat dipertanggungjawabkan. (Biofarma, 2011)
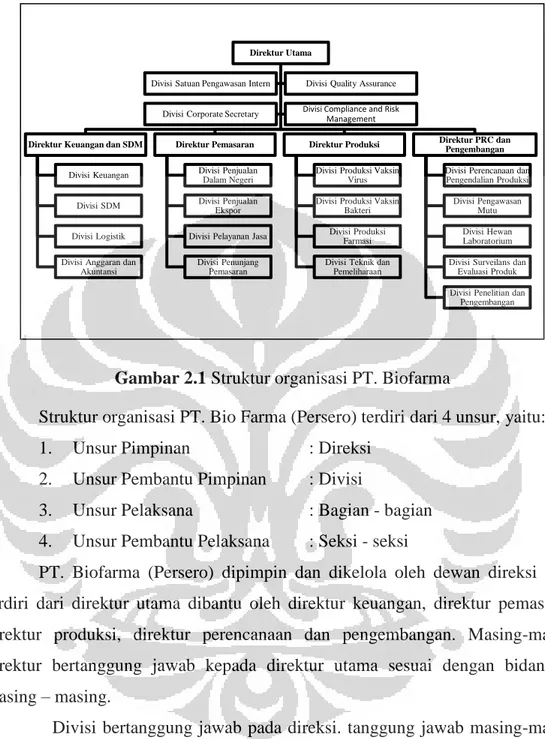
2.5 Struktur Organisasi PT. Biofarma (Persero)
Gambar 2.1 Struktur organisasi PT. Biofarma
Struktur organisasi PT. Bio Farma (Persero) terdiri dari 4 unsur, yaitu: 1. Unsur Pimpinan : Direksi
2. Unsur Pembantu Pimpinan : Divisi
3. Unsur Pelaksana : Bagian - bagian 4. Unsur Pembantu Pelaksana : Seksi - seksi
PT. Biofarma (Persero) dipimpin dan dikelola oleh dewan direksi yang terdiri dari direktur utama dibantu oleh direktur keuangan, direktur pemasaran, direktur produksi, direktur perencanaan dan pengembangan. Masing-masing direktur bertanggung jawab kepada direktur utama sesuai dengan bidangnya masing – masing.
Divisi bertanggung jawab pada direksi. tanggung jawab masing-masing divisi, adalah sebagai berikut:
Divisi yang berada di bawah direktur utama :
1. Divisi Pengawasan Intern, bertanggung jawab dalam pengawasan kekayaan perusahaan dengan melakukan pemeriksaan keuangan dan operasional perusahaan agar aktivitas perusahaan berjalan secara efisien namun efektif yang mengacu kepada peraturan perundang-undangan dan standar yang berlaku.
Direktur Utama
Direktur Keuangan dan SDM
Divisi Keuangan
Divisi SDM
Divisi Logistik Divisi Anggaran dan
Akuntansi Direktur Pemasaran Divisi Penjualan Dalam Negeri Divisi Penjualan Ekspor Divisi Pelayanan Jasa
Divisi Penunjang Pemasaran
Direktur Produksi Divisi Produksi Vaksin
Virus Divisi Produksi Vaksin
Bakteri Divisi Produksi
Farmasi Divisi Teknik dan
Pemeliharaan
Direktur PRC dan Pengembangan Divisi Perencanaan dan Pengendalian Produksi
Divisi Pengawasan Mutu Divisi Hewan Laboratorium Divisi Surveilans dan
Evaluasi Produk Divisi Penelitian dan
Pengembangan Divisi Satuan Pengawasan Intern Divisi Quality Assurance
Divisi Corporate Secretary Divisi Compliance and Risk Management
2. Divisi Corporate Secretary, bertanggung jawab atas pekerjaan kesekretariatan, public relation serta mengenai lingkungan dan keamanan kerja.
3. Divisi Quality Assurance (QA), bertanggung jawab terhadap mutu produk yang dihasilkan, bahwa produk memenuhi persyaratan mutu yaitu sesuai dengan tujuan penggunaannya. QA menjamin proses produksi, alat, lingkungan dan personal yang terlibat dalam suatu produksi tervalidasi dan terkalibrasi. QA juga mengawasi pelaksanaan kerja terkait dengan keselamatan dan kesehatan kerja (K3) serta pengawasan terhadap lingkungan. Divisi QA PT Biofarma terdiri dari empat bagian yaitu:
a. QA Operation bertanggung jawab dalam memastikan bahwa seluruh proses produksi dari penanganan bahan awal hingga produk jadi sesuai dengan persyaratan mutu. Bagian ini me-review dan me-release Batch
Production Record (BPR) yang berisi detail tentang proses produksi. QA
operation bertugas untuk membuat CoR (Certificate of Release) dari suatu produk, sehingga produk tersebut bisa didistribusikan ke konsumen. b. QA Service, bertanggung jawab dalam mengawasi dan mengontrol
dokumen, program validasi (proses dan personal), program kalibrasi alat, training GMP (Good Manufacturing Practice), vendor rating dan self
inspection.
b.1 Kontrol dokumentasi
QA service memastikan bahwa dokumen yang digunakan pada kegiatan industri adalah legal. Sebaran dokumen yang digunakan harus tercatat atau teregistrasi dengan baik sehingga ketika ada revisi maka QA service dapat menarik dengan cepat dokumen lama. Setiap dokumen penting yang dibuat QA service juga memiliki copy number. Dokumen juga dicetak dalam kertas khusus berlogo QA berwarna hijau.
Penggandaan dokumen terpusat oleh bagian QA service. QA service juga membuat sistem pengkodean dokumen yang unik, khas dan tertelusur untuk memudahkan identifikasi suatu dokumen. Setiap bagian memilki kode tersendiri yang menandakan dokumen tersebut yang membuat adalah bagian tertentu. QA service bertugas dalam membuat
SOP untuk pembuatan SOP, SOP ini mengatur detail teknis cara pembuatan SOP, sehingga SOP sesuai format, detail, jelas, informatif, komprehensif dan tidak duplikatif.
Revisi baru terhadap suatu dokumen harus disosialisasikan kepada semua pihak yang terkait dalam dokumen tersebut. Proses sosialisasi akan dipantau oleh QA service sehingga semua pihak terkait mendapat sosialiasi. Pemberlakuan dokumen baru dilakukan dengan tahapan sebagai berikut, penarikan dokumen lama, pemberian dokumen baru, sosialisai kepada pihak yang berkaitan, selanjutnya dokumen baru bisa diberlakukan.
b.2 Training
Program training merupakan tindak lanjut dari kebijakan PT. Biofarma yaitu perbaikan yang berkesinambungan dan terus menerus.
Training dilakukan ketika ada alat baru, karyawan baru serta bila ada
revisi dokumen. Training juga dilakukan secara rutin untuk meningkatkan pengetahuan karyawan.
b.3 Validasi dan kalibrasi
QA service berperan mengawasi pelaksanaan Validasi Master Plan serta Calibration Master Plan. QA service mengingatkan bagian-bagian yang memiliki alat yang harus dikalibrasi dalam waktu dekat. dan
me-review setiap laporan hasil kalibrasi serta memberikan sertifikat bahwa
alat sudah terkalibrasi juga memberikan waktu kapan harus dikalibrasi kembali.
Keterlambatan rekalibrasi alat atau disebut Out Of Frequency (OOF) ditindaklanjuti dengan investigasi. Bilamana hasil validasi atau kalibrasi diluar batas persyaratan atau disebut juga Out Of Tolerance (OOT) maka alat harus diperbaharui atau diperbaiki.
b.4Vendor rating
Vendor rating merupakan proses memilih produsen bahan baku
yang terkualifikasi. Ada tiga tahapan dalam proses kualifikasi vendor, yaitu:
1. Proses seleksi. Seleksi dilakukan dengan melakukan pengujian terhadap sampel yang diperoleh dari tiga batch berbeda yang diproduksi secara berturutan. Bagian QC melakukan pengujian dan menyerahkan laporan kepada QA service.
2. Vendor audit dilakukan dengan mendatangi vendor, memberikan kuisoner (tentang sistem QC, internal audit, justifikasi release,
complaint, kontrol dokumen vendor), dan melakukan review.
3. Kualifikasi vendor dengan melihat atau memantau konsistensi spesifikasi bahan selama proses produksi obat dalam jangka waktu 2 tahun. Jika selama 2 tahun ternyata tidak terjadi penyimpangan pada produk yang diproduksi, maka vendor tersebut dinyatakan lulus kualifikasi.
Hasil vendor rating diserahkan kepada bagian logistik. Bagian logistik hanya diperbolehkan melakukan pengadaan barang dari vendor yang sudah terkualifikasi. Penentuan bahan yang akan dipakai dalam produksi berdasarkan parameter-parameter lain seperti harga, ketepatan waktu pengiriman, dan komplain merupakan kewenangan bagian logistik, QA service hanya bertanggung jawab memastikan bahwa bahan baku sesuai dengan spesifikasi yang dibutuhkan dalam produksi.
c. QA System bertanggung jawab dalam pengelolaan change control, deviasi, product complaint, product recall, WTP serta seluruh sistem yang mendukung proses industri.
c.1 Change control
Change control merupakan pengendalian dan evaluasi terhadap
pengajuan perubahan sistem dan aktivitas yang terkait QSHE (kualitas (quality), keselamatan dan kesehatan kerja (Safety and Health) dan lingkungan (Environment)) yang dapat menimbulkan dampak pada identitas, kualitas serta kemurnian produk. Perubahan dapat terjadi pada proses produksi, pengujian, spesifikasi, peralatan, fasilitas, bahan baku, kemasan, produk, dokumen dan prosedur.
Change control committee dibentuk jika ada pengajuan perubahan.
beranggotakan perwakilan dari QA, QC, Produksi dan Teknik. Perubahan diklasifikasikan menjadi tiga yaitu minor, perubahan yang tidak berdampak substansi terhadap QSHE. Perubahan moderat jika perubahan berdampak substansial terhadap QSHE tetapi tidak berdampak pada regulasi. Mayor yaitu perubahan yang berdampak pada QSHE dan regulasi.
c.2 Deviasi managemen
Deviasi managemen merupakan kegiatan penanganan penyimpangan dan investigasi untuk memantau secara sistematis ketidaksesuaian yang terjadi dan mencari akar masalah sehingga dapat dilakukan tindakan yang sesuai untuk memastikan bahwa penyimpangan dapat diatasi. Beberapa kategori penyimpangan antara lain:
Out Of Alert Level (OOA) : Penyimpangan jika data monitoring diluar trend atau alert level yang telah ditentukan.
Out Of Frequency (OOF) : Penyimpangan jika proses kalibrasi, validasi atau preventive maintenance melewati jadwal yang telah direncanakan. Out Of Specification (OOS) : Penyimpangan jika hasil pengujian QC
diluar batas spesifikasi.
Out Of Tolerance (OOT) : Penyimpangan jika hasil pengukuran dari peralatan saat validasi atau kalibrasi diluar batas persyaratan.
Penyimpangan dibedakan menjadi dua jenis yaitu penyimpangan minor dan penyimpangan mayor. Penyimpangan minor terjadi karena adanya ketidaksesuaian dalam mengimplementasikan sistem mutu yang tidak secara langsung berdampak pada kualitas produk atau kapabilitas sistem mutu. Penyimpangan mayor terjadi karena tidak dijalankannya sistem mutu yang secara langsung berdampak pada kualitas produk atau kapabilitas sistem mutu.
c.3 Product complaint
Product complaint merupakan keluhan terhadap produk dari
pemakai, dokter, atau distributor terkait dengan penggunaan produk, keamanan atau kinerja produk. Keluhan dibagai menjadi dua kelompok yaitu Kejadian Ikutan Pasca Imunisasi (KIPI) yaitu keluhan medis yang
terkait kejadian ikutan setelah dilakukan imunisasi dan Pharmaceutical
Technical Complaint (PTC) yaitu keluhan teknis produk yang bukan
merupakan kejadian KIPI seperti kerusakan produk yang diakibatkan kesalahan penyimpanan atau penanganan.
Product complaint berawal dari laporan pelanggan baik secara
langsung, melalui email maupun telepon. Laporan diregistrasikan dan diberikan nomor sehingga mudah diidentifikasikan serta melakukan respon balik, sementara kepada pelanggan jika ada keluhan harus diinvestigasi terlebih dahulu. QA system melakukan investigasi untuk mencari akar masalah dengan menggunakan metode ishikawa dan fault
tree analysis. QA system melakukan review terhadap BPR baik secara
keseluruhan mapun hanya bagian tertentu jika diperlukan. Jika penyimpangan terjadi lebih dari 1 batch maka dilakukan penelusuran terhadap BPR yang lain Tahap berikutnya adalah melakukan pemeriksaan visual terhadap sampel pertinggal atau sampel yang dikirim pelanggan jika diperkirakan terjadi pemalsuan produk. Pemeriksaan tersebut melibatkan bagian QC. Selanjutnya dilakukan pemeriksaan catatan distribusi produk dan nomor batch untuk mengetahui lokasi pengiriman produk yang sejenis atau satu batch. Daerah yang menggunakan produk yang sama diperiksa apakah ada kejadian atau keluhan yang serupa dengan keluhan pertama. Seringkali QA system melakukan kunjungan terhadap pelanggan untuk mendapatkan informasi yang lebih lengkap. PT. Biofarma (Persero) melibatkan komnas KIPI dalam melakukan investigasi keluhan KIPI. QA
system melakukan verifikasi klasifikasi kasus keluhan dengan me-review
hasil investigasi dan melakukan analisis resiko. Tindak lanjut dari investigasi adalah kepala divisi QA menjawab atas keluhan pelanggan, jika perlu dilakukan penggantian produk jika disetujui oleh manajemen. Pelaporan atas keluhan produk dilaporkan kepada BPOM setiap 3 bulan atau kasus per kasus sesuai jenis keluhan. Selanjutnya dilakukan product
recall jika terjadi cacat mutu dan ketidakamanan produk. Produk yang
didokumentasikan. PT. Biofarma (Persero) tidak pernah melakukan
rework atau reprocess terhadap kegagalan produk.
c.4 Product recall
Product recall adalah proses penarikan produk dalam skala batch
yang utuh dalam proses produksi atau lot produk dalam kemasan yang utuh yang dikirim ke tujuan tertentu dengan kemasan tertentu. Batch tersebut harus ditelusuri dan ditarik dari semua daerah distribusi. Sedangkan produk kembalian adalah produk yang kembali dari lokasi tertentu karena keluhan cacat kualitas teknik, keluhan reaksi merugikan dari produk, kadaluwarsa atau salah pengiriman. PT. Biofarma(Persero) dan pihak berwenang seperti (POM dan WHO) dapat memprakarsai penarikan produk.
Penarikan produk dapat terjadi karena cacat kualitas (contohnya kerusakan label atau salah isi, salah label dan salah kadar), timbul reaksi merugikan dari produk, reaksi yang menimbulkan resiko serius terhadap kesehatan atau terjadi peningkatan frekuensi efek samping produk yang dikeluhkan oleh perorangan atau suatu lembaga, maupun kesalahan pengiriman atau dokumentasi yang tidak sesuai.
Keluhan beresiko tinggi ditindak lanjuti dengan penghentian distribusi. Selanjutnya distributor diberi informasi agar produk yang dicurigai bermasalah tidak dilanjutkan distribusinya hingga ada informasi selanjutnya. QA system melakukan evaluasi bersama QC terhadap sampel pertinggal dan mengkaji seluruh informasi yang didapat. Investigasi tidak terbatas dilakukan terhadap satu batch tetapi dilakukan penelusuran jika terdapat batch lain yang menggunakan bahan dasar (bulk) yang sama. Jika hasil investigasi menemukan penyimpangan dan produk harus ditarik, QA system menginformasikan hal ini kepada dewan direksi. Dewan direksi merupakan pengambil keputusan tentang penarikan produk.
Produk diharapkan sudah dapat ditarik keseluruhan dalam waktu 3 bulan. Produk yang sudah ditarik harus disimpan di tempat khusus dan dipisahkan dari produk yang lain untuk menunggu dimusnahkan. Penarikan produk selalu diinformasikan kepada BPOM dengan
mencantumkan nomer batch produk yang ditarik. Jumlah produk yang berhasil ditarik harus sesuai dengan jumlah produk yang sudah didistribusikan. Indikator keberhasilan penarikan dihitung dengan persentase dari produk yang berhasil ditarik dibandingkan dengan produk yang didistribusikan.
d. QA regulatory affair
QA regulatory affair bertanggung jawab dalam melakukan registrasi kepada badan terkait agar produk yang diproduksi PT. Biofarma (Persero) memiliki ijin edar. Badan terkait tersebut antara lain adalah BPOM untuk dalam negeri, negara tertentu untuk tujuan ekspor, serta WHO untuk mendapatkan prekualifikasi. Registrasi dapat dilakukan setelah mempunyai data 3 batch berturut-turut. Sebelum dilakukan registrasi QA RA mengajukan ijin uji klinik kepada BPOM, jika sudah
di-approve maka dilakukan uji klinik.
4. Divisi Compliance and Risk Management, bertanggung jawab untuk melakukan analisa mengenai dampak kegiatan yang berlangsung di perusahaan terhadap aspek bisnis, lingkungan dan masyarakat.
Divisi yang berada di bawah Direktur Pemasaran:
1. Divisi Pemasaran Dalam Negeri, bertanggung jawab dalam memasarkan produk di dalam negeri sesuai persyaratan pelanggan.
2. Divisi Pemasaran Luar Negeri, bertanggung jawab dalam memasarkan produk di luar negeri sesuai persyaratan pelanggan.
3. Divisi Pelayanan Jasa, bertanggung jawab dalam pelaksanaan pelayanan kesehatan kepada masyarakat sekitar dan keluarga karyawan seperti general chek up dan imunisasi.
Divisi yang berada di bawah Direktur Keuangan dan SDM:
1. Divisi Sumber Daya Manusia, bertanggung jawab di dalam melaksanakan pengadaan, pemeliharaan, pengembangan, mutasi, promosi, demosi, dan separasi SDM serta melaksanakan koordinasi kegiatan umum perusahaan, mengadakan pelatihan dan peningkatan pengetahuan karyawan.
2. Divisi Logistik, bertanggung jawab dalam melaksanakan pengadaan barang dan jasa yang memenuhi persyaratan pelanggan dan
perundang-undangan yang berlaku, serta mensosialisasikan penerapan K3 dan lingkungan kepada pihak vendor/supplier.
3. Divisi Keuangan, bertanggung jawab dalam mengatur cash flow perusahaan agar likuiditas perusahaan tidak terganggu, mengelola pajak perusahaan, mengelola program kemitraan dan bina lingkungan sebagai komitmen perusahaan terhadap pengembangan usaha kecil dan koperasi serta lingkungan sosial masyarakat.
4. Divisi Anggaran dan Akuntansi, bertanggung jawab dalam mengatur anggaran, akuntansi keuangan dan akuntansi manajemen.
Divisi yang berada di bawah Direktur Produksi:
1. Divisi Produksi Vaksin Virus, bertanggung jawab atas aktivitas produksi untuk menghasilkan produk bulk polio, bulk campak, vaksin polio dan vaksin campak yang memenuhi persyaratan.
2. Divisi Produksi Vaksin Bakteri, bertanggung jawab atas aktivitas produksi untuk menghasilkan produk bulk tetanus, bulk difteri, bulk pertusis dan vaksin BCG yang memenuhi persyaratan.
3. Divisi Produksi Farmasi, bertanggung jawab atas aktivitas produksi untuk menghasilkan produk vaksin TT, DT, DTP, DTP-Hb, Hepatitis B, Serum dan sediaan diagnostik yang sesuai persyaratan
4. Divisi Teknik dan Pemeliharaan, bertanggung jawab dalam pelaksanaan validasi, kalibrasi alat serta pemeliharaan instalasi dan perbaikan peralatan dan utilitas produksi, pengujian mutu dan penunjangnya, memastikan pemantauan dan pengukuran kinerja lingkungan, merencanakan perbaikan kinerja alat untuk memenuhi peraturan perundang-undangan.
Divisi yang berada di bawah Direktur PRC dan Pengembangan:
1. Divisi Perencanaan dan Pengendalian, bertanggung jawab terhadap pengendalian material, mencakup perencanaan dan pengendalian bahan baku untuk proses manufaktur dan barang-barang kebutuhan lainnya dengan memastikan aspek keamanan tehadap barang dan personal yang mengendalikannya dengan memperhatikan Material Safety Data Sheets (MSDS) atas materialnya.
2. Divisi Pengawasan Mutu, bertanggung jawab atas pengembangan dan pelaksanaan pengujian mutu untuk memastikan bahwa pengujian suatu sampel (bahan baku/produk) telah dilakukan dengan prosedur uji yang benar, tepat dan metode yang tervalidasi.
3. Divisi Hewan Laboratorium, bertanggung jawab dalam menyediakan hewan dan bahan hewan untuk kepentingan produksi dan pengujian mutu, memonitor kesehatan hewan uji, memelihara hewan uji serta melaksanakan uji in vivo.
4. Divisi Surveilance dan Evaluasi Produk, bertanggung jawab terhadap evaluasi perkembangan produk PT. Biofarma (Persero) yang telah beredar dan digunakan di masyarakat termasuk melakukan koordinasi bersama pihak Rumah Sakit dan Dokter Anak untuk mensukseskan program imunisasi yang diadakan pemerintah.
5. Divisi Penelitian dan Pengembangan, bertanggung jawab atas aktivitas penelitian dan pengembangan produk maupun metoda yang akan menunjang produksi dan pengawasan mutu, termasuk perencanaan, koordinasi dan pengendalian pelaksanaan penelitian dan pengembangan vaksin, produk sera dan informasi riset.
2.6 Produk PT. Biofarma
2.6.1 Produk Vaksin
Produk vaksin yang diproduksi oleh PT Biofarma digolongkan menjadi tiga, yaitu vaksin bakteri, vaksin virus, dan vaksin kombinasi. Vaksin bakteri yang diproduksi, yaitu :
a. Vaksin TT, untuk pencegahan terhadap penyakit Tetanus dan Tetanus Neonatal (Tetanus pada bayi baru lahir),
b. Vaksin Jerap DT, untuk pencegahan terhadap penyakit Diphtheria (difteri) dan Tetanus,
c. Vaksin DTP, untuk pencegahan terhadap penyakit Diphtheria, Tetanus dan Pertusis,
d. Vaksin BCG Kering (Freeze Dried), untuk pencegahan terhadap penyakit Tuberkulosis, dan
e. Vaksin Td, untuk pencegahan terhadap penyakit Tetanus dan Difteri untuk anak usia 7 tahun ke atas.
Vaksin virus yang diproduksi PT Biofarma, yaitu:
a. Vaksin Oral Polio Trivalen, untuk pencegahan terhadap penyakit poliomyelitis,
b. Vaksin Oral Poliomielitis Monovalen tipe-1, untuk pencegahan terhadap penyakit poliomyelitis tipe 1,
c. Vaksin Campak Kering, untuk pencegahan terhadap penyakit campak d. Vaksin Hepatitis B Rekombinan, untuk pencegahan terhadap penyakit
Hepatitis B.
e. Flubio (Vaksin Infuenza HA), untuk pencegahan terhadap virus influenza.
Vaksin kombinasi adalah vaksin yang memiliki beberapa kandungan bahan aktif (antigen) yang berasal dari bakteri maupun virus. Produk vaksin kombinasi yang diproduksi PT Biofarma adalah Vaksin DTP-HB yang digunakan untuk pencegahan terhadap penyakit Diphtheria,Tetanus, Pertussis (batuk rejan) dan Hepatitis B.
2.6.2 Produk Sera
Produk Sera yang diproduksi meliputi :
a. Serum Anti Tetanus, untuk pengobatan terhadap penyakit tetanus, b. Serum Anti Difteri, untuk pengobatan terhadap penyakit diphtheria, c. Serum Anti Bisa Ular, untuk pengobatan terhadap gigitan ular berbisa
yang mengandung efek neurotoksik (Naja sputratix / ular kobra dan Bungarus fasciatus / ular belang) dan efek hemotoksis (Ankystrodon rhodostoma / ular tanah), dan
d. Serum Anti Rabies, untuk pengobatan terhadap penyakit rabies. 2.6.3 Produk Diagnostik
Produk diagnostik yang diproduksi oleh PT Biofarma yaitu:
a. PPD RT 23 (Purified Protein Derivative), untuk pengujian kepekaan seseorang terhadap infeksi tuberkulosis.
c. Serum Aglutinasi untuk Diagnostik, untuk mengidentifikasi bakteri dari golongan Salmonella, Shigella, dan Escherichia coli yang berhasil diisolasi dari bahan pemeriksaan.
2.6.4 Layanan Pengujian
PT Biofarma selain memproduksi berbagai sediaan biologi juga memiliki jasa pelayanan pengujian untuk diagnosa Hepatitis B serta pemeriksaan kesehatan secara menyeluruh. Laboratorium pengujian ini beralamat di Jl. Rumah Sakit No. 4 Bandung.
Beberapa produk PT Biofarma telah mendapatkan prakualifikasi WHO. Produk-produk tersebut adalah vaksin virus, seperti Polio, Campak, Hepatitis B Uniject dan mOPV-1 (Monovalen Oral Polio Vaccine Tipe 1); vaksin bakteri, seperti Difteri, Pertussis, Tetanus dan Tetanus dalam kemasan Uniject sehingga termasuk dalam daftar WHO prequalified products.
2.7 Kerjasama PT. Biofarma
Dalam pengembangan dan penelitian tentang vaksin dan sera baik untuk menunjang kegiatan produksi maupun dalam menciptakan inovasi dan pengembangan produk-produk yang dipasarkan di masa yang akan datang PT. BIOFARMA (Persero) bekerja sama dengan beberapa pihak antara lain:
Beberapa perguruan tinggi di indonesia
Institut/Lembaga Penelitian Luar Negeri Untuk Pengembangan vaksin AUSAID, JICA, USAID, Colombo Plan, WHO, UNICEF dalam
pemberian bantuan finansial dan sarana produksi
Disamping itu PT. BIOFARMA juga melakukan kerja sama transfer teknologi dengan :
Netherland Vaccine Institute (NVI) Belanda pengembangan vaksin Hib
freeze dried
Cape biologicals Afrika Selatan pengembangan vaksin Hib Liquid
Kerjasama riset dengan NVI, NIBSC dan JPRI dalam pengembangan produk vaksin S-IPV (Sabin Injection Polio Vaccine)
BIKEN Jepang dalam rangka transfer teknologi formulasi, filing dan pengujian vaksin seasonal flu dalam rangka kesiapsiagaan menghadap
UNIT PENGEMBANGAN VAKSIN KOMBINASI PT. BIOFARMA
Praktek Kerja Profesi Apoteker (PKPA) ini bertujuan untuk mengenalkan kondisi kerja serta meningkatkan kompetensi mahasiswa dibidang industri. Mahasiswa PKPA di PT. Biofarma diarahkan untuk dapat mengenal serta mengikuti berbagai kegiatan di lingkungan kerja perusahaan. Mahasiswa diharapkan mampu memahami dan menerapkan ilmu yang telah diperoleh semasa kuliah saat melakukan kegiatan PKPA. PKPA Industri di PT. Biofarma dilaksanakan dari tanggal 2 April 2012 hingga 27 April 2012.
Kegiatan PKPA difokuskan di Unit Pengembangan Vaksin Kombinasi PT Biofarma. Proses pengenalan divisi lain dilakukan dengan cara diskusi serta melakukan kunjungan ke beberapa divisi terkait. Pelaksanaan CPOB dan cGMP di PT Biofarma dikenalkan melalui keikutsertaan langsung pada kegiatan PKPA di bagian PVK dan diskusi dengan pembimbing.
3.1 Divisi Penelitian dan Pengembangan PT. Biofarma
Divisi penelitian dan pengembangan bertugas untuk melakukan penelitian ilmiah yang beroriantasi pada pengembangan produk baru maupun produk yang telah ada. Divisi ini dibagi menjadi tiga bagian yaitu Pengembangan Vaksin Tunggal (PVT), Pengembangan Vaksin Kombinasi (PVK) dan Pengembangan Produk Lain (PPL). Bagian PVT berperan dalam pengembangan produk vaksin tunggal, antara lain rotavirus dan Inaktiv Polio Vaksin (IPV). Bagian PVK bertugas mengembangkan produk vaksin kombinasi, beberapa metode analisis untuk proses Quality Control (QC) dan proses produksi vaksin. Bagian PPL berperan untuk mengembangkan metode untuk kontrol kualitas rotavirus.
Beberapa prinsip kerja instrumen yang dikenalkan pada mahasiswa PKPA antara lain:
1. Polymerase Chain Reaction (PCR)
Metode PCR mengadaptasi kemampuan DNA polymerase untuk mensintesis strand baru dari DNA bebas untuk membentuk template strand.
Karena DNA polymerase dapat menambahkan nukleotida hanya pada gugus 3‟-OH yang telah ada, maka perlu sebuah primer, dimana dapat ditambahkan pada nukleotida pertama. Hal ini memungkinkan peneliti untuk mendeskripsikan daerah spesifik dari template sequence yang diinginkan. Di akhir reaksi PCR,
sequence spesifik tersebut akan terakumulasi dalam jutaan kopi (amplicons).
(Anonim, 2012a)
Reaksi PCR membutuhkan komponen sebagai berikut:
1. DNA template: sampel DNA yang mengandung sequence target. Pada awal reaksi, temperature yang tinggi dipaparkan pada molekul DNA rantai ganda untuk memisahkan rantai dari satu sama lain.
2. DNA polymerase: enzim yang mensintesis strand DNA baru dari DNA bebaspada sequence target. Enzim yang pertama dan paling sering digunakan adalah Taq DNA polimerase (dari Thermis aquaticus), sebagaimana Pfu DNA polymerase (dari Pyrococcus furiosus) banyak digunakan karena keakuratannya dalam mengkopi DNA. Walaupun kedua enzim ini sedikit berbeda, mereka memiliki kemampuan yang membuat mereka sesuai untuk PCR, yaitu:
a. Keduanya mampu menghasilkan strand DNA baru menggunakan
template dan primer DNA.
b. Keduanya tahan panas.
3. Primer : potongan pendek dari DNA rantai tunggal yang melengkapi
sequence target. Polimerase mulai mensintesa DNA baru dari sisi akhir
primer.
4. Nukleotida (dNTP atau deoksinukleotida trifosfat) : unit tunggal dari basa A, T, G, dan C, yang penting dalam “membangun blok” untuk rantai DNA baru.
5. RT-PCR (Reverse Transcription PCR): mengenalkan PCR dengan konversi sampel dari RNA ke dalam cDNA dengan enzim reverse
transcriptase.
PCR diaplikasikan dalam proses cloning, rekayasa genetika dan sequencing (Anonim, 2012a).
2. Elektroforesis
Elektroforesis adalah proses perpindahan molekul bermuatan dalam larutan dengan cara memberikan medan listrik pada campuran. Karena, molekul dalam medan listrik akan bergerak tergantung pada muatan, bentuk, dan ukurannya. Elektroforesis digunakan untuk pemisahan molekul yang sederhana dan relatif cepat. Metode ini digunakan untuk analisa dan pemurnian molekul besar seperti protein dan asam nukleat, namun dapat juga digunakan untuk molekul bermuatan lain yang lebih sederhana seperti gula, asam amino, peptida, nukleotida, dan ion sederhana. (Amersham Bioscience Inc., 1999)
Asam amino rantai samping protein dalam larutan mampu mengalami ionisasi, sehingga menjadi bermuatan positif atau negatif. Protein adalah elektrolit lemah dan terjadinya ionisasi sangat dipengaruhi pH dari medium disekitarnya. Muatan protein dalam larutan dikontrol dengan penggunaan larutan dapar. Dalam medan listrik, protein bermuatan bergerak menuju elektrode yang memiliki muatan berlawanan. Faktor-faktor yang mempengaruhi pergerakan protein antara lain muatan protein, kekauatan medan listrik, dan gaya gesek antara partikel dengan matriks.
Elektroforesis makromolekul umumnya dilakukan dengan mengaplikasikan lapisan tipis sampel pada larutan yang telah distabilisasi oleh matriks berpori. Voltase mempengaruhi pergerakan molekul dengan kecepatanan yang berbeda tergantung jenisnya. Pada akhir proses, molekul-molekul tersebut akan terdeteksi sebagai band pada posisi yang berbeda di matriks gel. Matriks dibutuhkan karena arus listrik yang melalui larutan elektroforesis menghasilkan panas, yang menyebabkan difusi dan pencampuran band dengan tidak adanya media stabilisasi. Jenis dan konsentrasi matriks mempengaruhi ukuran pemisahan. (Amersham Bioscience Inc., 1999)
Setelah elektroforesa, analisa kualitatif dapat dilakukan dengan metode
staining atau pewarnaan. Stainning dilakukan karena sebagian besar protein dan
semua asam nukleat tidak tampak secara langsung sehingga gel harus diproses untuk menentukan lokasi dan jumlah molekul yang terpisah. (Amersham Bioscience Inc., 1999)
Analisa kuantitatif dapat dilakukan untuk menentukan jumlah, ukuran dan
isoelectric point dari masing-masing band. Jumlah molekul dalam satu band dapat
ditentukan dengan berbagai cara, seperti membandingkan intensitas warna band baik dengan cara pewarnaan atau autoradiografi dengan standar yang telah diketahui kuantitasnya pada gel yang sama, densitometri, atau dengan menggunakan alat radioanalitik. Penentuan ukuran makromolekul berdasarkan mobilitasnya juga memerlukan standar yang ukuran molekulnya diketahui sebagai pembanding. Standar ukuran protein dan asam nukleat mengandung sekelompok molekul yang telah terkarakterisasi dan dapat digunakan untuk memperkirakan ukuran molekul protein atau asam nukleat yang tidak diketahui melalui perbandingan secara visual. Untuk perkiraan yang lebih akurat, pergerakan band standar dapat digunakan sebagai kurva kalibrasi, lalu ukuran sampel yang tidak diketahui dihitung berdasarkan kurva kalibrasi tersebut. Namun, karena ukuran molekul bukan fungsi sederhana dari jarak perpindahan molekul dalam gel, maka car aterbaik untuk menentukan ukuran molekul adalah dengan menggunakan beberapa standar yang memiliki ukuran lebih kecil dan lebih besar daripada molekul target. Bentuk molekul juga mempengaruhi mobilitas molekul yang melalui gel pengayak (sieving gel), semua molekul dalam satu gel harus memiliki bentuk yang sama agar perbandingannya valid. Isoelectric point (pI) dari protein yang tidak diketahui dapat diperkirakan dengan membandingkannya dengan standar protein yang telah diketahui pI-nya. Bila gradient pH dihasilkan dengan menggunakan amfolit,maka pH gel dapat diukur pada titik di sepanjang permukaan gel menggunakan electrode pH yang didesain untuk digunakan pada permukaan yang lembab. (Amersham Bioscience Inc., 1999)
3. SDS-PAGE (Sodium Dodecyl Sulphate-Polyacrylamide Gel Electrophoresis)
SDS-PAGE merupakan salah satu variasi dari teknik elektroforesa. Teknik
ini menggunakan SDS, suatu detergen anionik, untuk mendenaturasi dan memberikan muatan negatif pada protein. SDS terikat pada protein dengan rasio yang tetap yaitu, 1,4 g/g protein. Pada kondisi SDS berlebih, mobilitas protein pada elektroforesa bergantung pada ukuran molekul, tidak pada muatan intrinsik protein. PAGE merupakan teknik elektroforesa dengan format vertikal yang
seringkali digunakan untuk analisa DNA dan protein dengan berat molekul kecil. Teknik ini mengggunakan poliakrilamid sebagai media pemisahan. (Amersham Bioscience Inc., 1999)
Poliakrilamid merupakan matriks yang sering digunakan sebagai media stabilisasi pada pemisahan protein. Gel poliakriakrilamid dibuat dari polimer akrilamid yang berikatan sambung silang (crosslinked). Bahan yang digunakan untuk itu adalah N, N‟ metilenbisakrilamit (atau „bis‟). Konsentrasi akrilamit yang digunakan pada gel dinyatakan dalam % T (% w/v) yaitu jumlah gram akrilamit dan „bis‟ setiap 100 cm3
campuran gel sebelum terjadi polimerisasi. Konsentrasi matriks mempengaruhi pemisahan protein berdasarkan ukuran molekul protein. Kandungan poliakrilamid dalam gel berkisar antara 5 % hingga 20 %. Konsentrasi poliakrilamit yang rendah digunakan untuk pemisahan protein dengan berat molekul besar dan sebaliknya. Proses polimerisasi akrilamit dan “bis” merupakan reaksi ikatan radikal bebas. Proses ini diinisiasi dengan pembentukan radikal , umumnya dengan campuran ammonium persulfat (≤ 0,3 %) dan TEMED (≤ 0,2 %). Persulfat mengaktivasi TEMED, sehingga menghasilkan electron bebas. Rsdikal ini akan bereaksi dengan molekul akrilamit dan menghasilkan radikal baru yang bereaksi dengan molekul akrilamid lainnya, dan seterusnya hingga membentuk polimer.
Sebelum dimasukkan ke dalam sumuran di gel, sampel dilarutkan dalam larutan dapar. Untuk memastikan disolusi yang sempurna, loading buffer seringkali ditambahkan dengan SDS, yang mengurai aggregate, dan bahan pereduksi, 2-merkaptoetanol, yang berfungsi mereduksi ikatan disulfida. Pewarna, seperti bromofenol biru, dapat ditambahkan untuk mengamati running sampel dan kemungkinan terjadinya pergerakan sampel yang tidak sesuai jalur. Pewarna yang digunakan tidak boleh terikat pada protein.
Lokasi dan konsentrasi protein yang terpisah dapat diketahui dengan metode pewarnaan. Pewarna yang digunakan adalah pewarna yang mampu memberi warna band protein, namun tidak mewarnai gel poliakrilamit. Pewarna yang umumnya digunakan untuk pewarnaan protein adalah Coomassie™ Brilliant Blue atau silver staining. Coomassie Blue staining memiliki batas deteksi hingga 0,1-0,3 µg protein dalam satu band atau bahkan kurang untuk beberapa protein.
Silver staining system memiliki sensitivitas 100 kali lebih baik, dengan batas
deteksi hingga 1 ng protein. 4. Elektroforesa Agarosa
Agarosa merupakan polisakarida dengan kemurnian tinggi derivat agar. Agarosa dapat digunakan untuk memisahkan protein atau protein kompleks dengan ukuran besar. Agarosa juga dapat digunakan untuk pemisahan asam nukleat. Ukuran pori dan karakteristik pengayakan gel ditentukan dengan penyesuaian konsentrasi agarosa dalam gel. Semakin besar konsentrasi agarosa, semakain kecil ukuran pori yang dihasilkan. Konsentrasi yang umum digunakan adalah 0,4 – 4 % w/v. Gel agarosa relatif rapuh dan harus diperlakukan hati-hati. Gel yang dihasilkan adalah hidrokoloid, yang dihasilkan dari ikatan hidrogen dan hidrofobik, dan punya sifat keras namun mudah retak.
Deteksi asam nukleat dapat dilakukan dengan menggunkan pewarna etidium bromide, pewarna yang berflouresensi lemah dalm larutan namun menghasilkan warna flouresense oranye kuat ketika mengikat asam nukleat dan tereksitasi oleh sinar UV. Sekitar 10 – 50 ng DNA rantai ganda dapat terdeteksi dengan etidium bromide pada transluminator UV panjang gelombang 300 nm.
5. Akta Purifier
Akta Purifier merupakan sistem kromatografi cair yang didesain untuk
pengembangan metode dan penelitian. Sistem ini menyederhanakan proses transisi dari laboratorium ke skala produksi sehingga proses zcale-up dapat terprediksi dan tidak bermasalah. Akta Purifier memiliki monitor UPC-900 yang mampu mengukur absorban UV, pH dan konduktivitas. Alat ini dapat digunakan untuk purifikasi protein yang pemisahannya berdasarkan muatan protein. Konduktivitas diukur berdasarkan konsentrasi ion dalam larutan yang terelusi, konduktivitas tersebut dapat berasal dari eluen yang berupa larutan garam atau sampel yang mengandung ion. Absorbansi digunakan untuk mengukur konsentrasi protein yang diterelusi, absorbansi diukur pada panjang gelombang tertentu. Akta
Purifier merupakan teknik HPLC preparatif yang dapat memisahkan fraksi-fraksi
dalam sampel. Parameter seperti kecepatan aliran dan tekanan mempengaruhi proses pemisahan. Kecepatan aliran mempengaruhi daya tangkap resin. Tekanan mempengaruhi ketahanan alat atau kompresi kolom.
Tahapan dalam proses purifikasi ada tiga yaitu capturing, intermediate
purification dan polishing. Capturing adalah tahap isolasi, pemekatan dan
stabilisasi target produk. Intermediate purification adalah tahapan penghilangan pengotor dari bulk, pengotor tersebut dapat berupa protein, asam nukleat, endotoksin maupun virus. Polishing adalah tahapan pemurnian tertinggi dengan cara menghilangkan pengotor dan senyawa-senyawa lain yang tertinggal. Pada setiap tahap dapat digunakan teknik pemisahan yang berbeda, hal ini dilakukan untuk meningkatkan kemampuan pemisahannya. Teknik pemisahan yang dapat digunakan dapat berdasarkan pada ukuran partikel, muatan, hidrofobisitas, maupun spesifitas ikatan dengan ligan. Persyaratan kemurnian yang tergantung pada tujuan penggunaan produk target, misalnya untuk produk kefarmasian dan penelitian in vivo kemurnian sampel diharapkan mencapai 99%.
6. Tangential Flow Filtraton (TFF) System
TFF digunakan untuk pemekatan dan pemurnian protein. Pada TFF cairan dipompa dengan arah tangensial terhadap permukaan membran. Tekanan yang diberikan pada cairan menekan cairan melalui membran ke sisi pengumpul filtrat. Sedangkan partikel dan makromolekul yang berukuran besar akan tertahan pada permukaan upstream membran. Namun, partikel dan makromolekul tersebut tidak menumpuk. Komponen tersebut akan tersapu aliran tangensial cairan. Hal ini menyebabkan TFF menjadi proses yang ideal untuk pemisahan dibandingkan metode filtrasi normal. (Millipore, 2003)
Gambar 3.6 Skema sistem TFF (Millipore, 2003)
Pada pengoperasian unit TFF, pompa digunakan untuk menghasilkan aliran feed (cairan) sehingga mampu melalui permukaan membran. Selama cairan melalui permukaan membran, tekanan akan menekan cairan untuk melalui membran dan masuk ke bagian filtrat. Hal ini mengakibatkan perbedaan konsentrasi cairan feed pada daerah tengah arus dengan konsentrasi yang lebih pekat pada permukaan membrane. Gradien konsentrasi juga timbul pada jalur aliran dari inlet (feed) dan outlet (retentate) seiring dengan semakin banyaknya cairan yang melalui sisi filtrat. Laju aliran feed pada membran menyebabkan semakin menurunnya tekanan dari arah feed ke retentate. Aliran filtrat umumnya rendah dan memiliki hambatan, sehingga tekanan sepanjang sisi filtrate rata-rata konstan. (Millipore, 2003)
Gambar 3.7 Aliran dan tekanan dalam jalur TFF (Millipore, 2003)
Keterangan:
QF: feed flow rate [L h-1] QR: retentate flow rate [L h-1] Qf: filtrate flow rate [L h-1]
Cw: component concentration at the membrane surface [g L-1] Cf: component concentration in the filtrate stream [g L-1] TMP: applied pressure across the membrane [bar]
Gambar 3.8 Profil tekanan pada jalur TFF (Millipore, 2003)
Selama kegiatan PKPA mahasiswa juga diajarkan tentang tahapan pengembangan produk vaksin. Berikut tahapannya:
1. Basic Research
Pengembangan vaksin dilakukan bila ada kebutuhan masyarakat karena munculnya penyakit baru dan adanya perkembangan teknologi produksi vaksin, atau adanya perkembangan ilmu pengetahuan tentang antigen dan adjuvan vaksin. Perngembangan sediaan vaksin dilakukan untuk meningkatkan keamanan, kualitas, khasiat dan aseptabilitas masyarakat terhadap produk.
Pada tahap ini dilakukan pemilihan kandidat vaksin yang akan dikembangkan, pemilihan seed, serta adjuvant yang sesuai untuk vaksin tersebut.
Seed yang dimaksud disini dapat berasal dari isolasi mikroorganisme dari pasien
di suatu daerah endemik, ATCC, atau mikroorganisme yang telah dimodifikasi genetiknya dan diketahui identitasnya. Seed yang digunakan harus jelas history-nya. Antigen yang digunakan dalam sediaan vaksin ditentukan berdasarkan hasil penelitian. Adjuvan dipilih berdasarkan kompatibilitasnya dengan antigen.
2. Applied Research
Pada tahap ini dilakukan proses produksi dengan skala laboratorium dan dilakukan proses pengujian seperti layaknya pada pengujian sampel untuk produksi. Parameter pengujian dan spesifikasi hasil yang diinginkan harus sudah
ditentukan. Tahap ini terus dilakukan hingga diperoleh hasil yang optimal. Pelaksanaan produksi dan pengujian harus mengikuti standar GLP.
3. Clinical Development
Pada tahap ini dilakukan proses produksi dengan skala clinical lot dan dilakukan proses pengujian seperti layaknya pada pengujian sampel untuk produksi. Produk yang dihasilkan nantinya akan diuji preklinik dan klinik dengan bantuan beberapa pusat uji klinis. Pelaksanaan produksi dan pengujian harus mengikuti standar cGMP dan GLP.
4. Commercial Manufacturing
Pada tahap ini sudah dapat dilakukan proses registrasi produk dan melakukan produksi dengan skala komersial. Proses produksi harus memenuhi standar cGMP dan prekualifikasi WHO.
5. Post Marketing Survaillance
Pada tahap ini dilakukan monitoring penggunaan produk di masyarakat dan memantau efek samping yang timbul dari produk. Bila ada laporan mengenai KIPI maka dilakukan investigasi.
3.2 Divisi Teknik
Divisi teknik merupakan bagian pendukung operasional divisi produksi. Divisi ini dibagi menjadi empat bagian, yaitu: bagian pemeliharaan pendingin dan bangunan, bagian validasi dan kalibrasi, bagian pemeliharaan listrik dan jaringan (PLDJ) serta bagian mekanik. Bagian mekanik bertanggung jawab terhadap fasilitas produksi seperti pengujian mesin, perawatan mesin produksi, boiller
steam, insenerator untuk pengolahan limbah B3, jaringan perpipaan untuk air dan
gas, serta perbaikan peralatan yang rusak. Fasilitas produksi ini harus didesain sesuai standar untuk memproduksi obat. Fasilitas yang berada dalam ruang produksi harus mampu menjaga agar tidak terjadi kontaminasi partikel, mikroorganisme dan kontaminan lain terhadap produk dan personel yang sedang bekerja. Salah satu fasilitas dalam ruang produksi ini ialah clean room. Untuk menjaga clean room ini diperlukan pengaturan kelembaban, suhu dan tekanan untuk meminimalisasi timbul atau berkembangnya mikroba serta mencegah adanya sisa-sisa partikel di ruangan. Clean room memiliki dua tipe yaitu laminar
didesain khusus sesuai kebutuhan. Desain fisik di ruang produksi pada umumnya berupa permukaan dinding licin, tidak boleh terdapat sudut pada ruangan, tidak boleh terdapat retakan pada dinding atau lantai, ruangan mudah dibersihkan, menggunakan bahan-bahan yang tidak menumbuhkan mikroba, jalur pipa tersusun sesuai spesifikasi dan tidak boleh ada kebocoran. Bagian PLDJ bertanggung jawa terhadap listrik dan jaringan kabel serta IPAL (Instalasi Pengolahan Air Limbah). Sumber listrik di PT Bio Farma diperoleh dari genset dan PLN. Genset digunakan untuk pendukung bila terjadi kematian arus listrik dari PLN, karena berdasarkan peraturan WHO dinyatakan bahwa semua industri farmasi harus memiliki back up listrik karena produk kesehatan bersifat kritis (padamnya listrik akan berdampak pada produk). Untuk mengantisipasi padamnya listrik maka PT Bio Farma memiliki Uninterupted Power Supply (UPS) untuk mencegah matinya alat-alat kritis seperti fermentor disaat pergantian sumber listrik dari PLN ke genset. Bagian pendingin dan bangunan bertanggung jawab terhadap semua sistem atau ruang yang menggunakan refrigerator, seperti cold room, AHU (Air Handling
Unit) serta freezer dan juga desain bangunan. Bagian validasi dan kalibrasi
bertanggung jawab terhadap proses validasi dan kalibrasi HEPA Filter, alat atau mesin seperti autoklaf, oven, fermentor dan lain sebagainya serta instrumen-instrumen lain yang terkain proses produksi. Proses validasi dan kalibrasi dilakukan pada semua alat yang berkaitan dengan kualitas produk. Proses ini dilakukan secara periodik 1 tahun sekali atau tergantung risk analysis.
3.2.1 Bangunan
Prinsip untuk mendirikan bangunan di PT Biofarma mengadopsi persyaratan dari WHO. Parameter yang harus diperhatikan saat mendirikan industry farmasi adalah lokasi, desain bangunan, konstruksi bangunan, proses adaptasi, dan perawatan bangunan. Bangunan industri farmasi dibangun di lokasi tertentu yang tidak terhubung langsung dengan lingkunagn luar sehingga tidak menimbulkan polusi pada lingkungan sekitar. Desain dan layout harus dapat dibuat sedemikian rupa sehingga mencegah timbulnya kontaminasi silang, tidak kotor dan berdebu, memungkinkan perawatan yang efisien, meminimalisasi bahaya terjadinya error serta memungkinkan pembersihan bangunan. Desain bangunan harus memperhatikan aliran arus orang, proses, dan material. Desain
bangunan juga harus memperhatikan kenyamanan personil serta aman bagi produk maupun personil. Bangunan harus memiliki pet control untuk mencegah masuknya hewan pada fasilitas produksi. PT Biofarma menggunakan insect trap dan ultrasonik untuk mencegah masuknya hewan ke dalam bangunan. Konstruksi bangunan harus menggunakan material yang sesuai, memiliki suplai listrik yang cukup, pencahayaan yang cukup, suhu dan kelembaban ruang yang terkontrol, ventilasi dan noise terkendali. Perawatan bangunan juga harus dapat dilakukan secara efektif. Agar perawatan dapat dilakukan dengan mudah maka ada persyaratan tertentu seperti dinding yang harus licin sehingga tidak menyerap partikel dan mudah sibersihkan, ruangan tidak boleh bersudut sehingga tidak ada partikel yang tertinggal, lantai harus halus dan tahan bahan kimia karena pada pada ruang berkelas perlu dilakukan fumigasi, lampu diruang berkelas harus datar, jendela di ruang berkelas harus datar dan rangkap tiga untuk mencegah masuknya partikel dari udara luar, sambungan antar panel partisi harus diberi silikon (seal), pintu harus rapat dan bisa menutup sendiri. Untuk bangunan atau ruangan tertentu harus memiliki kontrol akses tertentu.
Dust Collector berfungsi untuk menyedot dan mengumpulkan
partikel-partikel debu sehingga tidak mengkontaminasi ruangan yang lain. Dust collector ada pada bagian penimbangan, pencampuran, sampling, dan packing powder.
Dust collector ada dua tipe, yaitu centrifugal fan yang dilengkapi dengan filter,
berfungsi untuk menghisap fine dust dan rotoclone yang berfungsi untuk menghisap debu dan dilengkapi dengan aliran air untuk mengikat debu tersebut (scrubber). Alat ini selalu berada dibagian bawah ruangan sehingga memungkinkan pengambilan debu dengan ukuran kecil maupun besar.
3.2.2 Heating, Ventilation and Air Conditioning System (HVAC System)
Heating, ventilation and air-conditioning (HVAC) memiliki peran penting
dalam memastikan kualitas produk farmasi. Sistem HVAC yang didesain dengan baik juga akan memberikan kondisi yang nyaman bagi operator. Desain sistem HVAC mempengaruhi layout bangunan. Sistem HVAC mencegah terjadinya kontaminasi dan kontaminasi silang. (WHO, 2006)
Sistem HVAC memberi perlindungan terhadap produk, personel dan lingkungan. Perlindungan terhadap produk dimaksudkan untuk mencegah
terjadinya kontaminasi dan kontaminasi silang serta memberikan kondisi lingkungan yang sesuai untuk menjaga stabilitas produk. Perlindungan terhadap personel dimaksudkan untuk mencegah terjadinya kontak dan memberikan kondisi kerja yang nyaman.
Temperatur, kelembaban dan ventilasi harus sesuai persyaratan dan tidak memberi pengaruh buruk pada kualitas produk baik selama proses produksi dan penyimpanan, maupun pada kinerja alat atau mesin produksi. (WHO, 2006) Pertukaran udara di ruangan minimal 20 kali per jam. Pertukaran udara dilakukan dengan bantuan booster, sehingga kapasitas booster diatur berdasarkan volume ruangan.
Parameter sistem tata udara meliputi suhu, kelembaban, perbedaan tekanan antar ruangan (differential pressure), pertukaran udara (room air changes), arah aliran udara (air flow direction) dan jumlah partikel. Parameter-parameter tersebut harus diperhatikan dalam mendesain sistem HVAC. Berikut ini merupakan komponen-komponen sistem HVAC :
Gambar 3.9 Komponen sistem HVAC (WHO, 2006a)
1. Weather louvre : Mencegah masuknya daun, serangga, kotoran dan hujan masuk ke dalam sistem.
2. Silencer : Mengurangi kebisingan akibat sirkulasi udara. 3. Flow rate controller : Mengatur volume atau kebutuhan udara (malam
dan sing hari, mengatur tekanan udara).