AKTIVITAS ANTIOKSIDAN EKSTRAK DAN FRAKSI AKTIF
TEMUKUNCI (Boesenbergia pandurata Roxb.)
ENGGAR PRATIWI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
ENGGAR PRATIWI. Aktivitas Antioksidan Ekstrak dan Fraksi Aktif Temukunci
(Boesenbergia pandurata). Dibimbing oleh ELLY SURADIKUSUMAH dan
BETTY MARITA SOEBRATA.
Temukunci
(Boesenbergia pandurata) merupakan salah satu tanaman
herbal di negara-negara Asia beriklim tropis yang digunakan dalam masakan dan
juga sebagai tanaman obat. Penelitian bertujuan menentukan aktivitas antioksidan
ekstrak dan fraksi aktif temukunci.
Aktivitas antioksidan temukunci diukur
menggunakan metode spektrofotometri penangkapan radikal bebas DPPH
(2,2’-difenil-1-pikrilhidrazil). Fraksi aktif diperoleh dengan penyemprotan DPPH
0.04% dalam metanol pada fraksi-fraksi menggunakan kromatografi lapis tipis.
Nilai IC
50untuk ekstrak temukunci sebesar 100 ppm sedangkan fraksi aktif
temukunci sebesar 99 ppm. Nilai ini sangat besar dibandingkan dengan BHT
(butylated hidroxytoluene) sebagai kontrol positif, yaitu sebesar 6.46 ppm.
ABSTRACT
ENGGAR PRATIWI. Antioxidant Activity of Extract and Active Fraction of
Temukunci (Boesenbergia pandurata). Supervised by ELLY
SURADIKUSUMAH and BETTY MARITA SOEBRATA.
Temukunci
(Boesenbergia pandurata Roxb.) is one of the herbal plants in
tropical Asian countries used for cooking and as medicine plant. The aim of this
research is to determine antioxidant activity of extract and its active fractions.
Antioxidant activity of temukunci was determined using the spectrophotometric
2,2’-diphenyl-1-picrylhydrazyl (DPPH) free radical scavenging method. Active
fraction was identified by spraying DPPH 0.04% in metanol using thin layer
chromatography. IC
50of its extract was 100 ppm and its active fraction was 99
ppm. These values were higher than BHT (butylated hidroxytoluene) as positive
control that was 6.46 ppm.
AKTIVITAS ANTIOKSIDAN EKSTRAK DAN FRAKSI AKTIF
TEMUKUNCI (Boesenbergia pandurata Roxb.)
ENGGAR PRATIWI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Skripsi
: Aktivitas Antioksidan Ekstrak dan Fraksi Aktif Temukunci
(Boesenbergia pandurata)
Nama
: Enggar Pratiwi
NIM :
G44204029
Menyetujui,
Pembimbing I Pembimbing II
Ir. Elly Suradikusumah, MS Betty Marita Soebrata, S.Si., M.Si.
NIP 130350043 NIP 131694523
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131578806
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah SWT
atas segala karuniaNya sehingga karya ilmiah ini dapat diselesaikan. Karya ilmiah
ini disusun berdasarkan hasil penelitian yang dilaksanakan mulai bulan Juli 2008
-Oktober 2008 di Laboratorium Kimia Analitik dan Laboratorium Bersama, Bogor
dengan judul Aktivitas Antioksidan Ekstrak dan Fraksi Aktif Temukunci
(Boesenbergia pandurata).
Penulis mengucapkan terima kasih kepada Ibu Ir. Elly Suradikusumah, MS
dan Ibu Betty Marita Soebrata, S.Si., M.Si. selaku pembimbing yang telah
memberikan arahan dan perhatian selama penelitian dan penulisan karya ilmiah
ini. Penulis juga mengucapkan terima kasih kepada keluarga atas dukungan dan
do’a serta kepada seluruh staf Laboratorium Kimia Analitik (Pak Eman, Pak
Ridwan, Pak Kosasih, Pak Dede, dan Bu Nunung), Pak Rafi, Pak Zulhan, Siti
Rahma, teman-teman seperjuangan yang telah banyak memberikan bantuan
selama melakukan penelitian (Muthoharoh, Suwandi, Budi, Rima, Lina, Ela, Ai,
Maipa, Ade M, Tanti, Fitri, dan Niken), serta seluruh teman-teman kimia
angkatan 41 atas segala dukungan dan doanya.
Akhir kata penulis berharap agar karya ilmiah ini dapat bermanfaat bagi
pembaca.
Bogor, Februari 2009
Enggar Pratiwi
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 30 September 1986 dari pasangan
Suratman dan Endah Triwahyuning. Penulis merupakan anak kedua dari empat
bersaudara.
Tahun 2004 penulis lulus dari SMU Negeri 3 Jakarta dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur USMI. Penulis memilih Program Studi
Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama perkuliahan, penulis aktif mengikuti organisasi kemahasiswaan atau
Himpunan Profesi Kimia/Imasika menjadi staf Departemen Keilmuan. Penulis
menjadi asisten praktikum mata kuliah Analitik Layanan tahun 2007/2008, mata
kuliah Kimia Analitik Dasar tahun 2007/2008, mata kuliah Kimia Dasar untuk
TPB dan Diploma tahun 2008/2009, mata kuliah Kimia Bahan Alam tahun
2008/2009, dan mata kuliah Manajemen Laboratorium tahun 2008/2009. Penulis
melaksanakan praktik lapangan di PT Indomilk. Selain itu, penulis juga mengikuti
Program Kreativitas Mahasiswa (PKM) Ilmiah dengan judul Pemanfaatan Sludge
Sebagai Kompos Pada Tanaman Padi Merah.
DAFTAR ISI
Halaman
DAFTAR ISI ………... i
DAFTAR GAMBAR ………... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Temukunci
...
1
Senyawa Aktif pada Temukunci ... 2
Ekstraksi
...
2
Antioksidan
...
2
DPPH
...
3
IC
50... 4
BAHAN DAN METODE
Alat dan Bahan ... 4
Penentuan Kadar Air ... 4
Fraksinasi Ekstrak Menggunakan Kromatografi Kilas ... 4
Penentuan Fraksi Aktif ... 4
Uji Aktivitas Antioksidan Metode DPPH ... 4
Uji Fitokimia ... 5
HASIL DAN PEMBAHASAN
Penentuan Kadar Air ... 5
Ekstraksi
...
5
Penentuan Fraksi Aktif ... 6
Penentuan Aktivitas Antioksidan ... 6
Kandungan Fitokimia ...7
SIMPULAN DAN SARAN
Simpulan
...
7
Saran
...
7
DAFTAR GAMBAR
Halaman
1 Rimpang temukunci ... ………... 2
2 Struktur senyawa aktif ... 2
3 Reaksi DPPH dengan antioksidan ... 3
4 Struktur BHT ... 3
5 Nilai IC
50... 7
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 10
2 Penentuan kadar air dan rendemen temukunci ... 11
3 Hasil pemisahan komponen ekstrak temukunci ... 12
4 Penentuan fraksi temukunci ... 13
5 Penentuan λ maksimum DPPH 1 mM ... 14
6 Pengukuran aktivitas antioksidan ekstrak temukunci ... 15
7 Pengukuran aktivitas antioksidan fraksi aktif temukunci ... 16
PENDAHULUAN
Seiring dengan makin meningkatnya kesadaran masyarakat akan pentingnya hidup sehat, tuntutan konsumen terhadap bahan pangan juga bergeser. Bahan pangan yang kini banyak diminati konsumen bukan saja yang mempunyai komposisi gizi yang baik serta penampilan dan cita rasanya menarik, tetapi juga harus memiliki fungsi fisiologis tertentu bagi tubuh, seperti dapat menurunkan tekanan darah, kadar kolesterol, dan kadar gula darah, serta meningkatkan penyerapan kalsium. Masyarakat di negara-negara maju dalam memilih bahan pangan tidak hanya bertumpu pada kandungan gizi serta kelezatannya, tetapi juga pengaruhnya terhadap kesehatan tubuh. Fenomena tersebut melahirkan konsep pangan fungsional.
Menurut Winarti dan Nurdjanah (2005), pangan fungsional adalah pangan yang secara alami dan melalui proses mengandung satu atau lebih senyawa yang berdasarkan kajian-kajian ilmiah dianggap mempunyai fungsi-fungsi fisiologis tertentu yang bermanfaat bagi kesehatan. Pangan fungsional dikonsumsi sebagaimana layak- nya makanan atau minuman, mempunyai karakteristik berupa penampilan, warna, tekstur dan cita rasa yang dapat diterima oleh konsumen, serta tidak memberikan kontraindikasi dan efek samping terhadap metabolisme zat gizi lainnya jika digunakan dalam jumlah yang dianjurkan.
Pangan fungsional dibedakan dari suplemen makanan atau obat berdasarkan penampilan dan pengaruhnya terhadap kesehatan. Bila fungsi obat terhadap penyakit bersifat kuratif, maka pangan fungsional lebih bersifat pencegahan terhadap penyakit. Tanaman rempah dan obat sudah lama dikenal mengandung komponen fitokimia yang berperan penting untuk pencegahan dan pengobatan berbagai penyakit. Kebutuhan akan tanaman rempah dan obat terus meningkat sejalan dengan munculnya kecenderungan untuk kembali ke bahan alam dan adanya anggapan bahwa efek samping yang ditimbulkannya tidak sebesar obat sintetis. Berdasarkan data yang didapatkan dari Pusat Data dan Informasi Pertanian tahun 2004, produksi tanaman biofarmaka di Indonesia meningkat cukup pesat dengan pertumbuhan tahun 2003 sebesar 12,93%.
Temukunci (Boesenbergia pandu- rata) merupakan salah satu tanaman herbal yang banyak ditemukan di negara-negara Asia beriklim tropis. Tanaman ini dapat digunakan
dalam memasak dan juga sebagai tanaman obat. Rizoma temukunci memiliki aktivitas biologi, yaitu antibakteri, antibisul, anti- peradangan, antioksidan, dan antitumor (Zaeoung et al. 2004).
Salah satu aktivitas biologi tersebut, yaitu antioksidan memiliki peranan penting untuk menghambat aktivitas radikal bebas yang masuk ke dalam tubuh. Aktivitas antioksidan banyak ditemukan pada tanaman rempah seperti temulawak dan kunyit tetapi belum banyak ditemukan pada rimpang temukunci. Untuk mengetahui besarnya potensi rimpang temukunci sebagai antioksidan, maka dilakukan suatu metode penentuan aktivitas antioksidan dari ekstrak temukunci. Dengan adanya potensi tersebut, temukunci sebagai salah satu tanaman rempah diharapkan menjadi pangan fungsional yang banyak digunakan oleh masyarakat seperti temulawak dan kunyit (Michalowska et al. 2007). Berdasarkan penelitian Lotulung et al. (2008), aktivitas antioksidan atau nilai konsentrasi inhibisi (inhibition concentration, IC50) dari ekstrak kloroform temukunci
menggunakan metode DPPH sebesar 180 ppm.
Beberapa metode penentuan aktivitas antioksidan antara lain 2,2’-difenil-1-pikrilhidrazil (DPPH), 2,2’-azinobis-(3-etil-benzotiazolin-6-asam sulfonat) (ABTS), asam 2-tiobarbiturat (thiobarbituric acid, TBA), kemampuan reduksi ion feri (ferric reducing
ability, FRAP), kapasitas antioksidan reduksi
ion kupri (cupric ion reducing antioxidant
capacity, CUPRAC), dan kapasitas absorbans
radikal oksigen (oxygen radical absorbance
capacity, ORAC) (Ozyurt et al. 2006).
Penelitian ini bertujuan mengukur aktivitas antioksidan ekstrak dan fraksi aktif temukunci. Metode yang digunakan adalah metode DPPH. Metode ini merupakan metode penentuan antioksidan berdasarkan penang- kapan radikal bebas dengan DPPH sebagai radikal bebasnya. Metode DPPH digunakan karena merupakan metode spektrofotometrik yang mudah dan banyak digunakan untuk penentuan aktivitas antioksidan. Pada metode DPPH, penangkapan radikal bebas diukur berdasarkan nilai absorbans pada panjang gelombang 515 nm.
TINJAUAN PUSTAKA Temukunci
Berdasarkan taksonomi tumbuhan, temukunci digolongkan ke dalam divisi
Magnoliophyta, kelas Liliopsida, ordo Zingiberales, familia Zingiberaceae, genus
Boesenbergia, dan spesies Boesenbergia pandurata. Nama lainnya, yaitu Boesen- bergia rotunda dan Kaempferia pandurata
(Kardono et al. 2003).
Gambar 1 Rimpang temukunci.
Berdasarkan morfologi, temukunci berbentuk silinder, memiliki panjang 6-10 cm, memiliki untaian-untaian, ujung runcing, berwarna coklat terang pada sisi luar dan kuning pada sisi dalam, dan berbau harum. Daunnya pendek, terdiri atas 3-4 daun, panjang tulang daun 12-25 cm, ujung daun elips, panjang daun 10-30 cm dengan lebar 5-10 cm (Gambar 1). Di Indonesia, temukunci berasal dari Pulau Jawa atau tepatnya daerah Jawa Tengah dan Jawa Timur. Tanaman ini tumbuh di daerah yang lembab atau di bawah perlindungan pohon-pohon besar.
Temukunci termasuk salah satu tanaman rempah dan obat asli dari wilayah Asia Tenggara. Rizoma dan akarnya digunakan sebagai obat tradisional seperti obat perangsang, obat disentri, anti- peradangan, obat sakit perut, dan untuk ketahanan tubuh. Temukunci digunakan dengan cara mengiris rimpangnya terlebih dahulu kemudian ditumbuk hingga halus. Rimpang yang sudah halus tersebut dapat dikunyah jika ingin mengobati sariawan, batuk, sakit tenggorokan, dan sebagainya. Selain itu, rimpang halus temukunci juga dapat ditambahkan sedikit air kemudian ditempelkan pada bagian tubuh luka (Kardono
et al. 2003).
Senyawa Aktif pada Temukunci
Aktivitas biologi temukunci dapat diperoleh dari komponen-komponen aktif fitokimia yang terdapat dalam temukunci. Komponen-komponen kimia tanaman temu- kunci ditemukan pada bagian rizoma. Menurut Kardono et al. (2003), senyawa-senyawa aktif pada temukunci terdiri atas flavanon (pinostrobin, pinosembrin, alpinetin, dan 5,7-dimetoksiflavanon), flavon (dimetoksiflavon dan 3’,4’,5,7-tetrametoksi flavon), kalkon
(2’,6’-dihidroksi-4’-metoksikalkon, kardamo- nin, panduratin A, panduratin B, boesenbergin A, boesenbergin B, dan rubranin), monoterpena (geranial dan neral), dan diterpena (asam pimarat). Beberapa struktur senyawa aktif temukunci ditunjukkan pada Gambar 2.
Gambar 2 Beberapa struktur senyawa aktif pada rimpang temukunci, (1) kalkon pinosembrin, (2) kardamonin, (3) pinosembrin, (4) pinostrobin, (5) 4-hidroksi panduratin A, dan (6) panduratin A.
Ekstraksi
Komponen aktif rimpang temukunci diperoleh dengan cara ekstraksi. Beberapa metode ekstraksi yang dapat digunakan untuk memperoleh ekstrak komponen suatu sampel, yaitu metode maserasi, refluks, dan soxhlet. Pada penentuan aktivitas antioksidan temukunci, metode ekstraksi yang digunakan adalah maserasi.
Maserasi dilakukan dengan cara merendam sampel, yaitu rimpang halus temukunci ke dalam suatu pelarut. Keuntungan menggunakan maserasi dalam memperoleh ekstrak dibandingkan dengan metode refluks atau soxhlet, yaitu maserasi dapat digunakan untuk mengekstrak komponen sampel yang tahan maupun tidak tahan panas. Ekstraksi menggunakan refluks atau soxhlet dikhawatirkan akan merusak komponen sampel yang dianalisis akibat pemanasan (Harborne 1987).
Antioksidan
Antioksidan merupakan penghambat adanya radikal bebas yang dapat merusak sel-sel manusia akibat kondisi oksidasi dan ketidakseimbangan radikal bebas yang menyebabkan gangguan terhadap metabo- lisme dalam sel. Radikal bebas adalah spesies yang tidak stabil karena memiliki elektron yang tidak berpasangan dan mencari pasangan elektron dalam makromolekul biologi.
Protein, lipida, dan DNA dari sel manusia yang sehat merupakan sumber pasangan elektron yang baik. Kondisi oksidasi dapat menyebabkan kerusakan protein dan DNA, kanker, penuaan, dan penyakit lainnya (Ozyurt et al. 2006).
Sumber radikal bebas diantaranya hasil metabolisme, neutrofil, radiasi uv, polusi air dan udara, lemak makanan, bahan kimia berbahaya, dan asap rokok. Antioksidan yang terdapat dalam tubuh dapat berupa enzim seperti fosfolipase, protease, serta enzim yang dapat memperbaiki susunan DNA (Ozyurt et
al. 2006). Antioksidan yang tersedia dalam
tubuh tidak sebanding dengan banyaknya radikal bebas yang mungkin masuk ke dalam tubuh. Oleh karena itu, untuk menangkap dan mencegah radikal bebas tersebut merusak sel-sel tubuh, diperlukan tambahan antioksidan dari luar tubuh.
Beberapa penelitian menunjukkan bahwa flavonoid dapat berperan sebagai antioksidan dan zat antikanker. Flavonoid merupakan metabolit sekunder yang terdis- tribusi pada tanaman. Lebih dari 6000 flavonoid telah diidentifikasi pada tanaman. Flavonoid terbagi menjadi beberapa bagian, yaitu flavon, flavanon, flavanol, dan isoflavon dengan struktur dan konformasi cincin oksigen heterosiklik (Harborne 1987). Contoh antioksidan alami lainnya diantaranya asam askorbat, α-tokoferol, β-karoten, glutation, asam urat, sistein, vitamin K, serum albumin, bilirubin, dan logam seperti seng dan selenium. Contoh antioksidan sintetik diantaranya hidroksianisol terbutilasi (buty-
lated hydroxyanisol, BHA) dan hidrok-
sitoluena terbutilasi (butylated hydroxy-
toluene, BHT) (Mosquera et al. 2007). DPPH
Metode yang digunakan pada penen- tuan aktivitas antioksidan rimpang temukunci pada penelitian ini adalah metode DPPH. Radikal bebas DPPH stabil dalam larutan berair atau metanol. Metode DPPH meru- pakan metode yang sering digunakan untuk penentuan aktivitas antioksidan dengan penggunaan radikal bebas DPPH yang stabil dan memiliki warna ungu yang ditunjukkan oleh pita absorpsi dalam pelarut metanol pada panjang gelombang sekitar 515-520 nm. Radikal bebas DPPH bersifat peka terhadap cahaya, oksigen, dan pH tetapi bersifat stabil dalam bentuk radikal sehingga mungkin dilakukan pengukuran aktivitas antioksidan. Radikal bebas DPPH dapat menangkap atom
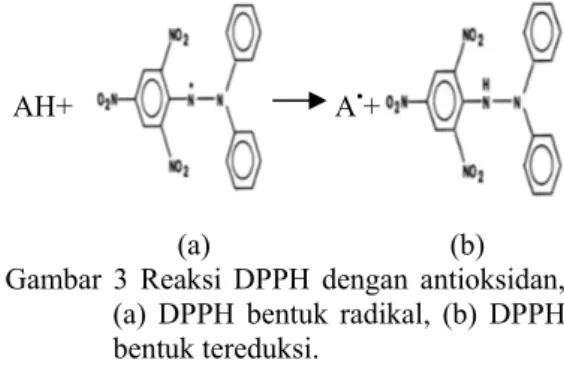
hidrogen dari komponen aktif ekstrak yang dicampurkan, kemudian bereaksi menjadi bentuk tereduksinya seperti yang terlihat pada Gambar 3. AH+ A•+ (a) (b) Gambar 3 Reaksi DPPH dengan antioksidan,
(a) DPPH bentuk radikal, (b) DPPH bentuk tereduksi.
Berdasarkan reaksi tersebut, senyawa antioksidan (AH) melepas atom hidrogen menjadi radikal senyawa antioksidan (A•).
DPPH yang merupakan radikal bebas direaksikan dengan senyawa antioksidan dan menjadi DPPH bentuk tereduksi (DPPH2)
(Molyneux 2004). Pada penelitian ini, senyawa antioksidan sintetik seperti BHT digunakan sebagai kontrol positif karena diharapkan dapat memberikan aktivitas antioksidan lebih besar dibandingkan antioksidan alami seperti α-tokoferol. BHT memiliki nama kimia 2,6-bis(1,1-dimetiletil)-4-metilfenol dan rumus kimianya adalah C15H24O dengan bobot molekul sebesar
220.35 g/mol. Struktur BHT dapat dilihat pada Gambar 4.
Gambar 4 Struktur hidroksitoluena terbutilasi (BHT) Dalam industri, BHT digunakan sebagai zat aditif antioksidan pada makanan, kosmetik, farmasi, produk karet, dan sebagainya. Fungsi BHT hampir sama seperti vitamin E, yaitu sebagai zat yang mencegah reaksi autooksidasi atau oksidasi yang disebabkan oleh O2 dari udara. Mekanisme
reaksi BHT sebagai senyawa antioksidan hampir sama seperti senyawa antioksidan dengan DPPH, yaitu:
RO2• + ArOH → ROOH + ArO•
dengan peroksi (RO2•) sebagai radikal bebas
direaksikan dengan BHT (ArOH) menjadi hidroperoksida (ROOH) yang nonradikal sedangkan BHT menjadi bentuk radikalnya (ArO•).
IC50
Larutan DPPH yang berisi ekstrak sampel diukur serapan cahayanya dan dihitung aktivitas antioksidannya dengan menghitung persentase inhibisi, yaitu banyaknya aktivitas senyawa antioksidan yang dapat menangkap radikal bebas DPPH. Parameter yang juga digunakan untuk pengukuran aktivitas antioksidan dari temukunci adalah IC50, yaitu bilangan yang
menunjukkan konsentrasi ekstrak yang mampu menghambat aktivitas suatu radikal sebesar 50% (Molyneux 2004).
Untuk menentukan IC50, diperlukan
persamaan kurva standar dari %inhibisi sebagai sumbu y dan konsentrasi fraksi antioksidan sebagai sumbu x. IC50 dihitung
dengan cara memasukkan nilai 50% ke dalam persamaan kurva standar sebagai sumbu y kemudian dihitung nilai x sebagai konsentrasi IC50. Semakin kecil nilai IC50 menunjukkan
semakin tinggi aktivitas antioksidannya (Molyneux 2004). Dalam hal ini diharapkan bahwa radikal bebas dapat ditangkap oleh senyawa antioksidan hanya dengan kon- sentrasi yang kecil.
BAHAN DAN METODE Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, cawan porselin, eksikator, oven, evaporator putar, kertas saring, neraca analitik, inkubator, lampu uv, kromatografi kilas Büchi Pump Manager C-615, kolom
Büchi Prepacked Cartridges dan spektro-
fotometer uv-vis (UV PharmaSpec 1700
Shimadzu). Bahan-bahan yang digunakan
adalah rimpang temukunci yang diperoleh dari Balitro, heksana, pelat KLT GF254, etanol
96%, methanol, kloroform, serbuk Mg, HCl pekat, amil alkohol, NH4OH, H2SO4 2 M,
pereaksi Mayer, Wagner, dan Dragendorf, dietil eter, asam asetat anhidrat, FeCl3 1%,
DPPH, dan BHT.
Metode
Penentuan Kadar Air (AOAC 2006)
Cawan porselin dikeringkan pada suhu 105ºC selama 30 menit. Setelah itu, didinginkan dalam eksikator. Serbuk temukunci ditimbang sebanyak 3 g lalu dimasukkan ke dalam cawan dan dipanaskan dalam oven pada suhu 105ºC selama 3 jam.
Kemudian cawan diangkat dan didinginkan dalam eksikator selama 30 menit. Setelah itu, cawan dengan rimpang temukunci ditimbang hingga bobot tetap atau selisih pengukuran bobot tiap kali penimbangan kurang dari 0,01 g. Pengukuran dilakukan triplo.
Ekstraksi Rimpang Temukunci
Sebanyak 50 gram rimpang temu- kunci dalam bentuk serbuk dihilangkan lemaknya terlebih dahulu dengan pelarut heksana kemudian dimaserasi dalam 150 ml etanol 96% selama 3×24 jam. Ekstrak temukunci kemudian disaring, dipekatkan dengan evaporator putar, ditentukan
rendemennya dan dilakukan uji selanjutnya, yaitu uji fitokimia, penentuan fraksi aktif dengan kromatografi, dan uji aktivitas antioksidan metode DPPH.
Fraksinasi Ekstrak Menggunakan Kro- matografi Kilas
Kolom yang digunakan memiliki panjang 150 mm dan diameter 40 mm dengan fase diam gel silika dengan ukuran 40-63 μm. Ekstrak temukunci ditimbang sebanyak 1,0027 g dan dilarutkan dengan 3 ml etanol. Kemudian larutan ekstrak tersebut dialirkan ke dalam kolom dan dielusi dengan pelarut metanol:kloroform (1:19) dan laju alir diatur menjadi 10 ml/menit. Vial-vial disiapkan untuk menampung eluat hasil pemisahan dengan volume retensi 5 ml. Setiap fraksi diuji kembali menggunakan KLT analitik untuk menentukan fraksi teraktif.
Penentuan Fraksi Aktif (Sreenivasan et al. 2007)
Masing-masing eluat hasil pemisahan dengan kromatografi kilas dielusi dengan pelarut metanol:kloroform (1:19) pada pelat KLT GF254. Hasil pemisahan tersebut dilihat
dengan lampu uv pada panjang gelombang 254 nm dan 365 nm. Eluat yang meng- hasilkan jumlah spot dan nilai Rf yang sama digabungkan menjadi satu fraksi. Fraksi-fraksi tersebut kemudian dielusi dengan pelarut metanol:kloroform (1:19) pada pelat KLT GF254. Lalu pelat KLT disemprot dengan
larutan DPPH 0,04% dalam metanol untuk melihat fraksi yang teraktif. Fraksi teraktif ditandai dengan lebih pudarnya warna ungu yang terlihat pada spot dibandingkan fraksi lainnya.
Uji Aktivitas Antioksidan Metode DPPH (Hanani et al. 2005)
Ekstrak dan fraksi teraktif temukunci dilarutkan dalam metanol dan dibuat dengan konsentrasi 10, 30, 50, dan 70 ppm. Masing-masing larutan dimasukkan ke dalam tabung reaksi sebanyak 4,5 ml. Ke dalam tiap tabung reaksi ditambahkan 0,5 ml larutan DPPH 1 mM dalam metanol. Kemudian diinkubasi pada suhu 37oC selama 30 menit dan
serapannya diukur pada panjang gelombang 515,2 nm. BHT digunakan sebagai kontrol positif dengan konsentrasi 2, 4, 6 dan 8 ppm. Nilai IC50 ekstrak, fraksi, dan BHT dihitung
dengan menggunakan rumus persamaan regresi.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid. Sebanyak 1 g ekstrak
temukunci ditambahkan 100 ml air panas kemudian dididihkan selama 5 menit dan disaring. Filtrat yang diperoleh kemudian diambil sebanyak 5 ml, ditambah dengan 0,05 g serbuk Mg, 1 ml HCl pekat, dan 1 ml amil alkohol. Campuran dikocok kuat-kuat. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Alkaloid. Sebanyak 1 g ekstrak
temukunci dilarutkan dengan 10 ml kloroform dan beberapa tetes NH4OH kemudian disaring
ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabung reaksi dikocok dengan penambahan 10 tetes H2SO4 2 M
kemudian lapisan asamnya dipindahkan ke dalam tabung reaksi yang lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan warna berturut-turut berwarna putih, coklat, dan merah jingga.
Uji Terpenoid dan Steroid. Sebanyak 1 g
ekstrak temukunci dimaserasi dengan 10 ml dietil eter selama 1 jam kemudian disaring. Ke dalam filtratnya ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid serta hijau atau biru untuk steroid.
Uji Saponin. Sebanyak 1 g ekstrak temukunci
ditambahkan dalam 100 ml air panas kemudian dididihkan selama 5 menit lalu
disaring. Sebanyak 5 ml filtrat dikocok dalam tabung reaksi tertutup selama 10 detik untuk kemudian dibiarkan 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih stabil.
Uji Tanin. Sebanyak 1 g ekstrak temukunci
ditambahkan ke dalam 100 ml air panas kemudian dididihkan selama 5 menit lalu disaring. Sebanyak 5 ml filtrat ditambah FeCl3
1%. Uji positif ditandai munculnya warna hijau kehitaman.
HASIL DAN PEMBAHASAN Penentuan Kadar Air
Pengeringan bahan dapat menyebab- kan air dalam bahan menguap sehingga kandungannya berkurang. Hal ini dapat menghambat pertumbuhan mikrob yang terdapat dalam bahan. Sampel yang baik disimpan dalam jangka panjang adalah sampel yang memiliki kadar air kurang dari 10% (Winarno 1997). Hasil penelitian menun- jukkan bahwa kadar air yang terkandung dalam sampel temukunci sebesar 13,53%. Kadar air sampel temukunci memiliki nilai lebih besar dari 10%. Dengan demikian, sampel temukunci memiliki waktu simpan yang relatif singkat dan mudah rusak oleh mikrob. Pertumbuhan mikrob dapat dikurangi dengan mengurangi kadar airnya. Hal tersebut dapat dilakukan dengan cara menyimpan serbuk temukunci dalam wadah dan tempat yang kering serta tidak lembab atau dengan memanaskan kembali serbuk temukunci sehingga kadar airnya dapat berkurang. Perhitungan penentuan kadar air dapat dilihat pada Lampiran 2.
Ekstraksi
Sebagian besar komponen aktif yang dianggap dapat digunakan sebagai anti- oksidan merupakan komponen yang bersifat polar. Sebelum rimpang temukunci diekstrak dengan pelarut polar, temukunci dihilangkan komponen lemak atau nonpolarnya terlebih dahulu menggunakan pelarut yang bersifat nonpolar seperti heksana. Komponen nonpolar yang terdapat dalam temukunci dapat mengganggu proses analisis. Lemak dapat menghambat penguapan pelarut pada saat ingin memperoleh ekstrak pekat etanol. Selain itu, lemak dikhawatirkan juga dapat terjerap dalam fasa diam pada saat penentuan fraksi aktif menggunakan kromatografi. Pada penelitian ini, pelarut yang digunakan dalam
ekstraksi komponen aktif temukunci adalah etanol 96%. Etanol merupakan pelarut yang bersifat polar yang diharapkan dapat mengekstrak atau mengambil senyawa aktif yang bersifat polar juga.
Sampel temukunci diekstraksi meng- gunakan metode maserasi. Maserasi dila- kukan dengan cara merendam rimpang halus temukunci ke dalam pelarut etanol. Berdasarkan hasil ekstraksi rimpang temukunci, rendemen yang diperoleh dari ekstrak etanol temukunci sebesar 9,93%. Perhitungan rendemen dapat dilihat pada Lampiran 2. Ekstrak yang diperoleh ber- warna kuning kecoklatan dengan aroma seperti jamu.
Penentuan Fraksi Aktif
Fraksi aktif sampel temukunci ditentukan setelah fraksinasi dengan suatu pelarut menggunakan kromatografi. Pemisa- han dengan kromatografi lapis tipis (KLT) digunakan untuk menentukan fraksi aktif ekstrak temukunci. Spot hasil pemisahan
komponen ekstrak temukunci dilihat menggunakan lampu uv 254 nm dan 365 nm. Fase diam yang digunakan adalah gel silika yang dipakai untuk melihat warna spot komponen yang berfluoresensi di bawah sinar uv pada panjang gelombang 254 nm dengan penyangga logam aluminium, sedangkan fase geraknya adalah campuran metanol:CHCl3
(1:19).
Fraksi-fraksi diperoleh dengan cara fraksinasi menggunakan kromatografi kolom. Pada fraksinasi ekstrak temukunci, kroma- tografi kolom yang digunakan adalah kromatografi kilas dengan fasa diam gel silika dan penyangga berupa kolom plastik. Kromatografi kilas merupakan suatu metode yang cukup mudah dan murah untuk melakukan fraksinasi dalam skala laboratorium.
Pelarut yang digunakan untuk mengelusi komponen ekstrak temukunci merupakan pelarut terbaik hasil pemisahan dengan KLT, yaitu campuran metanol:CHCl3
(1:19) (Lampiran 3). Pada pemisahan dengan kromatografi kolom, eluat ditampung dalam tabung atau vial dengan volume retensi 5 ml dan laju alir yang digunakan adalah 10 ml/menit. Berdasarkan hasil fraksinasi, diperoleh komponen hasil pemisahan sebanyak 45 tabung.
Menurut Blois (1958) dalam Hanani (2005), suatu bahan dapat dikatakan sebagai antioksidan yang kuat jika memiliki nilai IC
Masing-masing komponen hasil frak- sinasi dapat diidentifikasi menggunakan kromatografi lapis tipis dengan cara
menentukan nilai Rf masing-masing kom- ponen atau eluat. Nilai Rf yang sama dianggap sebagai satu fraksi. Berdasarkan hasil identifikasi dengan KLT, didapatkan fraksi pemisahan komponen sebanyak 4 fraksi. Hasil pemisahan fraksi dan nilai Rf terdapat pada Lampiran 4.
Penentuan fraksi aktif dari ekstrak temukunci dilakukan berdasarkan penam- pakan warna spot ekstrak dengan cara menyemprotkan larutan DPPH 0,04% dalam metanol pada beberapa fraksi ekstrak temukunci yang sudah ditotolkan pada pelat kromatografi lapis tipis dengan fasa diam silika gel.
Larutan DPPH menghasilkan warna ungu pada pelat KLT. Komponen aktif bereaksi dengan DPPH sehingga DPPH menjadi bentuk tereduksinya dan ditandai dengan berkurangnya intensitas warna ungu dari larutan DPPH pada spot fraksi ekstrak temukunci. Fraksi aktif dilihat pada spot-spot fraksi yang memiliki intensitas warna ungu yang rendah atau terlihat paling pudar. Hasil pewarnaan spot fraksi dengan DPPH menunjukkan bahwa fraksi yang dianggap merupakan fraksi teraktif ekstrak temukunci adalah fraksi 2 (Lampiran 4).
Penentuan Aktivitas Antioksidan
Penentuan aktivitas antioksidan dari ekstrak dan fraksi aktif temukunci didasarkan pada penangkapan radikal bebas DPPH dan aktivitasnya ditentukan menggunakan metode spektroskopik. DPPH memiliki warna ungu yang ditunjukkan oleh pita absorpsi dalam pelarut metanol pada panjang gelombang 515,2 nm (Lampiran 5).
Ekstrak dan fraksi aktif temukunci diukur aktivitas antioksidannya untuk mendapatkan nilai IC50. Berdasarkan hasil
penelitian, nilai IC50 untuk ekstrak temukunci
sebesar 100 ppm (Lampiran 6) dan nilai IC50
untuk fraksi aktif temukunci sebesar 99 ppm (Lampiran 7).
50
kurang dari 200 ppm. Dengan demikian, temukunci merupakan jenis tanaman yang memiliki kemampuan antioksidan yang kuat karena baik ekstrak maupun fraksinya memiliki nilai IC50 kurang dari 200 ppm.
Fraksi aktif temukunci diperoleh dari hasil pemisahan komponen menggunakan kromatografi. Berdasarkan hasil penelitian, didapatkan nilai IC50 ekstrak temukunci lebih
besar daripada fraksi aktifnya. Hal ini berarti fraksi aktif temukunci lebih berpotensi sebagai antioksidan dibandingkan dengan ekstraknya. Nilai IC50 antara ekstrak dan
fraksi aktif temukunci tidak berbeda jauh, mungkin dikarenakan fraksi aktif yang diperoleh tidak sepenuhnya merupakan campuran murni.
BHT sebagai kontrol positif juga diukur aktivitas antioksidannya. BHT memiliki bentuk seperti butiran kristal tidak berwarna. Dalam pelarut metanol, BHT tidak berwarna. Hasil penelitian menunjukkan bahwa BHT memiliki nilai IC50 sebesar 6,46
ppm (Lampiran 8). Nilai IC50 yang didapat
berbeda dengan hasil penelitian Hanani (2005), yaitu sebesar 3,81 ppm. Hal ini dikarenakan perbedaan kondisi dan waktu analisis yang berbeda.
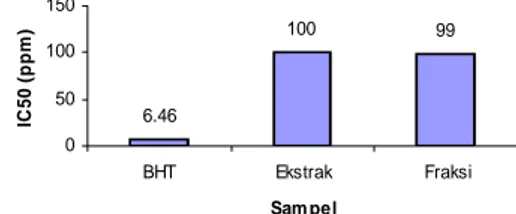
Berdasarkan metode DPPH, aktivitas antioksidan ekstrak dan fraksi aktif temukunci lebih rendah dibandingkan dengan kontrol positif BHT. Berdasarkan nilai IC50, BHT
memiliki nilai IC50 yang jauh lebih kecil
dibandingkan dengan ekstrak dan fraksi aktif temukunci (Gambar 5). Hal tersebut terjadi karena ekstrak dn fraksi aktif temukunci bukan merupakan senyawa murni seperti BHT. 6.46 100 99 0 50 100 150 BHT Ekstrak Fraksi Sam pel IC 50 ( p p m )
Gambar 5 Nilai IC50 dari BHT, ekstrak, dan
fraksi aktif temukunci.
Kandungan Fitokimia
Analisis fitokimia adalah salah satu cara untuk mengetahui kandungan metabolit sekunder pada suatu tanaman. Analisis fitokimia dilakukan dua kali, yaitu terhadap ekstrak kasar dan fraksi aktif temukunci. Tabel 1 Hasil uji fitokimia
Uji fitokimia Ekstrak Fraksi aktif Flavonoid + + Alkaloid + + Saponin - - Tanin + + Terpenoid - - Steroid - -
Berdasarkan hasil uji terhadap ekstrak dan fraksi aktif temukunci (Tabel 1), dapat dilihat bahwa baik ekstrak maupun fraksi aktif mengandung flavonoid, alkaloid, dan tanin. Hal ini sesuai dengan penelitian Kardono et al. (2003) yang menyatakan bahwa senyawa aktif pada temukunci merupakan senyawa polifenol seperti flavonoid dan tanin. Ekstrak dan fraksi aktif temukunci menunjukkan hasil negatif terhadap saponin, terpenoid, dan steroid. Hasil uji negatif pada analisis fitokimia dapat disebabkan karena kandungan fitokimia yang terdapat dalam sampel sangat kecil sehingga tidak terdeteksi. Hasil positif analisis fitokimia menunjukkan bahwa kemungkinan golongan senyawa yang aktif sebagai antioksidan pada temukunci adalah golongan senyawa flavonoid, alkaloid, dan tanin.
SIMPULAN DAN SARAN Simpulan
Berdasarkan nilai IC50, kemampuan
fraksi aktif temukunci sebagai antioksidan lebih besar dibandingkan dengan ekstrak temukunci. Aktivitas antioksidan baik ekstrak maupun fraksi aktif temukunci jauh lebih kecil dibandingkan dengan BHT. Temukunci memiliki kemampuan sebagai antioksidan yang kuat. Berdasarkan hasil uji fitokimia, ekstrak dan fraksi aktif temukunci mengandung flavonoid, alkaloid, dan tanin.
Saran
Aktivitas antioksidan temukunci perlu dibandingkan menggunakan metode lain untuk mengetahui potensi temukunci sebagai antioksidan lemah atau kuat. Senyawa-senyawa aktif pada temukunci perlu dianalisis dan diidentifikasi bagi penggunaan temukunci sebagai bahan obat.
DAFTAR PUSTAKA
[AOAC] The Association of Official Analytical Chemist. 2006. Official
Methods of Analysis. Ed ke-18.
Washington DC: Association of Official Analytical Chemist.
Hanani E, Abdul M, Ryany S. 2005. Identifikasi Senyawa Antioksidan dalam
Spons Callyspongia sp dari Kepulauan
Seribu. Majalah Ilmu Kefarmasian (2):127 – 133.
Harborne JB. 1987. Metode Fitokimia,
Penuntun Cara Modern Menganalisis Tumbuhan. Bandung: Penerbit ITB.
Kardono L, Artanti N, Dewiyanti I, Basuki T. 2003. Selected Indonesian Medicinal
Plants: Monographs and Descriptions.
Jakarta: PT Gramedia.
Lotulung PDN, Minarti, Kardono LBS, Kawanishi K. 2008. Antioxidant compound from the rhizomes of
Kaempferia rotunda L. Pakistan J Sci Bio
ISSN: 1028-8880, pp:1-4.
Michalowska AG, Korczak J, Hes M. 2007. Purification process influence on green tea extracs polyphenol content and antioxidant activity. Acta Sci Pol Technol
Aliment 6(2): 41-48.
Molyneux P. 2004. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. J Sci
Technol 26(2): 211-219.
Mosquera OM, Correa YM, Buitrago DC, Nino J. 2007. Antioxidant activity of twenty five plants from Colombian
biodiversity. Mem Inst Oswaldo Cruz 102(5): 631-634.
Ozyurt D, Demirata B, Apak R. 2006. Determination of total antioxidant capacity by a new spectrophotometric method based on Ce(IV) reducing capacity measurement. Talanta 24: 273-282.
Sreenivasan S, Ibrahim D, Noordin MJ. 2007. Free Radical Scavenging Activity and Total Phenolic Compound of Gracilaria changii. International J Nat Eng Sci 1(3): 15-117.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
Winarti C, Nurdjanah N. 2005. Peluang tanaman rempah dan obat sebagai sumber pangan fungsional. Jurnal Litbang
Pertanian 24(2).
Zaeoung S, Plubrukarn A, Keawpradub N. 2004. Cytotoxic and free radical scavenging of Zingiberaceous rhizomes.
Songklanakarin J Sci Technol 27(24):
799-812.
Lampiran 1 Diagram alir penelitian
Penentuan kadar air
Maserasi 3×24 jam
Penentuan eluen
terbaik dengan
KLT
Fraksinasi ekstrak
dengan kromatografi
kolom
Penentuan fraksi
teraktif
Penentuan aktivitas
antioksidan ekstrak dan fraksi
aktif
Pemekatan filtrat dengan
rotary evaporator
Uji fitokimia
Serbuk Temukunci
Ekstrak
Fraksi Aktif
Penentuan rendemen
Lampiran 2 Penentuan kadar air dan rendemen temukunci
Kadar air rimpang temukunci
Bobot sampel (g) Ulangan a b Kadar air (%) 1 3.0057 2.6081 13.23 2 3.0046 2.6014 13.42 3 3.0052 2.5864 13.94 rerata 13.53 a : sebelum dikeringkan b : sesudah dikeringkan
contoh perhitungan:
Kadar air (%) =
a
sampel
bobot
b
sampel
bobot
a
sampel
bobot
−
× 100%
=
g
g
g
0057
.
3
6081
.
2
0057
.
3
−
× 100%
= 13.23%
Rendemen ekstrak kasar etanol temukunci
Bobot sampel (g) Ulangan kering ekstrak Rendemen (%) 1 50.0470 4.1570 9.61 2 50.1685 4.4609 10.28 3 50.1105 4.2939 9.91 rerata 9.93
contoh perhitungan:
Rendemen (%) =
)
1
(
ker
ing
kadar
air
sampel
bobot
ekstrak
bobot
−
× 100%
=
%)
53
.
13
1
(
0470
.
50
1570
.
4
−
g
g
× 100%
= 9.61%
Lampiran 3 Hasil pemisahan komponen ekstrak temukunci untuk pemilihan eluen
terbaik
aseton:kloroform:metanol (10:9,5:0,5)
metanol:kloroform (1:4) metanol:kloroform (1:19)
Lampiran 4 Penentuan fraksi temukunci dengan eluen metanol:kloroform (1:19)
no tabung Rf Fraksi Rendemen
(g) 1 s.d. 7 0.8941 1 0.0954 8 s.d. 11 0.3176; 0.4706; 0.5882; 0.7059; 0.7647; 0.8235; 0.8823 12 s.d. 15 0.3176; 0.4941; 0.6118; 0.7059; 0.7647; 0.8235; 0.8823 16 s.d. 22 0.3529; 0.4706; 0.6000; 0.7059; 0.7647; 0.8235; 0.8823 2 0.5050 23 s.d. 26 0.3529; 0.4353; 0.4941; 0.6118; 0.7059 3 0.0044 27 s.d. 28 0.2588; 0.4000; 0.5059 29 s.d. 39 0.2353; 0.3529; 0.5059 40 s.d. 45 0.1882; 0.3529; 0.5059 4 0.0139
Contoh hasil penentuan fraksi pada pelat KLT:
Eluat tabung 1-13 Eluat tabung 14-26
Hasil penentuan fraksi aktif dengan DPPH:
Fraksi 3
Fraksi 1
Fraksi 4
Fraksi 2
Lampiran 5 Penentuan λ maksimum DPPH 1 mM
0.33 0.34 0.35 0.36 0.37 0.38 0.39 0.4 50 0 50 2 50 4 50 5 50 7 50 9 51 1 51 3 51 4 51 6 51 8 52 0 52 2 52 3 52 5 52 7 52 9 Panjang Gelombang (nm) Ab s o rb a n s Panjang gelombang maksimum = 515.2 nmLampiran 6 Pengukuran aktivitas antioksidan ekstrak temukunci
konsentrasi ulangan absorbans rerata A % inhibisi IC50 (ppm)
1 0.770 2 0.732 0 ppm 3 0.815 0.772 0.00 1 0.779 2 0.703 10 ppm 3 0.757 0.746 3.32 1 0.576 2 0.593 30 ppm 3 0.640 0.603 21.89 1 0.513 2 0.534 50 ppm 3 0.575 0.541 29.97 1 0.523 2 0.532 70 ppm 3 0.523 0.526 31.87 100.2422
Contoh perhitungan:
% Inhibisi =
blanko
A
sampel
A
blanko
A
−
× 100%
=
772
.
0
746
.
0
772
.
0
−
× 100%
= 3.32
%Berdasarkan data tabel di atas, didapatkan persamaan garis:
y = 0.4687x + 3.0165
50 = 0.4687x + 3.0165
46.9835 = 0.4687x
x = 100.2422
Lampiran 7 Pengukuran aktivitas antioksidan fraksi aktif temukunci
konsentrasi ulangan absorbans rerata A % inhibisi IC50 (ppm)1 0.770 2 0.732 0 ppm 3 0.815 0.772 0.00 1 0.677 2 0.732 10 ppm 3 0.651 0.687 11.05 1 0.587 2 0.583 30 ppm 3 0.577 0.582 24.57 1 0.522 2 0.564 50 ppm 3 0.543 0.543 29.66 1 0.486 2 0.490 70 ppm 3 0.481 0.486 37.09 98.6530
Contoh perhitungan:
% Inhibisi =
blanko
A
sampel
A
blanko
A
−
× 100%
=
772
.
0
687
.
0
772
.
0
−
× 100%
=
11.05%Berdasarkan data tabel di atas, didapatkan persamaan garis:
y = 0.4161x + 8.9505
50 = 0.4161x + 8.9505
41.0495 = 0.4161x
x = 98.6530
Lampiran 8 Pengukuran aktivitas antioksidan kontrol BHT
konsentrasi ulangan absorbans rerata A % inhibisi IC50 (ppm)
1 1.366 2 1.366 0 ppm 3 1.366 1.366 0.00 1 0.935 2 1.026 2 ppm 3 1.016 0.993 27.31 1 0.882 2 0.852 4 ppm 3 0.871 0.868 36.46 1 0.703 2 0.724 6 ppm 3 0.687 0.705 48.39 1 0.561 2 0.597 8 ppm 3 0.575 0.578 57.69 6.4626