KULTUR IN VITRO SEL-SEL FIBROBLAS
FETUS TIKUS
HARLYSTIARINI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
KULTUR IN VITRO SEL-SEL FIBROBLAS
FETUS TIKUS
HARLYSTIARINI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
KULTUR IN VITRO SEL-SEL FIBROBLAS
FETUS TIKUS
HARLYSTIARINI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya menyatakan bahwa skripsi dengan judul “Kultur In Vitro Sel-sel Fibroblas Fetus Tikus” adalah karya saya sendiri dengan arahan pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, September 2010
Harlystiarini B04060701
ABSTRAK
HARLYSTIARINI. Kultur In Vitro Sel-sel Fibroblas Fetus Tikus yang dibimbing oleh Dr. Drh. Ita Djuwita, M.Phil.
Penelitian yang dilakukan berupa kultur in vitro sel-sel fibroblas fetus tikus menggunakan Dulbeccos’ Modified Eagle Medium yang dimodifikasi dengan penambahan 3mM natrium bikarbonat, 10% fetal calf serum, dan 50 µg/ml gentamisin (mDMEM) di dalam inkubator CO2 pada suhu 37ºC. Evaluasi
dilakukan terhadap tingkat proliferasi dan produksi protein setelah beberapa pasase. Pertumbuhan sel-sel fibroblas diidentifikasi melalui pengamatan morfologi. Tingkat proliferasi sel ditentukan berdasarkan population doubling
time (PDT) dengan menghitung jumlah sel pada setiap pasase menggunakan
hemositometer Improved Neubauer. Identifikasi protein dilakukan dengan metode
Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE).
Berdasarkan pengamatan morfologi, sel yang berkembang di dalam kultur in vitro adalah sel fibrosit dan sel fibroblas dan memperlihatkan peningkatan homogenitas setelah beberapa pasase. Berdasarkan nilai PDT, tingkat proliferasi sel juga meningkat seiring pasase. Sel fibroblas juga tetap mensekresikan protein hingga pasase 9 berdasarkan hasil elektroforesis. Dengan demikian dapat disimpulkan bahwa pertumbuhan dan sekresi protein dari kultur in vitro sel-sel fibroblas bisa dipertahankan sampai 9 pasase.
ABSTRACT
Research has been conducted on the in vitro culture of rat fetal fibroblast using Dulbeccos’ Modified Eagle Medium supplemented with 3mM sodium bicarbonate, 10% fetal calf serum and 50 µg/ml gentamycin (mDMEM) in CO2
incubator at 37oC. Evaluation was done on the proliferation rate and the protein production after several passages. The growth of the fibroblast was confirmed by their morphology. The proliferation rate was done based on the population doubling time (PDT) by counting the number of cells in each passage by using Improved Neubauer hemocytometer. Identification of proteins was done quatitatively using Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE). Based on morphological observation the cell grown in in vitro culture were the fibrocyte and fibroblast and showed increasing of homogenicity after several passages. Based on the PDT, the proliferation rate was increased by each passages. Fibroblast also secrete proteins remain until passage 9 based on the results of electrophoresis. It can be concluded that the growth and protein secretion of rat fetal fibroblast in in vitro culture can be maintained up to 9 passages.
©Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
KULTUR IN VITRO SEL-SEL FIBROBLAS FETUS TIKUS
HARLYSTIARINI
B04060701
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Judul Skripsi : Kultur In Vitro Sel-sel Fibroblas Fetus Tikus Nama : Harlystiarini
NIM : B04060701
Disetujui :
Dr. Drh. Ita Djuwita, M.Phil Pembimbing
Diketahui :
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Syukur Alhamdulillah kehadirat Allah SWT, karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi ini berjudul “Kultur In Vitro Sel-sel Fibroblas Fetus Tikus” disusun berdasarkan hasil penelitian yang dilaksanakan pada Januari sampai dengan Juni 2010, dan merupakan salah satu syarat untuk memperoleh gelar sarjana kedokteran hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Pada kesempatan ini tidak lupa penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Dr. drh. Hj. Ita Djuwita, M.Phil selaku dosen pembimbing tugas akhir dan dosen pembimbing akademik yang telah banyak memberikan arahan dan masukan baik dalam penyelesaian skripsi ini maupun selama menyelesaikan pendidikan S1,
2. Dr. Drh. Nurhidayat, MS. Sebagai dosen penilai dalam seminar skripsi, 3. Drh. R. P. Agus Lelana, Sp. MP., M.Si. dan Drh. Titiek Sunartatie,
M.Si. sebagai dosen penguji dalam ujian sidang sarjana,
4. Keluarga tercinta, Bapak Hasanuddin Husain, Ibu Dra. St. Rosdia, serta adik-adikku Muh. Yasser dan Muh. Irfan yang telah memberikan do’a, semangat, dukungan, dan perhatian,
5. Dosen Fakultas Kedokteran Hewan atas segala ilmu yang diberikan, 6. Pak Wahyudin dan staf laboratorium Embriologi FKH IPB yang telah
banyak membantu kelancaran penelitian ini,
7. Rekan-rekan sepenelitian di Bagian Embriologi, Vivit Riyacumala, Novi Tandria, Khairunnisa, dan Karunia Maqfiroh, atas semangat dan kerjasamanya,
8. Sahabat-sahabat B4 Irna Suhaena Kadir, Asmayanti Azis, dan A. Nur Adhayanti atas kebersamaan, do’a, dan dukungannya,
9. Rekan Aesculapius FKH 43 khususnya Laras Andini, Sri Nofrianti, Ranti A, Fifit Diah P, dan Yulia Riza, atas kebersamaan, perjuangan, kekompakan, dan semangat selama menjalani pendidikan S1,
10. Rekan-rekan kostan “Sri Rahayu I” sebagai keluarga yang selalu memberikan do’a dan semangat, dan
11. Berbagai pihak yang telah membantu terselesaikannya skripsi ini. Penulis menyadari skripsi ini masih jauh dari sempurna, dikarenakan keterbatasan pengetahuan penulis. Namun demikian penulis mengharapkan bahwa hasil penelitian ini dapat bermanfaat untuk berbagai pihak.
Bogor, September 2010
RIWAYAT HIDUP
Penulis dilahirkan di Selayar, Sulawesi Selatan pada tanggal 14 Oktober 1987. Penulis merupakan putri pertama dari tiga bersaudara dari pasangan Bapak Hasanuddin Husain dan Ibu Dra. St. Rosdia.
Penulis telah menempuh pendidikan formal di SD Inpres Benteng II-Selayar (2000), SMP Negeri II Benteng-II-Selayar (2003), dan SMA Negeri I Benteng (2006). Pada tahun 2006 penulis melanjutkan pendidikan sarjana di Institut Pertanian Bogor melalui jalur USMI dan masuk Fakultas Kedokteran Hewan.
Selama menjalani pendidikan sarjana, penulis berkesempatan menjadi anggota Himpunan Profesi Ornithologi dan Unggas (2007-2009) dan aktif sebagai Ketua Divisi Dana Usaha (2007-2008) dan Ketua Divisi Kubah (2008-2009).
Untuk menyelesaikan pendidikan di Fakultas Kedokteran Hewan, penulis melaksanakan penelitian yang berjudul “Kultur In Vitro Sel-sel Fibroblas Fetus Tikus”.
DAFTAR ISI
Halaman
DAFTAR ISI ………. x
DAFTAR GAMBAR ……… xii
DAFTAR LAMPIRAN ………. xiii
DAFTAR SINGKATAN ……….. xiv
PENDAHULUAN Latar Belakang ……… 1 Tujuan ………. 3 Manfaat ………... 3 TINJAUAN PUSTAKA Sel Fibroblas ……… 4
Morfologi dan Peranan Sel Fibroblas ………. 4
Kultur Sel Fibroblas ……… 6
Sumber Sel Fibroblas ……….. 7
Sistem Kultur Sel Fibroblas ……… 8
Pemanfaatan Kultur Sel Fibroblas ……….. 11
Protein yang Dihasilkan Oleh Sel Fibroblas ………... 12
Metode Analisis Protein ……….. 12
METODOLOGI Waktu dan Tempat ……….. 15
Alat dan Bahan ………... 15
Prosedur Kerja ………. 15
Isolasi Sel Fibroblas ………... 15
Kultur In vitro Sel Fibroblas ………... 16
Pembuatan Conditioned Medium (CM) ………. 16
Pasase Sel Fibroblas ……….. 16
Evaluasi Hasil Kultur Sel Fibroblas ………... 17
Morfologi Sel Fibroblas ..………. 17
Pertumbuhan Sel Fibroblas ……….. 17
Identifikasi Protein ………..………… 17
HASIL DAN PEMBAHASAN Morfologi Sel Fibroblas dalam Kultur In Vitro ………. 19
Pertumbuhan Sel Fibroblas dalam Kultur ……….. 21
SIMPULAN DAN SARAN
Simpulan ………... 25
Saran ………. 25
DAFTAR PUSTAKA ……… 26
DAFTAR GAMBAR
Halaman
1 Sel fibroblas dan fibrosit secara skematis ………. 4
2 NIH 3T3 salah satu contoh cell line fibroblas ……….. 7
3 Mekanisme sederhana SDS PAGE ……….. 12
4 Kultur in vitro sel fibroblas preparat natif ……….. 18
5 Sel-sel fibroblas dengan pewarnaan HE ………... 19
6 Hasil SDS PAGE conditioned medium kultur sel fibroblas dengan pewarnaan silver nitrat ……….. 22
DAFTAR LAMPIRAN
1 Pembuatan Medium Kultur DMEM ……….. 29
2 Pembuatan Larutan PBS ……… 29
3 Prosedur Pewarnaan HE ……… 29
4 Pembuatan Stock Reagent ………. 30
5 Pembuatan Gel Poliakrilamid………. 31
6 Pembuatan Stock Buffer dan Running Buffer ……… 31
DAFTAR SINGKATAN
BMSC : Bone Marrow Stem Cell CM : Conditioned Medium
DMEM : Dulbecco’s Modified Eagle’s Medium ESC : Embryonic Stem Cell
FCS : Fetal Calf Serum HE : Hematoksilin eosin HFF : Human Fetal Fibroblas HNF : Human Neonatal Fibroblas MEF : Mouse Embrionic Fibroblas PBS : Phosphate Buffered Saline PDT : Population Doubling Time REF : Rat Embrionic Fibroblas
PENDAHULUAN
Latar Belakang
Sel fibroblas merupakan sel yang paling umum ditemui pada jaringan ikat. Sel ini bertanggung jawab terhadap sintesis komponen matriks ekstraseluler yang terdiri dari serabut dan bahan dasar (Junquieira dan Carneiro 2005). Serabut jaringan ikat terdiri dari serabut kolagen, retikuler, dan elastik (Dixon 2007). Menurut Junquieira dan Carneiro (2005) serabut jaringan ikat didominasi oleh kolagen yang membentuk tendon, aponeurose, kapsula organ, dan meningen. Bahan dasar terdiri dari makromolekul anionik (glycosaminoglycans dan
proteoglycans) dan multiadhesive glycoprotein (laminin dan fibronectin)
(Junquieira dan Carneiro 2005).
Sel fibroblas mampu mensekresi enzim yang berfungsi mendegradasi matriks ekstraseluler sebagai respons terhadap adanya luka atau saat dibutuhkan untuk proses perbaikan jaringan. Selain itu, sel fibroblas juga dapat menghasilkan beberapa faktor yang dapat menstimulasi atau menghambat proliferasi, diferensiasi, peradangan, serta angiogenesis tergantung pada keadaan atau kebutuhan jaringan. Sel fibroblas akan membelah dengan relatif lambat pada jaringan normal, tetapi akan segera berproliferasi dengan cepat sebagai respon saat terjadi perlukaan jaringan. Proses proliferasi ini secara umum dipengaruhi oleh faktor pertumbuhan (growth factor) yang dihasilkan oleh platelet saat terjadi perlukaan.
Sel fibroblas merupakan sel pertama yang berhasil dikultur secara in vitro. Menurut Prowse et al. (2007) kultur in vitro sel-sel fibroblas dapat mensekresikan sekitar 175 jenis protein. Beberapa jenis protein tersebut memiliki peranan penting dalam mempertahankan pluripotensi stem sel embrionik manusia. Selain itu, beberapa protein yang dihasilkan oleh sel-sel fibroblas juga berperan sebagai
growth factor. Salah satu growth factor yang dihasilkan oleh sel fibroblas adalah basic fibroblast growth factor (bFGF/FGF2) (Pereira et al. 2000). Faktor
pertumbuhan ini biasa digunakan dalam bentuk fibroblast feeder layer maupun dalam bentuk fibroblast conditioned medium (Levenstein et al. 2006). Kemampuan FGF2 dalam mempertahankan pluripotensi stem sel dikarenakan
stem sel embrionik manusia memiliki reseptor mRNA untuk FGF2 (Van Den Bos
et al. 1997, Xu et al. 2005).
Medium yang mengandung sekreta yang dihasilkan oleh sel-sel fibroblas kemudian dikenal dengan sebutan conditioned medium (CM). Conditioned
medium dari rat embryonic fibroblast (CM-REF) telah terbukti mampu
menginduksi peningkatan proliferasi bone marrow mesenchymal stem cells dan menjaga pluripotensinya (Efendi 2009).
Peranan lain dari kultur sel-sel fibroblas adalah sebagai feeder layer.
Mouse embryonic fibroblast (MEF) merupakan kultur sel fibroblas yang banyak
digunakan sebagai feeder layer dalam penelitian yang berkaitan dengan stem sel embrionik manusia karena kemampuannya menghasilkan beberapa faktor yang mampu menghambat diferensiasi sel (Rylova et al. 2008). Menurut Navsaria et al. (1994) MEF yang digunakan sebagai feeder layer menghasilkan protein matriks ekstraseluler yang mendorong perlekatan sel (attachment), selain itu MEF juga menghasilkan sitokin dan faktor pertumbuhan yang dapat menstimulasi proliferasi sel (Mallon et al. 2006).
Selain digunakan dalam penelitian yang berkaitan dengan stem sel, kultur sel-sel fibroblas juga dikembangkan untuk digunakan sebagai sel inang dalam produksi bahan-bahan terapeutik yang berkaitan dengan virus, misalnya dalam pembuatan vaksin (McSharry et al. 2001, Butler 2004). Compton (1993) berhasil membuktikan bahwa immortalized human fibroblast cell line dapat digunakan dalam analisis genetik mengenai human cytomegalovirus (HCMV). Chick
fibroblast juga pernah dijadikan sebagai substrat virus avian leukosis untuk
menghasilkan vaksin cacar air dan penyakit gondok (Johnson dan Heneine 2001). Adanya potensi dari kultur sel-sel fibroblas baik sebagai bahan yang dapat mempertahankan pluripotensi stem sel embrionik manusia maupun sebagai media untuk menguji bahan-bahan terapeutik, menyebabkan perlunya dilakukan analisis terhadap kemampuan pertumbuhan sel-sel fibroblas fetus tikus serta protein yang disekresikan dalam kultur in vitro setelah mengalami beberapa pasase.
Tujuan
Tujuan dari penelitian ini adalah mengamati morfologi dan mengidentifikasi kemampuan pertumbuhan sel-sel fibroblas fetus tikus serta protein yang disekresikan dalam kultur in vitro setelah mengalami beberapa pasase.
Manfaat
Penelitian ini dapat memberikan manfaat yaitu diperolehnya informasi tentang kemampuan pertumbuhan sel-sel fibroblas fetus tikus serta protein yang disekresikan dalam kultur in vitro setelah mengalami beberapa pasase. Selain itu, juga diperolehnya bahan baik feeder layer maupun conditioned medium yang dapat dimanfaatkan untuk menginduksi stem sel embrionik, serta diperolehnya galur sel fibroblas.
TINJAUAN PUSTAKA
Sel Fibroblas
Jaringan ikat merupakan jaringan yang bertanggung jawab untuk menunjang dan memelihara integritas struktur tubuh (Junquieira dan Carneiro 2005). Jaringan ini terdiri dari tiga dimensi kerangka penunjang epithelium dan jaringan lain, serta memegang peranan penting dalam proses regulasi panas, mekanisme penyimpanan, pertahanan, perlindungan, dan penyembuhan (Eurell dan Sickle 1998, Samuelson 2007).
Secara struktural, jaringan ikat terdiri atas tiga komponen yaitu sel jaringan ikat, serabut, dan bahan dasar (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) sel jaringan ikat meliputi sel fibroblas, makrofag, sel mast, leukosit, sel plasma, sel lemak, sel pigmen, dan sel mesenkim. Serabut jaringan ikat terdiri dari serabut kolagen, retikuler, dan elastik (Dixon 2007). Menurut Junquieira dan Carneiro (2005) serabut jaringan ikat didominasi oleh kolagen yang membentuk tendon, aponeurose, kapsula organ, dan meningen. Bahan dasar terdiri dari makromolekul anionik (glycosaminoglycans dan
proteoglycans) dan multiadhesive glycoprotein (laminin, fibronectin, dll) (Junquieira dan Carneiro 2005).
Sel jaringan ikat memiliki 2 tipe yaitu tipe tetap (resident type/fixed cells) dan tipe transient (wandering cells) (Eurell dan Sickle 1998). Menurut Trautmann dan Fiebiger (1957) sel fibroblas termasuk jaringan ikat tipe tetap karena sel fibroblas mempunyai peranan penting dalam pembentukan jaringan ikat yaitu membentuk serabut (kolagen, retikuler, dan elastik) dan memproduksi makromolekul (glycosaminoglycan dan proteoglycan) yang merupakan komponen bahan dasar dari jaringan ikat. Selain itu, sel fibroblas dikelompokkan ke dalam tipe tetap karena sel tersebut relatif stabil dan hanya sedikit sekali mengalami pergerakan (Ross et al. 1995).
Morfologi dan Peranan Sel Fibroblas
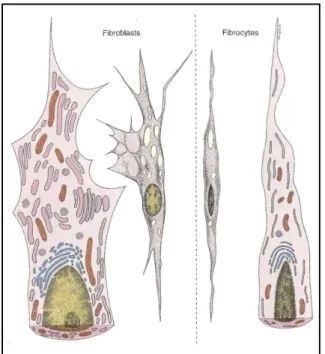
Sel fibroblas memiliki dua bentuk yaitu bentuk aktif dan bentuk tidak aktif. Bentuk aktif disebut sel fibroblas, sedangkan bentuk tidak aktif disebut sel fibrosit (Junquieira dan Carneiro 2005) (Gambar 1).
Menurut Eurell dan Sickle (1998) sel fibrosit merupakan sel yang paling umum ditemui pada jaringan ikat. Sel fibrosit umumnya berbentuk spindel dengan penjuluran yang saling bersentuhan dengan sel dan serabut yang berdekatan (Samuelson 2007). Inti sel fibrosit bersifat heterochromatic dan hanya dikelilingi oleh sedikit sitoplasma berwarna pucat. Pengamatan sel fibrosit dengan menggunakan mikroskop elektron memperlihatkan jumlah retikulum endoplasma kasar (rER) yang sedikit dengan kompleks golgi yang kecil (Eurell dan Sickle 1998).
Sel fibroblas memiliki bentuk yang lebih besar dibandingkan sel fibrosit dengan inti yang bersifat euchromatic (Eurell dan Sickle 1998). Sitoplasmanya berbentuk irregular dengan beberapa penjuluran (Junquieira dan Carneiro 2005). Pada pengamatan dengan mikroskop elektron akan terlihat rER dalam jumlah banyak serta kompleks golgi yang besar pada sitoplasma. Struktur ini mengindikasikan produksi matriks jaringan ikat yang lebih banyak dibandingkan sel fibrosit. Sel fibroblas dapat berkembang langsung dari sel mesenkim yang belum berdiferensiasi atau dapat juga berasal dari sel fibrosit tergantung pada pengaruh faktor lingkungan (Eurell dan Sickle 1998).
Gambar 1. Sel fibroblas dan fibrosit secara skematis Sumber : Junquieira dan Corneiro 2005
Sel fibroblas mampu mensintesis protein seperti kolagen dan elastin yang akan membentuk serabut kolagen, retikuler, dan elastik serta glycosaminoglycans,
proteoglycans, dan glycoprotein dari matriks ekstraseluler (Junquieira dan
Carneiro 2005).
Kultur Sel Fibroblas
Kultur jaringan merupakan bagian dari biologi yang berkaitan dengan pembiakan jaringan secara buatan dalam lingkungan yang terkontrol. Tujuan dari usaha tersebut adalah untuk mempelajari berbagai sifat jaringan tubuh dalam kondisi yang lebih sederhana dan terkontrol di luar tubuh (Malole 1990).
Terdapat tiga tipe kultur jaringan berdasarkan komposisi sel yang ditumbuhkan yaitu kultur organ, kultur eksplant primer, dan kultur sel (Freshney 2005). Kultur organ adalah kultur dari sebagian organ atau seluruh organ embrio secara in vitro dengan sifat-sifat kultur jaringan dan fungsi organ tersebut masih dapat dipertahankan seperti keadaan in vivo. Kultur eksplant primer pada dasarnya sama dengan kultur organ, perbedaannya hanya pada bagian organ yang dikultur lebih kecil dari kultur organ yaitu antara 1 – 2 mm3. Teknik ini biasanya digunakan apabila bagian organ yang tersedia hanya sedikit, misalnya biopsi tumor dan jaringan. Kultur sel adalah kultur sel-sel yang berasal dari organ atau jaringan yang telah diuraikan secara mekanis atau enzimatis menjadi suspensi sel. Suspensi sel tersebut kemudian dibiakkan menjadi satu lapisan jaringan
(monolayer) di atas permukaan yang keras (botol, tabung, atau cawan) atau
menjadi suspensi sel dalam media penumbuh (Malole 1990).
Teknik kultur jaringan tentu saja memiliki kelebihan dan keterbatasan. Beberapa kelebihan teknik kultur jaringan antara lain adalah lingkungan tempat sel atau jaringan ditumbuhkan dapat dikontrol melalui pengaturan pH, temperatur, osmolaritas, dan konsentrasi gas (O2 dan CO2). Selain itu, kultur jaringan yang
telah mapan melalui beberapa pasase akan terdiri dari sel-sel homogen, dengan demikian variasi yang timbul akibat pengulangan perlakuan dalam penelitian dapat ditekan semaksimal mungkin. Penelitian dengan kultur jaringan juga lebih ekonomis dibandingkan dengan percobaan menggunakan hewan percobaan biasa, karena hanya memerlukan sedikit reagen yang akan diuji, sedangkan jika
menggunakan hewan percobaan sebagian besar reagen tersebut akan hilang melalui ekskresi tubuh hewan (Freshney 2005).
Keterbatasan teknik kultur jaringan antara lain dalam pembuatan kultur jaringan memerlukan keahlian dan keterampilan khusus yang menjamin bahwa seluruh mata rantai prosedur pembuatannya terkontrol secara aseptis (Freshney 2005). Menurut Yadav dan Tyagi (2005) media yang digunakan untuk menumbuhkan kultur jaringan sangat cocok untuk pertumbuhan mikroorganisme seperti bakteri, kapang, dan ragi yang tingkat pertumbuhannya lebih cepat dari sel kultur jaringan itu sendiri sehingga sangat rentan terhadap kontaminasi. Selain itu, biaya yang dibutuhkan untuk melakukan kultur jaringan relatif lebih mahal dibandingkan mengambil sel dari jaringan hewan hidup karena mahalnya media untuk pertumbuhan dan peralatan yang digunakan (Freshney 2005).
Kultur sel fibroblas merupakan kultur sel yang banyak dilakukan di laboratorium. Sel ini berbentuk bulat setelah mengalami proses disosiasi dengan tripsin, tetapi akan segera berubah memanjang membentuk spindel setelah melekat pada permukaan yang keras. Sel fibroblas memiliki kemampuan tumbuh yang sangat baik dengan doubling time berkisar antara 18–24 jam, sehingga menjadi sel favorit untuk kultur sel. Selain itu, sel fibroblas dari embrio ayam telah terbukti dapat dipasase hingga 30 kali (Butler 2004).
Sumber-Sumber Sel Fibroblas
Sumber sel untuk kultur dapat berasal langsung dari jaringan hewan atau berasal dari koleksi kultur (cell banks). Pemilihan sumber sel ini didasarkan pada tujuan dan metode penelitian. Penumbuhan sel yang berasal isolasi langsung dari jaringan memiliki resiko yang lebih besar dibandingkan dengan sel yang berasal dari koleksi kultur. Selain itu, sel lestari (cell line) yang berasal dari koleksi kultur memiliki karakteristik yang baik dalam hal pertumbuhan, asal, dan genetik (Butler 2004). Contoh cell line fibroblas antara lain NIH 3T3 (gambar 2), BHK-21, L, MRC-5, WI-38, dan Vero (McSharry 2001, Butler 2004).
Kultur sel fibroblas umumnya menggunakan sel yang berasal dari isolasi langsung dari jaringan. Sel fibroblas berasal dari sel mesenkim yang berkembang dari lapis mesodermal embrio (Eurell dan Sickle 1998). Sel fibroblas biasa ditemukan di jaringan ikat longgar terutama yang dekat dengan serabut kolagen. Selain itu, juga banyak ditemukan pada jaringan yang sedang dalam tahap persembuhan (repairing) dan pada jaringan yang sedang dalam tahap pertumbuhan (Aughey dan Fyre 2001). Lokasi fibroblas antara lain langsung di bawah sel-sel epitel usus, di sekitar epitel kelenjar, dan di bawah epidermis (Butler 2004). Rat embryonic fibroblast (REF) berasal dari kultur otot embrio tikus dengan umur kebuntingan 15 hari (Yamada et al. 1982). Mouse embryonic
fibroblast (MEF) berasal dari kultur otot embrio mencit pada umur kebuntingan
12,5 hari (Xiong et al. 2007).
Sistem Kultur Sel Fibroblas
Kultur sel secara in vitro merupakan model fungsi fisiologis keadaan in
vivo sehingga semua komponen kultur harus diperhatikan dengan baik. Terkadang
sel tidak bisa mengekspresikan fenotip yang sama dengan keadaan in vivo karena Gambar 2. Kultur NIH 3T3 salah satu contoh cell line fibroblas dari embrio mencit
perubahan-perubahan kecil dalam lingkungan pertumbuhannya. Pengaruh lingkungan terhadap kultur sel antara lain terlihat pada jenis substrat atau tempat sel tumbuh, bisa permukaan yang keras seperti plastik atau matriks kaku, bahan semisolid seperti gel (kolagen atau agar), dan bahan cair; derajat kontak sel dengan sel lainnya; kondisi psikokimia dan fisiologis dari medium; kadar gas; dan temperatur inkubator (Freshney 2005).
Substrat merupakan tempat melekat sel agar dapat tumbuh, terutama sel yang hanya dapat tumbuh jika melekat pada suatu substrat (anchorage-dependent
cell). Jenis substrat yang digunakan tergantung pada tipe sel dan tujuan studi yang
dilakukan. Substrat yang umum digunakan saat ini adalah plastik polystyrene yang telah mengalami perlakuan khusus sehingga menjadi lembab dan bermuatan negatif. Pada sel tertentu, seperti sel saraf, sel otot, dan beberapa jenis epitel; plastik tersebut sebelumnya perlu dilapisi dengan gelatin, kolagen, atau polylysine untuk memberikan muatan positif (Malole 1990).
Faktor lain yang sangat menentukan keberhasilan kultur adalah kondisi psikokimia dan fisiologis dari medium penumbuh sel. Pemilihan medium kultur harus didasarkan pada kebutuhan sel yang ditumbuhkan dan disesuaikan dengan tujuan studi yang menggunakan sel tersebut. Medium penumbuh sel harus menyediakan semua kondisi lingkungan yang sama dengan keadaan alami sel dalam lingkungan in vivo, agar sel tersebut dapat bertahan hidup, berkembang, dan berdiferensiasi (Malole 1990). Medium penumbuh sel harus bisa menyediakan semua kebutuhan nutrisi esensial bagi sel, dalam hal ini termasuk kebutuhan raw materials yang dibutuhkan untuk sintesis sel baru, substrat untuk metabolisme energi, vitamin dan trace mineral (Ham dan McKeehan 1979).
Medium yang umum digunakan dalam kultur sel mamalia adalah
Dulbecco’s modified Eagle’s medium (DMEM). Medium ini merupakan medium
kultur berupa buffer bikarbonat yang didesain untuk pH 7,2–7,4 pada keadaan 5% CO2 dan 95% udara (Hogan et al. 1994). Nutrisi yang terkandung di dalam
DMEM adalah garam-garam anorganik (kalsium klorida, ferri nitrat, kalium klorida, magnesium sulfat, natrium bikarbonat, natrium klorida, dan natrium phosphat), D’glukosa, phenol red, dan asam amino (Arginin Hidroklor, L-Cystein.2HCl, L-Glutamin, Glycine, L-Histidin.HCl.H2O, L-Isoleusin, L-Lysine
Hidroksiklorida, L-Methionin, L-Phenilalanin, L-Serin, L-Treonin, L-Triptofan, L-Tyrosin.2Na.2H2O dan L-Valine), vitamin (D-Kalsium Pentothenate, Koline
klorida, asam folat, L-Inositol, Niacinamide, Pyridoxin HCl, Riboflavin dan Thiamine Hidroklorin) (Mather dan Roberts 1998).
Menurut Yadav dan Tyagi (2005) untuk memenuhi kebutuhan nutrisi sel selama pertumbuhan dapat ditambahkan serum atau ekstrak embrio ke dalam medium. Penambahan serum atau ekstrak embrio ini memang sangat beresiko terhadap kontaminasi, oleh karena itu perlu juga dilakukan penambahan antibiotik seperti penisilin atau streptomisin ke dalam medium untuk mencegah terjadinya kontaminasi.
Temperatur optimal untuk kultur sel tergantung pada suhu tubuh hewan dari mana sel diisolasi, perbedaan letak anatomis (misalnya temperatur kulit dan testis akan lebih rendah dibandingkan temperatur tubuh), dan pengaturan faktor keamanan untuk menghindari kesalahan (error) pada inkubator seperti kejadian
overheating (Freshney 2005). Temperatur berpengaruh langsung terhadap
pertumbuhan sel. Selain itu, juga mempengaruhi pH melalui peningkatan kelarutan CO2pada temperatur rendah (Malole 1990).
Selain temperatur, pH merupakan komponen yang juga memegang peranan penting dalam kegiatan kultur. Sebagian besar cell line tumbuh dengan baik pada pH 7,4 (Malole 1990). Walau demikian, pH optimum untuk pertumbuhan sel relatif sedikit bervariasi berdasarkan jenis sel masing-masing (Freshney 2005). Cell line fibroblas menunjukkan pertumbuhan yang sangat baik pada pH antara 7,4–7,7, sedangkan sel yang sama tapi telah mengalami transformasi tumbuh lebih baik pada pH antara 7,0–7,4 (Malole 1990, Freshney 2005).
Perubahan tekanan osmotik umumnya dapat ditoleransi dengan baik oleh sebagian besar sel (Waymouth 1970 dalam Freshney 2005). Dalam praktek, tekanan osmotik yang dapat diterima oleh sel berkisar antara 260 mosmol/kg hingga 320 mosmol/kg (Freshney 2005). Khusus untuk mencit tekanan osmotik yang dibutuhkan kurang lebih 310 mosmol/kg. Tekanan osmotik biasanya diukur berdasarkan depresi titik beku atau peningkatan tekanan uap dengan menggunakan alat osmometer. Pengukuran osmolaritas merupakan bagian penting
untuk mengontrol kualitas terutama untuk medium yang dibuat sendiri (Malole 1990, Freshney 2005).
Sistem buffer yang biasa terdapat dalam medium adalah sistem karbondioksida – bikarbonat yang sama seperti kondisi darah. Saat sel tumbuh, sel menghasilkan CO2, tetapi CO2 tersebut tidak dapat keluar karena sudah banyak
CO2 di atas medium. Akibatnya, terjadi penguraian NaHCO3 dari medium yang
menghasilkan kelebihan ion H+ sehingga pH akan turun. Oleh karena itu, volume ruangan di atas medium perlu diperhatikan karena pada waktu kultur dimulai diperlukan 5% CO2untuk mempertahankan pH dan mencegah keluarnya CO2dari
medium (Malole 1990). Keterkaitan antara CO2, ion HCO3-, dan pH satu sama
lain, menimbulkan kesulitan dalam menentukan pengaruh langsung dari CO2
(Freshney 2005).
Peningkatan produksi sel pada kultur sangat tergantung pada kecukupan penyediaan oksigen. Oksigen yang terlarut dalam media hanya sedikit yaitu 7,6 mikrogram/ml sedangkan tingkat penggunaannya oleh sel kurang lebih 6 mikrogram/10 juta sel setiap jam. Pemberian oksigen pada kultur dapat dilakukan dengan beberapa cara antara lain pemberian udara pada permukaan medium, difusi membrane, perfusi medium, dan pemompaan oksigen langsung ke dalam media (Malole 1990).
Pemanfaatan Kultur Sel Fibroblas
Kultur sel fibroblas terutama cell line fibroblas banyak digunakan dalam pengembangan teknik kultur sel. Sel fibroblas embrio mencit (NIH 3T3) merupakan salah satu contohnya. Baby Hamster Kidney Fibroblast (BHK-21) banyak digunakan dalam produksi vaksin, L yaitu cell line fibroblas dari tumor jaringan ikat mencit banyak digunakan dalam pengembangan teknik kultur sel selama tahun 1950-an, MRC-5 dan WI-38 yaitu sel fibroblas dari paru-paru embrio manusia banyak dimanfaatkan dalam produksi vaksin untuk manusia, dan Vero yang berasal dari ginjal Kera Hijau Afrika (African green monkey), juga digunakan dalam produksi vaksin untuk manusia. (Malole 1990, McSharry 2001, Butler 2004). Selain itu, Mouse embryonic fibroblast (MEFs) sering digunakan sebagai feeder cells pada penelitian stem sel embrionik manusia (Rylova 2008).
Protein yang Dihasilkan oleh Sel Fibroblas
Menurut Prowse et al. (2007) conditioned medium fibroblas baik dari fetus manusia (Human Fetal Fibroblast/HFF), manusia yang baru lahir (Human
Neonatal Fibroblast/HNF), maupun dari fetus mencit (Mouse Embryonic Fibroblast/MEF) mengandung protein yang berperan dalam pluripotensi, diferensiasi dan pertumbuhan (growth factor) sel. Beberapa protein yang dihasilkan oleh MEF antara lain Follistatin-Related Protein 1, Insulin-like Growth
Factor 1, dan Pigment Epithelium-Derived Factor.
Metode Analisis Protein
Analisis protein dapat dilakukan dengan beberapa metode antara lain metode liquid phase isoelectric focusing, metode imunopresipitasi, metode
two-dimensional gel electrophoresis, dan reversed phase liquid chromatography
(Hansson 2008).
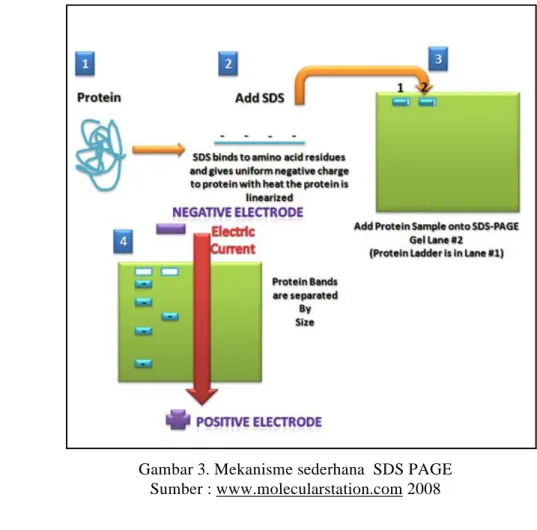
Dalam penelitian ini, metode analisis protein yang digunakan adalah metode SDS PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis). SDS PAGE merupakan metode untuk menganalisis kemurnian protein dan untuk mengestimasi berat molekul protein. Lebih jauh lagi SDS PAGE dapat digunakan untuk memonitoring purifikasi protein, menverifikasi konsentrasi protein, mendeteksi proteolisis, mendeteksi modifikasi protein, dan mengidentifikasi adanya protein yang mengalami immunopresipitasi (Ahmed 2005).
Komponen SDS PAGE adalah sodium dodecyl sulfate (SDS) dan gel poliakrilamid. Sodium dodecyl sulfate merupakan sejenis detergent (sabun) yang dapat mengganggu konformasi spesifik protein dengan cara melarutkan molekul hidrophobik yang ada di dalam struktur tersier polipeptida (Campbell 1996). SDS mengubah semua molekul protein kembali ke struktur primernya (struktur linear) dengan cara meregangkan gugus utama polipeptida (Purves dan Rybicki 1998). Selain itu, SDS juga menyelubungi setiap molekul protein dengan muatan negatif. Hal inilah yang menyebabkan protein bergerak kearah muatan positif di sisi lain gel.
Poliakrilamid merupakan polimer dari monomer akrilamid (Campbell 1998). Saat poliakrilamid berbentuk gel, maka akan terbentuk pori-pori kecil yang membentuk labirin atau terowongan dan saluran yang memungkinkan molekul bergerak (migrasi). Poliakrilamid merupakan medium yang tepat untuk memisahkan protein berdasarkan ukuran karena ukuran pori-pori kecil yang memungkinkan untuk memperlambat gerakan molekul (Purves dan Rybicki 1998).
Protein dengan berat molekul rendah akan bergerak lebih cepat melintasi gel dibandingkan dengan protein dengan berat molekul besar. SDS PAGE memisahkan protein berdasarkan berat molekul, sehingga berat molekul protein bisa diestimasi dengan cara me-running protein standar (marker) yang berat molekulnya telah diketahui (Ahmed 2005).
Gambar 3. Mekanisme sederhana SDS PAGE Sumber : www.molecularstation.com 2008
Visualisasi protein dapat dilakukan dengan beberapa metode pewarnaan. Menurut McGuigan dan Sharman (2006) metode pewarnaan yang umum digunakan untuk SDS PAGE adalah coomasie blue. Metode pewarnaan lainnya antara lain silver nitrat, copper, dan zink. Pemilihan metode pewarnaan tergantung pada jenis protein, konsentrasi, dan tujuan yang diharapkan.
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Januari sampai dengan Juni 2010 bertempat di Laboratorium Embriologi, Bagian Anatomi Histologi dan Embriologi, Departemen Anatomi Fisiologi dan Farmakologi, serta Laboratorium Pendidikan dan Layanan Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain peralatan bedah, timbangan digital, biosafety cabinet, inkubator, mikroskop, mikropipet, cawan petri, object glass, cover glass, mikrofilter, spuid, tabung eppendorf, tabung conical, gelas ukur, erlenmeyer, gelas piala, hemositometer, magnetic stirrer, dan perangkat SDS-PAGE.
Bahan yang digunakan antara lain otot fetus tikus dengan umur kebuntingan 14 hari, medium kultur Dulbecco’s modified Eagle’s medium (mDMEM), yang dimodifikasi dengan penambahan asam amino non-esensial (AANE) 10%, fetal calf serum (FCS) 10%, natrium bikarbonat (NaHCO3) 3 mM,
gentamisin 50 µg/ml, Phosphate Buffered Saline (mPBS) yang diberi tambahan
fetal calf serum (FCS) 10% dan gentamisin 50 µg/ml, mili-Q, tripsin 0,1%,
pewarna hematoksilin eosin, dan pewarna silver nitrat.
Prosedur Kerja Isolasi Sel Fibroblas
Sel fibroblas diisolasi dari fetus tikus dengan umur kebuntingan 14 hari. Bagian kepala, ekor, tungkai, dan organ dalam dari fetus dikeluarkan kemudian bagian otot dicuci dengan larutan PBS hingga bersih. Bagian otot selanjutnya dicacah hingga halus. Cacahan dimasukkan ke dalam larutan PBS yang mengandung tripsin 0,1%, kemudian diinkubasi selama 30 menit sambil diaduk menggunakan magnetic stirrer. Supernatan dimasukkan ke dalam tabung lalu dilakukan sentrifugasi selama 10 menit dengan kecepatan 210 g. Pencucian dilakukan sebanyak 3 kali ulangan menggunakan larutan mPBS dan 2 kali
ulangan menggunakan medium mDMEM. Setelah pencucian terakhir, pelet diresuspensi dalam medium mDMEM. Kemudian sel dihitung menggunakan hemositometer untuk mendapatkan konsentrasi sel yang akan dikultur.
Kultur In vitro Sel Fibroblas
Suspensi yang diperoleh sesuai dengan hasil perhitungan konsentrasi sel kemudian dikultur dalam 3 cawan petri yang masing-masing untuk pasase, koleksi
conditioned medium (CM), dan identifikasi sel. Suspensi sel dikultur selama 6
hari atau mencapai 90% konfluen di dalam inkubator 5% CO2 pada suhu 37oC.
Untuk identifikasi, sel dikultur di dalam cawan petri yang telah dialasi dengan
cover glass. Penggantian medium dilakukan setiap 2 hari sekali untuk
menyediakan kembali nutrisi yang berkurang dan membuang sisa metabolisme sel. Setelah 6 hari atau setelah kultur tersebut mencapai 90% konfluen, dilakukan pasase, koleksi CM, dan pewarnaan sel fibroblas.
Pembuatan Conditioned Medium (CM)
Kultur yang telah mencapai 90% konfluen dibuang mediumnya kemudian dicuci dengan larutan PBS. Selanjutnya, larutan PBS dibuang dan ganti dengan medium DMEM. Sel kemudian dikultur kembali selama 2 hari. Setelah 2 hari, medium dikoleksi sebagai CM yang akan dianalisa terhadap keberadaan protein menggunakan SDS PAGE.
Pasase Sel Fibroblas
Kultur yang telah mencapai 90% konfluen dibuang mediumnya kemudian dicuci dengan larutan PBS. Selanjutnya, larutan PBS dibuang lalu diganti dengan larutan PBS yang mengandung tripsin 0,1%, didiamkan selama kurang lebih 5 menit sampai larutan tersebut terlihat keruh (proses disosiasi). Untuk mempercepat proses disosiasi sel dapat dibantu dengan melakukan pemipetan berulang. Larutan kemudian dimasukkan ke dalam tabung, lalu ditambahkan larutan mPBS hingga volume mencapai minimal 3 ml. Larutan lalu disentrifugasi selama 10 menit dengan kecepatan 210 g. Pencucian dilakukan 3 kali dengan larutan mPBS, dan 1 kali dengan medium mDMEM. Supernatan dibuang, lalu
pelet yang mengendap diresuspensi dalam medium mDMEM, kemudian dikultur kembali dalam 3 cawan petri seperti prosedur pada kultur sel fibroblas.
Evaluasi Hasil Kultur Sel Fibroblas Morfologi Sel Fibroblas
Morfologi sel fibroblas diamati secara natif dan dengan pewarnaan hematoksilin eosin (HE). Kultur sel yang ditumbuhkan di atas cover glass dibilas dengan larutan PBS lalu difiksasi dengan buffer paraformaldehid 4% selama 24 jam. Setelah 24 jam, dilakukan penyimpanan di dalam alkohol 50% selama 2 jam dan dilanjutkan dengan alkohol 70% sampai kultur sel akan diwarnai dengan HE. Evaluasi morfologi sel dilakukan dengan mikroskop cahaya pada perbesaran 400x.
Pertumbuhan Sel Fibroblas
Untuk mengetahui terjadinya proliferasi sel, sebelum dan setelah kultur baik pada kultur primer maupun setiap galur sel (setelah pasase) dilakukan penghitungan jumlah sel menggunakan hemositometer Improved Neubauer, dengan perhitungan sebagai berikut:
Total sel = Jumlah sel pada 5 kotak x faktor pengenceran x 104 (sel/ml) Sedangkan Population Doubling Time (PDT) dihitung menggunakan rumus:
PDT (hari) = (log jumlah sel akhir log jumlah sel awal) x 3,321 waktu
Identifikasi Protein
Conditioned medium yang telah dikoleksi dari kultur primer, pasase 1,
pasase 5, dan pasase 9 kemudian dianalisa kandungan proteinnya menggunakan SDS PAGE. Proses SDS PAGE diawali dengan pembuatan gel Poliakrilamid. Kemudian, sampel CM sel fibroblas dimasukkan ke dalam sumur gel masing-masing sebanyak 15 µl setelah dicampurkan dengan loading buffer dengan perbandingan 1 : 2. Disamping itu, dimasukkan pula larutan ukuran baku protein
sebagai marker (kontrol positif). Dalam penelitian ini marker yang digunakan adalah Mark 12TM Unstained Standard (Invitrogen cat LC5677). Alat elektroforesis dijalankan dengan kuat arus listrik 25 A, tegangan 120 V selama 3 jam. Setelah proses elektroforesis selesai, dilakukan proses visualisasi protein dengan metode silver nitrat.
HASIL DAN PEMBAHASAN
Morfologi Sel Fibroblas dalam Kultur In Vitro
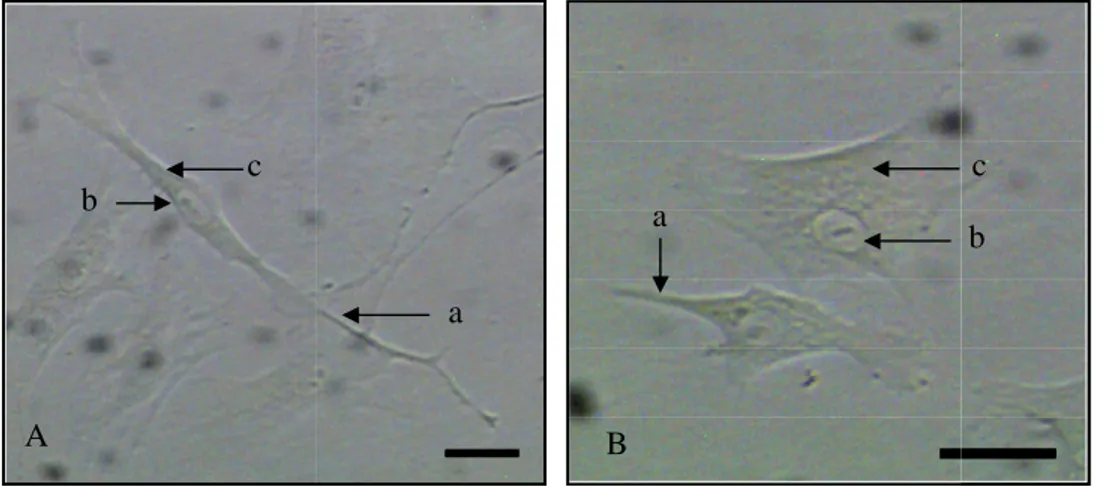
Hasil pengamatan kultur sel otot fetus tikus menunjukkan secara morfologi adanya dua bentuk sel, yakni sel fibrosit, berbentuk spindel pipih dan sel fibroblas, berbentuk spindel agak membulat dengan beberapa penjuluran sitoplasma (Gambar 4).
Sel fibroblas dan fibrosit memiliki inti sel yang berbentuk lonjong dan memiliki satu atau dua nukleoli yang kadang-kadang terlihat. Hal ini sejalan dengan Samuelson (2007) yang menyatakan bahwa sel fibrosit umumnya berbentuk spindel dengan penjuluran sitoplasma yang saling bersentuhan. Sedangkan, sel fibroblas memiliki bentuk yang lebih besar dibandingkan sel fibrosit (Eurell dan Sickle 1998) dengan beberapa penjuluran sitoplasma yang berbentuk irregular (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) inti sel fibrosit hanya dikelilingi oleh sedikit sitoplasma yang berwarna pucat. Sel fibrosit merupakan bentuk tidak aktif dari sel fibroblas (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) sel fibrosit merupakan sel yang paling umum ditemui pada jaringan ikat. Sel fibrosit memiliki kemampuan untuk membelah diri dan kembali aktif menjadi fibroblas saat dibutuhkan untuk memperbaiki jaringan yang rusak.
Gambar 4. Kultur in vitro sel fibroblas : A. Sel fibrosit; B. Sel fibroblas; (a) Penjuluran sitoplasma, (b) Inti sel, (c) Sitoplasma; A-B Preparat natif; Bar: 20 µm.
A a b c B a b c
HASIL DAN PEMBAHASAN
Morfologi Sel Fibroblas dalam Kultur In Vitro
Hasil pengamatan kultur sel otot fetus tikus menunjukkan secara morfologi adanya dua bentuk sel, yakni sel fibrosit, berbentuk spindel pipih dan sel fibroblas, berbentuk spindel agak membulat dengan beberapa penjuluran sitoplasma (Gambar 4).
Sel fibroblas dan fibrosit memiliki inti sel yang berbentuk lonjong dan memiliki satu atau dua nukleoli yang kadang-kadang terlihat. Hal ini sejalan dengan Samuelson (2007) yang menyatakan bahwa sel fibrosit umumnya berbentuk spindel dengan penjuluran sitoplasma yang saling bersentuhan. Sedangkan, sel fibroblas memiliki bentuk yang lebih besar dibandingkan sel fibrosit (Eurell dan Sickle 1998) dengan beberapa penjuluran sitoplasma yang berbentuk irregular (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) inti sel fibrosit hanya dikelilingi oleh sedikit sitoplasma yang berwarna pucat. Sel fibrosit merupakan bentuk tidak aktif dari sel fibroblas (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) sel fibrosit merupakan sel yang paling umum ditemui pada jaringan ikat. Sel fibrosit memiliki kemampuan untuk membelah diri dan kembali aktif menjadi fibroblas saat dibutuhkan untuk memperbaiki jaringan yang rusak.
Gambar 4. Kultur in vitro sel fibroblas : A. Sel fibrosit; B. Sel fibroblas; (a) Penjuluran sitoplasma, (b) Inti sel, (c) Sitoplasma; A-B Preparat natif; Bar: 20 µm.
A a b c B a b c
HASIL DAN PEMBAHASAN
Morfologi Sel Fibroblas dalam Kultur In Vitro
Hasil pengamatan kultur sel otot fetus tikus menunjukkan secara morfologi adanya dua bentuk sel, yakni sel fibrosit, berbentuk spindel pipih dan sel fibroblas, berbentuk spindel agak membulat dengan beberapa penjuluran sitoplasma (Gambar 4).
Sel fibroblas dan fibrosit memiliki inti sel yang berbentuk lonjong dan memiliki satu atau dua nukleoli yang kadang-kadang terlihat. Hal ini sejalan dengan Samuelson (2007) yang menyatakan bahwa sel fibrosit umumnya berbentuk spindel dengan penjuluran sitoplasma yang saling bersentuhan. Sedangkan, sel fibroblas memiliki bentuk yang lebih besar dibandingkan sel fibrosit (Eurell dan Sickle 1998) dengan beberapa penjuluran sitoplasma yang berbentuk irregular (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) inti sel fibrosit hanya dikelilingi oleh sedikit sitoplasma yang berwarna pucat. Sel fibrosit merupakan bentuk tidak aktif dari sel fibroblas (Junquieira dan Carneiro 2005). Menurut Eurell dan Sickle (1998) sel fibrosit merupakan sel yang paling umum ditemui pada jaringan ikat. Sel fibrosit memiliki kemampuan untuk membelah diri dan kembali aktif menjadi fibroblas saat dibutuhkan untuk memperbaiki jaringan yang rusak.
Gambar 4. Kultur in vitro sel fibroblas : A. Sel fibrosit; B. Sel fibroblas; (a) Penjuluran sitoplasma, (b) Inti sel, (c) Sitoplasma; A-B Preparat natif; Bar: 20 µm.
A a b c B a b c
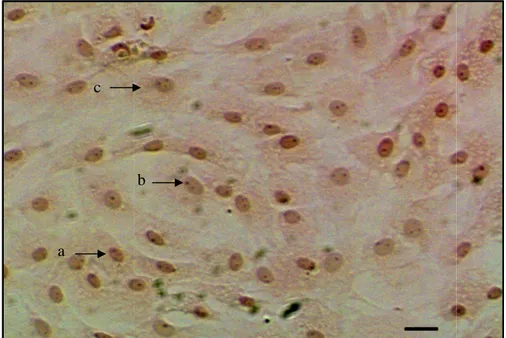
Selain dengan pengamatan secara natif, sel fibroblas juga diamati morfologinya dengan pewarnaan HE (Gambar 5).
Menurut Aughey dan Fyre (2001) sel-sel fibroblas tidak dapat terwarnai dengan baik menggunakan metode HE karena adanya kandungan bahan dasar jaringan ikat yang berlimpah dan bersifat seperti gelatin. Pernyataan Aughey dan Fyre (2001) ini mendukung hasil pewarnaan HE dalam penelitian ini. Berdasarkan hasil pengamatan terlihat bahwa dengan pewarnaan HE sel-sel fibroblas hanya terlihat jelas di bagian inti selnya saja, sedangkan sitoplasmanya kurang jelas. Oleh karena sitoplasma sel tidak terlihat dengan jelas, sulit dilakukan pembedaan antara sel fibroblas dengan sel fibrosit. Hal ini juga sejalan dengan Eurell dan Sickle (1998) yang menyatakan bahwa dengan pewarnaan HE, hanya inti sel fibroblas saja yang dapat terlihat jelas, sedangkan bagian membran plasmanya tidak jelas. Oleh karena itu diperlukan metode pewarnaan lain yang diharapkan dapat mewarnai sel fibroblas dengan lebih baik misalnya pewarnaan Van Gieson,
b c
a
Gambar 5. Sel-sel fibroblas dengan pewarnaan Hematoksilin Eosin. Inti sel fibroblas terlihat dengan jelas (a) dengan satu atau dua nukleoli (b), sedangkan bagian sitoplasma tidak terlalu jelas (c). Bar: 20 µm.
Selain dengan pengamatan secara natif, sel fibroblas juga diamati morfologinya dengan pewarnaan HE (Gambar 5).
Menurut Aughey dan Fyre (2001) sel-sel fibroblas tidak dapat terwarnai dengan baik menggunakan metode HE karena adanya kandungan bahan dasar jaringan ikat yang berlimpah dan bersifat seperti gelatin. Pernyataan Aughey dan Fyre (2001) ini mendukung hasil pewarnaan HE dalam penelitian ini. Berdasarkan hasil pengamatan terlihat bahwa dengan pewarnaan HE sel-sel fibroblas hanya terlihat jelas di bagian inti selnya saja, sedangkan sitoplasmanya kurang jelas. Oleh karena sitoplasma sel tidak terlihat dengan jelas, sulit dilakukan pembedaan antara sel fibroblas dengan sel fibrosit. Hal ini juga sejalan dengan Eurell dan Sickle (1998) yang menyatakan bahwa dengan pewarnaan HE, hanya inti sel fibroblas saja yang dapat terlihat jelas, sedangkan bagian membran plasmanya tidak jelas. Oleh karena itu diperlukan metode pewarnaan lain yang diharapkan dapat mewarnai sel fibroblas dengan lebih baik misalnya pewarnaan Van Gieson,
b c
a
Gambar 5. Sel-sel fibroblas dengan pewarnaan Hematoksilin Eosin. Inti sel fibroblas terlihat dengan jelas (a) dengan satu atau dua nukleoli (b), sedangkan bagian sitoplasma tidak terlalu jelas (c). Bar: 20 µm.
Selain dengan pengamatan secara natif, sel fibroblas juga diamati morfologinya dengan pewarnaan HE (Gambar 5).
Menurut Aughey dan Fyre (2001) sel-sel fibroblas tidak dapat terwarnai dengan baik menggunakan metode HE karena adanya kandungan bahan dasar jaringan ikat yang berlimpah dan bersifat seperti gelatin. Pernyataan Aughey dan Fyre (2001) ini mendukung hasil pewarnaan HE dalam penelitian ini. Berdasarkan hasil pengamatan terlihat bahwa dengan pewarnaan HE sel-sel fibroblas hanya terlihat jelas di bagian inti selnya saja, sedangkan sitoplasmanya kurang jelas. Oleh karena sitoplasma sel tidak terlihat dengan jelas, sulit dilakukan pembedaan antara sel fibroblas dengan sel fibrosit. Hal ini juga sejalan dengan Eurell dan Sickle (1998) yang menyatakan bahwa dengan pewarnaan HE, hanya inti sel fibroblas saja yang dapat terlihat jelas, sedangkan bagian membran plasmanya tidak jelas. Oleh karena itu diperlukan metode pewarnaan lain yang diharapkan dapat mewarnai sel fibroblas dengan lebih baik misalnya pewarnaan Van Gieson,
b c
a
Gambar 5. Sel-sel fibroblas dengan pewarnaan Hematoksilin Eosin. Inti sel fibroblas terlihat dengan jelas (a) dengan satu atau dua nukleoli (b), sedangkan bagian sitoplasma tidak terlalu jelas (c). Bar: 20 µm.
Masson's trichrome, atau Periodic acid Schiff (PAS) yang merupakan jenis
pewarnaan jaringan ikat.
Pertumbuhan Sel Fibroblas dalam Kultur In Vitro
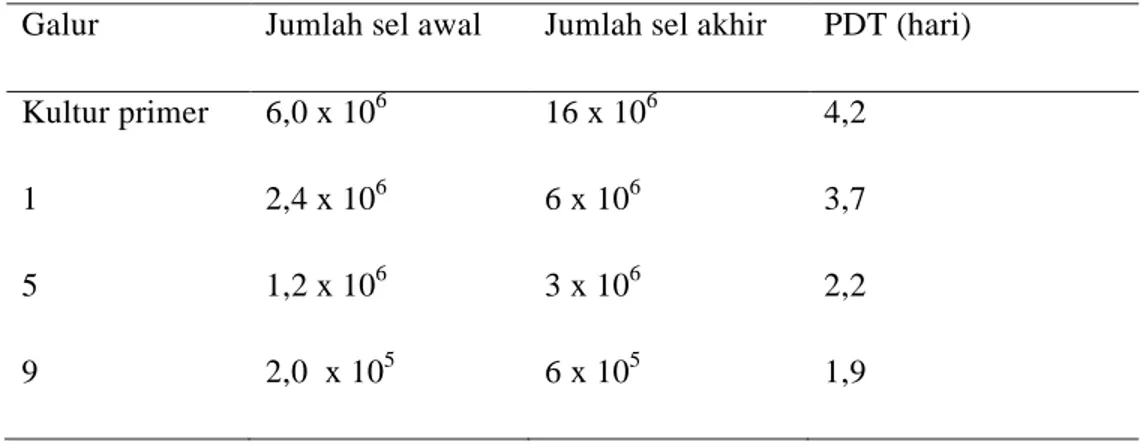
Hasil penghitungan jumlah sel fibroblas memperlihatkan terjadinya peningkatan jumlah sel baik pada kultur primer maupun pada kultur galur sel setelah mengalami pasase. Sedangkan dilihat dari PDT, tampak bahwa dengan meningkatnya jumlah pasase, waktu PDT menjadi semakin kecil (Tabel 1).
Tabel 1. Jumlah dan PDT sel fibroblas pada kultur in vitro Galur Jumlah sel awal Jumlah sel akhir PDT (hari)
Kultur primer 6,0 x 106 16 x 106 4,2
1 2,4 x 106 6 x 106 3,7
5 1,2 x 106 3 x 106 2,2
9 2,0 x 105 6 x 105 1,9
Doubling time adalah periode waktu yang diperlukan oleh sel untuk
menjadikan jumlah atau ukurannya dua kali dari jumlah maupun ukuran semula (Mader 2000). Semakin cepat proses proliferasi (pembelahan) sel, maka PDT yang dicapai pun akan semakin cepat.
Pada kultur primer tampak bahwa PDT adalah 4,2 yang menunjukkan bahwa waktu yang dibutuhkan untuk proses pembelahan sel adalah 4,2 hari, waktu ini jauh lebih tinggi dibandingkan waktu yang dibutuhkan untuk proses pembelahan sel secara in vivo yaitu berkisar 18–24 jam (Butler 2004). Hal ini disebabkan komposisi sel pada kultur primer masih tidak homogen. Selain itu, sel-sel pada kultur primer belum bisa beradaptasi dengan lingkungan in vitro, sehingga pertumbuhannya belum terlalu baik. Namun demikian, seiring dengan dilakukannya pasase yang mengarah kepada homogenisitas sel, maka waktu yang dibutuhkan oleh sel untuk membelah semakin cepat dan bahkan setelah sel mengalami pasase ke 9, PDT menunjukkan nilai yang semakin mendekati kisaran waktu normal yang dibutuhkan untuk pembelahan secara in vivo. Sel yang telah
mengalami beberapa kali pasase akan semakin homogen dan akan lebih mampu beradaptasi dengan kondisi lingkungan in vitro. Menurut Freshney (2005) setelah pasase ke tiga, sel yang dikultur akan menjadi lebih stabil dan mampu berproliferasi dengan lebih cepat. Peningkatan jumlah sel ini berkolerasi dengan hasil pengamatan morfologi sel. Semakin homogen sel di dalam kultur, maka tingkat proliferasinya juga akan semakin cepat.
Menurut Freshney (2005), proliferasi sel dipengaruhi oleh faktor dari lingkungan. Oleh karena itu, selain faktor homogenitas, salah satu faktor lain yang sangat berpengaruh terhadap tingkat proliferasi sel adalah kepadatan sel. Sel dermal fibroblas akan berkembang relatif seragam (uniform) pada kultur dengan kepadatan rendah (sekitar 104 sel/ml), dan sebaliknya pada kultur dengan kepadatan tinggi (sekitar 105 sel/ml), sel yang berkembang akan relatif tidak seragam, terjadi induksi terhadap sel untuk berdiferensiasi, dan terjadi penghambatan proliferasi sel (Freshney 2000). Sel fibroblas dalam penelitian dikultur dengan konsentrasi 105 yang menurut Freshney (2000) termasuk dalam kategori padat, oleh karenanya proliferasi sel juga tidak berjalan dengan baik.
Penghambatan proliferasi sel dapat diinisiasi oleh kontak antar sel dan ditonjolkan oleh kepadatan, perubahan resultan pada bentuk sel, dan penurunan penyebaran sel (Freshney 2005). Kepadatan menyebabkan terjadinya induksi dan diferensiasi karena kontak antar sel memungkinkan terbentuknya gap junction dan menyebabkan metabolit mengsinkronisasi ekspresi diferensiasi di dalam populasi sel. Hal ini umumnya terjadi saat populasi sel telah menutupi seluruh permukaan tempat sel ditumbuhkan atau dikenal dengan istilah konfluen (Butler 2004). Faktor lainnya yang dapat mempengaruhi proliferasi sel adalah nutrisi (Freshney 2000). Tetapi dalam penelitian ini, faktor nutrisi tidak mempengaruhi proliferasi sel, karena semua sel menggunakan medium dengan kandungan nutrisi yang sama.
Identifikasi protein
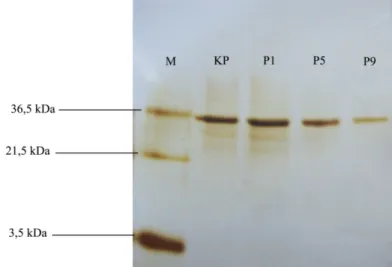
Conditioned medium yang mengandung sekreta protein yang diekskresikan oleh sel dalam kultur di analisis kandungannya menggunakan metode Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE) dilanjutkan dengan metode pewarnaan silver nitrat (Gambar 6).
Estimasi berat molekul protein yang terkandung di dalam CM kultur sel fibroblas dilakukan dengan menggunakan perbandingan berat molekul protein standar (marker) yang di-running secara bersamaan dengan CM kultur sel fibroblas. Hasil pewarnaan memperlihatkan pita (band) yang sejajar baik dari kultur primer, pasase 1, pasase 5, maupun pasase 9. Hal ini menunjukkan bahwa berat molekul protein dari keempat sampel CM yang dievaluasi adalah sama. Estimasi berat molekul protein berdasarkan marker yang digunakan adalah 36,5 kDa.
Ketebalan pita protein yang dihasilkan oleh tiap sampel berbeda. Pita protein yang paling tebal adalah pita protein dari CM kultur primer dan pasase 1 dengan ketebalan pita yang hampir sama. Selanjutnya adalah pasase 5 dan yang paling tipis adalah pita protein dari CM pasase 9. Ketebalan pita protein ini dipengaruhi oleh jumlah sel fibroblas yang ada di dalam kultur. Semakin sedikit jumlah sel fibroblas maka dapat diasumsikan bahwa konsentrasi protein yang disekresikan ke dalam CM juga semakin sedikit. Sesuai dengan data pengamatan pertumbuhan sel, jumlah total sel di akhir setiap pasase semakin menurun. Oleh karena itu, pita protein yang dihasilkan juga semakin lama semakin tipis.
Gambar 6. Hasil SDS PAGE conditioned medium kultur sel fibroblas dengan visualisasi protein menggunakan metode silver nitrat. Semua sampel memiliki BM kurang lebih 36,5 kDa. (M:
Marker; KP: Kultur primer; P1, P5, P9: Kultur galur sel 1, 5,
Penurunan jumlah sel akhir ini dikarenakan jumlah sel awal yang dikultur konsentrasinya tidak sama.
SIMPULAN DAN SARAN
Simpulan
Kesimpulan yang dapat diambil dari penelitian ini adalah berdasarkan pengamatan morfologi terdapat dua bentuk sel yakni sel fibroblas daan sel fibrosit, berdasarkan nilai population doubling time, kecepatan proliferasi meningkat pada setiap galur sel; dan pertumbuhan serta sekresi protein kultur in
vitro sel-sel fibroblas fetus tikus dapat dipertahankan hingga pasase 9.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui kemampuan pertumbuhan sel fibroblas sampai pasase selanjutnya. Selain itu, perlu juga dilakukan penelitian lebih lanjut terhadap identifikasi, purifikasi, dan penghitungan konsentrasi protein yang dihasilkan oleh sel fibroblas.
DAFTAR PUSTAKA
Ahmed H. 2005. Principles and Reactions of Protein Extraction, Purification, and
Characterization. CRC Press.
Anonimus. 2008. Protein Gel Electrophoresis Method.
www.molecularstation.com. [26 Februari 2010].
Aughey E, Fyre FL. 2001. Comparative Veterinary Histology with Clinical
Correlates. London: Manson Publishing.
Bloom H, Beier H, Gross HS. 1987. Improved Silver Staining of Plant Proteins, RNA and DNA in Polyacrilamide Gels. Electrophoresis 8: 93-99.
Butler M. 2004. Animal Cell Culture & Technology 2nd ed. London: Bios
Scientific Publisher, Taylor & Francis Group.
Campbell NA. 1996. Biology 4th ed. New York: The Benjamin/Cummings
Publishing Co. INC.
Campbell MA. 1998. SDS/PAGE (Polyacrylamide Gel Electrophoresis).
http://www.bio.davidson.edu/Biology/Courses/Molbio/SDSPAGE/SDSPA GE.html. [12 Maret 2010].
Compton T. 1993. An Immortalized Human Fibroblast Cell Line is Permissive for Human Cytomegalovirus Infection. Journal of Virology 67(6): 3644-3648.
Dixon MW. 2007. Myofascial Massage. USA: Lippincott Williams & Wilkins. Efendi A. 2009. Pengaruh Conditioned Medium Rat Embryonic Fibroblast
(CM-REF) Dengan dan Tanpa Leukimia Inhibitory Factor (LIF) dalam Medium terhadap Tingkat Proliferasi dan Sifat Pluripotensi Mesenchymal Stem Cell Sumsum Tulang Tikus dalam Kultur In Vitro [Skripsi]. Bogor: Fakultas Kedoteran Hewan Institut Pertanian Bogor.
Eurell JAC, Sickle DCV. 1998. Connective and Supportive Tissues. Di dalam Dellmann HD dan Eurell JAC, editor. Textbook of Veterinary Histology 5th
ed. USA: Lippincott Williams & Wilkins.
Freshney RI. 2000. Introduction to Basic Principles. Di dalam Masters JRW, editor. Animal cell culture: a practical approach. New York: Oxford University Press.
Freshney RI. 2005. Culture of Animal Cells a Manual Basic Technique 5th ed.
New York: Wiley-liss, a John Wiley & Sons, Inc, Pub.
Ham RG, McKeehan WL. 1979. Cell Culture. Jakoby WB dan Pastan IH, editor. San Diego: Academic Press, Inc.
Hansson S. 2008. Proteomic strategies for analysis of cerebrospinal fluid in
neurodegenerative disorders. Sweden: Intellecta Docusys.
Harrison MA, Rae IF. 1997. General Technique of Cell Culture. UK: Cambridge University Press.
Hogan B, Beddington R, Costantini F, Lacy E. 1994. Manipulating The Mouse
Embryo. New York: Cold Spring Harbor Laboratory Press.
Johnson JA, Heneine W. 2001. Characteristic of Endogenous Avian Leucosis Viruses in a Chick Fibroblast Substrate Used in The Production of Measles and Mumps Vaccines. Journal of Virology 75(8): 3605-3612. Junquieira LC, Carneiro J. 2005. Basic Histology 11thed. USA: The McGraw-Hill
Companies Inc.
Lavenstein ME, Ludwig TE, Xu RH, Llanas RA, VanDenHeuvel-Kramer K, Manning D, Thomson JA. 2006. Basic Fibroblast Growth Factor Support of Human Embryonic Stem Cell Self-Renewal. Stem Cells 24: 568-574. Mader SS. 2000. Human Biology. Iowa: McGraw Hill.
Mallon BS, Park KY, Chen KG, Hamilton RS, McKay RDG. 2006. Toward Xeno-Free Culture of Human Embryonic Stem Cells. The International
Journal of Biochemistry & Cell Biology 38: 1063–1075.
Malole MBM. 1990. Kultur Sel dan Jaringan Hewan. Bogor: Departemen Pendidikan dan Kebudayaan, Direktorat Jendral Pendidikan Tinggi Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Mather JP, Roberts PE. 1998. Introduction to Cell and Tissue Culture. New York: Plenum Press.
McGuigan M, Sharman M. 2006. Skeletal Muscle Structure and Function. Di dalam Maud PJ dan Foster C, editor. Fhysiological Assessment of Human
Fitness 2nded. USA: Sheridan Books.
McSharry BP, Jones CJ, Skinner JW, Kipling D, Wilkinson GWG. 2001. Human Telomerase Reverse Transcriptase-Immortalized MRC-5 and HCA2 Human Fibroblasts are Fully Permissive for Human Cytomegalovirus.
Journal of General Virology 82: 855-863.
Navsaria HA, Sexton C, Bouvard C, Leigh IM. 1994. Growth of Keratinocytes with a 3T3 Feeder Layer Basic Technique. Di dalam Leigh IM, Watt FM, editor. Keratinocytes Methods. USA: Cambridge University Press.
Olsen JC, Johnson LG, Yankaskas JR. 1997. Method For The Use Of Retroviral Vectors For Transfer Of The Cftb Gene To Airway Epithelium. Di dalam: Robbins PD, editor. Gene Therapy Protocols. New Jersey: Humana Press.
Pereira RC, Economides AN, Canalis E. 2000. Bone Morphogenetic Proteins Induce Gremlin, a Protein That Limits Their Activity in Osteoblasts.
Endocrinology 141: 4558-4563.
Prowse ABJ, McQuade LR, Bryant KJ, Marcal H, Gray PP. 2007. Identification of Potential Pluripotency Determinants for Human Embryonic Stem Cells Following Proteomic Analysis of Human and Mouse Fibroblast Conditioned Media. Journal of Proteome Research 6: 3796-3807.
Purves M, Rybicki E. 1998. SDS Polyacrylamide Gel Electrophoresis
(SDS-PAGE). http://www.uct.ac.za/depts/microbiology/sdspage.html. [1 Juli
2010].
Raffy R. 2007. 3T3 Mouse Fibroblasts. http://www.flickr.com /photos/dendrite/ 1057852632/ in/photostream. [7 Agustus 2010].
Reya T, Morrison SJ, Clarke MF, Weissman IL. 2001. Stem Cells, Cancer and Cancer Stem Cells. Nature 414: 105-111.
Ross MH. 1995. Histology a Text and Atlas. 3rd ed. USA: William & Wilkins,
Baltimore.
Rylova SN, Randhawa PK, Bautch VL. 2008. In Vitro Differentiation of Mouse Embryonic Stem Cells into Primitive Blood Vessel. Di dalam Cheresh DA, editor. Methods in Enzymology Volume 443 Angiogenesis In Vitro
Systems. London: Elsevier Inc.
Samuelson DA. 2007. Textbook of Veterinary Histology. Missiori: Saunders Elsevier.
Trautmann A, Fiebiger J. 1957. Fundamentals of The Histology of Domestic
Animals. New York: Comstock Publishing Associates.
Van Den Bos C et al. 1997. Human Mesenchymal Stem Cells Respond to Fibroblast Growth Factors. Human Cell 10(1): 45-50.
Wobus AM, Boheler KR. 2006. Stem Cells. Germany: Springer.
Xiong J, Liu Z, Liu X. 2007. Induced differentiation of mouse embryonic stem cell into endothelial cell in vitro. Zhongguo Xiu Fu Chong Jian Wai Ke Za
Zhi (9): 994-998.
Xu C, Rosler E, Jiang J, Lebkowski JS, Gold JD, O’Sullivan C, Delavan-Boorsma K, Mok M, Bronstein A, Carpenter MK. 2005. Basic Fibroblast Growth Factor Supports Undifferentiated Human Embryonic Stem Cell Growth Without Conditioned Medium. Stem Cells 23(3): 315-323.
Yamada M, Ikegami N, Okigaki T. 1982. Proteins From Fibroblast Conditioned medium and Enhance Cell Adhesion, Spreading, and Growth. Proc. Japan
Acad. 58: 160-164.
Yamanaka S. 2008. Induction of Pluripotent Stem cells From Mouse Embryonic Fibroblast by Four Transcription Factors. Cell Proliferation 41: 51-56.
Lampiran 1 Pembuatan Medium Kultur DMEM
Medium kultur DMEM merupakan medium Dulbecco’s Modified Eagle’s
Medium (DMEM; Sigma) yang telah dimodifikasi dengan penambahan asam
amino non-esensial (AANE; Sigma) 10%, fetal calf serum (FCS; Gibco) 10%, NaHCO33mM, dan gentamisin 5µg/ml. Pembuatan 200 ml DMEM diperlukan 2
gram serbuk DMEM, 0,37 gram serbuk NaHCO3, 200 µl larutan asam amino
non-esensial, dan 250 µl gentamisin. Selanjutnya, ditambahkan aquades hingga volume mencapai 200 ml. penambahan 10 ml FCS dilakukan saat medium akan digunakan untuk kultur. Medium yang telah ditambah FCS selanjutnya disterilisasi dengan menggunakan mikrofilter 0,22 µm. Setelah medium steril, medium diinkubasi di dalam inkubator dengan suhu 37oC dan 5% CO2 sebelum
digunakan sebagai medium kultur.
Lampiran 2 Pembuatan Larutan PBS
Larutan PBS merupakan larutan phosphate buffered saline (PBS; Gibco) yang diberi tambahan fetal calf serum 0,1 % dan gentamisin 5µg/ml. Pembuatan 100 ml PBS diperlukan 0,96 gram serbuk PBS, 125 µl gentamisin, lalu ditambahkan aquades hingga volume mencapai 100 ml. Selanjutnya, larutan ditambah FCS sebanyak 100 µl kemudian larutan disterilisasi dengan mikrofilter 0,22 µm. Sebelum digunakan untuk kultur PBS diinkubasi terlebih dahulu di dalam inkubator pada suhu 37oC dan 5% CO2.
Lampiran 3 Prosedur Pewarnaan HE
Kultur sel yang ditumbuhkan di atas cover glass dibilas dengan larutan PBS lalu difiksasi dengan buffer paraformaldehid 4% selama 24 jam. Selanjutnya, kultur sel difiksasi di dalam alkohol 50% selama 2 jam dan dilanjutkan dengan alkohol 70% sampai kultur sel akan diwarnai dengan HE. Saat kultur sel akan diwarnai, terlebih dahulu dilakukan proses stopping point dengan cara merendam kultur sel di dalam alkohol 50% selama 3 menit. Selanjutnya, direndam di dalam aquades selama 5 menit, hematoksilin 4 menit, dan dibilas dengan aquades. Kemudian dilakukan perendaman di dalam eosin selama 2 menit, lalu dibilas dengan aquades. Pewarnaan dilanjutkan dengan dehidrasi bertingkat dalam
alkohol 70%, 80%, 90%, 96%, 100%, 100%, 100%, masing-masing selama 10 menit. setelah itu, dilanjutkan dengan xilol sebanyak dua kali ulangan. Terakhir, dilakukan mounting pada object glass dengan menggunakan entelan. Evaluasi morfologi sel dilakukan dengan mikroskop cahaya pada perbesaran 400x.
Lampiran 4 Pembuatan Stock Reagent - Pembuatan SDS 10%
Serbuk SDS sebanyak 10 gram dilarutkan dalam 60 ml aquades, kemudian dihomogenkan. Setelah larutan homogen, ditambahkan aquades hingga volume mencapai 100 ml.
- Pembuatan Amonium Persulfat 10%
Sebanyak 100 mg serbuk ammonium persulfat dilarutkan di dalam 1 ml aquades, kemudian dihomogenkan.
- Pembuatan Bisakrilamid
Pembuatan bisakrilamid membutuhkan 146 gram akrilamid dan 4 gram N,N’Methylene-bis Acrylamide, dilarutkan dalam 500 ml aquades.
- Pembuatan Tris-HCl 1,5M pH 8,6
Sebanyak 54,45 gram serbuk Tris Base dilarutkan dalam 150 ml aquades. pH larutan diatur dengan penambahan HCl. Setelah pH tercapai, larutan ditambah aquades hingga volume mencapai 300 ml.
- Pembuatan Tris-HCl 0,5M pH 6,8
Serbuk Tris Base sebanyak 6 gram dilarutkan dalam 60 ml aquades, kemudian pH diatur dengan penambahan HCl. Selanjutnya larutan ditambah aquades hingga volume mencapai 100 ml.
Lampiran 5 Pembuatan Gel Poliakrilamid
Gel poliakrilamid terdiri dari dua bagian yaitu separating gel dan stacking
gel.
- Separating gel
Separating gel 12% dibuat dengan memasukkan berturut-turut larutan
bisakrilamid sebanyak 6 ml, aquades 5,025 ml, Tris HCl 1,5M (pH 8,6) sebanyak 3,75 ml, SDS 10% 0,15 ml, ammonium persulfat 10% sebanyak 75 µl, dan