KELAS X
STRUKTUR ATOM
Uswatun
Hasanah
Fatikah Giyana Cahyani
Siti Daniar Sobriawati
0 50 100
Peny
aji
Sindi Rahmawati
Veni Jumila Danin
2. Peserta didik dapat menjelaskan struktur atom dan perkembangan model atom
TUJUAN PEMBELAJARAN
3. Peserta didik dapat mengenal tanda atom
4. Peserta didik dapat menuliskan konfigurasi elektron
5. Peserta didik dapat menentukan konfigurasi elektron berdasarkan kulit, subkulit, dan gas mulia.
1. Model
Atom Dalton 2. Model
Atom Thomson
PERKEMBANGAN MODEL ATOM
3. Model Atom Rutherford
4. Model Atom Niels
Bohr
5. Model Atom Mekanika
1. MODEL ATOM DALTON
(1808) Jhon Dalton mengemukakan teorinya tentang atom yang memuat 5 pernyataan:
1. Materi terdiri atas atom yang tidak dapat dibagi lagi.
2. Semua atom unsur kimia tertentu mempunyai massa yang sama begitu pula semua sifat lainnya.
3. Unsur kimia yang lain memiliki jenis atom yang berbeda. 4. Atom tidak dapat dihancurkan dan tidak dapat diubah
selama reaksi kimia.
1. MODEL ATOM DALTON
Gambar model atom Dalton (bola pejal)
Kelebihan:
1. Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier).
2. Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust).
Kelemahan:
1. Tidak dapat menerangkan sifat listrik atom.
2. MODEL ATOM THOMSON
(1897)
Joseph John Thomson
mengusulkan suatu
model yang dikenal dengan model atom roti kismis
sebagai berikut:
1. Atom berbentuk bola pejal bermuatan positif
yang homogen.
2. Elektron
bermuatan
negatif
tersebar
2. MODEL ATOM THOMSON
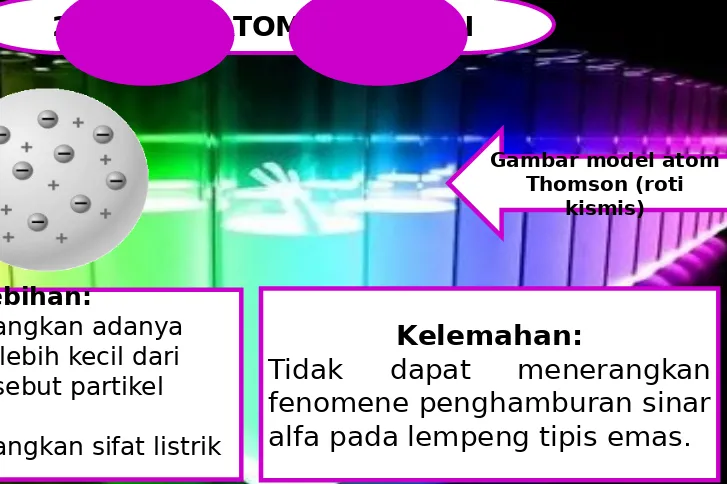
Gambar model atom Thomson (roti
kismis)
Kelebihan:
1. Dapat menerangkan adanya partikel yang lebih kecil dari atom yang disebut partikel subatomik.
2. Dapat menerangkan sifat listrik atom.
Kelemahan:
Tidak
dapat
menerangkan
3. MODEL ATOM RUTHERFORD
(1911)
Ernest Rutherford
bersama Goiger dan
3. MODEL ATOM RUTHERFORD
Rutherford
mengusulkan model atom sebagai
berikut:
1. Atom terdiri dari dari inti atom bermuatan positif
dan hampir seluruh massa atom terpusat pada
inti.
2. Elektron beredar mengelilingi inti.
3. Jumlah muatan inti sama dengan jumlah
muatan elektron, sehingga atom bersifat netral.
4. Sebagian ruangan dalam atom merupakan
3. MODEL ATOM RUTHERFORD
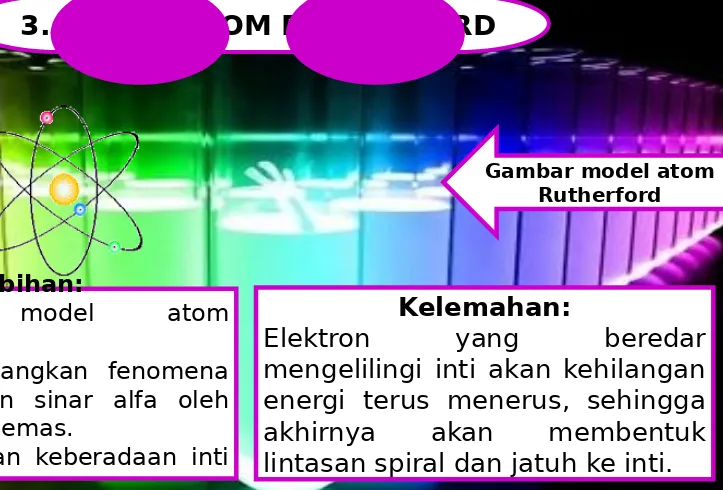
Gambar model atom Rutherford
Kelebihan:
1. Kelebihan model atom
Rutherford:
2. Dapat menerangkan fenomena penghamburan sinar alfa oleh lempeng tipis emas.
3. Mengemukakan keberadaan inti atom.
Kelemahan:
4. MODEL ATOM NIELS BOHR
(1913)
Niels Bohr
menyusun model atom sebagai berikut:
1. Atom terdiri atas inti atom yang mengandung proton
bermuatan positif dan elektron bermuatan negatif yang
mengelilingi inti atom.
2. Elektron-elektron yang mengelilingi inti atom tidak
memancarkan energi dan berada pada tingkat energi
tertentu yang bergerak secara stasioner.
3. Tingkat energi atau lintasan elektron yang paling dekat
dengan inti atom mempunyai tingkat energi tertentu.
4. MODEL ATOM NIELS BOHR
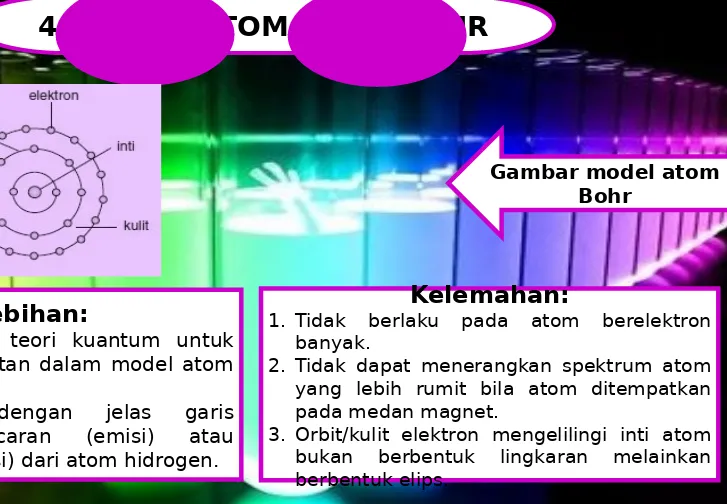
Gambar model atom Bohr
Kelebihan:
1. Mengaplikasikan teori kuantum untuk menjawab kesulitan dalam model atom Rutherford.
2. Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan:
1. Tidak berlaku pada atom berelektron banyak.
2. Tidak dapat menerangkan spektrum atom yang lebih rumit bila atom ditempatkan pada medan magnet.
5. MODEL ATOM MEKANIKA
KUANTUM
(1920) Ditemukan teori atom mekanika kuantum yang
digunakan untuk menjelaskan sifat atom dan molekul.
Asumsi dari model atom ini adalah:
1. Elektron dalam mengelilingi inti bergerak seperti
gelombang.
2. Karena gerak gelombang dari elektron ini maka
kedudukan elektron di sekeliling inti menjadi tak tentu
(asas ketidakpastian).
5. MODEL ATOM MEKANIKA
KUANTUM
Gambar model atom mekanika kuantum
Prinsip Ketidakpastian Heisenberg
Menurut Heisenberg: elektron yang bergerak menimbulkan perubahan dalam posisi dan momentum setiap saat sehingga posisi dan kecepatan elektron yang bergerak secara bersama-sama tidak dapat dilakukan secara tepat.
TANDA ATOM
X = lambang atom
A = nomor massa = p+n Z = nomor atom = p = e
Atom Netral
p=11, e=11, n=23-11=12 Ion Positif
p=19, e=19-1=18, n=39-19=20 Ion Negatif
p=16, e=16+2=18, n=32-16=16
LATIHAN SOAL
Tentukan jumlah proton, elektron, dan neutronnya!
ISOTOP, ISOTON, ISOBAR
1. Isotop, adalah unsur-unsur yang nomor atomnya sama, tetapi nomor massa berbeda.
Contoh: dengan
2. Isobar, adalah unsur-unsur yang nomor atomnya berbeda, tetapi nomor massanya sama.
Contoh: dengan
3. Isoton, adalah unsur-unsur yang nomor atom dan nomor massanya berbeda, tetapi jumlah neutronnya sama.
Contoh: dengan
LATIHAN SOAL
BILANGAN KUANTUM
Bilangan
kuantum
adalah
bilangan
yang
menentukan letak keberadaan elektron pada kulit
atom. Ada 4 bilangan kuantum, yaitu :
BILANGAN KUANTUM
Bilangan Kuantum Utama (n)
Utama (n) menyatakan kulit
Bilangan Kuantum Azimuth (l)
BILANGAN KUANTUM
Bilangan Kuantum Magnetik (m)
Magnetik (m) menyatakan posisi orbital dalam subkulit
= 0 m = 0
= 1 m = -1, 0, +1
= 2 m = -2, -1, 0, +1, +2
Bilangan Kuantum Spin (s)
BENTUK-BENTUK ORBITAL
Orbital pada suatu subkulit mempunyai bentuk tertentu yang bergantung pada bilangan kuantum azimuth (l).
1. Orbital s
BENTUK-BENTUK ORBITAL
2. Orbital p
BENTUK-BENTUK ORBITAL
3. Orbital d
BENTUK-BENTUK ORBITAL
4. Orbital f
KONFIGURASI ELEKTRON
Konfigurasi elektron merupakan gambaran penyebaran elektron dalam orbital-orbital kulit elektron.
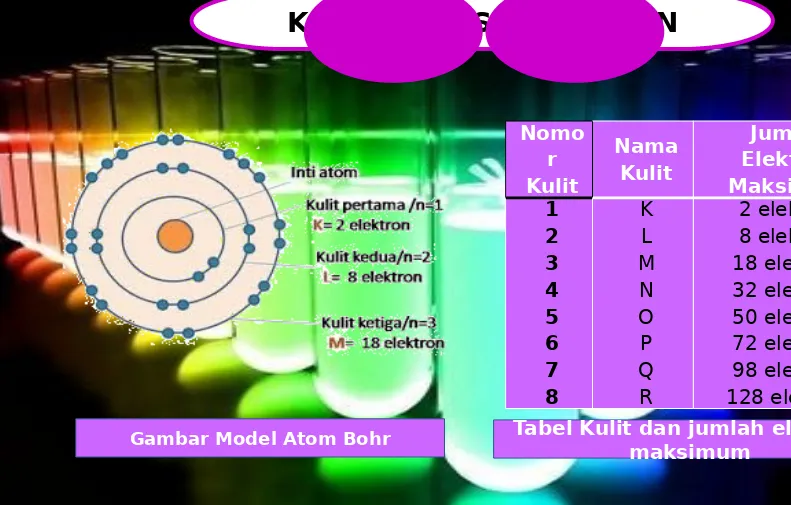
A. Konfigurasi Berdasarkan Kulit
Menurut model atom Neils Bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi.
KONFIGURASI ELEKTRON
Aturan pengisian elektron, yaitu:
1. Pengisian elektron dimulai pada kulit K, kemudian kulit L, M, N dan seterusnya.
a. Jumlah maksimum elektron pada kulit ke-n adalah 2n2 (n = nomor kulit).
b. Jumlah maksimum elektron pada kulit K (n = 1) = 2 x 12 = 2 elektron.
2. Jumlah maksimum elektron pada kulit L (n = 2) = 2 x 22 = 8 elektron, dan seterusnya.
KONFIGURASI ELEKTRON
Gambar Model Atom Bohr Tabel Kulit dan jumlah elektron
RUMUS PRAKTIS ATURAN
KONFIGURASI ELEKTRON
Nomor atom 1-20
Menggunakan rumus: 2 8 8 2
Contoh: 6C: 2 4 dan 19K : 2 8 8 1
Nomor atom 21-30
Menggunakan rumus: 2 8 18 2
Pengisian: 2 8 ... 2 baru sisanya diletakkan di depan angka 2.
Contoh: 21Sc : 2 8 9 2
Nomor atom 31-36
Menggunakan rumus: 2 8 18 8 Contoh: 35Br : 2 8 18 7
Nomor atom 37-38
Menggunakan rumus: 2 8 18 8 2 Contoh: 38Sr: 2 8 18 8 2
Nomor atom 39-48
Menggunakan rumus: 2 8 18 18 2 Pengisian: 2 8 18 ... 2 baru sisanya diletakkan di depan angka 2.
Contoh: 47Ag: 2 8 18 17 2
Nomor atom 49-54
ELEKTRON VALENSI
Jumlah elektron yang menempati kulit terluar
disebut
elektron valensi.
Contohnya, elektron valensi
19K = 2 8 8
1
adalah
LATIHAN SOAL
Buatlah konfigurasi elektron dari atom-atom dibawah ini berdasarkan kulit elektron atau tingkat energi serta tentukan jumlah elektron valensinya!
1. 11Na 6. 36Kr
2. 14Si 7. 37Rb
3. 20Ca 8. 40Zr
4. 26Fe 9. 43Tc
KONFIGURASI ELEKTRON
B. Berdasarkan Subkulit
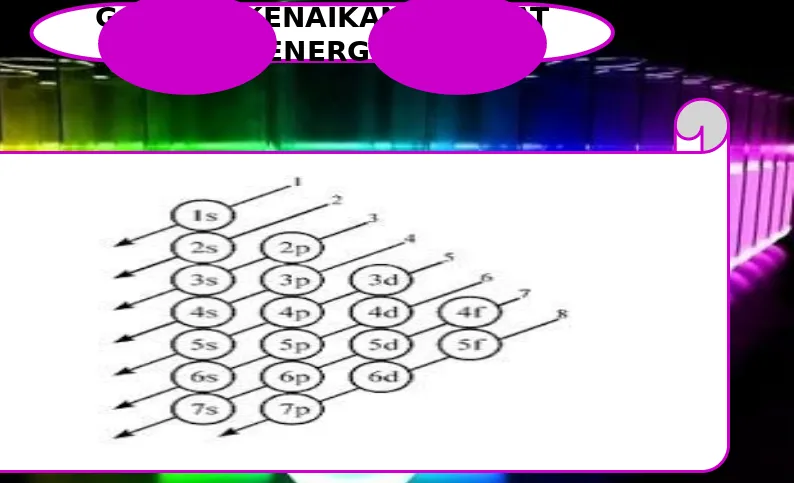
Aturan Aufbau (Membangun)
Prinsip: elektron dalam suatu atom akan berada dalam kondisi yang stabil bila mempunyai energi yang rendah, sedangkan elektron-elektron akan berada orbital-orbital yang bergabung membentuk subkulit.
Tabel Nilai (n + l) dan tingkat energi subkulit
LARANGAN PAULI
Berbunyi, “tidak boleh ada dua atom yang memiliki keempat bilangan kuantum yang sama”.
Jumlah maksimum elektron adalah sebagai berikut:
Subkulit s terdiri dari 1 orbital, dapat ditempati maksimum 2 elektron.
Subkulit p terdiri dari 3 orbital, dapat ditempati maksimum 6 elektron.
Subkulit d terdiri dari 5 orbital, dapat ditempati maksimum 10 elektron.
CONTOH SOAL
Konfigurasi elektron untuk atom 21Sc dan
25Mn
21Sc :
LATIHAN SOAL
Buatlah konfigurasi elektron dari atom-atom dibawah ini!
1. 11Na 6. 36Kr
2. 14Si 7. 37Rb
3. 20Ca 8. 40Zr
4. 26Fe 9. 43Tc
CONTOH SOAL
1. Bilangan kuantum elektron terakhir dari Ar (Z = 18) adalah...
KONFIGURASI NOTASI GAS
MULIA
Gas Mulia : 2He, 10Ne, 18Ar, 36Kr, 54Xe, dan 86Rn
Contoh: 12Mg konfigurasinya:
Gas mulia terdekat sebelumnya adalah
LATIHAN SOAL
Tuliskan konfigurasi elektron untuk setiap
atom berikut:
a.
20Ca
40ATURAN HUND
Proses pengisian elektron ke dalam orbital pertama kali akan mengisi semua orbital dengan tingkat energi yang sama terlebih dahulu sebelum memasangkan dengan elektron lain di orbital yang setengah penuh.
Contoh:
7Ni Konfigurasi : 1s2 2s2 2p3
LATIHAN SOAL
Gambarlah diagram orbital dari unsur berikut:
a. 13Al27
b. 16S32
ORBITAL PENUH DAN SETENGAH
PENUH
Ada beberapa penyimpangan pengisian elektron
berdasarkan atauran aufbau dengan berdasarkan
percobaan, bahwa orbital yang setengah penuh merupakan struktur yang relatif lebih stabil.
LATIHAN SOAL
Tentukan konfigurasi dari unsur berikut: 1. 24Cr
KONFIGURASI ION
Unsur yang mengalami ionisasi akan mengalami perubahan jumlah elektron.
Misalnya: 26Fe2+
26Fe mempunyai nomor atom 26 dan mempunyai
konfigurasi elektron [Ar] 3d64s2.
Fe2+, maka elektron Fe berkurang 2 dari jumlah asal.
LATIHAN SOAL
Tentukan konfigurasi dari ion berikut:
1. 11Na+