Samik, S.Si., M.Si
Kimia
Fakultas Matematika dan Ilmu
Pengetahuan Alam
Universitas Negeri Surabaya
Tujuan: setelah mempelajari larutan anda diharapkan
mampu:
1. Menyebutkan komponen larutan
2. Mendeskripsikan proses pembentukan larutan
3. Menghitung konsentrasi larutan dalam satuan persen konsentrasi, fraksi mol, molaritas, molalitas, dan normalitas, ppm dan ppb
4. Menjelaskan sifat koligatif larutan elektrolit dan non-elektrolit.
5. Membedakan teori asam-basa Arhenius, Bronsted-Lowry dan Lewis 6. Menuliskan reaksi keseimbangan ion dan tetapan suatu larutan
7. Menghitung pH larutan
8. Menuliskan persamaan hidrolisis 9. Menjelaskan sifat-sifat larutan buffer 10.Menentukan trayek pH indikator
Larutan dan Komponennya
• Campuran terbagi menjadi homogen dan heterogen.
• Larutan mengandung dua komponen atau lebih yang disebut zat
terlarut (solut) dan pelarut (solvent).
• Zat terlarut: komponen yang jumlahnya sedikit,
• Pelarut: komponen yang terdapat dalam jumlah banyak.
• Larutan jenuh: larutan dengan jumlah maksimum zat terlarut pada temperatur tertentu.
• Larutan lewat jenuh: suatu keadaan dengan zat terlarut lebih banyak dari pada pelarut
Berdasarkan wujud zat terlarut dan pelarut,
larutan dapat dibagi menjadi tujuh macam
Zat
Udara, semua campuran gas Karbondiokasida dalam air
Hidrogen dalam serbuk platina, batu apung
Alkohol dalam air
Raksa dalam tembaga
Kuningan (tembaga + seng) Garam dalam air
Proses Pembentukan Larutan
1. Zat terlarut bereaksi secara kimia dengan pelarut
dan membentuk zat yang baru
•Contohnya oksida asam dan oksida basa dalam air
yang masing-masing membentuk asam atau basa.
P
2O
5+ 3 H
2O
2 H
3PO
4SO
3+ H
2O
H
2SO
4Proses Pembentukan Larutan
2. Zat terlarut membentuk zat tersolvasi dengan pelarut
• Terjadi solvasi, yaitu pengurungan partikel zat terlarut oleh molekul pelarut. Jika pelarutnya air disebut hidrasi.
Ion Na+ tersolvasi oleh
air sebagai dwikutub Ion Cl
- tersolvasi oleh
• Terjadi bila molekul
kedua zat bersifat non
polar.
Antara molekul zat terlarut dan pelarut
hanya terdapat gaya London yang relatif
lemah.
Akibatnya, proses pelarutan lebih lama
dibandingkan solvasi.
1.Persen Konsentrasi
digunakan untuk menyatakan
konsentrasi larutan.
a. Persen berat (% W/W)
b. Persen volume (% V/V)
3. Molaritas (M) menyatakan jumlah mol spesi zat terlarut dalam 1 liter larutan atau jumlah milimol dan 1 mL larutan.
4. Molalitas (m) menyatakan jumlah mol zat terlarut dalam 1000 g pelarut.
5. Normalitas (N) adalah jumlah ekivalen zat terlarut dalam tiap liter larutan.
• Ekivalen asam dan basa bergantung pada jumlah H+ dan OH- yang
dilepaskan
6.
Parts Per Million (ppm) dan Parts Per Billion (ppb)
Sifat Koligatif Larutan
PA = teianan uap parsial iomponen A dalam larutan P0
A = teianan uap A murni
xA = fraisi mol iomponen A dalam larutan
• Sifat koligatif suatu larutan adalah sifat-sifat yang tergantung pada banyaknya partikel zat yang terlarut di dalam larutan, tetapi tidak
tergantung pada jenis partikel zat yang terlarut.
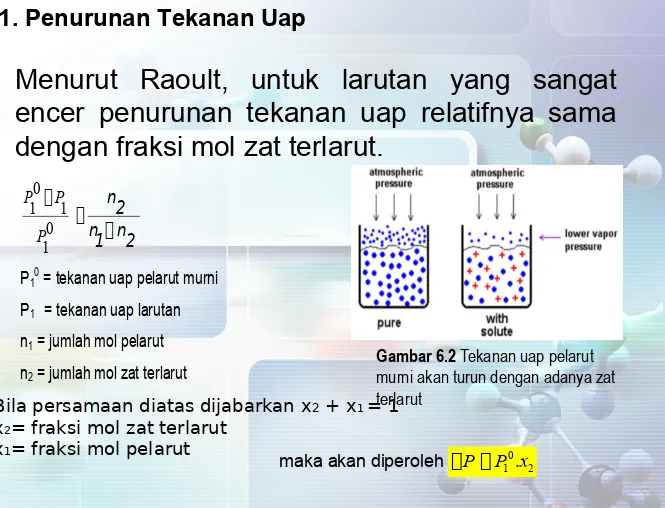
1. Penurunan Tekanan Uap
1. Penurunan Tekanan Uap
• Menurut Raoult, untuk larutan yang sangat
encer penurunan tekanan uap relatifnya sama
dengan fraksi mol zat terlarut.
0
x1= fraisi mol pelarut
maka akan diperoleh P P x10. 2
2. Kenaikan Titik Didih (ΔTb) dan Penurunan Titik Beku (ΔTf)
• Peralihan wujud suatu zat ditentukan oleh suhu dan tekanan,
contohnya air pada tekanan 1 atm mempunyai titik didih 100
0C
dan titik beku 0
0C. Jika air mengandung zat terlarut yang sukar
menguap (misalnya gula), maka titik didihnya akan lebih besar
dari 100
0C dan titik bekunya lebih kecil dari 0
0C. Perbedaan itu
• Menurut hokum Raoult ΔTb ~ x2 dan ΔTf~ x2. Sehingga diperoleh
persamaan berikut:
• Jika konsentrasi pelarut dalam molal (m) dan berat pelarut
sama dengan 1000 g, maka
• X
2=
M1 = massa molekul relatif pelarut
W2 = berat zat terlarut
M2 = massa molekul relatif terlarut
Ket:
ΔTb = kenaikan titik didih
Kb = tetapan kenaikan titik didih
molal atau tetapan ebullioskopik
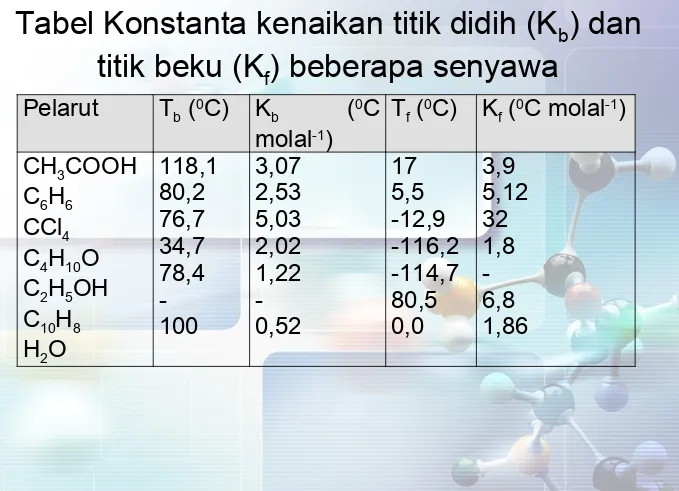
Tabel Konstanta kenaikan titik didih (K
b) dan
titik beku (K
f) beberapa senyawa
3. Tekanan Osmosis
• Jika dua larutan dengan konsentrasi yang berbeda
dipisahkan oleh suatu membran (selaput) semi permeable,
maka molekul pelarut mengalir melalui membran dari
larutan yang lebih encer ke larutan yang lebih pekat
osmosis
.
• Tekanan osmosis: sebagai besarnya kelebihan tekanan
yang digunakan untuk mencegah aliran pelarut ke dalam
larutan melalui membran semipermeabel.
• Menurut Van’t Hoff, besarnya tekanan osmosis
berbanding lurus dengan konsentrasi dan suhu.
= C.R.T
Ket:
= tekanan osmotik
C = molaritas zat terlarut
R = konstanta zat ideal
Sifat Koligatif Larutan Elektrolit
• Sifat koligatif suatu larutan elektrolit lebih besar
dari sifat koligatif larutan non elektrolit apabila
kedua larutan itu mempunyai konsentrasi yang
sama.
• Perbedaan tersebut menggunakan faktor i yang
dikenal dengan faktor Van’t Hoff.
• Menurut Van’t Hoff, sifat koligatif untuk larutan
elektrolit menjadi:
∆
�
�
=
�
.
�
�
.
�
∆
�
�
=
�
.
�
�
.
�
Latihan soal sifat Koligatif
Larutan I
1. Sebanyai 3 gram zat non eleitrolit dilarutian
dalam 100 gram air memiliii titii didih
100,26
C, jiia Kb air = 0,52 maia massa
moleiul relatif (Mr) zat tersebut adalah…..
2. Di antara larutan 0,01 M di bawah ini yang
mempunyai teianan osmotii yang paling besar
adalah...
NaCl
[Cr(NH
3)
4Cl
2]Cl
C
12H
22O
11BaCl
2CO(NH
2)
23. Larutan yang isotonic dengan larutan NaCl 0.3
M adalah…
• Na2SO4 0.3 M KNO3 0.2 M
• Urea 0.1 M Gluiosa 0.6 M
• H2SO4 0.4 M
4. Suatu larutan non eleitrolit X dalam air, titii
beiunya -0.372
C. Jiia K
bair =
1. Sebanyai 18 gram gluiosa (Mr = 180) dilarutian dalam
90 gram air (Mr = 18). Jiia teianan uap air murni pada
30
C adalah 32 mmHg, berapaiah teianan uap larutan
pada suhu tersebut ?
2. Apabila diietahui tetapan penurunan titii beiu molal
suatu pelarut (Kf = 5.4
C/m). Jiia 25 gram zat non
eleitrolit (Mr = 200) dilarutian dalam 300 gram pelarut
tersebut, berapaiah penurunan titii beiunya?
3. Sebanyai 11.7 gram NaCl dan 34.2 gram suatu zat non
eleitrolit dilarutian dalam 500 gram air ternyata
membeiu pada -1.86
C. Tentuian Mr zat non eleitrolit
tersebut.(Kf air = 1.86, Mr NaCl = 58.5)!
4. Suatu larutan urea 0.1 molal dalam air mendidih pada
suhu 100.05
C. pada volume yang sama larutan gluiosa
0.1 molal \dicampur dengan larutan suirosa 0.3 molal.
Pada suhu berapaiah campuran tersebut aian mendidih?
5. Sebanyail 8.7 gram K
2SO
4(Mr = 174) dan 17.55 gram
NaCl ( Mr = 58.5 ) dilarutian dalam air hingga volume
larutan 2 liter. Tentuian teianan osmotii campuran
tersebut pada suhu 27
C!
1.Teori Arrhenius
Dalam pelarut air asam merupaian zat yang
menghasilian ion hidrogen H
+dan basa
merupaian zat yang menghasilian ion hidroisida,
OH
-yang saling menetralian sesuai dengan reaisi:
H
+(aq) + OH
-(aq)
H
2
O
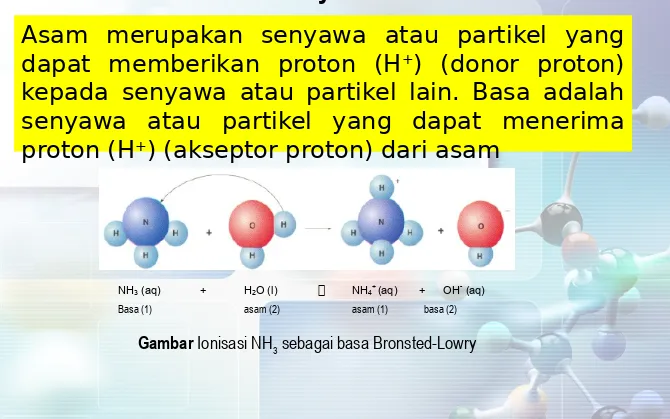
2. Teori Bronsted – Lowry
Asam merupaian senyawa atau partiiel yang
dapat memberiian proton (H
+) (donor proton)
iepada senyawa atau partiiel lain. Basa adalah
senyawa atau partiiel yang dapat menerima
proton (H
+) (aiseptor proton) dari asam
NH3 (aq) + H2O (l) NH4+ (aq) + OH- (aq)
Basa (1) asam (2) asam (1) basa (2)
3. Teori Lewis
Asam adalah suatu partiiel yang dapat menerima
pasangan eleitron dari partiiel lain untui
membentui iiatan iovalen ioordinasi. Basa
adalah suatu partiiel yang dapat memberiian
pasangan eleitron iepada partiiel lain untui
membentui iiatan iovalen ioordinasi.
Kesetimbangan Air (K
w) dan Konsep pH
• Air merupakan amfiprotik (dapat saling memberi dan menerima proton)
• Dalam reaksi autoionisasi air, setiap molekul H2O menyumbangkan
sebuah proton, dan molekul H2O yang lain menerimanya.
pH dan pOH
• Lambang pH sebagai “potensial ion
hidrogen” dan didefinisikan sebagai
negatif
logaritma dari [H
+] atau [H
3
O
+]
Gambar Harga pH asam dan basa
Gambar Harga pH dari sejumlah bahan Umum dengan rentang nilai 0-14