Makalah
Bioteknologi Molekul
PENGEMBANGAN TEKNIK ANALISIS STRUKTUR DAN FUNGSI MOLEKUL PROTEIN
OLEH:
NOVAYANI PAGILING (H311 14 014) RIRIN HANDAYANI (H311 14 016) WAHYUNI EKA NANDA (H311 14 017) HELEN SALUDUNG (H31 114 018)
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS HASANUDDIN
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa karena
atas berkat dan limpahan rahmat-Nyalah sehingga penulis dapat menyelesaikan
makalah ini dengan baik. Berikut ini penulis mempersembahkan sebuah makalah
dengan judul “Pengembangan Teknik Analisis Struktur dan Fungsi Molekul
Protein” yang menurut penulis dapat memberikan manfaat yang besar bagi kita untuk mengetahui perkembangan dari teknik analisis dan fungsi dari molekul
protein.
Melalui kata pengantar ini penulis lebih dulu meminta maaf yang
sebesar-besarnya bila makalah ini masih jauh dari kesempurnaan dan ada kata-kata penulis
yang menyinggung perasaan. Semoga makalah ini dapat bermanfaat bagi
pembaca.
Sekian dan terima kasih.
Makassar, 9 Oktober 2017
Penulis
DAFTAR ISI
DAFTAR ISI...iii
BAB I PENDAHULUAN...1
1.1 Latar Belakang...1
1.2 Rumusan Masalah...2
1.3 Tujuan ...2
BAB II TINJAUAN PUSTAKA...3
2.1 Protein...3
2.2 Struktur Protein...4
2.3 Teknik Analisis Struktur Protein...7
2.4 Fungsi Molekul Protein...13
2.5 Hubungan Struktur dan Fungsi Molekul Protein...15
BAB III PENUTUP...23
3.1 Kesimpulan...23
BAB I
PENDAHULUAN
1.1 Latar Belakang
Protein merupakan ikatan antara asam amino yang membentuk rantai
yang panjang. Ikatan antara asam amino tersebut dinamakan ikatan peptida.
Ikatan peptida merupakan ikatan antara dua asam amino dimana gugusan
karboksil dan ikatan amina dari dua asam amino yang berlainan bereaksi.
Protein merupakan molekul penyusun tubuh kita yang terbesar setelah air. Hal
ini mengindikasikan pentingnya protein dalam menopang seluruh proses
kehidupan dalam tubuh (Iskandar, 1974).
Prediksi struktur protein merupakan bagian penting dari ilmu protein.
Struktur protein telah bereksperimen selama beberapa dekade terakhir dengan
metode fisika dan kimia. Awal rangkaian protein dimulai pada awal tahun 1950an
setelah sekuensing lengkap insulin dan kemudian ribonuklease. Langkah kunci
menuju peningkatan pesat jumlah protein sekuensing pada tahun 1980an adalah
pengembangan sekuens otomatis yang diikuti oleh kemajuan spektrometri massa
untuk identitas struktur. Pengetahuan struktural sangat penting untuk pemahaman
kehidupan yang lengkap pada tingkat molekuler. Pemahaman tentang struktur
protein dapat menyebabkan derivasi fungsi dan mekanisme aktivitas protein.
Bioinformatika adalah pendekatan baru dalam penelitian terbaru mengenai
analisis sekuens dan prediksi struktur protein (John, dkk., 2011).
Dengan munculnya bioinformatika, telah dimungkinkan untuk memahami
hubungan antara urutan asam amino dan struktur tiga dimensi pada protein.
tidak hanya untuk memperoleh sarana penyimpanan dan pengambilan data urutan
yang efisien, namun juga untuk merancang lebih banyak alat analisis. Dengan
demikian, ada kebutuhan terus menerus untuk mengubah informasi sekuens
menjadi pengetahuan biokimia dan biofisik; untuk menguraikan petunjuk
struktural, fungsional dan evolusioner yang dikodekan dalam bahasa urutan
biologis. Informasi urutan protein disimpan dalam database yang tersedia di ranah
publik untuk mengakses, menganalisis dan mengambil data urutan dan struktur.
Secara umum, database protein dapat diklasifikasikan sebagai database primer dan
sekunder, database pola protein komposit dan database klasifikasi struktur.
Database primer dan sekunder membahas berbagai aspek analisis protein, karena
mereka menyimpan berbagai tingkat informasi protein (John, dkk., 2011).
1.2 Rumusan Masalah
Adapun rumusan masalah dari makalah ini adalah: 1. Bagaimana teknik analisis struktur molekul protein? 2. Apa fungsi molekul protein?
3. Bagaimana Hubungan struktur dan fungsi molekul protein?
1.3 Tujuan
Adapun tujuan penulisan makalah ini adalah: 1. Mengetahui teknik analisis struktur molekul protein. 2. Mengetahui fungsi molekul protein.
3. Memahami hubungan struktur dan fungsi molekul protein.
BAB II
TINJAUAN PUSTAKA
3.1 Protein
Istilah protein diperkenalkan pada tahun 1830-an oleh pakar kimia
Belanda bernama Mulder, yang merupakan salah satu dari orang-orang pertama
menyimpulkan peranan inti dari protein dalam sistem hidup dengan menurunkan
nama dari bahasa Yunani proteios, yang berarti “bertingkat pertama”. Protein
merupakan makromolekul yang menyusun lebih dari separuh bagian dari sel.
Protein menentukan ukuran dan struktur sel, komponen utama dari sistem
komunikasi antar sel serta sebagai katalis berbagai reaksi biokimia di dalam sel.
Karena itulah sebagian besar aktivitas penelitian biokimia tertuju pada protein
khususnya hormon, antibodi dan enzim (Iskandar, 1974).
Semua jenis protein terdiri dari rangkaian dan kombinasi dari 20 asam
amino. Setiap jenis protein mempunyai jumlah dan urutan asam amino yang khas.
Di dalam sel, protein terdapat baik pada membran plasma maupun membran
internal yang menyusun organel sel seperti mitokondria, retikulum endoplasma,
nukleus dan badan golgi dengan fungsi yang berbeda-beda tergantung pada
tempatnya. Protein-protein yang terlibat dalam reaksi biokimia sebagian besar
berupa enzim banyak terdapat di dalam sitoplasma dan sebagian terdapat pada
kompartemen dari organel sel (Iskandar, 1974).
Protein merupakan kelompok biomakromolekul yang sangat heterogen.
Ketika berada di luar makhluk hidup atau sel, protein sangat tidak stabil. Protein
merupakan komponen utama bagi semua benda hidup termasuk mikroorganisme,
hewan dan tumbuhan. Protein merupakan rantaian gabungan 22 jenis asam amino.
Protein ini memainkan berbagai peranan dalam benda hidup dan
bertanggungjawab untuk fungsi dan ciri-ciri benda hidup (Iskandar, 1974).
Keistimewaan lain dari protein ini adalah strukturnya yang mengandung N
(15,30-18%), C (52,40%), H (6,90-7,30%), O (21- 23,50%), S (0,8-2%),
disamping C, H, O (seperti juga karbohidrat dan lemak), dan S kadang-kadang P,
Fe dan Cu (sebagai senyawa kompleks dengan protein). Dengan demikian maka
secara kuantitatif adalah dengan penentuan kandungan N yang ada dalam bahan
makanan atau bahan lain (Sudarmaji, dkk., 1989).
Protein diperkenalkan sebagai molekul makro pemberi keterangan, karena
urutan asam amino dari protein tertentu mencerminkan keterangan genetik yang
terkandung dalam urutan basa dari bagian yang bersangkutan dalam DNA yang
mengarahkan biosintesis protein. Tiap jenis protein ditandai ciri-cirinya oleh
(Page, 1997):
1. Susunan kimia yang khas, setiap protein individual merupakan senyawa murni 2. Bobot molekular yang khas, semua molekul dalam suatu contoh tertentu dari
protein murni mempunyai bobot molekular yang sama. Karena molekulnya
yang besar maka protein mudah sekali mengalami perubahan fisik ataupun
aktivitas biologisnya.
3. Urutan asam amino yang khas, urutan asam amino dari protein tertentu adalah
terinci secara genetik. 3.2 Struktur Protein
Ada 20 asam amino di alam yang terdiri dari konfigurasi-L yang
membentuk semua jenis protein dan diklasifikasikan sebagai asam amino alifatik,
aromatik, asam, basa, hidroksik, sulfur dan amidik. Struktur utama protein berada
dalam urutan linier urutan asam amino sepanjang rantai polipeptida. Asam amino
telah disebutkan dalam kode tiga huruf dan dalam beberapa tahun terakhir, dengan
Asam amino yang membentuk urutan yang disebut residu untuk
menunjukkan komposisi polipeptida. Urutan utama protein dapat divisualisasikan
sebagai kode huruf tunggal yang mengalir dari kiri ke kanan dengan ujung kiri
yang membentuk N-terminal (kelompok amino) dari residu asam amino pertama
dan ujung kanannya merupakan terminal C (karboksilat kelompok asam) dari
residu asam amino terakhir. Aspek penting dari struktur primer adalah bahwa
ketidaksesuaian urutan protein fungsional seringkali mematikan fungsi seluler
yang dilakukan oleh protein. Hal ini menyebabkan beberapa cacat turun temurun
dan metabolik seperti anemia sel sabit dimana asam glutamat digantikan oleh
valin pada posisi ke-6 dari rantai β pada hemoglobin dengan mutasi titik.
Urutan asam amino protein ditentukan oleh urutan gen oleh proses transkripsi dan
translasi (John, dkk., 2011).
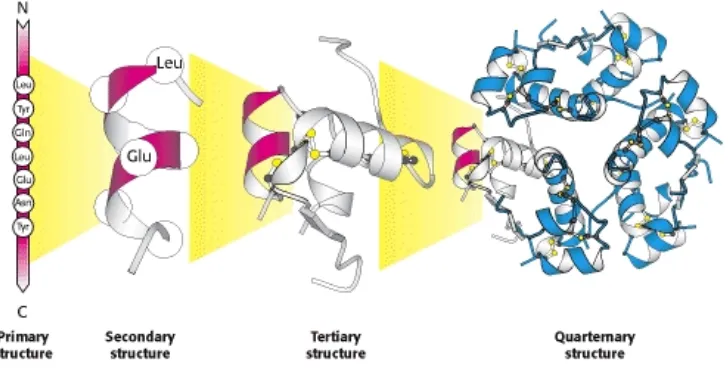
Struktur sekunder protein adalah konformasi lokal dari rantai polipeptida
atau hubungan spasial residu asam amino yang ditempatkan berdekatan dalam
urutan primer. Tingkat organisasi ini ditemukan pada protein globular di mana tiga
unit dasar struktur sekunder hadir, yaitu untai α -heliks, β -untai dan
belokan. Struktur sekunder lainnya didasarkan pada unsur-unsur ini (John, dkk.,
Struktur tersier adalah lipatan tiga dimensi global yang dihasilkan dari
interaksi antara elemen struktur sekunder. Struktur tersier protein mewakili
konformasi lipatan rantai polipeptida terlipat dalam ruang tiga dimensi, yaitu
susunan spasial residu asam amino yang secara luas dipisahkan dalam struktur
utamanya. Interaksi antara kelompok rantai samping adalah pendorong utama
lipatan rantai protein. Interaksi ini yang menstabilkan struktur tersier timbul dari
pembentukan jembatan disulfida, efek hidrofobik, interaksi charge-charge,
interaksi H-bonding dan van der Waal (John, dkk., 2011).
Banyak protein yang terlibat dalam fungsi struktural atau metabolik atau
enzimatik adalah protein oligomer karena mengandung lebih dari satu rantai
polipeptida tunggal yang disebut subunit. Konformasi kuartener dari protein
timbul dari interaksi yang mirip dengan struktur tersier, namun merupakan hasil
interaksi antara subunit yang mungkin identik atau tidak nyata. Oleh karena itu,
struktur kuartener mengacu pada asosiasi subunit ganda yang tidak stabil dan
stabil. Contoh klasik protein yang menunjukkan konformasi kuartener adalah
hemoglobin yang terdiri dari 4 rantai polipeptida atau subunit. Konformasi
kuadran dari protein memungkinkan pembentukan situs katalitik atau pengikatan
pada antarmuka antara subunit, yang tidak memungkinkan protein monomer.
Pengikatan ligan atau substrat menyebabkan perubahan konformasi yang
mempengaruhi rakitan protein untuk mengatur aktivitas biologisnya seperti
3.3 Teknik Analisis Struktur Protein
Ultrasentrifuga analitik dikembangkan pada tahun 1920-an oleh Theodor
Svedberg. Laju sedimentasi (pengendapan) suatu zat saat ultrasentrifugasi
terutama merupakan fungsi dari densitasnya dan yang kedua dari bentuknya.
ribosom, mitokondria, dan kloroplas. Alat tersebut bisa digunakan untuk
menentukan jumlah minimal jenis-jenis makromolekul dalam suatu specimen
biologi dan untuk membuat estimasi berat molekular makromolekul. Mikroskop
elektron ditemukan pada tahun 1930-an, dan pada akhirnya memungkinkan
visualisasi langsung tidak hanya substruktur-substruktur selular namun juga virus
dan makromolekul-makromolekul. Mikroskop electron telah menunjukkan bahwa
peta genetic mikroorganisme memang memiliki struktur fisik berbeda sirkular,
berbagai molekul mRNA (polisom) juga telah divisualisasikan dengan instrumen
ini. Elektroforesis adalah teknik yang memisahkan molekul-molekul berdasarkan
bentuk, muatan netto, dan berat molekulnya dalam sebuah medan listrik, biasanya
di atas medium penyokong padat atau semipadat, misalnya kertas atau agarosa.
Teknik tersebut digunakan pertama kalipada tahun 1949 untuk membedakan
hemoglobin sel sabit dari hemoglobin normal (Elrod dan Stansfield, 2006).
2.3.1 Metode Kristalografi Sinar-X (X-ray crystallography)
Metode penentuan struktur tiga dimensi protein yang luas digunakan saat ini adalah kristalografi sinar-X (X-ray crystallography). Kristalografi sinar-X
menggunakan pancaran sinar-X yang ditembakkan mengenai suatu protein yang
telah dimurnikan atau memiliki kemurnian tinggi sehingga berbentuk kristal.
Pancaran gelombang sinar-X yang mengenai struktur kristal protein kemudian
akan terhambur. Hamburan sinar-X yang muncul kemudian dibaca dan struktur
kristal protein dapat diketahui.
Kendala yang dihadapi saat ini adalah performa dari instrumen itu sendiri
dimana resolusi gelombangnya masih rendah sehingga struktur protein tidak dapat
Departemen Energi Amerika Serikat telah mengembangkan metode kristalografi
sinar-X terbaru yang menggunakan laser sinar-X beresolusi ultra-tinggi (ultra-high
resolution) yang mereka sebut SLAC Linac Coherent Light Source (LCLS).
Instrumen ini termasuk ke dalam jenis Coherent X-ray Imaging (CXI).
Metode ini dikembangkan dari kristalografi sinar-X konvensional dimana
perbedaannya terletak pada pulsa sinar-X yang digunakan. LCLS menggunakan
kristalografi femtosekon (10-15 s) dan pencitraan split-second laser sinar-X
dengan panjang gelombang yang sangat pendek dan berintensitas tinggi. Teknik
ini membuat para ilmuwan dapat meneliti struktur protein dengan ukuran yang
lebih kecil namun memiliki resolusi tinggi. LCLS juga dapat digunakan untuk
studi dinamika molekuler protein yang diamati.
2.3.2 Metode Spektroskopi NMR
Pada protein, tidak semua protein bisa dikristalisasi. Sebagai contoh,
membran protein yang memiliki banyak asam amino hidrofobik akan sulit untuk
mengkristalisasi. Teknik lain untuk melakukan analisis protein dalam larutan
tanpa kristalisasi adalah menggunakan NMR (Nuclear Magnetic Resonance).
NMR mengukur perubahan kimia pada atom di protein yang tergantung pada
atom di sekitarnya dan jarak atom di sekitarnya. NMR akan menghasilkan data
berupa struktur bukan struktur sebenarnya. Untuk protein kecil, alat ini dapat
secara akurat memprediksi strukturnya.
2.3.3 Elekroforesis
Elekroforesis adalah suatu teknik yang mengukur laju perpindahan atau
pergerakan partikel-partikel bermuatan dalam suatu medan listrik. Prinsip kerja
(anion), dalam hal tersebut DNA, yang bergerak menuju kutub positif (anode),
sedangkan partikel-partikel bermuatan positif (kation) akan bergerak menuju
kutub negatif (anode). Elektroforesis digunakan untuk mengamati hasil
amplifikasi dari DNA. Hasil elektroforesis yang terlihat adalah terbentuknya pita
yang merupakan fragmen DNA hasil amplifikasi dan menunjukkan
potongan-potongan jumlah pasangan basanya (Klug dan Cummings, 1994).
Teknik elektroforesis mempergunakan medium yang terbuat dari gel.
Perpindahan partikel pada medium gel tersebut dipengaruhi oleh faktor-faktor
seperti ukuran partikel, komposisi dan konsentrasi gel, densitas muatan, kuat
medan listrik dan sebagainya. Semakin kecil partikel tesebut, maka pergerakan
atau migrasinya akan semakin cepat, karena matriks gel mengandung jaringan
kompleks berupa pori-pori sehingga partikel-partikel tersebut dapat bergerak
melalui matriks tersebut (Brown, 1992).
Di dalam elektroforesis digunakan sumber arus listrik searah (DC), ruang
untuk elektroforesis (Comb, Well, platform dan cetakan wadah gel), larutan buffer
(buffer ionik dan loading buffer), matriks elektroforesis, marker dan gel.
Elektroforesis digunakan dengan tujuan untuk mengetahui ukuran dan bentuk
suatu partikel baik DNA, RNA dan protein. Selain itu, elektroforesis juga
digunakan untuk fraksionasi yang dapat digunakan untuk mengisolasi
masing-masing komponen dari campurannya, mempelajari fitogenetika, kekerabatan dan
mempelajari penyakit yang diturunkan. Elektroforesis dalam bidang genetika,
digunakan untuk mengetahui ukuran dan jumlah basa yang dikandung suatu
sekuen DNA tertentu (Klug dan Cummings 1994).
Uji xantoprotein merupakan uji kualitatif pada protein yang digunakan
untuk menunjukkan adanya gugus benzena (cincin fenil). Asam amino yang
menunjukkan reaksi positif untuk uji ini adalah tyrosin, phenilalanin, dan
tryptophan. Reaksi positif ada uji xantoprotein adalah munculnya gumpalan atau
cincin warna kuning. Pada uji ini, digunakan larutan HNO3 yang berfungsi untuk
memecah protein menjadi gugus benzena.
3.3.5 Tes Hopkins-cole
Pereaksi Hopkins-cole dibuat dari asam oksalat dan serbuk magnesium
dalam air. Pereaksi ini positif terhadap protein yang mengandung asam amino
dengan gugus samping indol, seperti pada asam amino triptofan. Triptofan
memberikan hasil yang positif dengan tes Hopkins-cole karena mengandung
gugus indol.
Pada reaksi ini, asam oksalat direduksi menjadi asam glioksilat dengan
bantuan katalis serbuk magnesium:
Asam glioksilat yang terbentuk mengkondensasi asam amino triftofan
membentuk senyawa berwarna. Setelah H2SO4 pekat dituangkan, akan terbentuk
dua lapisan dan beberapa saat kemudian terbentuk cincin ungu di antara batas
2.3.6 Tes Millon
Pereaksi Millon adalah campuran larutan raksa (I) nitrat dan raksa (II)
nitrat dalam asam nitrat. Jika pereaksi Millon ditambahkan ke dalam larutan
protein, akan dihasilkan endapan putih yang dapat berubah menjadi merah akibat
pemanasan.
Tirosin memberikan hasil yang positif dengan tes Millon karena
mengandung gugus fenol. Ini positif untuk protein yang mengandung asam amino
dengan gugus samping senyawa fenol sebab terjadi reaksi antara senyawa raksa
(II) dengan gugus hidroksifenil membentuk senyawa berwarna. Protein yang
mengandung tirosin akan memberikan hasil positif.
2.3.7 Tes Biuret
Larutan protein memberikan hasil yang positif terhadap pereaksi
biuret. Tes Biuret dilakukan dengan cara menuangkan larutan natrium hidroksida
pekat ke dalam larutan protein. Kemudian, larutan CuSO4 ditambahkan setetes
2.3.8 Tes Nitroprusida
Natrium nitroprusida dalam larutan amonia akan menghasilkan warna
merah dengan protein yang mempunyai gugus –SH bebas (merkapto). Jadi,
protein yang mengandung sistein akan memberikan hasil positif. Gugus –S–S–
pada sistein apabila direduksi terlebih dahulu dapat juga memberikan hasil positif.
2.3.9 Tes Sakaguchi
Pereaksi yang digunakan adalah naftol dan natrium hipobromit. Pada
dasarnya reaksi ini akan memberikan hasil positif jika terdapat gugus guanidin
seperti arginin memberikan warna merah.
2.3.10 Pereaksi Ninhidrin
Pereaksi ninhidrin merupakan oksidator lemah, asam amino dapat
bereaksi dengan ninhidrin sebagai berikut:
3.4 Fungsi Molekul Protein
Fungsi semua protein bergantung pada kemampuannya untuk secara
karena polipeptida dengan sekuens asam amino berbeda dilipat menjadi struktur
tersier yang berbeda. Setiap jenis protein berevolusi untuk berinteraksi dengan
molekul atau ligan tertentu. Protein katalitik (enzim) mengubah ligan menjadi
molekul lain. Protein struktural berinteraksi dengan molekul tertentu sering
menganugerahi molekul terikat dengan sifat biologis khusus. Misalnya, satu kelas
protein, histon, berikatan dengan DNA membentuk struktur nukleoprotein
kompak yang disebut nukleosom, sementara kelas kedua menggabungkan protein
dengan RNA untuk membentuk kompleks ribonukleoprotein yang dikenal sebagai
ribosom. Protein transportasi (seperti hemoglobin) mengikat ligan spesifik (dalam
hal ini oksigen) dan mengangkut ligan ke tempat yang dibutuhkan. jenis lain dari
protein transportasi memungkinkan molekul tertentu untuk melewati membran
biologis. Protein penyimpanan seperti mioglobin, protein pengikat oksigen
lainnya, memungkinkan sel untuk menyimpan konsentrasi ligan yang lebih tinggi
daripada yang mungkin terjadi. Protein regulator berinteraksi dengan protein lain
atau dengan asam nukleat untuk memperlambat atau mempercepat beberapa
proses biologis penting. Protein reseptor mengubah konformasi setelah mengikat
ligan tertentu dan kemudian memicu serangkaian perubahan metabolik. Bahkan
ada protein beracun seperti toksin kolera yang memodifikasi protein lain sehingga
tidak lagi berfungsi dengan baik.
Meskipun tampaknya protein transpor dan protein penyimpanan agak
kurang menarik bagi ahli biologi molekuler daripada jenis protein lainnya,
sebenarnya ini tidak benar. Protein penyimpanan oksigen mioglobin dan protein
pengangkutan oksigen hemoglobin memiliki tempat khusus dalam sejarah awal
struktur dari mempelajari kedua protein ini tetap relevan saat ini. Oleh karena itu
kami memulai pemeriksaan fungsi protein dengan mempertimbangkan struktur
fungsi hubungan yang ada untuk mioglobin dan hemoglobin (Tropp, 2007).
Enzim adalah protein yang mengkatalisis reaksi kimia. Hampir semua
reaksi kimia yang terjadi di dalam sel dikatalisis oleh enzim atau katalis RNA
yang disebut ribozim. Enzim mengkatalisis sebagian besar reaksi yang terlibat
dalam DNA, RNA, dan metabolisme protein. Sejumlah besar enzim berbeda
diperlukan untuk mengkatalisis proses kompleks seperti replikasi, transkripsi, atau
translasi (Tropp, 2007).
2.5 Hubungan Struktur dan Fungsi Molekul Protein
Protein adalah makromolekul paling serbaguna dalam sistem kehidupan
dan melayani fungsi penting pada dasarnya semua proses biologis. Protein
berfungsi sebagai katalisator, mengangkut dan menyimpan molekul lain seperti
oksigen, mereka memberikan dukungan mekanis dan perlindungan kekebalan,
menghasilkan gerakan, mentransmisikan impuls saraf, dan mereka mengendalikan
pertumbuhan dan diferensiasi.
Protein yang terbentuk dari molekul kompleks dalam struktur kuartener
dimana dua atau lebih rantai polipeptida dapat bergabung bersama. Sebagai hasil
dari beragam peran protein, bagaimana rantai polipeptida digabungkan secara
khusus berkaitan dengan fungsinya. Misalnya, protein berserat, yang memiliki
peran struktural, memiliki struktur kuartener yang berbeda dengan protein
globular seperti enzim yang memiliki fungsi metabolik. Contoh protein berserat
adalah kolagen, yang dibentuk dengan bergabungnya tiga rantai polipeptida
berserat melalui hubungan silang antara asam amino rantai. Pada titik di mana
satu molekul kolagen berakhir dan yang lainnya mulai menyebar ke seluruh serat,
kekuatan dan stabilitas molekul lengkap meningkat. Hal ini penting karena bentuk
kolagen tendon yang bergabung dengan otot ke tulang. Sebagai alternatif,
kelompok prostetik (non protein) dapat melekat pada protein. Contoh dari ini
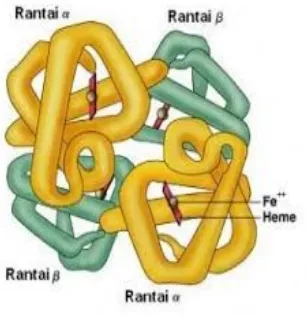
adalah kelompok Heme (mengandung ion besi) dalam hemoglobin. Kelompok ini
memungkinkan pemuatan dan pembongkaran oksigen ke dalam molekul
hemoglobin. Fitur ini memungkinkan hemoglobin, terbentuk dari empat rantai
polipeptida yang dihubungkan dalam molekul bola yang masing-masing berisi
kelompok haem, untuk menjalankan fungsinya membawa oksigen ke seluruh
Protein memegang peranan penting dalam hampir semua proses biologi.
Protein merupakan komponen penting atau komponen utama sel hewan atau
manusia. Oleh karena, sel itu merupakan pembentuk tubuh kita, maka protein
yang terdapat dalam makanan berfungsi sebagai zat utama dalam pembentukan
dan pertumbuhan tubuh. Untuk dapat melakukan fungsi biologis, protein melipat
ke dalam satu atau lebih konformasi spasial yang spesifik, didorong oleh sejumlah
interaksi non-kovalen seperti ikatan hidrogen, interaksi ionik, gaya van der Waals,
dan sistem kemasan hidrofobik. Struktur tiga dimensi protein sangat diperlukan
untuk memahami fungsi protein pada tingkat molekul.
Struktur protein bervariasi dalam hal ukuran, dari puluhan hingga ribuan
residu. Protein diklasifikasikan berdasarkan ukuran fisik protein sebagai
nanopartikel (1-100 nm). Sebuah protein dapat mengalami perubahan struktural
reversibel dalam menjalankan fungsi biologisnya. Struktur alternatif protein yang
sama disebut sebagai konformasi.
Struktur tiga dimensi protein mendefinisikan tidak hanya ukuran dan
bentuknya, tapi juga fungsinya. Salah satu karakteristik yang mempengaruhi
fungsi adalah hidrofobisitas protein, yang ditentukan oleh struktur primer dan
sekunder. Sebagai contoh, protein membran. Membran mengandung sejumlah
besar lipid, yang sangat hidrofobik (air dan minyak tidak bercampur). Daerah
pembentuk selaput membran protein biasanya terdiri dari α-heliks, terbuat dari
asam amino hidrofobik. Daerah hidrofobik ini berinteraksi secara menguntungkan
dengan lipida hidrofobik di membran, membentuk struktur membran yang stabil.
Hemoglobin adalah protein terlarut, ditemukan di sitoplasma sel darah
merah sebagai molekul tunggal yang mengikat oksigen dan membawanya ke
jaringan. Pada sel darah, mutasi protein β-globin pada sel darah merah
satu sama lain, menghindari lingkungan berair. Rantai hemoglobin mengubah
bentuk sel darah merah dari putaran ke bentuk sabit, yang menyebabkan sel
terkumpul di pembuluh darah sempit.
Gambar. Struktur Hemoglobin
Lipatan protein memungkinkan interaksi antara asam amino satu sama
lain dalam urutan utama protein. Dalam enzim, beberapa asam amino ini
membentuk sebuah situs dalam struktur yang mengkatalisis reaksi enzimatik.
Situs ini, yang disebut situs aktif enzim, memiliki asam amino yang mengikat
secara khusus molekul substrat, yang juga disebut ligan. Dengan cara yang sama,
situs-situs tertentu dalam protein reseptor sel mengikat molekul ligan spesifik
yang dikenali reseptornya.
Perubahan asam amino satu sama lain dalam urutan primer dapat
menyebabkan perubahan lipat. Ini juga dapat menyebabkan perubahan interaksi
kimia antara asam amino di tempat aktif, yang mengubah aktivitas enzim atau
pengikatan ligan ke protein reseptor. Pengikatan ligan ke tempat yang aktif
membutuhkan asam amino yang spesifik. Oleh karena itu, situs aktif dalam enzim
baru yang termasuk dalam family yang sama dengan enzim yang dikenal biasanya
Program komputer dapat menggunakan informasi dari database enzim yang
diketahui untuk memprediksi lokasi aktif protein baru dengan menggunakan
metode berbasis template, serupa dengan yang dijelaskan di atas untuk
menentukan struktur tiga dimensi protein. Begitu program telah mengidentifikasi
situs pengikat ligan yang potensial, program lain dapat menguji kesesuaian dan
kemampuan mengikat ribuan molekul ligan yang mungkin, bahkan ligan teoritis
yang mungkin belum ada. Ini memiliki kemungkinan besar untuk merancang obat
baru, terutama untuk terapi kanker.
Kompleksitas struktur 3D protein bukanlah satu-satunya kesulitan dalam
mengkarakterisasi protein. Banyak protein mengandung bahan kimia tambahan
yang memodifikasi strukturnya. Struktur akhir protein dapat mencakup sejumlah
modifikasi yang terjadi selama dan setelah sintesis protein pada ribosom.
Modifikasi pasca translasi ini mengubah ukuran dan struktur protein akhir.
Beberapa modifikasi terjadi setelah protein dibuat; Yang lain terjadi selama
penerjemahan protein, dan diperlukan untuk melipat protein dengan tepat. Salah
satu modifikasi yang mungkin dilakukan adalah pembelahan enzimatik
polipeptida asli oleh protease untuk menghasilkan produk yang lebih kecil.
Modifikasi lainnya termasuk penambahan molekul gula ke asam amino tertentu
dalam protein (glikosilasi), atau penambahan gugus fosfat (fosforilasi) atau
kelompok sulfat (sulfasi).
Banyak protein dimodifikasi oleh protease yang menghilangkan peptida
pendek dari kedua ujung protein. Polipeptida yang disingkat kemudian dilipat
menjadi protein aktif. Salah satu celah yang paling umum adalah pemindahan
seluler tertentu dalam proses yang dikenal sebagai pemilahan protein. Contohnya
adalah hormon insulin, yang dibuat sebagai preproinsulin. Setelah menghilangkan
peptida sinyal 24-amino-asam dari preproinsulin untuk membentuk proinsulin,
polipeptida terakhir diproses lebih lanjut dalam retikulum endoplasma. Ini
menghasilkan hormon akhir, insulin, yang dilepaskan dari sel.
Insulin adalah hormon protein, penting untuk menjaga gula darah pada
tingkat yang tepat. Rantai asam amino dalam urutan tertentu (struktur primer)
mendefinisikan protein seperti insulin. Rantai ini dilipat menjadi struktur yang
terdefinisi dengan baik (struktur tersier), dalam hal ini satu molekul insulin
tunggal. Struktur seperti itu berkumpul dengan rantai lain untuk membentuk
susunan seperti kompleks dari enam molekul insulin yang ditunjukkan di ujung
kanan (struktur kuarterner). Susunan ini sering dapat diinduksi untuk membentuk
kristal yang terdefinisi dengan baik, yang memungkinkan penentuan struktur ini
secara rinci.
Beberapa sifat utama memungkinkan protein untuk berpartisipasi dalam
berbagai fungsi:
1. Protein adalah polimer linier yang dibangun dari unit monomer yang disebut
asam amino. Pembangunan beragam makromolekul dari sejumlah bentuk
monomer. Fungsi protein secara langsung bergantung pada struktur tiga
dimensionalnya (Gambar 3.1). Hebatnya, protein secara spontan melipat
menjadi struktur tiga dimensi yang ditentukan oleh urutan asam amino dalam
polimer protein. Dengan demikian, protein adalah perwujudan transisi dari
dunia sekuens satu dimensi ke dunia molekul tiga dimensi yang mampu
Struktur Fungsi Dictates yaitu Komponen protein dari mesin replikasi
DNA mengelilingi bagian heliks ganda DNA. Struktur protein memungkinkan
segmen besar DNA disalin tanpa mesin replikasi yang memisahkan DNA.
2. Protein mengandung berbagai kelompok fungsional. Kelompok fungsional ini
meliputi alkohol, tiol, tioeter, asam karboksilat, karboksiamida, dan berbagai
kelompok dasar. Bila dikombinasikan dalam berbagai urutan, rangkaian
kelompok fungsional ini menjelaskan spektrum fungsi protein yang luas.
Misalnya, reaktivitas kimia yang terkait dengan kelompok ini sangat penting
untuk fungsi enzim, protein yang mengkatalisis reaksi kimia spesifik dalam
sistem biologis.
3. Protein dapat berinteraksi satu sama lain dan dengan makromolekul biologis
lainnya membentuk kompleks majemuk. Protein dalam kumpulan ini dapat
bertindak secara sinergis untuk menghasilkan kemampuan yang tidak diberikan
oleh komponen protein individu (Gambar 3.2). Kumpulan ini termasuk mesin
makro-molekuler yang melakukan replikasi DNA yang akurat, transmisi sinyal
Kumpulan Protein Kompleks, Sebuah mikrograf elektron dari jaringan
penerbangan serangga di bagian melintang menunjukkan susunan heksagonal
dari dua jenis filamen protein.
4. Beberapa protein cukup kaku, sedangkan yang lain menunjukkan fleksibilitas
yang terbatas. Unit kaku dapat berfungsi sebagai elemen struktural dalam
sitoskeleton (perancah internal di dalam sel) atau di jaringan ikat. Bagian
protein dengan fleksibilitas terbatas dapat berperan sebagai engsel, pegas, dan
pengungkit yang sangat penting untuk fungsi protein, perakitan protein satu
sama lain dan dengan molekul lain menjadi unit kompleks, dan pengiriman
informasi di dalam dan antar sel (Gambar 3.3).
Setelah mengikat besi, protein lactoferrin mengalami perubahan
konformasi yang memungkinkan molekul lain membedakan antara bentuk
BAB III
KESIMPULAN DAN SARAN
3.1 Kesimpulan
Adapun kesimpulan dari makalah ini adalah:
1. Protein merupakan makromolekul yang menyusun lebih dari separuh bagian
dari sel. Protein menentukan ukuran dan struktur sel, komponen utama dari
sistem komunikasi antar sel serta sebagai katalis berbagai reaksi biokimia di
dalam sel. Prediksi struktur protein merupakan bagian penting dari ilmu
protein. Pengetahuan struktural sangat penting untuk pemahaman kehidupan
yang lengkap pada tingkat molekuler. Pemahaman tentang struktur protein
dapat menyebabkan derivasi fungsi dan mekanisme aktivitas protein.
2. Fungsi semua protein bergantung pada kemampuannya untuk secara khusus
berinteraksi dengan molekul lain.
3. Protein merupakan komponen penting atau komponen utama sel hewan atau
manusia. Oleh karena, sel itu merupakan pembentuk tubuh kita, maka protein
yang terdapat dalam makanan berfungsi sebagai zat utama dalam
pembentukan dan pertumbuhan tubuh. Untuk dapat melakukan fungsi
biologis, protein melipat ke dalam satu atau lebih konformasi spasial yang
spesifik, didorong oleh sejumlah interaksi non-kovalen seperti ikatan
hidrogen, interaksi ionik, gaya van der Waals, dan sistem kemasan hidrofobik.
Struktur tiga dimensi protein sangat diperlukan untuk memahami fungsi
DAFTAR PUSTAKA
Brown, D.A., dan Rose, J.K., 1992, Sorting of GPI- Anchored Proteins to Glycolipid- Enriched Membrane Subdomain During Transport to the Apical Cell Surface. Jurnal of medicine, 68(3): 533-44.
Elrod, S.L., dan Stansfield, W.D., 2006, Genetika Edisi Keempat, Erlangga, Jakarta.
https://www.learner.org/courses/biology/textbook/proteo/proteo_6.html, diakses pada tanggal, 10 November 2017, Pukul 23.05 WITA.
Iskandar, Y., 1974, Biokimia bagian II, Yayasan Dharma Graha, Tanggerang Selatan.
John, G.S.M., Rose, C., dan Takeuchi, S., 2011, Understanding Tools and Techniques in Protein Structure Prediction, INTECH, Japan.
Klug, W.S., dan Cummings, M.R., 1994, Concepts of Genetics 4th Edition, Prentice hall, Englewood Cliffs.
Sudarmaji, S., dkk, 1989, Analisa Bahan Makanan dan Pertanian, Liberty, Yogyakarta.