BAB 2
TINJAUAN PUSTAKA
2.1 Angiofibroma Nasofaring Juvenile 2.1.1 Anatomi nasofaring
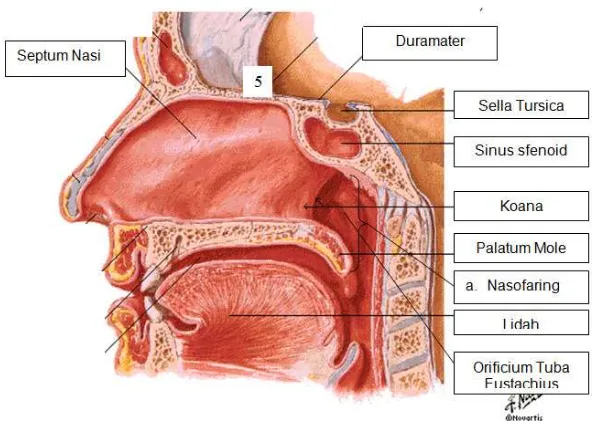
Nasofaring merupakan bagian faring paling atas yang terletak di belakang rongga hidung dan memanjang dari basis kranii hingga palatum molle (Dhingra & Dhingra 2010).
Nasofaring berbentuk seperti kubus dimana bagian anterior berhubungan dengan rongga hidung melalui koana dan tepi belakang septum nasi. Bagian atap nasofaring dibentuk oleh basiosfenoid dan basiocciput. Bagian posterior, dinding nasofaring melengkung ke supero# anterior dan terletak di bawah os spenoid. Pada bagian lateral nasofaring terdapat orificium tuba eustachius dimana bagian orificium ini dibatasi oleh bagian superior dan posterior torus tubarius, sehingga perluasan tumor ke lateral akan menyebabkan gangguan pendengaran (Dhingra & Dhingra 2010).
Nasofaring mendapat suplai darah dari cabang arteri karotis eksterna yaitu arteri faringeal asendens dan desendens, arteri sfenopalatina dan arteri maksilaris eksterna. Nasofaring mendapatkan persarafan dari pleksus faringeus yaitu dari n. glossofaringeus, n. vagus, gangglion servikalis dan cabang pertama n. trigeminus (Dhingra & Dhingra 2010).
2.1.2 Definisi
Angiofibroma nasofaring juvenile (ANJ) merupakan tumor fibrovaskuler nasofaring yang secara histopatologi adalah jinak akan tetapi memiliki kemampuan mendestruksi jaringan sekitarnya yang banyak menyerang laki#laki muda usia 5#25 tahun (Atalar, Solak & Muderris 2006).
2.1.3 Epidemiologi
ANJ berkaitan dengan usia dan jenis kelamin dimana ANJ sering mengenai laki#laki muda dan remaja yaitu dari umur 9#23 tahun sebanyak 98#100% (Boghani et al 2013). Kejadian ANJ mewakili 0,05% dari tumor kepala dan leher. Insidensi ANJ berkisar antara 1: 5.000 # 60.000 pasien Telinga Hidung Tenggorokan (Atalar, Solak & Muderris 2006; Nicolai, Schreiber & Bolzoni 2012).
Anggreani et al. (2011) di RSCM Jakarta dalam penelitiannya menemukan 56 angiofibroma nasofaring pada periode Februari 2001 sampai Oktober 2008 di bagian THT FKUI/RSCM, yang semuanya laki# laki dengan usia antara 9#23 tahun (Anggreani et al. 2011).
2.1.4 Etiologi
dari lamina oksipital embrio, b. Angiofibroma merupakan bentuk lain dari hemangioma, c. Angiofibroma merupakan tipe respon jaringan ikat dari periosteum nasofaring terhadap hamartoma ektopik jaringan vaskular, mungkin dari tipe konka inferior, d. Angiofibroma merupakan jenis spesifik fibromatosis (Antonio et al. 2005).
Faktor ketidakseimbangan hormonal juga banyak dikemukakan sebagai penyebab adanya kekurangan androgen atau kelebihan estrogen. Anggapan ini didasarkan juga atas adanya hubungan erat antara tumor ANJ dengan jenis kelamin dan umur. Banyak ditemukan pada anak atau remaja laki#laki. Itulah sebabnya tumor ANJ disebut juga dengan angiofibroma nasofaring belia (Roezin, Daid & Musa 2007).
Terlepas dari laporan penelitian tentang gangguan hormon pada penderita ANJ dan dijumpainya reseptor androgen atau estrogen pada massa tumor serta peran hormon tersebut dalam perkembangan dan regresi tumor, namun keterlibatan hormonal sebagai penyebab terjadinya ANJ masih tetap menjadi bahan perdebatan. Oleh karena itu penyelidikan ke arah ketidakseimbangan genetik mulai dikembangkan sebagai salah satu etiologi angiofibroma (Nicolai, Schreiber & Bolzoni 2012).
2.1.5 Patogenesis
Ciri umum ANJ adalah tumor yang kaya akan pembuluh darah. Oleh karena itu timbul dugaan adanya partisipasi faktor pertumbuhan angiogenik (angiogenic growth factor) yang dihasilkan oleh sel#sel tumor ANJ itu sendiri dan adanya kerjasama dengan reseptor androgen, berperan penting terhadap pertumbuhan pembuluh darah dan proliferasi sel tumor, ikut serta dalam proses patogenesis tumor walaupun mekanismenya belum dapat dijelaskan secara pasti. Yang termasuk faktor pertumbuhan angiogenik tersebut adalah vascular endothelial growth factor (VEGF), basic fibroblast growth factor (bFGF), transorming growth factor β1 (TGF β1), platelet derived growth factor (PDGF), insulin like growth factor (IGFs) dan nerve growth factor (NGF) (Gleeson 2008; Coutinho, Brentani & Nagai 2008).
Beberapa penelitian lain menunjukkan sejumlah perubahan kromosom pada pasien ANJ. Penambahan pada kromosom 4,6,8 dan X serta kehilangan kromosom 17, 22 dan Y merupakan kelainan kromosom yang sering ditemukan (Nicolai, Schreiber & Bolzoni 2012). Perubahan yang terjadi pada kromosom#kromosom tersebut diduga meningkatkan aktivitas gen yang mengatur pertumbuhan dan differensiasi sel (oncogen) dan mengurangi aktivitas gen yang menghambat pertumbuhan (tumor suppresor genes). Akan tetapi gen mana yang akan menjadi target penambahan atau kehilangan kromosom sampai saat ini masih belum dapat diketahui dengan pasti (Coutinho, Brentani & Nagai 2008).
Kecenderungan peningkatan prevalensi ANJ pada pasien dengan
nasofaring berkembang pada laki#laki remaja (Nicolai, Schreiber & Bolzoni 2012).
2.1.6 Diagnosis
Diagnosis ANJ ditegakkan berdasarkan anamnesis, pemeriksaan rinoskopi anterior dan endoskopi hidung ditambah dengan pemeriksaan radiologi (Panda, Gupta, Sharma 2012 & Gupta; Gleeson 2008). CT scan dan MRI sangat membantu untuk menunjukkan lokasi lesi, perluasan intrakranial atau infratemporal dan membedakan tumor dengan organ penting sekitarnya (Panda, Gupta, Sharma 2012 & Gupta; Gleeson 2008). Gejala klinis yang khas untuk ANJ adalah sumbatan hidung unilateral yang progresif (80#90%) disertai dengan rinorea dan epistaksis berulang (45#60%). Apabila gejala klinis di atas mengenai remaja laki#laki, maka dapat dicurigai sebagai ANJ (Nicolai, Schreiber & Bolzoni 2012). Gejala dan tanda dapat dirasakan dan diketahui oleh penderita setelah massa tumor berkembang beberapa bulan bahkan bertahun#tahun. Terkadang ada keterlambatan 6#7 bulan antara serangan awal gejala sampai penderita mencari pengobatan (Gleeson, 2008). Sakit kepala (25%) dan nyeri wajah terjadi akibat sekunder dari sumbatan sinus paranasal. Gangguan fungsi tuba Eusthacius dapat menyebabkan otitis media unilateral. Perluasan tumor ke rongga sinonasal dapat mengakibatkan rinosinusitis kronis. Perluasan ke rongga orbita menyebabkan proptosis dan gangguan visus. Pipi bengkak, gangguan neurologis dan gangguan penciuman juga dapat terjadi (Nicolai, Schreiber & Bolzoni 2012; Gleeson 2008).
mendorong palatum mole ke arah inferior (Nicolai, Schreiber & Bolzoni 2012).
Pemeriksaan penunjang CT scan merupakan pemeriksaan pre#operatif untuk melihat perluasan tumor, destruksi tulang, foramen dan fissure basis kranii yang melebar dan invasi tulang sfenoid. CT scan dilakukan dengan potongan aksial dan koronal tipis. Padas pemeriksaan MRI dapat membedakan antara tumor dan jaringan lunak sekitarnya. Dengan MRI, ANJ tampak seperti massa heterogen dengan tanda hampa yang sesuai dengan tumor kaya pembuluh darah (Atalar, Solak & Muderris 2006). Diagnosis ANJ dikonfirmasi melalui angiografi. Pemeriksaan angiografi bertujuan menilai sumber pembuluh darah tumor sekaligus sebagai terapi, karena embolisasi sumber pembuluh darah tumor dapat dilakukan pada waktu yang bersamaan. Gambaran khas ANJ pada angiografi adalah adanya gambaran “Tumor Blush” dan tidak adanya “venous filling”. Suplai darah utama terhadap tumor adalah dari arteri maksilaris interna ipsilateral dengan tambahan dari cabang arteri karotis interna atau arteri karotis eksterna kontralateral (Panda, Gupta & Sarma 2012).
Biopsi melalui kavum nasi merupakan kontraindikasi karena dapat menyebabkan perdarahan yang sulit dihentikan. Pemeriksaan histopatologi jaringan tumor paska operasi dilakukan untuk memastikan jenis jaringan sebagai suatu angiofibroma (Gleeson 2008).
2.1.7 Histopatologi
otot polos/serat elastik sehingga perdarahan masif bisa terjadi pada penderita ANJ (Fatih, Ari & Yuca 2010; Gleeson 2008).
2.1.8 Stadium
Stadium ANJ ditetapkan berdasarkan perluasan tumor yang ditentukan dari CT scan. Ada beberapa sistem penetapan stadium ANJ dan yang paling sering dipakai adalah stadium menurut Fisch (Alecio, Fabiano & Ramina 2011).
a. Menurut Fisch (Bareto et.al 2013) I
II
III
IV
Tumor terbatas pada nasofaring, destruksi tulang tak berarti atau terbatas pada foramen sfenopalatina.
Tumor menginvasi fossa pterigopalatina atau sinus maksilaris, etmoidalis atau sfenoidalis dengan destruksi tulang.
Tumor menginvasi fossa infratemporal dan regio orbita A. Tanpa keterlibatan intrakranial
B. Dengan keterlibatan ekstradural intrakranial parasellar Tumor intradural intrakranial
A. Tanpa infiltrasi sinus kavernous, fossa hipofise atau khiasma optikum
B. Dengan infiltrasi sinus kavernosa, fossa hipofise atau khiasma optikum
b. Menurut Radkowski (Alecio, Fabiano & Ramina 2011) Ia
Terbatas pada nares posterior dan/atau nasofaring
Meliputi nares posterior dan/atau nasofaring dengan keterlibatan minimal salah satu sinus paranasal
Perluasan minimal ke arah lateral ke fossa pterigomaksila Menempati penuh fossa pterigomaksila dengan atau tanpa menimbulkan erosi tulang#tulang orbita
Perluasan ke arah fossa infratemporal atau perluasan ke arah posterior yaitu lamina pterigoid
Erosi dasar tengkorak (fossa kranial media/dasar pterigoid) – perluasan intrakranial minimal
c. Menurut Andrews (Alecio, Fabiano & Ramina 2011) I Tumor terbatas pada kavum nasi dan nasofaring
II Tumor meluas ke fossa pterigoidpalatina, sinus maksilaris, sinus sfenoidalis, atau sinus etmoidalis
IIIa Perluasan ke orbita atau fossa infratemporal, tanpa perluasan intrakranial
IIIb Stadium IIIa dengan keterlibatan sedikit ekstradural intrakranial (paraselar)
IVa Perluasan ekstradural intrakranial yang banyak atau perluasan intradural
IVb Perluasan ke sinus kavernous, hipofise atau kiasma optikum
d. Menurut Chandler (Kolegium 2008; Alecio, Fabiano & Ramina 2011) I Tumor terbatas pada nasofaring
II Tumor meluas ke kavum nasi atau sinus sfenoidalis
III Tumor meluas ke dalam sinus maksilaris, sinus etmoidalis, fossa pterigopalatina dan fossa infratemporalis. Perluasan ke orbita atau fossa infratemporal, tanpa perluasan intrakranial IV Tumor meluas ke intrakranial
e. Menurut Modifikasi Sessions (Alecio, Fabiano & Ramina 2011) IA Tumor terbatas pada hidung dan/atau nasofaring
IB Tumor meluas ke ≥ 1 sinus
IIA Perluasan minimal ke fossa pterigomaksila
IIB Mengisi penuh fossa pterigomaksila dengan atau tanpa erosi tulang orbita
IIC Meliputi fossa infratemporal dengan atau tanpa pipi atau ke posterior ke lamina pterigoid
IIIA Erosi basis kranii – intrakranial minimal
IIIB Erosi basis kranii – intrakranial luas dengan atau tanpa sinus kavernosa
2.1.9 Diagnosis banding
ganas seperti karsinoma nasofaring, limfoma atau rhabdomyosarcoma (Fatih, Ari & Yuca 2010).
2.1.10 Penatalaksanaan a. Embolisasi
Tindakan embolisasi sebelum operasi ANJ masih kontroversial. Sebagian ahli bedah menganggap penting, tetapi yang lain berpandangan kurang tepat atau sebetulnya tidak setuju. Hal ini dikarenakan pada tumor ukuran kecil dengan suplai darah bisa diprediksi, perdarahan dapat dikontrol dengan mudah saat operasi. Dalam kasus ini embolisasi tidak diperlukan. Akan tetapi pada tumor ukuran besar yang memperoleh aliran darah dari berbagai pembuluh darah lain seperti dari cabang arteri karotis eksterna dan interna, embolisasi diperlukan (Gleeson 2008).
b. Pembedahan
Penatalaksanaan gold standar ANJ adalah pembedahan. Pendekatan operasi terbuka merupakan pilihan sebelum teknik operasi endoskopi berkembang. Pemilihan pendekatan operasi ditentukan setelah pemeriksaan radiologi yaitu berdasarkan perluasan tumor, suplai darah, dan ada atau tidaknya perluasan intrakranial (Panda, Gupta & Sarma, 2012).
Kombinasi pendekatan intrakranial dan ekstrakranial mungkin diperlukan. Pemilihan pendekatan operasi tergantung pada kemampuan pemaparan yang cukup baik dari massa tumor dan jaringan sekitarnya, mampu mengendalikan perdarahan, tidak mengganggu pertumbuhan tulang kraniofasial terutama pada penderita lebih muda, tidak meninggalkan luka parut atau deformitas wajah jika mungkin dan kemampuan operator (Persky & Manolidis, 2014).
Pendekatan teknik operasi angiofibroma antara lain : transpalatal, rinotomi lateral, degloving midfacial, transmaksilaris, pendekatan Denker, fossa infratemporalis dan kombinasi operasi terbuka dengan teknik endoskopi (Dhingra & Dhingra, 2010).
c. Radioterapi
d. Terapi Hormonal
Terapi hormonal telah dikembangkan sebagai terapi adjuvant. Beberapa penelitian telah melaporkan penambahan ukuran tumor ANJ dengan pemberian testosteron dan penyusutan setelah pemberian terapi estrogen. Flutamide methyl n propanamide merupakan non#steroid androgen antagonist (NSAA) oral, yang dapat menekan kadar gonadotropin atau testosteron. Gates et.al mengamati reduksi ukuran tumor sampai 44% setelah mendapat pengobatan hormonal selama 6 minggu. Rekomendasi terbaru, flutamide diberikan selama 6 minggu sebagai terapi adjuvan pada pasien post#pubertas. Bertujuan untuk menyusutkan volume tumor dan memudahkan eksisi tumor (Panda, Gupta & Sarma 2012).
Thakar et al. (2011) di India dalam penelitiannya mengenai pemberian terapi Flutamide pada penderita ANJ selama 6 minggu sebelum operasi menunjukkan regresi tumor parsial dari jaringan sekitarnya sehingga memudahkan pembedahan dan mengurangi angka kesakitan. Respon paling tinggi ditunjukkan oleh penderita setelah pubertas dibandingkan sebelum pubertas (Thakar et al. 2011).
2.1.11 Komplikasi
Komplikasi ANJ yang paling sering adalah kekambuhan. Kekambuhan terjadi pada 25% pasien tanpa memperhatikan metode pendekatan operasinya. Hal ini dikarenakan eksisi tumor yang tidak sempurna. Komplikasi lain yang bisa terjadi antara lain krusta hidung, fistel oronasal, dura terpapar, perdarahan sinus kavernosus, meningitis, anosmia dan jaringan parut (Panda, Gupta & Sarma 2012).
2.1.12 Kekambuhan
diperlukan diagnosa dini dan penatalaksanaan yang lebih baik (Moorthy, Ranagatha, Abdul, Madhira & Kolloju 2010).
Persky & Manolidis (2014) dalam penelitiannya menyebutkan kekambuhan ANJ berhubungan dengan perluasan tumor ke fossa infratemporal, sinus sfenoidalis, dasar dari pterigoid, sinus cavernosus foramen lacerum dan intrakranial (Persky & Manolidis, 2014).
2.1.13 Prognosis
Prognosis lebih baik bila diagnosis ANJ lebih dini dan tidak dijumpai perluasan ke intrakranial (Fatih, Ari & Yuka, 2010). Regresi spontan bisa terjadi akan tetapi sangatlah jarang. Angka kekambuhan berkisar 6% # 60%. Kekambuhan dapat terjadi pada 3#4 bulan setelah pembedahan (Atalar, Solak & Muderris, 2006).
2.2 Hormon Estrogen
Hormon estrogen merupakan hormon steroid kelamin. Hormon ini mempunyai struktur kimia berintikan steroid dan secara fisiologik sebagian besar diproduksi oleh kelenjar endokrin sistem reproduksi wanita. Pria juga memproduksi estrogen tetapi jumlahnya jauh lebih sedikit (Suherman 2007; Sherwood 2011).
2.2.1 Biosintesis
Estrogen disintesis dari androstenedion dan testosteron secara langsung dengan bantuan enzim aromatase melalui 3 langkah proses aromatisasi cincin A. Aktivitas ini dilakukan diberbagai sel yaitu di granulosa ovarium, sel Sertoli dan kelenjar Leydig testis, stroma jaringan adiposa, sinsitiotropoblas plasenta, tulang dan beberapa tempat di otak (Loose & Stancel 2006; Suherman 2007).
testis dan di luar testis. Di luar testis, estrogen dihasilkan dari hasil aromatisasi C19 steroid (di sirkulasi) dan berasal dari androstenedion dan
dehidroepiandrosteron (dari korteks adrenal), yang merupakan estrogen paling banyak di sirkulasi (Loose & Stancel 2006; Suherman 2007).
Estrogen dapat dihasilkan dari androgen melalui proses aromarisasi atau dari hidrolisis estrogen terkonjugasi. Estrogen juga dapat dihasilkan dari androgen melalui proses aromatisasi sistem saraf pusat dan jaringan lain dan efek kerja estrogen tampak di dekat tempat hormon tersebut diproduksi (Loose & Stancel 2006; Suherman 2007).
2.2.2 Fisiologis
Estrogen sangat penting peranannya pada perubahan bentuk dan fungsi tubuh pada masa pubertas anak perempuan menjadi bentuk tubuh yang karakteristik untuk wanita dewasa yaitu fungsi seks sekunder. Estrogen berperan pada pembentukan kontur tubuh, skelet dan tulang panjang pada masa pubertas dan diakhiri dengan fusi epifisis serta pertumbuhan rambut aksila dan pubis (Loose & Stancel 2006; Suherman 2007).
Estrogen juga memiliki peran penting dalam perkembangan laki#laki. Pada anak laki#laki defisiensi estrogen dapat menyebabkan kecepatan pertumbuhan pubertas berkurang dan maturasi skletal dan penutupan epifisis lambat sehingga pertumbuhan linier berlanjut sampai dewasa (Loose & Stancel 2006; Suherman 2007).
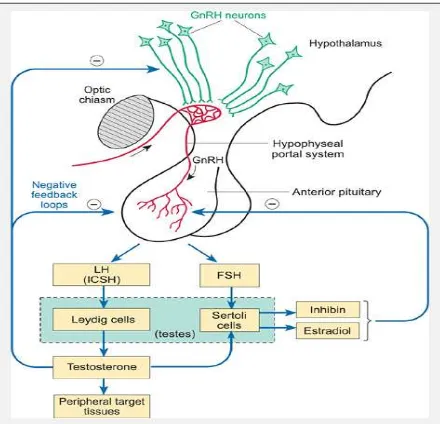
Pada wanita, siklus haid diatur oleh sistem neuroendokrin hipotalamus# hipofisis#ovarium. Suatu osilator neuronal di hipotalamus secara periodik akan menginduksi pengeluaran gonadotropin releasing hormone (GnRH) ke pembuluh portal hipotalamus#hipofisis yang akan merangsang sekresi
meningkat, akan menghambat sekresi hormon hipotalamus dan hipofisis (Loose & Stancel 2006; Suherman 2007).
Pada laki#laki, testosteron berfungsi untuk mengatur aksis hipotalamus# hipofisis#testis pada level hipotalamus dan hipofisis dan negatif feedback
dimediasi oleh estrogen yang dibentuk melalui aromatisasi (Loose & Stancel 2006). Gonadotrophin releasing hormone (GnRH) dari hipotalamus disekresikan ke hipotalamus anterior sehingga hipofisis mensekresi follicle stimulating hormone (FSH) dan luteinizing hormone
(LH) ke sirkulasi sistemik. LH berperan terutama pada sel Leydig testis untuk menghasilkan hormon testosteron sedangkan FSH berperan terutama di sel Sertoli testis sehingga melepaskan androgen binding protein dan hormon inhibin. LH juga memicu sintesis komplek aromatase yang bertanggung jawab mengubah testosteron menjadi estradiol. Pada akhirnya, testosteron dapat menghambat sekresi LH menggunakan mekanisme negative feedback pada level hipofisis dan hipotalamus. Pada waktu bersamaan inhibin dan estradiol menekan sekresi FSH melalui mekanisme yang sama. Sehingga kadar hormon LH, FSH dan hormon androgen relatif konstan (Gambar 2) (Pocock & Richards 2006).
2.2.3 Efek metabolik
Estrogen mempunyai efek metabolik dan dapat mempengaruhi banyak jaringan pada manusia. Secara umum estrogen mempunyai efek terhadap pembentukan tulang, metabolisme lemak dan protein serum serta terhadap faktor koagulasi (Loose & Stancel 2006; Suherman 2007).
Pada pembentukan tulang efek estrogen sangat menguntungkan, karena mengurangi proses resorbsi kalsium tulang. Tulang secara terus# menerus mengalami remodeling karena adanya osteoklas yang menyebabkan resorbsi dan osteoblas yang membentuk tulang. Osteoklas dan osteoblas mempunyai ER#α dan ER#β serta reseptor androgen dan progesteron. Hormon estrogen menginduksi apoptosis osteoklas dan mengantagonis efek osteoklastogenik dan pro#osteoklastik hormon paratiroid dan interleukin#6. Efek utama estrogen adalah menurunkan jumlah dan aktivitas osteoklas, menyebabkan pertumbuhan tulang dan penutupan epifisis pada wanita dan pria (Loose & Stancel 2006; Suherman 2007).
Efek estrogen terhadap metabolisme lemak secara umum, yaitu meningkatkan trigliserida dan sedikit menurunkan kolesterol total plasma. Akan tetapi efek yang penting, yaitu meningkatkan high density lipoprotein
(HDL) dan menurunkan low density lipoprotein (LDL). Dalam hal ini perubahan dalam metabolisme lemak tersebut berhubungan dengan timbulnya penyakit kardiovaskular (Loose & Stancel 2006; Suherman 2007).
Estrogen sedikit meningkatkan faktor koagulasi VII dan XII dan menurunkan faktor#faktor antikoagulasi protein C, protein S dan antitrombin III (Loose & Stancel 2006; Suherman 2007).
Estrogen juga menginduksi pertumbuhan sel endotel dan menghambat proliferasi sel otot polos pembuluh darah (Loose & Stancel 2006; Suherman 2007).
2.2.4 Reseptor estrogen
Reseptor estrogen adalah reseptor hormon steroid yang pertama kali dikenali, merupakan anggota dari superfamili protein inti dan merupakan reseptor intraselular yang berfungsi sebagai regulator transkripsi yang tergantung hormon. Reseptor estrogen ini menjalankan fungsinya melalui aktiviasi kedua reseptornya, yaitu reseptor estrogen α (ER#α) dan reseptor estrogen β (ER#β) (Jensen 2005; Montag, Tretiakova & Richardson 2006; Morani, Warner & Gustafsson 2008). ER#α dan ER#β terletak pada lokus kromatin yang berbeda, yaitu pada 6q25.1 untuk ER#α dan 14q23.2 untuk ER#β (Montag, Tretiakova & Richardson 2006). ER#α dan ER#β juga mempunyai distribusi jaringan yang berbeda. ER#α kebanyakan ditemukan di traktus reproduksi wanita (khususnya di uterus, vagina dan ovarium), kelenjar payudara, hipotalamus serta sel endotel dan otot polos pada dinding pembuluh darah. Sementara ER#β banyak ditemukan paling banyak di prostat dan ovarium dan dengan jumlah lebih sedikit juga ditemukan di paru, otak dan sel endotel pembuluh darah (Loose & Stancel 2006). Pada jaringan tersebut di atas ER#β terlibat dalam proses fisiologi yang penting seperti pada differensiasi sel, pembentukan matriks ekstraselular serta hubungan antara sel epitel dan stroma. Pada jaringan yang mengandung kedua reseptor, yaitu ER#α dan ER#β, tampaknya memiliki efek yang saling berlawanan satu sama lain. Pada uterus dan kelenjar payudara, tampaknya ER#α memiliki fungsi meningkatkan proliferasi, sedangkan ER#β dapat meningkatkan proses apoptosis
payudara, kehilangan ER#β atau rasio perbandingan ER#β/ER#α rendah, dapat meningkatkan risiko terjadinya kanker payudara. Begitu juga yang terjadi pada prostat, ER#β tampaknya dapat menghambat proliferasi dan kehilangan ER#β dapat mengakibatkan terjadinya kanker prostat dan high grade dysplasia prostat (Montag, Tretiakova & Richardson 2006). Secara umum reseptor hormon estrogen memiliki struktur yang serupa dengan reseptor hormon steroid yang lain, terdiri dari sejumlah domain
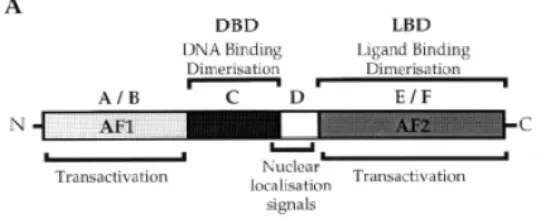
fungsional bebas. Semua reseptor estrogen tersusun dari :1) domain N terminal (A/B) yang mengandung daerah transaktivasi AF#1, 2) DNA binding domain (DBD), 3)daerah hinge yang fleksibel (D) dan 4)C terminal ligand binding domain (LBD,E) yang mengandung daerah transaktivasi AF#2. Khususnya pada reseptor estrogen α (ER#α) memiliki domain tambahan yaitu domain F C terminal (White & Parker 1998; Griekspoor et al. 2007).
Gambar 2.2.4. Struktur reseptor hormon steroid (White & Parker 1998).
2.2.5 Mekanisme kerja
dengan bantuan protein koregulator terjadilah proses transkripsi (Griekspoor 2007) sehingga afinitas dan kecepatan pengikatannya pada DNA meningkat. Reseptor estrogen akan terikat estrogen response element (EREs) di gen target (Suherman 2007).
2.2.6 Farmakokinetik
Berbagai jenis estrogen dapat diberikan oral, parenteral, transdermal ataupun topikal. Karena sifat lipofiliknya, absorbsi per oral adalah baik. Umumnya etinilestradiol, conjugated estrogen, ester estron, dietilstilbestrol
diberikan secara oral. Estradiol oral diabsorbsi dengan cepat dan lengkap dan mengalami metabolisme di hepar (Suherman 2007).
Di dalam darah, sebagian besar hormon estrogen terikat kuat dengan
sex steroid binding globulin (SSBG), sebagian lagi berikatan kuat dengan albumin dan sebagian kecil terdapat dalam keadaan bebas (Suherman 2007).
2.2.7 Efek samping
Efek samping estrogen yang paling sering timbul adalah mual, muntah, rasa kembung, edema dan berat badan bertambah. Kadang#kadang disertai pusing, kloasma kulit wajah, peningkatan tekanan darah dan trombosis (Suherman 2007).
Pada penderita ANJ yang diberikan terapi estrogen sebelum operasi dapat timbul efek samping berupa feminisasi (Gleeson, 2008;Thakar et al 2011).
2.3 Peran Hormon Estrogen Terhadap ANJ
menginduksi regresi tumor preoperasi sehingga mengurangi kehilangan darah saat operasi. Secara histopatologi pasca operasi, dimana sebelumnya mendapat terapi estrogen menunjukkan perubahan pada struktur pembuluh darah dan stroma dengan sklerotik pada jaringan tumornya (Schick et al. 2014). Belum jelas apakah efek estrogen terjadi akibat penekanan langsung terhadap tumor atau sekunder penurunan kadar gonadotropin dan testosteron (Thakar et al. 2011).
Seperti yang diketahui bahwa estrogen merupakan antiandrogen alami yang memiliki peran antagonis terhadap testosteron. Pemberian estrogen pada pasien ANJ dapat menekan sekresi gonadotropin dari hipofisis dan pada akhirnya menekan sekresi testosteron (Loose & Stancel 2006) Walaupun mekanisme kerja pemberian estrogen pada ANJ belum diketahui dengan jelas, namun beberapa ahli telah melakukan penelitian mengenai keberadaan reseptor estrogen pada ANJ sehubungan dengan berkurangnya ukuran tumor setelah pemberian terapi tersebut. Pemeriksaan untuk menentukan keberadaan reseptor estrogen telah secara rutin dilakukan sejak tahun 1970, meskipun metode yang digunakan terus mengalami perubahan. Pada awalnya pemeriksaan dilakukan berdasarkan metode ligand binding, radioligand binding atau
fluorescent hormone binding. Akan tetapi pada tahun 1980, metode# metode tersebut digantikan dengan metode yang menggunakan antibodi monoklonal atau poliklonal dan dikenal dengan pemeriksaan imunohistokimia (Coutinho, Brentani & Nagai 2008)
positif kuat terhadap reseptor androgen, sehingga menduga bahwa ANJ kemungkinan suatu tumor tergantung androgen (Coutinho, Brentani & Nagai 2008).
Hwang et al. seperti yang dikutip Coutinho, Brentani & Nagai (2008) memperoleh bukti langsung mengenai keberadaan reseptor androgen pada 18 dari 24 kasus ANJ dengan menggunakan pemeriksaan imunohistokimia. Pada pemeriksaan ini didapatkan reseptor androgen terdapat pada stroma dan sel endotel pembuluh darah. Untuk reseptor estrogen tidak ditemukan sama sekali pada semua kasus dan hanya pada 2 kasus saja reseptor progesteron ditemukan (Coutinho, Brentani & Nagai).
Gatalica (1998) dalam penelitiannya terhadap reseptor estrogen, progesteron dan androgen pada 8 kasus ANJ dengan menggunakan antibodi monoklonal, ternyata tidak dijumpai reseptor estrogen maupun progesteron. Sedangkan pada semua kasus terdapat ekspresi reseptor androgen dengan jumlah yang sangat sedikit, yaitu kurang dari 5% jika dibandingkan dengan kontrolnya yaitu adenokarsinoma prostat dan hiperplasia prostat jinak (Gatalica 1998).
Saylam et al. (2005) di Universitas Of Hacettepe, meneliti 27 pasien ANJ yang seluruhnya berjenis kelamin laki#laki dengan rentang usia antara 10 hingga 34 tahun mengenai keberadaan reseptor estrogen dan progesteron dengan menggunakan antibodi monoklonal. Dua dari 27 pasien menunjukkan adanya ekspesi reseptor estrogen, sementara 9 dari 27 pasien menunjukkan adanya ekspresi reseptor progesteron. Ekspresi reseptor estrogen dan progesteron yang rendah pada penelitian ini kurang mendukung indikasi adanya pengaruh hormon kelamin pada ANJ (Saylam et.al 2005).
nasofaring. Hasil yang diperoleh adalah semua kasus positif untuk ER#β yang terdapat pada stroma dan sel endotel pembuluh darah, namun tidak didapatkan adanya ekspresi ER#α dan reseptor progesteron pada semua kasus. Sementara pada 5 kasus menunjukkan ekspresi reseptor androgen yang positif lemah dan terutama terdapat pada stroma. Penemuan ini membuktikan bahwa memang terdapat ekspresi reseptor estrogen β pada ANJ sehingga dapat menjadi dasar penelitian lebih lanjut mengenai pemberian terapi hormonal pada tumor ini (Montag, Tretiakova & Richardson 2006).
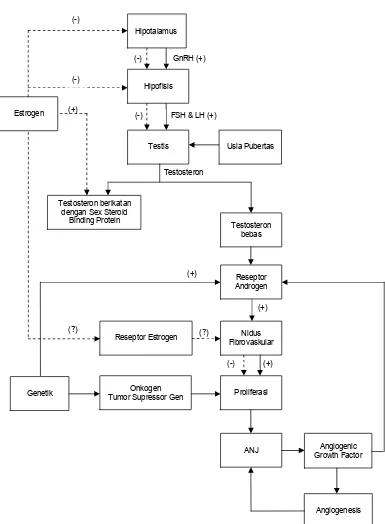
2.4 Kerangka Teori
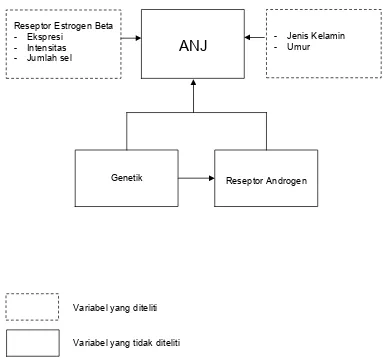
2.5 Kerangka Konsep
Kerangka konsep penelitian dapat dilihat pada gambar dibawah ini.
`
Variabel yang diteliti
Variabel yang tidak diteliti
Gambar 2.5. Kerangka konsep penelitian.
ANJ
Reseptor Estrogen Beta # Ekspresi
# Intensitas # Jumlah sel
Reseptor Androgen Genetik