I. PENDAHULUAN UMUM
A. Latar BelakangKecenderungan pemakaian bahan alam terutama tumbuh-tumbuhan sebagai obat-obatan semakin meningkat, karena mahalnya obat sintetik dan berbagai efek sampingnya yang merugikan. Berbagai penelitian telah membuktikan bahwa tanaman menghasilkan senyawa aktif yang berkhasiat sebagai obat.
Diantara senyawa aktif yang dihasilkan oleh tanaman diantaranya protein bioaktif, yang biasanya digunakan sebagai protein pertahanan bagi tanaman penghasilnya. Protein bioaktif tersebut diekspresikan pada berbagai organ dan jaringan, misalnya peptida antimikroba Snakin-1 (SN1) dari umbi kentang. Snakin mempunyai aktivitas anti bakteri dan anti jamur, menyebabkan agregasi pada bakteri gram negatif dan gram positif (Segura et al. 1999). Protein anti jamur, misalnya protein PR-5 dari daun labu (Cucurbita sp.) dan protein PR-5d dari daun serta akar tembakau. Keduanya mempengaruhi permiabilitas membran plasma, sehingga menyebabkan kebocoran membran dan keluarnya material intraseluler dari organisme target (Cheong et al. 1997; Koiwa et al. 1997). Protein antivirus dari akar Bougainvillea spectabilis (BAP 1) menunjukkan aktivitas penghambatan sintesis protein secara in vitro (Balasaraswati et al. 1998). Protein anti virus MAP 30 dari biji Momordica charanthia dan GAP 31 dari Gelonium multiflorum. Kedua protein tersebut menghambat infeksi virus HIV-1 dan perkembangbiakan virus pada sel yang sudah terinfeksi dengan menghambat HIV-integrase dan menonaktifkan topologi HIV-LTR (Huang et al. 1999). Protein penginaktivasi ribosom (ribosom inactivating protein = RIPs), menghambat sintesis protein pada organisme lain. RIPs bekerja dengan memotong N-glikosida pada Subunit besar ribosom pada situs spesifik, akibatnya ribosom tidak dapat berinteraksi dengan faktor elongasi, sehingga menghambat perpanjangan rantai polipeptida (Endo et al. 1987; Jensen et al. 1999).
Protein bioaktif menarik perhatian para peneliti karena dapat dikembangkan potensinya sebagai senyawa toksik pada imunotoksin. Protein dikonjugasikan dengan antibodi untuk mengenali sel target, sehingga tidak menyerang sel lainnya. Imunotoksin digunakan untuk perlakuan penyakit penting pada manusia seperti kanker, AIDS dan penyakit degeneratif (Minami et al. 1992; Girbes et al. 1993).
Protein bioaktif yang telah digunakan dalam imunotoksin antara lain protein antivirus dari daun dan biji Phytolaca americana (PAP). PAP termasuk kelompok protein penginaktivasi ribosom, yang dapat menahan serangan virus pada tanaman maupun manusia seperti virus influenza, herpes simplek, polio dan HIV-1. PAP dikonjugasikan dengan antibodi TXU (anti CD7) menjadi TXU-PAP untuk perlakuan sel yang terinfeksi HIV. Konjugat TXU-PAP sangat efektif dalam menghambat perkembangbiakan HIV-1 in vitro, efisiensi pengham-batannya meningkat 400 kali dibanding dengan PAP, selain itu tidak toksik terhadap sel-T (Anonym, 1998).
Untuk mendapatkan protein dari tanaman dapat diperoleh dengan mengekstrak langsung tanaman yang berasal dari lapang, atau melalui kultur in vitro. Keuntungan dari kultur in vitro adalah kultur dalam kondisi aseptik, lingkungan tumbuh dapat diatur, dan waktu relatif pendek. Kultur in vitro yang sering dilakukan untuk memproduksi suatu metabolit adalah kultur sel dan kultur organ. Kendala yang sering terjadi antara lain pada tingkat sel seringkali metabolit yang diinginkan tidak terbentuk, atau terbentuk tetapi jumlahnya sangat kecil. Sedangkan untuk menjaga kelangsungan pertumbuhan sel atau jaringan diperlukan zat pengatur tumbuh (ZPT). Pemberian ZPT pada suatu kultur secara terus menerus dalam waktu lama dapat mengubah komposisi genetik sel, dan berpengaruh terhadap pertumbuhan dan kestabilan metabolit yang dihasilkan (Baiza et al. 1999).
Kultur in vitro yang lebih menjanjikan adalah kultur akar rambut (hairy root) melalui bantuan Agrobacterium rhizogenes yang mampu mentransfer sebagian materi genetiknya (T-DNA) ke genom tanaman. Ekspresi T-DNA dari plasmid Ri (root inducing) mengakibatkan tumbuhya akar adventif dari tempat infeksi. Keunggulan kultur akar rambut adalah akar dapat tumbuh dan berkembang tanpa pemberian ZPT, karena terintegrasinya T-DNA dalam genom. Oleh karenanya dapat menurunkan biaya produksi dan mempunyai kestabilan genetik tinggi, sehingga pertumbuhan kultur serta metabolit yang diproduksi juga lebih stabil.
Uji pendahuluan aktivitas protein dilakukan dengan uji kematian larva udang (brine shrimp lethality test) menggunakan larva Artemia salina mengikuti metode Meyer (1982). Menurut Hostettmann (1991) metodenya sederhana,
bahannya mudah didapat, relatif murah, perlu waktu singkat, dan mempunyai korelasi positif dengan pengujian sitotoksisitas pada 3PS (P-388 murine leukemia in vivo).
Uji selanjutnya menggunakan galur sel kanker in vitro untuk mengetahui aktivitas protein dalam menghambat proliferasi sel kanker. Uji in vitro menggunakan kultur sel dapat mengamati secara langsung pengaruh protein terhadap viabilitas sel (Wilson, 1992). Uji in vitro sering dilakukan sebelum melangkah ke uji in vivo karena lebih ekonomis dan cepat.
Kanker adalah salah satu penyakit yang mendapat perhatian besar dalam ilmu kedokteran. Dengan perubahan pola hidup serta tingginya polusi, penderita kanker semakin meningkat jumlahnya dari tahun ke tahun. Berbagai pengobatan untuk penanggulangan penyakit kanker telah dilakukan, namun karena mahalnya biaya pengobatan dan dampak sampingnya yang berat semakin banyak dicari obat alternatif dari alam antara lain tumbuh-tumbuhan.
B. Tujuan Penelitian Tujuan Umum
Penelitian ini bertujuan untuk mendapatkan bagian tanaman dari tiga spesies Cucurbitaceae yaitu B. hispida (Thunb.) Cogn, Coccinia grandis (L.) Voigh.dan T. cucumirena L. var anguina (L.) Haines, dan kultur akar rambut dari bagian tanaman terpilih yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi serta dapat menghambat proliferasi galur sel kanker in vitro.
Tujuan Khusus
1. Mendapatkan informasi dari bagian tanaman, yaitu akar, buah dan biji dari tiga spesies Cucurbitaceae yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi dan BM 20-40 kDa.
2. Mendapatkan kultur akar rambut dari spesies terpilih yang dapat tumbuh dan berkembang dengan stabil dalam medium tanpa zat pengatur tumbuh dan menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi.
3. Mendapatkan protein bioaktif dari dari bagian tanaman dan kultur akar rambut terpilih yang dapat menghambat proliferasi galur sel kanker.
1. A. rhizogenes mampu mentrasfer T-DNA ke genom tanaman T. cucumirena L. var anguina (L.) Haines), sehingga dihasilkan kultur akar rambut yang dapat tumbuh dan berkembang dalam medium tanpa zat pengatur tumbuh.
2. Terdapat bagian tanaman dan kultur akar rambut yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi serta mempunyai BM 20-40 kDa.
3. Terdapat fraksi protein bioaktif asal tanaman dari lapang dan akar rambut yang dapat menghambat proliferasi secara spesifik terhadap galur sel kanker in vitro.
D. Manfaat Penelitian Dari penelitian ini diharapkan :
1. Mendapatkan metode induksi dan pemeliharaan kultur akar rambut untuk memproduksi protein bioaktif dengan rendemen dan aktivitas tinggi. 2. Mendapatkan informasi tentang bagian tanaman atau kultur akar rambut
yang menghasilkan protein bioaktif yang dapat menghambat proliferasi sel kanker.
3. Meningkatkan nilai ekonomis dari beberapa spesies Cucurbitaceae dari kelompok sayuran menjadi fitofarmaka.
E. Perumusan Masalah
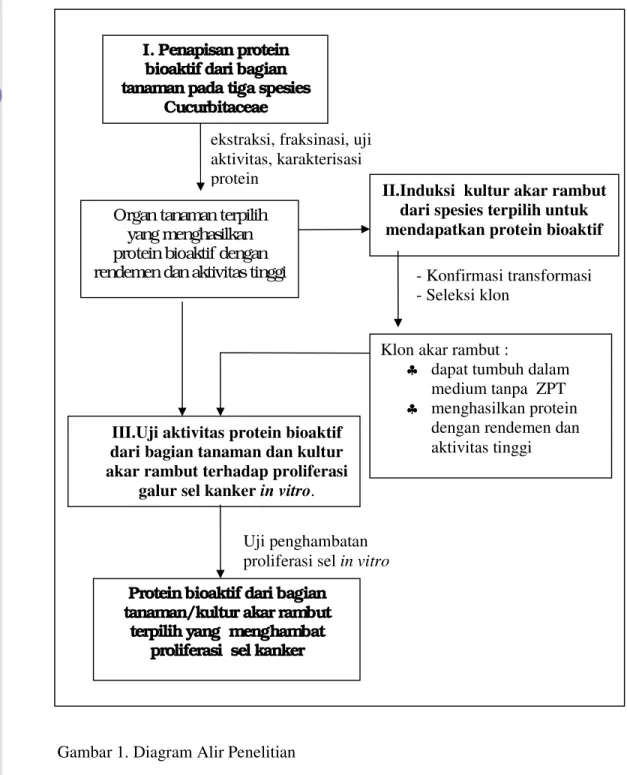
Penelitian terdiri dari tiga tahap seperti tersaji dalam diagram alir penelitian (gambar 1), yaitu :
1. Penapisan protein bioaktif dari bagian tanaman tiga spesies Cucurbitaceae, bertujuan untuk mendapatkan informasi dari bagian tanaman yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi (Penelitian 1).
2. Induksi kultur akar rambut dari spesies terpilih untuk mendapatkan protein bioaktif, dengan tujuan untuk mendapatkan kultur akar rambut yang dapat tumbuh dan berkembang dengan stabil dalam medium tanpa ZPT serta menghasilkan protein dengan rendemen dan aktivitas tinggi (Penelitian 2). 3. Uji aktivitas protein bioaktif dari bagian tanaman dan kultur akar rambut
bioaktif dari bagian tanaman atau akar rambut terpilih yang dapat menghambat proliferasi sel kanker (Penelitian 3).
Gambar 1. Diagram Alir Penelitian
II. TINJAUAN PUSTAKA
A. DISKRIPSI CUCURBITACEAEekstraksi, fraksinasi, uji aktivitas, karakterisasi protein
Organ tanaman terpilih yang menghasilkan protein bioaktif dengan rendemen dan aktivitas tinggi
I. Penapisan protein bioaktif dari bagian tanaman pada tiga spesies
Cucurbitaceae
II.Induksi kultur akar rambut dari spesies terpilih untuk mendapatkan protein bioaktif
Klon akar rambut :
♣ dapat tumbuh dalam medium tanpa ZPT ♣ menghasilkan protein
dengan rendemen dan aktivitas tinggi
Uji penghambatan proliferasi sel in vitro
- Konfirmasi transformasi - Seleksi klon
III.Uji aktivitas protein bioaktif dari bagian tanaman dan kultur akar rambut terhadap proliferasi
galur sel kanker in vitro.
Protein bioaktif dari bagian tanaman/kultur akar rambut
terpilih yang menghambat proliferasi sel kanker
1. Benincasa hispida (Thunb.) Cogn
Benincasa hispida (Thunb.) Cogn di Indonesia disebut bligo merupakan tanaman tahunan, umumnya berumah satu. Tanaman tumbuh baik pada dataran rendah, relatif toleran terhadap kekeringan. Batang tebal, menjalar hingga mencapai panjang beberapa meter. Daun sederhana, panjang tangkai daun 5-20 cm, helaian daun berukuran 10-25 cm x 10-20 cm, dengan 5-7 sudut. Bunga terletak pada ketiak daun, berwarna kuning, diameter 6-12 cm, panjang tangkai bunga 5-15 cm pada bunga jantan dan 2-4 cm pada bunga betina, bunga jantan mempunyai 5 benang sari. Buah besar, berbentuk lonjong, berukuran 20-60 cm x 10-25 cm, berwarna hijau tua, tertutup lapisan kapur, daging buah berwarna putih dengan ketebalan 2-4 cm. Biji berbentuk pipih lonjong, berwarna kuning kecoklatan, berukuran 10-15 mm x 5-7 mm x 1-2 mm. Perbanyakan tanaman melalui biji, untuk perkecambahan biji perlu waktu 1-2 minggu. Berbunga pada umur 50-80 hari setelah tanamm, penyerbukan memerlukan bantuan serangga. Pemasakan buah 1-2 bulan setelah penyerbukan, buah muda dapat dipanen 1-2 minggu setelah berbunga, buah tua 100-160 hari setelah tanam (Rifai dan Reyes, 1994).
2. Coccinia grandis (L.) Voigh
Coccinia grandis (L.) Voigh, di Indonesia dikenal dengan nama papasan atau kemarongan, merupakan tanaman tahunan. Tempat tumbuh sampai dengan ketinggian 1500 m, dengan kelembaban tinggi, dan tidak tahan genangan. Tanaman ini berumah dua, merupakan herba menjalar dapat mencapai panjang 20 m, akar berumbi. Batang muda berwarna hijau, setelah tua berbintik putih dan berkayu. Daun sederhana, berseling, panjang tangkai daun 1-5 cm, helaian daun berukuran 3-12 cm x 3-15 cm dengan 3-5 sudut. Bunga jantan diketiak daun, tunggal atau berpasangan, panjang tangkai bunga 0.7-7 cm, kelopak 5 helai dengan panjang lebih dari 6 mm, mahkota berwarna kuning kemerahan. Bunga betina juga diketiak daun, tunggal, panjang tangkai bunga lebih dari 2.5 cm. Bakal buah silindris, panjang 1.5 cm, tangkai putik panjang 3 mm, kepala putik 3 lobi. Buah berbentuk lonjong, berukuran 3-7 cm x 1-3.5 cm, buah muda berwarna hijau dengan garis putih, setelah masak berubah merah, panjang tangkai buah 4 cm. Biji pipih, umumnya berukuran 6mm x 3mm x 1.5 mm. Tanaman ini merupakan
satu-satunya Cucurbitaceae yang diperbanyak melalui stek. Daun dan buah muda biasanya dimanfaatkan sebagai sayuran (Boonkerd et al. 1994).
4. Trichosanthes cucumirena L. var anguina (L.) Haines
Trichosanthes cucumirena L. var anguina (L.) Haines, di Indonesia ada yang menyebutnya paria belut atau paria ular. Tempat tumbuh pada dataran rendah tropis, tidak tahan kekeringan, perlu kelembaban tinggi, dan tidak tahan genangan. Tanaman ini merupakan tanaman tahunan, berumah satu, berbatang lunak, dan tumbuh menjalar. Daunnya sederhana dengan 5-7 lobi, berukuran 7-25cm x 8-20 cm, berambut halus, panjang tangkai daun 2-10 cm. Bunga jantan terdiri dari 5 bunga atau lebih, panjang tangkai bunga 10-30 cm. Buah silindris memanjang, berukuran 30-180 cm x 2-10 cm, berwarna hijau keputihan saat masih muda dan berubah kemerahan setelah tua. Biji tebal, berwarna cokelat, panjang 1-1,5 cm. Berbunga sekitar 5 minggu setelah tanam, bunga jantan muncul lebih dulu, kira-kira tiga hari kemudian diikuti bunga betina, penyerbukan dibantu serangga. Buah muda berwarna hijau, dipanen 12-20 hari setelah berbunga atau setelah mencapai panjang 30-60 cm, sedangkan buah tua 1-2 bulan kemudian. Perbanyakan tanaman melalui biji, yang dipanen setelah buah benar-benar masak. Bagian tanaman yang dimanfaatkan buahnya, digunakan sebagai sayuran (Gildemacher et al. 1994).
B. PROSES PEMBENTUKAN AKAR RAMBUT
Agrobacterium adalah genus bakteri tanah familia Rhizobiaceae yang bersifat gram negatif. Spesies Agrobacterium yang bersifat parasit pada tanaman dan sudah dikenal luas adalah Agrobacterium tumefaciens dan Agrobacterium rhizogenes. Kedua Agrobacterium tersebut dapat menginfeksi berbagai tanaman spesies dikotil serta beberapa monokotil. A. tumefaciens menyebabkan timbulnya tumor, sedangkan A. rhizogenes menyebabkan tumbuhnya akar adventif pada tanaman yang terinfeksi. Timbulnya tumor maupun akar adventif tersebut akibat ditransfernya sebagian materi genetik (T-DNA) dari Ti-plasmid A. tumefaciens atau Ri-plasmid A. rhizogenes ke genom tanaman.
Menurut McClean (1998) pada proses transfer T-DNA terdapat dua tahap penting yaitu terjadinya kontak antara Agrobacterium dengan sel tanaman dan
proses transfer T-DNA, dimana masing-masing tahap melibatkan sekelompok gen yang berbeda. Selanjutnya adalah proses integrasi T-DNA didalam kromosom tanaman.
a) Kontak antara Agrobacterium dengan sel tanaman
Dalam tahap ini diperlukan peranan dari gen-gen kromosom antara lain dua lokus yang saling berpautan yaitu chvA dan chvB, dimana chvB berfungsi mensintesis β-1-2glukan dan chvA mensekresikan senyawa tersebut. Mutasi pada dua lokus tersebut menurunkan kemampuan Agrobacterium untuk kontak dengan sel tanaman. Gen lainnya adalah pscA (ExoC) berperan dalam sintesis polisakarida ekstraseluler.
b) Proses transfer DNA ke sel tanaman
Didalam proses transfer melibatkan berbagai gen vir yang terdiri dari virA, virB, virD dan virG yang berpenanan dalam proses transfer, virC dan virE untuk meningkatkan efisiensi transfer. Pada sel tanaman terluka mengeluarkan suatu senyawa fenol dengan BM rendah yaitu asetosiringone (AS) atau hidroksi asetosiringone (OH-AS). AS akan menginduksi ekspresi gen vir pada Agrobacterium melalui dua sistem komponen yaitu komponen sensor disandi oleh gen virA, dan komponen regulator oleh gen virG. VirA merupakan protein membran dalam, berfungsi sebagai khemoreseptor untuk menangkap AS. Dengan terdeteksinya senyawa AS oleh reseptor virA, AS ditransduksikan dari sensor virA ke regulator virG, mengakibatkan terjadinya aktivasi virG. Selanjutnya virG mengaktivasi ekspresi gen vir lainnya, diikuti terjadinya perubahan pada elemen T-DNA. Gen virD memproduksi protein virD1 dan virD2 yang berfungsi sebagai endonuklease untuk memotong kedua border dari T-DNA sehingga dihasilkan utas T (T-strand), yaitu molekul intermediet yang ditransfer dari Agrobacterium ke sel tanaman. Gen virC menghasilkan dua polipeptida yang berfungsi meningkatkan aktivitas virD1 dan virD2 sebagai nuklease pada T-DNA border. Gen virE memproduksi protein virE2 yang berperan dalam memproses utas T menjadi DNA utas tunggal dan berikatan dengan T-DNA utas tunggal tersebut membentuk ”ssDNA binding protein”. Selain virE2 protein lainnya yang berikatan dengan DNA utas tunggal adalah protein virD2 yang berikatan pada ujung 5', kedua protein tersebut berfungsi melindungi utas T dari degradasi nuklease. Fungsi virD2 lainnya adalah sebagai helikase yang menjaga agar utas T
tidak menggulung sehingga tetap dalam posisinya, dan sebagai pilot yang memandu transfer utas T dari Agrobacterium ke sel tanaman. Protein produk dari gen virB diduga berfungsi mengarahkan transfer T-DNA melalui membran Agrobacterium. Selanjutnya transfer T-DNA dari Agrobacterium ke sel tanaman dipandu oleh protein virD2.
c) Integrasi T-DNA ke genom tanaman
Tahap ini diawali dengan interaksi antara protein virD2 yang terdapat pada ujung 5’ dari T -DNA dengan titik potong (nick) pada DNA tanaman. DNA utas tunggal menempel pada suatu utas DNA tanaman dan terjadi pemilinan pada DNA tanaman yang menghasilkan titik potong kedua. Masing-masing utas dari T-DNA berligasi dengan DNA tanaman dan menghasilkan utas homolog. Penyusunan kembali dan replikasi dari titik potong yang berturutan pada DNA tanaman menghasilkan duplikasi dan perubahan susunan pada DNA target.
A. rhizogenes mentransfer T-DNA dari Ri (root inducing) plasmid ke sel tanaman yang diinfeksinya. Didalam Ri plasmid terdapat gen yang berfungsi mendorong pertumbuhan akar adventif. Ri plasmid. membawa satu atau beberapa T-DNA, dan dapat mentransfernya satu persatu atau beberapa T-DNA sekaligus. Ri plasmid selain membawa gen yang mendorong pertumbuhan akar adventif, juga membawa gen penyandi enzim yang memproduksi dan mensekresikan opin. Senyawa opin merupakan substrat pertumbuhan bagi Agrobacterium. Berdasarkan jenis opin yang diproduksi, antara lain terdapat A. rhizogenes strain mannopin dan A. rhizogenes strain agropin. A. rhizogenes strain manopin hanya mempunyai satu T-DNA. Sedangkan strain agropin mempunyai dua T-DNA yaitu TL-DNA dan TR-DNA. Salah satu dari T-DNA yaitu TR-DNA mempunyai homologi dengan T-DNA A. tumefaciens, yaitu gen iaaM dan iaaH yang meregulasi biosintesis auksin, dan gen penyandi sintase yaitu gen ags yang menyandi agropin. Sedangkan TL-DNA mempunyai beberapa homologi dengan T-DNA dari strain manopin. Pada kondisi tertentu TL-DNA tanpa TR-DNA dapat menginduksi pembentukan akar rambut, tetapi pada kondisi lainnya memerlukan TR-DNA, diduga meningkatnya biosintesis auksin endogen memacu kerja gen TL-DNA (Nilsson dan Olsson, 1997).
Analisis sekuens terhadap TL-DNA mengindikasikan adanya 18 open reading frame (ORF), tetapi dari 18 ORF tersebut hanya 4 lokus yang berpengaruh
terhadap morfologi akar rambut yang dihasilkan. Lokus tersebut adalah root locus A-D (rolA-D), yaitu rolA (ORF 10), rolB (ORF11), rolC (ORF12) dan rolD (ORF15). Akar yang diinduksi oleh oleh T-DNA mutant rolA mempunyai fenotipe lurus. Mutan rolB menyebabkan A. rhizogenes tidak virulen, menunjukkan begitu pentingnya lokus rolB pada induksi akar. Mutant rolC terjadi penghambatan pertumbuhan akar, sedangkan mutant rolD meningkatkan pembentukan kalus sehingga menghambat pertumbuhan akar (Oono et al. 1993).
Pada pembentukan akar rambut yang paling berpengaruh adalah gen rolA dan gen rolB, dimana gen rolA diduga berpengaruh terhadap rasio sitokinin/auksin. Sedangkan gen rolB bekerja melalui dua mekanisme, yaitu : 1) meningkatkan pool auksin aktif bebas dengan memediasi terjadinya hidrolisis IAA konjugat yang tidak aktif, 2) meningkatkan sensitivitas sel terhadap IAA. (Nilsson dan Olsson, 1997). Selain itu gen rolB diduga mendorong pembentukan meristem. Gen rolA maupun rolB secara tunggal mampu menginduksi pertumbuhan akar rambut, sedangkan gen rol C memerlukan promoter yang kuat (35S promoter). Tetapi bila semua gen rol berada bersama-sama akan bekerja secara sinergis dan cenderung mempunyai efek lebih kuat dibanding dalam keadaan tunggal (Nilsson dan Olsson, 1997).
Meskipun produksi akar rambut akibat infeksi A. rhizogenes merupakan hasil proses transfer gen seperti pada tumor akibat infeksi A. tumefaciens, tetapi proses yang terjadi pasca infeksi sangat berbeda. Selain itu sejumlah gen yang terlibat juga berbeda, dalam hal ini ekspresi gen rol terutama gen rolB sangat penting untuk terjadinya akar rambut. Sedangkan ORF lainnya seperti gen iaaM dan iaaH hanya merupakan faktor pelengkap yang diperlukan untuk terbentuknya akar rambut. Perbedaan lainnya antara crown gall dan akar rambut adalah crown gall terdiri dari sel yang tidak terdeferensiasi, tumbuh dengan cepat membentuk tumor yang terdiri dari sel-sel tertransformasi dan sel-sel non-transformasi. Karena pada crown gall seringkali terjadi difusi auksin dan sitokinin yang disintesis oleh sel tertransformasi ke sel sekitar yang tidak tertransformasi. Sebaliknya akar rambut terdiri dari sel-sel yang terdeferensiasi dan tertransformasi, karena akar rambut berasal dari sel tunggal yang tertransformasi (Nilsson dan Olsson, 1997).
semua gen rol mempunyai persamaan pola ekspresi yaitu pada jaringan tertentu (tissue specific expression) terutama meristem akar dan floem. Kecuali gen rolD ekspresinya diregulasi oleh perkembangan tanaman (developmentally regulated expression), terjadi pada fase elongasi/ekspansi dan pemasakan jaringan. Promoter rolB terekspresi pada parenkhim floem dan sel ray, demikian pula promoter rol C diekspresikan pada sel floem (Nilsson et al. 1997).
Altamura et al. (1991) melaporkan ada korelasi tinggi antara ekspresi gen rol dan inisiasi akar, yang ditunjukkan dengan diekspresikannya promoter rolB dan rolC pada sel-sel pericycle sebelum dan selama inisiasi serta pertumbuhan akar adventif. Menurut Maurel et al. (1994), promoter rolB diaktivasi oleh auksin, sedangkan aktivitas rolC dimodulasi oleh sukrosa. Kandungan sukrosa paling tinggi terdapat didalam floem dimana sukrosa ditransportasikan. Sedangkan konsentrasi IAA maksimal terdapat didalam pembuluh kambium, tetapi sejumlah IAA juga ditransportasikan melalui floem. Pengaturan promoter rolB dan rolC oleh sukrosa dan auksin menunjukkan pentingnya peranan kedua senyawa tersebut selama inisiasi akar, keduanya merupakan komponen yang diperlukan dalam induksi akar adventif. Oleh karena itu sel-sel dengan kandungan sukrosa dan auksin tinggi kompeten sebagai asal meristem akar dan merupakan sel target yang ideal untuk infeksi A. rhizogenes, sel-sel tersebut adalah sel ray dan sel floem.
C. BIOSINTESIS PROTEIN PADA TANAMAN
Biosintesis protein pada tanaman bersifat khas berbeda dengan organisme lain, karena tanaman mampu mensintesis asam amino yang diperlukan untuk pembentukan protein (Salysbury dan Ross, 1991).
1. Pembentukan Asam Amino
Pembentukan asam amino pada tanaman memerlukan dua unsur penting yaitu karbon dan nitrogen, serta sulfur untuk asam amino tertentu. Berdasarkan cara mendapatkan sumber nitrogen Salysbury dan Ross (1991) membagi tanaman menjadi tiga kelompok: a) melalui fiksasi N2, b) menggunakan NO3 sebagai sumber nitrogen, c) menggunakan NH4 sebagai sumber nitrogen.
prokariot membentuk NH3. Proses tersebut merupakan kerjasama secara simbiotik antara mikroorganisme dan sel akar, ditandai dengan terbentuknya nodul akar. Tanaman inang mensuplai karbohidrat hasil fotosintesis dari daun, ditrans-lokasikan melalui floem ke nodul akar dalam bentuk sukrosa. Kemudian sukrosa dioksidasi oleh bakteroid pada nodul akar, hasilnya untuk mereduksi NAD+ menjadi NADH atau NADP+ menjadi NADPH. Selain karbohidrat pada tanaman lain terjadi oksidasi piruvat yang mereduksi protein flavodoksin. Selanjutnya flavodoksin, NADH atau NADPH mereduksi feredoksin atau protein lain mirip feredoksin yang sangat efektif dalam mereduksi N2 menjadi NH3. Reaksi fiksasi nitrogen yang mereduksi N2 menjadi NH3 sebagai berikut:
N2 + 16 ATP + 8e + 8 H ◊ 2NH3 + H2 + 16ADP + 16Pi
Tanaman yang menggunakan NO3 sebagai sumber nitrogen mereduksi NO3, sebagian besar terjadi di akar atau daun di tempat nitrat reduktase paling aktif. Proses reduksi nitrat terdiri dari 2 reaksi, masing-masing dikatalisir oleh ensim yang berlainan. Reaksi pertama reduksi nitrat ke nitrit dikatalisir ensim nitrat reduktase, terjadi di sitosol diluar organel sebagai berikut :
NO3 - + NAD(P)H + H+ + 2e ◊ NO2 - + NAD(P) + H2O
Selanjutnya nitrit dari sitoplasma ditransportasikan ke kloroplas daun atau ke proplastid akar. Reaksi berikutnya adalah reduksi NO2- menjadi NH4+ dikatalisir oleh ensim nitrit reduktase sebagai berikut :
NO2- + 6Fdred + 8H+ + 6e ◊ NH4+ + 6 Fdox + 2H2O
Tanaman yang menggunakan NH4 sebagai sumber nitrogen utama, mengabsorbsi nitrogen dalam bentuk NH4. Tanaman ini biasanya hidup didaerah dengan kondisi pH tanah rendah, sehingga menghambat proses nitrifikasi.
Selain proses reduksi nitrogen pembentukan asam amino tertentu melibatkan asimilasi sulfur. Pada tanaman sumber sulfur umumnya dalam bentuk oksidasi atau sulfat, sehingga terjadi proses reduksi membentuk S = sebagai berikut :
SO4= + ATP + 8e- +8 H+ ◊ S = + 4H2O + AMP + PPi
Sulfur merupakan unsur penting dalam pembentukan asam amino sistein dan metionin (Crawford et al. 2000).
Rangka karbon pada asam amino diperoleh dari berbagai asam organik produk berbagai proses reaksi antara lain siklus Calvin, glikolisis, dan siklus asam
sitrat (Coruzzi dan Last., 2000). Asam organik tersebut antara lain :
a. á-ketoglutarat, menyumbangkan rangka karbon untuk asam amino glutamat, glutamin, histidin, prolin dan arginin.
b. Oksaloasetat, menyumbangkan rangka karbon untuk asam amino aspartat, asparagin, treonin, isoleusin, metionin dan lisin.
c. 3-fosfogliserat, sebagai sumber rangka karbon dari serin, glisin, sistein. d. Fosfoenol piruvat, merupakan sumber rangka karbon dari triptofan, tirosin
dan fenilalanin.
e. Piruvat , merupakan sumber rangka karbon dari alanin, leusin dan valin. Pembentukan asam amino melalui berbagai proses antara lain proses reduksi aminasi yang terjadi pada pembentukan glutamat dari á-ketoglutarat yang dikatalisir oleh ensim glutamat dehidrogenase. Selanjutnya pembentukan glutamin yang dikatalisir ensim glutamin sintetase, kemudian glutamin mentransfer gugus amidanya ke asam aspartat membentuk asparagin, dikatalisir ensim asparagin sintetase. Pembentukan asam amino lainnya melalui berbagai reaksi transaminasi dua arah. Reaksi transaminasi ini melibatkan perpindahan dua arah gugus α-amino dari suatu asam amino ke gugus α-keto dari asam α-keto, diikuti dengan terbentuknya asam amino baru dan asam α-keto baru (Coruzzi dan Last, 2000).
2. Sintesis Protein
Protein merupakan hasil ekspresi gen yang terbentuk melalui proses transkripsi, prosesing dan translasi. Pada proses transkripsi DNA dihasilkan pre-mRNA, selanjutnya pre-mRNA mengalami prosesing menjadi mRNA, kemudian mRNA ditranslasi atau diterjemahkan menjadi protein (Sugiura dan Takeda, 2000).
a. Perangkat sintesis protein
Menurut Spremulli (2000) berbagai makromolekul yang berperanan dalam proses translasi, antara lain :
- Messenger RNA (mRNA)
Messenger RNA (mRNA) berperanan sebagai pola cetakan suatu rangkaian asam amino, dimana pola tersebut ditetapkan dalam rangkaian kodon pada mRNA. Kodon adalah rangkaian tiga basa yang berdampingan, yang berdasarkan sandi genetik mampu menyandi satu asam amino.
- Transfer RNA (tRNA)
Transfer RNA (tRNA) berperanan sebagai penterjemah runtunan kodon mRNA menjadi runtunan asam amino, dibantu seperangkat ensim. Antikodon tRNA mengenali kodon mRNA melalui pasangan basa, masing-masing basa dari kodon membentuk pasangan dengan basa yang komplementer dari antikodon. - Ribosom
Merupakan organel tempat sintesis protein berlangsung, mempunyai struktur spesifik dan komplek. Pada sel eukariot ribosom terletak dalam sitoplasma, mempunyai koefisien sedimentasi 80S yang terbagi menjadi dua yaitu Subunit besar (60S) dan Subunit kecil (40S). Subunit kecil terdiri dari molekul RNA tunggal 18S, sedangkan Subunit besar mempunyai tiga molekul RNA (28S, 7S, dan 5S). Pada ribosom terdapat satu situs untuk mRNA, dua situs untuk tRNA (situs A dan situs P), dan satu situs untuk ensim peptidil transferase yaitu situs. Situs mRNA terdapat pada subunit kecil, sedangkan dua situs tRNA sebagian besar terletak pada subunit besar dan sebagian lagi pada subunit kecil, situs peptidil transferase pada subunit besar. Pada tanaman selain ribosom pada sitoplasma juga terdapat ribosom lain pada organel yaitu pada mitokondria dan kloroplas. Ribosom organel berfungsi mensintesis protein yang diperlukan oleh organel tersebut .
b. Mekanisme sintesis protein
Mekanisme sintesis protein disebut translasi, karena merupakan penterjemahan dari pasangan empat macam basa asam nukleat kedalam 20 macam asam amino. Menurut Watson et al. (1998) mekanisme sintesis protein meliputi berbagai tahap sebagai berikut :
- Pembentukan aminoasil-tRNA
Pada proses ini terjadi perpautan antara asam amino dengan tRNA membentuk aminoasil-tRNA, dikatalisir aminoasil-tRNA sintetase, yang disebut "activating enzyme". Perpautan ini berfungsi mengaktivasi gugus karboksil untuk membentuk suatu peptida. dan sebagai molekul adaptor karena asam amino tidak dapat mengenali langsung kodon pada mRNA. Satu aminoasil-tRNA sintetase mengkatalisir satu asam amino, karena setiap ensim berbeda ukuran, struktur subunit, maupun komposisi asam aminonya. Molekul tRNA penerima suatu asam amino mempunyai sekuensi basa spesifik untuk asam
amino tersebut, sehingga dengan cepat dapat bergabung dengan sintetase yang sesuai.
- Inisiasi
Pada proses ini terjadi ikatan antara inisiator tRNA dengan tanda awal (start signal) dari mRNA. Inisiator tRNA menempati situs P (peptidil) pada ribosom. Proses inisiasi terdiri dari tiga tahap :
- penempelan subunit kecil ribosom pada tRNA inisiator
- penempelan mRNA pada kompleks subunit kecil ribosom dan tRNA inisiator
- pembentukan kompleks subunit besar ribosom, subunit kecil ribosom, tRNA dan mRNA yang siap membaca kodon-kodon mRNA.
Proses inisiasi dibantu dua molekul protein yang disebut eIF2 dan eIF3 (eIF = eucaryotic initiation factor). Didalam sitoplasma kedua faktor inisiasi menempel pada subunit kecil ribosom. Fungsi eIF2 mendorong penempelan aminoasil-tRNA inisiator dan mRNA pada subunit kecil ribosom. Sedangkan eIF3 berfungsi memisahkan subunit kecil ribosom dari subunit besar setelah ribosom selesai melakukan translasi.
- Elongasi
Perpanjangan rantai polipeptida melibatkan sejumlah protein faktor perpanjangan EF (elongation factor), enzim peptidil tranferase serta GTP. Proses ini terdiri dari tiga tahap, yaitu pengikatan aminoasil-tRNA (pengenalan kodon), pembentukan ikatan peptida, dan translokasi.
- Terminasi
Merupakan akhir proses translasi yang terjadi bila tanda berhenti (stop signal) pada mRNA dibaca oleh protein faktor pembebas, dan terjadi pelepasan rantai polipeptida dari ribosom.
Didalam setiap tahapan proses sintesis protein terjadi interaksi antara berbagai perangkat (makromolekul) yang berperanan dalam proses sintesis protein. Interaksi tersebut terjadi dalam semua tahapan sintesis protein yaitu didalam proses inisiasi, elongasi dan terminasi (Spremulli, 2000).
Proses inisiasi diawali dengan penempelan eIF2, GTP dan aminoasil-tRNA inisiator pada subunit kecil ribosom. Sedangkan eIF3 sudah lebih dulu menempel pada subunit kecil ribosom pada saat pemisahan kedua subunit ribosom setelah
selesai proses translasi periode sebelumnya. Dengan adanya penempelan faktor inisiasi ini terjadi interaksi antara subunit kecil ribosom dengan mRNA, dimana subunit kecil ribosom akan menempel pada ujung 5' dan kemudian bergerak sepanjang mRNA untuk mencari kodon awal AUG. Pada proses inisiasi terjadi hidrolisis ATP menjadi ADP dan P yang diperlukan untuk mencari kodon awal. Setelah subunit kecil menyelesaikan inisiasi, subunit besar ribosom bergabung, dan GTP yang menempel pada eIF2 dihidrolisis menjadi GDP dan P. Kemudian. eIF2 dan eIF3 terlepas dari ribosom, dan ribosom siap memulai proses perpanjangan polipeptida. Pada akhir proses inisiasi subunit besar ribosom bersatu dengan subunit kecil ribosom dan berasosiasi dengan aminoasil-tRNA inisiator serta mRNA.
Proses elongasi dimulai dengan masuknya aminoasil-tRNA kedua ke situs A. Pada prokariot masuknya aminoasil-tRNA dibantu oleh faktor elongasi EF-Tu serta GTP yang membentuk kompleks EF-Tu-GTP-aminoasil-tRNA. Setelah terjadi hidrolisis GTP menjadi GDP dan P, maka EF-Tu-GDP terlepas dari aminoasil-tRNA. Protein faktor elongasi lainnya EF-Ts mengembalikan EF-Tu-GDP menjadi EF-Tu-GTP untuk berperan kembali dalam siklus berikutnya. Sedangkan pada eukariot hanya ada satu protein faktor elongasi yaitu EF1 yang mempunyai peran kombinasi EF-Tu dan EF-Ts.Tahap berikutnya adalah pembentukan ikatan peptida. Bila antikodon pada aminoasil tRNA sesuai dengan kodon mRNA pada situs A, maka ensim peptidil transferase akan melepaskan asam amino dari tRNA pada situs P dan menggabungkannya dengan asam amino yang terdapat pada aminoasil-tRNA pada situs A. Pada aminoasil-tRNA asam amino berikatan dengan tRNA melalui gugus karboksilnya (-COO-) sedangkan gugus aminonya (-NH) dalam keadaan bebas. Peptidil tranferase akan melepaskan ikatan -COO- dari ujung 3' tRNA dari aminoasil-tRNA pada situs P dan merangkaikannya pada gugus amino pada situs A membentuk ikatan peptida, sehingga terbentuk dipeptidil pada situs A. Reaksi tersebut disebut reaksi transpeptidasi. Transpeptidasi berikutnya tidak akan berlangsung selama peptidil-tRNA masih berada pada situs A, maka untuk reaksi transpeptidasi berikutnya terjadi perpindahan tempat atau translokasi. Pada proses translokasi ini terjadi tiga pergerakan, yaitu : tRNA yang tidak bermuatan meninggalkan situs P, peptidil-tRNA berpindah dari situs A ke situs P, dan mRNA bergeser sejauh tiga
nukleotida. Dengan demikian kodon berikutnya menduduki posisi yang dapat dibaca oleh aminoasil-tRNA baru. Translokasi memerlukan faktor elongasi kedua, yaitu EF2 (translokase). GTP yang terikat oleh EF2 dihidrolisa pada saat translokasi. Hidrolisis GTP menyebabkan EF2 dikeluarkan dari ribosom, karenanya GTP juga berfungsi sebagai katalitik. Setelah translokasi, situs A menjadi kosong, dan segera mengikat aminoasil-tRNA baru untuk memulai elongasi berikutnya
Terminasi terjadi bila ribosom menemukan salah satu kodon akhir UAA, UAG atau UGA. Pada kondisi tersebut tidak ada aminoasil-tRNA yang dapat menempel pada situs A, karena tidak ada tRNA dengan antikodon yang komplementer dengan tanda stop (stop signal). Tetapi tanda stop ini dikenali oleh protein faktor pembebas (RF = release factor). Kemudian RF berikatan dengan kodon akhir pada situs A, mengubah aktivitas peptidil transferase. Ensim tersebut tidak mereaksikan polipeptida dengan aminoasil-tRNA melainkan dengan H2O, akibatnya terjadi proses hidrolisis. Peptidil tRNA pada situs P dan rantai polipeptida terlepas dari tRNA, selanjutnya GTP terhidrolisis menjadi GDP dan P, disosiasi antara ribosom, tRNA dan mRNA, dan terurainya ribosom menjadi Subunit besar dan Subunit kecil.
D. PROTEIN BIOAKTIF
Protein bioaktif adalah protein yang mempunyai aktivitas biologis diluar aktivitas dari fungsi protein tersebut. Protein bioaktif yang sudah dikenal luas antara lain protein anti-jamur, protein anti-bakteri, protein anti-virus, dan protein penginaktivasi ribosom. Protein bioaktif pada tanaman penghasilnya diduga sebagai senyawa yang berfungsi dalam sistem pertahanan.
Protein anti jamur protein PR-5 dari daun labu ditemukan Cheong et al. (1997) dan protein PR-5d dari tembakau oleh Koiwa et al. (1997). Kedua protein ini mempunyai mekanisme kerja dengan meningkatkan permiabilitas plasma membran, sehingga menyebabkan kebocoran membran dan keluarnya material intraseluler pada jamur.
Protein antivirus dari akar Bougainvillea spectabilis (BAP 1) menunjukkan aktivitas penghambatan sintesis protein secara in vitro. (Balasaraswati et al. 1998) Protein anti virus MAP 30 dari biji Momordica charanthia dan GAP 31 dari
Gelonium multiflorum. Kedua protein tersebut mampu menghambat infeksi virus HIV-1 dan menghambat replikasi virus pada sel yang sudah terinfeksi, dengan menghambat HIV-integrase dan menginaktivasi topologi HIV-LTR (Huang et al. 1999).
Segura et al. (1999) menemukan peptida antimikroba Snakin-1 (SN1) dari umbi kentang. Protein ini menunjukkan aktivitasnya pada konsentrasi kurang dari 10 µM terhadap bakteri dan jamur patogen pada kentang dan spesies tanaman lainnya. Snakin-1 diketahui menyebabkan agregasi bakteri gram negatif maupun gram positif.
Protein yang menonaktifkan ribosom, menghambat sintesis protein pada organisme lain, dikenal sebagai ribosom inactivating protein (RIPs). Protein ini merupakan toksin tanaman dengan aktivitas N-glikosidase yang memotong N-glikosida pada Sub unit besar ribosom mamalia, jamur, dan bakteri. RIPs memotong N-glikosida rRNA pada situs spesifik, yaitu pada A4324 dari 28S rRNA liver tikus, A3024 pada 26S rRNA yeast dan A2660 dari 23S rRNA E. coli. Dengan terjadinya pemotongan N-glikosida pada Sub unit besar, ribosom tidak dapat berinteraksi dengan faktor elongation 2 (EF2) pada eukariot atau EFG pada prokariot sehingga menghambat elongasi rantai polipeptida (Girbes et al. 1993; Jensen et al. 1999).
RIPs dibedakan menjadi 2 tipe, yaitu
a) Tipe 1, merupakan rantai polipeptida dengan aktivitas ensim yang unik. RIPs tipe 1 relatif banyak, lebih dari 30 jenis telah berhasil diisolasi.
b) Tipe 2, terdiri dari satu atau dua dimer dari dua rantai polipeptida yang berlainan yang digabungkan dengan jembatan disulfida. Salah satu rantai polipeptida bersifat ensimatik (rantai A), sedangkan rantai lainnya adalah lektin (rantai B) yang dapat berikatan dengan gula membran, terutama residu galaktosa.
RIPs tipe 2 bekerja dengan mengikatkan toksin dari rantai B ke reseptor pada permukaan sel, kemudian rantai A masuk ke sitoplasma dan menonaktifkan sub unit besar ribosom 60 S. RIPs tipe 2 sangat jarang baru 5 jenis yang berhasil dideteksi dan diisolasi.
RIPs tipe 1 mempunyai banyak kemiripan struktur, termasuk berat molekul (26-32 kD), dan sebagian besar merupakan glikoprotein. Umumnya cukup stabil
terhadap degradasi denaturan maupun proteolitik (Jensen et al. 1999).
Pada umumnya protein bioaktif disintesa dalam bentuk tidak aktif, selanjutnya ditransport ketempat dimana protein tersebut disimpan, dan pada tempat protein tersebut disimpan mengalami proses pengaktifan. Kloning cDNA pada ricin menunjukkan bahwa molekul disintesa dalam bentuk prepro sebagai polipeptida tunggal, kemudian 12 asam amino yang menghubungkan antara dua rantai dipotong untuk menghasilkan protein aktif. Hal serupa dijumpai pada toksin diphteria dimana disintesa sebagai polipeptida tunggal, kemudian mengalami proses proteolitik membentuk dua rantai. Endopeptidase yang dapat memotong sekuen intervening 12 asam amino pada preporicin telah diisolasi dari protein pada biji jarak (Ricinus communis L), dimana toksin disimpan. Proricin tanpa sekuen signal, tetapi dengan sekuen intervening dapat mengikat galaktosa, bentuk ini bersifat inaktif dalam uji rantai ensim. Oleh karena itu sel jarak diduga memproteksi perangkat sintesis proteinnya dari pengaruh inaktivasi oleh ricin dengan mengekspresikan molekul ricin yang tidak aktif (proricin), kemudian menjadi aktif (ricin) setelah diekspor ke biji (Jensen et al. 1999).
Park et al. (2003) mengisolasi dan mengkarakterisasi RIPs tipe I dari akar rambut Phytolaca americana yang disebut PAP-H. Protein tersebut disekresikan secara konstitutif kedalam medium sebagai eksudat akar. Selain mempunyai aktivitas menghambat sintesis protein dengan menonaktifkan ribosom PAP-H juga mempunyai aktivitas anti-jamur.
E. UJI KEMATIAN LARVA UDANG
Dasar pertimbangan dari metode ini adalah senyawa bioaktif bersifat toksik pada dosis tinggi, sehingga kematian in vivo dari hewan sederhana Artemia salina Leach dapat digunakan untuk memonitor dengan mudah dan cepat dalam skrining ekstrak bioaktif tanaman. Selain metodenya cukup sederhana, bahannya mudah didapat, relatif murah dan perlu waktu singkat. Menurut Hostettmann (1991) metode ini mempunyai korelasi positif dengan pengujian sitotoksisitas pada 3PS (P-388 murine leukemia in vivo). Telur A. salina Leach (larva udang) tersedia dan dijual dengan harga murah dan tahan disimpan beberapa tahun dalam kondisi kering. Untuk menetaskannya sangat mudah dengan menaruh telur dalam medium
air laut buatan, dalam waktu 24 jam akan diperoleh larva (nauplii ) dalam jumlah banyak.
Larva A. salina Leach tidak mempunyai alat untuk mempertahankan diri dari serangan musuh, satu-satunya cara untuk menghindar dari musuh adalah dengan hidup diperairan kadar garam tinggi, dalam kondisi ini jarang organisme yang dapat bertahan hidup. Pada habitatnya A. salina memakan sisa-sisa jasad hidup yang sudah menghancur, ganggang, bakteri dan cendawan.
A. salina Leach berkembangbiak dengan dua cara yaitu ovipar melalui telur dan ovovivipar langsung melalui larva. Perkembangbiakan ovovivipar terjadi bila lingkungan cukup baik, kadar garam tidak terlalu tinggi dan oksigen cukup. Tetapi bila lingkungan buruk seperti meningkatnya kadar garam dan menurunnya oksigen maka larva akan berkembangbiak secara ovipar melalui telur yang bercangkang tebal disebut cyste. Dan bila lingkungan membaik telur akan menetas dalam waktu 24 – 36 jam (Meyer, 1982).
A. salina Leach atau brine shrimp adalah jenis udang-udangan primitif, dengan sistematika sebagai berikut :
filum : Arthropoda subfilum : Mandibulata kelas : Crustaceae subkelas : Branchiopoda ordo : Anostraca famili : Artemiidae genus : Artemia
spesies : Artemia salina Leach
Uji kematian larva udang (brine shrimp lethality test = BSLT) telah digunakan secara luas dalam berbagai pengujian antara lain untuk menguji residu pestisida, mikotoksin, anastesi, senyawa golongan morfin, dan toksisitas limbah
Gambar 2. Larva Artemia salina Leach
minyak (Hostettman, 1991). Oberlies et al. (1998) menggunakan uji BSL pada skrining sitotoksisitas buah muda alpokat Persea americana. Hasil penelitiannya menunjukkan buah muda yang diekstraksi dengan ethanol 95% pada uji BSL memperoleh LC50 pada konsentrasi 31 µg/ml. Jaki et al. (1999) menguji 86 ekstrak lipofilik dan hidrofilik dari 43 sampel cyanobacteria untuk penapisan bioaktivitasnya dengan uji BSL. Hasil penelitiannya menunjukkan 8,1% dari ekstrak mengakibatkan kematian ≥ 60% A. salina Leach pada konsentrasi 500 ppm. Lieberman (1999) memantau toksisitas limbah kimia rumah tangga dengan uji BSL menggunakan Artemia franciscana.
F. UJI MENGGUNAKAN GALUR SEL KANKER IN VITRO
Pada pertumbuhan normal terjadi pengaturan laju proliferasi sel dari suatu organ, meningkat atau menurunnya proliferasi sel setara dengan laju kerusakan sel sehingga ukuran organ tetap terjaga. Sebaliknya sel kanker tidak mengikuti aturan tersebut, tetapi terjadi proliferasi yang tidak terkendali, sehingga terbentuk tumor (Hood et al. 1997).
Tumor yang disebabkan oleh proliferasi sel disebut neoplasma atau pertumbuhan baru. Berdasarkan kemampuan menyebar neoplasma dibedakan antara neoplasma maligna dan neoplasma benigna. Neoplasma maligna atau kanker adalah neoplasma yang menyerang jaringan sekelilingnya, kemudian menyebar keseluruh tubuh (metastasis). Neoplasma yang membentuk tumor yang tidak menyebar disebut neoplasma benigna. Berdasarkan asalnya antara lain terdapat dua jenis tumor yaitu tumor yang berasal dari sel epitel disebut karsinoma, sedangkan yang berasal dari sel stroma atau mesenkhim disebut sarkoma (Van de Velde et al. 1999).
Pengobatan penyakit kanker umumnya dilakukan melalui biopsi, radioterapi dan khemoterapi yang memerlukan biaya sangat mahal. Oleh karena itu berbagai penelitian dilakukan untuk mencari obat alternatif yang berasal dari alam antara lain tumbuh-tumbuhan. Indonesia sebagai negara dengan kekayaan flora terbesar
kedua di dunia kaya akan berbagai tanaman berkhasiat obat, termasuk obat anti kanker (Maat, 2000).
Untuk mengidentifikasi senyawa anti kanker dilakukan evaluasi praklinik yang ekstensif dari berbagai senyawa untuk mendeteksi aktivitas neoplastik. Pengujian yang dilakukan meliputi pengujian in vivo menggunakan hewan model, dan pengujian in vitro menggunakan kultur sel. Pada kultur sel dapat diamati secara langsung sitotoksisitas suatu senyawa terhadap viabilitas sel (Wilson, 1992).
Berdasarkan asalnya Freshney (1992) membagi kultur sel menjadi beberapa jenis, yaitu : 1) Sel primer adalah kultur sel yang belum disubkultur, berasal dari jaringan yang diisolasi dan dikulturkan. Sel ini dapat mewakili atau mempunyai kemiripan dengan jaringan asal, tetapi pemeliharaannya sulit.. 2) Finite Cell Line, kultur sel yang mempunyai masa hidup terbatas, umumnya merupakan kultur jaringan sel normal atau sel-sel yang tidak berubah selama masa pengkulturan. Sel masih mempunyai kemiripan atau dapat mewakili jaringan asal, pemeliharaannya sulit dan waktu penggandaan sel 24-96 jam 3) Continuous cell line, adalah galur sel yang mempunyai masa hidup tidak terbatas (immortal), bisa berasal dari tumor atau sel yang mengalami perubahan selama pengkulturan. Umumnya sel kurang terdeferensiasi, pemeliharaannya mudah, dan memerlukan waktu penggandaan 12-24 jam.
Griffiths (1992) membedakan kultur sel berdasarkan sifat pertumbuhannya, sebagai berikut : a) sel suspensi adalah sel yang tumbuh membentuk suspensi dalam medium kultur, dapat hidup dan berkembang tanpa menempel pada cawan kultur. Sel yang berasal dari darah, limpa atau sumsum tulang, khususnya sel yang belum dewasa cenderung tumbuh dalam bentuk suspensi. Sel suspensi berbentuk seperti bola-bola kecil, dan mudah dipanen. Keuntungan lain dari sel suspensi adalah dapat menghasilkan sel dalam jumlah besar. b) Sel yang menempel, adalah sel yang tumbuh membentuk satu lapisan (monolayer), menempel pada permukaan cawan kultur. Sel yang berasal dari lapisan embrionik ektodermal atau endodermal cenderung tumbuh secara menempel, antara lain sel fibroblas dan sel epithel. Sel yang tumbuh secara menempel mempunyai beragam bentuk, tetapi umumnya pipih. Kelebihan dari pertumbuhan yang menempel adalah kemampuan dari sel untuk menempel dan menyebar pada permukaan, memudahkan dalam
pengujian mikroskop, hibridisasi dan pengujian fungsional lainnya.
Contoh galur sel kanker yang mempunyai masa hidup tidak terbatas adalah sel HeLa yang diisolasi dari epitheloid carcinoma pada servic seorang wanita negro berusia 31 tahun. Sel Hela merupakan sel monolayer, dan bersifat aneuploid. Sel lainnya adalah sel K-562 (ATCC CCL 243) diisolasi pertamakali oleh Lozzio (1972) dari efusi pleural wanita berumur 53 tahun yang menderita leukemia myleogenous kronik pada akhir masa blast. Sel K-562 merupakan galur erythroleukemia, multipotensial dan sel malignant haematopoeitic. Galur sel K-562 ini merupakan tipe sel yang dibiakkan dalam bentuk suspensi (ATCC, 1992).
Pada setiap kultur diperlukan pengamatan berkala secara makroskopis atau mikroskopis, karena bila sel tidak sehat percobaan tidak reprodusible. Pengamatan kultur menurut Hay (1992) meliputi : a) warna medium, umumnya media mempunyai indikator pH, bila berubah menjadi kuning menunjukkan bersifat asam atau keunguan menunjukkan basa. Medium yang terlalu asam atau basa menunjukkan terjadinya kontaminasi, pertumbuhan yang berlebihan, kematian kultur, atau kurangnya aliran CO2. b) ada selaput yang menyelimuti medium, menunjukkan kontaminasi atau pertumbuhan kultur yang berlebihan. c) terbentuk gumpalan sel pada kultur suspensi atau terjadi pengelupasan pada kultur yang menempel.