TINJAUAN PUSTAKA
Preservasi Ovarium
Preservasi jangka pendek ovarium diperlukan untuk transportasi ovarium, terutama jika lokasi sumber ovarium jauh dari laboratorium. Teknik penyimpanan ovarium jangka pendek telah dicoba pada kambing (Silva et al. 2000, Carvalho et al. 2001), pada sapi (Lucci et al. 2004), babi (Lucci et al. 2007), dan anjing (Lopes et al. 2009, Lima et al. 2010). Secara umum hasilnya menunjukkan bahwa suhu 4 oC memungkinkan preservasi folikel selama 18 atau 24 jam, sedangkan pada suhu 20 oC mampu mempreservasi folikel selama 4 atau 6 jam.
Kriopreservasi potongan jaringan cortex atau ovarium utuh memungkinkan penyimpanan jaringan ovarium jangka panjang. Kriopreservasi diaplikasikan diantaranya untuk mempertahankan fungsi ovarium, mempertahankan spesies yang terancam punah, dan menyelidiki fenomena folikulogenesis awal (Onions et al. 2008). Bagi pasien penderita kanker yang menjalani kemoterapi, kriopreservasi adalah alternatif untuk mempertahankan fungsi ovarium (Amorim et al. 2009). Kriopreservasi jaringan ovarium merupakan satu-satunya pilihan yang tersedia bagi wanita yang belum pubertas dan wanita yang tidak dapat menunda awal kemoterapi (Gosden et al. 2002). Jaringan ovarium dapat dibekukan mengunakan tiga pendekatan berbeda: sebagai fragmen cortex ovarium (Tsuribe et al. 2009, Muruvi et al. 2009), sebagai keseluruhan ovarium (Bedaiwy et al. 2006, Onions et al. 2008) atau folikel-folikel terisolasi (Donnez et al. 2006).
Folikel bukan objek ideal untuk kriopreservasi karena bersifat multiseluler dan heterogen. Untuk melindungi folikel selama pembekuan, banyak air harus digantikan oleh agen krioprotektan dan banyak diantaranya bersifat toksik dan konsentrasi yang dibutuhkan tinggi (Gosden et al. 2002). Keseimbangan harus diperhatikan dalam mengoptimalkan konsentrasi krioprotektan, lama pemaparan dan laju pendinginan serta pencairan kembali. Sebagian besar penelitian-penelitian awal ovarium menggunakan mencit dan tikus sebagai model, ovarium dibekukan dan isografting setelah thawing (Harp et al. 1994, Cox et al. 1996,
Candy et al. 1997, Gunasena et al. 1997). Litter size yang diperoleh dari grafting ovarium hasil kriopreservasi setara dengan grafting ovarium segar (Candy et al. 2000).
Beberapa metode kripopreservasi pada saat ini adalah metode konvensional dengan metode pendinginan lambat (slow freezing) dan pendinginan cepat (rapid freezing) serta metode vitrifikasi sebagai alternatif. Vitrifikasi adalah proses pemadatan cairan yang mengandung krioprotektan konsentrasi tinggi pada suhu -196 oC tanpa pembentukan kristal es sehingga terlihat seperti kaca (Rall & Fahy 1985). Pada metode vitrifikasi konsentrasi krioprotektan yang digunakan lebih tinggi dan laju pendinginan lebih cepat, tidak menimbulkan terbentuknya kristal serta tidak membutuhkan perlatan khusus (Yoeman et al. 2005). Metode vitrifikasi dapat mempertahankan viabilitas folikel preantral lebih baik dibandingkan metode pembekuan konvensional (Chen et al. 2006).
Penggunaan konsentrasi krioprotektan yang tinggi menyebabkan tingginya tingkat toksisitas (Chen et al. 2006). Etilen glikol (EG) merupakan salah satu krioprotektan yang paling rendah tingkat toksisitasnya, daya permeasi cepat sehingga sangat baik digunakan sebagai krioprotektan. Di samping EG, krioprotektan lain yang sering digunakan sebagai kombinasinya adalah dimetilsulfoksida (DMSO) (Lucci et al. 2007).
Gambaran Umum Perkembangan Folikel, Lingkungan dan Medium Kultur
Pada semua spesies mamalia, perkembangan folikel dan oosit mengikuti sekuen-sekuen peristiwa yang muncul seiring terbentuknya ovarium setelah konsepsi dan diakhiri peristiwa ovulasi oosit fertil tahap metaphase II. Sepanjang fase preantral yang panjang dari folikulogenesis mamalia, perkembangan oosit tergantung pada dan berbarengan dengan lapisan-lapisan sel-sel granulosa folikel (Diaz et al. 2007). Komunikasi efektif antara tipe-tipe sel folikel yang berbeda diperoleh melalui kontak gap junction homolog dan heterolog (Picton et al. 2007). Komunikasi antara sel-sel granulosa dan oosit sangat vital untuk mempertahankan pertumbuhan oosit sebab sumber utama nutrien untuk gamet adalah kompartemen somatik (Harris & Picton 2007).
Folikel primordial terdiri dari oosit kecil yang dikelilingi oleh lapisan sel tunggal sel-sel granulosa pipih terletak di membrana basalis. Ketika folikel mulai tumbuh, oosit akan membesar dan sel-sel somatik ekspansi membentuk sel-sel granulosa mural dan sel-sel cumulus dalam folikel de Graaf (Gougeon 1996). Membrana basalis memisahkan folikel dari sel-sel stroma termasuk prekursor lapisan sel-sel theca. Ukuran yang kecil, kurangnya organel-organel sitoplasma dan ketiadaan spindle apparatus membedakan oosit-oosit primordial dari oosit tahap metafase II dan hal ini menguntungkan untuk penyimpanan suhu rendah (Gosden et al. 2002). Folikel-folikel primordial melimpah pada ovarium muda, menurun secara eksponensial seiring umur dan bervariasi sesuai bobot tubuh pada berbagai spesies (Gosden dan Telfer 1987).
Sebagian besar folikel-folikel primordial tidak berkembang lebih lanjut atau gagal mencapai ukuran ovulasi. Pada ovarium rodensia prapubertas kurang lebih setengah dari folikel berdegenerasi (atresia), proses tersebut tampak lebih jelas pada folikel antral. Atresia folikel ini melibatkan apoptosis (Tilly 1999). Kemungkinan apoptosis dimulai pada sel-sel kecambah folikel-folikel primordial dan tidak tergantung level gonadotropin, sedangkan pada tahap preantral besar dan antral proses tersebut tergantung pada gonadotropin dan ketiadaan hormon menginisiasi apoptosis sel-sel granulosa sebelum oosit dipengaruhi (Gosden et al. 2002).
Selama pertumbuhan folikel, volume dan diameter oosit meningkat sebagai akibat akumulasi air, ion, karbohidrat dan lipid (Fair et al. 1997), sebagai contoh pada mencit kenaikan volume dari folikel primordial ke folikel praovulasi mencapai 150 kali (Pan et al. 2005). Perubahan morfologis dan kerangka waktu perkembangan folikel dan oosit sudah terkarakterisasi pada berbagai spesies (Peters et al. 1975, Gougeon 1996, McNatty et al. 1999), pada domba pembentukan antrum terjadi ketika diameter folikel sekitar 250 μm (Picton et al. 2008). Pada tahap ini sebagian besar pertumbuhan oosit sudah sempurna. Sebaliknya, perbedaan-perbedaan spesifik spesies telah diketahui dalam sejumlah parameter: i) keseluruhan waktu folikulogenesis dan oogenesis; ii) ukuran folikel ovulatoris dan oosit matang; iii) perbedaan kondisi alami, konsentrasi dan pengaruh growth factor yang memperantarai produksi folikel dan oosit in vivo
(Picton et al. 2008). Perbedaan-perbedaan ini sangat relevan ketika mengembangkan sistem yang mendukung pertumbuhan dan maturasi folikel dan oosit.
Dalam kultur folikel in vitro diperlukan optimasi pH, suhu dan oksigen untuk memaksimalkan potensi oosit-oosit yang dihasilkan (Ye et al. 2007). Sebagai contoh, meskipun jaringan ovarium marmut dipaparkan ke level oksigen plasma sekitar 5% in vivo, folikel mencit yang ditumbuhkan in vitro dalam 5% oksigen menghasilkan lebih banyak oosit matang dengan kelainan kromosom dan banyak yang mati secara prematur dibandingkan folikel yang dikultur dalam 20% oksigen (Hu et al. 2001). Hal serupa terjadi pada domba, folikel-folikel domba yang ditumbuhkan dalam 5% oksigen menurunkan pembentukan antrum dan meningkatkan konsumsi laktat dan glukosa dibandingkan dengan 20% oksigen (Jin et al. 2007). Suhu medium yang digunakan untuk transportasi dan penanganan sebelum pemanenan harus dioptimalkan untuk meminimalkan apoptosis (Schmidt et al. 2003, Lucci et al. 2004)
Sejumlah sistem kultur yang berbeda telah dicoba untuk menumbuhkan folikel dari spesies-spesies yang memiliki perbedaan spesifik spesies. Pada semua protokol kultur folikel in vitro, penting untuk mengoptimalisasi: i) suplai nutrien, elektrolit, antioksidan, asam-asam amino, substrat energi, vitamin, dan growth factor; ii) penghilangan produk-produk sisa seperti ammonia yang dapat terakumulasi karena produk sisa metabolisme ini dapat menekan pertumbuhan folikel (Kerr et al. 2006). Berbagai medium dasar telah dipakai untuk kultur folikel dari spesies yang berbeda diantaranya minimum essential medium (MEM) (Cortvrindt et al. 1996, Kerr et al. 2006), Waymouth medium (Muruvi et al. 2005) dan Mc Coy’s medium (Telfer et al. 2008). Medium-medium basal tersebut perlu dilengkapi bahan-bahan tambahan yaitu antibiotik/antimikotik; sediaan komersial insulin, transferrin, dan selenium (Wright et al. 1999).
Pertimbangan penting dalam menyusun medium kultur folikel in vitro adalah tipe dan konsentrasi substrat energi dalam medium basal. Penelitian menunjukkan bahwa glukosa adalah sumber energi yang umum bagi hampir semua tipe sel hewan, tetapi kemudian diketahui bahwa oosit matang pada banyak spesies mamalia termasuk mencit (Harris et al. 2008), sapi (Gandolfi et al. 1998),
dan manusia (Roberts et al. 2002) lebih cenderung memetabolisme piruvat dan punya sedikit kapasitas untuk metabolisme glukosa. Oosit mencit diketahui berkemampuan tinggi untuk mengkonsumsi piruvat dan oksigen pada semua tahap perkembangan folikel (Harris et al. 2008) sedangkan konsumsi glukosa berada di bawah level yang dapat dideteksi (Harris et al. 2007).
Kultur Folikel Preantral
Penelitian-penelitian yang dilakukan untuk mengkultur folikel dengan berbagai metode lebih intensif dilakukan pada rodentia sebagai model dan telah dicapai beberapa keberhasilan (Picton et al. 2008). Kemajuan dalam kultur folikel rodensia sulit direplikasikan pada ruminansia dan manusia. Salah satu alasan utama kurangnya kemajuan adalah kesulitan teknis yang lebih besar untuk mengisolasi folikel sebab jaringan cortex lebih padat dan fibrous (Telfer 1996) dan isolasi folikel seringkali membutuhkan protokol berbasis enzim yang agresif (Demeestere et al. 2002).
Keberhasilan kultur folikel preantral terkendala oleh kompleksitas sinyal-sinyal, interaksi sel-sel dan sel-stroma yang diperlukan untuk menduklung pertumbuhan folikel-folikel tahap awal (Demeestere et al. 2005). Dalam dekade terakhir kemajuan dicapai pada teknik kultur dua dimensi untuk mernumbuhkan folikel preantral in vitro (Von Wolff et al. 2009, Cortvrindt et al. 1996, Liu et al. 2001). Folikel-folikel yang dikultur dalam sistem dua dimensi harus melekat ke pemukaan kultur datar dimana sel-sel somatik bermigrasi dari oosit merubah struktur tiga dimensi asal merusak interaksi sel-sel somatik-gamet yang penting untuk pertumbuhan oosit normal (West et al. 2007). Walaupun demikian, pada mencit seluruh tipe sel folikel tetap kontak dan respon terhadap stimulasi gonadotropin dipertahankan (Picton et al. 2008).
Granulosa-oosit complex tumbuh optimal pada kepadatan sedang (~200/well) pada membran collagen yang memungkinkan folikel-folikel melekat dengan penyebaran terbatas. Dengan menggunakan defined medium mengandung albumin, ITS, dan hypoxantine (untuk mencegah meiosis prematur) oocytes dari folikel-folikel preantral anak mencit matang untuk IVF setelah inkubasi selama 10 hari (Eppig et al. 1992). Folikel-folikel utuh juga dapat ditumbuhkan pada
membran berpori (Nayudu dan Osborn 1992) atau dalam microdrop medium dibawah mineral oil dengan 75% folikel menghasilkan oosit tahap metafase 2 (Demeestere et al. 2002). Penambahan hCG dalam medium menghasilkan 80% folikel yang ovulasi in vitro (Rose et al. 1999).
Sistem kultur in vitro tiga dimensi yang menyerupai arsitektur internal ovarium tampaknya optimal untuk mendukung pertumbuhan folikel dan maturasi oosit. Beberapa tahun terakhir, telah dibuktikan kemungkinan untuk memelihara integritas tiga dimensi dari folikel ruminansia (Newton et al. 1999, Gutierrez et al. 2000, Thomas et al. 2007) dan folikel manusia (Picton et al. 1999, Telfer et al. 2008). Filosofi sistem ini adalah mengkultur sel granulosa dalam formasi dan bentuk yang menyerupai morfologi (Chang et al. 1977) dan fenotipe steroidogenik sel-sel granulosa in vivo (Picton et al. 1999) dibandingkan karakter fibroblastik karena perlekatan dengan permukaan cawan kultur. Sistem yang spesifik spesies ini mempertahankan integritas folikel dan folikel tetap dalam ultrastruktur normalnya (Jin et al. 2004). Dengan menggunakan sistem ini, pertumbuhan folikel dapat dimanipulasi dengan ada atau tidaknya lapisan sel theca seperti halnya komponen membrana basalis dalam medium kultur. Sel-sel theca mempunyai efek biokimia terhadap pertumbuhan dan perkembangan oosit in vitro yang dimediasi oleh sel-sel granulosa (Richard & Sirard 1996).
Sistem kultur folikel tiga dimensi dengan menggunakan alginat mendukung pertumbuhan dan maturasi folikel-folikel sekunder (Kreeger et al. 2006, Xu et al. 2009). Sistem ini menghasilkan oosit yang kompeten dan dapat difertilisasi serta menghasilkan keturunan yang normal (Xu et al. 2006a). Konsentrasi matrix hidrogel alginat dapat dimodifikasi untuk mendukung pertumbuhan folikel sekunder awal (Xu et al. 2006b).
Pembentukan antrum mencapai 50% dari folikel-folikel sekunder domba dengan ukuran awal 180-220 µm setelah 12-14 hari kultur dan pertumbuhan didukung sampai diameter 1,2 mm setelah 30 hari baik jaringan segar maupun hasil kriopreservasi (Newton et al. 1999). Potensi kultur folikel tiga dimensi telah dicoba pada spesies lain yaitu babi (Wu et al. 2001), sapi (Gutierez et al. 2000, McCaffery 2000, Thomas et al. 2007) dan juga manusia (Picton et al. 1999, Telfer et al. 2008).
Isolasi mekanik dan kultur in vitro juga telah dicoba pada folikel manusia (Abir et al. 1997) walaupun tingkat atresia setelah kultur tinggi. Telfer et al. (2008) mengisolasi folikel preantral manusia secara mekanik dari jaringan cortex setelah jaringan dikultur selama 6 hari. Folikel dikultur lanjut secara individual, pembentukan antrum terjadi dengan cepat yaitu dalam dua hari.
Regulator Perkembangan Folikel
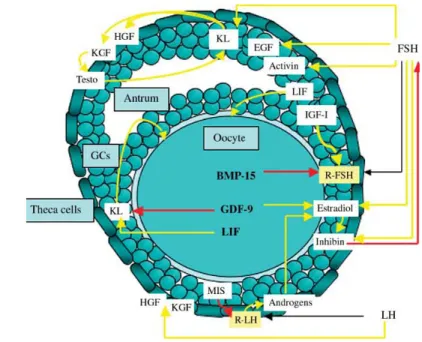
Folikulogenesis merupakan proses perkembangan yang kompleks yang diatur oleh berbagai faktor endokrin, parakrin, dan autokrin (Thomas et al. 2003, Demeestere et al. 2005, Gambar 1.), juga koneksi sel-sel dan sel-matriks intraovarian (Irving-Rodgers & Rodgers 2005). Interaksi antarsel yang krusial bagi pertumbuhan diantaranya antara sel-sel theca dan sel-sel granulosa. Sel-sel theca diketahui memproduksi transforming growth factors (TGFs) α dan β, hepatocyte growth factor (HGF), dan keratinocyte growth factor (KGF) untuk mengatur pertumbuhan dan fungsi sel-sel granulosa (Nilsson et al. 2001, Demeestere et al. 2005). Sebaliknya sel-sel granulosa memproduksi kit ligand yang mengatur pertumbuhan sel-sel theca dan menstimulasi produksi TGFs, HGF, dan KGF (Parrot et al. 1998, Nilsson et al. 2001).
Penelitian menunjukkan bahwa oosit mensekresikan faktor-faktor yang menginisiasi pertumbuhan folikel primordial dan mengatur aksi gonadotropin follicle stimulating hormone (FSH) dan luteinizing hormone (LH) terhadap pertumbuhan folikel preantral dan antral (Knight & Glister 2006, Mc Natty et al. 2007). Banyak yang diduga sebagai regulator folikulogenesis in vivo telah teridentifikasi. Tyrosine kinase receptor Kit dan dua isoform ligand yang berbeda (kit ligand, KL) terdeteksi di oosit dan sel-sel granulosa, faktor ini mendorong pertumbuhan oosit dan mempertahankan meiotic arrest sebagai respon terhadap level reseptor FSH (FSHR). Konsentrasi FSH yang rendah mendorong pertumbuhan oosit dengan menurunkan rasio KL-1/KL-2, sedangkan jika konsentrasi FSH tinggi perkembangan folikel meningkat tetapi pertumbuhan oosit terganggu (Thomas & Vanderhyden 2007). Regulator lain meliputi epidermal growth factor (EGF, Qu et al. 2000) dan reseptornya; activin (Telfer et al. 2008); basic fibroblastic growth factor (bFGF, Shikone et al. 1992), anggota-anggota
insulin-like growth factor (IGF) dan protein-protein pengikatnya (Thomas et al. 2007), anggota-anggota TGFβ (Knight & Glister 2006).
Gambar 1. Faktor - faktor yang terlibat dalam pengontrolan perkembangan folikel : efek negatif(anak panah merah), efek positif (anak panah kuning). GDF, growth differentiation factor-9; KGF, keratinocyte growth factor; GH, growth hormone; IGF-I, insulin growth factor-I; KL, kit ligand; LIF, leukemia inhibitory factor; EGF, epidermal growth factor; BMP-15, bone morphogenic protein-15; HGF, hepatocyte growth factor; MIS, mullerian-inhibiting substance; FSH, follicle-stimulating hormone; LH, luteinizing hormone; R-LH dan R-FSH, receptors for LH dan FSH; Testo, testosterone; GCs, granulosa cells. (Demesteere et al. 2005).
Beberapa anggota TGFβ (Transforming Growth Factor) superfamily mempunyai peran penting selama perkembangan folikel. TGF-TGF ini diproduksi baik oleh oosit maupun sel-sel somatik di sekelilingnya (sel-sel theca dan granulosa). Pro-protein convertase adalah anggota dari tujuh protein yang dikenal yang memproses ligan-ligan TGF serta produk yang disekresikan lainnya ke bentuk aktifnya (Diaz et al. 2007)
TGF-β superfamily mencakup faktor-faktor seperti activin, inhibin, growth differentiation factor (GDF-9), bone morphogenic protein (BMP), anti-mullerian hormone (AMH) yang mempengaruhi perkembangan folikel. GDF-9 dan BMP-15 diekspresikan oleh oosit primer dan folikel antral dan memainkan peranan penting dalam rekruitmen folikel awal. GDF-9 dan BMP-15 dapat menstimulasi proliferasi sel-sel granulos dalam folikel-folikel preantral melalui mekanisme
yang tergantung FSH (Shimasaki et al. 2004), dan mendorong biosintesis kolesterol dalam sel-sel cumulus (Su et al. 2008). Activin A telah dibuktikan dapat meningkatkan proliferasi sel-sel granulosa dalam kultur folikel in vitro tikus (Li et al. 1995), meningkatkan perkembangan folikel primordial manusia untuk membentuk folikel antral dengan oosit yang utuh (Telfer et al. 2008).
Faktor lain yang diketahui dapat mendorong perkembangan folikel preantral adalah EGF. Konsentrasi fisiologis EGF pada kultur folikel mencit adalah 1 ng/ml, pada konsentrasi ini EGF meningkatkan jumlah folikel yang mencapai tahap antral (Demeestere et al. 2005). Perlakuan EGF pada sel-sel granulosa dan folikel-folikel menghambat onset spontan cleavage DNA apoptosis selama kultur sebesar 40-60% melalui jalur tirosin kinase. EGF juga berperan dalam memediasi aksi LH dalam proses ovulasi (Park et al. 2004, Ashkenazi et al. 2005). Dole et al. (2008) menemukan bahwa suatu faktor yang disebut glial-derived neurotrophic factor (GDNF) mendorong perkembangan folikel primordial dan memediasi interaksi sel-sel autokrin dan parakrin yang diperlukan selama folikulogenesis.
Maturasi Oosit dan Ovulasi
Pada mamalia, meiosis terjadi dalam waktu yang panjang. Oogonia mengalami meiosis tetapi terhenti pada tahap diploten profase pertama (Eppig et al 2004). Meiosis akan dimulai kembali akibat pengaruh LH dari kelenjar pituitari selama siklus estrus atau menstruasi beberapa saat sebelum ovulasi. Proses oosit menyelesaikan pembelahan meiosis pertama dan mengalami perubahan sitoplasma kemudia berlanjut ke metafase II dikenal dengan maturasi oosit (Mehlmann 2005).
Selama perkembanganan folikel, sel-sel somatik membelah dan membentuk beberapa lapisan, oosit membesar, dan antrum mulai terbentuk. Beberapa folikel direkrut untuk melanjutkan pertumbuhan, keberhasilan pertumbuhan tergantung pada FSH (Wu et al. 2007, Zeleznik 2004). Setelah terbentuknya antrum, sel-sel granulosa terbagi menjadi dua kompartemen yaitu sel-sel granulosa mural yang membentuk lapisan luar dan sel-sel cumulus yang mengelilingi oosit. Oosit tumbuh ke ukuran maksimumnya tetapi tetap bertahan di
profase I (Eppig et al. 2004). Meiotic arrest tersebut diatur oleh level cAMP dalam oosit (Conti et al. 2002, Eppig et al. 2004).
Reseptor-reseptor LH berada di sel-sel granulosa mural tetapi tidak ada di sel-sel cumulus atau oosit (Peng et al. 1991, Eppig et al. 1997) sehingga mekanisme stimulasi maturasi oosit oleh LH bersifat tidak langsung. Aksi LH terhadap sel-sel granulosa mural diterjemahkan ke dalam perubahan molekul-molekul sinyal di dalam oosit untuk menginisiasi pembelahan meiosis (Mehlmann 2005). Sebelum pertengahan siklus surge LH, oosit yang sedang tumbuh membutuhkan kemampuan untuk melakukan proses maturasi. Kemampuan tersebut diperoleh di sekitar waktu pembentukan antrum (Mehlmann et al. 2004) dan berkaitan dengan pencapaian level ambang protein-protein yang mempromosi maturasi seperti CDK1 (cyclin-dependant kinase) dan cyclin pada oosit (Kanatsu-Shinohara et al. 2000).
Mekanisme aksi LH pada sel-sel granulosa kemudian menggertak oosit memulai meiosis belum diketahui (Mehlmann 2005). Beberapa penelitian menunjukkan bagaimana sinyal LH ditransmisikan dari eksterior ke interior folikel. Sel-sel granulosa mural mengekspresikan RNA yang mengkode protein-protein epidermal growth factor (EGF)-like dalam 1–3 jam setelah stimulasi reseptor LH (Park et al. 2004, Ashkenazi et al. 2005). Protein-protein tersebut khususnya amphiregulin dan epiregulin, mendorong proses maturasi oosit baik yang masih ada dalam folikel maupun cumulus oocyte complex (COC) di luar folikel (Coticchio et al. 2004, Mehlmann 2005). Protein-protein tidak dapat mendorong maturasi pada oosit tanpa sel-sel cumulusnya (Mehlmann 2005). Park et al. (2004) melaporkan bahwa penghambatan secara farmakologis reseptor EGF pada folikel yang dikultur menghambat maturasi oosit yang diinduksi LH.
Maturasi oosit adalah fase akhir dari folikulogenesis in vitro. Optimasi medium kultur untuk maturasi sangat diperlukan (Filali et al. 2008) seperti halnya menguji peran zat-zat tambahan yang relevan secara fisiologis seperti human chorionic gonadotrophin (hCG, Ge et al 2008), umbiliocal cord blood (Zhang et al. 2007), dan FCS (van Wagtendonk-de Leeuw et al. 2000). Demeestere et al. (2005) melaporkan bahwa penambahan LH dan EGF pada akhir periode kultur in vitro folikel preantral meningkatkan perolehan oosit matang.
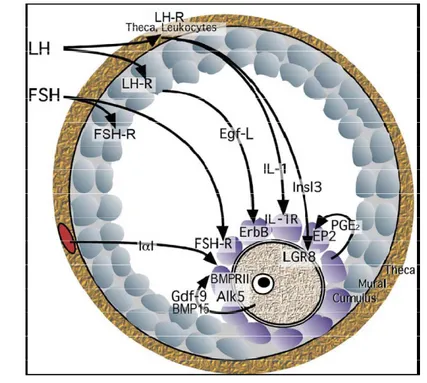
Bersaman dengan proses maturasi akhir dari oosit, inisiasi ovulasi juga berlangsung. Ovulasi in vivo terjadi karena kombinasi antara mekanisme yang meliputi: (a) mekanisme neuroendokrin dan endokrin, LH-RH, steroid, dan prostaglandin; (b) mekanisme neurobiokimia dan farmakologi; (c) mekanisme neuromuscular dan neurovascular, dan interaksi enzimatik (Hafez 1993). Ovulasi dimediasi oleh sinyal-sinyal intraovarian yang kompleks (Russel & Robker 2007, Gambar 2).
Gambar 2. Sinyal-sinyal intraovarian yang memediasi ovulasi pada mencit. Gdf-9, growth
and differentiation factor-9; BMP-15, bone morphogenetic protein-15; PGE2,
prostaglandin E2; EP2, PGE2 receptor. LH-R, luteinizing hormone receptor; FSH-R, follicle-stimulating hormone receptor; ErbB, Egf receptor family; Alk5, activin receptor-like kinase-5; BMPRII, BMP receptor type-II; LGR8, Insl3 receptor; IL-1R, interleukin-1 receptor. (Russell & Robker 2007)
LH surge dari hipotalamus menginisiasi sinyal-sinyal sekunder dari folikel yang terpusat pada COC. Di kompartemen theca. LH bekerja pada sel-sel theca atau leukosit untuk menginduksi sekresi Insl-3 dan IL-1. Di lapisan granulosa mural, Egf-L (ampiregulin, epiregulin dan betacellulin) diproduksi dan mentranduksi sinyal ovulasi ke sel-sel cumulus. FSH bekerja secara langsung pada reseptor-reseptor yang diekspresikan sel-sel mural dan sel-sel cumulus. IαI
memasuki cumulus complex dari sirkulasi. Di dalam COC, GDF-9 dan atau BMP-15 dari oosit mempengaruhi sel-sel cumulus secara parakrin melalui dimer reseptor Alk5/BMPRII. Prostaglandin E2 (PGE2) bekerja secara autokrin melalui reseptor PGE2 (EP2)(Russel & Robker 2007).
DAFTAR PUSTAKA
Abir R, Roizman P, Fisch B, Nitke S, Okon E, et al. 1999. Pilot study of isolated early human follicles cultured in collagen gels for 24 hours. Hum Reprod 14: 1299–1301.
Allan CM, Wang Y, Jimenez M, Marshan B, Spaliviero J, et al. 2006. Follicle-stimulating hormone increase primordial follicle reserve in mature female hypogonadal mice. Endocrinology 188: 549-557.
Amorim CA, Van Langendonckt A, David A, Dolmans MM, Donnez J. 2009. Survival of human pre-antral follicles after cryopreservation of ovarian tissue, follicular isolation and in vitro culture in a calcium alginate matrix. Hum Reprod 24(1): 92–99.
Ashkenazi H, Cao X, Motola S, Popliker M, Conti M, et al. 2005. Epidermal growth factor family members: endogenous mediators of the ovulatory response. Endocrinology 146: 77-84.
Attisano L, Carcamo J, Ventura F, Weis FM, Massague J, et al. 1993. Identification of human activin and TGF beta type I receptors that form heteromeric kinases complexes with type II receptors. Cell 75: 671-680.
Baird DT, Webb R, Campbell BK, Harkness LM, Gosden RG. 1999. Long-term ovarian function in sheep after ovariectomy and transplantation of autografts stored at -196oC. Endocrinology 140:462–471.
Bedaiwy MA, Hussein MR, Biscotti C, Falcone T. 2006. Cryopreservation of intact human ovary with its vascular pedicle. Hum Reprod 21 (12): 3258– 3269.
Candy CJ, Wood MJ, Whittingham DG. 1997. Effect of cryoprotectants on the survival of follicles in frozen mouse ovaries. J Reprod Fertil 110:11-19. Candy CJ, Wood MJ, Whittingham DG. 2000. Restoration of a normal
reproductive lifespan after grafting of cryopreserved mouse ovaries. Hum Reprod 15:1300-1304.
Carvalho FCA, Lucci CM, Silva JRV, Andrade ER, Bao SN, et al. 2001. Effect of Braun-Collins and Saline solutions at different temperatures and incubation
times on the quality of goat preantral follicles preserved in situ. Anim. Reprod Sci 66: 195–208.
Chang SCS, Anderson W, Lewis JC, Ryan RJ, Kang YH. 1977. The porcine ovarian follicle. II. Electron microscopic study of surface features of granulosa cells at different stages of development. Biol Reprod 16: 349– 357.
Chen SU, Chien CL, WuMY, Chen TH, Lai SM, et al. 2006. Novel direct cover vitrification for cryopreservation of ovarian tissues increases follicle viability and pregnancy capability in mice. Hum Reprod 21(11): 2794– 2800.
Conti M, Andersen CB, Richard F, Mehats C, Chun SY, et al. 2002. Role of cyclic nucleotide signaling in oocyte maturation. Mol Cell Endocrinol 187:153–159.
Cortvrindt R, Smitz J, Van Steirteghem AC. 1996. In vitro maturation, fertilization and embryo development of immature oocytes from early preantral follicles from prepubertal mice in a simplified culture system. Hum Reprod 11: 2656–2666.
Coticchio G, Rossi G, Borini A, Grøndahl C, Macchiarelli G, et al. 2004. Mouse oocyte meiotic resumption and polar body extrusion in vitro are differentially influenced by FSH, epidermal growth factor and meiosis-activating sterol. Hum Reprod 19 2913–2918.
Cox SL, Shaw J, Jenkin G. 1996. Transplantation of cryopreserved fetal ovarian tissue to adult recipient in mice. J Reprod Fertil 107: 315-322.
Donnez J, Martinez-Madrid B, Jadoul P, Van Langendonckt A, Demylle D, et al. 2006. Ovarian tissue cryopreservation and transplantation: a review. Hum Reprod Update 12 (5): 519–535.
Demeestere I, Centner J, Gervy C, Englert Y, Delbaere A. 2005. Impact of various endocrine and paracrine factor on in vitro culture of preantral follicles in rodents. Reproduction 130:147-156.
Diaz FJ, Wigglesworth K, Eppig JJ. 2007. Oocytes are required for the preantral granulosa cell to cumulus cell transition in mice. Dev Biol 305: 300–311. De Jong FH, Welschen R, Hermans WP, Smith SD, van der Molen HJ. 1979.
Effects of factors from ovarian follicular fluid and Sertoli cell culture medium on in vivo and in vitro release of piyuitary gonadotrophins in the rat: an evaluation of systems for assay of inhibin. J Reprod Fertil 26: 47-59. Dole G, Nillson EE, Skinner MK. 2008. Glial-derived neurotrophic factor
promotes ovarian primordial follicle development and cell-cell interaction during folliculogenesis. Reproduction 135 : 671-682.
Eppig JJ, Vivieros MM, Marin-Bivens C, De La Fuente R. 2004. Regulation of mammalian oocyte maturation. In The Ovary, pp 113–129. Eds PCK Leung & EY Adashi. Amsterdam: Elsevier Academic Press.
Eppig JJ, Wigglesworth K, Pendola F, Hirao Y. 1997. Murine oocytes suppress expression of luteinizing hormone receptor messenger ribonucleic acid by granulosa cells. Biol Reprod 56: 976–984.
Eppig JJ, Wigglesworth K, O’Brien MJ. 1992. Comparison of embryonic development competence of mouse oocytes grown with and without serum. Mol Reprod Dev 32: 33-34.
Fair T, Hulshof SCJ, Hyttel P, Greve T. 1997. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anat Embryo 195: 327–336.
Filali M, Hesters L, Franchin R, Tachdjian G, Frydman R, et al. 2008. Retrospective comparison of two media for in vitro maturation of oocytes. Reprode Biomed Online 16: 250–256.
Gandolfi F, Milanesi E, Pocar P, Luciano AM, Brevini TA, et al. 1998. Comparative analysis of calf and cow oocytes during in vitro maturation. Mol Reprod Dev 49: 168–175.
Ge HS, Huang XF, Zhang W, Zhao JZ, Lin JJ, et al. 2008. Exposure to human chorionic gonadotrophin during in vitro maturation does not improve the maturation rate and developmental potential of immature oocytes from patients with polycystic ovary syndrome. Fertil Steril 89: 98–103.
Gougeon A. 1996. Regulation of ovarian follicular development in primates – facts and hypotheses. Endoc Rev 17: 121–155.
Gunasena KT, Lakey JR, Villines PM. 1997. Allogeneic and xenogeneic transplantation of cryopreserved ovarian tissue to athymic mice. Biol Reprod 57: 226-231.
Gutierrez CG, Ralph JH, Telfer EE, Wilmut I, Webb R. 2000. Growth and antrum formation of bovine preantral follicles in long-term culture in vitro. Biol Reprod 62: 1322–1328.
Harp R, Leibach J, Black J. 1994. Cryopreservation of murine ovarian tissue. Cryobiology 31: 336-343.
Harris SE, Picton HM. 2007. Metabolism of follicles and oocytes during growth and maturation. In In-Vitro Maturation of Human Oocytes – Basic Science to Clinical Application, pp 15–36. Eds Tan SL, Chian RC, Buckett WM. Oxon, UK: Informa Health.
Harris SE, Adriaens I, Leese HJ, Gosden RG, Picton HM. 2007. Carbohydrate metabolism by murine ovarian follicles and oocytes grown in vitro. Reproduction 134 415–424.
Hu Y, Betzendahl I, Cortvrindt R, Smitz J, Eichenlaub-Ritter U. 2001. Effects of low O2 and ageing on spindles and chromosomes in mouse oocytes from pre-antral follicle culture. Hum Reprod 16 :737–748.
Jin P,Harris SE, Picton HM. 2004. The effect of ascorbic acid onovine preantral follicle development in vitro. Proceedings of the Society for Reproduction and Fertility, 2004 Annual Conference, Ghent, Belgium. P22.
Kanatsu-Shinohara M, Schultz RM, Kopf GS. 2000. Acquisition of meiotic competence in mouse oocytes: absolute amounts of p34cdc2, cyclin B1, cdc25C, and wee1 in meiotically incompetent and competent oocytes. Biol Reprod 63: 1610–1616.
Kerr JB, Ducket R, M. Myers, KL Britt, T Mladenovska, Findlay JK. 2006. Quantification of healthy follicles in the neonatal and adult mouse ovary: evidence for maintenance of primordial follicle supply. Reproduction 132: 95-109.
Knight PG, Glister C. 2006. TGF-b superfamily members and ovarian follicle development. Reproduction 132 191–206.
Kreeger PK, Deck JW, Woodruff TK, Shea LD. 2006. The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials 27:714–23.
Lima GL, Costa LLM, Cavalcanti DMLP, Rodrigues CMF, Freire FAM et al. 2010. Short-term storage of canine preantral ovarian follicles using a powdered coconut water (ACP1)-based medium. Theriogenology doi:10.1016/ j.theriogenology.2010.01.025
Liu J, Van der Elst J, Van den Broecke R, Dhont M. 2001. Live offspring by in vitro fertilization of oocytes from cryopreserved primordial mouse follicles after sequential in vivo transplantation and in vitro maturation. Biol Reprod 64:171–8.
Lopes CAP, Santos RR, Celestinoa JJH, Meloa JAP, Chaves RN et al. 2009. Short-term preservation of canine preantral follicles: Effects of temperature, medium and time. Anim Reprod Sci 115: 201–214.
Lucci CM, Kacinskis MA, Rumpf R, Ba´o. SN 2004. Effects of lowered temperatures and media on short-term preservation of zebu (Bos indicus) preantral ovarian follicles. Theriogenology 61: 461–472.
Lucci CM, Schreier LL, Machado GM, Amorim CA, Bao SN, Dobrinsky JR. 2007. Effects of storing pig ovaries at 4 or 20oC for different periods of time on the morphology and viability of pre-antral follicles. Reprod Dom Anim 42: 76–82.
Martinez-Madrid B, Dolmans MM, Van Langendonckt A, Defrere S, Donnez J.2004. Freeze-thawing intact human ovary with its vascular pedicle with a passive cooling device. Fertil Steril 82:1390–1394.
Mason AJ, Niall HD, Seeburg PH. 1986. Structure of two human ovarian inhibins. Biochem Biophys. Res. Commun. 135: 957-964.
McCaffery FH, Leask R, Riley SC, Telfer EE. 2000. Culture of bovine preantral follicles in a serum-free system: markers for assessment of growth and development. Biol Reprod 63: 267–273.
McNatty KP, Heath DA, Lundy T, Fidler AE,Quirke L, et al. 1999. Control of early ovarian follicular development. J Reprod Fertil 49: 123–135.
McNatty KP, Reader K, Smith P, Heath DA, Juengel JL. 2007. Control of ovarian follicular development to the gonadotrophin-dependent phase: a 2006 perspective. Society of Reproduction and Fertility 64: 55–68.
Mehlmann LM. 2005. Stops and starts in mammalian oocytes: recent advances in understanding the regulation of meiotic arrest and oocyte maturation. Reproduction 130: 791–799.
Mehlmann LM, Saeki Y, Tanaka S, Brennan TJ, Evsikov AV, et al. 2004. The Gs-linked receptor GPR3 maintains meiotic arrest in mammalian oocytes. Science 306: 1947–1950.
Moravia W, Picton HM, Rodway RG, Joyce IM 2005 In vitro growth of oocytes from primordial follicles isolated from frozen–thawed lamb ovaries. Theriogenology 64 1357–1370.
Muruvi W, Picton HM, Rodway RG, Joyce IM. 2009. In vitro growth and differentiation of primary follicles isolated from cryopreserved sheep ovarian tissue. Anim Reprod Sci 112:36–50.
Nayudu PL, Osborn SM. 1992. Factors influencing the rate of preantral and antral growth of mouse ovarian folliecles in vitro. J Reprod Fertil 95: 349-363. Newton H, Picton HM, Gosden RG. 1999. In vitro growth of oocyte– granulosa
cell complexes isolated from cryopreserved ovine tissue. J Reprod Fertil 115: 141–150.
O’Brien MJ, Pendola JK, Eppig JJ. 2003. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol Reprod 68: 1682-1686. Onions VJ, Mitchell MRP, Campbell BK, Webb R. 2008. Ovarian tissue viability
following whole ovine ovary cryopreservation: assessing the effects of sphingosine-1-phosphate inclusion. Hum Reprod 23 (3 ): 606–618.
Oktay K, Karlikaya GG, Aydin BA. 2000. Ovarian cryopreservation and transplantation: basic aspects. Mol Cell Endocrinol 169:105–108.
Oktem O, Oktay K. 2007. The role of extracellular matrix and activin-A in vitro growth and survival of murine preantral follicles. Reprod Sci 14 (4): 358-366.
Pan H, O’Brien MJ,Wigglesworth K, Eppig JJ, Schultz RM. 2005. Transcript profiling during mouse oocyte development and the effect of gonadotrophin priming and development in vitro. Dev Biol 286: 493–506.
Park JY, Su YQ, Ariga M, Law E, Jin SL, et al. 2004. EGF-like growth factors as mediators of LH action in the ovulatory follicle. Science 303: 682–684.
Peng XR, Hsueh AJ, LaPolt PS, Bjersing L, Ny T. 1991. Localization of luteinizing hormone receptor messenger ribonucleic acid expression in ovarian cell types during follicle development and ovulation. Endocrinology 129 3200– 3207.
Peters H, Byskov AG, Himelstein-Braw R, Faber M .1975. Follicular growth: the basic event in the mouse and human ovary. J Reprod Fertil 45: 559–566. Picton HM, Campbell BK, Hunter MG. 1999. Maintenance of oestradiol
production and cytochrome P450 aromatase enzyme messenger ribonucleic acid expression in long-term serum-free cultures of porcine granulosa cells. J Reprod Fertil 115: 67–77.
Picton HM, Muruvi W, Jin P. 2007. Interaction of oocyte and somatic cells. In In-Vitro Maturation of Human Oocytes – Basic Science to Clinical Application, pp 37–48. Eds SL Tan, RC Chian &WM Buckett. Oxon, UK: Informa Health.
Picton HM, Harris SE, Muruvi W, Chambers EL. 2008. The in vitro growth and maturation of follicles Reproduction 136: 703–715.
Rall WF, Fahy GM. 1985. Ice-free cryopreservation of mouse embryo at 196 oC. Nature 313: 573-575.
Richard FJ, Sirard MA. 1996. Effects of follicular cells on oocyte maturation.II. Theca cell inhibition of bovine oocyte maturation in vitro. Biol Reprod 54: 22–28.
Rivier C, Meunier H, V Roberts V, Vale W. 1990. Inhibin: role and secretion in the rat. Recent Prog. Horm. Res. 46: 231-57
Roberts R, Franks S, Hardy K. 2002. Culture environment modulates maturation and metabolism of human oocytes. Hum Reprod 17: 2950–2956.
Rose UM, Hanssen RG, Klosterboer HJ. 1999. Development and characterization on an in vitro ovulation model using mouse ovarian follicles. Biol Reprod 61: 503-511.
Russell DL, Robker RL. 2007.
Molecular mechanisms of ovulation:co-ordination through the cumulus complex. Hum Reprod Update 13(3): 289– 312.
Shoji H, Tsuchida K, Kishi H, Yamakawa N, Matsuzaki T et al. 2000. Identification and characterization of a PDZ protein that interact with activin type II receptors. J Biol Chem 275: 5485-5492.
Silva JRV, Lucci CM, Carvalho FCA, Bao SN, Costa SHF, et al. 2000. effect of coconut water and Braun-Collins solutions at different suhuees and incubation times on the morphology of goat preantral follicles preserved in vitro. Theriogenology 54: 809–822.
Smith JC, Price BM, Green JB, Weigel D, Herrmann BG. 1991. Expression of a Xenopus homolog of Brachyury (T) is an immediate-early response to mesoderm. Cell 67: 79-87.
Telfer EE. 1996. The development of methods for isolation and culture of preantral follicles from bovine and porcine ovaries. Theriogenology 45: 101–110.
Telfer EE, Gosden RG, Byskov AG, Spears N, Anderson R, et al. 2005. On regenerating the ovary and generating controversy. Cell 122: 821-822. Telfer EE, McLaughlin M, Ding C, Thong KJ. 2008. A two-step serum-free
culture system supports development of human oocytes from primordial follicles in the presence of activin. Hum Reprod 23: 1151–1158.
Thomas FH, Campbell BK, Armstrong DG, Telfer EE. 2007. Effects of IGF-I bioavailability on bovine preantral follicular development in vitro. Reproduction 133: 1121–1128.
Tilly JL. 1996. Apoptosis and ovarian function. Rev Reprod 1: 162-172.
Tsuribe PM, Gobbo CAM, Landim-Alvarenga FC. 2009. Viability of primordial follicles derived from cryopreserved ovine ovarian cortex tissue. Fertil Steril 91(5) Supplement: 1976-1983.
Van Wagtendonk-de Leeuw AM, Mullaart E, de Roos APW, Merton JS, den Daas JHG, et al. 2000. Effects of different reproductive techniques: AI, MOET or IVP on health and welfare of bovine offspring. Theriogenology 53: 575– 597.
Von Wolff M, Donnez J, Hovatta O, Keros V, Maltaris T, et al. 2009. Cryopreservation and autotransplantation of human ovarian tissue prior to cytotoxic therapy–a technique in its infancy but already successful in fertility preservation. Eur J Cancer 45:1547–53.
West ER, Xu M, Woodruff TK, Shea LD. 2007. Physical properties of alginate hydrogels and their effects on in vitro follicle development. Biomaterials 28: 4439–4448.
Wu J, Xu B,WangW. 2007. Effects of luteinizing hormone and follicle stimulating hormone on the developmental competence of porcine preantral follicle oocytes grown in vitro. J. Assist. Reprod. Genet. 24: 419–424.
Wu J, Emery BR & Carrell DT 2001 In vitro growth, maturation, fertilization, and embryonic development of oocytes from porcine preantral follicles. Biol Reprod 64: 375–381.
Xu M, Banc A, Woodruff TK, Shea LD. 2009. Secondary follicle growth and oocyte maturation by culture in alginate hydrogel following cryopreservation of the ovary or individual follicles. Biotechnol Bioeng 103:378–86.
Xu M, Kreeger PK, Shea LD, Woodruff TK. 2006a. Tissueengineered follicles produce live, fertile offspring. Tissue Eng 2:2739–46.
Xu M,West E, Shea LD,Woodruff TK. 2006b. Identification of a stage-specific permissive in vitro culture environment for follicle growth and oocyte development. Biol Reprod 75:916–23.
Ye J, Coleman J, Hunter MG, Craigon J, Campbell KH, Luck MR. 2007. Physiological suhue variants and culture media modify meiotic progression and developmental potential of pig oocytes in vitro. Reproduction 133: 877– 886.
Ying SY, Zhang Z, Huang G. 1997. Expression and localization of inhibin/activin subunits and activin receptors in the normal rat prostate. Life Sci 60(6): 397-401.
Zeleznik AJ. 2004. Dynamics of primate follicular growth: a physiological perspective. In The Ovary, edn 2, pp 45–53. Eds Leung PCK, Adashi EY. Amsterdam, Elsevier Academic Press.
PRESERVASI OVARIUM DAN PENGARUHNYA TERHADAP
MORFOLOGI FOLIKEL DOMBA
ABSTRAK
Penelitian ini bertujuan untuk mempelajari pengaruh penyimpanan ovarium pada suhu dingin dan beku terhadap morfologi folikel domba. Penelitian ini terdiri dari 2 eksperimen. Pada eksperimen 1, ovarium disimpan dalam larutan PBS pada suhu: a) -20 oC, b) suhu kamar (25 oC) selama 24 jam, c) suhu 5oC selama 24 jam dan d) 72 jam. Setelah penyimpanan, folikel-folikel dievaluasi secara histologis. Pada eksperimen 2, cortex ovarium dipisahkan dari ovarium dan dibentuk dalam potongan berukuran ±1 mm3. Potongan jaringan diletakkan di atas hemistraw dan ditransfer ke larutan ekuilibrasi masing-masing selama 10, 20, dan 30 menit pada suhu kamar, selanjutnya dipindahkan ke larutan vitrifikasi selama 3 menit. Hemistraw beserta jaringan dicelupkan dalam nitrogen cair. Setelah thawing, dilakukan preparasi histologis. Seluruh folikel mengalami kerusakan morfologi setelah penyimpanan ovarium pada suhu kamar selama 24 jam. Persentase folikel dengan morfologi normal menurun secara nyata pada jaringan ovarium yang disimpan pada suhu -20 oC selama 24 jam, pada suhu 5 oC selama 24 jam dan 72 jam, penyimpanan pada suhu 5 oC selama 24 jam memberikan hasil lebih baik (P<0,05). folikel antral rusak pada semua perlakuan. Folikel-folikel primordial mempertahankan keutuhan morfologinya lebih baik daripada folikel-folikel yang sedang tumbuh. Pemaparan jaringan ke larutan ekuilibrasi selama 10 min menghasilkan lebih banyak folikel-folikel dengan morfologi normal (P<0,05).
Kata-kata kunci: ovarium, preservasi, vitrifikasi, domba ABSTRACT
The purpose of this study was to evaluate the effect of cooling and freezing of ovarian tissue on the follicles morphology in ovine. The study was carried out in 2 experiments. Experiment 1, ovaries were maintained in PBS at: a) -20 oC and b) room suhu (RT, 25 oC) for 24 h, c) 5 oC for 24 h and 72 h. After storage, follicles were histologically evaluated. Experiment 2, the ovarian cortex was isolated and tissue slices (±1 mm3) were prepared. The tissues were loaded into hemistraw and transferred into the equilibration solution at room suhu and held for 10, 20, 30 min, respectively, then in to vitrification solution for 3 min. The hemistraw was placed directly into liquid nitrogen. After thawing, the tissues were prepared for histological examination. No follicle survived after 24 h storage at RT. The percentage of morphologically normal follicles was significantly reduced in ovarian tissue stored at -20 oC for 24 h and at 5 oC for 24 h and 72 h,5oC for 24 h gave the better results (P<0.05). Antral follicles were damaged in all treatment. Exposing tissue to equilibration medium for 10 min had higher morphologically normal follicles (P<0.05), no difference results between 20 min and 30 min exposing time (P>0.05). Frozen-thawed tissues had fewer morphologically normal follicles than equilibration solution-exposed tissues with similar pattern among the treatment (P<0.05). We conclude that storage of ovine ovaries for up to 24 h at -20 oC, RT, and 5 oC declined the number of
morphologically normal follicle, 5 C storage gave the better results. Primordial follicles preserved their morphology intactness better than growing follicles. Good morphology of follicles was confirmed when exposing tissue to equilibration for 10 min.
Key words : ovarium, follicle, preservation, vitrification, ovine PENDAHULUAN
Ovarium dari hewan yang dipotong atau mati karena sebab lain memiliki nilai ekonomis rendah karena ukurannya sangat kecil. Ovarium ini sebenarnya bisa dimanfaatkan untuk produksi anak dengan mengaplikasikan teknologi reproduksi melalui produksi embrio in vitro, salah satu caranya adalah mengoptimalkan potensi folikel-folikel yang terkandung di dalamnya. Folikel-folikel ini merupakan struktur dasar dan unit fungsional ovarium mamalia yang menyediakan lingkungan mikro yang dibutuhkan untuk pertumbuhan dan maturasi oosit, lebih dari 90% merupakan folikel preantral (Lucci et al. 2007). Cadangan folikel-folikel mamalia yang belum tumbuh berisi oosit yang beristirahat pada tahap diploten dari profase meiotik (Telfer et al. 2005), pada domba jumlahnya berkisar 36.000 folikel per ovarium (Rosadi et al. 2010). Dari sejumlah besar folikel hanya 0,01% yang ovulasi sepanjang masa produktifnya (Santos et al. 2006).
Ovarium domba berguna dalam riset reproduksi manusia sebab ovarium domba cocok sebagai model ovarium manusia karena persamaan ukuran dan kondisi jaringan (Oktay et al. 2000, Picton et al. 2008). Penggunaan ovarium dalam riset bidang ini banyak diarahkan ke masalah infertilitas dan preservasi ovarium khususnya pada wanita-wanita penderita kanker. Seperti diketahui, ovarium sangat sensitif terhadap obat kanker kelompok alkilating agent (cyclophosphamide, busulfan, melphalan, chlorambucil, dacarbazine, procarbazine, dll.) yang diklasifikasikan memiliki resiko tinggi terhadap disfungsi gonad (Blumenfeld et al. 2000, Kenney et al. 2001, Tauchmanova et al. 2002).
Bioteknologi yang dikembangkan untuk isolasi,kriopreservasi dan kultur folikel preantral ditujukan untuk mencegah atresia folikel dengan menyelamatkan folikel-folikel preantral dari ovarium dan maturasi folikel-folikel tersebut selama kultur in vitro (Matos et al. 2004). Penelitian-penelitian menunjukkan bahwa
kualitas oosit dalam folikel-folikel preantral tergantung pada medium preservasi, suhu dan waktu inkubasi selama transportasi dan penyimpanan ovarium (Carvalho et al. 2001, Lima et al. 2010). Penyimpanan ovarium jangka pendek yang telah dicoba pada kambing (Silva et al. 2000, Carvalho et al. 2001), sapi (Lucci et al. 2004), babi (Lucci et al. 2007) dan anjing (Lopes et al. 2009, Lima et al. 2010) menunjukkan bahwa suhu 4 oCmemungkinkan preservasi folikel selama 24 jam, sedangkan pada suhu lebih tinggi hanya mampu mempreservasi folikel sampai 6-8 jam.
Kriopreservasi potongan jaringan cortex atau ovarium utuh yang memungkinkan penyimpanan jaringan ovarium jangka panjang dapat mempertahankan fungsi ovarium, dan bermanfaat dalam mempertahankan spesies yang terancam punah serta menyelidiki fenomena folikulogenesis awal (Onions et al., 2008). Kriopreservasi telah diaplikasikan untuk mempertahankan fertilitas pada pasien kemoterapi kanker (Donnez et al. 2006).
Metode slow freezing menggunakan mesin pembekuan terprogram adalah metode konvensional kriopreservasi jaringan ovarium, proses pembekuan membutuhkan waktu lebih dari satu jam. Vitrifikasi merupakan metode alternatif untuk kriopreservasi jaringan ovarium, konsentrasi krioprotektan yang digunakan lebih tinggi dan laju pendinginan lebih cepat, tidak menimbulkan terbentuknya kristal es serta tidak membutuhkan perlatan khusus (Yoeman et al. 2005). Metode vitrifikasi dapat mempertahankan viabilitas folikel preantral lebih baik dibandingkan metode pembekuan konvensional (Chen et al 2006).
Pada penelitian ini dicoba metode penyimpanan pada berbagai tingkat suhu yaitu suhu kamar (25 oC), 5 oC, -20 oC, dan vitrifikasi (-196 oC). Diharapkan dari eksperimen ini diketahui suhu dan lama penyimpanan ovarium domba yang dapat mempertahankan viabilitas folikel domba dilihat berdasarkan keutuhan morfologinya.