MAKALAH
MAKALAH
KATALIS HOMOGEN
KATALIS HOMOGEN
–
–
KATALIS DALAM MISEL
KATALIS DALAM MISEL
Disusun untuk Memenuhi Tugas
Disusun untuk Memenuhi Tugas
pada Mata Kuliah Kimia Katalis
pada Mata Kuliah Kimia Katalis
yang Diampu oleh Ibu Dra. Arnelli, M.S.
yang Diampu oleh Ibu Dra. Arnelli, M.S.
OLEH:
OLEH:
Nur
Nur Kamila
Kamila
24030114140106
24030114140106
Shella
Shella Valentina
Valentina Yuliani
Yuliani 24030114120064
24030114120064
DEPARTEMEN KIMIA
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN MATEMATIKA
FAKULTAS SAINS DAN MATEMATIKA
UNIVERSITAS DIPONEGORO
UNIVERSITAS DIPONEGORO
SEMARANG
SEMARANG
2017
2017
BAB I
PENDAHULUAN
I.1 Latar Belakang
Reaksi kimia sealu berikatan dengan perubahan dari suatu pereaktan (reaktan) menjadi hasil reaksi (produk). Dalam reaksi kimia, cepat atau lambatnya suatu reaksi dapat berlangsung ditentukan oleh laju reaksinya. Laju reaksi dapat dinyatakan sebagai berkurangnya jumlah (konsentrasi) pereaksi per satuan waktu atau bertambahnya jumlah (konsentrasi) hasil reaksi per satuan waktu. Terdapat beberapa faktor yang dapat mempengaruhi laju reaksi, diantaranya yaitu konsentrasi reaktan, suhu berlangsungnya reaksi, luas permukaan bidang sentuh reaksi, dan katalis.
Salah satu upaya untuk mempercepat laju reaksi yang banyak dilakukan baik dalam skala laboratorium dan skala industri yaitu penambahan katalis ke dalam suatu reaksi kimia. Katalis merupakan suatu zat yang ditambahkan pada suatu reaksi kimia dengan tujuan untuk mempercepat laju reaksi. Katalis memiliki keistimewaan karena selain katalis mampu mempercepat laju reaksi dengan cara menurunkan energi aktifasi dengan jalan membentuk senyawa antara, katalis dapat diperoleh kembali sebagai bentuk asalnya di akhir proses reaksi. Katalis digolongkan ke dalam dua golongan besar, yang terdiri dari katalis heterogen dan katalis homogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama.
Masing-masing dari katalis heterogen dan katalis homogen terbagi lagi ke dalam beberapa golongan katalis. Salah satunya yaitu pada katalis homogen, terdapat jenis katalis
yang dikenal sebagai katalis dalam misel. Katalis dalam misel ini merupakan salah satu jenis katalis larut air yang mana biasanya agen pengkatalisisnya berupa suatu surfaktan
yang memiliki gugus polar dan non polar secara bersamaan (amfifilik) yang apabila dilarutkan ke dalam air akan membentuk misel bila tercapai konsentrasi misel kritisnya (CMC). Misel yang dihasilkan dari surfaktan ini yang mampu mengkatalisis suatu zat organik (tidak larut air) sehingga mampu bereaksi untuk membentuk suatu produk. Katalis dalam misel ini cukup banyak digunakan karena memiliki keunggulan yaitu sederhana sehingga mudah untuk digunakan dengan biaya yang cukup murah.
I.2 Rumusan Masalah
1. Apa saja jenis-jenis dari katalis dalam misel?
2. Bagaimana cara kerja katalis dalam misel mengkatalisis suatu reaksi? 3. Bagaimana contoh aplikasi katalis dalam misel yang telah dilakukan? 4. Apa kelemahan dan kelebihan dari katalis dalam misel?
I.3 Tujuan
1. Untuk mengetahui jenis-jenis dari katalis dalam misel.
2. Untuk mengetahui cara kerja katalis dalam misel mengkatalisis suatu reaksi. 3. Untuk mengetahui contoh aplikasi katalis dalam misel yang telah dilakukan. 4. Untuk mengetahui kelemahan dan kelebihan dari katalis dalam misel.
BAB II
TINJAUAN PUSTAKA
II.1 Katalis
Katalis merupakan zat yang mampu meningkatkan laju suatu reaksi kimia agar reaksi tersebut dapat berjalan lebih cepat. Dalam suatu reaksi sebenarnya katalis ikut terlibat, tetapi pada akhir reaksi terbentuk kembali seperti bentuknya semula. Dengan demikian, katalis tidak memberikan tambahan energi pada sistem dan secara termodinamika tidak dapat mempengaruhi keseimbangan. Katalis mempercepat reaksi dengan cara menurunkan energi aktivasi reaksi. Penurunan energi aktivasi tersebut terjadi sebagai akibat dari interaksi antara katalis dan reaktan. Katalis menyediakan situs-situs aktif yang berperan dalam proses reaksi. Situs-situs aktif ini dapat berasal dari logam-logam yang terdeposit pada pengemban atau dapat pula berasal dari pengemban sendiri. Logam-logam tersebut umumnya adalah logam-logam transisi yang menyediakan orbital d kosong atau elektron tunggal yang akan disumbangkan pada molekul reaktan sehingga terbentuk ikatan baru dengan kekuatan ikatan tertentu.
II.2 Penggolongan Katalis
Katalis dapat digolongkan ke dalam 2 jenis, yaitu katalis homogen dan katalis heterogen. Dalam reaksi dengan katalis homogen, katalis berada dalam fase yang sama dengan reaktan. Biasanya, semua reaktan dan katalis berada dalam satu fasa tunggal cair atau gas. Dalam reaksi dengan katalis heterogen, katalis dan reaktan berada dalam fase yang berbeda. Katalis heterogen cenderung lebih mudah untuk dipisahkan dan digunakan kembali dari campuran reaksi karena fasa yang digunakan berbeda dengan produk reaksinya. Biasanya katalis heterogen yang digunakan berupa fase padat.
II.3 Katalis dalam Misel
Katalis dalam misel merupakan salah satu jenis katalis homogen yang menggunakan surfaktan sebagai agen pengkatalisis. Karena memanfaatkan surfaktan sebagai agen pengkatalisis maka senyawa-senyawa organik yang tidak larut dalam air dapat
tersolubilisasi ke dalam misel yang terbentuk akibat proses agregasi dari molekul -molekul surfaktan, hal ini lah yang menyebabkan dapat terjadinya reaksi antara reaktan yang memiliki kepolaran yang berbeda untuk membentuk suatu produk.
II.4 Surfaktan
Surfaktan adalah molekul ampifilik atau ampifatik yang terdiri dari dua gugus yaitu gugus hidrofobik yang bersifat non polar dan gugus hidrofilik yang bersifat polar. Semua jenis surfaktan mempunyai struktur dasar yang sama yaitu hidrofilik (suka air) disebut
“kepala” dan hidrofobik (takut air) disebut “ekor” selalu berupa sebuah rantai panjang dari
atom-atom karbon. Bagian ekor, hidrofobik, berinteraksi dengan fasa nonaqueous atau permukaan (atau dirinya sendiri) ketika bagian kepala mencoba untuk meningkatkan
interaksi dalam sistem aqueous. Surfaktan memiliki kemampuan untuk larut dalam air atau minyak yang sesuai, yang menunjukkan aktivitas surfaktan yang berbeda dengan sistem larutan alami dan berbeda pada kondisi yang digunakan. Menurut terminologi “kepala”
menunjuk pada gugus yang melarut disebut gugus lyophilic atau hidrofilik pada sistem
aqueous dan “ekor” menunjuk pada gugus lyo phobic atau hidrofobik pada air. Adapun gugus pada surfaktan dapat dilihat pada Gambar 1.
Gambar 1 : Gugus surfaktan 1
Klasifikasi penggunaan dari surface active agent berdasarkan pada sifat alami dari gugus hidrofilnya dibagi menjadi empat kelas yaitu :
1. Anionik, yaitu gugus hidrofil memiliki muatan negatif seperti karboksil (RCOO-M + ), sulfonat (RSO3-M +), sulfat (ROSO3-M + ), atau fosfat (ROPO3 -M + ).
2. Kationik, yaitu gugus hidrofil mempunyai muatan positif seperti kuartener ammonium halida (R 4 N+X - ) dimana 4 gugus R mungkin dapat sama atau tidak
sama untuk semuanya (tetapi pada umumnya R sama).
3. Nonionik, yaitu gugus hidrofil tidak memiliki muatan, tetapi turunannya dapat larut dalam air dari gugus polar yang tinggi seperti polioxyetilene (POE atau ROCH2CH2O -) atau gugus R-polyol meliputi gula.
4. Amfoterik (zwitterionic) yaitu molekul paduannya bermuatan positif dan negatif, seperti sulfobataine RN+(CH3)2CH2CH2SO3-.
II.5 Pembentukan Misel
Pada konsentrasi yang cukup tinggi, molekul-molekul surfaktan akan beragregat membentuk sebuah struktur melingkar yang disebut micelle, sedangkan gugus hidrofilik berorientasi keluar micelle. Agregasi molekul surfaktan didorong oleh adanya gaya Van
der Waals yang terjadi sepanjang ekor lipofilik dan gaya tolak ionik dari gugus hidrofilik. Ilustrasi pembentukan micelle dapat dilihat pada Gambar 2.
Gambar 2 : Ilustrasi pembentukan misel 1
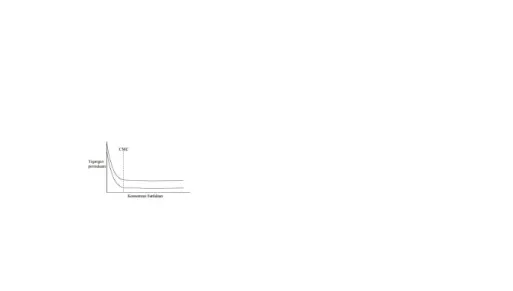
Pada kondisi tersebut konsentrasi surfaktan disebut dengan critical micelle concentration (CMC). Pada konsentrasi surfaktan di bawah CMC, tegangan permukaan dan antar muka turun dengan meningkatnya konsentrasi, namun pada saat konsentrasi mencapai taraf CMC atau lebih tinggi dari itu, tidak terjadi penurunan tegangan permukaan dan antar muka atau penurunannya sangat rendah. Grafik hubungan antara konsentrasi surfaktan dengan tegangan permukaan dan antar muka cairan disajikan pada Gambar 3.
BAB III
PEMBAHASAN
III.1 Jenis Katalis dalam Misel
Jenis katalis dalam misel dapat ditentukan berdasarkan jenis surfaktan yang digunakan untuk proses katalisis tersebut, adapun jenis-jenis surfaktan terdiri dari :
1. Anionik, yaitu gugus hidrofil memiliki muatan negatif seperti karboksil (RCOO-M + ), sulfonat (RSO3-M +), sulfat (ROSO3-M + ), atau fosfat (ROPO3 -M + ). Adapun contoh surfaktan anionik adalah sodium dodesilsulfat (SDS).
2. Kationik, yaitu gugus hidrofil mempunyai muatan positif seperti kuartener ammonium halida (R 4 N+X - ) dimana 4 gugus R mungkin dapat sama atau tidak
sama untuk semuanya (tetapi pada umumnya R sama). Adapun contoh surfaktan kationik adalah cetylpiridinium bromide.
Gambar 5 : Cetylpiridinium bromide 1
3. Nonionik, yaitu gugus hidrofil tidak memiliki muatan, tetapi turunannya dapat larut dalam air dari gugus polar yang tinggi seperti polioxyetilene (POE atau ROCH2CH2O-) atau gugus R-polyol meliputi gula. Adapun contoh surfaktan
nonionic adalah polyoxyethylene-4-lauryl ether.
Gambar 6 : polyoxyethylene-4-lauryl ether 1
4. Amfoterik (zwitterionic) yaitu molekul paduannya bermuatan positif dan negatif, seperti sulfobataine RN+(CH3)2CH2CH2SO3-. Adapun contoh surfaktan
amfoterik adalah Dipalmitoylphosphatidylcholine (lecithin).
Gambar 7 : Dipalmitoylphosphatidylcholin (Lesitin) 1 Gambar 4 : Sodium d odesilsulfat 1
Selain berdasarkan jenis surfaktan yang digunakan, jenis katalis dalam misel juga dapat dibedakan berdasarkan sifat keasaman dari surfakatan tersebut saat dilarutkan dalam air, terdiri dari :
1. Katalis surfaktan asam Lewis
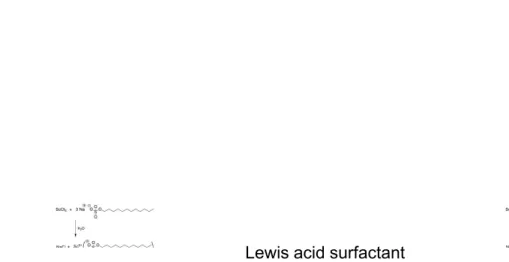
Pada katalis surfaktan asam lewis (asam umum) yang mempengaruhi laju reaksi adalah surfaktan asam lewis itu sendiri. Salah satu contoh katalis surfaktan asam Lewis adalah sodium lauril sulfat (SLS) yang distabilkan menggunakan garam ScCl3.
Gambar 9 : Pembentukan surfaktan asam Lewis 1
Surfaktan asam Lewis yang dihasilkan ini memiliki peran ganda yaitu sebagai katalis asam Lewis dan juga sebagai surfaktan yang membantu proses solubilisasi senyawa organic dalam larutan air.
Gambar 10 : Surfaktan asam Lewis mensolubilisasi senyawa organik 1 Lewis acid surfactant
2. Katalis surfaktan asam Bronsted
Pada katalis surfaktan asam Bronsted (asam spesifik) yang mempengaruhi laju reaksi adalah asam konjugatnya (H+). Salah satu contoh katalis surfaktan asam Bronsted adalah surfaktan zwitterionik yang memiliki muatan positif dan negative pada gugus hidrofiliknya. Sebagai contoh adalah surfaktan yang terdiri dari asam amino rantai panjang.
Gambar 11 : Katalis surfaktan Bronsted 1
III.2 Cara Kerja Katalis dalam Misel
Ketika sebuah molekul dengan struktur amphiphilic dilarutkan dalam media berair, kelompok hidrofobik mendistorsi struktur air. Sebagai hasil dari distorsi ini, beberapa molekul surfaktan dikeluarkan ke permukaan sistem dengan kelompok hidrofobik yang berorientasi untuk meminimalkan kontak dengan molekul air.
Gambar 12 : Surfaktan dalam Air 1
Saat konsentrasi surfaktan dalam air mencapai konsentrasi jenuhnya, yaitu saat konsentrasi surfaktan dalam air cukup tinggi, pada kondisi tersebut konsentrasi s urfaktan disebut dengan critical micelle concentration (CMC). Pada konsentrasi tersebut molekul-molekul surfaktan dapat beragregasi membentuk misel dalam air. Gugus kepala dari surfaktan yang bersifat hidrofobik akan menghadap fasa air sementara gugus ekor dari
surfaktan yang bersifat hidrofilik akan menjauhi fasa air. Karena struktur misel yang dihasilkan dari molekul surfaktan ini, maka surfaktan memiliki kemampuan untuk mensolubilisasi senyawa organic yang tidak larut air ke dalam misel. Hal ini memungkinkan terjadinya reaksi antara reaktan yang memiliki kepolaran yang berbeda untuk berinteraksi menghasilkan suatu produk.
Gambar 13 : Pembentukan misel 1
Adapun lokasi solubilisasi (lokus) dari senyawa organik pada misel dapat terletak pada beberapa kemungkinan, bergantung pada polaritas dari senyawa organik yang akan
disolubilisasi, diantaranya : 1. Permukaan misel
2. Diantara gugus kepala hidrofil 3. Lapisan palisade
4. Lebih dalam dari palisade 5. Di bagian dalam misel
III.3 Aplikasi Katalis dalam Misel
Adapun contoh aplikasi dari katalis dalam misel diantaran ya : 1. Aplikasi katalis surfaktan asam Lewis
Salah satu aplikasi surfaktan asam lewis adalah pada sintesis derivatif chromeno[4,3-b]chromene menggunakan surfaktan Fe(DS)3 pada pelarut air.
Surfaktan Fe(DS)3 dibuat dengan mereaksikan FeCl3 dengan Sodium dodesilsulfat.
Adapun sintesis dilakukan dengan mereaksikan Aldehyde (1 mmol), 1,3-dicarbonyl (1 mmol), dan 4-hydroxycoumarin (1 mmol) yang distirrer menggunakan 2.5 ml H2O
sebagai pelarut dan 10 mol % Fe(DS)3 sebagai surfaktan asam Lewis pada 70 ᵒC.
Adapun reaksi yang terjadi :
Mekanisme reaksi melibatkan, kondensasi Knoevenagel, addisi Michael, dan siklisasi intra yang dikatalisis oleh keberadaan Fe3+. Keberadaan surfaktan dan keasaman Lewis karena terdapatnya ion Fe3+, mampu berikatan dengan oksigen pada gugus karbonil dari Aldehida memfasilitasi terjadinya serangan nukleofilik oleh senyawa 1,3 diketo sehingga dapat memfasilitasi pembentukan produk kondensasi A sebagai senyawa intermediet Knoevenagel. Kemudian zat antara A mengalami reaksi addisi Michael dengan gugus hidroksil pada posisi-α dari 4-hidroksiolinumarin menghasilkan terbentuknya senyawa antara B dengan dikatalisis oleh keberadaan Fe3+. Pada akhirnya, dengan bantuan ion Fe3+, serangan nukleofilik oleh atom oksigen dari gugus hidroksil dan penghilangan air menyebabkan terbentuknya turunan heterosiklik coumarin yang diinginkan.
2. Aplikasi katalis surfaktan asam Bronsted
Salah satu aplikasi surfaktan asam Bronsted adalah pada sintesis aminonaphthoquinones yang merupakan senyawa derivate 2-hydroxy-1,4-naphthoquinone (lawsone) menggunakan surfaktan asam dodecyl benzenesulfonic (DBSA) pada pelarut air. Adapun sintesis dilakukan dengan mereaksikan lawsone (1 mmol), p-nitrobenzaldehyde (1 mmol), dan p-nitroaniline (1 mmol), dengan 20 mol% catalyst surfaktan asam dodecyl benzenesulfonic dalam H2O (10 mL) pada
Adapun mekanisme yang terjadi :
Awalnya, amina dan aldehida non-enolizable terperangkap di dalam misel karena memiliki afinitas yang lebih tinggi untuk interior hidrofobik. Setelah terperangkap, kedua reaktan tersebut bereaksi melalui reaksi kondensasi, mengusir keluar dari vesikel satu molekul air per garam iminium yang dibentuk. Hal ini mengubah keseimbangan kimiawi bergeser ke arah produk begitu air dikeluarkan dari sistem misel. Ini sesuai dengan prinsip ekstraksi partisi pelarut sederhana. Akhirnya, satu molekul lawsone yang tergabung dalam interior misel bereaksi dengan ion iminium dengan penyerangan nukleofilik pada karbon elektrofilik.
III.3 Kelebihan dan Kelemahan Katalis dalam Misel
Adapun keuntungan menggunakan katalis surfaktan yang dikombinasikan pada reaksi organik diantaranya :
1. Menggunakan air sebagai solvent 2. Aktifitasnya tinggi
3. Melarutkan reagen-reagen yang tidak saling kompatibel 4. Mudah dipisahkan dan digunakan kembali
Adapun kekurangan menggunakan katalis surfaktan yang dikombinasikan pada reaksi organik diantaranya :
1. Jumlah substratnya terbatas 2. Jumlah katalis terbatas.
BAB IV
PENUTUP
IV.1 Kesimpulan
Katalis dalam misel merupakan salah satu jenis katalis homogen yang menggunakan surfaktan sebagai agen pengkatalisis. Surfaktan sebagai katalis akan membantu proses solubilisasi reaktan yang berupa senyawa organic yang tidak larut dalam air untuk dapat bereaksi membentuk suatu produk.
IV.2 Saran
Dilakukan variasi terhadap berbagai jenis surfaktan yang digunakan dalam proses sintesis suatu senyawa sehingga dapat diketahui surfaktan mana yang memiliki daya katalisis paling optimum pada reaksi sintesis tersebut.
DAFTAR PUSTAKA
Filho, João F. Allochio, dkk . 2015. First synthesis of aminonaphthoquinones derived from
lawsone in a colloidal dispersion system created by a Brønsted acid-surfactant-combined catalyst in water: An environmentally friendly protocol. Colloids and Interface Science Communications 4: 14 – 18.
Pradhan, Koyel, dkk . 2013. Fe(DS)3, an efficient Lewis acid-surfactant-combined catalyst
(LASC) for the one pot synthesis of chromeno[4,3-b]chromene derivatives by assembling the basic building blocks. Tetrahedron Letters 54: 3105 – 3110.