18
IV. HASIL DAN PEMBAHASAN
A. Hasil Analisis Biji dan Minyak Jarak Pagar
Biji jarak pagar dari PT Rajawali Nusantara ini dikemas dalam kemasan karung, masing-masing karung berisi kurang lebih 30 kg. Hasil analisis biji jarak dapat dilihat pada Tabel 5.
Tabel 5. Hasil analisis biji jarak pagar Analisis Proksimat Nilai
Kadar Air (%) 8,90
Kadar Abu (%) 4,62
Kadar Minyak (%) 39,87
Kadar air biji jarak diukur dengan menggunakan basis basah menunjukkan nilai 8,9%. Nilai ini lebih tinggi dibandingkan dengan yang telah dilakukan oleh Winkler (1997) yaitu 5,77%, Gubitz et al. (1999) sebesar 3,1-5,8%, serta Peace dan Aladesanmi (2008) yaitu sebesar 5%. Tingginya kadar air ini disebabkan oleh umur simpan biji jarak yang sudah lama. Penyimpanan biji yang ditumpuk-tumpuk serta tempat penyimpanan yang lembab juga dapat membuat kadar air biji jarak meningkat. Hal tersebut juga tampak dari penampakan beberapa biji yang disimpan di bagian bawah tumpukan yang tampak agak basah.
Kadar abu yang diukur menunjukkan nilai 4,62 yang tidak jauh berbeda dengen penelitian yang dilakukan oleh Gubitz et al. (1999) 3,6-4,3%, serta Peace dan Aladesanmi (2008) 4,9%, namun sedikit lebih tinggi dibandingkan dengan Winkler (1997) yaitu 3,17%. Kadar abu menunjukkan kandungan bahan-bahan anorganik yang ada dalam biji jarak pagar.
Kadar minyak yang dianalisis menunjukkan nilai yang tidak jauh berbeda dengan yang ada pada literatur. Kadar minyak ini merupakan jumlah minyak yang diukur dengan menggunakan ekstraksi pelarut dalam soxhlet.
19 penyimpanan yang baik. Biji jarak selanjutnya diekstraksi dengan menggunakan mesin pres ulir (screw press).
Minyak yang diperoleh dari hasil ekstraksi berwarna hitam karena masih mengandung banyak pengotor. Pengotor tersebut terdiri dari kulit dan senyawa kimia seperti: alkoloid, fosfatida, karotenoid, khlorofil, dan partikel lainnya. Kotoran berupa getah/lendir disebut gum yang terdiri dari komponon berupa fostatida, protein, karbohidrat, residu, air dan resin. Gum dan pengotor ini diendapkan terlebih dahulu sebelum dilakukan analisis lebih lanjut. Beberapa gum yang sulit untuk dipisahkan dengan cara diendapkan dipisahkan dengan cara filtrasi. Beberapa minyak juga terlalu sulit dipisahkan dari gum dan pengotor sehingga tetap tersisa pada pengotor. Hal ini mengurangi rendemen total minyak jarak yang dihasilkan. minyak jarak yang dihasilkan dari proses ini berwarna kuning jernih dan berbau seperti kacang. Hasil analisis sifat fisiko-kimia minyak jarak pagar dapat dilihat pada Tabel 6.
Tabel 6. Hasil analisis sifat fisiko-kimia minyak jarak pagar
Analisis Satuan Nilai
Kadar Abu % 0,042
FFA % 10,98
Bilangan Asam mg KOH/g lemak 20,94
Bilangan Iod mg iod/g lemak 99,34
Bilangan Penyabunan mg KOH/g lemak 197,6
Densitas g/cm3 0,91
20 Bilangan asam pada minyak jarak yang dianalisis lebih tinggi yaitu sebesar 20,94 mg KOH/g minyak bila dibandingkan dengan hasili uji yang diuji oleh Peace dan Aladesanmi (2008) yang hanya mencapai nilai 3,21 mg KOH/g minyak. Tingginya bilangan asam ini terjadi karena minyak jarak pagar yang sudah diproses dilakukan proses pengendapan. Proses pengendapan yang lama dan dalam kondisi terbuka ini bertujuan untuk memisahkan antara minyak dengan sludge serta pengotor lain. Kondisi pengendapan yang terbuka tersebut meningkatkan kemungkinan terjadinya reaksi oksidasi dan hidrolisis.
B. Analisis Metil Ester Jarak Pagar
Proses produksi metil ester menggunakan proses esterifikasi terlebih dahulu karena FFA minyak jarak pagar lebih dari 2%. Minyak yang mempunyai kandungan FFA lebih dari 2% harus dilakukan proses esterifikasi terlebih dahulu untuk mereaksikan asam lemak bebas menjadi metil ester, bila asam lemak bebas tidak direaksikan menjadi metil ester maka asam lemak bebas ini akan mengganggu proses transesterifikasi karena bereaksi dengan katalis basa. Proses esterifikasi akan mereaksikan FFA terlebih dahulu dengan metanol dengan bantuan katalis asam. Tahapan selanjutnya baru mengkonversi trigliserida dengan bantuan katalis basa. Hasil analisis sifat fisiko-kimia metil ester jarak pagar dapat dilihat pada Tabel 7.
Tabel 7. Hasil analisis sifat fisiko-kimia metil ester jarak pagar
No Karakter Satuan Nilai
1 Kadar air % 1,33 – 2,29
2 Bilangan asam mg KOH/g sampel 0,155 – 0,41
3 Bilangan iod mg Iod/g sampel 98,33
4 Bilangan penyabunan mg KOH/g sampel 214,46
5 Gliserol total % 0,12 – 0,27
6 Bilangan tak tersabunkan % 0,39
7 Kadar ester %, 98,9
21 dibandingkan pada minyak jarak. Hal ini diakibatkan proses transesterifikasi mereaksikan asam lemak bebas dengan metanol. Reaksi tersebut membuat asam lemak bebas terkonversi menjadi metil ester.
C. Analisis Methyl Ester Sulfonate Acid 1. Tegangan Antarmuka/IFT
Dua cairan yang tidak saling mencampur cenderung bergabung dengan fasa yang sama, bagian yang hidrofilik akan bergabung dengan bagian hidrofilik dan bagian hidrofobik akan bergabung dengan hidrofobik. Batasan antara dua fasa yang tidak saling bercampur itu disebut antarmuka (Rosen, 2004).
Tegangan antarmuka, disebut juga energi bebas antarmuka, didefinisikan sebagai usaha minimum yang dibutuhkan utuk memperluas permukaan cairan per satuan luas (Rosen, 2004 dan Shaw, 1980). Satuan
tegangan antarmuka dinyatakan dalam dyne/cm atau erg/m2. Sedangkan
dalam satuan SI dinyatakan dalam N/m. kedua besaran tersebut saling berhubungan dengan 1 dyne/cm = 1 mN/m (Bird, 1993).
Analisis tegangan antarmuka dilakukan dengan menggunakan alat
spinning drop tensiometer. Penggunaan spinning drop tensiometer ini
dilakukan karena tesiometer ini mampu mengukur tegangan antarmuka yang rendah (µN/m). Prinsip pengukuran tegangan antarmuka dengan metode spinning dorp adalah dengan menginjeksikan tetes cairan sampel dalam tabung yang berisi cairan yang tidak bercampur dengan cairan sampel dengan densitas yang lebih tinggi. Ketika tabung diputar pada bagian panjangnya, tetes sampel terdorong ke tengah akibat gaya sentrifugal sehingga bentuknya menjadi memanjang. Tegangan antarmuka diukur dari kecepatan angular tabung dan bentuk (panjang dan diameter) dari tetes sampel yang ada dalam tabung (Farn, 2006).
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
terhadap nilai tegangan antarmuka dilakukan sidik ragam. Tingkat kepercayaan yang dipakai adalah 95% (α = 0,05). Hasil sidik ragam
22 terhadap nilai tegangan antarmuka. Lama reaksi dan Interaksi kedua perlakuan tidak memberikan pengaruh signifikan terhadap nilai tegangan antarmuka.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda secara signifikan atau
tidak. Hasil uji lanjut Duncan pada faktor laju alir reaktan SO3
menunjukkan bahwa laju alir reaktan SO3 pada taraf 3,0 kg/jam berbeda
nyata dengan taraf laju alir SO3 2,8 kg/jam, sementara taraf laju alir
reaktan SO3 2,2 kg/jam tidak berbeda nyata terhadap laju alir reaktan SO3
2,8 kg/jam. Sementara itu, hasil uji lanjut Duncan pada faktor lama reaksi pada berbagai taraf (30, 45, 60, 75 dan 90 menit) tidak menunjukkan perbedaan signifikan diantara taraf-taraf tersebut. Hasil analisis tegangan antarmuka, sidik ragam serta uji lanjut Duncan dapat dilihat pada Lampiran 5.
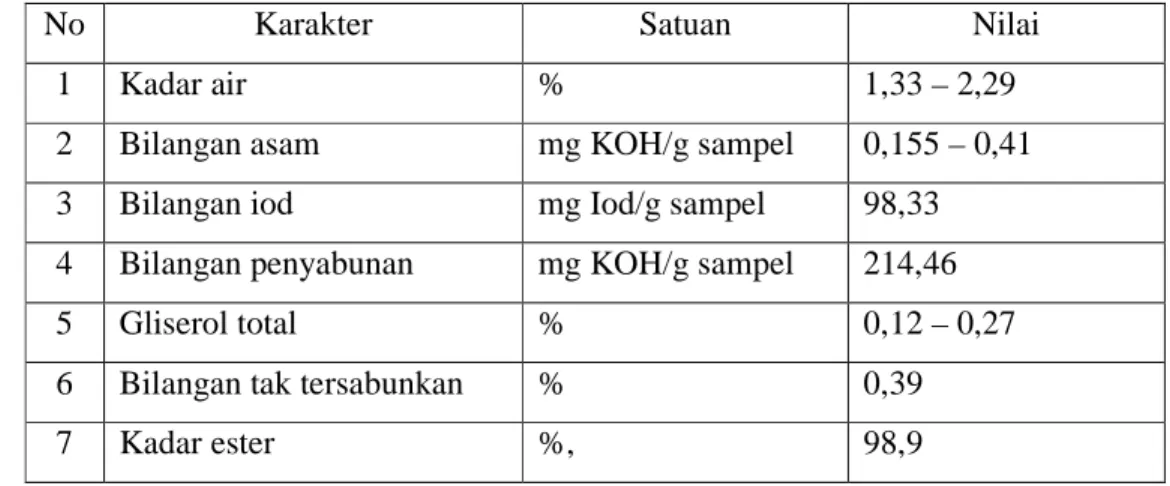
Gambar 8. Grafik hubungan lama reaksi dan laju alir reaktan SO3 terhadap
nilai tegangan antar muka
Hasil analisis fisiko-kimia dari MESA yang dihasilkan menunjukkan kisaran Nilai tegangan antarmuka adalah 1,15-4,43dyne/cm. Dari Gambar 8 tampak bahwa nilai tegangan antarmuka semakin menurun
dengan bertambahnya laju alir reaktan SO3. Lama reaksi yang semakin
lama juga menunjukkan nilai tegangan antarmuka yang semakin menurun.
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50 5,00 30 45 60 75 90 T eg ang an A nt ar m uka ( dy ne /c m )
Lama Reaksi (menit)
Laju Alir SO3
(kg/jam)
23 Hal ini mengindikasikan bahwa semakin banyak molekul surfaktan yang terbentuk.
Semakin banyak molekul surfaktan yang terbentuk dapat membuat tegangan antarmuka semakin menurun. Hal ini selaras dengan yang diteliti oleh Rosen (2004). Farn (2006) menyebutkan ketika suatu molekul surfaktan ditambahkan ke dalam suatu larutan yang tidak tercampur (immiscible), bagian hidrofobik surfaktan bergabung dengan fasa non-polar. Bagian surfaktan yang lain, yaitu bagian hidrofilik, bergabung pada fasa yang lebih polar. Molekul surfaktan tersebut mengurangi gaya kohesi antara molekul polar dan non-polar. Hal tersebut dapat mengurangi energi untuk memperluas lapisan antarmuka, yang akibatnya dapat menurunkan tegangan antarmuka.
Pada surfaktan MES, gugus hidrofilik yang berperan adalah gugus sulfonat. Gugus sulfonat ini bersifat anionik. Gugus hidrofobik yang terdapat dalam MES adalah metil ester. Gugus sulfonat ini berikatan dengan fasa yang polar yaitu air. Metil ester berikatan dengan minyak. Hal ini mengakibatkan berkurangnya energi bebas antarmuka sehingga tegangan antarmuka semakin menurun dengan semakin banyaknya gugus sulfonat yang terikat pada metil ester.
Laju alir reaktan SO3 yang semakin tinggi akan meningkatkan
pembentukan molekul surfaktan. Laju alir reaktan SO3 yang semakin
tinggi pada falling film menyebabkan peningkatan konsentrasi reaktan. Dalam kinetika reaksi, konsentrasi reaktan yang semakin tinggi akan meningkatkan peluang terjadinya tumbukan antar molekul. Semakin
banyak reaktan gas SO3 yang dialirkan pada falling film membuat molekul
surfaktan yang terbentuk semakin banyak karena gugus sulfonat yang terikat semakin banyak.
Pada laju alir SO3 2,8 kg/jam, surfaktan mengalami kenaikan nilai
24 bahan yang belum melewati pipa falling film. Dugaan lain adalah karena adanya proses desulfonasi, yaitu putusnya kembali ikatan C-S seperti yang diamati oleh Hidayati (2005) serta Hui dan Tuvell (1998). Dugaan bahwa surfaktan tercampur dengan bahan baku awal mempunyai kemungkinan terjadi lebih tinggi karena peningkatan kembali nilai tegangan antarmuka yang cukup tinggi.
Pada laju alir SO3 3,0 kg/jam dan lama reaksi 30 menit tegangan antar
muka tidak terukur oleh alat spinning drop tensiometer. Hal tersebut diduga akibat MESA yang terbentuk belum mampu menurunkan tegangan antarmuka sehingga droplet minyak menempel pada dinding tabung.
2. Penurunan Tegangan Permukaan
Tegangan permukaan merupakan batas antara dua fasa yang berbeda antara air dan udara. Gaya tarik menarik antara molekul cairan adalah sama ke segala arah. Hal ini tidak berlaku bagi molekul cairan yang berada di permukaan. Molekul air yang berada di permukaan mempunyai energi potensial lebih besar dibanding molekul yang berada di dalam karena molekul-molekul tersebut berikatan lebih erat. Hal ini membuat bagian atas membutuhkan kerja yang lebih besar untuk menarik ke dalam cairan (Rosen, 2004). Molekul air yang cenderung untuk tertarik pada sesama molekul air disebut gaya kohesi. Hal inilah yang menyebabkan timbulnya tegangan permukaan (Suryani et al., 2003 dan Farn, 2006).
Tegangan permukaan, disebut juga energi bebas permukaan, didefinisikan sebagai usaha minimum yang dibutuhkan utuk memperluas permukaan cairan per satuan luas (Rosen, 2004 dan Shaw, 1980). Bird (1993) menyatakan Satuan tegangan permukaan sama dengan tegangan
antarmuka yaitu dinyatakan dalam dyne/cm atau erg/m2. Dalam satuan SI
dinyatakan dalam N/m. kedua besaran tersebut saling berhubungan dengan 1 dyne/cm = 1 mN/m.
25 platina dengan diameter kawat 0,3 mm dan berdiameter cincin 2,4 atau 6 meter pada cairan. Cincin tersebut kemudian diangkat melewati permukaan cairan yang diukur. Tegangan permukaan memberikan gaya pada cincin sehingga berat cincin meningkat. Gaya vertikal maksimum yang diberikan untuk mengangkat cincin hingga terlepas dari permukaan cairan itulah yang diukur sebagai nilai tegangan permukaan (Farn, 2006).
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
terhadap penurunan nilai tegangan permukaan dilakukan sidik ragam. Tingkat kepercayaan yang dipakai adalah 95% (α = 0,05). Hasil sidik
ragam menunjukkan bahwa laju alir reaktan SO3 tidak berpengaruh
signifikan terhadap penurunan nilai tegangan permukaan. Lama reaksi dan interaksi kedua perlakuan memberikan pengaruh signifikan terhadap penurunan nilai tegangan permukaan.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda secara signifikan atau
tidak. Hasil uji lanjut Duncan pada faktor laju alir reaktan SO3
menunjukkan bahwa laju alir reaktan SO3 pada berbagai taraf (2,2, 2,8 dan
26
Gambar 9. Grafik hubungan lama reaksi dan laju alir reaktan SO3 terhadap
penurunan nilai tegangan permukaan
Hasil analisis penurunan tegangan permukaan berada pada kisaran 35,5-42,4 dyne/cm. Hal ini tidak berbeda jauh dengan yang disebutkan Pore (1993) yaitu sebesar 39,8 dyne/cm. Dari grafik pada Gambar 9. terlihat bahwa dengan semakin bertambah panjangnya lama reaksi maka nilai tegangan permukaan juga semakin menurun. Menurunnya tegangan permukaan ini diakibatkan oleh semakin banyaknya molekul surfaktan. Semakin lama reaksi terjadi maka semakin banyak molekul surfaktan yang terbentuk.
Semakin banyak molekul surfaktan yang terbentuk dapat membuat tegangan permukaan semakin menurun. Semakin banyaknya molekul surfaktan, maka gaya kohesi air akan menurun. Molekul-molekul surfaktan mempunyai kecenderungan untuk berada pada permukaan sebuah cairan. Akibat dari adanya surfaktan adalah secara signifikan menurunkan jumlah total kerja untuk memperluas permukaan karena molekulnya mengikat fasa polar, yaitu air, dan non-polar, yaitu udara (Farn, 2006).
Gugus hidrofilik MESA adalah gugus sulfonat. Menurut Myers (2006) gugus ini merupakan gugus anionik. Gugus sulfonat yeng berikatan dengan metil ester inilah yang dapat menurunkan tegangan permukaan. Semakin banyak gugus sulfonat yang bereaksi dengan metil ester, maka
0,0 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 45,0 30 45 60 75 90 P enur una n T eg ang an P er m uka an (dy ne /c m )
Lama Reaksi (menit)
Laju Alir SO3
(kg/jam)
27 semakin banyak molekul surfaktan yang terbentuk dan semakin tinggi kemampuannya untuk menurunkan tegangan permukaan.
Semakin lama reaksi antara metil ester dengan reaktan gas SO3
maka semakin banyak pula molekul surfaktan yang terbentuk. Lama reaksi memberikan peluang untuk molekul bertumbukan lebih banyak sehingga akibatnya molekul surfaktan yang terbentuk lebih banyak. Menurut Syam
et al. (2009) waktu berpengaruh terhadap reaksi, semakin lama reaksi
maka semakin banyak molekul yang dapat bercampur dan terlarut. Pada
akhirnya banyaknya molekul reaktan gas SO3 yang terdispersi pada metil
ester akan meningkatkan banyaknya reaksi sehingga surfaktan yang terbentuk semakin banyak.
3. Bilangan Iod
Bilangan Iod merupakan salah satu parameter yang digunakan untuk mengukur banyaknya ikatan rangkap dalam suatu bahan (Ketaren, 1986). Banyaknya ikatan rangkap ini diukur dengan melihat berapa mili gram iodine yang diikat dalam ikatan rangkap per gram sampel (AOAC, 1995). Bilangan iod ini diukur untuk melihat berapa banyak ikatan rangkap yang
berkurang akibat bereaksi dengan reaktan SO3
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
terhadap nilai bilangan iod dilakukan sidik ragam. Tingkat kepercayaan yang dipakai adalah 95% (α = 0,05). Hasil sidik ragam menunjukkan
bahwa laju alir reaktan SO3 berpengaruh sangat signifikan terhadap nilai
bilangan iod. Lama reaksi memberikan pengaruh sangat signifikan terhadap nilai bilangan iod. Interaksi kedua perlakuan tidak memberikan pengaruh signifikan terhadap kadar bahan aktif.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda nyata atau tidak. Hasil
uji lanjut Duncan pada faktor laju alir reaktan SO3 menunjukkan bahwa
laju alir reaktan SO3 pada berbagai taraf (2,2, 2,8 dan 3,0 kg/jam) saling
berbeda secara signifikan. Sementara itu, hasil uji lanjut Duncan pada
28 dengan taraf 45 menit. Begitu pula antara taraf pada lama reaksi 45 menit berbeda nyata dengan taraf 60 menit. Taraf pada lama reaksi 60 tidak berbeda nyata dengan lama reaksi pada taraf 75 menit dan 90 menit. Hasil analisis bilangan iod, sidik ragam serta uji lanjut Duncan dapat dilihat pada Lampiran 7.
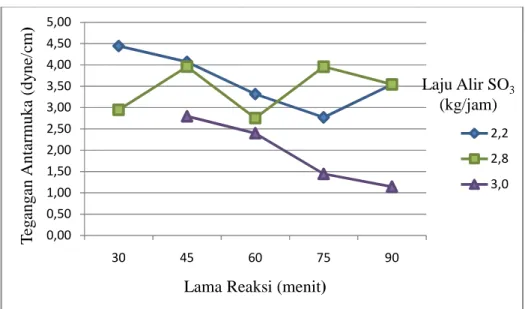
Gambar 10. Grafik hubungan lama reaksi dan laju alir reaktan SO3
terhadap nilai bilangan iod.
Dari Gambar 10. tampak bahwa lama reaksi dan laju alir SO3
berkorelasi negatif dengan nilai bilangan iod. Semakin lama reaksi dan
semakin tinggi laju alir SO3 maka nilai bilangan iod semakin kecil.
Bilangan iod yang semakin menurun menunjukkan banyaknya ikatan
rangkap pada metil ester yang diadisi oleh SO3 sehingga terbentuk
molekul surfaktan.
Hasil pengamatan bilangan iod ini mendukung penelitian Jungerman (1979) bahwa salah satu tempat terjadinya reaksi adalah kompleks karboksil, bagian α-atom karbon, dan ikatan rangkap. Ikatan rangkap yang semakin berkurang menunjukkan bahwa molekul surfaktan yang terbentuk semakin banyak dengan meningkatnya lama reaksi dan laju alir reaktan
SO3 yang ditambahkan.
Lama reaksi memberikan pengaruh pada reaksi karena memberikan peluang percampuran dan pelarutan (Syam et al, 2009). Semakin banyak
molekul SO3 yang terlarut, maka semakin tinggi pula reaksi dengan metil
0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 30 45 60 75 90 B il anga n Iod (m g I od/ g M E S A )
Lama Reaksi (menit)
Laju Alir SO3
(kg/jam)
29 ester akibatnya adalah semakin banyak surfaktan yang terbentuk. Laju alir reaktan yang semakin tinggi meningkatkan konsentrasi reaktan, sehingga
kinetika reaksi menjadi lebih tinggi. Konsentrasi gas SO3 yang semakin
tinggi meningkatkan laju reaksi dengan metil ester sehingga surfaktan yang terbentuk semakin banyak
4. Kadar Bahan Aktif
Bahan aktif merupakan salah satu mutu yang dinilai dari banyak surfaktan. Kinerja surfaktan mempunyai korelasi yang nyata pada kadar bahan aktif. Semakin banyak bahan aktif sebuah surfaktan maka akan semakin baik kinerjanya. Menurut Cox dan Weerasooriya (1997) Industri surfaktan menjadikan pengujian bahan aktif sebagai salah satu standar kualitas untuk menilai surfaktan lolos uji kualitas atau tidak.
Prosedur yang digunakan untuk menguji kadar bahan aktif yang diterima secara universal adalah metode titrasi dua fasa, atau sering dikenal dengan metode epton. Metode ini dapat juga digunakan untuk menguji kadar bahan aktif pada surfaktan kationik. Menurut Stache (1995) prinsip dasar dari uji ini adalah titrasi bahan aktif anionik menggunakan cetylpiridinium bromide, yang merupakan salah satu jenis surfaktan kationik. Indikator yang digunakan adalah methylen blue. Campuran surfaktan dengan indikator ditambahi kloroform sehingga tercipta dua fasa yaitu fasa kloroform di bagian bawah dan fasa larutan surfaktan dan
methylen blue yang berada di bagian atas. Bahan aktif yang larut pada methylen blue akan memberikan warna biru pekat pada larutan surfaktan.
Langkah selanjutnya adalah dititrasi dengan surfaktan kationik. Dalam proses titrasi ini warna biru akan berpindah ke fasa kloroform hingga warna dua fasa tersebut seragam. Bila titrasi diteruskan maka fasa kloroform akan menjadi lebih pucat lalu lama-kelamaan akan menjadi bening.
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
30
bahwa laju alir reaktan SO3 berpengaruh sangat signifikan terhadap kadar
bahan aktif. Lama reaksi memberikan pengaruh sangat signifikan terhadap kadar bahan aktif. Interaksi kedua perlakuan tidak memberikan pengaruh signifikan terhadap kadar bahan aktif.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda nyata atau tidak. Hasil
uji lanjut Duncan pada faktor laju alir reaktan SO3 menunjukkan bahwa
laju alir reaktan SO3 pada berbagai taraf (2,2, 2,8 dan 3,0 kg/jam) saling
berbeda secara signifikan. Sementara itu, hasil uji lanjut Duncan pada faktor lama reaksi pada taraf 30 menit tidak berbeda nyata dengan lama reaksi dengan taraf 45 menit. Taraf pada lama reaksi 45 menit berbeda nyata dengan taraf 60 menit. Taraf pada lama reaksi 60 berbeda nyata dengan lama reaksi pada taraf 75 menit, namun taraf pada lama reaksi 75 menit tidak berbeda nyata dengan taraf lama reaksi 90 menit. Hasil analisis kadar bahan aktif, sidik ragam serta uji lanjut Duncan dapat dilihat pada Lampiran 8.
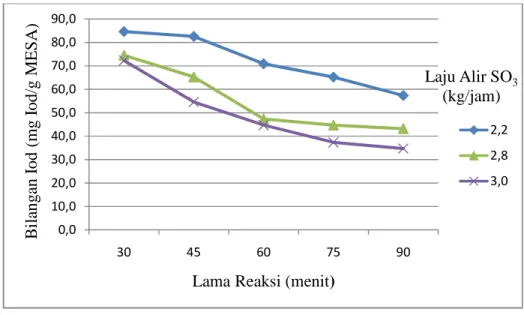
Gambar 11. Grafik hubungan lama reaksi dan laju alir reaktan SO3
terhadap kadar bahan aktif.
Kadar bahan aktif berada pada kisaran 0,07-28,6%. Dari grafik pada Gambar 11. dapat dilihat bahwa lama reaksi memberikan pengaruh positif
pada kadar bahan aktif. Hal yang sama juga terlihat dari laju alir SO3 yang
memberikan pengaruh positif pada kadar bahan aktif. Kadar bahan aktif
0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 30 45 60 75 90 K ada r B aha n A kt if ( pe rs en)
Lama Reaksi (menit)
Laju Alir SO3
(kg/jam)
31 yang semakin tinggi menunjukkan bahwa molekul surfaktan yang terbentuk semakin banyak.
Pada surfaktan anionik gugus ion anionik adalah bahan aktif yang diukur. Menurut Myers (2006) bahan aktif pada MESA berupa gugus sulfonat yang terikat pada rantai karbon asam lemak MESA. Bahan aktif ini akan berfungsi sebagai polar head atau bahan yang lebih cenderung larut air (hidrofilik).
Menurut Syam et al, (2009), lama reaksi memberikan pengaruh pada reaksi karena memberikan peluang percampuran dan pelarutan.
Semakin banyak molekul SO3 yang terlarut, maka semakin tinggi pula
reaksi dengan metil ester akibatnya adalah semakin banyak surfaktan yang terbentuk. Laju alir reaktan yang semakin tinggi meningkatkan konsentrasi reaktan, sehingga kinetika reaksi menjadi lebih tinggi. Konsentrasi gas
SO3 yang semakin tinggi meningkatkan laju reaksi dengan metil ester
sehingga surfaktan yang terbentuk semakin banyak
Beberapa data menunjukkan angka mendekati nol, seperti tampak
pada laju alir SO3 2,2 kg/jam pada lama reaksi 30 dan 45 menit. Hal ini
diakibatkan kadar bahan aktif yang terlampau kecil sehingga ketika dititrasi warna biru langsung memudar meskipun hanya dilakukan titrasi satu tetes.
5. Bilangan Asam
Bilangan asam merupakan ukuran banyaknya gram basa untuk menetralkan suatu bahan. Basa yang dipakai dalam hal ini adalah NaOH.
Gas SO3 merupakan salah satu gugus yang membentuk asam kuat.
Banyaknya gugus SO3 yang terikat pada suatu bahan akan meningkatkan
bilangan asam.
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
terhadap kadar bahan aktif dilakukan sidik ragam. Tingkat kepercayaan yang dipakai adalah 95% (α = 0,05). Hasil sidik ragam menunjukkan
bahwa laju alir reaktan SO3 tidak berpengaruh signifikan terhadap nilai
32 terhadap nilai bilangan asam. Interaksi kedua perlakuan memberikan pengaruh signifikan terhadap nilai bilangan asam.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda nyata atau tidak. Hasil
uji lanjut Duncan pada faktor laju alir reaktan SO3 menunjukkan bahwa
laju alir reaktan SO3 pada berbagai taraf (2,2, 2,8 dan 3,0 kg/jam) tidak
saling berbeda secara signifikan. Sementara itu, hasil uji lanjut Duncan pada faktor lama reaksi pada taraf 30 menit berbeda nyata dengan lama reaksi dengan taraf 45 menit. Taraf pada lama reaksi 45 menit berbeda nyata dengan taraf 60 menit. Taraf pada lama reaksi 60 tidak berbeda nyata dengan lama reaksi pada taraf 75 menit dan 30 menit. Taraf pada lama reaksi 75 menit tidak berbeda nyata dengan taraf lama reaksi 90 menit. Taraf pada lama reaksi 90 menit berbeda nyata dengan lama reaksi 60 menit. Hasil analisis bilangan asam, sidik ragam serta uji lanjut Duncan dapat dilihat pada Lampiran 9.
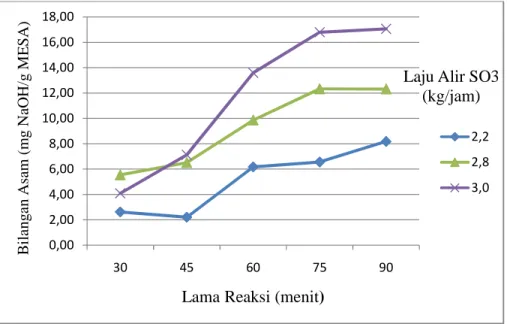
Gambar 12. Grafik hubungan lama reaksi dan laju alir reaktan SO3
terhadap bilangan asam
Kisaran nilai bilangan asam tersebar antara 2,2-17 mg NaOH/g MESA. Nilai bilangan ini naik cukup tinggi dari nilai bilangan asam bahan baku metil ester yaitu 0,41 mg NaOH/g MESA. Hal ini menunjukkan
bahwa terjadi reaksi antara gugus SO3 yang bersifat asam dengan metil
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 30 45 60 75 90 B ila n g a n A sa m ( m g N aO H /g M E S A )
Lama Reaksi (menit)
Laju Alir SO3 (kg/jam)
33 ester. Dari grafik semakin tinggi nilai bilangan asam maka semakin
banyak metil ester yang bereaksi dengan gugus SO3.
Dari grafik pada Gambar 12. dapat diketahui bahwa laju alir SO3 dan
lama reaksi memberikan korelasi positif terhadap nilai bilangan asam.
Semakin besar laju alir SO3 meningkatkan nilai bilangan asam. Begitu
juga dengan faktor lama reaksi. semakin lama waktu reaksi menunjukkan adanya peningkatan bilangan asam.
Alasan naiknya bilangan asam seiring dengan naiknya lama reaksi dan
naiknya laju alir reaktan gas SO3 sama dengan alasan pada kadar bahan
aktif. Lama reaksi yang semakin tinggi akan memperbanyak reaktan SO3
yang dapat tercampur dan terlarut, akibatnya reaksi antara metil ester dan
reaktan gas SO3 semakin tinggi, dengan semakin banyaknya gugus SO3
yang terikat akan meningkatkan bilangan asam karena sifat SO3 yang
bersifat asam. Laju alir reaktan SO3 yang semakin tinggi akan
meningkatkan konsentrasi reaktan SO3 pada tube falling film. Peningkatan
konsentrasi reaktan tersebut membuat laju reaksi lebih tinggi karena peluang molekul untuk saling bertumbukan semakin tinggi. Akibat tingginya peluang tumbukan antar molekul ini, maka reaksi yang terjadi
antara metil ester dan reaktan gas SO3 akan semakin besar. Hal ini akan
meningkatkan nilai bilangan asam.
6. Derajat Keasaman/pH
pH adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Menurut teori Brownsted dan Lowry didefinisikan sebagai banyaknya akseptor atau donor elektron dalam suatu larutan. Koefisien pH tidak dapat diukur secara eksperimental, sehingga nilainya didasarkan pada perhitungan teoritis. Skala pH bukanlah skala absolut. Ia bersifat relatif terhadap sekumpulan larutan standar yang pH-nya ditentukan berdasarkan persetujuan internasional.
Untuk mengetahui pengaruh laju alir reaktan SO3 dan lama reaksi
34 dengan rancangan percobaan acak lengkap faktorial. Tingkat kepercayaan yang dipakai adalah 95% (α = 0,05). Hasil sidik ragam menunjukkan
bahwa laju alir reaktan SO3 berpengaruh sangat signifikan terhadap derajat
keasaman. Lama reaksi memberikan pengaruh sangat signifikan terhadap derajat keasaman. Interaksi kedua perlakuan memberikan pengaruh sangat signifikan terhadap derajat keasaman.
Uji lanjut Duncan dilakukan untuk melihat apakah setiap taraf dari
faktor laju alir reaktan SO3 dan lama reaksi berbeda nyata atau tidak. Hasil
uji lanjut Duncan pada faktor laju alir reaktan SO3 menunjukkan bahwa
laju alir reaktan SO3 pada berbagai taraf (2,2, 2,8 dan 3,0 kg/jam) saling
berbeda secara signifikan. Sementara itu, hasil uji lanjut Duncan pada faktor lama reaksi pada taraf 30 menit tidak berbeda nyata dengan lama reaksi dengan taraf 45 menit. Taraf pada lama reaksi 45 menit berbeda nyata dengan taraf 60 menit. Taraf pada lama reaksi 60 berbeda nyata dengan lama reaksi pada taraf 75 menit, namun taraf pada lama reaksi 75 menit tidak berbeda nyata dengan taraf lama reaksi 90 menit. Hasil analisis derajat keasaman, sidik ragam serta uji lanjut Duncan dapat dilihat pada Lampiran 10.
Gambar 13. Grafik hubungan lama reaksi dan laju alir reaktan SO3
terhadap derajat keasaman
Nilai pH berkisar antara 0,6-1,8. Nilai pH terendah didapatkan pada
laju alir SO3 0,9 menit ke 75. Dari gambar 13. terlihat bahwa lama reaksi
0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80 2,00 30 45 60 75 90 N il ai pH
Lama Reaksi (menit)
Laju Alir SO3
(kg/jam)
35 memberikan korelasi negatif terhadap besarnya nilai pH. Hal ini menunjukkan bahwa semakin banyak gugus sulfonat yang berikatan dengan metil ester sehingga membuat pH larutan semakin rendah. Seperti pada parameter bilangan asam, nilai pH yang semakin turun menunjukkan