AZAS TEKNIK KIMIA
(NERACA ENERGI)
PRODI TEKNIK KIMIA
FAKULTAS TEKNIK
KESETIMBANGAN ENERGI
Konsep dan Satuan
Perhitungan Perubahan Entalpi
Penerapan Kesetimbangan Energi Umum
tanpa terjadinya reaksi kimia
Kesetimbangan Energi Mekanis
KONSEP DAN SATUAN
Menjelaskan konsep dari energi, sistem, lingkungan,
jenis-jenis sistem, jenis-jenis energi
Memilih sistem yang sesuai untuk memecahkan
masalah baik sistem tertutup maupun terbuka,
keadaan steady state, unsteady state, dan
menetapkan batasan sistem
Membedakan jenis energi potensial, kinetik, dan
internal
Menyatakan kesetimbangan energi dalam kata-kata
dan enulis kesetimbangan tersebut dalam simbol
matematis untuk sistem terbuka maupun tertutup
KONSEP POKOK
Sistem merupakan sembarang massa materi atau
bagian peralatan tertentu pada apa kita harus mencurahkan perhatian kita. Suatu sitem dipisahkan dengn lingkungan oleh suatu batas sistem
Lingkungan adalah segala sesuatu yang berada di
luar sistem
Batas sistem merupakan suatu permukaan yang
MACAM SISTEM
MACAM SISTEM
Sistem terbuka (sistem aliran)
merupakan sistem dimana memungkinkan terjadinya pertukaran massa maupun energi antara sistem dengan lingkungan
Sistem tertutup (sistem non-aliran)
Merupakan sistem yang tidak memungkinkan terjadinya pertukaran massa antara sistem dan lingkungan namun masih memungkinkan terjadinya pertukaran energi
PROPERTY SYSTEM
Property merupakan segala variabel/parameter
yang dapat diamati maupun diukur dari suatu sistem. Misalnya: tekanan, temperatur, volume, dll
Berdasarkan ukurannya dibagi menjadi dua yaitu
sifat intensif (intensif property) dan sifat ekstensif (ekstensif property)
Sifat intensif tidak dipengaruhi oleh ukuran
sistem sedangkan sifat ekstensif dipengaruhi oleh ukuran sistem
Contoh sifat intensif: temperatur, tekanan,
densitas, dll. Contoh sifat ekstensif: massa, volume, dll
Energi
Dua jenis energi berpindah antara sistem dan
lingkungan tanpa menyertai perpindahan massa yaitu Kerja dan Panas (kalor)
Kerja (work) adalah suatu bentuk energi yang
menunjukkan perpindahan (transfer) antara sistem dan lingkungannya. Kerja merupakan energi yang tidak dapat disimpan.
Besarnya kerja oleh gaya mekanis: W= 𝒌𝒆𝒂𝒅𝒂𝒂𝒏 𝟏𝒌𝒆𝒂𝒅𝒂𝒂𝒏 𝟐 𝑭. 𝒅𝒔
dimana F adalah gaya, ds adalah perpindahan
Tanda W positif (+) kerja jika dilakukan pada
sistem dan W negatif (-) jika sistem melakukan kerja
Kerja
Karena kerja bergantung pada lintasan yang
diambil maka kerja merupakan fungsi lintasan (path function)
Contoh: kerja mekanis pada piston
suatu gas ideal pada 300 K dan 200 Kpa berada didalam silinder tertutup dan tanpa gesekan. Gas tersebut menekan piston sehingga secara perlahan volume mengembang dari 0,1 m3 ke 0,2 m3. hitung kerja gas pada piston jika digunakan dua lintasan yang berbeda:
Jawab
Lintasan A (tekanan konstan) : karena kerja
dilakukan oleh sistem (gas) maka W bertanda negatif
Lintasan B (suhu konstan)
kerja dalam proses isotermal (suhu konstan):
Dengan n untuk gas ideal
Sehingga kerja:
KALOR (HEAT)
Kalor (Heat, panas) merupakan bagian dari energi
yang mengalir melintasi batas sistem yang
disebabkan oleh perbedaan suhu antara sistem dan sekitarnya
Kalor merupakan energi yang tidak dpat disimpan Tanda untuk aliran kalor: positif (+) jika mengalir
masuk ke dalam sistem dan negatif (-) jika mengalir keluar sistem
Besarnya energi kalor yang mengalir:
Q= U. A. ΔT
U adalah koefisien heat transfer
A adalah luas area perpindahan panas ΔT adalah beda temperatur
ENERGI KINETIK
Energi kinetik (KE) adalah energi yang
dimiliki oleh suatu sistem karena
kecepatannya relatif terhadap sekitarnya
Besarnya K dapat dihitung:
atau energi persatuan massa (spesifik energi
kinetik)
Contoh soal:
air dipompa dari sebuah tangki penyimpanan ke dalam pipa berdiameter dalam 3 cm pada laju 0,001 m3/s. berapa energi kinetik spesifiknya?
Jawab:
ENERGI POTENSIAL
Energi potensial (PE) adalah energi yang dimiliki
oleh suatu sistem karena kedudukannya
(ketinggian) dari suatu permukaan (referensi)
Besarnya energi potensial dapat dihitung:
PE = m. g. h
atau spesifik energi potensial:
Contoh soal:
Air dipompa dari sebuah reservoir ke yang lainny sejauh 300 ft. permukaan air dalam reservoir kedua adalah 40 ft. berapa kenaikan energi potensial spesifik dari air tersebut dalam Btu/lbm?
ENERGI INTERNAL
Energi internal (U) merupakan pengukuran dari
melekuler, atomik, dan subatomik, yang semuanya mengikuti kaidah konservasi mikroskopik
tertentu
Energi internal merupakan fungsi dari T dan V,
𝑈 = 𝑈 (T,V)
sehingga:
Dimana merupakan kapasitas panas Cv
ENTALPI
Entalpi merupakan kombinasi dari dua variabel
energi yang dapat diformulasikan: H = U + PV
dengan P adalah tekanan, dan V adalah volume
Entalpi persatuan massa merupakan fungsi suhu dan
tekanan
Entalpi (H) dan internal energi (U) merupakan
fungsi keadaan
NERACA ENERGI CLOSED
NERACA ENERGI SISTEM
contoh soal:
1. Berapakah perubahan energi internal bila 10 kgmol
udara didinginkan dari suhu 60 C hingga 30 C pada volume konstan? Cv=2,1 x 104 j/mol.K
2. Lihat gambar berikut
pada lintasan (A atau B) manakah yang memiliki 𝑈
3. Lihat gambar berikut:
manakah yang memiliki terbesar, lintasan ABD atau ACP?
4. Berapakah perubahan entalpi bila 10 kgmol udara didinginkan dari suhu 60 C hingga 30 C pada
Gas N2 di dalam silinder pada P 200 kpa dan T 80 C. Gas
didinginkan hingga P 190 kpa dan T 30 C. Berapa besar kerja yang telah dilakukan oleh gas
Hitung besarnya kerja untuk masing-masing stage:
ENERGI BALANCE, OPEN
ENERGI BALANCE, OPEN
SISTEM (STEADY STATE)
ENTALPI
Entalpi suatu unsur dalam fase tunggal (tidak
terjadi perubahan fase) dapat dihitung menggunakan kapasitas kalor:
Δ𝑯 = 𝑪𝑻𝟏𝑻𝟐 𝒑𝒅𝑻
satuan Cp adalah Kj/kg mol.K atau BTU/lb mol.0F besarnya Cp padat, cair, maupun gas merupakan
fungsi dari temperatur:
Cp = a + bT + cT2 -dimana T suhu dalam C, K, R, F
bila diintegralkan persamaan entalpi menjadi:
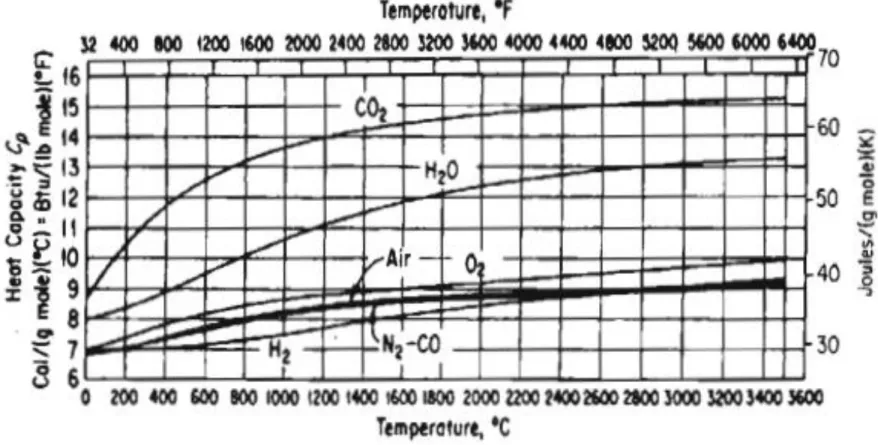
KAPASITAS KALOR GAS
IDEAL
GRAFIK Cp GAS
CONTOH SOAL
Diketahui data kapasitas kalor untuk CO2:
a = 2.675 x 104
b = 42.27
c = -1.425 x 10-2
-Susunlah pers. Cp (j/Kg mol.ΔK) dari data diatas ? -konversikan pers. Cp tersebut dalam satuan (Btu/Lb mole.0F)
Jawab
- Persamaan Cp:
Untuk mengkonversi dari satuan j/kg mole.K ke
satuan J/lb mole.F dengan mengalikan rus kiri :
kemudian subtitusikan hub. Antara T kelvin dan T fahrenheit pada suku T pada Cp:
sehingga Cp dalam Btu/Lb mole. F:
Contoh: konversi buangan padat menjadi gas yang
tidak berbahaya dapat dikerjakan melalui pembakaran sampah. Namun gas buangan harus di dinginkan atau diencerkan dengan udara. Studi kelayakan ekomomi menunjukkan bahwa sampah padat kota dapat dibakar menjadi gas dengan komposisi berikut:
CO2 9.2% CO 1.5% O2 7.3% N2 82%
berapa perubahan entalpi untuk gas ini per lb mol antara bagian atas dan bawah cerobong jika suhu bagian bawah cerobong 550 F dan bag. atas 200 F?
Basis 1 lb mol gas
Persamaan Cp (Btu/Lb mole.F)
Persamaan Cp dikalikan dengan mol fraksi:
PENGGUNAAN TABEL UAP
Uap didinginkan dari 640 F dan 92 psia sampai
480 F dan 52 psia. Berapa Δ𝐻 dalam Btu/lb?
Untuk memperoleh entalpi maka harus dilakukan
APLIKASI ENERGI BALANCE
TANPA TERJADINYA REAKSI
Closed sistem. Untuk sistem tertutup dimana tidak
ada aliran m1=m2 =0 sehingga
jika tidak ada akumulasi :
Open sistem dengan heat transfer (steady sate):
dengan EK, Ep, W lebih kecil daripada ΔH sehingga dapat diabaikan (contoh: sistem heat exchanger)
Open steady state sistem no heat transfer
Analisa energi balance
Soal: Lakukan analisa energi balance untuk
menghitung perubahan entalpi dari masing-masing segmen
Air sedang dipompa dari dasar sumur dengan
kedalaman 15 ft pada laju 200 gal/hr ke dalam tangki penyimpanan yang berada 165 ft di atas permukaan tanah. Untuk mencegah pembekuan sebuah kalor dipasok sebesar 30000 btu/jam ke dalam air selama perpindahannya dari sumur ke tangki. Klor hilang dari sistem sebesar 25000 Btu/jam. Jika suhu air dari sumur 35 F dan daya pompa 2 hp dengan efisiensi 55%, berapa suhu air masuk tangki?
SOAL
Uap memasuki peti uap, yang terpisah dari
biomassa tersebut, dalam sebuah reaktor, pada 250 C jenuh. Dan diembunkan dengan sempurna dalam peti uap. Laju kehilangan kalor dari peti ke sekitarnya 1.5 kj/s. reaktan diletakkan dalam wadah pada suhu 20 C dan pada akhir pemanasan materi tersebut pada suhu 100 C. jika beban terdiri dari 150 kg materi dengan Cp 3.26 J/g.K. berapa kg uap yang dibutuhkan per Kg beban? Materi tetap di wadah reaksi selama 1 jam